将过氧虾钠 氯化氢 氧化氯溶于水完全反应 只剩下钠离子 氢离子 氯离子 氢氧根离子 且溶液呈中性
 oo人042022-10-04 11:39:542条回答
oo人042022-10-04 11:39:542条回答求三种物质的物质的量之比
4比 1

已提交,审核后显示!提交回复
共2条回复
 abobo515 共回答了21个问题
abobo515 共回答了21个问题 |采纳率85.7%- 发生三个反应就行:
2Na2O2+2H2O=4NaOH+O2
Al2O3+6HCl=2AlCl3+3H2O
AlCl3+3NaOH=Al(OH)3+3NaCl
设氧化铝为1mol,则盐酸为6mol,氢氧化钠为6mol过氧化钠为3oml,
所以过氧化钠,氯化氢,氧化铝三种物质的物质的量的比为3:6:1 - 1年前
 馨月2116 共回答了2个问题
馨月2116 共回答了2个问题 |采纳率- 溶液呈中性说明C(氢离子)=C(氢氧根离子) 只要根据钠离子和氯离子守恒 离子浓度相等来算就可以了
- 1年前
相关推荐
- 根据下列实验装置图填空:(1)写出上图所示装置中标有序号的仪器名称:①______,②______.(2)实验室中用过氧
根据下列实验装置图填空:
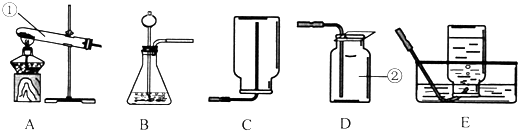
(1)写出上图所示装置中标有序号的仪器名称:①______,②______.
(2)实验室中用过氧化氢溶液与二氧化锰混合制取氧气,应该选取上面的______(填序号)作为发生装置;发生反应的文字表达式为:过氧化氢
水+氧气二氧化锰 过氧化氢;制取气体时,组装好仪器后,应先______,再添加药品;收集氧气时,使用______(选填装置序号〕所示的方法收集到的气体比较纯净.
水+氧气二氧化锰
(3)如果用D装置收集氧气,怎样判断氧气是否收满?______.
(4)在用B装置制氧气中,要使B装置中锥形瓶上部剩余的氧气全部排出,应该怎样操作?______. wshxj3691年前1
wshxj3691年前1 -
 lwq1981 共回答了17个问题
lwq1981 共回答了17个问题 |采纳率100%解题思路:(1)依据实验室常用仪器的认识解决此题.
(2)根据反应物的状态和反应条件选取发生装置;由氧气的密度和溶解性来选取收集装置;
(3)由于氧气具有助燃性,能使带火星的木条复燃解答;
(4)利用水排出氧气.(1)依据实验室常用仪器①试管,②集气瓶;
(2)用过氧化氢溶液与二氧化锰制取氧气,属于固液反应不用加热,故选装置B是,文字表达式是:过氧化氢
二氧化锰
水+氧气,在制取气体前一定先要检查装置的气密性,以防漏气;因为氧气不溶于水,所以可以采用排水法收集氧气,这样收集的气体较纯净;
(3)由于氧气具有助燃性,能使带火星的木条复燃,所以验满方法:将带火星的木条放在集气瓶瓶口,木条复燃,证明氧气已收集满;
(4)要使B装置中锥形瓶上部剩余的氧气全部排出,从长颈漏斗注水,让水把氧气排出.
故答案;
(1)①试管②集气瓶
(2)B 过氧化氢
二氧化锰
水+氧气;检查装置的气密性;E
(3)将带火星的木条放在集气瓶瓶口,木条复燃,证明氧气已收集满;
(4)从长颈漏斗注水至锥形瓶中装满水点评:
本题考点: 氧气的制取装置;氧气的收集方法;氧气的检验和验满;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要对气体的制备的反应原理、发生装置、气体的收集装置的选择进行考查.学生平时要对实验室制气中氧气、二氧化碳和氢气的制备进行归纳.1年前查看全部
- (2013•阆中市模拟)实验室可用过氧化氢溶液加入适量二氧化锰来制取氧气,如果要制取0.48g氧气,那么需要多少克的过氧
(2013•阆中市模拟)实验室可用过氧化氢溶液加入适量二氧化锰来制取氧气,如果要制取0.48g氧气,那么需要多少克的过氧化氢参加反应?
 小单1年前1
小单1年前1 -
 jiangwengyu 共回答了19个问题
jiangwengyu 共回答了19个问题 |采纳率84.2%解题思路:化学方程式可以表示反应中各物质间的质量关系,根据过氧化氢分解生成水和氧气的化学方程式,确定反应中过氧化氢与生成氧气的质量关系,利用这一质量关系可由生成氧气的质量求得分解过氧化氢的质量.设需要过氧化氢的质量为x
2H2O2
MnO2
.
2H2O+O2↑
68 32
x0.48g
[68/x=
32
0.48g]
x=1.02g
答:要制得0.48克氧气,需要1.02g过氧化氢.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题为根据化学方程式的基础计算,正确书写化学方程式、规范的计算步骤、准确的计算结果是解答时注意的关键.1年前查看全部
- 下列对分子、原子、离子的认识,其中错误的是 [ ] A.过氧
下列对分子、原子、离子的认识,其中错误的是 [ ]A.过氧化氢分子发生分解反应是破坏旧分子、形成新分子的变化
B.我们能闻到花的香味是由于分子的不断运动
C.当液态水变成冰,水分子间不存在间隔
D.分子、原子、离子都可以直接构成物质 cabg10881年前1
cabg10881年前1 -
 lucerfy 共回答了19个问题
lucerfy 共回答了19个问题 |采纳率89.5%C1年前查看全部
- 下列说法正确的是( )A.从海水中提取物质都必须通过化学反应才能实现B.二氧化硫可用于消毒杀菌和漂白纸张草帽等C.过氧
下列说法正确的是( )
A.从海水中提取物质都必须通过化学反应才能实现
B.二氧化硫可用于消毒杀菌和漂白纸张草帽等
C.过氧化钠、烧碱、纯碱分别属于碱性氧化物、碱、盐
D.Na、Al、Cu可以分别用热还原法、热分解法和电解冶炼法得到 中年好男人1年前1
中年好男人1年前1 -
 bonfish 共回答了21个问题
bonfish 共回答了21个问题 |采纳率90.5%解题思路:A.海水晒盐为物理变化;
B.二氧化硫具有漂白性;
C.过氧化钠为过氧化物;
D.Na、Al为电解法,Cu为还原法冶炼.A.海水晒盐为物理变化,提炼I、Mg、Br等物质都必须通过化学反应才能实现,故A错误;
B.二氧化硫具有漂白性,二氧化硫可用于消毒杀菌和漂白纸张草帽等,故B正确;
C.过氧化钠为过氧化物,与酸反应生成盐、气体,而烧碱、纯碱分别属于碱、盐,故C错误;
D.Na、Al、Cu可以分别用电解冶炼法、电解冶炼法、热还原法得到,故D错误;
故选B.点评:
本题考点: 二氧化硫的化学性质;金属冶炼的一般原理;钠的重要化合物.
考点点评: 本题考查物质的性质,为高频考点,把握漂白原理及物质的性质、金属冶炼为解答的关键,注重基础知识的考查,题目难度不大.1年前查看全部
- 饲养观赏鱼,可以陶冶人的情操,空运观赏鱼必须密封.空运时为了解决鱼的呼吸问题,可在水中加入过氧化钙(CaO2).因为过氧
饲养观赏鱼,可以陶冶人的情操,空运观赏鱼必须密封.空运时为了解决鱼的呼吸问题,可在水中加入过氧化钙(CaO2).因为过氧化钙与水反应生成氢氧化钙与氧气,反应的化学方程式为2CaO2+2H2O═2Ca(OH)2+O2↑,若称取1.44g CaO2加到足量水中,则生成的氧气的体积为多少?(氧气的密度为1.43g/L)
 leihang_xie1年前1
leihang_xie1年前1 -
 ys_wang0 共回答了20个问题
ys_wang0 共回答了20个问题 |采纳率90%解题思路:根据化学方程式和过氧化钙的质量求出氧气的质量,再根据密度求体积.设生成的氧气的质量为x
2CaO2+2H2O═2Ca(OH)2+O2↑
144 32
1.44g x
[144/32=
1.44g
x]
x=0.32g
则生成的氧气的体积为:[0.32g/1.43g/L]=0.22L
答:生成的氧气的体积为0.22L.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题主要考查根据化学方程式的计算以及质量、密度、以及体积之间的换算,难度不大.1年前查看全部
- (2011•太原模拟)科学家P•Tatapudi等人首先使用空气中电解水(酸性条件下)的方法,阳极制得臭氧,阴极制得过氧
(2011•太原模拟)科学家P•Tatapudi等人首先使用空气中电解水(酸性条件下)的方法,阳极制得臭氧,阴极制得过氧化氢,电解总方程式为3H2O+3O2
3H2O2+O3.下列说法正确的是( )电解 .
A.阴极反应式为:3O2+6H2O+6e-=3H2O2+6OH-
B.阳极反应式为:3H2O-6e-=O3+6H+
C.生成22.4L O3(标准状况)时,转移3mol电子
D.电解一段时间后,溶液的pH不变 暨大zz周正阳1年前1
暨大zz周正阳1年前1 -
 发呆的我 共回答了22个问题
发呆的我 共回答了22个问题 |采纳率95.5%解题思路:由阳极制得臭氧,阴极制得过氧化氢.电解总方程式为:3H2O+3O2═3H2O2+O3,阳极反应为3H2O→O3+6H++6e-,阴极反应为6H++3O2+6e-→3H2O2,以此来解答.A.阴极制得过氧化氢,酸性条件下,阴极反应为6H++3O2+6e-→3H2O2,故A错误;
B.由阳极制得臭氧,阳极反应为3H2O-6e-→O3+6H+,故B正确;
C.由阳极反应为3H2O→O3+6H++6e-,则每生成1molO3转移电子数为6mol,故C错误;
D.由电解反应可知,消耗水,则氢离子的浓度增大,pH变小,故D错误;
故选B.点评:
本题考点: 电解原理.
考点点评: 本题为信息习题,考查电解原理,明确电解反应及阳极制得臭氧,阴极制得过氧化氢是解答本题的关键,难度不大.1年前查看全部
- 结合图示装置回答下列问题.(1)写出标号仪器的名称:①______,②______,③______;(2)实验室若用过氧
结合图示装置回答下列问题.

(1)写出标号仪器的名称:①______,②______,③______;
(2)实验室若用过氧化氢溶液和二氧化锰混合制取氧气,则你选用的发生装置是______,如果要收集比较干燥的氧气,你会用______收集.
(3)用高锰酸钾制取氧气,若选择A和D装置制取并收集氧气,则要对A装置进行的改进是______,______.实验结束时应先______再______,否则会导致______炸裂试管.检验一瓶氧气是否收满的方法是______.铁在氧气中燃烧的实验,实验前瓶中装少量水的作用是什么______.
(4)某化学课外活动小组的同学在探究中发现,在氯酸钾固体中,加入少量高锰酸钾固体并加热,很快就有氧气放出,其原因是:______.常温下实验室可用金属锌粒和稀硫酸液体反应制取较纯净的氢气,则应选择的装置组合是______.
(5)若收集某气体时只能选用E装置,则可推知该气体的性质可能有______、______. 飞花飘雪0081年前1
飞花飘雪0081年前1 -
 sadflkjslk 共回答了14个问题
sadflkjslk 共回答了14个问题 |采纳率85.7%解题思路:(1)根据对常见仪器名称的识记考虑;(2)根据反应物是固体和液体不需要加热,排水法收集到的气体比排空气法收集到的气体纯考虑;(3)根据用高锰酸钾制取氧气装置图的特点和操作注意事项考虑,根据氧气的验满方法和铁丝燃烧的注意事项考虑;(4)根据高锰酸钾加热分解的产物考虑;根据反应物的状态选择发生装置;(5)根据气体的密度与收集方法的关系和气体的溶解性与收集的方法考虑.(1)根据对常见仪器名称的记忆可知①是酒精灯;②是铁架台;③是集气瓶;
(2)选择气体的制取装置是由反应物的状态和反应条件决定的,反应物是固体需要加热,反应物是固体和液体不需要加热,收集方法由气体的溶解性和密度决定,排水法收集到的气体要比排空气法收集到的气体纯;
(3)用高锰酸钾制取氧气时,试管口要略向下倾斜,用酒精灯的外焰加热,要先进行预热,再集中药品部位加热,实验结束时,要先撤导管后熄灭酒精灯,防止冷凝水倒吸,使试管炸裂;如果用排水法收集氧气验满方法是:有大的气泡从集气瓶口向外冒出,铁丝燃烧时,在集气瓶底部放少量的水或铺一层细沙,防止生成物溅落到集气瓶底部,使集气瓶炸裂;
(4)由于高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气,生成的二氧化锰正好作为氯酸钾受热分解的催化剂,所以加快了反应速度;锌粒和稀硫酸液体反应制取较纯净的氢气,反应物是固体和液体不需要加热,发生装置选择B,由于排水法收集到的气体比排空气法收集到的气体纯.
(5)因为该气体是向下排空气法收集,所以密度比空气小,只能用向下排空气法收集,说明该气体易溶于水,不能用排水法收集.
故答案为:(1)①酒精灯;②铁架台;③集气瓶;(2)B;D;(3)试管口略向下倾斜;调节试管高度用酒精灯外焰加热;撤导管;熄灭酒精灯;水倒吸;如果用排水法收集氧气验满方法是:有大的气泡从集气瓶口向外冒出;防止生成物溅落到集气瓶底部,使集气瓶炸裂;(4)高锰酸钾加热生成的二氧化锰正好作为氯酸钾受热分解的催化剂;BD;(5)密度比空气小;易溶于水.点评:
本题考点: 氧气的制取装置;氧气的化学性质;氧气的收集方法;制取氧气的操作步骤和注意点.
考点点评: 该题属于考查气体的发生装置与收集气体的选取与反应原理的考查,重点考查了氧气的制取装置和收集装置,选择气体的制取装置是由反应物的状态和反应条件决定的,收集方法由气体的溶解性和密度决定.1年前查看全部
- 物质是由______、______等微小粒子构成的,如:二氧化硫是由______构成,金属汞是由______构成.在过氧
物质是由______、______等微小粒子构成的,如:二氧化硫是由______构成,金属汞是由______构成.在过氧化氢分解的反应中的最小粒子是______.一个水分子是由______构成.
 jzwsky5301年前1
jzwsky5301年前1 -
 我愿化做飞鸟 共回答了16个问题
我愿化做飞鸟 共回答了16个问题 |采纳率100%解题思路:根据构成的物质的粒子有分子、原子和离子,金属和大多数固态非金属单质等由原子构成,有些物质是由分子构成的,如水、气态非金属单质等,有些物质是由离子构成的,如氯化钠;原子是化学变化中的最小粒子;进行分析解答即可.构成的物质的粒子有分子、原子和离子.
二氧化硫是由二氧化硫分子构成的;汞属于金属,是由汞原子直接构成的.
原子是化学变化中的最小粒子,在过氧化氢分解的反应中的最小粒子是氢原子、氧原子.
一个水分子是由二个氢原子和一个氧原子构成的.
故答案为:分子、原子等,二氧化硫分子,汞原子;氢原子、氧原子;二个氢原子和一个氧原子.点评:
本题考点: 物质的构成和含量分析.
考点点评: 本题难度不大,主要考查了构成物质的微观粒子方面的知识,掌握常见物质的粒子构成是正确解答本题的关键.1年前查看全部
- 过二硫酸不稳定的过氧键断裂时是断氧氧键还是硫氧键?为什么?
 a9265351年前3
a9265351年前3 -
 李明飞 共回答了18个问题
李明飞 共回答了18个问题 |采纳率94.4%断的是硫氧键.H2S2O8 + H2O == H2SO4 + H2SO5
其中H2SO5中含有过氧键,说明过二硫酸中的氧氧键没有断.
过二硫酸可以看成是H2O2的衍生物,即H2O2中两个氢原子被都磺基–SO3H 取代的产物.1年前查看全部
- (2014•天门)如图所示,将 A 中产生的潮湿 CO2通入到 Na2O2(过氧
(2014•天门)如图所示,将 A 中产生的潮湿 CO2通入到 Na2O2(过氧化钠)中,片刻后观察到D中燃着的蜡烛火焰更旺.请回答下列问题:

信息:Na2O2是淡黄色固体,与水作用生成一种碱和O2,与CO2作用生成碳酸盐和O2.
问题 1:A中反应的化学方程式是______.
问题 2:B中有关产生氧气的化学方程式:(1)______;(2)______.
问题3:B中反应产生的现象是______. leven01年前1
leven01年前1 -
 jianglie 共回答了20个问题
jianglie 共回答了20个问题 |采纳率100%碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳;
根据质量守恒定律可知,在B中,过氧化钠与水反应生成氢氧化钠和氧气;与二氧化碳反应生成碳酸钠和氧气;
过氧化钠是一种淡黄色固体,而氢氧化钠和碳酸钠均为白色固体,故看到玻璃管中的淡黄色固体变成了白色;
故答案为:问题1:CaCO3+2HCl=CaCl2+H2O+CO2↑
问题2:(1)2Na2O2+2H2O=4NaOH+O2↑
(2)2Na2O2+2CO2=2Na2CO3+O2;
问题3:固体由淡黄色变成白色.1年前查看全部
- (2012•高新区一模)卫生部等部门正式发布公告自2011年5月1日起,禁止在面粉中添加过氧化钙作为食品添加剂.其中过氧
(2012•高新区一模)卫生部等部门正式发布公告自2011年5月1日起,禁止在面粉中添加过氧化钙作为食品添加剂.其中过氧化钙中氧元素的化合价与过氧化氢中氧元素的化合价相同,则过氧化钙的化学式正确的是( )
A.CaO2
B.CaO
C.Ca2O2
D.Ca2O 嗷嗷少男1年前1
嗷嗷少男1年前1 -
 shenhude 共回答了14个问题
shenhude 共回答了14个问题 |采纳率85.7%解题思路:首先根据熟知的过氧化氢中氧元素的化合价为-1价,及金属钙的化合价为+2价,然后根据化学式的书写规则进行解答.方法一:过氧化氢中H2O2中氧元素的化合价为-1价,金属钙的化合价只有+2价,
根据化学式书写中一般是金属元素在前,非金属元素在后,根据化合物中化合价代数和为零的原则可得过氧化钙的化学式为CaO2.
方法二:根据题中信息及所学知识可知过氧化钙中氧元素的化合价为-1价,钙元素的化合价为+2价.
然后根据化合物中化合价代数和为零的原则直接判断选项中元素的化合价是否符合,发现BCD三个选项化合价代数和都不等于零.
故选A点评:
本题考点: 化学式的书写及意义;有关元素化合价的计算.
考点点评: 化学式的正确书写是初中化学的一个难点,首先要对常见元素和原子团的化合价熟悉,其次要掌握化学式的书写规则.1年前查看全部
- (2014•重庆模拟)亚硝酸钠被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧
(2014•重庆模拟)亚硝酸钠被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如图所示(部分夹持装置略).(在木炭和浓硝酸反应之前已排尽装置中的空气)
已知:室温下,①2NO+Na2O2═2NaNO2 ②3NaNO2+3HCl═3NaCl+HNO3+2NO↑+H2O;
③酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2+
(1)写出浓硝酸与木炭反应的化学方程式C+4HNO3(浓)
CO2↑+4NO2↑+2H2O△ .C+4HNO3(浓).
CO2↑+4NO2↑+2H2O△ .
(2)B中观察到的主要现象是______,D装置的作用是______.
(3)检验C中产物有亚硝酸钠的方法是______.
(4)经检验C产物中除亚硝酸钠外还含有副产物碳酸钠和______.为避免产生这些副产物,应在B、C装置间增加装置E、F,则B中导管与E、F装置中导管接口的连接顺序是______. 1236893541年前1
1236893541年前1 -
 Ricko_zheng 共回答了9个问题
Ricko_zheng 共回答了9个问题 |采纳率88.9%解题思路:(1)装置A中是浓硝酸和碳加热发生的反应,反应生成二氧化氮和二氧化碳和水,依据氧化还原反应电子守恒和原子守恒配平;
(2)装置B中是A装置生成的二氧化氮和水反应生成硝酸和一氧化氮,硝酸和铜反应生成硝酸铜,一氧化氮和水;通过装置C中的过氧化钠吸收一氧化氮、二氧化碳,最后通过酸性高锰酸钾溶液除去剩余一氧化氮防止污染空气;
(3)依据亚硝酸钠具有氧化性或还原性,选择还原剂或氧化剂发生的反应现象证明产物中是否是亚硝酸钠;
(4)因为一氧化氮中混有二氧化碳和水蒸汽,二氧化碳和过氧化钠发生的反应生成碳酸钠和氧气,水与过氧化钠反应生成氢氧化钠;为避免产生这些副产物,应在B、C装置间增加装置E、F,依次除去二氧化碳和水蒸气.(1)装置A中是浓硝酸和碳加热发反应,反应生成二氧化氮和二氧化碳和水,反应的化学方程式为C+4HNO3(浓)
△
.
CO2↑+4NO2↑+2H2O,
故答案为:C+4HNO3(浓)
△
.
CO2↑+4NO2↑+2H2O;
(2)装置B中是A装置生成的二氧化氮和水反应生成硝酸和一氧化氮,3NO2+H2O=2HNO3+NO,硝酸和铜反应生成硝酸铜,一氧化氮和水,所以反应现象为溶液变蓝,铜片溶解,导管口有无色气体冒出;通过装置C中的过氧化钠吸收一氧化氮、二氧化碳,最后通过酸性高锰酸钾溶液除去剩余一氧化氮防止污染空气,
故答案为:铜片溶解,溶液变蓝,导管口有无色气体冒出;除去未反应的NO,防止污染空气;
(3)检验亚硝酸钠的实验设计为:取少量生成物置于试管中,加入稀盐酸,若产生无色气体并在液面上方变为红棕色,则产物是亚硝酸钠.
故答案为:取样,加入稀盐酸,若产生无色气体并在液面上方变为红棕色,则产物是亚硝酸钠;
(4)因为一氧化氮中混有二氧化碳和水蒸汽,二氧化碳和过氧化钠发生的反应生成碳酸钠和氧气,水与过氧化钠反应生成氢氧化钠,故C产物中除亚硝酸钠外还含有副产物碳酸钠和氢氧化钠,为避免产生这些副产物,应在B、C装置间增加装置E、F,依次除去二氧化碳和水蒸气,则B中导管与E、F装置中导管接口的连接顺序是dcba.故答案为:氢氧化钠;dcba.点评:
本题考点: 制备实验方案的设计.
考点点评: 本题考查了物质制备实验方案的设计和信息判断,物质性质的理解应用,注意实验过程中的反应现象分析,掌握基础是关键,题目难度中等.1年前查看全部
- 酵母菌细胞中的过氧酶体在什么条件下最发达()A葡萄糖溶液中 B蔗糖溶液中 C甲醇溶液中 D脂肪酸溶液中
酵母菌细胞中的过氧酶体在什么条件下最发达()A葡萄糖溶液中 B蔗糖溶液中 C甲醇溶液中 D脂肪酸溶液中
参考资料也行 cdnc1年前1
cdnc1年前1 -
 xiaoyi1234 共回答了23个问题
xiaoyi1234 共回答了23个问题 |采纳率78.3%C 甲醇溶液中
酵母细胞在含糖培养基中生长过氧化酶体很少;在含甲醇的培养基中生长则形成大量能氧化这种化学物质的过氧化酶体.
百度教育团队【海纳百川团】为您解答.
感谢您的采纳,O(∩_∩)O 如有疑问,欢迎追问.1年前查看全部
- 过氧乙酸(C2H4O3)是2003年我国用于预防“非典”的高效消毒剂,在抗击“非典”战役中发挥过重要作用.下列关于过氧乙
过氧乙酸(C2H4O3)是2003年我国用于预防“非典”的高效消毒剂,在抗击“非典”战役中发挥过重要作用.下列关于过氧乙酸的说法正确的是( )
A.它是一种氧化物
B.它是由2个碳元素、4个氢元素、3个氧元素组成的
C.它是由C2H4O3分子构成的
D.过氧乙酸中碳、氢、氧的质量比为2:4:3 真武ii杨彦1年前1
真武ii杨彦1年前1 -
 henkon 共回答了23个问题
henkon 共回答了23个问题 |采纳率91.3%解题思路:A、根据氧化物是指由两种元素组成,且其中一种元素为氧元素的化合物进行解答;
B、根据元素只讲种类不讲个数进行解答;
C、根据过氧乙酸是由过氧乙酸分子构成的进行解答;
D、根据元素的质量比就是相对原子质量与原子个数的乘积之比进行解答.A、过氧乙酸由碳、氢、氧三种元素组成,不符合氧化物只有两种元素组成的定义,故说法错误;
B、元素只讲种类不讲个数,故B说法错误;
C、过氧乙酸是由过氧乙酸分子构成的,故C说法正确;
D、过氧乙酸中碳、氢、氧的质量比为:12×2:1×4:16×3=6:1:12,故D说法错误;
故选C点评:
本题考点: 化学式的书写及意义;从组成上识别氧化物;元素质量比的计算.
考点点评: 本题考查了氧化物的判断、物质的组成、元素的质量比的计算等,考查较为全面.1年前查看全部
- 许多因素会影响化学反应速率.请分析下列实验或事实,分别说明在其他条件不变时,这些因素是如何影响化学反应速率的.示例:过氧
许多因素会影响化学反应速率.请分析下列实验或事实,分别说明在其他条件不变时,这些因素是如何影响化学反应速率的.示例:过氧化氢溶液在常温下能缓慢分解,若加入少量Mn02时分解加速.答:使用催化剂,可以加快化学反应速率.
(1)同种食品在夏天比冬天更容易变质.
(2)木炭在纯氧中燃烧比在空气中进行得更快,更剧烈.
(3)在相同质量的锌粉和锌粒中分别加入足量l0%的稀盐酸,前者先反应完. lprpg1年前4
lprpg1年前4 -
 甫风 共回答了14个问题
甫风 共回答了14个问题 |采纳率78.6%解题思路:(1)根据同种食品在夏天比冬天更容易变质,说明了升高温度,可以加快化学反应速率进行解答;
(2)根据增大反应物浓度,可以加快化学反应速率进行解答;
(3)根据增大反应物接触面积,可以加快化学反应速率进行解答.(1)同种食品在夏天比冬天更容易变质,夏天温度高,这说明了升高温度,可以加快化学反应速率;
(2)木炭在纯氧中燃烧比在空气中进行得更快,更剧烈,是因为氧气的浓度不同,所以增大反应物浓度,可以加快化学反应速率;
(3)在相同质量的锌粉和锌粒中分别加入足量10%的稀盐酸,前者先反应完.说明反应物的接触面积越大,反应的速率大,所以增大反应物接触面积,可以加快化学反应速率.
故答案为:(1)升高温度,可以加快化学反应速率;(2)增大反应物浓度,可以加快化学反应速率;(3)增大反应物接触面积,可以加快化学反应速率.点评:
本题考点: 影响化学反应速率的因素探究;金属活动性顺序及其应用.
考点点评: 解答本题的关键是要充分理解影响化学反应速率的因素,只有这样才能对问题做出正确的判断.1年前查看全部
- 下列符合题意的化学方程式书写及其所属反应类型均正确的是 [ ] A.过氧
下列符合题意的化学方程式书写及其所属反应类型均正确的是 [ ]A.过氧化氢分解制氧气:H 2 O 2  H 2 ↑+O 2 ↑;分解反应
H 2 ↑+O 2 ↑;分解反应
B.硫酸铜溶液中加入铁粉:2Fe+3CuSO 4 ==Fe 2 (SO 4 ) 3 +3Cu↓;置换反应
C.氢氧化镁用于治疗胃酸过多:H 2 SO 4 +Mg(OH) 2 ==MgSO 4 +2H 2 O;复分解反应
D.高温煅烧石灰石得到生石灰:CaCO 3 CaO+CO 2 ↑;分解反应
CaO+CO 2 ↑;分解反应 qszyg1年前1
qszyg1年前1 -
 都是dd人 共回答了19个问题
都是dd人 共回答了19个问题 |采纳率94.7%D1年前查看全部
- 过氧化钠和水的反应电子是怎么转移的,是2个Na2O2一起转移1个电子对么?我意思Na2O2里过氧根不是配位键么,是不是过
过氧化钠和水的反应
电子是怎么转移的,是2个Na2O2一起转移1个电子对么?
我意思Na2O2里过氧根不是配位键么,是不是过氧根总是成对转移电子的 napgx1年前3
napgx1年前3 -
 老葱头儿 共回答了25个问题
老葱头儿 共回答了25个问题 |采纳率84%不是的 过氧化钠的氧是负1价 放映过程中一个氧把电子给另一个氧,得电子的变为氧气 失电子的在水中生成氢氧根 不是的1年前查看全部
- 1.由钾和氧组成的某种离子化合物含钾的质量分数是78/126,其因阴离子只有过氧根离子和超氧根离子两种.在此晶体中,过氧
1.由钾和氧组成的某种离子化合物含钾的质量分数是78/126,其因阴离子只有过氧根离子和超氧根离子两种.在此晶体中,过氧根离子和超氧根离子的个数比为多少?
2.由1H、2H、3H和16O、17O和18O(1、2、3、16、17、18都是左上标)可形成的水分子有多少种?
3.下列选项中错误的是( )
A.在标准状况下的密度:CO2>O2>空气
B.通常状况下在水中的溶解度:CO2>O2>H2
C.常压下的沸点:N2>O2>H2
D.常温下在水中的溶解度:MgSO4>CaSO4>CaCO3
4.在1~18号元素中,X和Y元素可组成化合物XY3,当X的原子序数为m,Y的原子序数可能是( )
①m+4 ②m-4 ③m-8 ④m+2 ⑤m-6 ⑥m+12
A.①②③ B.①④⑤⑥ C.①②③④⑤ D.①②③④⑤⑥
5.某元素醋酸盐的相对分子质量为m,相同价态该元素的硝酸盐的相对分子质量为n,则该元素在两种盐中的化合价数值为多少?
6.已知某种碳原子(原子核内有6个质子和6个中子)一个原子的质量为a g,另一种元素R的一个原子的质量为m g.由R元素组成的单质分子的化学式为Rm(m为下标),则该分子(Rm)的相对原子质量是多少?
7.有H(+1)、O(-2)、C(+4)、Ca(+2)四种元素,按指定化合价最多可以组成化合物的种数是多少?
8.某元素氧化物分子量为a,价态相同的硫酸盐分子量为b,则此元素的化合价可能是( )
(A)b-a/80 (B)a-b/80 (C)2b-a/80 (D)b-a/40
9.Rn+离子有两个电子层且已达稳定结构.与Rn+的电子数相等的微粒(分子、原子和离子,但不包括Rn+本身)可有( )
(A)6种 (B)7种 (C)8种 (D)9种 落花满袖1年前1
落花满袖1年前1 -
 bo2323 共回答了17个问题
bo2323 共回答了17个问题 |采纳率94.1%1、分析:因为过氧化钾的化学式为K2O2,超氧化钾的化学式为K2O4
根据含钾质量分数可知钾原子和氧原子的个数比为2:3(质量比为2×39:3×16)
所以过氧根离子和超氧根离子个数之比为1:1(这样钾原子和氧原子个数比为4:6)
2、3×2×3=18种
3、选C
4、D
物质原型依次为:AlCl3 AlF3 SO3 NF3 NH3 BCl31年前查看全部
- 关于化学实验的一些题分别写出下列实验所需的器材(有的需要些药品,要具体的)好的十分 1.过滤 2.稀释浓硫酸 3.用过氧
关于化学实验的一些题
分别写出下列实验所需的器材(有的需要些药品,要具体的)好的十分 1.过滤 2.稀释浓硫酸 3.用过氧化氢制氧气(写药品) 4.配制一定溶质质量分数的溶液 5.蒸发 6.高锰酸钾制氧气(写药品) 7.实验室制取二氧化碳(写药品) jsh11281年前1
jsh11281年前1 -
 deeperbl046 共回答了22个问题
deeperbl046 共回答了22个问题 |采纳率95.5%1.过滤:漏斗,烧杯*2,滤纸,玻璃棒,铁架台,中型铁圈一个.2.稀释浓硫酸:烧杯*2,玻璃管,水,浓硫酸.3.过氧化氢制氧器:试管,皮塞(与试管口大小一样,双孔),导气管,集气瓶(带玻璃片),水槽,铁架台,试管夹,沸石,过氧化氢.4.配制溶液:托盘天平,砝码,等质量的烧杯,药匙,玻璃棒,量筒,水,药品.5.蒸发:三角架,蒸发皿,玻璃棒,酒精灯.6.高锰酸钾制氧气:试管,试管夹,铁架台,导气管,集气瓶(带玻璃片),水槽,酒精灯,棉花,水,高锰酸钾,二氧化锰.7.实验室制取二氧化碳:集气瓶*2(其中一个带玻璃片),皮塞(与集气瓶口大小一样,双孔),长颈漏斗,导气管,稀硫酸,碳酸钙.1年前查看全部
- 用N A 表示阿伏加德罗常数.下列说法中,正确的是( ) A.16.0g的过氧(根)离子中含有的电子数为9N A B.
用N A 表示阿伏加德罗常数.下列说法中,正确的是( ) A.16.0g的过氧(根)离子中含有的电子数为9N A B.100mL3.0mol/L的盐酸与5.6g铁屑完全反应转移的电子数为0.3N A C.含2molH 2 SO 4 的浓硫酸与足量金属铜完全反应,产生SO 2 的数目为N A D.1L0.1mol/LNa 2 CO 3 溶液中,阴阳离子总数为0.3N A  我爱笨喵喵1年前1
我爱笨喵喵1年前1 -
 zengguiyeah 共回答了20个问题
zengguiyeah 共回答了20个问题 |采纳率95%A.n=
m
M =
16g
32g/mol =0.5mol,含电子的物质的量为0.5mol×(2×8+2)=9mol,所以含有的电子数为9N A ,故A正确;
B.盐酸与铁屑发生反应生成氯化亚铁,n(HCl)=0.3mol,n(Fe)=0.1mol,完全反应转移的电子数为0.2N A ,故B错误;
C.含2molH 2 SO 4 的浓硫酸与足量金属铜完全反应,随着反应的进行,硫酸浓度不断减小,稀硫酸与铜不反应,则生成的SO 2 的数目小于N A ,故C错误;
D.Na 2 CO 3 溶液中存在:CO 3 2- +H 2 O
HCO 3 - +OH - ,则1L0.1mol/LNa 2 CO 3 溶液中,阴阳离子大于0.3N A ,故D错误.
故选A.1年前查看全部
- 已知S2O8n-离子和H2O2一样含有过氧键,因此也有强氧化性,S2O8n-离子在一定条件下可把Mn2+氧化成MnO4-
已知S2O8n-离子和H2O2一样含有过氧键,因此也有强氧化性,S2O8n-离子在一定条件下可把Mn2+氧化成MnO4-离子,若反应后S2O8n-离子变成SO42-;又知反应中氧化剂与还原剂的离子数之比为5:2,则S2O8n-中的n值和S的化合价是( )
A. 2,+7
B. 2,+6
C. 4,+7
D. 4,+4 青青的许愿树1年前1
青青的许愿树1年前1 -
 切断电源 共回答了13个问题
切断电源 共回答了13个问题 |采纳率76.9%解题思路:Mn2+氧化成MnO4-,Mn元素的化合价由+2价升高为+7价,若反应后S2O8n-变成SO42-,S的化合价降低,SO42-中S的化合价为+6价,以此来解答.Mn2+氧化成MnO4-,Mn元素的化合价由+2价升高为+7价,若反应后S2O8n-变成SO42-,S的化合价降低,SO42-中S的化合价为+6价,则S2O8n-中的S元素的化合价为+7价,则+7×2+(-2)×8=-n,解得n=2,
故选A.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析能力的考查,注意从化合价角度分析,题目难度不大.1年前查看全部
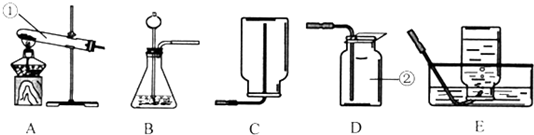
- 根据下列实验装置图填空:(二)写出0图所示装置中标有序号的仪器名称:①______,②______.(q)实验室中用过氧
根据下列实验装置图填空:

(二)写出0图所示装置中标有序号的仪器名称:①______,②______.
(q)实验室中用过氧化氢溶液与二氧化锰混合制取氧气时,组装好仪器后,应先______,再添加药品;要得到平稳的氧气流,加药品的顺序是先加(填化学式______,再加______.收集氧气时,使用______(选填装置序号)所示的方法收集到的气体比较纯净.
(3)若用氯酸钾固体制取氧气,反应的化学方程(表达)式为qKCl13
qKCl+31q↑Mn1q .△ qKCl13.其发生装置应选用______(选填装置序号),选择该发生装置的理由是因为______和______.
qKCl+31q↑Mn1q .△
(4)比较用过氧化氢和氯酸钾制取氧气的两组种方法,你认为更合适在实验中制取氧气的方法是______;该方法的优点是______;(答一条即可). qwert19878231年前1
qwert19878231年前1 -
 普洱茶王茶 共回答了21个问题
普洱茶王茶 共回答了21个问题 |采纳率85.7%解题思路:根据图示即可写出有关仪器的名称,制取气体时要保证装置不漏气,装药品时要先固后液;加热氯酸钾和二氧化锰的混合物能生成氯化钾和氧气,发生装置的选择取决于反应物的状态和反应的条件,据此解答即可.(1)据v可知,①是长颈漏斗,②是集气瓶,故填:长颈漏斗,集气瓶;
(2)组装仪器后,要先检查装置的气密性,加入药品要先固后液,故先加二氧化锰,后加过氧化氢,使用排水法收集的氧气比较纯净,故填:检查装置气密性,中nO2,H2O2,E;
(她)加热氯酸钾和二氧化锰的混合物能生成氯化钾和氧气,该反应是固体加热型反应,故选用A装置制取氧气,故填:A,反应物均为固体,反应条件需加热;
(她)使用加热氯酸钾和二氧化锰的混合物制取氧气,操作比较复杂,使用过氧化氢和二氧化锰的混合物制取氧气,操作比较简单,故填:用过氧化氢溶液制取氧气,操作简单.点评:
本题考点: 氧气的制取装置;氧气的收集方法.
考点点评: 本题考查了氧气的实验室制取,完成此题,可以依据已有的知识进行.要求同学们加强对气体制取的掌握,以便灵活应用.1年前查看全部
- 下列说法正确的是( )A.金属铁中铁元素有0、+2、+3价B.纯净物都是由同种元素组成的C.在实验室里,常采用分解过氧
下列说法正确的是( )
A.金属铁中铁元素有0、+2、+3价
B.纯净物都是由同种元素组成的
C.在实验室里,常采用分解过氧化氢溶液、加热氯酸钾或加热高锰酸钾的方法制取氧气
D.催化剂是一种在化学反应里能加快其它物质的化学反应速率,而本身的质量和化学性质在反应前后都没有改变的物质 欧米罗1年前1
欧米罗1年前1 -
 镜花水月1412 共回答了20个问题
镜花水月1412 共回答了20个问题 |采纳率100%解题思路:A、单质中元素的化合价为0;
B、纯净物包括单质和化合物,单质由同种元素组成,化合物由不同种元素组成;
C、在实验室里,常采用分解过氧化氢溶液、加热氯酸钾或加热高锰酸钾的方法制取氧气;
D、从催化剂的概念进行分析判断.A、单质中元素的化合价为0,化合物中铁元素常显+2、+3价,故错误;
B、纯净物都是由同种物质组成,包括单质和化合物,单质由同种元素组成,化合物由不同种元素组成,故错误;
C、在实验室里,常采用分解过氧化氢溶液、加热氯酸钾或加热高锰酸钾的方法制取氧气,说法正确;
D、催化剂能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后保持不变,这里的改变包括加快和减慢双重含义,故错误.
故选C.点评:
本题考点: 实验室制取氧气的反应原理;催化剂的特点与催化作用;纯净物和混合物的概念;常见元素与常见原子团的化合价.
考点点评: 本题考查了学生对于纯净物、催化剂、物质中元素的化合价及实验室制取氧气所用药品的认识,有些认识不注意辨别容易被误判误记,学习中要注意这一点.1年前查看全部
- 活泼金属过氧化合物有哪些平常状态下呈固体状
 jlzhenghui1年前1
jlzhenghui1年前1 -
 jianvren 共回答了12个问题
jianvren 共回答了12个问题 |采纳率100%过氧化钠1年前查看全部
- 钠的化合物在空气中最稳定的是 氧化钠 过氧华纳 氯化钠 氢氧化钠
 wibxy1年前4
wibxy1年前4 -
 好男才好看 共回答了14个问题
好男才好看 共回答了14个问题 |采纳率78.6%绿化钠1年前查看全部
- (2012•丰泽区质检)在一些公共场所可用3%的双氧水溶液对空气进行消毒.现有一瓶500g30%的双氧水,其中含溶质过氧
(2012•丰泽区质检)在一些公共场所可用3%的双氧水溶液对空气进行消毒.现有一瓶500g30%的双氧水,其中含溶质过氧化氢质量______g,将其稀释成3%的溶液需要加水______g.
 大左右1年前1
大左右1年前1 -
 敏琪 共回答了11个问题
敏琪 共回答了11个问题 |采纳率100%解题思路:根据溶质质量=溶液质量×溶质的质量分数,溶液稀释前后,溶质的质量不变,结合题意进行分析解答.一瓶500g30%的双氧水,其中含溶质过氧化氢质量为500g×30%=150g.
设要加水的质量为x,根据溶液稀释前后,溶质的质量不变,
则(500g+x)×3%=150g x=4500g.
故答案为:150;4500.点评:
本题考点: 用水稀释改变浓度的方法.
考点点评: 本题难度不大,掌握溶质质量分数的有关计算、溶液稀释前后溶质的质量不变是正确解答本题的关键所在.1年前查看全部
- 许多因素会影响化学反应速率.请分析下列实验或事实,分别说明在其他条件不变时,这些因素是如何影响化学反应速率的.示例:过氧
许多因素会影响化学反应速率.请分析下列实验或事实,分别说明在其他条件不变时,这些因素是如何影响化学反应速率的.示例:过氧化氢溶液在常温下能缓慢分解,若加入少量Mn02时分解加速.答:使用催化剂,可以加快化学反应速率.
(1)同种食品在夏天比冬天更容易变质.
(2)木炭在纯氧中燃烧比在空气中进行得更快,更剧烈.
(3)在相同质量的锌粉和锌粒中分别加入足量l0%的稀盐酸,前者先反应完. 鲁丹1年前4
鲁丹1年前4 -
 喜欢淋雨2 共回答了16个问题
喜欢淋雨2 共回答了16个问题 |采纳率93.8%解题思路:(1)根据同种食品在夏天比冬天更容易变质,说明了升高温度,可以加快化学反应速率进行解答;
(2)根据增大反应物浓度,可以加快化学反应速率进行解答;
(3)根据增大反应物接触面积,可以加快化学反应速率进行解答.(1)同种食品在夏天比冬天更容易变质,夏天温度高,这说明了升高温度,可以加快化学反应速率;
(2)木炭在纯氧中燃烧比在空气中进行得更快,更剧烈,是因为氧气的浓度不同,所以增大反应物浓度,可以加快化学反应速率;
(3)在相同质量的锌粉和锌粒中分别加入足量10%的稀盐酸,前者先反应完.说明反应物的接触面积越大,反应的速率大,所以增大反应物接触面积,可以加快化学反应速率.
故答案为:(1)升高温度,可以加快化学反应速率;(2)增大反应物浓度,可以加快化学反应速率;(3)增大反应物接触面积,可以加快化学反应速率.点评:
本题考点: 影响化学反应速率的因素探究;金属活动性顺序及其应用.
考点点评: 解答本题的关键是要充分理解影响化学反应速率的因素,只有这样才能对问题做出正确的判断.1年前查看全部
- 下列试剂的保存或使用正确的是( ) A.金属锂保存在煤油中,使用前要用滤纸吸干煤油 B.过氧化钠比氧化钠稳定,因此过氧
下列试剂的保存或使用正确的是( ) A.金属锂保存在煤油中,使用前要用滤纸吸干煤油 B.过氧化钠比氧化钠稳定,因此过氧化钠可露置在空气中 C.称量NaOH固体时,应先在天平两个托盘上各放一张等质量的纸,左边纸上放NaOH,右边纸上放砝码 D.做焰色反应实验时,透过蓝色钴玻璃,观察到火焰颜色为紫色,证明被检验物中一定有钾元素  kk9111年前1
kk9111年前1 -
 千山沐雪 共回答了17个问题
千山沐雪 共回答了17个问题 |采纳率100%A.锂密度比水小,不能保存在煤油中,应固封在石蜡中,故A错误;
B.过氧化钠与水、二氧化碳都反应,不能露置在空气中,故B错误;
C.应氢氧化钠具有吸水性,易于空气中二氧化碳反应,称量NaOH固体时,应放在小烧杯中称量,故C错误;
D.钾的焰色反应为紫色,透过蓝色钴玻璃,观察到火焰颜色为紫色,证明被检验物中一定有钾元素,故D正确.
故选:D.1年前查看全部
- 许多因素会影响化学反应速率.请分析下列实验或事实,分别说明在其他条件不变时,这些因素是如何影响化学反应速率的.示例:过氧
许多因素会影响化学反应速率.请分析下列实验或事实,分别说明在其他条件不变时,这些因素是如何影响化学反应速率的.示例:过氧化氢溶液在常温下能缓慢分解,若加入少量Mn02时分解加速.答:使用催化剂,可以加快化学反应速率.
(1)同种食品在夏天比冬天更容易变质.
(2)木炭在纯氧中燃烧比在空气中进行得更快,更剧烈.
(3)在相同质量的锌粉和锌粒中分别加入足量l0%的稀盐酸,前者先反应完. JenniferSu1年前1
JenniferSu1年前1 -
 zjd0812 共回答了18个问题
zjd0812 共回答了18个问题 |采纳率77.8%解题思路:(1)根据同种食品在夏天比冬天更容易变质,说明了升高温度,可以加快化学反应速率进行解答;
(2)根据增大反应物浓度,可以加快化学反应速率进行解答;
(3)根据增大反应物接触面积,可以加快化学反应速率进行解答.(1)同种食品在夏天比冬天更容易变质,夏天温度高,这说明了升高温度,可以加快化学反应速率;
(2)木炭在纯氧中燃烧比在空气中进行得更快,更剧烈,是因为氧气的浓度不同,所以增大反应物浓度,可以加快化学反应速率;
(3)在相同质量的锌粉和锌粒中分别加入足量10%的稀盐酸,前者先反应完.说明反应物的接触面积越大,反应的速率大,所以增大反应物接触面积,可以加快化学反应速率.
故答案为:(1)升高温度,可以加快化学反应速率;(2)增大反应物浓度,可以加快化学反应速率;(3)增大反应物接触面积,可以加快化学反应速率.点评:
本题考点: 影响化学反应速率的因素探究;金属活动性顺序及其应用.
考点点评: 解答本题的关键是要充分理解影响化学反应速率的因素,只有这样才能对问题做出正确的判断.1年前查看全部
- (附加题)酶具有高效性、专一性和多样性的特性,其活性受到温度和pH等因素的影响.氯化铁是一种无机催化剂,其溶液能催化过氧
(附加题)酶具有高效性、专一性和多样性的特性,其活性受到温度和pH等因素的影响.氯化铁是一种无机催化剂,其溶液能催化过氧化氢的分解.肝脏组织细胞中也有一种能催化过氧化氢溶液分解的酶.为了研究生物酶与无机催化剂的催化效率,某同学设计了一个实验,以下是该实验的几个步骤:
①向3号试管滴入几滴氯化铁溶液;
②将点燃但无火焰的卫生香分别放在1、2、3号试管的管口,仔细观察,发现1号试管口的卫生香燃烧剧烈;2号试管口几乎没有变化;
③取三支洁净的试管,编上1、2、3号,分别注入10mL3%的过氧化氢溶液;
④轻轻振荡这三支试管,使试管内的物质混合均匀,会发现1号试管的气泡多而且最先产生,2号试管几乎无气泡产生.
⑤取豌豆大小的新鲜肝脏,放在培养皿中迅速剪碎并投入到1号试管中,将同样大小的新鲜肝脏煮熟后,冷却、剪碎,投入到了2号试管中.
(1)请根据实验原理,选择正确的顺序是______.
A、①②③④⑤,B、③④①②⑤,C、③④①⑤②,D、③⑤①④②
(2)该实验主要是证明了酶具有______特性
(3)2号试管没有明显变化的原因是______. pZ881年前1
pZ881年前1 -
 aaa76 共回答了20个问题
aaa76 共回答了20个问题 |采纳率95%解题思路:本题主要是为了对比生物酶和无机催化剂的催化效率.
(1)实验顺序应该为加药品→加催化剂→观察气泡的产生情况→观察卫生香的燃烧情况;
(2)1号试管气泡多、燃烧剧烈,说明1号试管内的反应发生的快;
(3)2号试管中的肝脏煮熟了,蛋白质变性,失去了活性.(1)实验顺序应该为加药品→加催化剂→观察气泡的产生情况→观察卫生香的燃烧情况,即选D.
(2)1号试管气泡多、燃烧剧烈,说明1号试管内的反应发生快,生物酶比无机催化剂的催化效率高.证明了酶具有高效特性.
(3)2号试管没有明显变化的原因是:酶是蛋白质,加热后变性,失去了原有的生物活性.
故答案为:(1)D;(2)高效;(3)酶是蛋白质,加热后变性,失去了原有的生物活性.点评:
本题考点: 生命活动与六大营养素;实验探究物质的性质或变化规律;实验步骤的探究.
考点点评: 本题主要考查蛋白质的相关知识,难度稍大.1年前查看全部
- CO和H 2 的混合气体a克与少量m克的氧气混合,放入装有足量Na 2 O 2 的密闭容器中连续不断用电火花点燃.则过氧
CO和H 2 的混合气体a克与少量m克的氧气混合,放入装有足量Na 2 O 2 的密闭容器中连续不断用电火花点燃.则过氧化钠的质量增加了______.  ufo51841年前1
ufo51841年前1 -
 狼星闪曜 共回答了15个问题
狼星闪曜 共回答了15个问题 |采纳率86.7%CO和H 2 的混合气体燃烧的方程式:2CO+O 2
点燃
.
2CO 2 ,2H 2 +O 2
点燃
.
2H 2 O,与Na 2 O 2 反应的方程式:2CO 2 +2Na 2 O 2 =2Na 2 CO 3 +O 2 ,2H 2 O+2Na 2 O 2 =4NaOH+O 2 ,通过方程式可以看出,固体质量的增加量就是原混合气体的质量,为ag,
故答案为:ag.1年前查看全部
- 已知S2O8n-离子和H2O2一样含有过氧键,因此也有强氧化性,S2O8n-离子在一定条件下可把Mn2+氧化成MnO4-
已知S2O8n-离子和H2O2一样含有过氧键,因此也有强氧化性,S2O8n-离子在一定条件下可把Mn2+氧化成MnO4-离子,若反应后S2O8n-离子变成SO42-;又知反应中氧化剂与还原剂的离子数之比为5:2,则S2O8n-中的n值和S的化合价是( )
A.2,+7
B.2,+6
C.4,+7
D.4,+4 鄂鲵叶1年前1
鄂鲵叶1年前1 -
 fsq123 共回答了24个问题
fsq123 共回答了24个问题 |采纳率91.7%解题思路:Mn2+氧化成MnO4-,Mn元素的化合价由+2价升高为+7价,若反应后S2O8n-变成SO42-,S的化合价降低,SO42-中S的化合价为+6价,以此来解答.Mn2+氧化成MnO4-,Mn元素的化合价由+2价升高为+7价,若反应后S2O8n-变成SO42-,S的化合价降低,SO42-中S的化合价为+6价,则S2O8n-中的S元素的化合价为+7价,则+7×2+(-2)×8=-n,解得n=2,
故选A.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析能力的考查,注意从化合价角度分析,题目难度不大.1年前查看全部
- 一道八下科学题,“物质的结构决定性质,物质的性质决定用途”是自然科学的重要思想.过氧化氢是常用的杀菌消毒剂,其原因是过氧
一道八下科学题,
“物质的结构决定性质,物质的性质决定用途”是自然科学的重要思想.过氧化氢是常用的杀菌消毒剂,其原因是过氧化氢分子中含有一种叫“过氧基”的结构H-(O-O)-H(括出部分).据此推测下列物质中,可作杀菌消毒剂的是( )
 fuzhongren1年前1
fuzhongren1年前1 -
 似水流年_三毛 共回答了18个问题
似水流年_三毛 共回答了18个问题 |采纳率88.9%答案D.A为H2O,B为CO2,C为CH4,D为(CH3CO(OO)H,含有过氧基.1年前查看全部
- 问一个生活中的化学问题平时用的红笔的墨水是一种混合物那它主要的成分有哪些?在日常生活中的什么东西能和它发生化学反应?过氧
问一个生活中的化学问题
平时用的红笔的墨水是一种混合物
那它主要的成分有哪些?
在日常生活中的什么东西能和它发生化学反应?
过氧化氢行吗? 末日狼1年前1
末日狼1年前1 -
 忘忧草儿 共回答了10个问题
忘忧草儿 共回答了10个问题 |采纳率80%主要成分是品红
SO2,NA2O2,HCLO,H2O2都可以使它褪色即是反应,它是一种有机色素1年前查看全部
- 实验室常里用于制取氧气的方法有:a、加热氯酸钾晶体和二氧化锰粉末;b、加热高锰酸钾固体;c、用二氧化锰粉末作催化剂使过氧
实验室常里用于制取氧气的方法有:a、加热氯酸钾晶体和二氧化锰粉末;b、加热高锰酸钾固体;c、用二氧化锰粉末作催化剂使过氧化氢(H 2 O 2 )溶液分解产生水和氧气.实验室制取氧气常用装置如下列图A、图B所示. 
请回答有关问题:
(1)请仔细分析图A的特点,推测所用制取氧气的方法是______(填“a”、“b”、“c”)
(2)采用c方法制氧气,应选用装置______(填“图A”、“图B”).为检验装置B中氧气是否收集满,可用带火星的木条放在集气瓶口,这是利用了氧气______的性质.利用图A装置制氧气,在结束实验时要先撤离导管出水面,再熄灭酒精灯,其目的是______;利用图B装置制氧气时,长颈漏斗的下端要插入液面以下,其目的是______.
(3)实验室里,常用氯化铵晶体跟氢氧化钙粉末混合加热制取氨气.它是一种无色的,有刺激性气味的,密度比空气小,而溶于水且能跟水反应生成氨水的气体,制取氨气过程中还有氯化钙和水生成.实验室制取氨气可选用制取______(填“A”或“B”)的装置,其理由是______;收集氨气可用______法,理由是______. xt1_20011年前1
xt1_20011年前1 -
 热带丛林里的鱼 共回答了17个问题
热带丛林里的鱼 共回答了17个问题 |采纳率94.1%(1)A图是“固体加热型”,根据实验室制取氧气的反应原理,氯酸钾、高锰酸钾需加热,且管口有棉花,说明是用高锰酸钾制取氧气;
故答案为:b;
(2)C为“固液常温型”,实验室用过氧化氢制氧气是在常温下进行,故用B;根据氧气可以助燃,可以使带火星的木条复燃放在集气瓶口验满;实验结束先移导管后熄灯,目的是防止防止水槽中水倒吸,引起试管破裂;长颈漏斗下端要伸入液面以下,目的是防止生成的气体从长颈漏斗中逸出;
故答案为:图B;氧气能支持燃烧;防止水槽中水倒吸,引起试管破裂;防止生成的气体从长颈漏斗中逸出;
(3)用氯化铵晶体跟氢氧化钙粉末混合加热制取氨气,属于“固体加热型”,因此应选择A装置,氨气密度比空气小,溶于水且能跟水反应生成氨水,所以不能用排水法收集,只能用向下排空气法收集;
故答案为:A;固体和固体反应需加热;向下排空气;密度比空气小,溶于水且能跟水反应.1年前查看全部
- 为探究酶的浓度(以土豆块数多少代表)对酶促反应的影响,某兴趣小组设计了如图1的实验装置.可供选用的材料用具有:3%的过氧
为探究酶的浓度(以土豆块数多少代表)对酶促反应的影响,某兴趣小组设计了如图1的实验装置.可供选用的材料用具有:3%的过氧化氢溶液、新鲜土豆(含有过氧化氢酶)、水果刀、量筒、带刻度的50mL注射器(3个)、橡皮塞、计时器.请.回答下面的问题.
(1)实验步骤: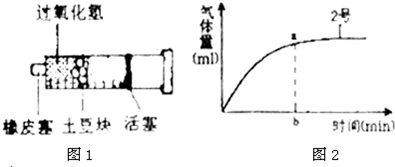
①将新鲜土豆去皮,______;
②取3个50mL的注射器编号为A、B、C.______;
③然后______,如图示装置;
④______.
(2)实验中需控制的无关变量有______、______等(至少答2点).
(3)如果图2是B注射器的实验结果,与B相比.那么A、C注射器内产生a量气体时所需的时间b应分别为______、______. 6_sss1年前1
6_sss1年前1 -
 布里斯班的春天 共回答了20个问题
布里斯班的春天 共回答了20个问题 |采纳率95%解题思路:影响酶促反应的因素:(1)温度对酶活性的影响:在一定的温度范围内反应速率随温度升高而加快;但当温度升高到一定限度时反应速率随温度的升高而下降.在一定的条件下,酶在最适温度时活性最大.高温使酶永久失活,而低温使酶活性降低,但能使酶的空间结构保持稳定,适宜温度下活性会恢复.(2)pH对酶促反应的影响:每种酶只能在一定限度的pH范围内才表现活性.过酸或过碱会使酶永久失活.(3)酶的浓度对酶促反应的影响:在底物充足,其他条件固定、适宜的条件下,酶促反应速率与酶浓度成正比.(4)底物浓度对酶促反应的影响:在底物浓度较低时,反应速率随底物浓度的增加而急剧加快,反应速率与底物浓度成正比;在底物浓度较高时,底物浓度增加,反应速率也增加,但不显著;当底物浓度很大且达到一定限度时反应速率达到一个最大值,此时,再增加底物浓度反应速率不再增加.本题为探究酶的浓度(以土豆块数多少代表)对酶促反应的影响,实验的自变量为土豆块数多少,因变量为酶促反应速度,其他为无关变量.
(1)实验步骤:
①将新鲜土豆去皮,为控制变量,应切成大小相等的若干小块;
②取3个50mL的注射器编号为A、B、C,分别加入10ml(等量)过氧化氢溶液;
③再分别加入2,4,6个土豆小块
④定时观察记录针筒内体积的变化.
(2)试验中除了自变量和应变量意外的都是无关变量,有:温度、土豆的新鲜程度、注射器的密封性、注射器针筒与活塞之间的摩擦力等.
(3)如果图2是B注射器的实验结果,与B相比.A注射器内加入了2个土豆块,含有的过氧化氢酶少,反应的慢,所以产生a量气体时所需的时间b应延长,C注射器内加入了6个土豆块,含有的过氧化氢酶多,反应的快,所以产生a量气体时所需的时间b应缩短.
故答案为:
(1)①切成大小相等的若干小块
②分别加入10ml(等量)过氧化氢溶液
③再分别加入2,4,6个土豆小块
④定时观察记录针筒内体积的变化
(2)温度土豆的新鲜程度注射器的密封性注射器针筒与活塞之间的摩擦力等
(3)延长、缩短点评:
本题考点: 探究影响酶活性的因素.
考点点评: 此题结合实验考查酶促反应的相关考点,意在考查学生对基础知识的理解和综合运用,难度较大.1年前查看全部
- (q044•塘沽区八模)只用下列鉴别方法不能把待鉴别的物质区分开的是( ) 选项 待鉴别的物质 鉴别方法 A 水、过氧
(q044•塘沽区八模)只用下列鉴别方法不能把待鉴别的物质区分开的是( )
选项 待鉴别的物质 鉴别方法 A 水、过氧化氢溶液 加二氧化锰,观察能否产生气体 4 硬水和软水 加肥皂水,振荡,观察产生泡沫的情况 C 氮气和二氧化碳 用燃y的木条,观察木条燃烧的情况 0 棉纤维、羊毛纤维 点燃,闻燃烧产生的气味
A.A
B.B
C.C
D.D vv极客1年前1
vv极客1年前1 -
 vhjlhjvjh7 共回答了20个问题
vhjlhjvjh7 共回答了20个问题 |采纳率95%解题思路:根据已有的知识进行分析,过氧化氢能在二氧化锰的催化作用下反应生成氧气,而水不可以;硬水中含有较多的可溶性钙镁化合物,与肥皂水混合会产生大量的浮渣,软水中不含或含有少量的可溶性钙镁化合物,与肥皂水混合产生大量的泡沫;氮气和二氧化碳都不支持燃烧;羊毛灼烧有烧焦羽毛的气味,据此解答.3、过氧化氢能在二氧化锰的催化作用下反应生成氧气,而水不可以,故加入二氧化锰有气泡产生的是过氧化氢,无现象的是水,可以鉴别,故3不符合题意;
B、硬水中含有较多的可溶性钙镁化合物,与肥皂水混合会产生大量的浮渣,软水中不含或含有少量的可溶性钙镁化合物,与肥皂水混合产生大量的泡沫,加入肥皂水产生的现象不同,可以使用肥皂水鉴别硬水和软水,故B不符合题意;
C、氮气和二氧化碳都不支持燃烧,都能使燃着的木条熄灭,现象相同,无法鉴别,故C符合题意;
D、棉纤维灼烧没有气味,而羊毛灼烧有烧焦羽毛的气味,现象不同,可以鉴别,故D不符合题意;
故选C.点评:
本题考点: 物质的鉴别、推断;常见气体的检验与除杂方法;实验室制取氧气的反应原理;硬水与软水;棉纤维、羊毛纤维和合成纤维的鉴别.
考点点评: 本题考查了常见物质的鉴别,完成此题,可以依据物质的性质差异进行.1年前查看全部
- 许多因素会影响化学反应速率.请分析下列实验或事实,分别说明在其他条件不变时,这些因素是如何影响化学反应速率的.示例:过氧
许多因素会影响化学反应速率.请分析下列实验或事实,分别说明在其他条件不变时,这些因素是如何影响化学反应速率的.示例:过氧化氢溶液在常温下能缓慢分解,若加入少量Mn02时分解加速.答:使用催化剂,可以加快化学反应速率.
(1)同种食品在夏天比冬天更容易变质.
(2)木炭在纯氧中燃烧比在空气中进行得更快,更剧烈.
(3)在相同质量的锌粉和锌粒中分别加入足量l0%的稀盐酸,前者先反应完. bestlovehangeng1年前5
bestlovehangeng1年前5 -
 寒夜月色 共回答了17个问题
寒夜月色 共回答了17个问题 |采纳率82.4%解题思路:(1)根据同种食品在夏天比冬天更容易变质,说明了升高温度,可以加快化学反应速率进行解答;
(2)根据增大反应物浓度,可以加快化学反应速率进行解答;
(3)根据增大反应物接触面积,可以加快化学反应速率进行解答.(1)同种食品在夏天比冬天更容易变质,夏天温度高,这说明了升高温度,可以加快化学反应速率;
(2)木炭在纯氧中燃烧比在空气中进行得更快,更剧烈,是因为氧气的浓度不同,所以增大反应物浓度,可以加快化学反应速率;
(3)在相同质量的锌粉和锌粒中分别加入足量10%的稀盐酸,前者先反应完.说明反应物的接触面积越大,反应的速率大,所以增大反应物接触面积,可以加快化学反应速率.
故答案为:(1)升高温度,可以加快化学反应速率;(2)增大反应物浓度,可以加快化学反应速率;(3)增大反应物接触面积,可以加快化学反应速率.点评:
本题考点: 影响化学反应速率的因素探究;金属活动性顺序及其应用.
考点点评: 解答本题的关键是要充分理解影响化学反应速率的因素,只有这样才能对问题做出正确的判断.1年前查看全部
- 请根据下列实验装置图回答问题:(1)写出仪器a、b的名称. a是______,b是______.(2)若用过氧
请根据下列实验装置图回答问题:

(1)写出仪器a、b的名称. a是______,b是______.
(2)若用过氧化氢来制取氧气,反应的发生装置是______,收集装置为______,反应的符号表达式是2H2O2
2H2O+O2↑,MnO2 .2H2O2.
2H2O+O2↑,MnO2 .
(3)若用高锰酸钾来制取氧气,反应的发生装置为______,该装置中还应补充______,反应的符号表达式是2KMnO4
K2MnO4+MnO2+O2↑△ .2KMnO4.如何检验氧气已满,写出检验方法______.
K2MnO4+MnO2+O2↑△ . 难得作贼1年前1
难得作贼1年前1 -
 hanyidao 共回答了20个问题
hanyidao 共回答了20个问题 |采纳率95%解题思路:(1)根据仪器名称解答;(2)通常情况下,过氧化氢在二氧化锰的催化作用下,分解生成水和氧气,应选择固液不需加热的发生装置B,由于氧气的密度比空气大不易溶于水,故采用向上排空气法收集和排水法收集; (3)高锰酸钾受热时能够分解生成锰酸钾、二氧化锰和氧气,需选择加热固体产生气体的发生装置A;还需在在试管口加一团棉花,防止高锰酸钾随气流进入导管;检验氧气用带火星的木条;(1)仪器a是酒精灯、b是分液漏斗;故填:酒精灯,分液漏斗;
(2)用过氧化氢和二氧化锰制取氧气时不需要加热,应选择固液不需加热的发生装置B,由于氧气的密度比空气大不易溶于水,故采用向上排空气法收集和排水法收集; 反应的化学方程式为:2H2O2
MnO2
.
2H2O+O2化↑.
故填:B;C或E;2H2O2
MnO2
.
2H2O+O2↑;
(3)用高锰酸钾制取氧气需要加热,需选择加热固体产生气体的发生装置A;还需在在试管口加一团棉花,防止高锰酸钾随气流进入导管;反应的化学方程式为:2KMnO4
△
.
K2MnO4+MnO2+O2↑.检验氧气用带火星的木条伸入试管,如木条复燃就是氧气;
故填:A;在试管口加一团棉花;2KMnO4
△
.
K2MnO4+MnO2+O2↑;带火星的木条伸入试管,如木条复燃就是氧气.点评:
本题考点: 氧气的制取装置;氧气的收集方法;氧气的检验和验满;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要考查化学方程式的书写和实验装置的选择,选择发生装置时,要考虑反应物的状态、反应条件等因素;选择收集装置时,要考虑气体的水溶性、能否和水发生化学反应、密度、能否和空气中的物质发生化学反应等因素.1年前查看全部
- 过氧乙醇和过氧化氢一样不稳定,能分解生成乙醇(化学式为CH3COOOH)和氧气,反应的化
过氧乙醇和过氧化氢一样不稳定,能分解生成乙醇(化学式为CH3COOOH)和氧气,反应的化
过氧乙醇(CH3COOOH)和过氧化氢一样不稳定,能分解生成乙醇(化学式为CH3COOOH)和氧气,反应的化学方程式为__________
配制600克质量分数 为05%的过氧乙醇消毒液,需要20%的过氧乙醇多少克
 风中雨衡1年前1
风中雨衡1年前1 -
 丁次 共回答了18个问题
丁次 共回答了18个问题 |采纳率94.4%要学会自己思考哦~~2CH3COOOH=2CH3COOH+O2!
假设需要Xg
600*0.005=X*0.2 X=1年前查看全部
- 根据下列实验装置图填空:(1)写出如图所示装置中标有序号的仪器名称:①______,②______.(2)实验室中用过氧
根据下列实验装置图填空:
(1)写出如图所示装置中标有序号的仪器名称:①______,②______.
(2)实验室中用过氧化氢溶液与二氧化锰混合制取氧气,发生反应的化学方程式为:2H2O2
2H2O+O2↑MnO2 .2H2O2;制取气体时,组装好仪器后,应先______,再添加药品;收集氧气时,使用______(选填装置序号〕所示的方法收集到的气体比较纯净.
2H2O+O2↑MnO2 .
(3)实验室加热高锰酸钾取氧气时应选择的发生装置是______,若用E收集氧气,实验结束时要先______,其理由是______,此时发现水槽中的水变成了浅紫红色,你认为产生该现象的原因可能是______.
(4)用氯酸钾和二氧化锰固体制取较纯的氧气时,可选用的发生装置和收集装置是______(填字母序号),反应的化学方程式是2KClO3
2KCl+3O2↑MnO2 .△ 2KClO3.
2KCl+3O2↑MnO2 .△  kaka198701221年前1
kaka198701221年前1 -
 漫天轻羽 共回答了22个问题
漫天轻羽 共回答了22个问题 |采纳率77.3%解题思路:(1)要熟悉各种仪器的名称、用途和使用方法;
(2)通常情况下,过氧化氢在二氧化锰的催化作用下,分解生成水和氧气;
凡是有气体参加或产生的实验,实验前一定要检查装置的气密性;
氧气的密度比空气大,不易溶于水;
(3)高锰酸钾受热时能够分解生成锰酸钾、二氧化锰和氧气;
利用加热的方法制取氧气,并且利用排水法收集氧气时,要按照一定的步骤进行,特别是要注意集满氧气后的操作顺序,以防发生安全事故;
高锰酸钾易溶于水,形成的溶液是浅紫红色的;
(4)氯酸钾在二氧化锰的催化作用下,受热分解生成氯化钾和氧气.(1)①是试管,常用作反应容器;②是集气瓶,常用来收集气体.
故填:试管;集气瓶.
(2)过氧化氢在二氧化锰的催化作用下分解的化学方程式为:2H2O2
MnO2
.
2H2O+O2↑;
为了防止装置漏气影响实验结果,制取气体时,组装好仪器后,应先检查装置的气密性;
因为氧气的密度比空气大,可以用向上排空气法收集,即用D装置收集,氧气不易溶于水,可以用排水法收集,即用E装置收集,用排水法收集的氧气比用排空气法收集的氧气纯净.
故填:2H2O2
MnO2
.
2H2O+O2↑;检查气密性;E.
(3)实验室加热高锰酸钾取氧气时应选择的发生装置是A装置;
若用E收集氧气,实验结束时要先把导管移出水面,其理由是能够防止水倒流入试管,把试管炸裂,如果试管口没有塞一团棉花,高锰酸钾会进入水槽,溶于水后,能使水槽中的水变成浅紫红色.
故填:A;把导管移出水面;能够防止水倒流入试管,把试管炸裂;试管口没有塞一团棉花.
(4)用氯酸钾和二氧化锰固体制取氧气时需要加热,应该用A装置作为发生装置;
因为氧气的密度比空气大,可以用向上排空气法收集,即用D装置收集,氧气不易溶于水,可以用排水法收集,即用E装置收集,用排水法收集的氧气比用排空气法收集的氧气纯净;
氯酸钾在二氧化锰的催化作用下受热分解的化学方程式为:2KClO3
MnO2
.
△2KCl+3O2↑.
故填:AE;2KClO3
MnO2
.
△2KCl+3O2↑.点评:
本题考点: 氧气的制取装置;氧气的收集方法;制取氧气的操作步骤和注意点;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要考查仪器的用途、化学方程式的书写,实验装置的选择,选择发生装置时,要考虑反应物的状态、反应条件等因素;选择收集装置时,要考虑气体的水溶性、能否和水发生化学反应、密度、能否和空气中的物质发生化学反应等因素.1年前查看全部
- (附加题)酶具有高效性、专一性和多样性的特性,其活性受到温度和pH等因素的影响.氯化铁是一种无机催化剂,其溶液能催化过氧
(附加题)酶具有高效性、专一性和多样性的特性,其活性受到温度和pH等因素的影响.氯化铁是一种无机催化剂,其溶液能催化过氧化氢的分解.肝脏组织细胞中也有一种能催化过氧化氢溶液分解的酶.为了研究生物酶与无机催化剂的催化效率,某同学设计了一个实验,以下是该实验的几个步骤:
①向3号试管滴入几滴氯化铁溶液;
②将点燃但无火焰的卫生香分别放在1、2、3号试管的管口,仔细观察,发现1号试管口的卫生香燃烧剧烈;2号试管口几乎没有变化;
③取三支洁净的试管,编上1、2、3号,分别注入10mL3%的过氧化氢溶液;
④轻轻振荡这三支试管,使试管内的物质混合均匀,会发现1号试管的气泡多而且最先产生,2号试管几乎无气泡产生.
⑤取豌豆大小的新鲜肝脏,放在培养皿中迅速剪碎并投入到1号试管中,将同样大小的新鲜肝脏煮熟后,冷却、剪碎,投入到了2号试管中.
(1)请根据实验原理,选择正确的顺序是______.
A、①②③④⑤,B、③④①②⑤,C、③④①⑤②,D、③⑤①④②
(2)该实验主要是证明了酶具有______特性
(3)2号试管没有明显变化的原因是______. tianzi191年前1
tianzi191年前1 -
 阳光眯着眼看我 共回答了17个问题
阳光眯着眼看我 共回答了17个问题 |采纳率94.1%(1)实验顺序应该为加药品→加催化剂→观察气泡的产生情况→观察卫生香的燃烧情况,即选D.
(2)1号试管气泡多、燃烧剧烈,说明1号试管内的反应发生快,生物酶比无机催化剂的催化效率高.证明了酶具有高效特性.
(3)2号试管没有明显变化的原因是:酶是蛋白质,加热后变性,失去了原有的生物活性.
故答案为:(1)D;(2)高效;(3)酶是蛋白质,加热后变性,失去了原有的生物活性.1年前查看全部
- 如果两瓶消毒剂的标签没有了,你如何用化学方法去检验此消毒剂是双氧水还是过氧乙
 蹒跚@学步1年前1
蹒跚@学步1年前1 -
 dreadghost 共回答了16个问题
dreadghost 共回答了16个问题 |采纳率81.3%加碳酸盐,产生大量气体的是过氧乙酸1年前查看全部
- 有关化合价的意义作用和引入大家都学过氧还反应,知道氧化反应化合价升高,还原反应化合价降低.化合价升降与得失电子有关.做有
有关化合价的意义作用和引入
大家都学过氧还反应,知道氧化反应化合价升高,还原反应化合价降低.化合价升降与得失电子有关.
做有关习题的时候,总得背升失氧,降得还.觉得很机械.学化学是了解事物本质和变化规律的.
想真正了解化学本质的朋友介绍一下:
化合价的意义?为什么引入化合价?化合价的作用? 不高兴注册1年前3
不高兴注册1年前3 -
 如果风过耳 共回答了15个问题
如果风过耳 共回答了15个问题 |采纳率73.3%化合价的本质
元素的“化合价”就是该元素的1个原子跟其他元素的原子相化合时得失电子或共用电子的数目.化合价有正价和负价.在离子化合物中,元素正化合价的数值等于该元素1个原子给出电子的数目,元素负化合价的数值等于该元素的1个原子为了填满最外电子层所必须结合的电子数目.例如在氯化镁中,1个镁原子给出两个电子,1个氯原子获得1 于该元素的1个原子与其他元素的原子共用电子对的数目.由于不同元素的原子吸引共用电子对的能力不同,使电子对发生偏移,共用电子对
化合价的应用
在离子化合物中,得、失电子的数目是相等的,在共价化合物中,共用电子对偏离和偏向的数目也是相等的,所以在任何化合物中正、负化合价的代数和都等于“0”.由此不难理解,不同元素相化合时,其原子个数不能是任意的,而要有一定的个数比,这是我们书写化学式和判断化学式是否正确的依据.例如,已知铝为+3价,硫酸根是-2价的原子团,铝跟硫酸根结合成的硫酸铝的化学式应为Al2(SO4)3,这样才符合化合物中的各元素正、负化合价的代数和等于“0”的原则.如果写成AlSO4就错了,理由很简单,因为这个化学式中元素正、负化合价的代数和不等于“0”.1年前查看全部
- 过氧化氢,过氧化钠分别是什么晶体啊?为什么?还有为什么突然过氧啊 三个小问题哦```
 有点迟疑的思维1年前1
有点迟疑的思维1年前1 -
 iris1107 共回答了21个问题
iris1107 共回答了21个问题 |采纳率100%分子晶体 离子晶体
一个过氧根是负二价,而氢离子是公用电子对组成晶体
钠离子是通过正负离子之前的吸引力成键的
所以分别是分子晶体和离子晶体
为什么有过氧根?
没有为什么,过氧根是一个离子嘛
像过氧化氢和过氧化钠只是一种无知而已
比如过氧化钠就是氧气和钠燃烧得到的,在空气中会和二氧化碳反应生成氧气,又会变成氧化钠的1年前查看全部
- 焦硫酸钠(Na2S2O7)到底是什么东西?结构式呢?有什么性质?还有过氧硫酸钠(Na2S2O8)的结构又是什么?
焦硫酸钠(Na2S2O7)到底是什么东西?结构式呢?有什么性质?还有过氧硫酸钠(Na2S2O8)的结构又是什么?
别打错别字哈~要准确的结构式。感之不尽啊~不管什么我都想听听~ 我的所罗门1年前2
我的所罗门1年前2 -
 莉莉52 共回答了16个问题
莉莉52 共回答了16个问题 |采纳率100%焦硫酸钠(Na2S2O7)是两个硫酸中的一个S=O键脱去O,S与另一个上的C=O键的O相连形成S-O-S.两个羟基氢被Na取代.焦硫酸在水中加热会重新生成硫酸,硫酸酸性较焦硫酸强.
过氧硫酸钠(Na2S2O8)是S-O-S变成S-O-O-S,所有过氧酸都有强氧化性.1年前查看全部
- 长途运输鱼苗时,人们常在水中加入少量过氧化钙(CaO2)固体.甲.乙两位同学发现往水中投入过氧?
长途运输鱼苗时,人们常在水中加入少量过氧化钙(CaO2)固体.甲.乙两位同学发现往水中投入过氧?
进行猜想:甲同学认为:生成氧化钙和氧气;
乙同学认为:生成氢氧化钙和氧气。
(1)你认为 同学的猜想是错误的,其理由是
(2)请设计一个实验方案来验证另一个同学的猜想是正确的,并填入下表空格中。
实验步骤及操作方法 预期的实验现象 结论
1.取少量过氧化钙放入试管中,
加足量水,
___________________________。有氧气生成
2.________________________
___________________________
___________________________ 出现浑浊
(3)运输鱼苗时,在水中加入少量过氧化钙的主要目的_____________ __________ squashgirl1年前3
squashgirl1年前3 -
 刀客1998 共回答了13个问题
刀客1998 共回答了13个问题 |采纳率92.3%(1)甲,氧化钙和水会反应,生成氢氧化钙(CaO+H2O=Ca(OH)2)
(2)1.有气泡,并能使带火星的木条复燃
2.一段时间后,溶液
(3)增加氧气,吸收二氧化碳1年前查看全部
- 有些化学名称当中经常说“过氧” 而且这种化合物的化合价代数和不为零呀?
有些化学名称当中经常说“过氧” 而且这种化合物的化合价代数和不为零呀?
例如 过氧化钙 对比 氧化钙.过氧化氢 对比 水.是什么特殊原因让它们多了一个氧原子呢? wyuncngmail1年前4
wyuncngmail1年前4 -
 爱上一只羊 共回答了21个问题
爱上一只羊 共回答了21个问题 |采纳率85.7%过氧根离子,是两个氧原子以共价键结合的一个离子团,他们共用了一对电子,所以每个氧原子是7电子的结构,呈-1价,需要左右各一个电子,达到8电子的稳定结构.所以有双氧水的H2O2结构.碱金属在燃烧的时候会产生过氧化物,如Na2O2.1年前查看全部
- 过氧化氢在常温下分解缓慢,加入二氧化锰后反应明显加快.为了更好地证明二氧化锰和氯化钠是否对过氧
过氧化氢在常温下分解缓慢,加入二氧化锰后反应明显加快.为了更好地证明二氧化锰和氯化钠是否对过氧
为了更好地证明二氧化锰和氯化钠是否对过氧化氢生成氧气快慢有影响,应该进行什么对比试验.麻烦给出实验选用的药品和用量 gxit881年前1
gxit881年前1 -
 一声长啸 共回答了19个问题
一声长啸 共回答了19个问题 |采纳率89.5%①往盛有5mL 5% H2O2溶液的试管中,伸入带火星的木条,木条不复燃.
②往盛有5mL 5% H2O2溶液的试管中,加入1g MnO2,伸入带火星的木条,木条复燃.
③往盛有5mL 5% H2O2溶液的试管中,加入1gNaCl,伸入带火星的木条,木条不复燃.1年前查看全部
大家在问
- 1怎么写苏州小吃豆腐脑的作文500字
- 2温暖 作文
- 3May l borrow this book?Sure.You can ____ ____ for two weeks.
- 4请问为什么黄种人不能打败白种人这句话在日本人眼里不存在?
- 5揣摩例句特点,发挥想象,根据提示,将句子补充完整
- 6在等比数列中,已知a5-a1=15,a4-a2=6,求通项公式
- 7郑州金水区七年级上册语文数学什么版本?
- 8几道语文词语搭配题1.坚强的( )刚强的)( )2.悄悄地( )缓缓地( )徐徐地( )3.跳得( )
- 9英语翻译非常抱歉,上星期六由于供应商的物料有问题,导致货物生产时出现异常,我们品质部已经判定不合格了,所以今天没有安排该
- 10关于声现象,下列说法正确的是( )
- 11when does leave the last train? 这句话对吗?
- 12用适当形式完成下面短文.——是写的,()是要改的单词
- 13afternoon和zoo 发音一样吗
- 14当前世界粮食问题的主要表现有( ) A.全球粮食产量严重不足 B.发达国家人均粮食消费量过高,粮食不能自给 C.世界
- 15登岳阳楼杜甫是一首诗反映了作者的什么风格
