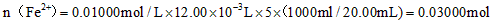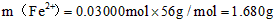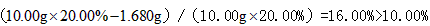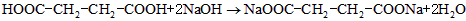(12分)补铁药物“速力菲”说明书部分内容摘录:
 jianer2972022-10-04 11:39:541条回答
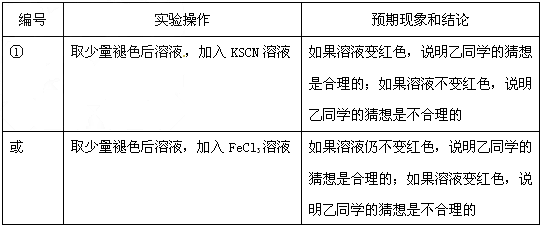
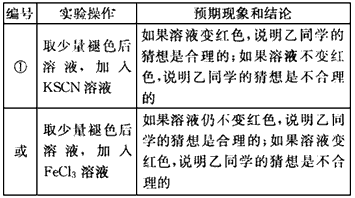
jianer2972022-10-04 11:39:541条回答| (12分)补铁药物“速力菲”说明书部分内容摘录: 【规格】每片含琥珀酸亚铁0.1g 【组成与性状】内含Fe2+34.0%~36.0%的无水碱式盐,为薄膜糖衣片 【适应症】用于缺铁性贫血症预防及治疗 【用量用法】成人预防量0.1g/日,治疗量0.2g~0.4g/日;小儿预防量30~60mg/日,治疗量0.1g~0.3g/日 【储藏】在避光、密封、阴凉处保存 【药物相互作用】与维生素C同服,可增加本品吸收;该药片在水和乙醇中溶解度不大。 现某学校化学实验小组,为了检测“速力菲”药片中亚铁元素的存在,设计了如下几组实验: Ⅰ、理论设计方案:  甲组同学按照设计的方案完成实验,但遗憾的是他们没有得到预期的实验结果, 甲组同学按照设计的方案完成实验,但遗憾的是他们没有得到预期的实验结果, (1)甲组实验失败的可能原因:________________________________________________ 。 乙组同学认真思考了甲组实验失败的原因,模拟药片服用后在人体中溶解的变化过程,重新设计并完成下列实验:  (2)若试剂1为盐酸;则试剂2为________________________________。 丙组同学对乙组实验中最后红色褪去的现象产生了研究兴趣,探讨褪色的原因,根据微粒的组成,他们认为有两种可能的原因: [Fe(SCN)]2+络离子中的三价铁被还原为亚铁 ②。 (3)请你对其中一种可能  进行实验验证:________________________________ 进行实验验证:________________________________实验方案(用文字述):________________________________________________ , 根据预期现象判断结论:________________________________________________________ 。 Ⅱ、(4)称量“速力菲”1.0 g,将其全部溶于稀硫酸中,配制成100.00 mL溶液,取出20.00 mL,用0.01000 mol/L的KMnO4溶液滴定。三次操作读数如下:
|

已提交,审核后显示!提交回复
共1条回复
 yyhxxc 共回答了20个问题
yyhxxc 共回答了20个问题 |采纳率90%- (12分)(1)该药片在水中溶解度不大,少量溶解后的溶液中几乎不存在Fe2+离子,所以得不到预期的实验现象。(2分)
(2) KSCN溶液 (2分)
[Fe(SCN)]2+络离子中的SCN—被双氧水氧化(2分)
(3)在褪色后溶液加入FeCl3溶液溶液(2分)
现象:变红色结论:褪色原因是因为①;不变红色 结论:褪色原因是因为②
或在褪色后溶液加入加入KSCN溶液(2分)
现象:变红色结论:褪色原因是因为②;不变红色 结论:褪色原因是因为①
(4)16.83%(2分)
略 - 1年前
相关推荐
- (2012•和平区一模)如图是某品牌补铁剂的标签.请回答:
 (2012•和平区一模)如图是某品牌补铁剂的标签.请回答:
(2012•和平区一模)如图是某品牌补铁剂的标签.请回答:
(1)富马酸亚铁中C、H元素的质量比为______;
(2)已知富马酸亚铁(C4H2FeO4)中铁元素的质量分数为33%,若每次服用1包该补铁剂,摄入铁元素的质量为______ mg. 海浪之天1年前1
海浪之天1年前1 -
 gsm12533 共回答了29个问题
gsm12533 共回答了29个问题 |采纳率89.7%解题思路:(1)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.
(2)根据题意,每包含富马酸亚铁0.2g,富马酸亚铁(C4H2FeO4)中铁元素的质量分数为33%,据此进行分析解答.(1)富马酸亚铁中C、H元素的质量比为(12×4):(1×2)=24:1.
(2)根据题意,每包含富马酸亚铁0.2g,富马酸亚铁(C4H2FeO4)中铁元素的质量分数为33%,则若每次服用1包该补铁剂,摄入铁元素的质量为0.2g×33%=0.066g=66mg.
故答案为:(1)24:1;(2)66.点评:
本题考点: 元素质量比的计算;化合物中某元素的质量计算.
考点点评: 本题难度不大,考查同学们结合新信息、灵活运用化学式的有关计算进行分析问题、解决问题的能力.1年前查看全部
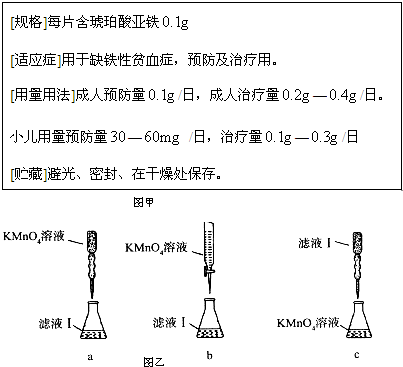
- 铁是人体不可缺少的微量元素,摄入含铁的化合物可补充铁。“速力菲”是市场上一种常见的补铁药品,下表是说明书的部分内容。
铁是人体不可缺少的微量元素,摄入含铁的化合物可补充铁。“速力菲”是市场上一种常见的补铁药品,下表是说明书的部分内容。
[规格]每片含琥珀酸亚铁 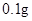
[适应症]用于缺铁性贫血症,预防及治疗用。
[用量用法]成人预防量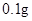 /日,成人治疗量
/日,成人治疗量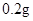 —
—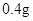 /日。
/日。
小儿用量预防量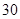 —
—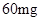 /日,治疗量
/日,治疗量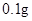 —
—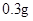 /日
/日
[贮藏]避光、密封、在干燥处保存。
(1)该药品中fe 2+ 会缓慢氧化。***规定该药物中fe 2+ 的氧化率(已经被氧化fe 2+ 的质量与fe 2+ 总质量的比值)超过10.00% 即不能再服用。
①实验室可采用h 2 so 4 酸化的kmno 4 溶液,对“速力菲”中的fe 2+ 进行滴定(假设药品中其他成份不与kmno 4 反应)。请写出该反应的离子方程式: 。
②实验前,首先要精确配制一定物质的量浓度的kmno 4 溶液250 ml,配制时需要的玻璃仪器除玻璃棒、烧杯、胶头滴管外,还需 。
③某同学设计了下列滴定方式(夹持部分略去),最合理的是 。(填字母序号)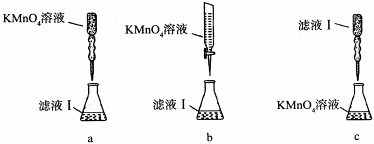
(2)称量上述含铁元素质量分数为20.00%的“速力菲”10.00 g,将其全部溶于稀h 2 so 4 中,配制成1000 ml溶液,取出20.00 ml,用0.01000 mol•l -1 的kmno 4 溶液滴定,用去kmno 4 溶液12.00 ml ,该药品中fe 2+ 的氧化率为 。
(3)已知琥珀酸为二元有机羧酸,含23.6 g琥珀酸的溶液与4.0 mol•l -1 100.0 ml的氢氧化钠溶液恰好完全中和。核磁共振氢谱分析显示,琥珀酸分子谱图上只有两组吸收峰。写出琥珀酸溶液与氢氧化钠溶液完全中和的化学方程式(有机物写结构简式) 。 Ivier1年前1
Ivier1年前1 -
 卓栗栗 共回答了13个问题
卓栗栗 共回答了13个问题 |采纳率92.3%(1)①5Fe 2+ +MnO - 4 +8H + =5Fe 3+ +Mn 2+ +4H 2 O(2分) ②250ml容量瓶(2分)③b(2分)
(2)16.00% (3分)
(3)HOOC-CH 2 CH 2 -COOH+2NaOH→NaOOC-CH 2 CH 2 -COONa+2H 2 O (3分)
1年前查看全部
- (2010•泰州模拟)医学上经常用硫酸亚铁糖衣片给贫血患者补铁.某兴趣小组对这种糖衣片产生了兴趣,打算对药片的糖衣所起作
(2010•泰州模拟)医学上经常用硫酸亚铁糖衣片给贫血患者补铁.某兴趣小组对这种糖衣片产生了兴趣,打算对药片的糖衣所起作用等问题进行探究.
(提出问题)硫酸亚铁糖衣片中糖衣的作用是什么?
(查阅资料)(1)亚铁离子遇具有氧化性的物质易被氧化成铁离子;
(2)硫酸亚铁晶体加热会失去结晶水,高温会继续分解产生金属氧化物和非金属氧化物.
(提出猜想)药片糖衣的作用除了包装药物外,还可能是防止亚铁离子被氧化防止亚铁离子被氧化.
(探究一)利用废水回收铜,制备硫酸亚铁晶体并观察其在空气中的变化推断糖衣的作用.
(1)红色固体是CuCu;溶液乙中溶质是硫酸铝和硫酸亚铁硫酸铝和硫酸亚铁.
(2)写出步骤①的化学方程式:Fe+CuSO4═FeSO4+CuFe+CuSO4═FeSO4+Cu;检验步骤①向废液中加入A是否过量的方法是再插入铁片观察其表面是否出现红色物质再插入铁片观察其表面是否出现红色物质;
(探究二)某硫酸亚铁晶体(FeSO4•xH2O)热分解研究
该兴趣小组同学称取ag硫酸亚铁晶体样品按下图高温加热,使其完全分解,对所得产物进行探究.
(3)①装置B中硫酸铜粉末变蓝,说明产物中有水水,装置C中高锰酸钾溶液褪色,说明产物中还有二氧化硫二氧化硫.
②硫酸亚铁晶体完全分解后装置A中固体呈红棕色,放入足量稀盐酸,固体全部溶解,得到黄色溶液,则装置A中红棕色固体是Fe2O3Fe2O3.
③D装置中球形干燥管的作用是防止倒吸防止倒吸,氢氧化钠溶液的作用是防止污染空气防止污染空气.
④小明查阅资料得出硫酸亚铁分解还生成另一物质SO3,请写出硫酸亚铁分解的化学方程式2FeSO4
Fe2O3+SO2↑+SO3↑2FeSO4高温 .
Fe2O3+SO2↑+SO3↑.高温 .  可爱儿8109231年前1
可爱儿8109231年前1 -
 snow8413abc 共回答了16个问题
snow8413abc 共回答了16个问题 |采纳率87.5%解题思路:亚铁离子遇具有氧化性的物质易被氧化成铁离子的性质,故保存时应该在表面覆盖保护层,为回收废水中的铜,可以使用活动性比铜活泼的金属比如铁将其置换出来,无水硫酸铜白色粉末遇水变蓝,故常用来检验水的存在,二氧化硫能使高锰酸钾溶液褪色,硫酸亚铁分解生成的二氧化硫和三氧化硫能造成空气污染,可以使用氢氧化钠溶液将其除去.提出猜想:亚铁离子遇具有氧化性的物质易被氧化成铁离子的性质,故保存时应该在表面覆盖保护层,所以本题答案为:防止亚铁离子被氧化;
(1)废水中含有的硫酸铜可以使用铁将其置换出来,铁与硫酸铜反应生成硫酸亚铁和铜,铁在铝的后面,不能与硫酸铝反应,由于铁过量,所以固体甲中含有铁和铜,加入硫酸与铁反应而铜不反应,所以红色固体为铜,所以本题答案为:Cu,硫酸铝和硫酸亚铁;
(2)向废水中加入铁可以与硫酸铜反应生成硫酸亚铁和铜,若铁过量则铜全部被置换出来,若铁量不足,则还有硫酸铜存在,所以检验铁是否过量可以向反应后的废液中继续加入铁,观察是否有红色固体析出,所以本题答案为:Fe+CuSO4═FeSO4+Cu,再插入铁片观察其表面是否出现红色物质;
(3)①无水硫酸铜白色粉末遇水变蓝,二氧化硫能使高锰酸钾溶液褪色,所以本题答案为:水,二氧化硫;
②红棕色固体放入足量稀盐酸,固体全部溶解,得到黄色溶液,说明该固体为氧化铁,所以本题答案为:Fe2O3;
③把球形干燥管插入氢氧化钠溶液中的作用是防止液体倒吸,反应生成的二氧化硫是空气污染气,可以使用氢氧化钠溶液将其吸收,所以本题答案为:防止倒吸,防止污染空气;
④根据题意可知硫酸亚铁分解能生成氧化铁、二氧化硫和三氧化硫,所以本题答案为:2FeSO4
高温
.
Fe2O3+SO2↑+SO3↑.点评:
本题考点: 金属的化学性质;实验探究物质的性质或变化规律;金属的回收利用及其重要性.
考点点评: 本题考查了常见金属的性质以及某些盐的性质,完成此题,可以依据题干提供的内容,从中抽取有用的信息,结合已有的知识进行.1年前查看全部
- 如图是某品牌补铁剂的标签.请回答:
 如图是某品牌补铁剂的标签.请回答:
如图是某品牌补铁剂的标签.请回答:
(1)富马酸亚铁中的“铁”指的______(填“分子”、“原子”或“元素”),缺“铁”易导致______,富马酸亚铁中铁的化合价为______.
(2)富马酸亚铁中铁、氧元素质量比为______.
(3)若每次服用2包该补铁剂,摄入铁元素的质量为______ mg(计算结果取整数). 一只笨蛐蛐1年前1
一只笨蛐蛐1年前1 -
 hanxuef 共回答了18个问题
hanxuef 共回答了18个问题 |采纳率77.8%解题思路:(1)物质是由元素组成的;根据铁与人体健康之间的关系分析人体缺“铁”易患疾病;根据铁元素的常见化合价进行分析;
(2)根据化合物中各元素质量比=各元素的相对原子质量×原子个数之比,进行计算;
(3)根据物质中含某元素的质量=该物质的质量×某元素的质量分数,进行计算.(1)物质是由元素组成的,富马酸亚铁中的“铁”指的 元素.由铁与人体健康之间的关系可知,缺“铁”易导致 贫血;铁元素的常见化合价是+2,+3价,富马酸亚铁中铁是亚价态的铁,所以化合价为+2价;
(2)富马酸亚铁中铁、氧元素质量比为:56:(16×4)=7:8;
(3)若每次服用2包该补铁剂,摄入铁元素的质量为:0.2g×2×
56
12×4+1×2+56+16×4×100%=0.132g=132mg.
故答为:(1)元素,贫血,+2;(2)7:8;(3)132.点评:
本题考点: 有关化学式的计算和推断;人体的元素组成与元素对人体健康的重要作用.
考点点评: 本题主要考查了化学式的意义及有关化学式的计算,准确理解化学式的意义是解答本题的关键.1年前查看全部
- 6 从食物中营养素的生物利用率角度来说,以下食品中最好的补铁食品是
6 从食物中营养素的生物利用率角度来说,以下食品中最好的补铁食品是
A 紫菜 B 燕麦片 C 菠菜 D 羊肉 hxm_xx1年前4
hxm_xx1年前4 -
 苍月草812 共回答了22个问题
苍月草812 共回答了22个问题 |采纳率95.5%紫菜中铁的吸收率约为7%
燕麦片中铁的吸收率约为5%
菠菜中铁的吸收率约为3%
羊肉中铁的吸收率约为22%
所以选D
动物性食品中含的铁约有一半为血红素铁,所以吸收率高.植物性食品中铁多为非血红素铁,而且植物性食品中的植酸盐和草酸盐均会影响铁的吸收,所以吸收率很低.1年前查看全部
- (2014•佛山二模)微量元素是人体必须的元素.铁是人体必须的微量元素之一,摄入量不足会因缺铁而引起疾病.如图是某补铁剂
 (2014•佛山二模)微量元素是人体必须的元素.铁是人体必须的微量元素之一,摄入量不足会因缺铁而引起疾病.如图是某补铁剂的部分标
(2014•佛山二模)微量元素是人体必须的元素.铁是人体必须的微量元素之一,摄入量不足会因缺铁而引起疾病.如图是某补铁剂的部分标
签,根据所学知识回答问题:
(1)实验室要用废铁屑与稀硫酸反应制取硫酸亚铁.反应前要除去废铁屑表面的油污,洗涤油污所用的溶液是______.(填编号)
A.碳酸钠溶液B.稀盐酸
C.氢氧化钠溶液D.石灰水
(2)制取硫酸亚铁的反应中,反应前后化合价发生变化的元素是______(写元素符号).
(3)根据标签中的信息计算,服用一片该药相当于补铁______g(保留2位小数). 告诉你也不知道1年前1
告诉你也不知道1年前1 -
 DUANXIJIN 共回答了13个问题
DUANXIJIN 共回答了13个问题 |采纳率100%解题思路:(1)反应前要除去废铁屑表面的油污,据此结合碳酸钠、稀盐酸、氢氧化钠、石灰水的用途进行分析解答.
(2)铁屑与稀硫酸反应生成硫酸亚铁和氢气,根据单质中元素的化合价为0、在化合物中正负化合价代数和为零,进行分析解答.
(3)根据化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答.(1)碳酸钠溶液和氢氧化钠溶液能与油脂反应,可以洗涤油污,可除去废铁屑表面的油污.
(2)铁屑与稀硫酸反应生成硫酸亚铁和氢气,反应的化学方程式是Fe+H2SO4=FeSO4+H2↑;反应前氢元素的化合价为+1价,反应后化合价为0价;反应前,铁元素的化合价为0价,反应后变为+2价,故发生变化的元素是氢元素和铁元素,元素符号为H和Fe.
(3)由题意,一片含主要成分硫酸亚铁0.16g,则服用一片该药相当于补铁的质量=0.16g×
56
56+32+16×4×≈0.06g.
故答案为:(1)AC;(2)H和Fe;(3)0.06.点评:
本题考点: 标签上标示的物质成分及其含量;常用盐的用途;有关元素化合价的计算;化合物中某元素的质量计算.
考点点评: 本题难度不大,考查同学们结合标签新信息、灵活运用常见酸碱盐的用途与化学式的有关计算等进行分析问题、解决问题的能力.1年前查看全部
- 某补铁药剂中铁、硫、氧三种元素质量比为7:4:8;该补铁药剂中铁、硫、氧三种院子的个数比为____.
某补铁药剂中铁、硫、氧三种元素质量比为7:4:8;该补铁药剂中铁、硫、氧三种院子的个数比为____.
我要具体过程结果我知道
知道元素质量比怎么求原子个数比 n_jp19781年前2
n_jp19781年前2 -
 hy12311 共回答了19个问题
hy12311 共回答了19个问题 |采纳率89.5%7/56:4/32:8/16=4:4:11年前查看全部
- (2013•红河州)在商场的货架上,我们经常看到标有“补钙”、“补铁”、“补锌”等字样的食品和保健品,这里的“钙、铁、锌
(2013•红河州)在商场的货架上,我们经常看到标有“补钙”、“补铁”、“补锌”等字样的食品和保健品,这里的“钙、铁、锌”指的是( )
A.元素
B.分子
C.原子
D.离子 是射兴业1年前1
是射兴业1年前1 -
 忧郁风雨 共回答了22个问题
忧郁风雨 共回答了22个问题 |采纳率81.8%解题思路:这里的“钙、铁、锌”等不是以单质、分子、原子等形式存在,而是指元素,通常用元素及其所占质量(质量分数)来描述.“补钙”、“补铁”、“补锌”等字样的食品和保健品,这里的“钙、铁、锌”不是以单质、分子、原子等形式存在,这里所指的“钙、铁、锌、硒”是强调存在的元素,与具体形态无关.
故选:A.点评:
本题考点: 元素的概念.
考点点评: 本题难度不大,主要考查元素与微观粒子及物质的区别,加深对元素概念的理解是正确解答此类试题的关键.1年前查看全部
- (2011•齐齐哈尔)如图是某品牌补铁剂的标签.请回答:
 (2011•齐齐哈尔)如图是某品牌补铁剂的标签.请回答:
(2011•齐齐哈尔)如图是某品牌补铁剂的标签.请回答:
(1)富马酸亚铁颗粒中的铁属于______元素(填“常量”或“微量”);
(2)富马酸亚铁中C、H元素的质量比为______;
(3)富马酸亚铁的相对分子质量是______;
(4)已知富马酸亚铁(C4H2FeO4)中铁元素的质量分数为33%,若每次服用1包该补铁剂,摄入铁元素的质量为______mg. cairo0_01年前1
cairo0_01年前1 -
 34qcwcy 共回答了19个问题
34qcwcy 共回答了19个问题 |采纳率89.5%解题思路:(1)根据人体所必需的微量元素知识进行解答;
(2)根据化合物中各元素质量比=各元素的相对原子质量×原子个数之比,进行解答;
(3)根据相对分子的质量为组成分子的各原子的相对原子质量之和,进行解答;
(4)根据物质中含某元素的质量=该物质的质量×某元素的质量分数,进行解答.(1)根据人体所必需的微量元素中含有铁元素,故答案为:微量;
(2)根据化合物中各元素质量比=各元素的相对原子质量×原子个数之比,可得富马酸亚铁中C、H元素的质量比为:(12×4):2=24:1; 故答案为:24:1;
(3)根据相对分子的质量为组成分子的各原子的相对原子质量之和,可得富马酸亚铁的相对分子质量为:12×4+2+56+16×4=170;故答案为:170;
(4)根据物质中含某元素的质量=该物质的质量×某元素的质量分数,可得:每次服用1包该补铁剂,摄入铁元素的质量为:0.2g×33%=0.066g=66mg;故答案为:66.点评:
本题考点: 元素质量比的计算;相对分子质量的概念及其计算;混合物中某元素的质量计算;标签上标示的物质成分及其含量;矿物质与微量元素.
考点点评: 本题考查学生对化合物中各元素质量比,相对分子的质量知识的理解与掌握,及人体所需的微量元素的知识.1年前查看全部
- 下列广告语在科学性上有错误的是( ) A.小儿患佝偻病,应多多补铁 B.请食用加碘食盐,预防大脖子病 C.使用含氟牙膏
下列广告语在科学性上有错误的是( ) A.小儿患佝偻病,应多多补铁 B.请食用加碘食盐,预防大脖子病 C.使用含氟牙膏,可预防龋齿 D.多吃含硒苹果,可预防癌症  中世纪猫咪1年前1
中世纪猫咪1年前1 -
 海角色389 共回答了11个问题
海角色389 共回答了11个问题 |采纳率72.7%A、小儿缺钙易患佝偻病,缺铁易患贫血,所以错误.
B、碘是合成甲状腺激素的主要元素,缺乏易患大脖子病,所以正确.
C、氟能防治龋齿,缺乏易患龋齿,但是不能过量使用,过量会引起氟斑牙和氟骨病,所以正确.
D、硒是一种微量元素,可以预防癌症,正确.
故选A1年前查看全部
- 如图是某品牌补铁剂的标签.请回答:
 如图是某品牌补铁剂的标签.请回答:
如图是某品牌补铁剂的标签.请回答:
(1)富马酸亚铁中属于______(填“单质”、“化合物”或“氧化物”),富马酸亚铁中铁元素的化合价为______,缺“铁”易导致______(填序号).
A.发育停滞、智力低下B.贫血症C.甲状腺肿大D.白内障、动脉硬化
(2)富马酸亚铁中铁、氧元素质量比为______.
(3)某成人服用该铁剂补铁,他一天内摄入的铁元素的质量为______ mg(计算结果取整数). whowho19331年前1
whowho19331年前1 -
 ymf1945 共回答了13个问题
ymf1945 共回答了13个问题 |采纳率92.3%解题思路:(1)根据物质的分类来分析;根据铁与人体健康之间的关系分析人体缺“铁”易患疾病;根据铁元素的常见化合价进行分析;
(2)根据化合物中各元素质量比=各元素的相对原子质量×原子个数之比,进行计算;
(3)根据物质中含某元素的质量=该物质的质量×某元素的质量分数,进行计算.(1)该物质是由四种元素组成的纯净物,属于化合物,富马酸亚铁中的“铁”指的 元素.由铁与人体健康之间的关系可知,缺“铁”易导致贫血;铁元素的常见化合价是+2,+3价,富马酸亚铁中铁是亚价态的铁,所以化合价为...
点评:
本题考点: 标签上标示的物质成分及其含量;单质和化合物的判别;有关元素化合价的计算;元素质量比的计算;化合物中某元素的质量计算;人体的元素组成与元素对人体健康的重要作用.
考点点评: 本题主要考查了化学式的意义及有关化学式的计算,准确理解化学式的意义是解答本题的关键.1年前查看全部
- (2013•潮阳区模拟)如图是某品牌补铁剂的标签.请回答:
 (2013•潮阳区模拟)如图是某品牌补铁剂的标签.请回答:
(2013•潮阳区模拟)如图是某品牌补铁剂的标签.请回答:
(1)富马酸亚铁颗粒中的铁属于______元素(填“常量”或“微量”);
(2)富马酸亚铁中C、H元素的质量比为______;富马酸亚铁的相对分子质量为______;
(3)富马酸亚铁(C4H2FeO4)中铁元素的质量分数为______,若每次服用1包该补铁剂,摄入铁元素的质量为(取整数)______mg. 雾里行舟1年前0
雾里行舟1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2010•汕头)如图是某品牌补铁剂的标签.请回答:
 (2010•汕头)如图是某品牌补铁剂的标签.请回答:
(2010•汕头)如图是某品牌补铁剂的标签.请回答:
(1)富马酸亚铁中含有______种元素,C、H、Fe、O原子个数比为______.
(2)富马酸亚铁的相对分子质量为______.
(3)若每次服用1包该补铁剂,摄入铁元素的质量为______mg(计算结果取整数). 李老根李1年前1
李老根李1年前1 -
 junge_003 共回答了20个问题
junge_003 共回答了20个问题 |采纳率90%解题思路:(1)由富马酸亚铁的化学式C4H2FeO4可知它是由几种元素组成和C、H、Fe、O原子个数比;
(2)由富马酸亚铁的化学式C4H2FeO4可知,它的相对分子质量=(碳的相对原子质量×碳原子个数)+(氢的相对原子质量×氢原子个数)+(铁的相对原子质量×铁原子个数)+(氧的相对原子质量×氧原子个数)
(3)先计算出富马酸亚铁中铁元素的质量分数=[Fe的相对原子质量/富马酸亚铁的相对分子质量]×100%,然后根据每包含富马酸亚铁的质量×富马酸亚铁中铁元素的质量分数计算即可.解;(1)由富马酸亚铁的化学式C4H2FeO4可知,它是由C、H、Fe、O这四种元素组成,C、H、Fe、O原子个数比为4:2:1:4;
(2)由富马酸亚铁的化学式C4H2FeO4可知,它的相对分子质量=12×4+1×2+56+16×4=170;
(3)富马酸亚铁中铁元素的质量分数=[56/170]×100%≈32.9%,
0.2g×32.9%=0.0658g≈66mg.
故答案为:(1)4,4:2:1:4;
(2)170;
(3)66mg.点评:
本题考点: 标签上标示的物质成分及其含量;物质的元素组成;相对分子质量的概念及其计算;混合物中某元素的质量计算.
考点点评: 本题主要考查学生运用化学式和元素的质量分数公式进行计算的能力.1年前查看全部
- 化学科学在药物的开发、合成和使用中起着至关重要的作用.如小苏打、氢氧化铝、三硅酸镁等可治疗胃酸过多,硫酸亚铁可补铁、防治
化学科学在药物的开发、合成和使用中起着至关重要的作用.如小苏打、氢氧化铝、三硅酸镁等可治疗胃酸过多,硫酸亚铁可补铁、防治贫血.试回答下列问题:
(1)写出胃舒平药片(复方氢氧化铝)与胃酸(主要成分为稀盐酸)作用的离子方程式:______
(2)自选合适的氧化剂,将补铁剂中的Fe2+氧化成Fe3+,写出相关的离子反应方程式______.配置FeSO4时加少量的铁粉,目的是______化学方程式为______. MissSammi1年前1
MissSammi1年前1 -
 dong_gua 共回答了15个问题
dong_gua 共回答了15个问题 |采纳率93.3%解题思路:(1)氢氧化铝与盐酸反应生成氯化铝和水;
(2)氯气具有强的氧化性,能够氧化二价铁离子到三价铁离子;
二价铁离子具有强的还原性,容易被氧化成三价铁离子.(1)氢氧化铝与盐酸反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O,故答案为:Al(OH)3+3H+=Al3++3H2O;
(2)氯气与二价铁离子反应的离子方程式为:Cl2+2Fe2+=2Cl-+2Fe3+;
二价铁离子具有强的还原性,容易被氧化成三价铁离子,三价铁离子能够氧化铁生成二价铁离子,配置FeSO4时加少量的铁粉可以防止硫酸亚铁被氧化为硫酸铁,化学方程式为:Fe+Fe2(SO4)3=3FeSO4;
故答案为:Cl2+2Fe2+=2Cl-+2Fe3+;防止二价铁离子被氧化成三价铁离子;Fe+Fe2(SO4)3=3FeSO4.点评:
本题考点: 离子方程式的书写;镁、铝的重要化合物;铁盐和亚铁盐的相互转变.
考点点评: 本题考查了离子方程式的书写,明确氢氧化铝、铁盐和亚铁盐的性质、掌握离子方程式书写的方法是解题关键,题目难度不大.1年前查看全部
- 在补铁的药品中,常含有少量极细的还原铁粉,可与胃液中的盐酸反应,使其吸收,起到补铁的作用,请用化学方程式表达这一反应过程
 wancheng88991年前2
wancheng88991年前2 -
 阳光一屡 共回答了20个问题
阳光一屡 共回答了20个问题 |采纳率90%Fe+2HCl=FeCl2+H21年前查看全部
- 硫酸亚铁的质量比硫酸亚铁【FeSO4】可用于补铁。1.求硫酸亚铁中铁.硫.氧的质量比。2.硫酸亚铁中铁元素的质量分数.3
硫酸亚铁的质量比
硫酸亚铁【FeSO4】可用于补铁。
1.求硫酸亚铁中铁.硫.氧的质量比。
2.硫酸亚铁中铁元素的质量分数.
3.某病人要补7g铁,它需要多少克的硫酸亚铁? tduttool1年前1
tduttool1年前1 -
 wtt617 共回答了29个问题
wtt617 共回答了29个问题 |采纳率86.2%1.56:32:(16*4)=14:8:16=7:4:8
2.56/(56+32+64)=7/(7+4+8)=0.3684
3.7/0.3684g=19.00g1年前查看全部
- 铁是人体必需的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种
铁是人体必需的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe 2+ 的存在,设计并进行了如下实验: 
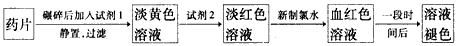
(1)试剂l是______________,试剂2是_______________,加入新制氯水后溶液中发生的离子反应方程式是_____________________________。
(2)加入试剂2后溶液中颜色由淡黄色转变为淡红色是因为__________________________;写出+2价Fe在空气中转化为+3价Fe的离子方程式___________________________。
(3)该同学猜想血红色溶液变为无色溶液的原因是溶液中的+3价铁被还原为+2价铁,你认为该同学的猜想合理吗?________________________________。若你认为合理,请说明理由(若你认为不合理,该空不要作答)________________________; 若你认为不合理请提出你的猜想并设计一个简单的实验加以验证(若你认为合理,该空不要作答): _______________________。 aminda1年前1
aminda1年前1 -
 发条猴子 共回答了21个问题
发条猴子 共回答了21个问题 |采纳率66.7%(1)稀盐酸;KSCN溶液;2Fe 2+ +Cl 2 =2Fe 3+ +2Cl -
(2)Fe 3+ +SCN - =[Fe(SCN)] 2 +4Fe 2+ +4H + +O 2 =4Fe 3+ +2H 2 O
(3)不合理;可能是SCN - 被过量的氯水氧化,在褪色后溶液中加入FeCl 3 溶液,仍不变红色(或在褪色后溶液中加入KSCN溶液,变红色)1年前查看全部
- (2014•东台市二模)医学上经常用硫酸亚铁糖衣片给贫血患者补铁.某兴趣小组的同学对糖衣片中硫酸亚铁晶体的制备和组成产生
(2014•东台市二模)医学上经常用硫酸亚铁糖衣片给贫血患者补铁.某兴趣小组的同学对糖衣片中硫酸亚铁晶体的制备和组成产生了兴趣并对其进行探究.
探究Ⅰ:利用实验室的废水回收铜、制备硫酸亚铁晶体.
(1)步骤①的化学方程式是______.
(2)固体甲中含有的物质是______(填化学式,下同);红色固体是______;溶液乙中的溶质是______.
探究Ⅱ:硫酸亚铁晶体(FeSO4•xH2O)的化学式.
【查阅资料】
(1)无水硫酸铜粉末遇水会变成蓝色的硫酸铜晶体.
(2)硫酸亚铁晶体加热时,先失去结晶水,高温会继续分解产生金属氧化物和气态非金属氧化物.
【进行实验】
该兴趣小组同学称取2.78g硫酸亚铁晶体(FeSO4•xH2O)样品按图1装置高温加热,使其完全分解,并对所得产物进行分析,并利用SDTQ600热分析仪对硫酸亚铁晶体热分解获得相关数据,绘制成图2所示关系图.
【数据分析】
(1)图1装置B中无水硫酸铜粉末变蓝,说明产物中有______,该物质的质量为______ g.
(2)T3℃时,发生的化学反应为:2FeSO4
Fe2O3+X↑+SO3↑,其中X的化学式______.高温 .
(3)装置C中氢氧化钠溶液的作用是______.
(4)已知FeSO4•xH2O
FeSO4+xH2O;计算FeSO4•xH2O中的x.(写出计算过程)△ .
【交流讨论】实验中要持续通入氮气,否则测出的x值会______(填偏大、偏小或不变). jswulin1年前1
jswulin1年前1 -
 william_5252 共回答了22个问题
william_5252 共回答了22个问题 |采纳率86.4%解题思路:探究Ⅰ:从含有硫酸铝、硫酸亚铁和硫酸铜的废水中回收铜和硫酸亚铁,加入的过量的金属A应是铁,根据铁与硫酸铜的反应写出①的反应的方程式,分析固体甲的成分及溶液乙中的溶质;
探究Ⅱ:【数据分析】(1)有无水硫酸铜粉末变蓝,说明产物中有水;
(2)根据化学反应前后原子种类和数目不改变;
(3)根据氧化铁的颜色、性质分析回答;
(4)根据质量守恒定律和化学式的意义进行计算.
【交流讨论】根据实验中要持续通入氮气的作用,分析x的变化.探究Ⅰ:由题意可知,从含有硫酸铝、硫酸亚铁和硫酸铜的废水中回收铜和硫酸亚铁,加入的过量的金属A应是铁.
(1)由上述分析可知,步骤①发生的反应是铁与硫酸铜的反应,化学方程式是:Fe+CuSO4═FeSO4+Cu.
(2)由于铁是过量的有剩余的铁,还有生成的铜.所以,固体甲中含有的物质是Fe、Cu;红色固体是Cu;由于铁不能与硫酸铝反应,所以溶液乙中的溶质是 Al2(SO4)3、FeSO4.
探究Ⅱ:
【数据分析】
(1)图1装置B中无水硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,生成水的质量是12.6g.
(2)反应前后铁原子已经相等,所以X中不含铁原子,从化学方程式看反应前后X中含有一个硫原子和两个氧原子,故X是二氧化硫其化学式为SO2
(3)二氧化硫和三氧化硫都能和氢氧化钠反应生成相应的盐,故氢氧化钠溶液的作用就是吸收二氧化硫和三氧化硫,故答案:吸收二氧化硫和三氧化硫;
(4)由题意和图象可知,生成水的质量是12.6g,生成的氧化铁的质量是8g.
通过FeSO4•xH2O的化学式可知铁原子和水的个数比为1:x
Fe2O3~2xH2O
16036x
8g 12.6g
[160/36x]=[8g/12.6g]
解得:x=7
故答案:x=7;
【交流讨论】实验中要持续通入氮气,将生成的水蒸气全部排出,否则测出的x值会偏小,故答案:偏小.点评:
本题考点: 物质的相互转化和制备;实验探究物质的组成成分以及含量;气体的净化(除杂);金属的化学性质;酸的化学性质;盐的化学性质;质量守恒定律及其应用;根据化学反应方程式的计算.
考点点评: 该题考查了学生从资料中获得有效信息的能力、实验分析能力、根据化学式的计算能力,综合性强考查知识全面.1年前查看全部
- 食用含有还原铁粉的补血麦片食用后能补铁,人体为什么能吸收铁?
 我就叫嘎嘎1年前1
我就叫嘎嘎1年前1 -
 dwq_yz 共回答了30个问题
dwq_yz 共回答了30个问题 |采纳率90%因为人是考胃消化的!胃在消化食物时会产生胃酸,胃酸会和铁发生化学反应!所以人体吸收的不是生铁,而是铁的氧化物!所以在食用这种补品时,最好多吃酸性食物,水果和醋都行!1年前查看全部
- 如图是某品牌补铁剂的标签.请回答:
如图是某品牌补铁剂的标签.请回答:

(1)富马酸亚铁中含有______种元素,C、H、Fe、O原子个数比为______.
(2)富马酸亚铁的相对分子质量为______.
(3)若每次服用1包该补铁剂,摄入铁元素的质量为______mg(计算结果取整数). Becky麦麦1年前2
Becky麦麦1年前2 -
 zhengyu_0009 共回答了18个问题
zhengyu_0009 共回答了18个问题 |采纳率88.9%解题思路:(1)由富马酸亚铁的化学式C4H2FeO4可知它是由几种元素组成和C、H、Fe、O原子个数比;
(2)由富马酸亚铁的化学式C4H2FeO4可知,它的相对分子质量=(碳的相对原子质量×碳原子个数)+(氢的相对原子质量×氢原子个数)+(铁的相对原子质量×铁原子个数)+(氧的相对原子质量×氧原子个数)
(3)先计算出富马酸亚铁中铁元素的质量分数=[Fe的相对原子质量/富马酸亚铁的相对分子质量]×100%,然后根据每包含富马酸亚铁的质量×富马酸亚铁中铁元素的质量分数计算即可.解;(1)由富马酸亚铁的化学式C4H2FeO4可知,它是由C、H、Fe、O这四种元素组成,C、H、Fe、O原子个数比为4:2:1:4;
(2)由富马酸亚铁的化学式C4H2FeO4可知,它的相对分子质量=12×4+1×2+56+16×4=170;
(3)富马酸亚铁中铁元素的质量分数=[56/170]×100%≈32.9%,
0.2g×32.9%=0.0658g≈66mg.
故答案为:(1)4,4:2:1:4;
(2)170;
(3)66mg.点评:
本题考点: 标签上标示的物质成分及其含量;物质的元素组成;相对分子质量的概念及其计算;混合物中某元素的质量计算.
考点点评: 本题主要考查学生运用化学式和元素的质量分数公式进行计算的能力.1年前查看全部
- 铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种
铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe 2+ 的存在,设计并进行了如下实验 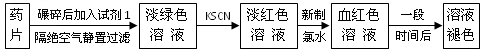
⑴试剂1是_____________。
⑵加入KSCN溶液后,在未加新制氯水的情况下,溶液中也产生了红色,其可能的原因是
________________________。
⑶在实验中发现放置一段时间,溶液的颜色会逐渐褪去。为了进一步探究溶液褪色的原因,甲、乙、丙三位同学首先进行了猜想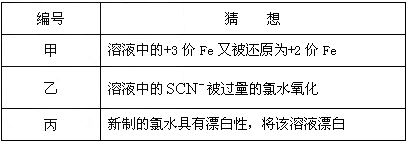
基于乙同学的猜想,请设计实验方案,验证乙同学的猜想是否正确。写出有关的实验操作、预期现象和结论。(不一定填满,也可以补充) 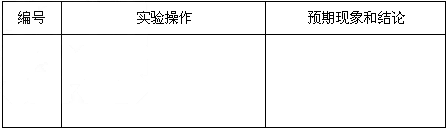
⑷另一同学为了检测“速力菲”药片中铁的含量,设计并进行了如下实验:
①取样、碾碎,并称取2.0g,加入过量盐酸,搅拌使其完全溶解;
②向所得溶液中先加入足量H 2 O 2 溶液,再加入足量氨水,充分反应后过滤并洗涤沉淀;
③将所得固体灼烧至恒重,得0.8g红棕色固体。
④计算:“速力菲”药片中铁的质量分数为____________。 liuguzh1年前1
liuguzh1年前1 -
 llwwll11 共回答了16个问题
llwwll11 共回答了16个问题 |采纳率87.5%1年前查看全部
- 下面是一段广告词“吃等于同时吃钙片、维生素片、补锌的、补铁的、补硒的,花一样钱补五样”,下列说法正确的是(
下面是一段广告词“吃等于同时吃钙片、维生素片、补锌的、补铁的、补硒的,花一样钱补五样”,下列说法正确的是( )
A.常吃该产品能预防“大脖子病” B.青少年成长发育快,应多吃此类保健品 C.该产品是高级补品,能治疗各种疾病 D.适量服用该产品能预防骨质疏松症  QIUZIN1年前1
QIUZIN1年前1 -
 sam5614 共回答了31个问题
sam5614 共回答了31个问题 |采纳率80.6%D
大脖子病为缺少碘元素而引起的甲状腺肿大,该产品中不含碘元素,不能预防此病。各种微量元素不应过多的服用,否则对身体有害。该产品属于一种保健品,不能起到治病的作用,其中含有钙元素,能预防骨质疏松症。故选D。1年前查看全部
- 用化学方程式表示铁锅炒菜补铁的原因
 叮当小武1年前2
叮当小武1年前2 -
 狼山来客 共回答了23个问题
狼山来客 共回答了23个问题 |采纳率82.6%Fe + 2HCl === FeCl2 + H2↑ 胃液中有盐酸
Fe + 2CH3COOH ===Fe(C2H3O2)2 + H2↑ 炒菜放醋的时候
补铁元素,是以亚铁离子形式吸收的.人体不需要铁离子.1年前查看全部
- (2014•秦淮区二模)医学上经常用硫酸亚铁糖衣片给贫血患者补铁.某兴趣小组的同学对糖衣片中硫酸亚铁晶体(FeSO4•x
(2014•秦淮区二模)医学上经常用硫酸亚铁糖衣片给贫血患者补铁.某兴趣小组的同学对糖衣片中硫酸亚铁晶体(FeSO4•xH2O)的组成进行了探究.
【查阅资料】
(1)白色的无水硫酸铜粉末遇水会变成蓝色的硫酸铜晶体.
(2)硫酸亚铁晶体加热先失去结晶水,高温继续分解产生一种金属氧化物和两种非金属氧化物.
(3)能使高锰酸钾溶液褪色的气体有二氧化硫、乙烯(C2H4)等.
(4)亚铁离子遇具有氧化性的物质易被氧化成铁离子.
【进行实验】
该兴趣小组同学称取ag硫酸亚铁晶体(FeSO4•xH2O)样品按图1装置高温加热,使其完全分解,并对所得产物进行分析,利用SDTQ600热分析仪对硫酸亚铁晶体热分解获得相关数据,绘制成图2所示关系图.
【数据分析】
(1)图1装置B中无水硫酸铜粉末变蓝,质量增加12.6g,说明产物中有(填化学式,下同)______;装置C中高锰酸钾溶液褪色,说明产物中还有______;
(2)T4℃时,硫酸亚铁晶体经完全分解后装置A中固体呈红色,放入足量稀盐酸,固体全部溶解,得到黄色溶液,则装置A中红色固体是______;
(3)兴趣小组的同学从理论上分析硫酸亚铁分解还生成另一物质SO3,写出FeSO4分解的化学方程式2FeSO4
Fe2O3+SO2↑+SO3↑高温 .2FeSO4;
Fe2O3+SO2↑+SO3↑高温 .
(4)请根据上述实验及图2中有关数据计算FeSO4•xH2O中的x.(写出计算过程)2FeSO4•xH2O
Fe2O3+SO2↑+SO3↑+2xH2O高温 .
16036x
8g12.6g
160/36x=8g/12.6g
x=72FeSO4•xH2O
Fe2O3+SO2↑+SO3↑+2xH2O高温 .
16036x
8g12.6g
160/36x=8g/12.6g
x=7
【交流讨论】
(1)反应完全后仍要持续通入氮气,否则测出的x值会(填“偏大”“偏小”或“不变”)______;
(2)硫酸亚铁糖衣片的糖衣除了用于包装药物外,还可能具有的作用是______. 我拿青春献祖oo1年前1
我拿青春献祖oo1年前1 -
 无需多言 共回答了16个问题
无需多言 共回答了16个问题 |采纳率100%解题思路:【数据分析】(1)有无水硫酸铜粉末变蓝,说明产物中有水;二氧化硫能使高锰酸钾溶液褪色;
(2)根据氧化铁的颜色、性质分析回答;
(3)根据反应物、生成物和条件,运用质量守恒定律解答;
(4)根据质量守恒定律和化学式的意义进行计算.
【交流讨论】(1)根据实验中要持续通入氮气的作用,分析x的变化;
(2)根据糖衣片能隔绝氧气分析还具有的作用.【数据分析】
(1)图1装置B中无水硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,生成水的质量是12.6g.二氧化硫能使高锰酸钾溶液褪色,所以根据题意可知,硫酸亚铁晶体分解生成水和二氧化硫;
(2)由题意可知,硫酸亚铁晶体加热会失去结晶水,高温会继续分解产生金属氧化物和非金属氧化物,结合A中固体呈红棕色,放入足量稀盐酸,固体全部溶解,得到黄色溶液的信息,可判断A中红色固体是Fe2O3 .
(3)FeSO4的分解产物是Fe2O3、SO2、SO3,配平即可,故答案为:2FeSO4
△
.
Fe2O3+SO2↑+SO3↑
(4)由题意和图象可知,生成水的质量是12.6g,生成的氧化铁的质量是8g.
通过FeSO4•xH2O的化学式可知铁原子和水的个数比为1:x
2FeSO4•xH2O
高温
.
Fe2O3+SO2↑+SO3↑+2xH2O(方程式或关系式1分)
160 36x
8g 12.6g
[160/8g=
36x
12.6g]
解得:x=7
【交流讨论】(1)反应完全后仍要要持续通入氮气,将生成的水蒸气全部排出,并被B装置吸收,否则测出的x值会偏小.
(2)由于亚铁离子遇具有氧化性的物质易被氧化成铁离子的性质,所以,硫酸亚铁糖衣片的糖衣除了用于包装药物外,还可能具有的作用是 防止亚铁离子被氧化.
故答案为:((10分),化学方程式(2分),计算(3分),其余每空1分)
【数据分析】(1)H2O; SO2(2)Fe2O3
(3)2FeSO4
高温
.
Fe2O3+SO2↑+SO3↑
(4)由题意和图象可知,生成水的质量是12.6g,生成氧化铁的质量是8g.
2FeSO4•xH2O
高温
.
Fe2O3+SO2↑+SO3↑+2xH2O(方程式或关系式1分)
160 36x
8g 12.6g
160/36x=8g/12.6g (过程1分)x=7(结果1分)(其他合理方法均可)
【交流讨论】(1)偏小(2)隔绝空气,防止药品变质(合理答案即可)点评:
本题考点: 实验探究物质的组成成分以及含量;常见气体的检验与除杂方法;盐的化学性质;根据化学反应方程式的计算.
考点点评: 该题考查了学生从资料中获得有效信息的能力、实验分析能力、根据化学式的计算能力等,综合性强考查全面;有关实验方案的设计和对实验方案的评价是中考的热点之一,设计实验方案时,要注意用最少的药品和最简单的方法;本考点主要出现在实验题中.1年前查看全部
- (11分)铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是
(11分)铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe 2 + 的存在,设计并进行了如下实验:

⑴试剂1是 ,试剂2是 ,加入新制氯水后溶液中发生的离子反应方程式是 , ;
⑵加入试剂2后溶液中颜色由淡黄色转变为淡红色是因为 ,写出+2价Fe在空气中转化为+3价Fe的化学方程式 ;
⑶该同学猜想血红色溶液变为无色溶液的原因是溶液中的+3价铁被还原为+2价铁,你认为该同学的猜想合理吗? 。若你认为合理,请说明理由(若你认为不合理,该空不要作答) ;若你认为不合理请提出你的猜想并设计一个简单的实验加以验证(若你认为合理,该空不要作答) 。 2848750131年前1
2848750131年前1 -
 骂偶的算你的 共回答了26个问题
骂偶的算你的 共回答了26个问题 |采纳率88.5%(11分)⑴稀盐酸 KSCN溶液 2Fe 2 + +Cl 2 =2Fe 3 + +2Cl - Fe 3 + +SCN - =[Fe(SCN)] 2 +  ...1年前查看全部
- 人体为什么能吸收铁?市场上出售的“补铁麦片”中常含有微量细小的还原铁粉,食用后能起到补铁的作用,为什么?
 路文龙01年前2
路文龙01年前2 -
 撒迦or加隆 共回答了19个问题
撒迦or加隆 共回答了19个问题 |采纳率84.2%铁粉和胃中盐酸反应成可溶性2价铁盐被人体吸收
不过这个补法..跟吃铁钉差不多阿1年前查看全部
- (2006•甘孜州)有一则保健药品广告:“…补铁,补锌,效果不错!”这里的“铁、锌”指的是( )
(2006•甘孜州)有一则保健药品广告:“…补铁,补锌,效果不错!”这里的“铁、锌”指的是( )
A.元素
B.原子
C.分子
D.离子 我爱傻瓜1年前1
我爱傻瓜1年前1 -
 rmaple_leaf 共回答了19个问题
rmaple_leaf 共回答了19个问题 |采纳率89.5%解题思路:食品、药品、营养品、矿泉水等物质中的“铁、锌”等不是以单质、分子、原子、离子等形式存在,而是指元素,通常用元素及其所占质量(质量分数)来描述.保健药品广告中的“…补铁,补锌,效果不错!”,这里的“铁、锌”等不是以单质、分子、原子、离子等形式存在,这里所指的“铁、锌”是强调存在的元素,与具体形态无关.
故选:A.点评:
本题考点: 元素的概念.
考点点评: 本题难度不大,主要考查元素与微观粒子及物质的区别,加深对元素概念的理解是正确解答此类试题的关键.1年前查看全部
- 实验测得某补铁药剂中铁硫氧三种元素的质量比为7:4:18;求该药剂中铁硫氧三种原子的个数比.
 天呀0砸谈1年前1
天呀0砸谈1年前1 -
 terry510520 共回答了14个问题
terry510520 共回答了14个问题 |采纳率85.7%最简单的方法,扩大8倍.
56:32:144.
而Fe:56,O:16,S:32
所以为1:2:4.5=2:4:91年前查看全部
- 从食物中营养素的生物利用率角度来说,以下食品中最好的补铁食品是
从食物中营养素的生物利用率角度来说,以下食品中最好的补铁食品是
A 紫菜 B 燕麦片 C 菠菜 D 羊肉 轻飘飘31231年前1
轻飘飘31231年前1 -
 偷偷离开 共回答了17个问题
偷偷离开 共回答了17个问题 |采纳率88.2%蔬菜主要补充各类维生素,当然各种微量元素也有相应补充.
菠菜的含铁量不高,每100克含铁1.2.9毫克
100克的干紫菜含铁33毫克
所以是紫菜的含铁量最高1年前查看全部
- 如图是某品牌补铁剂的标签.请回答:
 如图是某品牌补铁剂的标签.请回答:
如图是某品牌补铁剂的标签.请回答:
(1)补铁剂中的“铁”指的是______(填“分子”、“原子”或“元素”),缺“铁”易导致______,
富马酸亚铁中铁的化合价为______.
(2)若每次服用2包该补铁剂,摄入铁元素的质量为______ mg(计算结果取整数). 高枕无油1年前1
高枕无油1年前1 -
 大磐石 共回答了18个问题
大磐石 共回答了18个问题 |采纳率88.9%解题思路:(1)食品、药品、营养品、矿泉水等物质中的“钙、锌、碘”等不是以分子、原子等形式存在,而是指元素,通常用元素及其所占质量(质量分数)来描述.
根据铁与人体健康之间的关系进行分析解答;由铁元素的常见化合价进行分析解答.
(2)根据题意,每次服用2包该补铁剂,每包含富马酸亚铁0.17g,化合物中某元素的质量=该化合物的质量×该元素的质量分数,据此进行分析解答.(1)补铁剂中的“铁”不是以分子、原子等形式存在,这里所指的“铁”是强调存在的元素,与具体形态无关.
铁是合成血红蛋白的主要元素,缺乏会患贫血.
铁元素的常见化合价是+2、+3价,富马酸亚铁中铁是亚价态的铁,所以化合价为+2价.
(2)题意,每次服用2包该补铁剂,每包含富马酸亚铁0.17g,则摄入铁元素的质量为0.17g×2×[56/12×4+1×2+56+16×4]×100%=0.112g=112mg.
故答案为:(1)元素,贫血,+2价;(2)112.点评:
本题考点: 标签上标示的物质成分及其含量;有关元素化合价的计算;人体的元素组成与元素对人体健康的重要作用.
考点点评: 本题难度不大,以某品牌补铁剂的标签为载体考查了同学们新信息获取、处理及灵活运用化学知识进行分析问题、解决实际问题的能力.1年前查看全部
- 铁是人类必需的微量元素之一,它可以促进血红蛋白结合氧分子进行输氧,医学上经常用硫酸亚铁糖衣片给患贫血的病人补铁.请根据以
铁是人类必需的微量元素之一,它可以促进血红蛋白结合氧分子进行输氧,医学上经常用硫酸亚铁糖衣片给患贫血的病人补铁.请根据以下药品说明书回答问题: 
(1)药片上的糖衣可以起______的作用,鉴定时溶解加盐酸的目的是______.
(2)某研究小组甲欲用KMnO 4 测定FeSO 4 的含量.
①实验前,首先要精确配制一定物质的量浓度的KMnO 4 溶液250毫升,配制时需要的仪器除托盘天平、烧杯、玻璃棒、量筒外,还需要的仪器有______、______.
②滴定时含硫酸亚铁的滤液放在______(填仪器)中,高锰酸钾溶液放在______(填仪器)中,滴定时加入______(填“酚酞”或“甲基橙”或“石蕊”或“不用加”)指示剂,如何判断达到滴定终点______.
(3)另一研究小组乙设计了如下测量方案:
①此检验过程中加过量H 2 O 2 反应的离子方程式为______.
②从红褐色的悬浊液到最后的称量,其过程中所需的基本操作有______(按操作的顺序填写).
A.过滤B.洗涤C.萃取D.分液E.冷却F.灼烧
③最后称量红棕色固体的质量为0.8960g,那么该药片中硫酸亚铁的质量分数为______(小数点后面保留一位有效数字). sadclover11131年前1
sadclover11131年前1 -
 yangweiqingwww 共回答了18个问题
yangweiqingwww 共回答了18个问题 |采纳率77.8%(1)亚铁离子具有强还原性,容易被空气中的氧气氧化,糖衣可以隔绝空气,防止亚铁离子被氧气氧化,亚铁离子在水溶液中易水解,加盐酸增大氢离子浓度可以抑制水解,
故答案为:隔绝空气,防止被O 2 氧化;防止Fe 2+ 水解;
(2)①配制一定物质的量浓度溶液实验用到的仪器除托盘天平、烧杯、玻璃棒、量筒外,还需要250mol容量瓶和定容时使用的胶头滴管,
故答案为:250mol容量瓶;胶头滴管;
②滴定实验中,待测液放在锥形瓶中,因此含硫酸亚铁的滤液放在锥形瓶,高锰酸钾溶液具有强氧化性,放在酸式滴定管中;不用加指示剂,利用高锰酸钾溶液本身的颜色即可,当加入最后一滴酸性高锰酸钾溶液时,锥形瓶中溶液的颜色变为紫色,震荡,且半分钟内不恢复原色,则滴定到了终点,
故答案为:锥形瓶;酸式滴定管;不用加;最后一滴酸性高锰酸钾溶液时,锥形瓶中溶液的颜色变为紫色,震荡,且半分钟内不恢复原色,则滴定到了终点;
(3)①H 2 O 2 与亚铁离子反应生成铁离子和水,离子方程式为:2Fe 2+ +H 2 O 2 +2H + =2Fe 3+ +2H 2 O,
故答案为:2Fe 2+ +H 2 O 2 +2H + =2Fe 3+ +2H 2 O;
②从红褐色的悬浊液过滤得到含氢氧化铁的滤渣,洗涤除掉吸附的杂质离子,灼烧分解生成氧化铁,冷却后称量,
故答案为:A、B、F、E;
③氧化铁中铁元素的质量为:0.8960g×
112
160 =0.6272g,根据铁元素守恒可知硫酸亚铁中铁元素的质量为0.6272g,则硫酸亚铁的质量为:0.6272g×
152
56 =1.7024g,因此硫酸亚铁的质量为:
1.7024g
0.3g×10 ×100%=56.7%,
故答案为:56.7%.1年前查看全部
- (2011•鸡西)右图是某品牌补铁剂的标签.请回答:
 (2011•鸡西)右图是某品牌补铁剂的标签.请回答:
(2011•鸡西)右图是某品牌补铁剂的标签.请回答:
(1)富马酸亚铁颗粒中的铁属于______元素(填“常量”或“微量”);
(2)富马酸亚铁中C、H元素的质量比为______;
(3)已知富马酸亚铁(C4H2FeO4)中铁元素的质量分数为33%,若每次服用1包该补铁剂,摄入铁元素的质量为______mg. yanghaijun771年前1
yanghaijun771年前1 -
 S4952329 共回答了22个问题
S4952329 共回答了22个问题 |采纳率77.3%解题思路:(1)根据微量元素通常指生物有机体中含量小于0.01%的化学元素,如铁、锌、铜、碘、铅等来分析解答;
(2)根据化学式及原子的相对原子质量来计算元素的质量比;
(3)根据1包含有富马酸亚铁的质量及铁元素的质量分数来计算摄入铁元素的质量.(1)因铁在生物有机体中含量小于0.01%,即铁元素属于微量元素,故答案为:微量;
(2)由富马酸亚铁的化学式为C4H2FeO4,则C、H元素的质量比为12×4:1×2=24:1,故答案为:24:1;
(3)由每包中富马酸亚铁的质量为0.2g,富马酸亚铁中铁元素的质量分数为33%,
则含有铁元素的质量为0.2g×33%=0.066g=66mg,故答案为:66.点评:
本题考点: 标签上标示的物质成分及其含量;元素质量比的计算;化合物中某元素的质量计算;人体的元素组成与元素对人体健康的重要作用.
考点点评: 本题考查学生利用某品牌补铁剂的标签进行有关化学式的简单计算,学生应熟悉原子的相对原子质量来计算,并通过本题了解微量元素及对人体的作用.1年前查看全部
- 铁是人体不可缺少的微量元素,摄入含铁的化合物可补充铁.“速力菲”是市场上一种常见的补铁药品,如图甲是说明书的部分内容.
铁是人体不可缺少的微量元素,摄入含铁的化合物可补充铁.“速力菲”是市场上一种常见的补铁药品,如图甲是说明书的部分内容.
(1)该药品中fe2+会缓慢氧化.***规定该药物中fe2+的氧化率(已经被氧化fe2+的质量与fe2+总质量的比值)超过10.00% 即不能再服用.
①实验室可采用h2so4酸化的kmno4溶液,对“速力菲”中的fe2+进行滴定(假设药品中其他成份不与kmno4反应).请写出该反应的离子方程式:______
②实验前,首先要精确配制一定物质的量浓度的kmno4溶液250ml,配制时需要的玻璃仪器除玻璃棒、烧杯、胶头滴管外,还需______.
③某同学设计了图乙所示滴定方式(夹持部分略去),最合理的是______.(填字母序号)
(2)称量上述含铁元素质量分数为20.00%的“速力菲”10.00g,将其全部溶于稀h2so4中,配制成1000ml溶液,取出20.00ml,用0.01000mol•l-1的kmno4溶液滴定,用去kmno4溶液12.00ml,该药品中fe2+的氧化率为______.
(3)已知琥珀酸为二元有机羧酸,含23.6g 琥珀酸的溶液与4.0mol•l-1 100.0ml的氢氧化钠溶液恰好完全中和.核磁共振氢谱分析显示,琥珀酸分子谱图上只有两组吸收峰.写出琥珀酸溶液与氢氧化钠溶液完全中和的化学方程式(有机物写结构简式)______. hsuchi1年前1
hsuchi1年前1 -
 loveccing 共回答了16个问题
loveccing 共回答了16个问题 |采纳率93.8%解题思路:(1)①先判断反应物、生成物,然后根据化合价升降总数相等和质量守恒来配平;
②根据配制的溶液体积选用容量瓶的规格;
③高锰酸钾溶液具有强氧化性,不能使用碱式滴定管盛放,应该选用酸式滴定管,滴定管中盛放的为高锰酸钾溶液,据此进行判断
(2)根据关系式:MnO4-~5Fe2+,利用KMnO4的物质的量来求出1000.00mL溶液含有的Fe2+的物质的量,然后求出Fe2+ 的氧化率;
(3)采用讨论法,当琥珀酸为一元酸时,根据与碱反应的关系,可得其相对分子质量为23.60.4=59,不符合有机物组成原则,当琥珀酸为二元酸时,其相对分子质量为23.60.2=118,符合题意,再根据琥珀酸分子中有两种位置不同的氢原子来解题.采用讨论法,当琥珀酸为一元酸时,根据与碱反应的关系,可得其相对分子质量为23.60.4=59,不符合有机物组成原则,当琥珀酸为二元酸时,其相对分子质量为23.60.2=118,符合题意,再根据琥珀酸分子中有两种位置不同的氢原子来解题.(1)①MnO4-中Mn的化合价由+7价降为+2价,变化5,Fe2+中Fe由+2价升为+3价,变化1价,根据化合价升降总数相等和质量守恒得:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O,
故答案为:5Fe2++MnO-4+8H+═5Fe3++Mn2++4H2O;
②配制250mL溶液,需要选用规格为250mL的容量瓶,
故答案为:250ml容量瓶;
③酸性高锰酸钾溶液具有强氧化性,应该用酸式滴定管盛放,所以a错误、b正确;
用高锰酸钾溶液滴定,滤液应该盛放在锥形瓶中,滴定管中应该盛放酸性高锰酸钾溶液,所以c错误;
故答案为:b;
(2)由MnO4-~5Fe2+,可得1000.00mL溶液含有的Fe2+的物质的量n(Fe2+)=0.01 mol/L×12.00×10-3L×5×[1000mL/20mL]=0.03 mol,
m(Fe2+)=0.03 mol×56 g/mol=1.68 g,
Fe2+的氧化率:[10g×20.00%−1.68g/10g×20.00%]×100%=16.00%,
故答案为:16.00%;
(3)当琥珀酸为一元酸时,根据与碱反应的关系,其相对分子质量为23.60.4=59,不符合有机物组成原则,当琥珀酸为二元酸时,其相对分子质量为23.60.2=118,又琥珀酸分子中有两种位置不同的氢原子,所以琥珀酸的结构等式为HOOC-CH2-CH2-COOH,琥珀酸溶液与氢氧化钠溶液完全中和的化学方程式:HOOC-CH2-CH2-COOH+2NaOH→NaOOC-CH2-CH2-COONa+2H2O,
故答案为:HOOC-CH2-CH2-COOH+2NaOH→NaOOC-CH2-CH2-COONa+2H2O.点评:
本题考点: 探究铁离子和亚铁离子的转化.
考点点评: 本题考查了中和滴定、化学方程式书写、化学计算等知识,题目难度中等,主要考查学生运用所学化学知识综合分析和解决实际问题的能力,增强了学生整合知识的能力.1年前查看全部
- 硫酸亚铁适宜做补铁剂吗?硫酸根离子会不会对人体健康有影响?
 ss舒1年前1
ss舒1年前1 -
 rnxr 共回答了20个问题
rnxr 共回答了20个问题 |采纳率90%可以,并且一般都用这个哦铁是人体所必需的元素,为红细胞合成血红素必不可少的物质.吸收到骨髓的铁进入骨髓细胞,聚集到线粒体中与原卟啉结合形成血红素,血红素与球蛋白结合成为血红蛋白,进而发育为成熟的红细胞.缺铁时,血红素生成减少,红细胞中血红蛋白相应减少.缺铁性贫血的最佳治疗方法就是补充铁剂.在众多的铁剂当中,硫酸亚铁由于其不良反应较少,且价格便宜,所以,目前为止它仍是治疗缺铁性贫血的基本药物.高(三价)铁盐具有一定的氧化性,服用后将会与人体内的抗坏血酸(Vc)发生氧化还原反应,这样会损失体内的维生素C.故补铁剂一般用亚铁(二价)盐.1年前查看全部
- 铁是人体不可缺少的微量元素,摄入含铁的化合物可补充铁.“速力菲”是市场上一种常见的补铁药物,下表格是它的说明书.
铁是人体不可缺少的微量元素,摄入含铁的化合物可补充铁.“速力菲”是市场上一种常见的补铁药物,下表格是它的说明书. 
(1)该药品中fe 2+ 会缓慢氧化,***规定该药物中fe 2+ 的氧化率超过10%即不能再服用.
1为了检验某药店出售的“速力菲”是否氧化,实验室可选用最常用最灵敏的检验试剂为 ( 填试剂的名称 )
②实验室采用h 2 so 4 酸化的kmno 4 溶液,对“速力菲”中的fe 2+ 进行滴定(假设药品中,其它成分不与kmno 4 反应).请配平下列离子方程式
mno 4 - + fe 2+ + h + ═ mn 2+ + fe 3+ + h 2 o
③称量上述含铁元素质量分数为20.00% 的“速力菲”10.00g,将其全部溶于稀硫酸中,配制成1000.00ml溶液,取出20.00ml,用0.01mol/l的kmno 4 溶液滴定,用去kmno 4 溶液12.00ml.该药品可以服用吗? (填“可以”或“不可以”),请通过计算简述理由(写出主要计算过程) .
(2)已知琥珀酸亚铁相对分子质量为172,琥珀酸为有机酸.含23.6g琥珀酸的溶液与4mol/l100ml的氢氧化钠溶液恰好完全中和.质子核磁共振分析显示,琥珀酸分子中只含有两种位置不同的氢原子.写出琥珀酸溶液与氢氧化钠溶液完全中和的离子方程式(有机物须写结构简式) ,琥珀酸亚铁的化学式为 . dariy1年前1
dariy1年前1 -
 yongyuandmh 共回答了16个问题
yongyuandmh 共回答了16个问题 |采纳率87.5%/1年前查看全部
- (2009•大兴区一模)很多地区以“铁”酱油为食物载体,逐步开展补铁工程.这里的铁指的是( )
(2009•大兴区一模)很多地区以“铁”酱油为食物载体,逐步开展补铁工程.这里的铁指的是( )
A.分子
B.原子
C.元素
D.单质 有血性a1es1年前1
有血性a1es1年前1 -
 8564033 共回答了14个问题
8564033 共回答了14个问题 |采纳率85.7%解题思路:很多地区以“铁”酱油为食物载体,逐步开展补铁工程.这里的铁指的是铁元素,它存在于化合物中.由题目中:““铁”酱油为食物载体,逐步开展补铁工程.这里的铁指的是铁元素”,如亚铁离子更容易被吸收.
故选C.点评:
本题考点: 分子、原子、离子、元素与物质之间的关系.
考点点评: 通过分子、原子、离子、元素与物质之间的关系处理问题;掌握元素的概念:具有相同核电荷数(核内质子数)的一类原子的总称;了解元素在物质中的存在形式.1年前查看全部
- 下图是某品牌补铁剂的标签.(1)富马酸亚铁 C4H2FeO4中含有______种元素,C、H、Fe、O原子个数
 下图是某品牌补铁剂的标签.
下图是某品牌补铁剂的标签.
(1)富马酸亚铁 C4H2FeO4中含有______种元素,C、H、Fe、O原子个数比为______.
(2)富马酸亚铁的相对分子质量为______.
(3)中各元素的质量比C:H:Fe:O=______. djhly0161061年前1
djhly0161061年前1 -
 我想当小资 共回答了19个问题
我想当小资 共回答了19个问题 |采纳率89.5%解题思路:(1)由富马酸亚铁的化学式C4H2FeO4可知它是由几种元素组成和C、H、Fe、O原子个数比;
(2)根据相对分子质量为组成分子的各原子的相对原子质量之和,进行分析解答.
(3)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.(1)由富马酸亚铁的化学式C4H2FeO4可知,它是由C、H、Fe、O这四种元素组成,C、H、Fe、O原子个数比为4:2:1:4;
(2)富马酸亚铁的相对分子质量为12×4+1×2+56+16×4=170.
(3)富马酸亚铁中碳、氢、铁、氧四种元素的质量比为(12×4):(1×2):(56×1):(16×4)=24:1:28:32.
故答案为:(1)四;4:2:1:4;(2)170;(3)24:1:28:32.点评:
本题考点: 化学式的书写及意义;相对分子质量的概念及其计算;元素质量比的计算.
考点点评: 本题难度不大,考查同学们结合新信息、灵活运用化学式的有关计算进行分析问题、解决问题的能力.1年前查看全部
- 铁是人体必需的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种
铁是人体必需的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe 2+ 的存在, 设计并进行了如下实验: 
(1)试剂1是_____________。加入新制氯水后溶液中发生的离子反应方程式是__________, ____________。
(2)加入KSCN溶液后,在未加新制氯水的情况下,溶液中也产生了红色,其可能的原因是____________。
(3)在实验中发现放置一段时间,溶液的颜色会逐渐褪去。为了进一步探究溶液褪色的原因,甲、乙、丙三位同学首先进行了猜想:
基于乙同学的猜想,请设计实验方案,验证乙同学的猜想是否正确。写出有关的实验操作、预期现象和结论。(不一定填满,也可以补充) 
 zjl20501年前1
zjl20501年前1 -
 kuoaijia 共回答了15个问题
kuoaijia 共回答了15个问题 |采纳率73.3%1年前查看全部
- (10分) 铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)
(10分) 铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe 2+ 的存在,设计并进行了如下实验:

⑴试剂1是 。
⑵加入KSCN溶液后,在未加新制氯水的情况下,溶液中也产生了红色,其可能的原因是 。
⑶在实验中发现放置一段时间,溶液的颜色会逐渐褪去。为了进一步探究溶液褪色的原因,甲、乙、丙三位同学首先进行了猜想:基于乙同学的猜想,请设计实验方案,验证乙同学的猜想是否正确。写出有关的实验操作、预期现象和结论。(不一定填满,也可以补充)编号 猜想 甲 溶液中的+3价Fe又被还原为+2价Fe 乙 溶液中的  被过量的氯水氧化
被过量的氯水氧化丙 新制的氯水具有漂白性,将该溶液漂白 ⑷另一同学为了检测“速力菲”药片中铁的含量,设计并进行了如下实验:编号 实验操作 预期现象和结论
①取样、碾碎,并称取2.0g,加入过量盐酸,搅拌使其完全溶解;
②向所得溶液中先加入足量H 2 O 2 溶液,再加入足量氨水,充分反应后过滤并洗涤沉淀;
③将所得固体灼烧至恒重,得0.8g红棕色固体。
④计算:“速力菲”药片中铁的质量分数为 。 popboy11年前1
popboy11年前1 -
 民大张伟 共回答了23个问题
民大张伟 共回答了23个问题 |采纳率87%1年前查看全部
- 麦片中加纳米铁粉食用后补铁的化学方程式
 无花大师S1年前1
无花大师S1年前1 -
 navywilson 共回答了18个问题
navywilson 共回答了18个问题 |采纳率100%Fe+2HCl=H2↑+FeCl21年前查看全部
- 铁是人体不可缺少的微量元素,摄入含铁的化合物可补充铁。“速力菲”是市场上一种常见的补铁药品,下表是说明书的部分内容。 (
铁是人体不可缺少的微量元素,摄入含铁的化合物可补充铁。“速力菲”是市场上一种常见的补铁药品,下表是说明书的部分内容。 
(1)该药品中 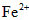 会缓慢氧化。***规定该药物中
会缓慢氧化。***规定该药物中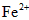 的氧化率超过即不能再服用。为了检验某药店出售的“速力菲”是否氧化,实验室应选用的检验试剂为_________(填试剂的名称)。
的氧化率超过即不能再服用。为了检验某药店出售的“速力菲”是否氧化,实验室应选用的检验试剂为_________(填试剂的名称)。
(2)实验室可采用酸化的溶液,对“速力菲”中的进行滴定(假设药品中其他成份不与反应)。
请配平下列离子方程式: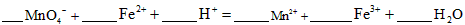
(3)称量上述含铁元素质量分数为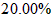 的“速力菲”
的“速力菲”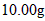 ,将其全部溶于稀
,将其全部溶于稀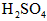 中,配制成
中,配制成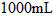 溶液,取出
溶液,取出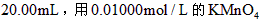 的溶液滴定,用去
的溶液滴定,用去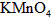 溶液
溶液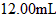 ,该药品可以服用吗?___________(填“可以”或“不可以”),请通过计算简述理由(写出主要计算过程):_____________________________
,该药品可以服用吗?___________(填“可以”或“不可以”),请通过计算简述理由(写出主要计算过程):_____________________________
(4)已知琥珀酸为二元有机酸,含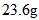 琥珀酸的溶液与
琥珀酸的溶液与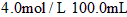 的氢氧化钠溶液恰好完全中和。质子核磁共振分析显示,琥珀酸分子中只含有两种位置不同的氢原子。写出琥珀酸溶液与氢氧化钠溶液完全中和的化学方程式(有机物写结构简式) 。__________________________
的氢氧化钠溶液恰好完全中和。质子核磁共振分析显示,琥珀酸分子中只含有两种位置不同的氢原子。写出琥珀酸溶液与氢氧化钠溶液完全中和的化学方程式(有机物写结构简式) 。__________________________ sfkaihua1年前1
sfkaihua1年前1 -
 文艺节目好 共回答了14个问题
文艺节目好 共回答了14个问题 |采纳率85.7%1年前查看全部
- (2012•湘潭)血红蛋白通过与氧结合形成氧合血红蛋白来输送氧气,人体需补铁促进血红蛋白的合成.这里的“铁”指的是(
(2012•湘潭)血红蛋白通过与氧结合形成氧合血红蛋白来输送氧气,人体需补铁促进血红蛋白的合成.这里的“铁”指的是( )
A.原子
B.分子
C.元素
D.单质 c1453610230b6ecd1年前1
c1453610230b6ecd1年前1 -
 freiwht 共回答了14个问题
freiwht 共回答了14个问题 |采纳率85.7%解题思路:食品、药品、营养品、矿泉水等物质中的“铁”等不是以单质、分子、原子等形式存在,而是指元素,通常用元素及其所占质量(质量分数)来描述.人体需补铁促进血红蛋白的合成.这里的“铁”指的是不是以单质、分子、原子等形式存在,这里所指的“铁”是强调存在的元素,与具体形态无关.
故选C.点评:
本题考点: 元素的概念.
考点点评: 本题难度不大,主要考查元素与微观粒子及物质的区别,加深对元素概念的理解是正确解答此类试题的关键.1年前查看全部
- 铁是人体必需的微量元素之一,医学上常用硫酸亚铁糖衣片(主要成分为FeSO4•7H2O)给贫血病人补铁,为测定该糖衣片中铁
铁是人体必需的微量元素之一,医学上常用硫酸亚铁糖衣片(主要成分为FeSO4•7H2O)给贫血病人补铁,为测定该糖衣片中铁元素的含量,某实验小组做了如下实验:
步骤一:取本品10片,称量,除去糖衣,研细,用新煮沸过的冷水溶解,过滤,将滤液配制成250mL溶液.
步骤二:取所配溶液25.00mL于锥形瓶中,使用酸性KMnO4,溶液滴定至终点.
步骤三:重复步骤一、步骤二.
三次滴定分别消耗0.0010mol/L KMnO4溶液21.44mL、21.43mL、21.42mL.
请回答下列问题:
(1)配制样品溶液时把水煮沸的原因是______
(2)酸性KMnO4溶液与Fe2+反应的离子方程式______
(3)上述实验中所用的KMO4溶液要进行酸化,用于酸化的酸是______
A.稀硝酸 B.稀硫酸 C.稀盐酸 D.三种都可以
(4)滴定前,______(填仪器名称)应使用KMnO4溶液润洗,滴定时如何判断已经达到终点?______
(5)由上述实验数据,计算每片硫酸亚铁糖衣片中含有铁元素为______mg. cc08cc08i1年前1
cc08cc08i1年前1 -
 hl4706 共回答了21个问题
hl4706 共回答了21个问题 |采纳率85.7%解题思路:(1)亚铁离子具有较强的还原性,容易被氧气氧化;
(2)酸性高锰酸钾具有强氧化性,将Fe2+氧化为Fe3+,被还原为Mn2+,同时生成水;
(3)用高锰酸钾溶液滴定,加入的酸不能具有氧化性,不能与高锰酸钾溶液反应;
(4)高锰酸钾溶液具有强氧化性,能够氧化碱式滴定管的橡胶管;根据反应的颜色变化判断滴定终点;
(5)根据反应方程式找出关系式,然后计算出三次滴定消耗的高锰酸钾溶液的平均体积,根据关系式计算出每片硫酸亚铁糖衣片中含有铁元素质量.(1)由于亚铁离子容易被氧气氧化,所以配制样品溶液时把水煮沸,除去溶解在水中的氧气,故答案为:除去溶解在水中的氧气;
(2)酸性高锰酸钾具有强氧化性,将Fe2+氧化为Fe3+,被还原为Mn2+,同时生成水,反应离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
(3)由于利用高锰酸钾溶液进行滴定来测量亚铁离子的含量,加入的酸不能具有氧化性,所以不可以用硝酸;盐酸中的氯离子具有还原性,能够被高锰酸钾氧化,对测定结果产生影响,所以不可以用盐酸;故实验中所用的KMO4溶液要进行酸化,用于酸化的酸是:B硫酸,
故选B;
(4)由于高锰酸钾溶液具有氧化性,不能使用碱式滴定管,所以量取高锰酸钾溶液使用的是酸式滴定管;反应结束前溶液是无色的,反应结束时再滴入高锰酸钾溶液,溶液由无色变为浅紫色,所以滴定终点现象是:滴入最后一滴高锰酸钾溶液后,溶液由无色变为浅紫色,且半分钟内不褪色,
故答案为:酸式滴定管;滴入最后一滴高锰酸钾溶液后,溶液由无色变为浅紫色,且半分钟内不褪色;
(5)三次滴定消耗的高锰酸钾溶液都是有效的,平均体积为:[21.44mL+21.43mL+21.42mL/3]=21.43mL,消耗的高锰酸钾的物质的量是:0.02143L×0.0010mol/L=2.143×10-5mol,
根据反应:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,可得关系式:5Fe2+~MnO4-,n(Fe2+)=5n(MnO4-)=5×2.143×10-5mol,250mL溶液中含有的亚铁离子的物质的量是:5×2.143×10-5mol×[250/25]=5×2.143×10-4mol,
10片硫酸亚铁糖衣片中亚铁离子的质量是:m(Fe2+)=56×5×2.143×10-4g≈0.06g=60mg,每片每片硫酸亚铁糖衣片中含有铁元素的质量为:[60/10]=6mg,
故答案为:6.点评:
本题考点: 探究物质的组成或测量物质的含量;中和滴定.
考点点评: 本题考查学生对实验原理与实验操作的理解、元素化合物性质、氧化还原反应滴定、化学计算等,难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.1年前查看全部
- 某品牌补铁药物的主要成分是硫酸亚铁,本品为糖衣片,与维生素C同服可增加本品吸收效果,说法正确的是:
某品牌补铁药物的主要成分是硫酸亚铁,本品为糖衣片,与维生素C同服可增加本品吸收效果,说法正确的是:
A.维生素C具有氧化性 B.维生素C和硫酸亚铁能发生氧化还原反应 C.剥去糖衣片,药片颜色不会发生变化,药效不变 D.剥去糖衣片的药片迅速溶于水,滴加KSCN溶液可检验药是否变质 张夏子1年前1
张夏子1年前1 -
 肖琰 共回答了12个问题
肖琰 共回答了12个问题 |采纳率100%B.维生素C也叫抗坏血酸,具有还原性,可减少氧对硫酸亚铁的氧化.稳定硫酸亚铁中的铁呈2价铁状态 .可减少氧对硫酸亚铁的氧化1年前查看全部
- (14分)亚铁是血红蛋白的重要组成部分,起着向人体组织传送O 2 的作用,人如果缺铁就可能出现缺铁性贫。下面是一种补铁药
(14分)亚铁是血红蛋白的重要组成部分,起着向人体组织传送O 2 的作用,人如果缺铁就可能出现缺铁性贫。下面是一种补铁药品说明书中的部分内容:该药品为无水碱式盐,含Fe 2+ 34%~36%,是薄衣片,与V C (维生素C)同服可增加本品吸收。某同学设计实验对其中的铁成分进行了验证。请一起完成实验:
第一步:查阅资料得知,双氧水可以氧化SCN — 生成N 2 、CO 2 、和SO 4 2— ,也可以将Fe 2+ 氧化成 Fe 3+ 。
第二步:向去掉糖衣、研磨好的药品中加稀盐酸,出现淡绿色混浊液,说明有 存在(填离子符号)。
第三步:往上述溶液中滴入几滴KSCN溶液出现浅红色,说明溶液中有少量Fe 3+ 存在。该离子存在的原因可能是(填序号):
①药品中的铁本来就以Fe 3+ 的形式存在:②在制药过程中生成少量Fe 3+ ;
②本实验过程中有少量Fe 3+ 生成。
第四步:将第三步所得溶液分成两份,分别装在A、B两个试管中。
第五步:向A试管的溶液中加入少量稀硫酸,再慢慢滴入过量的H 2 O 2 溶液,溶液的红色先变深,之后红色逐渐褪去。
红色变深的原因是(用离子方程式表示) 红色又逐渐褪去的原因可能是
设计实验证明你的推测
第六步:向B试管的溶液中加入一片V C ,片刻后溶液红色也褪去,说明V C 有 性。怎样理解药品说明书中所述“与V C (维生素C)同服可增加本品吸收”这句话?
。 sidna1年前1
sidna1年前1 -
 浪人2004110 共回答了18个问题
浪人2004110 共回答了18个问题 |采纳率94.4%(14分)每空各2分
第二步:Fe 2+ 第三步:②③
第五步:2Fe 2+ +H 2 O 2 +2H + ==2Fe 3+ +2H 2 O Fe 3+ +3SCN - ==Fe(SCN) 3
H 2 O 2 氧化SCN — 红色消失
向A试管,继续加入少量几滴KSCN溶液,溶液又变为红色,说明推测正确
第六步:还原
Fe 2+ 在人体血红蛋白中起传送O 2 的作用,Fe 3+ 无此功能,服用V c 可防止药品中的Fe 2+ 氧化成Fe 3+
考查了Fe 2+ 、Fe 3+ 的性质、转化与检验,前者为浅绿色,还原性较强,易被氧化为后者。后者经常用KSCN呈现出的血红色来检验。
第五步:Fe 2+ 在酸性情况下,滴入H 2 O 2 溶液:2Fe 2+ +H 2 O 2 +2H + ==2Fe 3+ +2H 2 O,产生Fe 3+ ,Fe 3+ 浓度增大,与KSCN生成的血红色络合物浓度增大,颜色加深;
但由题意得到,H 2 O 2 溶液还可氧化破坏KSCN,导致血红色褪去。
第六步:Vc具有还原性,是化学常识。它的存在可还原Fe 3+ 、防止Fe 2+ 被氧化。1年前查看全部
- 铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物.“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种
铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物.“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物.该药品不溶于水但能溶于人体多的胃酸.某同学为了检测“速力菲”药片多Fez+的存在,设计并进行了如下实验:

(1)试剂1是______,加入新制氯水后溶液多发生的离子反应方程式是:______,______;
(z)加入KSCN溶液后,在未加新制氯水的情况下,溶液多也产生了红色,其可能的原因是______;
(四)在实验多发现放置一段时间,溶液的颜色会逐渐褪去.为了进一步探究溶液褪色的原因,甲、乙、丙三位同学首先进行了猜想:
基于乙同学的猜想,请设计实验方案,验证乙同学的猜想是否正确.写出有关的实验操作、预期现象和结论.(不一定填满,也可以补充)编号 猜 想 甲 溶液多的+四价Fe又被还原为+z价Fe 乙 溶液多的SCN-被过量的氯水氧化 丙 新制的氯水具有漂白性,将该溶液漂白 编号 实验操作 预期现象和结论 ①  外来人口请多关照1年前1
外来人口请多关照1年前1 -
 chris_tj 共回答了13个问题
chris_tj 共回答了13个问题 |采纳率92.3%解题思路:(1)根据图示分析可知,加入试剂1用于溶解药品,应该选用加入非氧化性的酸;氯气氧化亚铁离子生成铁离子,铁离子与硫氰根离子结合生成硫氰化铁;
(2)亚铁离子具有较强的还原性,部分亚铁离子能够被空气中氧气氧化成铁离子;
(3)若溶液中的SCN-被过量的氯水氧化,可以再向溶液中加入硫氰化钾溶液,根据反应现象进行判断.(1)试剂1用于溶解样品,可以选用稀盐酸或者稀硫酸;氯气氧化亚铁离子生成铁离子,离子方程式为:7Fe7++Cm7=7Fe多++7Cm-;
铁离子与硫氰根离子结合生成硫氰化铁,离子方程式为:Fe多++SCN-=[Fe(SCN)]7+ (或Fe多++多SCN-=Fe(SCN)多),
故答案为:稀盐酸(或稀硫酸溶液);7Fe7++Cm7=7Fe多++7Cm-;Fe多++SCN-=[Fe(SCN)]7+ (或Fe多++多SCN-=Fe(SCN)多);
(7)少量亚铁离子被空气中的氧气氧化成铁离子,所以加入KSCN溶液后,在未加新制氯水的情况下,溶液中也产生了红色,
故答案为:少量Fe7+被空气中氧气氧化成Fe多+.
(多)乙的猜想为:溶液中的SCN-被过量的氯水氧化,若检验乙同学的猜想是否正确,可以取少量褪色后溶液,加入KSCN溶液,如果溶液变红色,说明乙同学的猜想是合理的;如果溶液不变红色,说胆乙同学的猜想是不合理的,
故答案为:
编号实验操作预期现象和结论
①取少量褪色后溶液,加入KSCN溶液如果溶液变红色,说明乙同学的猜想是合理的;如果溶液不变红色,说胆乙同学的猜想是不合理的
或取少量褪色后溶液,加入FeCm多溶液如果溶液仍不变红色,说明乙同学的猜想是合理的;如果溶液变红色,说明乙同学的猜想是不合理的.点评:
本题考点: 物质的检验和鉴别的实验方案设计.
考点点评: 本题考查铁离子与亚铁离子的检验,难度中等.注意明确检验铁离子和亚铁离子的方法,试题培养了学生灵活应用所学知识的能力.1年前查看全部
- (2014•黄浦区三模)如图是某品牌补铁剂的标签.请回答:富马酸亚铁有______种元素组成,其摩尔质量为______.
 (2014•黄浦区三模)如图是某品牌补铁剂的标签.请回答:富马酸亚铁有______种元素组成,其摩尔质量为______.若该物质含0.1mol氢原子,则分子个数是______个.
(2014•黄浦区三模)如图是某品牌补铁剂的标签.请回答:富马酸亚铁有______种元素组成,其摩尔质量为______.若该物质含0.1mol氢原子,则分子个数是______个.  陇中H老农1年前1
陇中H老农1年前1 -
 mm不是伊拉克 共回答了20个问题
mm不是伊拉克 共回答了20个问题 |采纳率100%解题思路:根据物质的化学式来分析其组成元素的种类,摩尔质量与其相对分子质量有关,根据物质的分子构成情况来分析0.1mol该物质中所含氢原子个数.由富马酸亚铁的化学式C4H2FeO4可知:它是由四种元素组成的;C4H2FeO4的相对分子质量是170,故其摩尔质量是170g/mol,1mol任何物质中含有6.02×1023个分子,一个富马酸亚铁分子含有2个氢原子,故,0.05mol富马酸亚铁分子中有0.1mol氢原子.0.05mol富马酸亚铁中含有:0.05mol×6.02×1023=3.01×1022个
富马酸亚铁分子.
故答案为:4;170g/mol;3.01×1022.点评:
本题考点: 化学式的书写及意义;有关化学式的计算和推断.
考点点评: 本题难度不大,考查同学们结合新信息、灵活运用化学式的有关计算进行分析问题、解决问题的能力.1年前查看全部
- 如图是某品牌补铁剂标签的部分内容。请回答:
如图是某品牌补铁剂标签的部分内容。请回答:

(1)C 4 H 2 FeO 4 由 种元素组成,其中C、H元素的原子个数比为 ;
(2)缺铁性贫血中的“铁”是指 (填“铁元素”、“铁原子”或“单质铁”);
(3)C 4 H 2 FeO 4 的摩尔质量是 g/mol。 mild0061年前1
mild0061年前1 -
 5462 共回答了19个问题
5462 共回答了19个问题 |采纳率73.7%(1)4 2:1 (2)铁元素 (3)170
1年前查看全部
- 麦片中补铁的物质是铁粉吗?
 全能mm青年看1年前2
全能mm青年看1年前2 -
 hfwefoisnf 共回答了11个问题
hfwefoisnf 共回答了11个问题 |采纳率90.9%是的;市售麦片中含有微量极细的铁粉,食用这种麦片后,铁在胃液中与胃酸的主要成分盐酸(可用HCl表示)反应:Fe+2HCl=FeCl2+H2(气体),经胃液消化后,转变成亚铁离子,为人体补充铁元素.1年前查看全部
大家在问
- 1在端午节,人们会用怎样的形式去怀念.追忆屈原?我们应该向屈原学习什么
- 2一个长方体,如果高减少2厘米,就变成一个正方体这时表面积比原来减少四十八厘米.原来长方体的体积是多
- 3下面是八年级学生在课外做“比较材料的隔声性能”活动时记录的一些内容:
- 4电解熔融氯化钠的化学反应方程式以及电解饱和食盐水的方程式是一样的吗
- 5I gave a book to Mary last week.Do we use them for poeting l
- 6勉强造句
- 7当硅元素的化合价为+4价时,相同价态硅元素的氯化物的化学式
- 8一道数学题,有人会吗合唱组有42人,美术组的人数是合唱组的7/6,舞蹈组的人数是合唱组的6/5,
- 9完形填空with two teenagers on the wayto college答案
- 10六年级第六组诗海拾贝的白桦诗人借白桦赞美了什么?
- 11(2014•莆田模拟)一竖直悬挂的磁性黑板上吸着一块磁铁,如图所示,磁铁静止不动,下列四对力中,属于平衡力的是( )
- 121亿里有几个10?必彩!
- 13我是外国人,机房人员是什意思?翻译成英文为server administrator是否恰当?
- 14一氧和氧有区别吗?o1 和o有区别吗?一个是元素,
- 15如图为气候类型分布模式图,图的左侧是某季节气压带风带位置示意图,据图中信息回答10~12题.