反应物均为气体,保持容积不变,通入b mol氖气,反应速率怎么变化,为什么会这样变呢?求大师
 xiujing_pp2022-10-04 11:39:546条回答
xiujing_pp2022-10-04 11:39:546条回答
已提交,审核后显示!提交回复
共6条回复
 我是那么那么的想 共回答了11个问题
我是那么那么的想 共回答了11个问题 |采纳率90.9%- 反应速率不变.
因为氖气是稀有气体,不参加反应,通入后,由于保持容积不变,所以反应物浓度不变,化学反应速率不变. - 1年前
 小一龙 共回答了1个问题
小一龙 共回答了1个问题 |采纳率- 反应速率不变
- 1年前
 娃哈哈g6hn 共回答了5个问题
娃哈哈g6hn 共回答了5个问题 |采纳率- 不变。因为瓶内各物质浓度不变,虽然压强增大但这种情况称为假变
- 1年前
 lnm2046 共回答了5个问题
lnm2046 共回答了5个问题 |采纳率- 反应物均为气体,保持容积不变,通入b mol氖气,压强增大,但浓度不变,因此反应速率不变。
- 1年前
 list1126 共回答了2个问题
list1126 共回答了2个问题 |采纳率- 楼上不对,应该不变。因为容积不变,各反应物物质的量不变,即便充入氖气,各反应物物质的量浓度是不会发生变化的,所以反应速率不变。你可能感觉压强变了,但是压强变化导致速率变化原因还是因为压强变化引起了浓度变化,而这个事不变的,所以速率不变。
纯手打,满意采纳啊亲。。。很感激~但我还想问,按您这种说法的话,只要保持体积不变,无论压强增大或减小,物质的量浓度不变,反应速率就不变?... - 1年前
 wq3344520 共回答了5个问题
wq3344520 共回答了5个问题 |采纳率- 变快 你加氖气 相当于体积缩小了
- 1年前
相关推荐
- 下列叙述正确的是( )A.吸热反应一定是反应物总能量大于生成物的总能量B.明矾和漂白粉常用于自来水的净化和杀菌消毒,两
下列叙述正确的是( )
A.吸热反应一定是反应物总能量大于生成物的总能量
B.明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同
C.强电解质溶液导电能力一定很强,弱电解质溶液导电能力一定很弱
D.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 懒惰的V1年前1
懒惰的V1年前1 -
 绕世界流浪 共回答了10个问题
绕世界流浪 共回答了10个问题 |采纳率100%解题思路:A.反应物总能量大于生成物总能量为放热反应;
B.明矾的漂白原理是利用铝离子水解生成的氢氧化铝胶体的吸附性,漂白粉漂白原理是利用了次氯酸钙的强氧化性;
C.电解质的导电能力和离子浓度有关;
D.根据原电池原理分析.A.反应物总能量大于生成物总能量为放热反应,生成物总能量大于反应物总能量为吸热反应,故A错误;
B.明矾的漂白原理是利用铝离子水解生成的氢氧化铝胶体的吸附性,漂白粉漂白原理是利用了次氯酸钙的强氧化性,两者的作用原理不相同,故B错误;
C.电解质的导电能力和离子浓度有关,离子浓度大,导电能力强,若强电解质离子浓度很小,则导电性很弱,如硫酸钡为强电解质,但离子浓度很小,导电性很弱,故C错误;
D.在海轮外壳上镶入锌块,写出原电池,锌作负极失电子,轮船外壳铁作正极被保护,可减缓船体的腐蚀速率,故D正确;
故选D.点评:
本题考点: 反应热和焓变;金属的电化学腐蚀与防护;强电解质和弱电解质的概念;盐类水解的应用;氯、溴、碘及其化合物的综合应用.
考点点评: 本题易错点为C项,要明确导电性和离子浓度有关,相同浓度下,强电解质导电能力大于弱电解质导电能力.1年前查看全部
- 下列说法中错误的是( )A.在热化学方程式中无论反应物还是生成物必须标明聚集状态B.热化学方程式的化学计量数不能表示分
下列说法中错误的是( )
A.在热化学方程式中无论反应物还是生成物必须标明聚集状态
B.热化学方程式的化学计量数不能表示分子的个数
C.反应热指的是反应过程中放出的热量
D.所有的化学反应都伴随着能量的变化 蚊子飞飞1年前1
蚊子飞飞1年前1 -
 林天雨 共回答了14个问题
林天雨 共回答了14个问题 |采纳率92.9%解题思路:A、物质的聚集状态和反应能量变化有关,需要标注物质聚集状态;
B、热化学方程式中计量数只表示物质的量不能表示微粒数,所以可以用分数表示;
C、反应热是反应过程中吸收或放出的能量;
D、化学反应的实质是断裂旧化学键,形成新的化学键的过程,一定伴随能量变化.A、物质的聚集状态和反应能量变化有关,需要标注物质聚集状态,在热化学方程式中无论反应物还是生成物必须标明聚集状态,故A正确;
B、热化学方程式中计量数只表示物质的量不能表示微粒数,不能表示分子的个数,所以可以用分数表示,故B正确;
C、反应热是反应过程中吸收或放出的热量,故C错误;
D、化学反应的实质是断裂旧化学键,形成新的化学键的过程,一定伴随能量变化,所有的化学反应都伴随着能量的变化,故D正确;
故选C.点评:
本题考点: 热化学方程式;反应热和焓变.
考点点评: 本题考查了化学反应能量变化,反应焓变理解,热化学方程式的书写方法,掌握基础是关键,题目较简单.1年前查看全部
- 下列根据硫燃烧的化学方程式(S+O 2 点燃 . SO 2 )获得的信息错误的是( ) A.反应物是硫和氧气,
下列根据硫燃烧的化学方程式(S+O 2
SO 2 )获得的信息错误的是( )点燃 . A.反应物是硫和氧气,生成物是二氧化硫 B.反应前后硫元素、氧元素的化合价都发生了改变 C.1g硫和1g氧气反应生成2g二氧化碳 D.1个硫原子加上1个氧分子等于1个二氧化碳分子  罗鸣1年前1
罗鸣1年前1 -
 celine83 共回答了19个问题
celine83 共回答了19个问题 |采纳率89.5%A、根据化学方程式S+O 2
点燃
.
SO 2 ,该反应的反应物为硫和氧气,生成物是二氧化硫,故选项说法正确.
B、单质中元素的化合价为0,二氧化硫中氧元素显-2价,硫元素显+4价,故选项说法正确.
C、该反应中反应物和生成物的质量比为32:(16×2):(32+16×2)=1:1:2,故选项说法正确.
D、加号不能读作“加”,此化学方程式从微观上可读作一个硫原子和一个氧分子在点燃条件下生成一个二氧化硫分子,而不是二氧化碳分子,故选项错误.
故选D.1年前查看全部
- 下列说法正确的是( )A.乙醇燃烧是生成物总能量高于反应物总能量的反应B.稀溶液中,H+(aq)+OH-(aq)=H2
下列说法正确的是( )
A.乙醇燃烧是生成物总能量高于反应物总能量的反应
B.稀溶液中,H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ/mol可表示稀硫酸与稀Ba(OH)2溶液反应的中和热为△H=-57.3 kJ/mol
C.2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=-QkJ/mol可以表示H2S的燃烧热.
D.高温下,某反应达到平衡,平衡常数为K=
,恒容时,温度升高,H2浓度减小,故该反应的焓变为正值c(CO)•c(H2O) c(CO2)•c(H2)  牛狼之鱼1年前1
牛狼之鱼1年前1 -
 wstflh 共回答了15个问题
wstflh 共回答了15个问题 |采纳率80%解题思路:A、燃烧是放热反应,放热反应中反应物能量高于生成物;
B、生成沉淀时放热;
C、燃烧热是指1mol可燃物燃烧放出的热量;
D、K=[生成物浓度系数幂次方/反应物浓度系数幂次方],升温时反应物浓度减小,说明平衡正向移动.A、燃烧是放热反应,放热反应中反应物能量高于生成物,故A错误;
B、生成沉淀时放热,所以稀硫酸与稀Ba(OH)2溶液反应的中和热为△H<-57.3 kJ/mol,故B错误;
C、燃烧热是指1mol可燃物燃烧放出的热量,故C错误;
D、升温时反应物浓度减小,说明升温平衡正向移动,焓变为正值,故D正确;
故选D.点评:
本题考点: 反应热和焓变;化学反应的能量变化规律;化学平衡常数的含义.
考点点评: 本题考查了燃烧是放热反应、中和热、燃烧热、平衡常数的关系知识,题目难度中等.1年前查看全部
- 如果一个化学反应前后化学计量数之和相等,增大压强,化学反应正逆方向同等增加,是不是在瞬间就抵消掉了,导致反应物的百分含量
如果一个化学反应前后化学计量数之和相等,增大压强,化学反应正逆方向同等增加,是不是在瞬间就抵消掉了,导致反应物的百分含量不变?还是有什么具体的原因,
 木头004862531年前2
木头004862531年前2 -
 jhwr2005 共回答了16个问题
jhwr2005 共回答了16个问题 |采纳率93.8%你说的对.
如果一个化学反应前后化学计量数之和相等,增大压强,化学反应正逆方向同等增加,
所以平衡不移动,各物质的百分含量不变,1年前查看全部
- 初中化学涉及许多化学反应类型,请你整理归纳,按以下化学反应类型选择合适的反应物,各举一例,要求有二氧化碳生成,用化学方程
初中化学涉及许多化学反应类型,请你整理归纳,按以下化学反应类型选择合适的反应物,各举一例,要求有二氧化碳生成,用化学方程式表示,并注明反应条件.
(1)化合反应C+O2
CO2(合理均可)点燃 .C+O2;
CO2(合理均可)点燃 .
(2)分解反应______;
(3)置换反应C+2CuO
2Cu+CO2↑(合理均可)高温 .C+2CuO;
2Cu+CO2↑(合理均可)高温 .
(4)复分解反应______. lawyerwan1年前1
lawyerwan1年前1 -
 斯渺 共回答了14个问题
斯渺 共回答了14个问题 |采纳率85.7%解题思路:首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤进行书写即可.(1)碳和氧气在点燃条件下生成二氧化碳,反应的化学方程式为:C+O2
点燃
.
CO2(合理均可).
(2)碳酸分解生成水和二氧化碳,属于分解反应,反应的化学方程式为:H2CO3═H2O+CO2↑(合理均可).
(3)碳与氧化铜在高温条件下生成铜和二氧化碳,属于置换反应,反应的化学方程式为:C+2CuO
高温
.
2Cu+CO2↑(合理均可).
(4)碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,属于复分解反应,反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑(合理即可).
故答案为:(1)C+O2
点燃
.
CO2(合理均可);(2)H2CO3═H2O+CO2↑(合理均可);(3)C+2CuO
高温
.
2Cu+CO2↑(合理均可);(4)CaCO3+2HCl═CaCl2+H2O+CO2↑(合理即可).点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度不大,考查学生根据反应原理书写化学方程式的能力,化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等.1年前查看全部
- 指示剂指示酸碱变色是化学变化吗?如果是,那么他是做反应物还是做其他成分?如果是反应物那酸碱走后,那他为什么又会变会原来的
指示剂指示酸碱变色是化学变化吗?如果是,那么他是做反应物还是做其他成分?如果是反应物那酸碱走后,那他为什么又会变会原来的颜色?如果不是反应物那他是什么呢?
 cyj198204251年前3
cyj198204251年前3 -
 思过628 共回答了18个问题
思过628 共回答了18个问题 |采纳率72.2%指示剂指示酸碱变色是化学变化,变化原理是这样的,指示剂再酸性环境中是形态A,碱性环境中是形态B,两个形态随环境的酸碱变化而变化.(实际上是化学平衡状态)
A+氢氧根=B
B+氢离子=A
反应中生成或消耗的水没有写.1年前查看全部
- 下图每一方框中的字母代表一种反应物或生成物:
下图每一方框中的字母代表一种反应物或生成物:

物质A跟B反应生成物质E、F和G;物质C跟D反应生成物质I,某温度下该反应起始和某时刻的反应混合物组成如右上表格所示.请填写下列空白:
(1)物质H的分子式是 ___ .
(2)反应①的化学方程式是 ___ .
(3)反应②的化学方程式(须注明反应条件)是 ___ .
 龙堂风1年前1
龙堂风1年前1 -
 乖逗逗 共回答了23个问题
乖逗逗 共回答了23个问题 |采纳率100%解题思路:电解饱和食盐水生成Cl2、H2和NaOH,其中Cl2和NaOH反应生成NaClO、NaCl和H2O三种物质,而Cl2和H2反应只生成HCl,由框图可知A为NaOH,B为Cl2,C为H2,由表中数据可知n(H2):n(D):n(I)=3:1:2,由质量守恒定律可知,D为双原子分子,1molI中含有3molH和1molD,I应为NH3,则D为N2,以此进行解答.电解饱和食盐水生成Cl2、H2和NaOH,其中Cl2和NaOH反应生成NaClO、NaCl和H2O三种物质,而Cl2和H2反应只生成HCl,由框图可知A为NaOH,B为Cl2,C为H2,由表中数据可知n(H2):n(D):n(I)=3:1:2,由质量守恒定律可知,D为双原子分子,1molI中含有3molH和1molD,I应为NH3,则D为N2,则
(1)B为Cl2,C为H2,二者反应生成HCl,故答案为:HCl;
(2)Cl2和NaOH反应生成NaClO、NaCl和H2O三种物质,反应的化学方程式为Cl2+2NaOH=NaClO+NaCl+H2O,
故答案为:Cl2+2NaOH=NaClO+NaCl+H2O;
(3)反应②为N2和H2在催化剂条件下的反应,反应的化学方程式为N2+3H2
催化剂
.
高温高压2NH3,
故答案为:N2+3H2
催化剂
.
高温高压2NH3.点评:
本题考点: 无机物的推断.
考点点评: 本题考查无机物的推断,题目难度不大,注意Cl2和NaOH的反应,根据生成物的种类判断是解答该题的关键.1年前查看全部
- 有什么,才能判断参加化学反应的反应物总质量和生成物总质量是否相等
 godwujie1年前1
godwujie1年前1 -
 dd教师_987 共回答了19个问题
dd教师_987 共回答了19个问题 |采纳率84.2%因为化学反应中原子的个数不增减,原子的种类不改变.所以参加反应的原子的种类和个数与反应中的生成物中的原子的种类和个数完全一致.所以参加反应的反应物的质量与生成物的总质量完全相等.1年前查看全部
- 下图所示图像中,纵坐标为沉淀的量,横坐标为某溶液中加入反应物的物质的量,试按题意将相应的字母序号填入表中:
下图所示图像中,纵坐标为沉淀的量,横坐标为某溶液中加入反应物的物质的量,试按题意将相应的字母序号填入表中:
(1)表示在铝铵明矾[NH4Al(SO4)2]溶液中滴入NaOH至过量_____
(2)表示在含少量NaOH的Na[Al(OH)4]溶液中滴入HCl至过量_____
(3)表示在含少量KOH的K[Al(OH)4]溶液中滴入AlCl3至过量_____
(4)表示在HCl酸化的AlCl3溶液中滴入KOH溶液至过量_____
(5)表示在Ca(ClO)2溶液中通入CO2至过量_____

 xftkxt1年前3
xftkxt1年前3 -
 丘丘断翅 共回答了26个问题
丘丘断翅 共回答了26个问题 |采纳率88.5%(1)选A.Al3+ + 3OH- = Al(OH)3↓,NH4+ + OH- = NH3·H2O,Al(OH)3 + OH- = [Al(OH)4]- ,先生成Al(OH)3沉淀,然后生成NH3·H2O,沉淀量不变,最后是Al(OH)3沉淀溶解.
(2)选B.OH- + H+ = H2O,[Al(OH)4]- + H+ = Al(OH)3↓ + H2O,Al(OH)3 + 3H+ = Al3+ + 3H2O,先中和剩余的碱,再生成沉淀,最后沉淀溶解.并且沉淀和溶解所消耗的酸为1:3.
(3)选C.Al3+ + 4OH- = [Al(OH)4]- ,3[Al(OH)4]- + Al3+ = 4Al(OH)3↓,刚开始没沉淀,等OH-全部消耗后才开始双水解产生沉淀.
(4)选D.OH- + H+ = H2O,Al3+ + 3OH- = Al(OH)3↓,Al(OH)3 + OH- = [Al(OH)4]- ,先中和剩余的酸,再生成沉淀,最后沉淀溶解,沉淀和溶解所消耗的碱为3:1.
(5)选E.Ca(ClO)2 + CO2 + H2O = CaCO3↓ + 2HClO,CaCO3 + CO2 + H2O = Ca(HCO3)2,先生成沉淀,然后沉淀溶解,消耗CO2的量相等.1年前查看全部
- 银锌纽扣电池和银锌蓄电池的负极反应为什么不一样?都是一样的反应物,产物为什么不同?
银锌纽扣电池和银锌蓄电池的负极反应为什么不一样?都是一样的反应物,产物为什么不同?
正极反应相同
负极
纽扣电池的产物是ZnO2+H2O
蓄电池的产物是Zn(OH)2
为什么?
电极,电解质都是一样的。继续期待正确答案! 紫月诗云1年前4
紫月诗云1年前4 -
 lanqiuyu 共回答了15个问题
lanqiuyu 共回答了15个问题 |采纳率80%好像银锌纽扣电池和银锌蓄电池的负极反应都是
Zn + 2OH- - 2e- = ZnO + H2O
不过碱性锌锰干电池的负极反应
Zn + 2OH- - 2e- = Zn(OH)21年前查看全部
- 下列说法正确的是( )A.需要加热才能发生的反应一定是吸热反应B.任何放热反应在常温条件下一定能发生反应C.反应物和生
下列说法正确的是( )
A.需要加热才能发生的反应一定是吸热反应
B.任何放热反应在常温条件下一定能发生反应
C.反应物和生成物具有的总能量的相对大小决定了反应是放热还是吸热
D.吸热反应一定要加热才能发生 WANGNEI1年前1
WANGNEI1年前1 -
 zhang0312 共回答了14个问题
zhang0312 共回答了14个问题 |采纳率100%解题思路:A.吸热反应实质是反应物所具有的总能量低于生成物所具有的总能量;
B.一个化学反应发生的条件与反应的热效应无关;
C.化学反应中生成物总能量不等于反应物的总能量,反应前后的能量差值为化学反应中的能量变化;
D.吸热反应在不加热的条件下也能发生.A.需要加热才能发生的反应不一定是吸热反应,如木炭的燃烧是一个放热反应,但需要点燃,点燃的目的是使其达到着火点,故A错误;
B.放热的反应在常温下不一定很容易发生.如:铝热反应2 Al+Fe2O3
高温
.
Al2O3+2Fe是放热反应,但需在高热条件下以保证足够的热量引发氧化铁和铝粉反应,故B错误;
C.放热反应是指:反应物所具有的总能量高于生成的总能量,在反应中会有一部分能量转变为热能的形式释放,反之,就是吸热反应,故C正确;
D.吸热反应在不加热的条件下也能发生,如Ba(OH)2•8H2O与NH4Cl反应常温下就能发生,故D错误.
故选C.点评:
本题考点: 吸热反应和放热反应.
考点点评: 本题考查化学反应的条件与化学反应的热效应间的关系,难度不大,需正确理解放热吸热的本质是解题的关键.1年前查看全部
- 反应热是等于生成物总能量减去反应物总能量吗
 ilwendy1年前3
ilwendy1年前3 -
 chguho 共回答了12个问题
chguho 共回答了12个问题 |采纳率83.3%能量不可能被创造,也不可能被消灭.化学反应前后体系的总能量是相等的,有一部分没有留在物质化学键内部而是以热能形式放出了,所以你说的是对的,反应热是等于生成物总能量减去反应物总能量.1年前查看全部
- 为了验证物质在发生化学变化时“参加反应的反应物总质量与生成物总质量相等”,某校甲、乙两个兴趣小组分别设计了如下的探究实验
 为了验证物质在发生化学变化时“参加反应的反应物总质量与生成物总质量相等”,某校甲、乙两个兴趣小组分别设计了如下的探究实验:
为了验证物质在发生化学变化时“参加反应的反应物总质量与生成物总质量相等”,某校甲、乙两个兴趣小组分别设计了如下的探究实验:
【实验方案】
【实验现象】反应后,甲小组的天平______,乙小组的天平______(填“平衡”、“不平衡”),上述反应中符合质量守恒定律的是______(填“甲”、“乙”).
【解释与结论】
乙小组的解释为:______.
【反思与评价】比较两个小组的实验设计,若乙小组使用的试剂不变但要得到和甲小组相同的结论,你认为应对实验装置进行怎样的改进?______.
【拓展与延伸】
硝酸在工业生产中有广泛的应用,工业上制硝酸的关键反应为4NH3+5O2
4NO+6R,其中R的化学式为______.MnO2 .△  时代鱼鱼1年前1
时代鱼鱼1年前1 -
 cdq2006520 共回答了18个问题
cdq2006520 共回答了18个问题 |采纳率83.3%解题思路:盐酸和碳酸钠反应生成了氯化钠、水、二氧化碳,有气体跑出质量减少,天平不平衡,所以不能用来验证质量守恒,硫酸铜与氢氧化钙反应生成硫酸钙和氢氧化铜,没有物质跑出,质量不变,能验证质量守恒.化学反应前后,元素的种类不变,原子的种类、总个数不变.[实验现象]由于甲小组用硫酸铜与氢氧化钙反应,生成硫酸钙和氢氧化铜,没有物质散失,质量不变天平指针指向刻度盘的中间;乙小组用的是盐酸和碳酸钠反应生成了氯化钠、水、二氧化碳,有气体跑出质量减少,指针指向刻度盘的右边;
[解释与结论]甲小组天平平衡说明参加化学反应的各物质的质量总和等于反应生成的各物质的质量总和;乙小组质量不相等是因为反应中有二氧化碳气体生成,因此烧杯内总质量会减少;
[反思与评价]有气体产生的实验必须在密闭容器中进行.
【拓展与延伸】由4NH3+5O2═4NO+6R可知,
反应前氮原子是4个,反应后是4个;
反应前氢原子是12个,反应后应该是12个,包含在6R中;
反应前氧原子是10个,反应后应该是10个,其中6个包含在6R中;
由分析可知,每个R中含有2个氢原子和1个氧原子,是水,化学式是H2O.
故答案为:[实验想象]:平衡;不平衡;甲乙.
[解释与结论]:反应中有二氧化碳气体生成,因此烧杯内总质量会减少.
[反思与评价]:将乙小组中的烧杯改为密闭容器.
【拓展与延伸】H2O.点评:
本题考点: 质量守恒定律的实验探究.
考点点评: 在设计验证质量守恒的实验时要考虑实验在密闭容器中进行,组装装置时注意实验的准确性和安全性.1年前查看全部
- 判断对错:1、“分解反应的反应物一定是一种” 2、“物质跟氧气发生反应时,都有热量放出”
 木下人1年前3
木下人1年前3 -
 277951760 共回答了17个问题
277951760 共回答了17个问题 |采纳率76.5%1严格上是错的 比如说过氧化氢分解反应用二氧化锰做催化剂,二氧化锰也参与反应只是质量化学性质不变罢了
2错氧气合成臭氧时吸热1年前查看全部
- 盐酸在做反应物时,既做氧化剂,又做还原剂的化学反应式
 绮萃1年前2
绮萃1年前2 -
 hcg2 共回答了27个问题
hcg2 共回答了27个问题 |采纳率85.2%2HCl=通电=H2↑+Cl2↑1年前查看全部
- 下列反应中,反应物中的各种元素都参加了氧化还原的是( )
下列反应中,反应物中的各种元素都参加了氧化还原的是( )
A.2KNO3+S+3C═K2S+N2↑+3CO2↑
B.2KMnO4═K2MnO4+MnO2+O2↑
C.4HNO3═2H2O+4NO2↑+O2↑
D.HgS+O2═Hg+SO2 zhangfeng0961年前1
zhangfeng0961年前1 -
 雪小艳儿 共回答了23个问题
雪小艳儿 共回答了23个问题 |采纳率78.3%解题思路:A.K、O元素的化合价没有变化;
B.K元素的化合价没有变化;
C.H元素的化合价没有变化;
D.Hg、O元素的化合价降低,S元素的化合价升高.A.2KNO3+S+3C═K2S+N2↑+3CO2↑中,K、O元素的化合价没有变化,没有都参加氧化还原反应,故A不选;
B.2KMnO4═K2MnO4+MnO2+O2↑中,K元素的化合价没有变化,没有都参加氧化还原反应,故B不选;
C.4HNO3═2H2O+4NO2↑+O2↑中,H元素的化合价没有变化,没有都参加氧化还原反应,故C不选;
D.HgS+O2═Hg+SO2中,Hg、O元素的化合价降低,S元素的化合价升高,都参加氧化还原反应,故D选;
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,明确反应中元素的化合价变化及常见物质中元素的化合价即可解答,题目难度不大.1年前查看全部
- (2014•道外区三模)如图所示,箭头表示各物质间的转换关系,箭头指向的为生成物,部分反应物或生成物已略去.现有氯化钠溶
 (2014•道外区三模)如图所示,箭头表示各物质间的转换关系,箭头指向的为生成物,部分反应物或生成物已略去.现有氯化钠溶液、碳酸钠溶液、氢氧化钠溶液和硫酸钠溶液,请回答下列问题:
(2014•道外区三模)如图所示,箭头表示各物质间的转换关系,箭头指向的为生成物,部分反应物或生成物已略去.现有氯化钠溶液、碳酸钠溶液、氢氧化钠溶液和硫酸钠溶液,请回答下列问题:
(1)请将四种溶液中溶质的化学式填入圆圈内,表示出它们间的转化关系;
(2)写出A与B之间相互转化的化学方程式______
(3)写出B转换为D的实验现象______. molu81961年前1
molu81961年前1 -
 aiai413 共回答了21个问题
aiai413 共回答了21个问题 |采纳率90.5%解题思路:观察图框,总结图框中物质之间关系是A与B可以相互转化,A与D也可以相互转化,ABD都可以转化成C,然后分析四种物质的性质氢氧化钠与碳酸钠可以相互转化,氢氧化钠和硫酸钠之间也可以相互转化,故A为氢氧化钠,BD为碳酸钠和硫酸钠,C为氯化钠,据此分析解决即可.根据框图关系A与B可以相互转化,A与D也可以相互转化,ABD都可以转化成C,然后分析四种物质的性质氢氧化钠与碳酸钠可以相互转化,氢氧化钠和硫酸钠之间也可以相互转化,故A为氢氧化钠,BD为碳酸钠和硫酸钠,C为氯化钠,因此
(1)故四种溶液的转化关系为: ;
;
(2)A转化为B的反应是氢氧化钠和二氧化碳反应产生碳酸钠和水,故反应的方程式为:CO2+2NaOH=Na2CO3+H2O;
B转化为A可以是碳酸钠和氢氧化钙反应产生碳酸钙沉淀和氢氧化钠,故反应的方程式为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
(3)B转换为D是碳酸钠和硫酸反应产生硫酸钠、水和二氧化碳,故反应的现象为:有气泡产生.点评:
本题考点: 物质的鉴别、推断;碱的化学性质;盐的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 此题为框图式物质推断题,完成此类题目,关键是找准解题突破口,直接得出结论,然后利用顺向或逆向或两边向中间推,逐一导出其他结论.1年前查看全部
- 可逆反应反应物产物中既有气体又有液体,则平衡常数该如何表示
 bl999cncom1年前2
bl999cncom1年前2 -
 MK寒冰 共回答了22个问题
MK寒冰 共回答了22个问题 |采纳率81.8%液体或固体浓度用1代替1年前查看全部
- 化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质.例如:
化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质.例如:
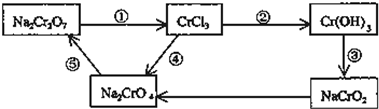
(1)在上述有编号的步骤中,需用还原剂的是______,需用氧化剂的是______(填编号).
(2)在上述循环中,既能与强酸反应又能与强碱反应的两性物质是______(填化学式)
(3)完成并配平步骤①的化学方程式,标出电子转移的方向和数目:
______Na2Cr2O7+______KI+______HCl→______CrCl3+______NaCl+______KCl+______I2+______. 不是我是谁1年前1
不是我是谁1年前1 -
 臂刺玫瑰 共回答了16个问题
臂刺玫瑰 共回答了16个问题 |采纳率93.8%解题思路:(1)需用还原剂的反应,应为还原,所含元素的化合价降低,需要氧化剂,物质被氧化,所含元素的化合价升高,从化合价的角度判断;
(2)由图中转化可知,Cr(OH)3具有两性;
(3)根据氧化还原反应中氧化剂和还原剂之间得失电子数目相等,表现为化合价升降的总数相等进行解答.(1)在反应中,①中Cr元素化合价降低,应加入还原剂,②③Cr元素化合价不变,④Cr元素化合价升高,需加入氧化剂,⑤元素化合价不变,
故答案为:①;④;
(2)由图中转化可知,Cr(OH)3具有两性,既能与强酸反应又能与强碱反应,故答案为:Cr(OH)3;
(3)反应中Cr元素化合价由+6价降低到+3价,I元素化合价由-1价升高到0价,则根据化合价升降总数相等结合质量守恒可知配平后的方程式应为Na2Cr2O7+6KI+14HCl=2CrCl3+2NaCl+6KCl+3I2+7H2O,故答案为:1;6;14;2;2;6;3;7H2O.点评:
本题考点: 氧化还原反应;两性氧化物和两性氢氧化物.
考点点评: 本题考查了氧化还原反应,明确元素化合价变化即可解答,根据转移电子相等进行配平方程式即可,题目难度不大.1年前查看全部
- 复分解反应的条件为什么有反应物都溶于水(与酸反应固体可不溶于水)?
 66nnll1年前1
66nnll1年前1 -
 dorazion 共回答了24个问题
dorazion 共回答了24个问题 |采纳率91.7%复分解反应的反应物不一定溶于水,比如碳酸钙和稀盐酸的反应,生成二氧化碳水和1年前查看全部
- 如果在一个恒定的容器里,混合气体的密度会改变吗,假如反应物和生成物都是气体.不是P=m/V吗?
如果在一个恒定的容器里,混合气体的密度会改变吗,假如反应物和生成物都是气体.不是P=m/V吗?
如果在一个恒温恒容条件下,A(g)+B(g)==C(g),是不是无论反应达不达到平衡,混合气体的密度都不改变!懂的回答,不懂的别乱吹. iexyc0__7_ww3fe71年前5
iexyc0__7_ww3fe71年前5 -
 风中的飞沙 共回答了22个问题
风中的飞沙 共回答了22个问题 |采纳率95.5%你这个反应是这样的.
气体总质量不变,总体积不变,密度就不变.
假如反应中有固体或液体参与,仅管反应前后都有气体,如果气体总质量改变,体积不变,密度必然改变.1年前查看全部
- F是初中化学中的常见物质,题15图是它们之间的转化关系,图中部分反应物或生成物未全部标出.
F是初中化学中的常见物质,题15图是它们之间的转化关系,图中部分反应物或生成物未全部标出.
已知:A是天然气的主要成分,B在常温下为液态,F是黑色粉末. 乱世散人1年前3
乱世散人1年前3 -
 春江花yy 共回答了20个问题
春江花yy 共回答了20个问题 |采纳率100%分析:根据已有的知识进行分析,A是天然气的主要成分,则A是甲烷,甲烷完全燃烧生成二氧化碳和水,B是液态,则B是水,C是二氧化碳,水能与氧化钙反应生成氢氧化钙,同时放出大量的热,则D是氢氧化钙;二氧化碳能与灼热的碳反应生成一氧化碳,则E是一氧化碳,一氧化碳具有还原性,能还原金属氧化物;红棕色固体可能是氧化铁,则生成的F是铁,
A是天然气的主要成分,则A是甲烷,甲烷完全燃烧生成二氧化碳和水,B是液态,则B是水,C是二氧化碳,水能与氧化钙反应生成氢氧化钙,同时放出大量的热,则D是氢氧化钙;二氧化碳能与灼热的碳反应生成一氧化碳,则E是一氧化碳,一氧化碳具有还原性,能还原金属氧化物;红棕色固体可能是氧化铁,F是黑色粉末,则生成的F是铁,代入框图,推断合理;
(1)B→D是氧化钙与水反应,此反应是放热反应,故填:放热;
(2)C是二氧化碳,与碳在高温下反应生成一氧化碳,是化合反应,故填:化合;
(3)E是一氧化碳,能与氧化铁反应生成铁和二氧化碳,故填:
Fe2O3+3CO =高温= 2Fe+3CO2;
(4)一氧化碳还具有可燃性,能用作燃料,故填:燃料.1年前查看全部
- 小刚和小洁以“化学反应中,反应物和生成物的质量关系”为课题进行科学探究.请填写以下探究过程中的空格:
小刚和小洁以“化学反应中,反应物和生成物的质量关系”为课题进行科学探究.请填写以下探究过程中的空格:
[提出假设]化学反应中,反应物和生成物的质量(1)相等相等.
[确定研究方法]分析推理、查阅资料、实验探究.
[设计并进行实验]小刚设计的实验装置和选用的药品如图A所示,小洁设计的实验装置如图B所示,他们在反应前后都进行了规范的操作、准确的称量和细致的观察.
注意:
A中稀盐酸的主要成份为HCl,石灰石的主要成份是CaCO3
A中发生的反应:CaCO3+2HCl=CaCl2+CO2↑+2H2O
B中稀硫酸的主要成份为H2SO4,氯化钡溶液的主要成份是BaCl2
B中发生的反应:BaCl2+H2SO4=BaSO4↓+2HCl
[实验结论]小刚认为:在化学反应中,生成物的总质量与反应物的总质量不相等.小洁认为:在化学反应中,生成物的总质量与反应物的总质量相等.你认为:(2)小刚小刚的结论不正确,请你谈谈导致另一种结论错误的原因 (3)因为生成的二氧化碳逸出因为生成的二氧化碳逸出.
[结论分析]请从原子的角度,简要分析你认为正确的结论.(4)化学反应前后,原子的种类不变,数目没有增减,质量也不发生变化化学反应前后,原子的种类不变,数目没有增减,质量也不发生变化
[查阅资料]小刚和小洁通过查阅资料了解到:法国伟大的科学家拉瓦锡,早在18世纪就围绕这个问题,进行了准确、缜密的研究,并作出了科学结论.
[交流表达]简要谈一下,你认为这条科学结论有什么重大意义?(不超过30字)(5)化学反应还表示反应物、生成物各物质之间的质量关系,使对化学的研究就由定性化学转向了定量化学化学反应还表示反应物、生成物各物质之间的质量关系,使对化学的研究就由定性化学转向了定量化学
[结论应用]环保部门常用I2O5测定空气受CO污染的程度,发生反应的化学方程式为:I2O5+5CO=I2+5X,根据生成X的多少,可以判断CO的含量,X的化学式为(6)CO2CO2. 阿卡aka1年前1
阿卡aka1年前1 -
 93749374 共回答了13个问题
93749374 共回答了13个问题 |采纳率92.3%(1)小洁用的是硫酸和氯化钡反应生成了硫酸钡和盐酸,没有气体跑出,所以反应前后质量相等;
(2)小洁反应前后质量不变;小刚反应前后质量变小,因为生成的二氧化碳逸出;所以小洁结论正确;小刚的结论错误;
(3)由于小刚在操作过程中反应生成的CO2气体逸出锥形瓶,所以剩余的生成物的质量比反应物的总质量减少了,天平发生了偏向,不能用来验证质量守恒定律;
(4)化学反应的实质是分子分成原子,原子再重新组合成新的分子,所以反应前后原子的种类没有改变,原子的数目没有增减,原子的质量没有变化,所以,在化学反应中,反应物的质量总和与生成物的质量总和必然相等.
(5)该科学结论对于定量认识化学反应,合理进行化工生产有重要作用.
(6)根据“化学方程式为:I2O5+5CO=I2+5X”,根据质量守恒定律的元素守恒,反应前后原子的个数不变,生成物中还少10个O,5个C,又因为X前面系数是5,所以推测X的化学式是CO2
故答为:(1)相等;
(2)小刚;
(3)因为生成的二氧化碳逸出;
(4)化学反应前后,原子的种类不变,数目没有增减,质量也不发生变化.
(5)化学反应还表示反应物、生成物各物质之间的质量关系,使对化学的研究就由定性化学转向了定量化学.
(6)CO21年前
71年前查看全部
- (2012•佛山)A是钠的氧化物,B、C、D、E是初中常见的盐.图1是这些物质的转化关系,部分反应物、生成物及反应条件已
(2012•佛山)A是钠的氧化物,B、C、D、E是初中常见的盐.图1是这些物质的转化关系,部分反应物、生成物及反应条件已省略.

(1)请写出下列物质的化学式:C______,E______.
(2)A→B反应的化学方程式为______.
(3)可用D制烧碱,写出反应的化学方程式______.
(4)要将没有标签的B、C、D、E四种溶液区分开来,某同学设计了如图2所示实验方案.方案中试剂①为______(填化学式,下同),试剂②为______溶液. 刘改之1年前1
刘改之1年前1 -
 mmsaraqi 共回答了14个问题
mmsaraqi 共回答了14个问题 |采纳率92.9%解题思路:(1)根据题意,A是钠的氧化物,应为氧化钠,氧化钠与硫酸反应生成了硫酸钠和水,硫酸钠和硝酸钡反应生成了硫酸钡和硝酸钠,氧化钠与硝酸反应也能生成硝酸钠,所以,可推出C为硝酸钠;由硫酸钠与氯化钡反应生成了硫酸钡沉淀和氯化钠,氧化钠和盐酸反应应为能生成氯化钠,所以可推出E为氯化钠;
(2)根据氧化钠和硫酸的反应写出反应的方程式;
(3)氧化钠和二氧化碳反应生成了碳酸钠,碳酸钠和氢氧化钙反应生成了氢氧化钠,根据反应写出反应的方程式;
(4)根据碳酸钠与酸反应放出气体,可以先鉴别出来,再根据硫酸钠能与可溶性的钡盐反应生成了硫酸钡沉淀,将硫酸钠鉴别出来.由此可推出试剂②.(1)由题意可知,A是钠的氧化物,应为氧化钠,氧化钠与硫酸反应生成了硫酸钠和水,硫酸钠和硝酸钡反应生成了硫酸钡和硝酸钠,氧化钠与硝酸反应也能生成硝酸钠,所以,可推出C为硝酸钠,化学式是NaNO3;由硫酸钠与氯化钡反应生成了硫酸钡沉淀和氯化钠,氧化钠和盐酸反应应为能生成氯化钠,所以可突出E为氯化钠,化学式是:NaCl;
(2)氧化钠和硫酸的反应,生成了硫酸钠和水,反应的方程式是:Na2O+H2SO4=Na2SO4+H2O;
(3)碳酸钠和氢氧化钙反应生成了氢氧化钠和碳酸钙沉淀,常用此反应制取烧碱,反应的方程式是:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
(4)由于碳酸钠与酸反应放出气体,可以先鉴别出来.所以,试剂①是硝酸;再根据硫酸钠能与可溶性的钡盐反应生成了硫酸钡沉淀,将硫酸钠鉴别出来.由此,可推出试剂②是硝酸钡.
故答为:(1)NaNO3NaCl(2)Na2O+H2SO4=Na2SO4+H2O;(3)Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;(4)HNO3,Ba(NO3)2.点评:
本题考点: 物质的鉴别、推断.
考点点评: 此题为框图式物质推断题,完成此类题目,关键是找准解题突破口,直接得出结论,然后利用顺向或逆向或两边向中间推,逐一导出其他结论.1年前查看全部
- 密闭容器中气体反应达平衡后向容器中加入反应物,逆反应速率增加还是减少?
 wsnmgry1年前1
wsnmgry1年前1 -
 天女天女 共回答了14个问题
天女天女 共回答了14个问题 |采纳率85.7%影响反应速率的其实是浓度,密闭容器中气体反应达平衡后向容器中加入反应物,会使反应物的浓度增大,因此正反应速率是加快的,就这一瞬间来说,生成物的浓度还没有改变,因此逆反应这一瞬速率不变,尤其是画图这一点很重要,但由于反应物消耗,就会有生成物产生,这时,生成物浓度变大,自然反应速率也加快了.
综合来说,增大反应物浓度,会使正反应速率加快,也会使逆反应速率加快.1年前查看全部
- 作为生成的苯酚写离子方程式时能拆吗?需要写沉淀符号吗?反应物呢?
 这不扯了吗1年前1
这不扯了吗1年前1 -
 shqtzzhglkhfkl4t 共回答了13个问题
shqtzzhglkhfkl4t 共回答了13个问题 |采纳率76.9%这个要看苯酚所在的体系.如果是有机体系,那么苯酚就是溶解的.
如果是水体系,苯酚作为生成物一般就写上沉淀符号.如果写离子方程式,由于苯酚是弱电解质,因此应该写分子式,不拆.1年前查看全部
- 关于启普发生器为什么启普发生器不用于强烈放热反应和剧烈放气反应?是否所有玻璃仪器都是这样?为什么?为什么反应物必须为块状
关于启普发生器
为什么启普发生器不用于强烈放热反应和剧烈放气反应?是否所有玻璃仪器都是这样?为什么?为什么反应物必须为块状固体和液体,而且生成物也必须是难或微溶于水的气体?若反应物是颗粒或粉末状的会怎样?生成物中可否存在微或难溶于水的固体?为什么?否则会怎样? 四纪冰川1年前1
四纪冰川1年前1 -
 cdturkey2001 共回答了9个问题
cdturkey2001 共回答了9个问题 |采纳率88.9%好多问题哦
启普发生器不用于强烈放热反应和剧烈放气反应是因为他是一个相对密封的整体,如果反应过于强烈就会导致气体不能排出而爆炸.
启普发生器有两个反应物的存放空间,一个是由金属丝网构成的,用来盛放固体块,如果是颗粒或粉末状的会从中漏出,而另一个是由玻璃构成用来盛液体的,所以一定反应物必须为块状固体和液体.
启普发生器有个优点就是它能随时停止反应,原理是让反应物分离,这就靠难或微溶于水的气体生成物在阀们关闭的情况下把液体压到与固体分离从而阻止反应.
至于生成物嘛~只要有难或微溶于水的气体,都行,但注意,微或难溶于水的固体可能会使固体表面与液体无法充分接触从而影响反应.
打了这么多,老弟也该选我了吧~1年前查看全部
- 对于一个可逆反应,如果只增大其中一种反应物浓度,为什么会使平衡右移?又没有增大另一种反应物浓度来
对于一个可逆反应,如果只增大其中一种反应物浓度,为什么会使平衡右移?又没有增大另一种反应物浓度来
和它反应? 草阿鞋1年前2
草阿鞋1年前2 -
 fannifanny 共回答了17个问题
fannifanny 共回答了17个问题 |采纳率94.1%化学反应之所以有一些是可逆反应,指的是在反应时反应物浓度降低,生成物浓度升高,当达到动态平衡时浓度不变即可认为是保持平衡,增大浓度促使反应(正反应)右移仅仅是其中的一个因素,包括反应物本身的性质,反应条件的改变如温度、压强、容器体积、冲入保护气等在内的因素都会使得正反应或逆反应的发生1年前查看全部
- 二氧化锰作催化剂时,用质量守恒定律计算,用反应物的质量减生成物的质量,放映物种算不算二氧化锰的质量
 snwvh19781年前1
snwvh19781年前1 -
 nobarking 共回答了25个问题
nobarking 共回答了25个问题 |采纳率92%不算1年前查看全部
- 增加或减少化学平衡时的反应物或生成物浓度对反应有影响吗?如果有反应速率怎么变?麻烦讲得通俗点,谢谢
 844920351年前2
844920351年前2 -
 ss燃烧 共回答了25个问题
ss燃烧 共回答了25个问题 |采纳率88%这应该是高中化学反应速率的题,增加或减少化学平衡时的反应物或生成物浓度时可能有影响,也可能没有影响,要看反应物或生成物是固体还是气体,对于气体和固体来说,固体没有影响(对于高中来说),对于气体和气体来说,一定有影响,记住一个口诀对于气体来说无论是反应物还是生成物对反应速率,一定有影响,固体和液体不一定(很少有影响的),还得看具体的题1年前查看全部
- 化学平衡向正方应方向移动那么反应物的转化率一定变高吗
化学平衡向正方应方向移动那么反应物的转化率一定变高吗
不是 我是说反应物的转化率一起变高! 馅饼儿1年前3
馅饼儿1年前3 -
 mikazz 共回答了17个问题
mikazz 共回答了17个问题 |采纳率88.2%不是,转化率与转化量和反应物量都有关:反应向正反应进行,说明转化量变大,但如果这种改变是由于反应物物质的量增多,导致反应物浓度增大而导致反应向正反应方向移动的话,那么,由转化率=转化量/反应物量得:1个量增大,另1个量减小,无法判断其比值的大小关系.并且,由勒夏特列原理:反应向着能减小改变的方向进行得:反应物转化量1年前查看全部
- 水做反应物的复分解反应与水反应的物质是短周期元素组成的
 一个想法_1年前1
一个想法_1年前1 -
 jsgxya 共回答了13个问题
jsgxya 共回答了13个问题 |采纳率92.3%2KAl(SO4)2+6H2O=2Al(OH)3+K2SO4+2H2SO4
应该只能考虑水解了吧- -|1年前查看全部
- 复分解反应反应物条件是:当反应物为盐盐或盐碱时反应物必须溶于水.那为什么酸发生复分解反应时不需要溶于水?
 fengxiaohui1年前2
fengxiaohui1年前2 -
 asdf7512 共回答了18个问题
asdf7512 共回答了18个问题 |采纳率94.4%事实上,我们说的酸正常情况下就是酸溶液,而碱的话一般都是固体(一般是其氧化物或氢氧化物)直接溶于水配置而成的1年前查看全部
- 关于化学配平的疑惑反应物中A元素的脚标是1,生成物脚标是2,用不用在反应物乘以2再来看升降. 假如这个:NH3 + ..
关于化学配平的疑惑
反应物中A元素的脚标是1,生成物脚标是2,用不用在反应物乘以2再来看升降. 假如这个:NH3 + ...=N2 +HNO3 +..那用不用在NH3前乘以2来配?如果乘了,那么HNO3中变几价?是不是HNO3前也要乘? iqhb1年前4
iqhb1年前4 -
 无边边 共回答了13个问题
无边边 共回答了13个问题 |采纳率76.9%一般按产物来配
反应物中A元素的脚标是1,生成物脚标是2,反应物应该乘以2再来看升降.
NH3 + ...=N2 +HNO3 +..看N2的话NH3应该乘以2来配,HNO3的话就不用了,把产物根据得失电子数相等配好后,再利用元素守恒把产物中N原子个数加起来就是NH3的系数1年前查看全部
- 对于一个可逆反应,正反应为放热反应.且反应物化学计量数大于生成物计量数.若增大压强,反应会向哪边进行
 lengbinger121年前1
lengbinger121年前1 -
 我爱西芹 共回答了21个问题
我爱西芹 共回答了21个问题 |采纳率85.7%这个还要看反应物生成物的状态
如果都是气态 那么增大压强 反应物增加的速率>生成物
则反应向正反映方向进行1年前查看全部
- 化学方程式记的多的来.求一个反应 要求:反应物,生成物全部都是固体.1楼的那个。那要在溶液里面进行好不好
 湘粤直通车1年前3
湘粤直通车1年前3 -
 4sfd9t 共回答了19个问题
4sfd9t 共回答了19个问题 |采纳率94.7%首先 我反对记方程式
铝和氧化铁在高温下会置换,生成氧化铝和铁 铁路工人用来修复铁路之类的
做多点题就会积累很多你不知道的化学式.1年前查看全部
- 充分反应是不是完全反应充分反应是不是反应物的质量全部转化为形成物?现有化学反应X+Y=Z 若将a克X和b克Y在一定条件下
充分反应是不是完全反应
充分反应是不是反应物的质量全部转化为形成物?
现有化学反应X+Y=Z
若将a克X和b克Y在一定条件下充分反应,生成物Z的质量为? 峰回路转又一村1年前2
峰回路转又一村1年前2 -
 jdfn3504 共回答了18个问题
jdfn3504 共回答了18个问题 |采纳率88.9%充分反应不是完全反应
完全反应指反应物全没了
充分反应指反应达到平衡,即反应物和生成物的量不变了
对你问题的补充:
因为该反应是不可逆反应,所以充分反应后X和Y都反应掉了,根据质量守恒Z的质量就是(a+b)g1年前查看全部
- 高中反应物含硅的化学反应是指反应物有硅单质
 candy_show1年前1
candy_show1年前1 -
 bing_zhur 共回答了21个问题
bing_zhur 共回答了21个问题 |采纳率85.7%与碱反应:2Si+H2O+2NaOH=Na2SiO3+H2 ↑与氧气:Si+O2==SiO2(加热)
与氢氟酸:Si+4HF2=SiF4+H2 ↑和其他的强氧化剂很难反应(如高锰酸钾、硝酸、硫酸等)1年前查看全部
- 1.有一种氧化物既能跟某些酸性要化物化合,又能跟某些碱性氧化物化合,但反应物都不是盐,此氧化物的化学式是_
1.有一种氧化物既能跟某些酸性要化物化合,又能跟某些碱性氧化物化合,但反应物都不是盐,此氧化物的化学式是_
2.在白色粉末A中加入B后成为蓝色溶液,向其中加入试剂C生成白色沉淀硫酸钡,过滤后向滤液中加入试剂D得到蓝色沉淀E.再次过滤后,滤液为氯化钡溶液.
根据以上现象判断:
A_ B_ C_ D_ E_
3.在硫酸钠溶液中,含有少量杂质碳酸钠,适量加入下列试剂,即可除去杂质碳酸钠有不会引入新杂质的是_.
A.硝酸银 B.硫酸 C.盐酸 D.氯化钡 兰色灵魂1年前5
兰色灵魂1年前5 -
 言留 共回答了19个问题
言留 共回答了19个问题 |采纳率89.5%1 Al2O3
2 A CuSO4
B H2O
C BaCl2
D Ba(OH)2
E Cu(OH)2 解有很多
3 B1年前查看全部
- 向2L密闭容器中加入2molN2、10molH2,发生反应,2min后N2剩1mol,求生成物和反应物的反应速率.
 dawei3291年前1
dawei3291年前1 -
 aomama 共回答了18个问题
aomama 共回答了18个问题 |采纳率83.3%v(N2)=0.25mol/L·min
v(H2)=0.75mol/L·min
v(NH3)=0.5mol/L
N2反应掉的物质的量是2-1=1mol
变化浓度是1/2=0.5mol
反应速率v=△c/t=0.5/2=0.25mol/L·min
反应速率之比等于化学计量数之比.
v(N2)/1=v(H2)/3=v(NH3)/2
v(H2)=0.75mol/L·min
v(NH3)=0.5mol/L1年前查看全部
- “如平衡向正反应方向移动时,反应物的浓度不一定都减小”请解释一下原因?
 尖笔_dd1年前4
尖笔_dd1年前4 -
 bcgzcr 共回答了11个问题
bcgzcr 共回答了11个问题 |采纳率100%如果反应物是固体或纯液体的话,那么它的浓度不变.1年前查看全部
- 1.一个反应物可以和其他两个物质反应,那么是有沉淀的反应优先进行吗?
1.一个反应物可以和其他两个物质反应,那么是有沉淀的反应优先进行吗?
2.一个反应物可以和其他两个物质反应,是先和比较不活泼的物质进行反应的吗? 黄金新娘11年前3
黄金新娘11年前3 -
 mylongsky 共回答了14个问题
mylongsky 共回答了14个问题 |采纳率78.6%1 有沉淀或者气体或者水生成的优先
2 是和能够生成不活泼的物质先反应
这些都是最简单的,你需要先弄懂课本上的内容.1年前查看全部
- al与o2反应的反应物有什么用
 clybb10061年前1
clybb10061年前1 -
 清歌盈泪 共回答了15个问题
清歌盈泪 共回答了15个问题 |采纳率93.3%氧化铝,化学式为Al2O3,刚玉型晶体接近于原子晶体,其它晶型的基本上是离子晶体,熔点为2050℃,沸点为3000℃,真密度为3.6g/cm. 它的流动性好,难溶于水,能溶解在熔融的冰晶石中.它是铝电解生产中的主要原料. 有四种同素异构体β-氧化铝 δ- 氧化铝 γ-氧化铝 α-氧化铝 ,主要有α型和γ型两种变体,工业上可从铝土矿中提取. 名称 氧化铝;刚玉;白玉;红宝石;蓝宝石;刚玉粉;corundum 化学式 Al₂O₃外观 白色晶状粉末或固体1年前查看全部
- 1、SO2能使淀粉碘化钾试纸变蓝吗 2、少量SO2通入漂白粉溶液的反应物和生成物,过量SO2呢
1、SO2能使淀粉碘化钾试纸变蓝吗 2、少量SO2通入漂白粉溶液的反应物和生成物,过量SO2呢
有把握再回答 不要误导
用高一的化学知识回答就可以了 不用太深 ColdBloodAnimal11年前1
ColdBloodAnimal11年前1 -
 海东311 共回答了18个问题
海东311 共回答了18个问题 |采纳率94.4%1.不能.SO2与KI不反应,SO2的氧化性很弱,不足以把I-氧化成I2.
但是I2+SO2+2H2O=2HI+H2SO4
2.Ca2+ + CIO- + SO2 +H2O =CI- +CaSO4(沉淀) +2H+,如果SO2过量,再发生SO2+H2O=H2SO31年前查看全部
- 金属氧化物和非金属氧化物跟水反应,反应物的条件是什么?怎么才能知道反应的氧化物溶不溶于水?
 sheyue1年前3
sheyue1年前3 -
 新妖妖 共回答了12个问题
新妖妖 共回答了12个问题 |采纳率91.7%1.碱性氧化物+水→碱
多数碱性氧化物不能跟水直接化合.判断某种碱性氧化物能否跟水直接化合,一般的方法是看对应碱的溶解性,对应的碱是可溶的或微溶的,则该碱性氧化物能与水直接化合.如:
对应的碱是难溶的,则该碱性氧化物不能跟水直接化合.如CuO、Fe2O3都不能跟水直接化合.
2.酸性氧化物+水→含氧酸
除SiO2外,大多数酸性氧化物能与水直接化合成含氧酸.如:SO21年前查看全部
- 下列反映的生成物都是单质的是1.分解过氧化氢2.电解水3.硫在氧气中燃烧4.加热分解氯酸钾2.下列说法正确的是1.反应物
下列反映的生成物都是单质的是
1.分解过氧化氢
2.电解水
3.硫在氧气中燃烧
4.加热分解氯酸钾
2.下列说法正确的是
1.反应物都是化合物
2.反映属于分解反应
3.生成物可能是氧化物
4.反应前后分子种类不变
3.蒸馏水不宜养鱼,是因为蒸馏水中几乎不含
1.水分子
2.氧元素
3.氧分子
4.氧原子 erwear1年前2
erwear1年前2 -
 阳光不锈623 共回答了20个问题
阳光不锈623 共回答了20个问题 |采纳率85%下列反应的生成物都是单质的是:( )
A.电解水 B.分解过氧化氢
C.加热高锰酸钾 D.硫在氧气中燃烧
A
2.某两种物质在一定条件下发生化学反应的微观示意如图(其中●和○分别代表两种不同的原子)
●●+○○ ○○→○●○ ○●○
对上述反应,下列说法正确的是
A.反应物都是化合物 B.反应属于分解反应 C.生成物可能是氧化物 D.反应前后分子种类不变
C
蒸馏水不宜用来养鱼,其主要原因是因为蒸馏水中几乎不含什么?
A氧元素 B氧分子 C氧原子 D氧离子
B氧分子1年前查看全部
- 浓盐酸和高锰酸钾反映为什么通过反应生成 氯化锰就可以判断氯化氢具有酸性?怎样通过生成物判断反应物是否具有酸性
 kolan8881年前1
kolan8881年前1 -
 jjslm 共回答了14个问题
jjslm 共回答了14个问题 |采纳率92.9%生成盐了mncl和kcl 说明酸与盐反映生成了新盐 叫做酸的通性1年前查看全部
- 为什么化学平衡正向移动,反应物转化率升高
 zhiyong19711年前1
zhiyong19711年前1 -
 今日风采 共回答了11个问题
今日风采 共回答了11个问题 |采纳率100%转化率=(反应前反应物的物质的量-反应后反应物的物质的量)/反应前反应物的物质的量.化学平衡正向移动,就是反应物反应的更多了,反应后反应物的物质的量减少,所以转化率升高1年前查看全部
大家在问
- 1设函数f(x)等于x三次方/3-(1+a)x平方/2+ax+2a/3 .第一问求f(x)单调区间
- 2EXCEL如果两列值相等自动向目标列填入一个固定的值函数怎么写如A;1,B;1如A=B的话C=1如果不等的话C=9
- 3x为锐角,sin(x+2分之π)=4分之1,(1)求sinx(2)求tan(x+4分之π)
- 4初三生物题(急)单选题1、人体内消化脂肪的器官、所需要的酶、消化的终产物、吸收器官分别是( ) A 胆囊、胆汁、脂肪微粒
- 5Hampton Inns的中文名是什么
- 6在一个电路中,若有多个理想电流源,这些电流源可以直接叠加吗?若是有多个理想电压源呢?
- 7英语翻译:她的亲戚帮助她继续她的学业
- 8关于 子夏曰 博学而笃志 切问而近思 人在其中矣 的文言知识
- 9物体随钭面传送带匀速转动受什么摩察力
- 10英语翻译reconcile the vendor accounts periodically and follow up
- 11已知质量,m=1kg的物体在倾角α=37°的斜面上,恰能匀速下滑.当对该物体施加一个沿斜面向上的推力F时,物体恰能匀速上
- 12工商人员在某商店的一堆大米中,随意抽查了8袋25千克装的大米,其中4袋平均重24.98千克,另4袋平均重25千克,则8袋
- 13一个草字头下面是平字,是什么字啊?
- 14三角形ABC的外接圆的圆心为O 两条边上的高的交点为H
- 15“凿壁借光”的典故与谁有关?
