在100mL混合酸中,HNO3和H2SO4的物质的量浓度分别为0.4mol/L和0.1mol/L,向其中加入1.92g铜
 婚后女人亭亭2022-10-04 11:39:541条回答
婚后女人亭亭2022-10-04 11:39:541条回答A. 0.225mol/L
B. 0.15mol/L
C. 0.35mol/L
D. 0.45mol/L

已提交,审核后显示!提交回复
共1条回复
 腼腆的郎 共回答了17个问题
腼腆的郎 共回答了17个问题 |采纳率94.1%- 解题思路:根据n=[m/M]计算1.92g铜物质的量,铜屑投入HNO3和H2SO4的混合溶液中发生的反应:3Cu+8H++2NO3-=3Cu2++2NO+4H2O,结合铜、硝酸根、氢离子的物质的量根据离子方程式进行过量计算,再根据不足的物质计算铜离子的物质的量,结合c=[n/V]计算铜离子浓度.
溶液中的氢离子包括硝酸、硫酸电离的,所以n(H+)=0.4mol/L×0.1L+0.1mol/L×0.1L×2=0.06mol,n(NO3-)n=0.4mol/L×0.1L=0.04mol,1.92g铜的物质的量为[1.92g/64g/mol]=0.03mol,则:
3Cu+8 H++2 NO3-=3Cu2++2NO+3H2O
3 8 2
0.03mol 0.08mol 0.02mol
所以氢离子的物质的量不足,根据氢离子的物质的量计算,由离子方程式可知0.06mol氢离子反应,生成的铜离子的物质的量为0.06mol×[3/8]=0.0225mol,所以溶液中c(Cu2+)=[0.0225mol/0.1L]=0.225mol/L,
故选A.点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 本题考查物质的量浓度的计算,题目难度中等,关键是把握反应的离子方程式,根据离子方程式判断反应的过量问题. - 1年前
相关推荐
- 在100mL混合酸的溶液中,硝酸的物质的量浓度为0.5mol/L,硫酸的物质的量浓度为0.15mol/L.向其中加入5.
在100mL混合酸的溶液中,硝酸的物质的量浓度为0.5mol/L,硫酸的物质的量浓度为0.15mol/L.向其中加入5.76g铜粉,微热,使其充分反应.(忽略体积变化)
(1)求溶液中Cu2+的物质的量浓度.
(2)若要使5.76g铜粉完全溶解,且溶液中只存在一种盐,则原溶液中的硝酸和硫酸的物质的量浓度应分别为多少? 晨曦20011年前1
晨曦20011年前1 -
 Parksa12 共回答了21个问题
Parksa12 共回答了21个问题 |采纳率85.7%解题思路:(1)依据离子方程式:3Cu+2NO3-+8H+=3Cu2++2NO+4H2O计算解答;
(2)若要使5.76g铜粉完全溶解,且溶液中只存在一种盐,则硝酸根离子应完全反应,最后剩余盐为硫酸铜.(1)混合酸中硝酸的物质的量为:n(HNO3)=0.1L×0.5mol/L=0.05mol,硫酸的物质的量为:n(H2SO4)=0.1L×0.15moL/L=0.015moL,
溶液中所含氢离子的物质的量为:n(H+)=0.05moL+2×0.015moL=0.08mol,铜的物质的量为:n[5.76g/64g/mol]=0.09mol,则:
3Cu+2NO3-+8H+=3Cu2++2NO+4H2O
3 2 8
0.03mol 0.02mol 0.08mol
由上述计算可知,H+不足,应该根据H+计算,由方程式可知n(Cu2+)=[3/8]n(H+)=[3/8]×0.08mol=0.03mol,
所以C(Cu2+)=[0.03mol/0.1L]=0.3 mol/L,
答:溶液中Cu2+的物质的量浓度为:0.3 mol/L;
(2)依据方程式3Cu+2NO3-+8H+=3Cu2++2NO+4H2O,
要使0.09molCu完全反应,需要消耗的硝酸根离子的物质量的为:0.09mol×[2/3]=0.06mol,
依据氮原子个数守恒可知n(HNO3)=n(NO3-)=0.06mol;
要使0.09molCu完全反应,需要消耗的氢离子的物质量的为:0.09mol×[8/3]=0.24mol,
依据氢离子个数守恒得0.24mol=n(HNO3)+2n(H2SO4)=0.06mol+2n(H2SO4),解得:n(H2SO4)=0.09 mol,
C(HNO3)=[0.06mol/0.1L]=0.6mol/L;
C(H2SO4)=[0.09mol/0.1L]=0.9mol/L,
答:原溶液中的硝酸和硫酸的物质的量浓度应分别为0.6mol/L和0.9mol/L.点评:
本题考点: 硝酸的化学性质;离子方程式的有关计算.
考点点评: 本题考查了硝酸的有关计算,明确利用离子反应方程式计算是解题的关键,题目难度中等.1年前查看全部
- 写出下列反应方程式(1)苯乙烯的加聚反应:___________________;(2)甲苯与浓硫酸、浓硝酸的混合酸在1
写出下列反应方程式
(1)苯乙烯的加聚反应:___________________;
(2)甲苯与浓硫酸、浓硝酸的混合酸在100℃时生成三取代产物:________________;
(3)2-氯丙烷与氢氧化钠水溶液共热:_____________________;
(4)向苯酚钠溶液中通入过量二氧化碳:__________________;
(5)丙醛发生银镜反应:____________________;
(6)对苯二甲酸和乙二醇作用形成高分子酯:___ +_____→
+_____→ +______;
+______;
(7)2-甲基-1-丁醇发生消去反应_____________________ 30c69r94yuaug1年前1
30c69r94yuaug1年前1 -
 5utrjyu 共回答了28个问题
5utrjyu 共回答了28个问题 |采纳率92.9%(1)苯乙烯发生加聚反应生成聚苯乙烯,该反应为
,故答案为: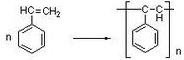 ;
;
(2)发生取代反应生成2,4,6-三硝基甲苯,该反应为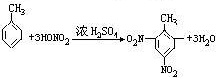 ,
,
故答案为:
(3)发生水解反应生成2-丙醇,该反应为CH 3 CHClCH 3 +H 2 O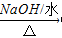 CH 3 CHOHCH 3 +HCl,故答案为:CH 3 CHClCH 3 +H 2 O
CH 3 CHOHCH 3 +HCl,故答案为:CH 3 CHClCH 3 +H 2 O 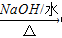 CH 3 CHOHCH 3 +HCl;
CH 3 CHOHCH 3 +HCl;
(4)反应生成苯酚和碳酸氢钠,该反应为C 6 H 5 ONa+CO 2 +H 2 O→C 6 H 5 OH+NaHCO 3 ,故答案为:C 6 H 5 ONa+CO 2 +H 2 O→C 6 H 5 OH+NaHCO 3 ;
(5)反应生成丙酸氨、Ag、氨气、水,该反应为CH 3 CH 2 CHO+2Ag(NH 3 ) 2 OH→CH 3 CH 2 COONH 4 +H 2 O+2Ag+3NH 3 ↑,故答案为:CH 3 CH 2 CHO+2Ag(NH 3 ) 2 OH→CH 3 CH 2 COONH 4 +H 2 O+2Ag+3NH 3 ↑;
(6)发生缩聚反应生成聚酯,该反应为
n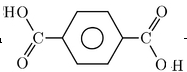 +nOHCH 2 CH 2 OH→
+nOHCH 2 CH 2 OH→ +2nH 2 O,
+2nH 2 O,
故答案为: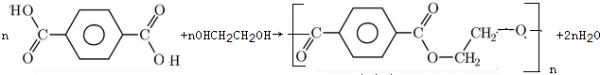
(7)发生消去反应2-甲基-1-丁烯,该反应为OHCH 2 CH(CH 3 )CH 2 CH 3 CH 2 =C(CH 3 )CH 2 CH 3 +H 2 O,故答案为:OHCH 2 CH(CH 3 )CH 2 CH 3
CH 2 =C(CH 3 )CH 2 CH 3 +H 2 O,故答案为:OHCH 2 CH(CH 3 )CH 2 CH 3  CH 2 =C(CH 3 )CH 2 CH 3 +H 2 O.
1年前查看全部
CH 2 =C(CH 3 )CH 2 CH 3 +H 2 O.
1年前查看全部
- 用K2Cr2O7滴定Fe2 之前,为什么要加H2SO4-H3PO4混合酸溶液
 sgreatlight1年前1
sgreatlight1年前1 -
 小翠1979 共回答了16个问题
小翠1979 共回答了16个问题 |采纳率93.8%酸性条件下氧化性更强1年前查看全部
- 如何配置硫磷混合酸.怎样配置才最安全.对人体伤害最小.我现在的配置比例是 400毫升磷酸。再加入600毫升硫酸。这样的操
如何配置硫磷混合酸.
怎样配置才最安全.对人体伤害最小.
我现在的配置比例是 400毫升磷酸。再加入600毫升硫酸。
这样的操作怎么最安全。
------------------------------- wygyaya721年前1
wygyaya721年前1 -
 songhua127 共回答了23个问题
songhua127 共回答了23个问题 |采纳率87%两个的浓度呢?要是很稀的话随便一倒就行了……1年前查看全部
- 在100毫升混合酸的溶液中,硝酸的物质的量浓度为0.5mol/L,硫酸的物质的量的浓度为0.15mol/L.向其中加入5
在100毫升混合酸的溶液中,硝酸的物质的量浓度为0.5mol/L,硫酸的物质的量的浓度为0.15mol/L.向其中加入5.76g的铜粉,微热,使其充分反应,反应后的溶液体积仍为100毫升.
1.求溶液中Cu2+的物质的量浓度.
2.若要使5.76g铜粉完全溶解,且溶液中只存在一种盐,则原溶液中的硝酸和硫酸的物质的量浓度应分别是多少? caigen19811年前1
caigen19811年前1 -
 境界影视 共回答了17个问题
境界影视 共回答了17个问题 |采纳率88.2%Cu有部分没反应完.溶液中它的物质的量浓度为0.4mol/L1年前查看全部
- 硫酸和硝酸的混合酸溶液中硫酸的量浓度怎么求
硫酸和硝酸的混合酸溶液中硫酸的量浓度怎么求
有一硫酸和硝酸的混合溶液,取10ML该混合溶液加入足量BaCl2溶液,得到4.66g沉淀,过滤后滤液跟2mol/L的NaOH溶液反映,恰好中和时用去NaOH溶液25mL.
计算(1)原混合酸溶液的物质的量浓度
(2)原混合溶液中,H+离子的物质的量浓度 jdsq1年前1
jdsq1年前1 -
 秋林1937 共回答了23个问题
秋林1937 共回答了23个问题 |采纳率87%(1)
(硝酸与氯化钡不反应)
H2SO4 + BaCl2 → BaSO4↓ + 2HCl
--98---------------233-------73
--x----------------4.66g-----y
解得:
x = 1.96g,y = 1.46g
硫酸的物质的量=1.96g / 98g/mol = 0.02mol
硫酸的物质的量浓度=0.02mol / 0.01L = 2mol/L
根据H2SO4 + BaCl2 → BaSO4↓ + 2HCl
生成的HCl物质的量=1.46g / 36.5g/mol = 0.04mol
而使用氢氧化钠2mol/L共计25ml
NaOH物质的量=2mol/L * 0.025L = 0.05mol
无论是硝酸还是盐酸与氢氧化钠反应配平系数都是1:1
所以0.04molHCl消耗0.04molNaOH
NaOH剩余0.01mol
题目说恰好中和时用去NaOH溶液25ml
则说明硝酸物质的量必然为0.01mol
所以硝酸物质的量浓度=0.01mol/0.01L = 1mol/L
(2)
硝酸为一元强酸,0.01mol电离出氢离子0.01mol
硫酸为二元强酸,0.02mol电离出氢离子0.04mol
所以氢离子浓度[H+] = (0.01mol + 0.04mol)/0.01L =5mol/L1年前查看全部
- 滴定Fe前加入硫—磷混合酸的目的是什么
 red4771年前2
red4771年前2 -
 hallojin 共回答了21个问题
hallojin 共回答了21个问题 |采纳率85.7%硫酸的作用是维持体系的酸性环境,因为氧化剂重铬酸钾只在酸性环境下具有较强的氧化能力.
磷酸的作用是与产物Fe3+形成无色的配离子,消除Fe3+的颜色对滴定终点判定的干扰.1年前查看全部
- 在100mL混合酸中,HNO3和H2SO4的物质的量浓度分别为0.4mol/L和0.1mol/L,向其中加入1.92g铜
在100mL混合酸中,HNO3和H2SO4的物质的量浓度分别为0.4mol/L和0.1mol/L,向其中加入1.92g铜粉,待其充分反应后,所得溶液中Cu2+的物质的量浓度是( )
A. 0.225mol/L
B. 0.15mol/L
C. 0.35mol/L
D. 0.45mol/L 可怜的小鱼1年前2
可怜的小鱼1年前2 -
 yydcok 共回答了19个问题
yydcok 共回答了19个问题 |采纳率68.4%解题思路:根据n=[m/M]计算1.92g铜物质的量,铜屑投入HNO3和H2SO4的混合溶液中发生的反应:3Cu+8H++2NO3-=3Cu2++2NO+4H2O,结合铜、硝酸根、氢离子的物质的量根据离子方程式进行过量计算,再根据不足的物质计算铜离子的物质的量,结合c=[n/V]计算铜离子浓度.溶液中的氢离子包括硝酸、硫酸电离的,所以n(H+)=0.4mol/L×0.1L+0.1mol/L×0.1L×2=0.06mol,n(NO3-)n=0.4mol/L×0.1L=0.04mol,1.92g铜的物质的量为[1.92g/64g/mol]=0.03mol,则:
3Cu+8 H++2 NO3-=3Cu2++2NO+3H2O
3 8 2
0.03mol 0.08mol 0.02mol
所以氢离子的物质的量不足,根据氢离子的物质的量计算,由离子方程式可知0.06mol氢离子反应,生成的铜离子的物质的量为0.06mol×[3/8]=0.0225mol,所以溶液中c(Cu2+)=[0.0225mol/0.1L]=0.225mol/L,
故选A.点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 本题考查物质的量浓度的计算,题目难度中等,关键是把握反应的离子方程式,根据离子方程式判断反应的过量问题.1年前查看全部
- 在50mL稀硝酸、稀盐酸的混合酸中,加入100mL0.2mol/LNaOH溶液正好中和;另取50ml这种混合酸加入过量硝
在50mL稀硝酸、稀盐酸的混合酸中,加入100mL0.2mol/LNaOH溶液正好中和;另取50ml这种混合酸加入过量硝酸银溶液时,可产生0.7175g白色沉淀.计算混合酸中硝酸和盐酸的物质的量浓度分别为多少?
解析:硝酸、盐酸与氢氧化钠反应的方程式为:
HNO3 + NaOH = NaNO3 + H2O
HCl + NaOH = NaCl + H2O
可见硝酸、盐酸分别与氢氧化钠反应的物质的量之比都是1:1.
所以硝酸和盐酸的物质的量之和是:0.2mol/L×0.1L=0.02mol.
另取50ml这种混合酸加入过量硝酸银溶液时,反应如下:
HCl + AgNO3 = AgCl ↓+ HNO3
1mol 143.5g
n 0.7175g
n= 0.005mol
所以盐酸的物质的量浓度为:c(HCl)=0.1mol/L
硝酸的物质的量浓度为:
c(HNO3)=
=0.3mol/L
HCl + AgNO3 = AgCl ↓+ HNO3
1mol 143.5g
n 0.7175g
n= 0.005mol
是依据什么列出的比例的呢? 张胜利开心宝1年前1
张胜利开心宝1年前1 -
 我的游戏 共回答了24个问题
我的游戏 共回答了24个问题 |采纳率91.7%这道题我会 一摩尔盐酸对应生成143.5克的氯化银( 因为氯化银的相对分子量是143.5克每摩尔)而本题设混合酸中盐酸为N摩尔 最后得到沉淀0.7175克 1/n=143.5/0.7175 最后算出n为0.005摩尔1年前查看全部
- 苯与浓硫酸浓硝酸混合酸100度到110度反应方程式
 生活是什么啊1年前2
生活是什么啊1年前2 -
 wmopc 共回答了18个问题
wmopc 共回答了18个问题 |采纳率88.9%C6H6+2HNO3——>C6H4(NO2)2(两硝基处于间位)+2H2O
该温度主要生成二硝基取代物,而硝基是间位定位基,第二个硝基会取代前一个硝基的间位.1年前查看全部
- 分析化学中判断能否分步滴定cka>10-8时,在求多元酸和混合酸的c的时候有什么不同.如用0.1mol/L的NaOH滴定
分析化学中判断能否分步滴定cka>10-8时,在求多元酸和混合酸的c的时候有什么不同.如用0.1mol/L的NaOH滴定
0.1mol/LH2B是为什么Cka1>10-8中C是0.050.而用0.1mol/LNaOH滴定0.1mol/L的甲酸和等浓度的氯化铵的混合溶液时,ck甲酸>10-8,c为0.1,为什么不像多元酸一样为0.05. 野蛮部落1年前1
野蛮部落1年前1 -
 张之恒 共回答了15个问题
张之恒 共回答了15个问题 |采纳率80%这种判别本身就是粗略估计,所以浓度不会很强调,有时考虑稀释引起的浓度变化,有时还用0.1M.1年前查看全部
- 某100mL混合酸溶液中,HNO3物质的量浓度为0.2mol/L,H2SO4的物质的量浓度为0.3mol/L.向其中加入
某100mL混合酸溶液中,HNO3物质的量浓度为0.2mol/L,H2SO4的物质的量浓度为0.3mol/L.向其中加入2.克铜,充
反应后,溶液体积仍为100mL求(1)反应后溶液中氢离子和硝酸根离子的物质的量是?(2)反应后溶液中铜离子的物质的量浓度是多少?(3)产生气体体积是多少升?(标况下) 烙心1年前1
烙心1年前1 -
 莫女士 共回答了14个问题
莫女士 共回答了14个问题 |采纳率92.9%因为是混合酸,所以需要用离子方程式解答
3Cu + 8H+ + 2NO3^- = 3Cu2+ + 2NO + 4H2O
3*64--------8-------------------2-----------3
2.56----(0.4*0.1+0.2*2*0.1)----0.4*0.1
经判断,3组数据,Cu过量,NO3^-过量,所以,用H+的量进行计算
所以,n(Cu2+)=0.03mol
即,浓度为0.3mol/L1年前查看全部
- 某稀硫酸和稀硝酸的混合溶液中c(SO42-)+c(NO3-)=2.5 mol•L-1.取200mL该混合酸,则能溶解铜的
某稀硫酸和稀硝酸的混合溶液中c(SO42-)+c(NO3-)=2.5 mol•L-1.取200mL该混合酸,则能溶解铜的最大质量为( )
A.12.8g
B.19.2g
C.32.0g
D.38.4g susan_zt1年前1
susan_zt1年前1 -
 jkdssdiosdoq 共回答了19个问题
jkdssdiosdoq 共回答了19个问题 |采纳率84.2%解题思路:反应的离子方程式为3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,要使溶解铜的质量最大,则氢离子和硝酸根浓度满足化学计量数即4:1,硝酸全部起氧化剂作用,设硫酸浓度为x,则硝酸浓度为:2.5mol/L-x,溶液中氢离子浓度共:2x+(2.5mol/L-x),则:
=4:1,解得x=1.5mol/L,硝酸浓度为1mol/L,根据方程式可计算溶解铜的质量.2x+(2.5mol/L−x) 2.5mol/L−x 反应的离子方程式为3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,要使溶解铜的质量最大,则氢离子和硝酸根浓度满足化学计量数即4:1,硝酸全部起氧化剂作用,设硫酸浓度为x,则硝酸浓度为:2.5mol/L-x,溶液中氢离子浓度共:2x+(2.5mol/L-x),则:
2x+(2.5mol/L−x)
2.5mol/L−x=4:1,解得x=1.5mol/L,硝酸浓度为1mol/L,硝酸得物质的量为:0.2L×1mol/L=0.2mol,
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
3×64g 2mol
m 0.2mol
m=[3×64g×0.2mol/2mol]=19.2g,
故选B.点评:
本题考点: 离子方程式的有关计算.
考点点评: 本题考查了硝酸与铜反应的计算,计算的关键是根据反应原理判断出当符合化学计量数之比时反应消耗铜最多.1年前查看全部
- 两道化学计算题!急!1.在某100mL混合酸中,硝酸的物质的量浓度为0.4mol/L ,硫酸的浓度为0.2mol/L.向
两道化学计算题!急!
1.在某100mL混合酸中,硝酸的物质的量浓度为0.4mol/L ,硫酸的浓度为0.2mol/L.向其中加入2.56g铜粉,微热,充分反应后溶液中铜离子的物质的量浓度为_______.
2. 0.96克Mg跟含6.3g HNO3的稀溶液恰好完全反应,则HNO3还原产物的相对分子质量为_______.
其中第一题我是这样想的:因为硫酸浓度只有0.2mol/L,所以是稀硫酸,不能和铜反应.又因为硝酸的浓度为0.4mol/L,所以为稀硫酸,还原产物为NO,且要完全溶解铜粉需要0.04*(8/3)≈0.11mol的硝酸,所以铜过量,需要按照硝酸的量为标准计算.所以消耗的铜的物质的量为0.4mol/L * 0.1L * (3/8) = 0.015mol,所以n(Cu2+)=n(Cu)=0.015mol,c(Cu2+)=0.015/0.1 = 0.15mol/L.可是答案说是0.3mol/L,不懂为什么.
第二题我这样想:设还原产物的化学式为NOx,则还原产物中氮的化合价为+2x,由得失电子守恒可以得n(Cu)*2 = n(气体)*(5-2x),又由氮原子守恒可得n(Cu)*2 + n(气体)=n(HNO3),将两式联立可得x=1/2,所以还原产物的化合价为+1,还原产物为N2O,所以其相对分子质量为44.但是答案上除了44以外还有一个80,不知怎么搞的. 嫣嫣宝贝1年前1
嫣嫣宝贝1年前1 -
 wfkwujie 共回答了15个问题
wfkwujie 共回答了15个问题 |采纳率93.3%第一问:因为是有硫酸所以就不可以用化学方程式求解要用离子方程式来求解了
3Cu+2NO3- +8H+=Cu2+ +2NO(气体上升)+2H2O
所以要完全溶解同分需要0.04*(2/3)≈0275mol的硝酸根离子 和 0.11mol的氢离子 所以要用氢离子来计算铜的量了
氢离子有0.02*2+0.04*1=0.08mol
所以Cu2+就有0.03mol了
第二题
要分两种情况了
一种情况是还有其它酸的混合溶液硝酸根离子全部做氧化剂
另一种情况就是硝酸即显氧化性又显酸性
提示的可以了吧自己做吧 - - 我只是考完了特别空虚其实也懒了 - -1年前查看全部
- 化学选择题一道在100mL盐酸、硝酸的混合酸中,HNO3的物质的量浓度为0.2mol/L,HCl的物质的量浓度为0.1m
化学选择题一道
在100mL盐酸、硝酸的混合酸中,HNO3的物质的量浓度为0.2mol/L,HCl的物质的量浓度为0.1mol/L.向其中加入0.96g铜粉微热,待充分反应后,溶液中Cu2+的物质的量浓度约为
A、 0.075mol/L B、 0.1125mol/L C、 0.15mol/L D、0.225mol/L
选B,求正解 彬彬动1年前1
彬彬动1年前1 -
 zxl88222 共回答了24个问题
zxl88222 共回答了24个问题 |采纳率87.5%0.96g铜粉=0.015mol,n(NO3-)=0.02mol,n(H+)=0.03mol
3Cu+2NO3- + 8H+==3Cu2+ + 2NO+4H2O
3mol 2mol 8mol
0.015mol 0.01mol 0.04mol
可见氢离子不足,生成铜离子按照氢离子计算,设为Xmol
3:8=X:0.03,X=0.01125(mol)
溶液中Cu2+的物质的量浓度=0.01125/0.1=0.1125(mol/L)
选B1年前查看全部
- 盐酸会不会影响光度法测定硼酸我们要做盐酸和硼酸混合酸的各组分含量的测定,想用光度法测出硼酸含量,分别测出两种酸的质量,不
盐酸会不会影响光度法测定硼酸
我们要做盐酸和硼酸混合酸的各组分含量的测定,想用光度法测出硼酸含量,分别测出两种酸的质量,不知道可不可行, chandlerqian1年前2
chandlerqian1年前2 -
 容家良品 共回答了21个问题
容家良品 共回答了21个问题 |采纳率90.5%可行性还是有的,就是可能会碰到一些困难,从而影响到实验数据的,建议可以多做几次,这样有个对比性,做出来的结果相对会准一点.1年前查看全部
- 小忻和小燕合作测定盐酸、硫酸组成的混合酸中溶质的质量分数,设计并进行了如下两个探究实验:
小忻和小燕合作测定盐酸、硫酸组成的混合酸中溶质的质量分数,设计并进行了如下两个探究实验:
【实验1】 取20g该混合酸并分成4等份,然后分别加入一定量未知质量分数的BaCl 2 溶液,实验记录如下: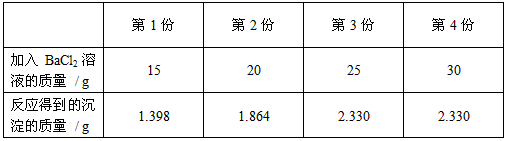
【实验2】 将【实验1】中的第4份反应液过滤,再向滤液中逐滴加入10%的NaOH溶液,通过pH测定仪打印出加入NaOH溶液的质量与烧杯中溶液pH的关系如下图: 
【数据处理】小忻依据【实验1】沉淀的质量计算出混合酸中H 2 SO 4 的质量分数。小燕依据【实验2】求混合酸中HCl的质量分数,过程如下:
【解】设混合酸中HCl的质量分数为ω。
HCl + NaOH = NaCl + H 2 O
解得:ω=0.1825=18.25%
现请你参与探究并完成相关问题。(可能用到的相对分子质量:H 2 SO 4 -98 BaSO 4 -233 BaCl 2 -208 )
(1)【实验1】中发生反应的化学方程式为 _______________。
(2)小忻测出原混合酸中H 2 SO 4 的质量分数为 ________________(保留三位有效数字)。
(3)小燕计算出混合酸中HCl的质量分数会_______ (填“偏高”、“偏低”或“无影响”),理由是__________ (如“无影响”,本空不作答)。 miu_miu99991年前1
miu_miu99991年前1 -
 孤单蚂蚁之宁静 共回答了18个问题
孤单蚂蚁之宁静 共回答了18个问题 |采纳率83.3%(1)BaCl 2 +H 2 SO 4 =2HCl+BaSO 4
(2)19.6%
(3)偏高 ; 因为BaCl 2 与H 2 SO 4 反应后有盐酸生成,从而使滤液中的盐酸的质量增大。1年前查看全部
- 小璐和小磊合作测定盐酸、硫酸组成的混合酸中溶质的质量分数,设计进行了如下两个探究实验:
 小璐和小磊合作测定盐酸、硫酸组成的混合酸中溶质的质量分数,设计进行了如下两个探究实验:
小璐和小磊合作测定盐酸、硫酸组成的混合酸中溶质的质量分数,设计进行了如下两个探究实验:
[实验1]取20g该混合酸并分成4等份,分别加入一定量未知质量分数的BaCl2溶液,记录如下:
[实验2]将实验1中的第4份反应液过滤,再向滤液中逐滴加入10%的NaOH溶液,通过pH测定仪打印出加入NaOH溶液的质量与烧杯中溶液pH的关系如图:第1份 第2份 第3份 第4份 加入BaCl2溶液的质量/g 15 20 25 30 反应得到的沉淀的质量/g 1.398 1.864 2.330 2.330
[数据处理]
小璐依据[实验1]沉淀的质量计算出混合酸中H2SO4的质量分数.
小磊依据[实验2]求混合酸中HCl的质量分数,过程如下:
解:设混合酸中HCl的质量分数为ω.
HCl+NaOH=NaCl+H2O
36.540
[20g/4]×ω 10g×10%
解得:ω=0.1825=18.25%
现请你参与探究并完成相关问题.
(1)[实验1]中发生反应的化学方程式为______.
(2)根据小璐的计算,测出原混合酸中H2SO4的质量分数为多少?(保留三位有效数字).
[反思交流]小磊计算出混合酸中HCl的质量分数会______(填“偏高”、“偏低”或“无影响”),理由是______
(如“无影响”,本空不作答). 大葱蘸甜面酱1年前1
大葱蘸甜面酱1年前1 -
 freebird0827 共回答了19个问题
freebird0827 共回答了19个问题 |采纳率84.2%解题思路:可以根据质量守恒定律正确书写化学方程式.根据相关计算方法进行有关的计算.例如,求硫酸的质量分数时,可以根据化学方程式求出硫酸的质量,再用硫酸的质量除以混合溶液的质量就是硫酸的质量分数.(1)氯化钡和硫酸反应的化学方程式为:BaCl2+H2SO4=2HCl+BaSO4↓.
(2)设硫酸的质量分数为x
BaCl2+H2SO4=2HCl+BaSO4↓
98 233
5g×x 2.330g
[98/5g×x
233
2.330g]
x=19.6%
答:硫酸的质量分数是19.6%.
(3)因为氯化钡和硫酸反应生成了氯化氢,所以结果应该偏高.故填:偏高;因为BaCl2与H2SO4反应后有盐酸生成,从而使滤液中的盐酸的质量增大.点评:
本题考点: 实验探究物质的组成成分以及含量;有关溶质质量分数的简单计算;根据化学反应方程式的计算.
考点点评: 本题主要考查了溶液的质量分数求法、书写化学方程式等方面的问题.1年前查看全部
- 为什么配制硫酸和水混合或者硫酸和硝酸混合酸都是硫酸最后加?
 scancai1年前3
scancai1年前3 -
 Ly02006 共回答了18个问题
Ly02006 共回答了18个问题 |采纳率88.9%水与硝酸(尽管是浓硝酸也含有很大比例的水)【除了发烟硝酸】中的水与硫酸混合放热,使水沸腾,硫酸尽管最后加,也要小心缓慢地,沿着杯壁,使之与水均匀混合,若向硫酸中加水,少量的水立即沸腾,故会将硫酸液滴“那什么”出来,发生危险!1年前查看全部
- 盐酸硝酸氢氟酸混合酸会产生什么气体
盐酸硝酸氢氟酸混合酸会产生什么气体
如题,请问盐酸、硝酸、氢氟酸这三种混合酸会产生什么气体 海域石头1年前4
海域石头1年前4 -
 k3810215 共回答了12个问题
k3810215 共回答了12个问题 |采纳率91.7%基本上是王水分解的气体
盐酸与硝酸混合液里按一定比例混合液就是王水,由于硝酸的强氧化性,溶液里的氯离子逐渐被氧化:HNO3 + 3HCl===2H2O + Cl2 + NOCl、2HNO3 + 2HCl===2NO2 + CI2 + 2H2O
至于氢氟酸是很稳定的,没啥变化
所以会生成的气体有:Cl2、NOCl、NO2、HCI、HF(后两者是它们的挥发性所致)1年前查看全部
- 实验设计 测定盐酸和磷酸混合酸的含量
 宇轩231年前2
宇轩231年前2 -
 雪融为春 共回答了26个问题
雪融为春 共回答了26个问题 |采纳率80.8%先用标准氯化钙溶液滴定磷酸浓度,再用标准硝酸银溶液滴定盐酸浓度.因为磷酸银微溶,磷酸钙不溶解;氯化银不溶解.1年前查看全部
- 怎么测定硫酸和磷酸混合酸中各组分的含量
 piaohua_19871年前3
piaohua_19871年前3 -
 coco34 共回答了19个问题
coco34 共回答了19个问题 |采纳率94.7%我认为可以用钼蓝法测磷也可以.1年前查看全部
- 盐酸和硼酸混合酸浓度的测定实验怎样设计啊!
盐酸和硼酸混合酸浓度的测定实验怎样设计啊!
特别是指示剂的选用!脑子笨,请高手出手相助! 糊丝嫩裳1年前1
糊丝嫩裳1年前1 -
 gy_97214 共回答了16个问题
gy_97214 共回答了16个问题 |采纳率87.5%先以酚酞做指示剂,用碱溶液滴定测出盐酸,此时硼酸没有被滴定.
然后加入中性甘油,用碱溶液机械滴定,此时硼酸被滴定.
最后,分别计算.1年前查看全部
- 若废酸是盐酸硫酸硝酸的混合酸,则从反应产物在农业上再利用角度考虑,固体最好选用纯碱 还是小苏打还是碳
若废酸是盐酸硫酸硝酸的混合酸,则从反应产物在农业上再利用角度考虑,固体最好选用纯碱 还是小苏打还是碳
碳酸氢铵 新A09911年前1
新A09911年前1 -
 Γ九五二七 共回答了13个问题
Γ九五二七 共回答了13个问题 |采纳率76.9%用碳酸氢铵最好,产物分别为氯化铵,硫酸铵,和硝酸铵,都是化肥,可以直接用于农业生产1年前查看全部
- 硫酸和硝酸配制混合酸需要排放废水么
 laotou7061年前1
laotou7061年前1 -
 irenelinlin 共回答了26个问题
irenelinlin 共回答了26个问题 |采纳率100%混合酸总有用剩下的吧,用完之后总会变成其他的酸性废水吧,配完的瓶子得洗洗吧.
所以废水是一定的,量多量少而已1年前查看全部
- 设计化学实验 硫酸、盐酸混合酸含量测定
设计化学实验 硫酸、盐酸混合酸含量测定
需要具体操作步骤哦 聂方华1年前1
聂方华1年前1 -
 迷仙 共回答了17个问题
迷仙 共回答了17个问题 |采纳率88.2%先用NaOH滴定到中性,再用BaCl2滴定到取上层清液不再形成沉淀.后者先算出H2SO4多少,再用两者一起算HCl多少1年前查看全部
- 先制混合酸,冷却后,再加入苯,那么不怕酸液飞溅吗?
先制混合酸,冷却后,再加入苯,那么不怕酸液飞溅吗?
对比稀释浓硫酸的时候要现加水,后加浓硫酸 遗弃的躯壳1年前1
遗弃的躯壳1年前1 -
 hhhxxxjjj123 共回答了15个问题
hhhxxxjjj123 共回答了15个问题 |采纳率93.3%浓硫酸加水会放出大量热是因为浓硫酸能与水反应生成水合硫酸..苯是不会发生这种反应的,所以加入苯不会发生飞溅的情况...1年前查看全部
- 铜和混合酸反应.为什么会有氢离子过量这种情况,硝酸根离子不是永远都存在溶液中吗 因为一直都有硝酸铜生成,那么硝酸更离子是
铜和混合酸反应.为什么会有氢离子过量这种情况,硝酸根离子不是永远都存在溶液中吗 因为一直都有硝酸铜生成,那么硝酸更离子是不是不会被消耗完?(消耗了又生成了) 所以只要氢离子足量,就始终会形成硝酸,
 羽毛飘飘飞1年前3
羽毛飘飘飞1年前3 -
 bankrupt 共回答了22个问题
bankrupt 共回答了22个问题 |采纳率90.9%你把铜和稀硝酸反应的化学方程式改成离子方程式,然后将铜,氢离子,硝酸根三个物质的量都带入离子方程式,你就明白怎么回事了,1年前查看全部
- 现有98克纯硫酸和纯磷酸的混合酸,测得其中含氧元素百分之63.5则该混合酸中硫酸和磷酸的物
现有98克纯硫酸和纯磷酸的混合酸,测得其中含氧元素百分之63.5则该混合酸中硫酸和磷酸的物
现有98克纯硫酸和纯磷酸的混合酸,测得其中含氧元素百分之63.5则该混合酸中硫酸和磷酸的物质的量之比是多少?这是什么逻辑? 猛为自己鼓掌1年前3
猛为自己鼓掌1年前3 -
 hyphdx 共回答了16个问题
hyphdx 共回答了16个问题 |采纳率100%你好!
这主要是根据氧元素的含量来算的,硫酸是H2S04,4个氧原子,磷酸是HP04,也是4个
设硫酸为X,磷酸为Y
就有:X+Y=98,[(64/98)X+(64/96)Y]/X+Y=0.635
这两个方程可以算出X、Y的值1年前查看全部
- 用什么混合酸溶解钢材最快?(王水不行)
 被冻僵的火山1年前2
被冻僵的火山1年前2 -
 siming51 共回答了21个问题
siming51 共回答了21个问题 |采纳率85.7%不知道你是有什么用途
一般做分析 用盐酸和双氧水的混合物 或者 硫酸和磷酸的混合物
极难溶的用浓硝酸和氢氟酸的混合物溶解 不过很危险1年前查看全部
- 在100毫升混合酸中,硝酸为0.5摩尔每升,硫酸0.15摩尔每升,
在100毫升混合酸中,硝酸为0.5摩尔每升,硫酸0.15摩尔每升,
加入5.76克铜,微热充分反应后求铜离子的量浓度 另求若使5.76克铜完全溶解,且溶液中只存在一种盐,则原溶液中硝酸和硫酸的量溶度为多少? songhua1271年前1
songhua1271年前1 -
 milan2007 共回答了14个问题
milan2007 共回答了14个问题 |采纳率100%1.求在0.5mol/L硝酸和0.15mol/L硫酸环境中反应完全后铜离子浓度
(氢离子物质的量0.065mol)(在硫酸存在时H+足量,硝酸根离子完全被还原为NO)
设:消耗铜单质的质量为x,反应完全后铜离子物质的量为y.
3Cu + 8H+ +2NO3 - ==3Cu2+ + 2NO↑ + 4 H2O
192g 2mol 3mol
x 0.05mol y
列比例解出x=4.8g1年前查看全部
- 这道题铁不和硫酸反应吗有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3物质的量浓度分别是4mol/L和2mol/L,
这道题铁不和硫酸反应吗
有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3物质的量浓度分别是4mol/L和2mol/L,取10mL此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状况下的气体多少升?(设反应中HNO3被还原成NO) sygsb1年前1
sygsb1年前1 -
 kinkin_12 共回答了19个问题
kinkin_12 共回答了19个问题 |采纳率84.2%方程式3Fe + 8H+ + 2NO3- == 3Fe^2+ + 2NO + 4H2O
可以看出H+和NO3-以1:4消耗,题目中H+较多,所以NO3-全部消耗掉先得到NO的量为0.02mol剩下的H+的量为0.02mol,可以和铁反应生成H2 0.01mol气体 ,总共0.03mol.V=0.03mol*22.4L/mol=0.672L ,有不懂的可以发消息给我..1年前查看全部
- 在100ml混合酸的溶液中,硝酸的物质的量浓度为0.5mol/L,硫酸的物质的量浓度为0.15mol/L,向其中加入5.
在100ml混合酸的溶液中,硝酸的物质的量浓度为0.5mol/L,硫酸的物质的量浓度为0.15mol/L,向其中加入5.76g
铜粉,微热,使其充分反映.
若要使5.76g铜粉恰好完全溶解,且溶液中只存在一种硫酸盐,则原100mL溶液中的硝酸和硫酸的物质的量浓度分别是多少 端木芹菜1年前1
端木芹菜1年前1 -
 静静的读书 共回答了26个问题
静静的读书 共回答了26个问题 |采纳率92.3%3Cu~2NO~2HNO3
所以HNO3要0.06mol,所以HNO3为0.6mol/L
Cu2+ SO42- H2SO4
所以H2SO4要0.09mol,所以H2SO4为0.9mol/L1年前查看全部
- 在100ML的混合酸溶液中,硝酸的物质的量浓度为0.5MOL/L,硫酸的物质的量浓度为0.15MOL/L,
在100ML的混合酸溶液中,硝酸的物质的量浓度为0.5MOL/L,硫酸的物质的量浓度为0.15MOL/L,
向其中加入5.76克铜粉,微热使其充分反应.:)求溶液中铜离子的物质的量浓度?:-)若使5.76克铜粉恰好完全溶解,且溶液中只存在一种盐,则原溶液中硝酸和硫酸的物质的量浓度分别是多少. zxlcr1年前1
zxlcr1年前1 -
 蒈踱鬼 共回答了21个问题
蒈踱鬼 共回答了21个问题 |采纳率90.5%稀硝酸,nNO3-=0.05mol nH+=0.05+0.015x2=0.08mol
nCu=5.76/64=0.09mol
3Cu + 8H+ 2NO3-=3Cu2+ +2NO气体+4H2O
3 8 2 3
0.09 0.08 0.05 x
这样看H+不足,按H+计算
0.08 / 8 =x / 3
nCu2+=0.03mol ,cCu2+=0.03/0.1=0.3molL-
说只有1种盐,是说硝酸完全被还原成NO,只有硫酸铜
那就按Cu的量计算
3Cu + 8H+ 2NO3-=3Cu2+ +2NO气体+4H2O
3 8 2
0.09 z y
y=0.06mol ,cHNO3=0.6molL-
z=0.24mol cH2SO4= (0.24-0.06)/ 2x0.1=0.9molL-1年前查看全部
- 双指示剂法滴定盐酸和氯化铵需采用双指示剂法滴定HCl-NH4Cl混合酸 先用甲基红为指示剂 用NaOH将其中和 然后采用
双指示剂法滴定盐酸和氯化铵
需采用双指示剂法滴定HCl-NH4Cl混合酸
先用甲基红为指示剂 用NaOH将其中和
然后采用甲醛法 滴定NH4+
但是书上说要以酚酞为指示剂 甲基红此时为黄色 加入酚酞后如何判断终点.
或应采用其它什么指示剂? 蓝qq1年前2
蓝qq1年前2 -
 曼婵 共回答了14个问题
曼婵 共回答了14个问题 |采纳率92.9%如果你需要准确计算出NH4Cl的量,请选用甲醛法 滴定NH4+,如果你的要求不是太高,也可以选用酚酞为指示剂,终点是变黄色.1年前查看全部
- 5%的盐酸和4%的氢氟酸的混合酸溶液如何配置啊?
 gdlxx1年前1
gdlxx1年前1 -
 wumengyuguojun 共回答了10个问题
wumengyuguojun 共回答了10个问题 |采纳率100%氢氟酸市售通常浓度:35%(质量分数)
盐酸市售通常浓度:36%(质量分数)
配1Kg上述混酸则需称取:
氢氟酸:1000*4%/35% 克
具体你自己计算吧,称好后放入烧杯中,加水到1000克,搅拌混匀即得.1年前查看全部
- 5%的盐酸和4%的氢氟酸的混合酸溶液如何配置啊?
 usth_lw1年前1
usth_lw1年前1 -
 coej 共回答了26个问题
coej 共回答了26个问题 |采纳率100%氢氟酸市售通常浓度:35%(质量分数)
盐酸市售通常浓度:36%(质量分数)
配1Kg上述混酸则需称取:
氢氟酸:1000*4%/35% 克
具体你自己计算吧,称好后放入烧杯中,加水到1000克,搅拌混匀即得.1年前查看全部
- 用K2Cr2O7测铁时,为什么要加入硫酸-磷酸混合酸溶液?
 wang510701年前1
wang510701年前1 -
 建建狗 共回答了15个问题
建建狗 共回答了15个问题 |采纳率93.3%硫酸能减缓空气对亚铁的氧化作用,且能控制酸度,磷酸能与滴定过程中生成的三价铁离子生成无色络合物,降低了三价到二价铁的电极电位,消除了三价铁对指示剂的氧化,使滴定终点清晰准确.1年前查看全部
- 制备浓HNO3和浓H2SO4的混合酸 为什么先加浓HNO3
 bendan3171年前2
bendan3171年前2 -
 神州学子 共回答了19个问题
神州学子 共回答了19个问题 |采纳率94.7%浓硫酸遇水会放热,浓硝酸中含水且比浓硫酸密度小,当将浓硝酸加到浓硫酸中时,接触放出的热不方便分散,导致硝酸挥发加分解,属于危险操作.而将浓硫酸加入到浓硝酸中,因浓硫酸下沉,只要加入速度慢些,并不停搅拌,其放热升温就会缓和在可控范围内.浓硫酸稀释要求先放水,后向水中加浓硫酸也是这原因.1年前查看全部
- 有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3的物质的量浓度分别是4mol/L和2mol/L,取10mL此混合酸,
有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3的物质的量浓度分别是4mol/L和2mol/L,取10mL此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状况下的混合气体体积为(设反应中HNO3被还原成NO)( )
A. 0.448L
B. 0.672L
C. 0.896L
D. 0.224L 鸡_爪_子1年前2
鸡_爪_子1年前2 -
 09916044 共回答了18个问题
09916044 共回答了18个问题 |采纳率100%解题思路:10mL混合酸中含有:n(H+)=0.01L×2×4mol/L+0.01L×2mol/L=0.1mol,n(NO3-)=0.01L×2mol/L=0.02mol,由于铁过量,则发生反应:3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O,Fe+2H+=Fe2++H2↑,以此计算该题.10mL混合酸中含有:n(H+)=0.01L×2×4mol/L+0.01L×2mol/L=0.1mol,n(NO3-)=0.01L×2mol/L=0.02mol,
由于铁过量,则发生反应:3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O,Fe+2H+=Fe2++H2↑,则
3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O
0.02mol 0.08mol 0.02mol
反应后剩余n(H+)=0.1mol-0.08mol=0.02mol,
Fe+2H+=Fe2++H2↑
0.02mol 0.01mol
所以:n(NO)+n(H2)=0.02mol+0.01mol=0.03mol,
V(NO)+V(H2)=0.03mol×22.4L/mol=0.672L,
故选B.点评:
本题考点: 有关混合物反应的计算;硝酸的化学性质.
考点点评: 本题考查混合物的计算,题目难度中等,本题注意铁过量,根据n(H+)、n(NO3-)判断反应的可能性,判断生成气体为NO和H2的混合物,进而计算气体的体积,题目易错.1年前查看全部
- 硝酸与硫酸混合酸配法
 司徒衡1年前1
司徒衡1年前1 -
 韦宇凡 共回答了18个问题
韦宇凡 共回答了18个问题 |采纳率94.4%硝酸与硫酸混合的不多,你也没说道浓度,硫酸不管是与水还是其它酸混合都要注意要将硫酸小心倒入水或其它酸(指浓度低于硫酸的)中并不断搅拌.如果是低浓度的,要将两种酸分别用水稀释后再混合,特别注意倒入顺序.1年前查看全部
- 混合酸的计算题,今有一个由硫酸和磷酸组成的混合酸,拟定采用甲基橙和酚酞双指示剂法测定各自含量,用氢氧化钠标准溶液进行滴定
混合酸的计算题,
今有一个由硫酸和磷酸组成的混合酸,拟定采用甲基橙和酚酞双指示剂法测定各自含量,用氢氧化钠标准溶液进行滴定,标准溶液浓度为0.5000molL-1,用甲基橙作指示剂,滴定至终点消耗氢氧化钠25.00mL,用酚酞作指示剂滴定至终点时消耗氢氧化钠15.00mL,若该混合酸的总体积为25.00mL,试计算混合酸中各组分的含量(以gL-1表示).已知M(H2SO4)=98.0gmol-1,M(1/2H3PO4)=49.0gmol-1.[T/] desay1年前1
desay1年前1 -
 tomatoduan 共回答了12个问题
tomatoduan 共回答了12个问题 |采纳率91.7%硫酸为0.1mol/L磷酸为0.3mol/L1年前查看全部
- 碳化钨(WC)与硝酸和磷酸的混合酸加热反应的方程式是什么呀?
 等宝宝1年前1
等宝宝1年前1 -
 xiaoben123 共回答了17个问题
xiaoben123 共回答了17个问题 |采纳率100%生成磷钨酸,CO2,NO,水
补充提问就给你写化学式1年前查看全部
- 在100ML混合酸的溶液中,硝酸的物质的量浓度为0.2MOL/L,硫酸的物质的量浓度为0.3MOL/L,向其中加入2g铜
在100ML混合酸的溶液中,硝酸的物质的量浓度为0.2MOL/L,硫酸的物质的量浓度为0.3MOL/L,向其中加入2g铜粉微热,使其充分反应,反应后溶液的体积仍为100ML.
(1)反应后溶液中H+和NO3-的物质的量浓度分别是多少?
(2)充分反应后溶液中CU+的物质的量浓度分别是多少?
(3)产生气体的体积是多少升?(标况) 猪头东1年前1
猪头东1年前1 -
 zhangjiawen606 共回答了12个问题
zhangjiawen606 共回答了12个问题 |采纳率100%溶液中,含氢离子0.02+0.06=0.08mol,硝酸根离子0.02mol;硫酸根离子0.03mol,加入铜0.03125mol.
根据 3Cu + 8H+ + 2NO3- = 3Cu2+ + 2NO↑ + 4H2O
0.03125 0.08 0.02 x y
可以看出铜过量,生成的溶液是0.3mol/L的CuSO4溶液.这样一来:
(1)反应后溶液中H+的浓度是10的-7次方mol/L【不考虑铜离子水解】NO3-的物质的量浓度分别是0.
(2)充分反应后溶液中Cu2+的物质的量浓度是0.3mol/L.
(3)产生气体的体积是22.4×0.02=0.448升.(标况)1年前查看全部
- 在100mL混合酸中,HNO3的物质的量浓度为0.4 mol/L,H2SO4的物质的量浓度为0.1mol/L,向其中加入
在100mL混合酸中,HNO3的物质的量浓度为0.4 mol/L,H2SO4的物质的量浓度为0.1mol/L,向其中加入1.92g铜粉,
微热,待充分反应后,求溶液中铜离子的物质的量浓度为多少? yy112412051年前1
yy112412051年前1 -
 袁芬 共回答了22个问题
袁芬 共回答了22个问题 |采纳率86.4%解析:
假设反应前后溶液体积变化可以忽略:
Cu物质的量 = 1.92 g / 64 g/mol = 0.03 mol
HNO3物质的量 = 0.4 mol/L * 0.1 L = 0.04 mol
H2SO4物质的量 = 0.1 mol/L * 0.1 L = 0.01mol
H+ 总物质的量 = 0.04 mol + 0.01 mol * 2 = 0.06 mol
无论硝酸物质的量多少,只要满足NO3- 和 H+共存,就是硝酸,其余非氧化性酸只起到酸性作用.
根据离子方程式:
3Cu + 2NO3- + 8H+ → 3Cu2+ + NO↑ + 4H2O
Cu:NO3-:H+物质的量 = 3:2:8
而实际上比值只有 0.03:0.04:0.06
所以H+不足,按照最低的H+计算:
设反应后Cu2+物质的量为 x mol
8H+ 3Cu2+
8 3
0.06mol x
解得:x = 0.0225 mol
所以Cu2+物质的量浓度 = 0.0225 mol / 0.1L = 0.225 mol/L1年前查看全部
- 氢氧化钠怎么滴定硫酸和盐酸的混合酸?
 5kelly1年前1
5kelly1年前1 -
 xxx156124 共回答了17个问题
xxx156124 共回答了17个问题 |采纳率94.1%硫酸在水中电离成氢离子和硫酸根离子,盐酸在水中电离成氢离子和氯离子.
氢氧化钠在水中电离成钠离子和氢氧根离子.
实际上是硫酸和盐酸在溶液中已经是氢离子和硫酸根离子和氯离子了.
滴定只是氢离子和氢氧根离子反应1年前查看全部
- 有没有比王水酸性更强的混合酸?氢氟酸(HF)和五氟化锑(sbF5)的混合酸也就是人们说的魔酸(magic acid)或魔
有没有比王水酸性更强的混合酸?
氢氟酸(HF)和五氟化锑(sbF5)的混合酸也就是人们说的魔酸(magic acid)或魔术酸 ,魔酸(HSO3F-SbF5)是目前世界上已知最强的超酸,许多物质(如H2SO-4)在魔酸中可获得质子(即质子化).当它们按1 :0.3(摩尔比)混合时,它的酸性是浓硫酸的 1亿倍;按1:1混合时,它的酸性是浓硫酸的10亿倍,而以0.2:1的摩尔比混合时酸度更能达到100%纯硫酸的10^9倍以上,随着SbF5的比例增加酸度还能增强 .它能轻易溶解不溶于王水的高级烷烃蜡烛.所以王水在它们面前只能是“小巫见大巫”. 泰然居士1年前1
泰然居士1年前1 -
 垃圾ww人 共回答了17个问题
垃圾ww人 共回答了17个问题 |采纳率76.5%的确 王水曾是最强酸 直到发现超强酸1年前查看全部
- 有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3的物质的量浓度分别是4mol/L和2mol/L,取10mL此混合酸,
有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3的物质的量浓度分别是4mol/L和2mol/L,取10mL此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状况下的混合气体体积为(设反应中HNO3被还原成NO)( )
A. 0.448L
B. 0.672L
C. 0.896L
D. 0.224L fdpq2m1年前1
fdpq2m1年前1 -
 快乐如风2 共回答了14个问题
快乐如风2 共回答了14个问题 |采纳率85.7%解题思路:10mL混合酸中含有:n(H+)=0.01L×2×4mol/L+0.01L×2mol/L=0.1mol,n(NO3-)=0.01L×2mol/L=0.02mol,由于铁过量,则发生反应:3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O,Fe+2H+=Fe2++H2↑,以此计算该题.10mL混合酸中含有:n(H+)=0.01L×2×4mol/L+0.01L×2mol/L=0.1mol,n(NO3-)=0.01L×2mol/L=0.02mol,
由于铁过量,则发生反应:3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O,Fe+2H+=Fe2++H2↑,则
3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O
0.02mol 0.08mol 0.02mol
反应后剩余n(H+)=0.1mol-0.08mol=0.02mol,
Fe+2H+=Fe2++H2↑
0.02mol 0.01mol
所以:n(NO)+n(H2)=0.02mol+0.01mol=0.03mol,
V(NO)+V(H2)=0.03mol×22.4L/mol=0.672L,
故选B.点评:
本题考点: 有关混合物反应的计算;硝酸的化学性质.
考点点评: 本题考查混合物的计算,题目难度中等,本题注意铁过量,根据n(H+)、n(NO3-)判断反应的可能性,判断生成气体为NO和H2的混合物,进而计算气体的体积,题目易错.1年前查看全部
- 一道高一物质的量浓度的化学题有某混合酸,其中氢氟酸浓度为12mol/L,硫酸浓度为1mol/L.如何利用密度为1.84g
一道高一物质的量浓度的化学题
有某混合酸,其中氢氟酸浓度为12mol/L,硫酸浓度为1mol/L.如何利用密度为1.84g/mL、浓度为98%的浓硫酸使400mL上述混合酸中氢氟酸的浓度变为8mol/L、硫酸的浓度变为3mol/L? lvtianhui1年前1
lvtianhui1年前1 -
 蔓秀蕾敦 共回答了16个问题
蔓秀蕾敦 共回答了16个问题 |采纳率75%首先氢氟酸HF的物质的量是不变的,要配制400ml浓度8mol/L的溶液需要12mol/L的溶液的体积=400*8/12=267ml
267ml原混合溶液中硫酸的物质的量=1*267/1000=0.267mol
400ml硫酸浓度为3mol/L的混合溶液中硫酸的物质的量=0.4*3=1.2mol
所以需加入硫酸的物质的量=1.2-0.267=0.933mol
密度为1.84g/mL、浓度为98%的浓硫酸的物质的量浓度=1.84*1000*0.98/98=18.4mol/L
所以需加入密度为1.84g/mL、浓度为98%的浓硫酸的体积=0.933/18.4=0.05(L)1年前查看全部
大家在问
- 1jack works with mr.wang and mr.zhang.
- 2把一块蛋糕切成8块,芳芳吃了2块,她吃了这块蛋糕的8分之2,是对还是错
- 3你还知道有哪些昆虫的发育过程与家蚕相似,有哪些昆虫的发育过程与家蚕不一样?网上查找资料,与同学作进
- 4设NA代表阿伏加德罗常数,下列说法不正确的是( )
- 5给加粗的字注音。 祗 辱于( ) 骈 死( )槽 枥 ( ) 食 马者( )一 石 (
- 6关于父亲的作文怎么写???拒绝百度!!!
- 70.25乘以9度43分47秒减去3分30秒等于2度26分26秒是怎样计算的步骤是?
- 8将一盆-5℃的冰放在0℃的房间,那么冰水混合物的温度将为()
- 9举止等自然,不拘束.词语
- 108/5乘25/7等于 7/4乘17/21等于 81/20乘25/9 51/5乘20/17
- 11“下的很急的雨”表示的词语
- 12一条公路长30米.已修了全长的6分之5.还剩下几分之几?
- 13下列结论中,不正确的是( )A.方程[2/x=3x+1]的解是x=2B.方程[2/x+1=3x−1]的解是x=-5C.
- 14甲乙两人从a、b两地同时出发,相向而行,在c地相遇时,甲又经过t1小时到达b地,乙又经过t2小时到达a设ac=s1
- 15"问渠那得清如许 为有源头活水来"中"活水"比喻什么?告诉人们什么道理?
