300℃时,将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:
 林苑楼主2022-10-04 11:39:541条回答
林苑楼主2022-10-04 11:39:541条回答| 300℃时,将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应: 3A(g)+B(g)  2C(g)+2D(g);ΔH=Q,2 min末达到平衡,生成0.8 mol D. 2C(g)+2D(g);ΔH=Q,2 min末达到平衡,生成0.8 mol D.(1)300℃时,该反应的平衡常数表达式为:K=___________. 已知K 300℃ (2)在2 min末时,B的平衡浓度为________,D的平均反应速率为______________. (3)若温度不变,缩小容器容积,则A的转化率________(填“增大”、“减小”或“不变”),原因是__________________________________________________. (4)如果在相同的条件下,上述反应从逆反应方向进行,开始时若加入C、D各 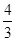 mol.若使平衡时各物质的物质的量浓度与原平衡相同,则还应该加入B________ mol. mol.若使平衡时各物质的物质的量浓度与原平衡相同,则还应该加入B________ mol. |

已提交,审核后显示!提交回复
共1条回复
相关推荐
- 300℃时,将2mol A和2mol B两种气体混合于2L密闭容器中,发生如下反应:3A(g)+B(
300℃时,将2mol A和2mol B两种气体混合于2L密闭容器中,发生如下反应:3A(g)+B(g)⇌2C(g)+2D(g);△H>0,2min末达到平衡,生成0.8mol D.
(1)在2min末时,B的平衡浓度为______,D的平均反应速率为______.
(2)如果在相同的条件下,上述反应从逆反应方向进行,开始时若加入C、D各4/3mol.若使平衡时各物质的物质的量浓度与原平衡相同,则还应该加入B[4/3][4/3]mol. xy591112341年前1
xy591112341年前1 -
 会说话的哑巴 共回答了18个问题
会说话的哑巴 共回答了18个问题 |采纳率100%解题思路:(1)根据生成D的物质的量,计算参加反应的A、B的物质的量,进而计算平衡时B的物质的量,根据c=[n/V]计算B的平衡浓度,根据速率等于[△C/△t]计算D的平均反应速率;
(2)由方程式可知反应前后气体的物质的量不变,恒温恒容下,按化学计量数转化到左边,满足n(A):n(B)=2mol:2mol=1:1即可,据此判断应加入的物质及该物质的量物质的量.(1)2min末反应达到平衡状态,生成0.8molD,则参加反应的A、B的物质的量都是0.8mol,平衡时B的物质的量=2mol-0.8mol=1.6mol,故B的平衡浓度=[1.6mol/2L]=0.8mol/L,v(D)=
0.8mol
2L
2min=0.2mol/(L•min),
故答案为:0.8mol/L;0.2 mol/(L•min);
(2)该反应前后气体的物质的量不变,恒温恒容下,按化学计量数转化到左边,满足n(A):n(B)=2mol:2mol=1:1即可,开始加入C和D各[4/3]mol,由化学方程式3A(g)+B(g)⇌2C(g)+2D(g)可知转化到左边,可以得到A为[4/2]mol×[3/2]=2mol,得到B为[4/3]mol×[1/2]=[2/3]mol,故还需要加入B的物质的量为2mol-[2/3]mol=[4/3]mol;
故答案为:[4/3].点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查化学平衡的有关计算、影响化学平衡的因素、等效平衡等,难度中等,注意等效平衡规律的掌握.1年前查看全部
- 请教两道关于热力学的计算题1.2kg质量某种理想气体按可逆多变过程膨胀到原有体积的三倍,温度从300℃下降到60℃,膨胀
请教两道关于热力学的计算题
1.2kg质量某种理想气体按可逆多变过程膨胀到原有体积的三倍,温度从300℃下降到60℃,膨胀过程中做功418.68kJ,吸热83.736kJ.求该气体的定压比热容和定容比热容(10分)
2、某理想气体在定压下从t1℃加热到t2℃,并做了膨胀功W (KJ/kg),该气体定压比热cp为定值,试用t1、t2、cp等已知参数表示:
(1)、该气体的气体常数R.
(2)、热力过程中单位质量气体内能的改变量.
(3)、热力过程中单位质量气体的吸热量.
(4)、热力过程中单位质量气体熵变. 无限索爱1年前1
无限索爱1年前1 -
 chemhan 共回答了20个问题
chemhan 共回答了20个问题 |采纳率95%你自己去网上的大型网站看看,他们的解析很权威,这是我在网上找到http://studytv.cctv.com/.1年前查看全部
- 蒸汽加热水需要多少量如题 现在需要用蒸汽来加热水,已知蒸汽的参数为0.8mpa,300℃,水量为12t/h,水温为57℃
蒸汽加热水需要多少量如题
现在需要用蒸汽来加热水,已知蒸汽的参数为0.8mpa,300℃,水量为12t/h,水温为57℃,现在将蒸汽直接通过水混合将水加热到62℃,请问需要多少蒸汽呢?是否是按照等焓来计算呢[ ] 521rose1年前7
521rose1年前7 -
 茄子love水怪 共回答了22个问题
茄子love水怪 共回答了22个问题 |采纳率86.4%我是这样计算,不知道对不对,请大家指教.蒸汽的参数为0.8mpa,300℃时,这是过热蒸汽,H = 731.3kcal/kg;加热前水的比焓为57kcal/kg;加热后蒸汽变成水,比焓变为62kcal/kg.设需要的蒸汽量为D,则D×731.3+12000×57=(D+12000)×62,算出D=89.6kg/h 查看原帖1年前查看全部
- 蒸汽加热水需要多少量0.8MPa,温度300℃的蒸汽,加热水,水量为5t/h,需要将水从20℃加热至180℃,问每小时需
蒸汽加热水需要多少量
0.8MPa,温度300℃的蒸汽,加热水,水量为5t/h,需要将水从20℃加热至180℃,问每小时需要多少蒸汽量?
加热方式为蒸汽直通水中,需列出计算方法! Zazk88881年前2
Zazk88881年前2 -
 Realchris1106 共回答了11个问题
Realchris1106 共回答了11个问题 |采纳率100%先查出0.8MPa、300℃的蒸汽的焓值h1,再查出0.8MPa、180℃的水的焓值h2,查出0.8MPa、20℃的水的焓值h3,根据蒸汽放热与水吸热相等的关系,可得:
D(h1-h2)=5(h2-h3),即可求出所需蒸汽量D,单位为t/h.
前提是你确认存在0.8MPa、180℃的水!
若是0.8MPa、80℃的水,则将h2改为此参数下的水的焓值即可.1年前查看全部
- 将33.6gNa2CO3和NaHCO3固体混合物加热到300℃充分反应后,将生成的气体通入澄清石灰水中得到10g白色沉淀
将33.6gNa2CO3和NaHCO3固体混合物加热到300℃充分反应后,将生成的气体通入澄清石灰水中得到10g白色沉淀.求
(1)加热产生的二氧化碳
(2)原混合物中NaHCO3的质量分数 aeintw08161年前1
aeintw08161年前1 -
 肥鼠 共回答了24个问题
肥鼠 共回答了24个问题 |采纳率91.7%10g碳酸钙对应二氧化碳0.1mol
对应碳酸氢钠0.2mol,也就是16.8g
w(NaHCO3)=16.8/33.6=50%1年前查看全部
- 无机推断题FeSO4·7H2O在300℃氮气保护条件下生成无水盐A,A焙烧分解,放出两种无色刺激性气体B和C,并生成红棕
无机推断题
FeSO4·7H2O在300℃氮气保护条件下生成无水盐A,A焙烧分解,放出两种无色刺激性气体B和C,并生成红棕色固体D.请写出物质的化学式或名称:
A______,B______,C______,D______. feng070071年前1
feng070071年前1 -
 如风1314 共回答了11个问题
如风1314 共回答了11个问题 |采纳率100%A___FeSO4___,B___SO2___,C____SO3__,D___Fe2O3___.1年前查看全部
- 下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K). 温度 250℃ 300℃ 350℃ K 2.041 0.270
下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K). 温度 250℃ 300℃ 350℃ K 2.041 0.270 0.012 由表
下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K).
温度250℃300℃350℃
K2.0410.2700.012
由表中数据判断 H1---0(填“>”“=”或“ 忧郁红酒1年前1
忧郁红酒1年前1 -
 chris30 共回答了20个问题
chris30 共回答了20个问题 |采纳率80%随着温度的升高,K值不断减小,K值越大表示正反应进行越彻底,所以该反应是放热反应,温度升高,平衡逆向移动,K值减小,即△H<0
不知楼主的反应是哪个?总之根据方程中的化学计量数计算平衡时候每种物质的浓度,求K值就可以知道温度了.转化率等于参与反应的气体物质的量比反应前该物质物质的量1年前查看全部
- (2014•陕西)“嫦娥三号”成功着陆后,月球车开始了对月球的科学探测,月球表面无大气层,昼夜温差超过300℃,部分土壤
(2014•陕西)“嫦娥三号”成功着陆后,月球车开始了对月球的科学探测,月球表面无大气层,昼夜温差超过300℃,部分土壤非常松软.针对这种环境,下列说法正确的是( )
A.“嫦娥三号”降落时,要使用降落伞减速
B.月球车利用电磁波向地面传输探测到的数据
C.月球车的车轮使用了充气橡胶轮胎
D.月球车的轮子表面积较大,可以减小对月球表面的压力 zlnlzq1年前1
zlnlzq1年前1 -
 tangxp 共回答了20个问题
tangxp 共回答了20个问题 |采纳率95%解题思路:(1)使用降落伞降落时,空气对降落伞有阻力作用,使降落的物体减速降落,月球上没有空气,降落伞不能工作.
(2)在太空中是通过无线电波(电磁波)传递信号的.
(3)月球上没有空气,充气轮胎是利用大气压工作的.
(4)当压力大小一定时,增大受力面积可以减小压强.A、降落伞在月球上空降落时,靠变推力发动机产生向下的推力实施减速下降,因为月球周围是真空,没有空气,所以“嫦娥三号”不能利用降落伞减速.选项错误;
B、月球车利用电磁波向地面传输探测到的数据.选项正确;
C、月球上没有空气,不能使用橡胶轮胎.选项错误
D、月球车的轮子表面积较大,可以减小对月球表面的压强.选项错误.
故选B.点评:
本题考点: 物理常识.
考点点评: 要注意培养运用所学知识分析生活中现象的能力,学以致用.1年前查看全部
- 有一种乳白色的固体物质,在250℃开始就熔化,直到温度升高到300℃时,才熔化结束,这种物质一定是______
有一种乳白色的固体物质,在250℃开始就熔化,直到温度升高到300℃时,才熔化结束,这种物质一定是______ (选填:“晶体”或“非晶体”),此物质在熔化的过程中______(选填:“吸热”或“不吸热”).
 caucwind1年前1
caucwind1年前1 -
 一水按时 共回答了18个问题
一水按时 共回答了18个问题 |采纳率77.8%解题思路:晶体和非晶体的重要区别:晶体有一定的熔点,非晶体没有一定的熔点.乳白色的固体物质,在250℃开始熔化,直到温度升高到300℃才熔化完,说明固体物质熔化时没有一定的熔点,此物质是非晶体.物体的熔化过程需要吸热.
故答案为:非晶体;吸热.点评:
本题考点: 晶体和非晶体的区别.
考点点评: 晶体熔化时不断吸收热量,温度保持不变;非晶体熔化时不断吸收热量,温度不断升高这是,晶体和非晶体的重要区别.1年前查看全部
- 容积为5L的密闭容器中,通入40mol的SO2和20mol的O2,在1,01*10^5Pa,300℃条件下发生反应
容积为5L的密闭容器中,通入40mol的SO2和20mol的O2,在1,01*10^5Pa,300℃条件下发生反应
8min后达到平衡,此时,测得气体的总物质的量是44mol
求1,平衡时,SO3的浓度
第二题:某温度下,容积为5L的密闭容器中,通入8mol的SO2和xmol的O2,发生反应,2min后平衡,此时,测得平衡后的压强为原来的0,75倍,容器中还剩余1molO2
求1,x=?
SO2的转化率 卧风1年前1
卧风1年前1 -
 alc89 共回答了16个问题
alc89 共回答了16个问题 |采纳率81.3%2SO2+O2=2SO3
反应前 40 20
反应后40-2X 20-X 2X
X=16
平衡时,SO3的体积分数浓度8/44=18.18%
2SO2 +O2 =2SO3
反应前 8 X
反应后 8-2(x-1)1 2(X-1)
8-2(X-1) + X-1 + 2(X-1)=0.75(8+X)
X=4
SO2的转化率6/8=75%1年前查看全部
- 有一密封容器储有一定量的氮气,升高温度(不高于300℃),密封容器体积增大了一倍.
有一密封容器储有一定量的氮气,升高温度(不高于300℃),密封容器体积增大了一倍.
注:氮分子在3000℃以下不会***.上题中所述的过程是物理变化还是化学变化?为什么? LY7205201年前1
LY7205201年前1 -
 24479179 共回答了14个问题
24479179 共回答了14个问题 |采纳率92.9%当然是物理变化了,氮分子没有发生改变嘛,从微观的角度解释,升高温度只是加剧了氮分子的热运动而增大了容器内的压强,1年前查看全部
- 测量范围-100℃~+300℃ 测量精确度±0.5%的温度传感器有哪些
 好好的81年前1
好好的81年前1 -
 feather2172 共回答了13个问题
feather2172 共回答了13个问题 |采纳率100%常用的有Pt100铂热电阻.1年前查看全部
- 一块钢锭放出3.22×107J的热量,温度从1.3×103℃降到300℃,钢的比热容为460J/(kg•℃),求该钢的质
一块钢锭放出3.22×107J的热量,温度从1.3×103℃降到300℃,钢的比热容为460J/(kg•℃),求该钢的质量是多少千克?
 sigorilin1年前1
sigorilin1年前1 -
 浙江传ww 共回答了20个问题
浙江传ww 共回答了20个问题 |采纳率85%解题思路:知道物体放出的热量、初温和末温,根据公式Q放=cm△t=cm(t0-t)求钢的质量.∵Q放=cm△t=cm(t0-t),
即 3.22×107J=460J/(kg•℃)×m×(1.3×103℃-300℃)
m=
3.22×107J
460J/(kg•℃)×1000℃=70kg.
答:该钢的质量是70kg.点评:
本题考点: 热量的计算.
考点点评: 本题考查学生对热量公式的灵活运用,计算时注意温度下降(△t)和下降到(末温)的区别.1年前查看全部
- (2013•芜湖模拟)混合下列各组物质,加热蒸干并在300℃灼烧至质量不变,最终残留固体为纯净物的是( )
(2013•芜湖模拟)混合下列各组物质,加热蒸干并在300℃灼烧至质量不变,最终残留固体为纯净物的是( )
A.等物质的量的硫酸铝与氯化铝
B.等物质的量浓度,等体积的(NH4)2SO4与BaCl2混合
C.等物质的量NaHCO3与Na2O2
D.向Na2SO3溶液中通入一定量的Cl2 cxh19786111年前1
cxh19786111年前1 -
 酷吧酷吧尚 共回答了16个问题
酷吧酷吧尚 共回答了16个问题 |采纳率87.5%解题思路:A、加热时氯化铝会水解生成氢氧化铝,蒸干溶液继续灼烧,则氢氧化铝分解生成氧化铝,硫酸铝蒸干并灼烧后还是硫酸铝;
B、等物质的量浓度、等体积的(NH4)2SO4溶液与BaCl2溶液混合恰好生成硫酸钡和氯化铵;
C、发生的反应为:
Na2O2 +H2O=2NaOH+[1/2]O2
NaHCO3 +NaOH=Na2CO3+H2O
由于Na2O2与NaHCO3等物质的量,所以NaOH是NaHCO3量的二倍,所以NaOH过量;
D、Na2SO3 +Cl2+2NaOH=Na2SO4 +2NaCl+H2O.A、加热时氯化铝会水解(生成的HCl受热从溶液中逸出,促进水解进行)生成氢氧化铝,蒸干溶液继续灼烧,则氢氧化铝分解生成氧化铝,硫酸铝蒸干并灼烧后还是硫酸铝,故等物质的量的硫酸铝与氯化铝加热蒸干并在300℃灼烧至质量不变,最终残留固体为氧化铝和硫酸铝的混合物,故A错误;
B、等物质的量浓度、等体积的(NH4)2SO4溶液与BaCl2溶液混合恰好生成硫酸钡和氯化铵,氯化铵加热分解,加热蒸干、灼烧,氯化铵分解,残留固体为硫酸钡,故B正确;
C、发生的反应为:
Na2O2 +H2O=2NaOH+[1/2]O2
NaHCO3 +NaOH=Na2CO3+H2O
由于Na2O2与NaHCO3等物质的量,所以NaOH是NaHCO3量的二倍,所以NaOH过量,因此残留固体是碳酸钠和氢氧化钠的混合物,故C错误;
D、Na2SO3 +Cl2+2NaOH=Na2SO4 +2NaCl+H2O,因此残留固体是硫酸钠和氯化钠的混合物,故D错误,
故选B.点评:
本题考点: 镁、铝的重要化合物;铵盐;钠的重要化合物.
考点点评: 考查物质之间的反应及物质性质,涉及过量问题,难度中等,注意水解和分解.1年前查看全部
- 有没有沸点超过300度的液体无腐蚀性,常压下超过300℃。我的实验得到350℃以上啊。300℃以上有些悬乎。
 美极章鱼1年前2
美极章鱼1年前2 -
 xx_love 共回答了22个问题
xx_love 共回答了22个问题 |采纳率95.5%水银,标准大气压下,沸点357摄氏度.
用过的硅油最高到300度,到350就狂冒烟
食用油,非食用油等等.1年前查看全部
- 玻璃在200℃时熔化,当温度升到300℃时还没有熔化完,由此可知( )
玻璃在200℃时熔化,当温度升到300℃时还没有熔化完,由此可知( )
A. 玻璃变大了
B. 玻璃是晶体
C. 玻璃是非晶体
D. 玻璃难熔化 给我的快乐幸福1年前4
给我的快乐幸福1年前4 -
 maomaosi 共回答了19个问题
maomaosi 共回答了19个问题 |采纳率100%解题思路:根据我们对晶体和非晶体熔化过程的了解来作答.常见的晶体有各种金属,海波,冰;常见的非晶体有石蜡,玻璃,沥青,松香.晶体有一定的熔化温度,在熔化的过程中虽然吸热但温度是不变的;非晶体没有一定的熔化温度,在熔化时吸热升温.玻璃在200℃时熔化,当温度升到300℃时还没有熔化完,说明玻璃熔化时温度不断上升,没有固定的熔点,故玻璃是非晶体.
故选C.点评:
本题考点: 晶体和非晶体的区别.
考点点评: 本题考查了晶体和非晶体的区别:晶体和非晶体的区别是晶体有确定的熔点和凝固点,而非晶体没有.难度不大,是一道热学的基础题.1年前查看全部
- 300℃时将等物质的量的CO,H2,CO2,H2O组成的混合气体共1mol,置于装有足量Na202的密闭容器中,用电火花
300℃时将等物质的量的CO,H2,CO2,H2O组成的混合气体共1mol,置于装有足量Na202的密闭容器中,用电火花连续作用,充分反映后,下列说法不正确的是( )
A.Na202的质量增加15g
B.剩余气体的物质的量为0.25mol
C.剩余固体中n(na2co3):(naoh)=1:2
D.反应过程中共转移1mol电子 消毒鬼1年前1
消毒鬼1年前1 -
 langrencha 共回答了19个问题
langrencha 共回答了19个问题 |采纳率84.2%由CO2+H2=CO+H2O 可将各0.25mol的CO H2 CO2 H2O等效为各0.5mol的CO2 H20
你老师肯定讲过 Na2O2与水和二氧化碳作用 固体增重的质量就是其中H2和CO的质量 那么0.5molCO2和0.5mol水增重的就是0.5CO和0.5H2 也就是15g A对
再由方程式2Na2O2+2H2O=4NaOH+O2 和 2Na2O2+2CO2=2Na2CO3+O2
可知当H20 和 CO2都是0.5mol时 产生氧气共0.5mol 所以B错 剩余气体就是氧气 应该是0.5mol
而且na2co3是0.5mol naoh为1mol 那么C对 又可以由方程式得知生成1mol氧气都转2mol电子 那么现在生成0.5mol氧气自然转移1mol电子 D对1年前查看全部
- 在容积为2L的密闭容器中进行反应:CO(g)+2H 2 (g) CH 3 OH(g) ,其他条件不变,在300℃和500
在容积为2L的密闭容器中进行反应:CO(g)+2H 2 (g)
 CH 3 OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH 3 OH)-反应时间t的变化曲线如图所示,下列说法正确的是
CH 3 OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH 3 OH)-反应时间t的变化曲线如图所示,下列说法正确的是
A.该反应的△H<0 B.其他条件不变,升高温度反应的平衡常数增大 C.300℃时,0-t 1 min内 CH 3 OH的平均生成速率为 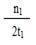 mol·L -1 min -1
mol·L -1 min -1 D.A点的反应体系从300℃升高到500℃,达到平衡时  减小
减小 新太阳WW1年前1
新太阳WW1年前1 -
 紫色天门 共回答了28个问题
紫色天门 共回答了28个问题 |采纳率89.3%AC
1年前查看全部
- 称取质量为m1克的氢氧化钠和碳酸氢钠的固体混合物置于密闭容器中,在300℃条件下充分加热,排尽气体后,
称取质量为m1克的氢氧化钠和碳酸氢钠的固体混合物置于密闭容器中,在300℃条件下充分加热,排尽气体后,
测得剩余固体质量为m2克.小林和小芳两同学对加热后的剩余固体进行研究.为了研究方便,令a=m2/m1.a的取值范围是什么?当a=53/79时,剩余固体的成分为?当a=53/61时,剩余固体的成分为? 放飛心靈1年前1
放飛心靈1年前1 -
 huntsun 共回答了17个问题
huntsun 共回答了17个问题 |采纳率94.1%1、第一问用极值法,
若固体全部是氢氧化钠,a=1,
若固体全部是碳酸氢钠,2NaHCO3——Na2CO3+CO2+H2O
a=53/84,
固体为混合物,极值不能取,所以53/841年前查看全部
- (2014•徐汇区一模)在300℃时,改变起始反应物中n(H2)对反应N2(g)+3H2(g)⇌2NH3(g)+Q(Q>
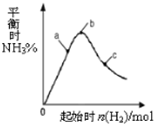 (2014•徐汇区一模)在300℃时,改变起始反应物中n(H2)对反应N2(g)+3H2(g)⇌2NH3(g)+Q(Q>0)的影响如图所示.下列说法正确的是( )
(2014•徐汇区一模)在300℃时,改变起始反应物中n(H2)对反应N2(g)+3H2(g)⇌2NH3(g)+Q(Q>0)的影响如图所示.下列说法正确的是( )
A.反应在b点达到平衡
B.b点H2的转化率最高
C.c点N2的转化率最高
D.a、b、c三点的平衡常数Kb>Ka>Kc nash1101年前1
nash1101年前1 -
 bluemen 共回答了29个问题
bluemen 共回答了29个问题 |采纳率93.1%解题思路:合成氨的反应是放热反应,升高温度平衡逆向进行,氨气的含量减小,增大氢气量平衡正向进行,开始氨气含量增大,当氢气量增大到一定程度,氢气增加为主要因素时,氨气含量会减小.反应N2(g)+3H2(g)⇌2NH3(g)△H<0,反应是放热反应,升高温度,反应速率增大,平衡逆向进行,氨气的含量减小,随氢气量的增大,平衡移动为主,氨气含量增大,随氢气量增多,当氢气量增大为主时,氨气含量会减小;
A、图象分析可知b点是加入氢气一定量,氨气平衡含量最大,但不能说明反应达到平衡,故A错误;
B、图象分析,b点氨气平衡含量最大,说明增大氢气量,氮气的转化率最最大,氢气转化率不是最大、故B错误;
C、图象分析,b点氨气平衡含量最大,说明增大氢气量,氮气的转化率最最大,故C正确;
D、平衡常数随温度变化,不随浓度改变,所以abc点平衡常数相同,故D错误;
故选C.点评:
本题考点: 化学平衡的影响因素.
考点点评: 本题考查了化学平衡影响因素分析判断,化学平衡移动原理的应用,掌握基础是解题关键,题目难度中等.1年前查看全部
- 两体积相同的密闭容器中均充入1mol X和1mol Y,分别于300℃和500℃开始发生反应:X(g
两体积相同的密闭容器中均充入1mol X和1mol Y,分别于300℃和500℃开始发生反应:X(g)+Y(g) 3Z(g).Z的含量(Z%)随时间t的变化如下图所示.已知在t 3 时刻改变了某一实验条件.相关判断正确的是( ) A.曲线a是500℃时的图象 B.正反应是吸热反应 C.t 3 时刻可能是升高了温度 D.t 3 时刻可能是减小了压强 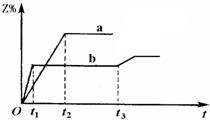
 开心就好灭1年前1
开心就好灭1年前1 -
 曾经拥有的 共回答了14个问题
曾经拥有的 共回答了14个问题 |采纳率100%A、图象判断,b曲线先到达平衡,反应速率大,说明b曲线的反应温度高,应是500℃时的图象,故A错误;
B、温度升高,Z%的数值减小,说明升高温度平衡向逆向移动,正反应是放热反应,故B错误;
C、t 3 时刻时,改变条件,到达平衡时Z%的数值增大,说明平衡向正反应移动,该反应正反应是放热反应,可能为降低温度,不可能是升高温度,故C错误;
D、t 3 时刻时,改变条件,到达平衡时Z%的数值增大,说明平衡向正反应移动,该反应正反应是气体体积增大的反应,减小压强,平衡向正反应移动,故可能是减小了压强,故D正确;
故选D.1年前查看全部
- 混合下列各组物质使之充分反应,加热蒸干产物并在300℃灼烧至质量不变,最终残留固体不是纯净物的是( )
混合下列各组物质使之充分反应,加热蒸干产物并在300℃灼烧至质量不变,最终残留固体不是纯净物的是( )
A. 向Fe、FeO和Fe2O3的混合物中加入过量氯水
B. 等物质的量浓度、等体积的(NH4)2SO4与 BaC12溶液
C. 等物质的量的 NaHCO3与 Na2O2固体
D. 在NaBr溶液中通入过量氯气 avocado的uu1年前1
avocado的uu1年前1 -
 wee9 共回答了20个问题
wee9 共回答了20个问题 |采纳率80%解题思路:A.Fe、FeO和Fe2O3的混合物中加入过量氯水生成氯化铁,氯化铁会水解得到氢氧化铁和盐酸,盐酸挥发,氢氧化铁分解最终得到氧化铁;
B.等物质的量的浓度、等体积的(NH4)2SO4与BaCl2溶液,反应生成硫酸钡和氯化铵,氯化铵分解生成氨气和HCl;
C.等物质的量的NaHCO3与Na2O2固体混合,发生2NaHCO3
Na2CO3+H2O+CO2↑,过氧化钠再与二氧化碳、水反应;△ .
D.在NaBr溶液中通入过量Cl2,反应生成NaCl、溴,溴易挥发.A.Fe、FeO和Fe2O3的混合物中加入过量氯水生成氯化铁,氯化铁会水解得到氢氧化铁和盐酸,盐酸挥发,灼烧氢氧化铁分解最终得到氧化铁,为纯净物,故A错误;
B.等物质的量的浓度、等体积的(NH4)2SO4与BaCl2溶液,反应生成硫酸钡和氯化铵,氯化铵分解生成氨气和HCl,蒸干灼烧后的固体为硫酸钡,为纯净物,故B错误;
C.等物质的量的NaHCO3与Na2O2固体混合,发生2NaHCO3
△
.
Na2CO3+H2O+CO2↑,过氧化钠再与二氧化碳、水反应,蒸干灼烧后的固体为碳酸钠和NaOH,为混合物,故C正确;
D.在NaBr溶液中通入过量Cl2,反应生成NaCl、溴,溴易挥发,蒸干灼烧后的固体为NaCl,为纯净物,故D错误;
故选C.点评:
本题考点: 铁的氧化物和氢氧化物;卤素原子结构及其性质的比较;铵盐;钠的重要化合物;铁的化学性质.
考点点评: 本题考查物质的性质,明确发生的化学反应及物质的性质是解答本题的关键,题目难度中等.1年前查看全部
- (2011•淮安二模)已知300℃、70MPa下由二氧化碳和氢气合成乙醇的反应成为现实:2CO2(g)+6H2(g)⇌C
(2011•淮安二模)已知300℃、70MPa下由二氧化碳和氢气合成乙醇的反应成为现实:2CO2(g)+6H2(g)⇌CH3CH2OH(g)+3H2O(g).在温度为T℃,容积不变的密闭容器中,将3molH2和1molCO2混合,达到平衡时乙醇气体的体积分数为a,下列有关说法正确的是( )
A. 升高温度,该反应的平衡常数将增大
B. 再向该容器中充入1molH2和1molCO2,达到平衡时,H2的转化率将高于CO2
C. 加入催化剂或从平衡混合气中分离出水蒸气均可提高CO2和H2的利用率
D. T℃,在容积可变的密闭容器中将3molH2和1molCO2混合,达到平衡时乙醇的体积分数大于a Jackmore1年前1
Jackmore1年前1 -
 sharp_2005 共回答了17个问题
sharp_2005 共回答了17个问题 |采纳率100%解题思路:根据催化剂、温度、浓度对化学反应速率和化学平衡的影响来分析解答,注意题中没有明确该反应为吸热还是放热,温度变化不能确定移动方向.A.题中没有明确该反应为吸热还是放热,温度变化不能确定移动方向,则不能确定平衡常数的变化,故A错误;
B.如加入3olH2和1molCO2,二者的转化率相等,此时加入1molH2和1molCO2,n(H2):n(CO2)<3:1,加入CO2的量相对较多,则达到平衡时,H2的转化率将高于CO2,故B正确;
C.加入催化剂不能改变平衡移动,故C错误;
D.如在恒容条件下进行,随着反应进行,容器的压强逐渐减小,但在体积可变的容器中进行,压强不变,相当于在原来的基础上增大压强,有利于平衡向正反应方向移动,则达到平衡时乙醇的体积分数大于a,故D正确.
故选BD.点评:
本题考点: 化学平衡的影响因素.
考点点评: 本题考查化学反应速率和化学平衡知识,易错点为利用化学平衡知识判断反应吸热还是放热时,一定要注意温度的变化使反应正向移动还是逆向移动,倘若给出的信息为温度条件则无法判断,升高温度化学平衡向吸热的方向移动,而吸热反应取决于反应物与生成物总能量的相对大小.1年前查看全部
- MgCl2溶液加热蒸干,并在300℃灼烧至质量不变,最终残留固体为
MgCl2溶液加热蒸干,并在300℃灼烧至质量不变,最终残留固体为
应该是MgCl2,虽然有水解成Mg(OH)2,然后分解成MgO的过程,
但是,Mg2+水解程度很小,在这个过程中可以不考虑水解问题。
类型一样的如:FeCl3和AlCl3则必须考虑水解。 lemonljw1年前1
lemonljw1年前1 -
 qingwu2005 共回答了35个问题
qingwu2005 共回答了35个问题 |采纳率85.7%是的,水解量很少,可以认为不水解.得到的就是氯化镁固体,继续加热和加热助熔剂的情况下会熔化.化工上就是将氯化镁溶液蒸发,熔化后电解来制取金属镁.这是一个比较稳定的反应,没有什么争议.不信的话可以查询海水制镁的化学工艺.1年前查看全部
- 玻璃在200℃时熔化,当温度升到300℃时还没有熔化完,由此可知( )
玻璃在200℃时熔化,当温度升到300℃时还没有熔化完,由此可知( )
A. 玻璃变大了
B. 玻璃是晶体
C. 玻璃是非晶体
D. 玻璃难熔化 amyslh1年前1
amyslh1年前1 -
 晓风残月阳 共回答了14个问题
晓风残月阳 共回答了14个问题 |采纳率92.9%解题思路:根据我们对晶体和非晶体熔化过程的了解来作答.常见的晶体有各种金属,海波,冰;常见的非晶体有石蜡,玻璃,沥青,松香.晶体有一定的熔化温度,在熔化的过程中虽然吸热但温度是不变的;非晶体没有一定的熔化温度,在熔化时吸热升温.玻璃在200℃时熔化,当温度升到300℃时还没有熔化完,说明玻璃熔化时温度不断上升,没有固定的熔点,故玻璃是非晶体.
故选C.点评:
本题考点: 晶体和非晶体的区别.
考点点评: 本题考查了晶体和非晶体的区别:晶体和非晶体的区别是晶体有确定的熔点和凝固点,而非晶体没有.难度不大,是一道热学的基础题.1年前查看全部
- 混合下列各组物质使之充分反应,加热蒸干产物并在300℃灼烧至质量不变,最终残留固体为纯净物的是 [
混合下列各组物质使之充分反应,加热蒸干产物并在300℃灼烧至质量不变,最终残留固体为纯净物的是 []A.向CuSO 4 溶液中加入一小块金属钠
B.在NaBr溶液中通入少量氯气
C.等物质的量的NaHCO 3 与Na 2 O 2 固体
D.等物质的量浓度、等体积的(NH 4 ) 2 SO 4 与BaC1 2 溶液 jiuaiwuqi1年前1
jiuaiwuqi1年前1 -
 牧帆 共回答了16个问题
牧帆 共回答了16个问题 |采纳率87.5%D1年前查看全部
- 在容积为2L的密闭容器中进行反应:CO(g)+2H2(g)⇌CH3OH(g),其他条件不变,在300℃和500℃时,物质
 在容积为2L的密闭容器中进行反应:CO(g)+2H2(g)⇌CH3OH(g),其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图,下列说法正确的是( )
在容积为2L的密闭容器中进行反应:CO(g)+2H2(g)⇌CH3OH(g),其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图,下列说法正确的是( )
A.该反应的△H>0
B.其他条件不变,升高温度反应的平衡常数增大
C.300℃时,0-t1min内CH3OH的平均生成速率为
mol•L-1 min-1n1 2t1
D.A点的反应体系从300℃升高到500℃,达到平衡时
减小n(H2) n(CH3OH)  zmm11201年前1
zmm11201年前1 -
 新凤凰 共回答了9个问题
新凤凰 共回答了9个问题 |采纳率77.8%解题思路:A、由图象可知,温度越高,到达平衡时甲醇的物质的量越小,故升高温度平衡向逆反应移动,据此判断;
B、由图象可知,温度越高,到达平衡时甲醇的物质的量越小,升高温度平衡向逆反应移动,平衡常数减小;
C、平衡时甲醇的物质的量为n1mol,根据v=
,计算v(CH3OH);△n V △t
D、A点的反应体系从300℃升高到500℃,甲醇的物质的量减小,平衡向逆反应,氢气的物质的量增大,据此判断.A、由图象可知,温度越高,到达平衡时甲醇的物质的量越小,故升高温度平衡向逆反应移动,该反应正反应是放热反应,即△H<0,故A错误;
B、由图象可知,温度越高,到达平衡时甲醇的物质的量越小,升高温度平衡向逆反应移动,平衡常数减小,故B错误;
C、平衡时甲醇的物质的量为n1mol,v(CH3OH)=
n1mol
2L
t1min=
n1
2t1mol•L-1•min -1,故C正确;
D、A点的反应体系从300℃升高到500℃,甲醇的物质的量减小,平衡向逆反应,氢气的物质的量增大,故达到平衡时
n(H2)
n(CH3OH)增大,故D错误;
故选C.点评:
本题考点: 化学平衡的影响因素;化学平衡建立的过程.
考点点评: 本题考查化学平衡图象、影响平衡的因素、平衡常数影响因素、化学反应速率的计算等,难度不大,注意掌握平衡移动原理,根据图象判断温度对平衡移动的影响.1年前查看全部
- 高中化学amolKOH和bmolKHCO3混合物25.60g,经300℃加热充分反应后减少4.90g(K的相对原子质量为
高中化学
amolKOH和bmolKHCO3混合物25.60g,经300℃加热充分反应后减少4.90g(K的相对原子质量为39).下列判断正确的是.
A.a<b B.a>b C.a+b=0.25 D.a+b=0.5
答案给的是A
求详细过程! funy19841年前2
funy19841年前2 -
 covertly_kiss 共回答了17个问题
covertly_kiss 共回答了17个问题 |采纳率100%正确答案:A
体系可能发生反应:
KOH + KHCO3 = H2O + K2CO3 ①
2KHCO3 = K2CO3 + H2O + CO2 ②
若减少的4.90g全部是H2O,则只进行反应①,需要反应物 4.9×(56+100)/18 = 42.5g
超过了总量,不可能.所以 KHCO3过量 ,先发生反应①,后发生反应②,产物中有CO2 .
A.根据上述分析,KHCO3的量大于KOH的量,即a<b,正确.
B.a>b,错.
D.如果a+b=0.50
KOH + KHCO3 = H2O + K2CO3
a a
2KHCO3 = K2CO3 + H2O + CO2
0.5-2a (0.5-2a)/2 (0.5-2a)/2
则 18a + (0.5-2a)×31 = 4.9 ,解得a = 0.241
KOH质量 0.241×56 = 13.5g ,KHCO3质量 0.259×100 = 25.9g ,不符合,所以D错.
C.a+b=0.25 即D选项减半,计算同理,也不符合,C错.1年前查看全部
- (2012•丰泽区质检)碱式碳酸镁在300℃分解的化学方程式是:Mg2(OH)2CO3
(2012•丰泽区质检)碱式碳酸镁在300℃分解的化学方程式是:Mg2(OH)2CO3
2MgO+X+CO2↑,生成物X的化学式是( )△ .
A.H2O
B.O2
C.H2
D.CH4 混世霸主1年前1
混世霸主1年前1 -
 qqbbb 共回答了24个问题
qqbbb 共回答了24个问题 |采纳率91.7%解题思路:由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断生成物X的化学式.根据反应的化学方程式,反应物中镁、氧、氢、碳原子个数分别为2、5、2、1,反应后的生成物中镁、氧、氢、碳原子个数分别为2、4、0、1,根据反应前后原子种类、数目不变,则每个X分子由2个氢原子和1个氧原子构成,则物质X的化学式为H2O.
故选:A.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本题难度不大,利用化学反应前后元素守恒、原子守恒来确定物质的化学式是正确解题的关键.1年前查看全部
- 据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实,其反应的化学方程式为:2CO 2 (g)+6H 2
据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实,其反应的化学方程式为:2CO 2 (g)+6H 2 (g)
 CH 3 CH 2 OH(g)+3H 2 O(g) 。 下列叙述正确的是
CH 3 CH 2 OH(g)+3H 2 O(g) 。 下列叙述正确的是 A.当v(CO 2 )=2v(CH 3 CH 2 OH)时,反应一定达到平衡状态 B.当平衡向正方向移动时,平衡常数一定增大 C.增大压强,可提高CO 2 和H 2 的转化率 D.相同条件下,2 mol氢原子所具有的能量等于1 mol氢分子所具有的能量  mirror8403291年前1
mirror8403291年前1 -
 痞子孔 共回答了15个问题
痞子孔 共回答了15个问题 |采纳率86.7%C
1年前查看全部
- 据报道,在300℃、70 MPa下由二氧化碳和氢气合成乙醇已成为现实:2CO 2 (g)+6H 2 (g) CH 3 C
据报道,在300℃、70 MPa下由二氧化碳和氢气合成乙醇已成为现实:2CO 2 (g)+6H 2 (g)  CH 3 CH 2 OH(g)+3H 2 O(g),下列叙述中错误的是 [ ]
CH 3 CH 2 OH(g)+3H 2 O(g),下列叙述中错误的是 [ ]A.使用Cu-Zn-Fe催化剂可大大提高生产效率
B.反应需在300℃条件下进行可推测该反应是吸热反应
C.充入大量CO 2 气体可提高H 2 的转化率
D.从平衡混合气体中分离出CH 3 CH 2 OH和H 2 O可提高CO 2 和H 2 的利用率 灵动神彩1年前1
灵动神彩1年前1 -
 多里个多 共回答了20个问题
多里个多 共回答了20个问题 |采纳率90%B1年前查看全部
- 2.5Mpa水蒸汽,温度300℃,流量30吨/小时,请问其体积流量是多少m3/h?
 207020701年前1
207020701年前1 -
 天青色等烟雨s 共回答了26个问题
天青色等烟雨s 共回答了26个问题 |采纳率88.5%30吨水的摩尔数=1.67*10^6
利用克拉伯龙方程PV=nRT
R=8.31帕·米3/摩尔·K T=300+273.1=573.1K
求得V=3.175*10^3m3
流量为3.175*10^3m3/h1年前查看全部
- 计算硅在-78℃,27℃,300℃时的本征费米能级,假设它在禁带中线处合理吗?
 Bahamut_0011年前1
Bahamut_0011年前1 -
 wildwestwind 共回答了17个问题
wildwestwind 共回答了17个问题 |采纳率94.1%对si而言可以,只要看㏑(Nc/Nv)是不是1的数量级,是即可1年前查看全部
- 300℃时将100mL由H2O\CO2\H2和CO组成的混合气体与足量的 Na2O2,容器内压强只有原来的五分之一
300℃时将100mL由H2OCO2H2和CO组成的混合气体与足量的 Na2O2,容器内压强只有原来的五分之一
在密闭容器中,300℃时将100mL由H2O、CO2、H2和CO组成的混合气体与足量的Na2O2在连续电火花作用下充分反应后,容器内压强只有原来的五分之一,则原混合气体中各组分的体积比不可能是 ( )
A.1∶1∶1∶1 B.3∶1∶2∶4 C.1∶3∶5∶1 D.2∶2∶3∶3 dream231年前1
dream231年前1 -
 9978 共回答了17个问题
9978 共回答了17个问题 |采纳率88.2%由方程式可知,每mol氢气与一氧化碳的耗氧量是一样的,每摩水和二氧化碳生成氧气的量也是一样的,所以在这个情况下,可以将1:1的H2O与CO转化成1:1的H2与CO2,这样再来看这四个选项,将他们按此法转化成CO2:氢气:CO,有
A1:1B4:5:1C2:3D4:5:1
由于每mol氢气与一氧化碳的耗氧量一样,可将一氧化碳也转化为氢气,故有
A1:1BCD2:3
A情况50mlCO2生成25ml氧气,与H2恰好完全反应,50ml水蒸气,生成25mlO2不符合
BCO2 40ml,H2 60ml,CO2 40ml生成20ml氧气,与40mlH2生成40ml水蒸气,又生成20ml氧气,10ml氧气与氢气反应生成20ml水蒸气,又生成10mlO2,合计剩余20mlO2符合题意,故选A1年前查看全部
- (2013•长宁区一模)下列各组物质混合后,再加热蒸干并在300℃时充分灼烧至质量不变,最终可能得到纯净物的是( )
(2013•长宁区一模)下列各组物质混合后,再加热蒸干并在300℃时充分灼烧至质量不变,最终可能得到纯净物的是( )
A.向FeSO4溶液中通入Cl2
B.向KI和NaBr混合溶液中通入Cl2
C.向NaAlO2溶液中加入HCl溶液
D.向NaHCO3溶液中加入Na2O2粉末 浙江传ww1年前1
浙江传ww1年前1 -
 unrealworks 共回答了20个问题
unrealworks 共回答了20个问题 |采纳率80%解题思路:A.根据硫酸难挥发,盐酸易挥发,FeSO4溶液和过量Cl2反应生成Fe2(SO4)3和FeCl3,Fe2(SO4)3再加热蒸干得到硫酸铁;FeCl3再加热蒸干,得到后氢氧化铁来解答;
B.根据KI、NaBr在高温下不会分解,氯气会把碘和溴氧化出来,最终碘和溴和水挥发,只剩KCl、NaCl来解答;
C.向NaAlO2溶液中加入HCl溶液反应生成氢氧化铝和氯化钠,过量时生成氯化钠和氯化铝溶液,加热蒸发得到氢氧化铝和氯化钠;
D.1mol过氧化钠与水反应生成2mol氢氧化钠,氢氧化钠与碳酸氢钠按1:1恰好反应生成碳酸钠.A.FeSO4溶液和过量Cl2反应生成Fe2(SO4)3和FeCl3,Fe2(SO4)3加热水解生成氢氧化铁和硫酸,硫酸难挥发,再加热蒸干并在300℃时充分灼烧至质量不变得到硫酸铁;FeCl3加热水解生成氢氧化铁和氯化氢,灼烧后氢氧化铁分解产生氧化铁和水,所以得到的是Fe2(SO4)3和Fe2O3混合物,故A错误;
B.因KI NaBr在高温下不会分解,氯气会把碘和溴氧化出来,加热蒸干、灼烧至质量不变,碘升华,溴和水挥发,加热蒸干、灼烧,残留固体为KCl、NaCl混合物,故B错误;
C.向NaAlO2溶液中加入适量HCl溶液反应生成氢氧化铝和氯化钠,过量时生成氯化钠和氯化铝溶液,加热蒸发得到氢氧化铝和氯化钠混合物,加热蒸干、灼烧,残留固体为氧化铝和氯化钠,故C错误;
D.1mol过氧化钠与水反应生成2mol氢氧化钠,2mol氢氧化钠与2mol碳酸氢钠按恰好反应生成碳酸钠,加热蒸干、灼烧,残留固体为碳酸钠,故D正确;
故选D.点评:
本题考点: 氯气的化学性质;钠的重要化合物;镁、铝的重要化合物.
考点点评: 本题考查了物质性质的应用,物质反应量不同产物不同,水解的盐蒸干溶液得到水解产物还是原溶质取决于水解生成物的挥发性,盐的性质,题目难度中等.1年前查看全部
- 18.4克NaOH和NaHCO3固体混合物,在密闭容器中加热到约300℃时,经充分反应后排出气体,冷却,称得剩余固体质量
18.4克NaOH和NaHCO3固体混合物,在密闭容器中加热到约300℃时,经充分反应后排出气体,冷却,称得剩余固体质量为16.6克,则原混合物组成为?
A.NaOH的物质的量小于NaHCO3物质的量
B.NaOH与NaHCO3物质的量相等
C.NaOH物质的量大于NaHCO3物质的量
D.NaOH与NaHCO3以任意比混合 夜里oo的男人1年前4
夜里oo的男人1年前4 -
 baichia123 共回答了14个问题
baichia123 共回答了14个问题 |采纳率100%18.4-16.2=1.8g,1.8这个数据和后H2O 的相对分子质量很有关系(恰好0.1mol),所以气体是H2O,那么碳酸氢钠不足量或两者相等,
NaOH+NaHCO3==加热==Na2CO3+H2O
碳酸氢钠和氢氧化钠各0.1mol时总质量为12.4g,比18.4g少,所以氢氧化钠过量(多的6g都是氢氧化钠,即0.15mol),所以氢氧化钠0.25mol,碳酸氢钠0.1mol.
希望对你有所帮助!
不懂请追问!
望采纳!1年前查看全部
- (2013•威海模拟)据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实,其反应的化学方程式为:2CO2
(2013•威海模拟)据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实,其反应的化学方程式为:2CO2(g)+6H2(g)⇌(g)+3H2O(g). 下列叙述正确的是( )
A.当v(CO2)=2v(CH3CH2OH)时,反应一定达到平衡状态
B.当平衡向正方向移动时,平衡常数一定增大
C.增大压强,可提高CO2和H2的转化率
D.相同条件下,2mol氢原子所具有的能量等于1 mol氢分子所具有的能量 rita01201年前1
rita01201年前1 -
 天人合一厚德载物 共回答了20个问题
天人合一厚德载物 共回答了20个问题 |采纳率80%解题思路:A.未指明正、逆反应速率,不能判断反应是否到达平衡状态;
B.平衡向正反应移动,不一定是改变温度引起平衡的移动;
C.增大压强平衡向气体体积减小的方向移动,据此判断;
D.氢原子之间形成化学键释放能量,据此判断.A.若表示不同方向的正、逆反应速率,则反应到达平衡,若为同一方向速率,则反应始终按此关系进行,不能说明到达平衡,故A错误;
B.平衡常数只受温度影响,温度不变平衡常数不变,平衡向正反应移动,不一定是改变温度引起平衡的移动,故平衡常数不一定增大,故B错误;
C.该反应正反应是气体体积减小的反应,增大压强平衡向正反应移动,可提高CO2和H2的转化率,故C正确;
D.氢原子结合生成氢气分子,氢原子之间形成化学键释放能量,2mol氢原子所具有的能量高于1 mol氢分子所具有的能量,故D错误;
故选C.点评:
本题考点: 化学平衡的影响因素;化学平衡状态的判断.
考点点评: 本题考查化学平衡状态判断、化学平衡的影响因素、化学平衡常数、化学反应热效应等,难度不大,A选项为易错点,容易忽略正、逆速率,注意理解外界条件对化学平衡及平衡常数的影响.1年前查看全部
- (2011•淮安二模)已知300℃、70MPa下由二氧化碳和氢气合成乙醇的反应成为现实:2CO2(g)+6H2(g)⇌C
(2011•淮安二模)已知300℃、70MPa下由二氧化碳和氢气合成乙醇的反应成为现实:2CO2(g)+6H2(g)⇌CH3CH2OH(g)+3H2O(g).在温度为T℃,容积不变的密闭容器中,将3molH2和1molCO2混合,达到平衡时乙醇气体的体积分数为a,下列有关说法正确的是( )
A.升高温度,该反应的平衡常数将增大
B.再向该容器中充入1molH2和1molCO2,达到平衡时,H2的转化率将高于CO2
C.加入催化剂或从平衡混合气中分离出水蒸气均可提高CO2和H2的利用率
D.T℃,在容积可变的密闭容器中将3molH2和1molCO2混合,达到平衡时乙醇的体积分数大于a ltcdma7891年前1
ltcdma7891年前1 -
 风一样的翱翔 共回答了25个问题
风一样的翱翔 共回答了25个问题 |采纳率84%解题思路:根据催化剂、温度、浓度对化学反应速率和化学平衡的影响来分析解答,注意题中没有明确该反应为吸热还是放热,温度变化不能确定移动方向.A.题中没有明确该反应为吸热还是放热,温度变化不能确定移动方向,则不能确定平衡常数的变化,故A错误;
B.如加入3olH2和1molCO2,二者的转化率相等,此时加入1molH2和1molCO2,n(H2):n(CO2)<3:1,加入CO2的量相对较多,则达到平衡时,H2的转化率将高于CO2,故B正确;
C.加入催化剂不能改变平衡移动,故C错误;
D.如在恒容条件下进行,随着反应进行,容器的压强逐渐减小,但在体积可变的容器中进行,压强不变,相当于在原来的基础上增大压强,有利于平衡向正反应方向移动,则达到平衡时乙醇的体积分数大于a,故D正确.
故选BD.点评:
本题考点: 化学平衡的影响因素.
考点点评: 本题考查化学反应速率和化学平衡知识,易错点为利用化学平衡知识判断反应吸热还是放热时,一定要注意温度的变化使反应正向移动还是逆向移动,倘若给出的信息为温度条件则无法判断,升高温度化学平衡向吸热的方向移动,而吸热反应取决于反应物与生成物总能量的相对大小.1年前查看全部
- 据报道:在 300℃、70MPa下的密闭容器中、由二氧化碳和氢气合成乙醇已成为现实:2CO2(g)+6H2(g
据报道:在 300℃、70MPa下的密闭容器中、由二氧化碳和氢气合成乙醇已成为现实:2CO2(g)+6H2(g)⇌CH3CH2OH(g)+3H2O(g).下列叙述正确的是( )
A.使用合适的催化剂可提高生产效率
B.反应在高压下进行有利于平衡向正反应方向移动
C.充入大量 CO2 气体不能提高 H2 的转化率
D.从平衡混合气体中分离出 CH3CH2OH 和水蒸气不能提高 CO2的利用率 gyf82101年前1
gyf82101年前1 -
 zhhliu2002 共回答了23个问题
zhhliu2002 共回答了23个问题 |采纳率87%解题思路:A、催化剂增大反应速率缩短达到平衡的时间,提高生产效率;
B、反应是气体体积减小的反应,压强增大,平衡向气体体积减小的方向进行;
C、加入二氧化碳会提高氢气的转化率;
D、分离出生成物,平衡正向进行;A、因催化剂能提高化学反应速率,加快反应进行,则在一定时间内提高了生产效率,故A正确;
B、反应是气体体积减小的反应,反应在高压下进行有利于平衡向正反应方向移动,故B正确;
C、充入大量CO2气体,能使平衡正向移动,提高H2的转化率,故C错误;
D、从平衡混合物中及时分离出产物,使平衡正向移动,可提高CO2和H2的转化率,故D错误;
故选:AB.点评:
本题考点: 化学平衡的影响因素.
考点点评: 本题考查化学反应速率和化学平衡知识,一定要注意压强的变化使反应正向移动还是逆向移动,化学平衡移动原理和反应特征是解题关键,题目难度中等.1年前查看全部
- 碱式碳酸镁在300℃分解的化学方程式是:Mg 2 (OH) 2 CO 3 △ 2MgO + X + CO 2 ↑,生成物
碱式碳酸镁在300℃分解的化学方程式是:Mg 2 (OH) 2 CO 3 △ 2MgO + X + CO 2 ↑,生成物X的化学式是
A.H 2 O B.O 2 C.H 2 D.CH 4  wfh54874461年前1
wfh54874461年前1 -
 霏霏碧尔 共回答了21个问题
霏霏碧尔 共回答了21个问题 |采纳率95.2%A
根据:Mg 2 (OH) 2 CO 3 △ 2MgO + X + CO 2 ↑,可知,每个X中含有2个氢原子和1个氧原子,是水故选A1年前查看全部
- 将168gNaHCO3加热到300℃产物有Na2CO3,H2O,CO2.1计算残留物体的物质的量是多?2生成的CO2标况
将168gNaHCO3加热到300℃产物有Na2CO3,H2O,CO2.1计算残留物体的物质的量是多?2生成的CO2标况下是多少升?
 相当左_weq1年前2
相当左_weq1年前2 -
 lanbel168 共回答了18个问题
lanbel168 共回答了18个问题 |采纳率100%2NaHCO3(加热)=Na2CO3+CO2+H2O
2:1 :1
nNaHCO3=168/84=2mol
n剩余物体=1mol
生成CO2=22.4X1=22.4L1年前查看全部
- 将126克的NaHCO3加热到300℃,充分反应后,则残留固体的物质的量是()生成CO2的体积在标准状况下是()
 zhlben11161年前1
zhlben11161年前1 -
 偷米 共回答了13个问题
偷米 共回答了13个问题 |采纳率92.3%2NaHCO3=加热=Na2CO3+H2O+CO2
168 106 44
126g x y
168/126g=106/x=44/y
x=79.5g y=33g
残留固体的物质的量是( 79.5/106=0.75mol )
生成CO2的体积在标准状况下是( 22.4*33/44=16.8L )1年前查看全部
- ⑵500℃,上述反应达到平衡时NO的浓度为 ⑶300℃时,反应达到平衡,N2的浓度为_______
⑵500℃,上述反应达到平衡时NO的浓度为 ⑶300℃时,反应达到平衡,N2的浓度为_______
⑵500℃,上述反应达到平衡时NO的浓度为
⑶300℃时,反应达到平衡,N2的浓度为________,NO的转化率为
⑷在其他条件不变的情况下,将处于E点的体积压缩到原来的一半,
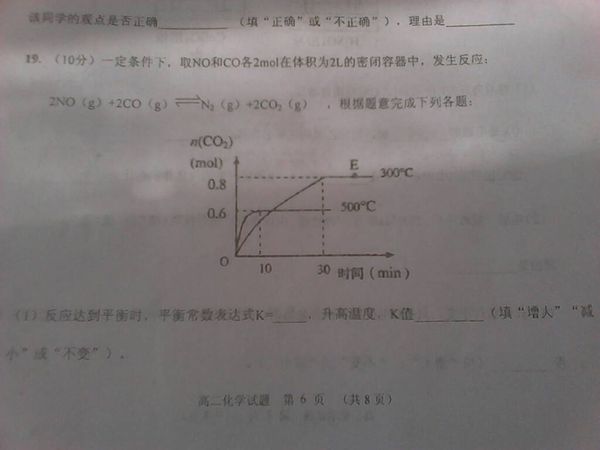
 668489371年前0
668489371年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 0.9—1.0Mpa 300℃蒸汽是过热蒸汽还是饱和蒸汽
 李凯19831年前1
李凯19831年前1 -
 panyuqi 共回答了16个问题
panyuqi 共回答了16个问题 |采纳率87.5%过热蒸汽.
饱和蒸汽的压力和温度是有一定比值的而且固定不变.
1.0Mpa的饱和蒸汽温度应该是183摄氏度.温度超过这个数值则是饱和蒸汽.1年前查看全部
- 求NaO2和NH4HCO3固体混合加热至300℃反应方程式
 拂晓起航1年前1
拂晓起航1年前1 -
 shss5678 共回答了15个问题
shss5678 共回答了15个问题 |采纳率93.3%2Na2O2+NH4HCO3=加热=2NaOH+Na2CO3+O2↑+NH3 ↑1年前查看全部
- 34.300℃时,体积为1L的密闭容器中充入16.20g SO2Cl2,达到平衡时容器中含SO27.616g.若在上述中

34.300℃时,体积为1L的密闭容器中充入16.20g SO2Cl2,达到平衡时容器中含SO27.616g.若在上述中的平衡体系中,再加入16.20g SO2Cl2,当再次达平衡时,容器中含SO2的质量范围是_____________________________________________. 小卉1年前1
小卉1年前1 -
 zxwcq 共回答了15个问题
zxwcq 共回答了15个问题 |采纳率93.3%根据K值来做,K值只与温度有关,还有那个题目有一定的问题,SO2CL2他不能写液态的,应该写气态,自己做吧,没有计算器比较麻烦啦,1年前查看全部
- 300℃时,将2 mol A和 2 mol B两种气体混合于2
300℃时,将2 mol A和 2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g)  2C(g)+2D(g);ΔH=Q,2 min末达到平衡,生成0.8 mol D.
2C(g)+2D(g);ΔH=Q,2 min末达到平衡,生成0.8 mol D.
(1)升高温度C的百分含量增大,则ΔH________0(填“>”或“<”).
(2)在2 min末时,B的平衡浓度为________,D的平均 反应速率为_______________.
(3)若温度不变,缩小容器容积,则A的转化率______(填“增大”、“减小”或“不变”),原因是______________________.
(4)如果在相同的条件下,上述反应从逆反应方向进行, 开始时若加入C、D各4/3 mol.若使平衡时各物质的物质的量浓度与原平衡相同,则还原该加入B____________ mol. 撒缰的野马1年前1
撒缰的野马1年前1 -
 xxx999888 共回答了22个问题
xxx999888 共回答了22个问题 |采纳率81.8%1年前查看全部
- 水银温度计测量范围实验室里的水银温度计最大测量范围标记的是300℃,每小格代表温度2℃,但在80℃到300℃之间就省略了
水银温度计测量范围
实验室里的水银温度计最大测量范围标记的是300℃,每小格代表温度2℃,但在80℃到300℃之间就省略了每小格2℃的标记,也就是说从80到300之间只有10小格的间隔,这是为什么? w983121年前2
w983121年前2 -
 清醒的温柔 共回答了16个问题
清醒的温柔 共回答了16个问题 |采纳率81.3%很少有人像你这么细心和善于发现问题!读书的时候我没注意过这个,但是要解释也不难.
选水银做温度计的测温物质,一方面是由于水银的比热小吸热后温度变化较大,另一方面是因为水银的膨胀系数极为均匀,在各种不同的温度下,它的热膨胀系数都相同.
实际上在温度升高过程中,水银受热体积膨胀的同时,温度计的玻璃管及液泡部分的玻璃也受热膨胀,结果所读出的只不过是水银膨胀数值与玻璃膨胀数值之间的差数而已.所以水银温度计所测量的数值也不是很精确的.测量误差随着温度的升高会增大.因此在测量较低温度时可读出较细微的差别,测量较高温度时就不行了.即使80-300度也按2度的间隔刻标度,读出来的数据也没有意义.1年前查看全部
- 什么物质在300℃左右液态变成气态
什么物质在300℃左右液态变成气态
液态的物质在300℃时,可以变成气态了,压力不变化的情况下. 雪白的燧石1年前3
雪白的燧石1年前3 -
 易枝粉笔ㄑ 共回答了19个问题
易枝粉笔ㄑ 共回答了19个问题 |采纳率100%水的沸点是100度 当周围温度聚变到300度时 液态水在常压下直接转变为气态1年前查看全部
大家在问
- 16时40分=( )时要算式和解题思路
- 2藻类、苔藓类、和蕨类植物主要区别是什么
- 3三条牛仔裤 英文翻译
- 4翻译成英语.Mary生病了,她的父母坚持要她去看医生.
- 5tell jokes tell sb sth tell sth to sb tell sb to do sth造句
- 6作文——让我怦然心动什么让我怦然心动 我也看了一些 可总感觉不合适呢 不知应怎样写 谁知道就提示一下
- 71 can you help her_______the things?2 does she want to go __
- 8100以内有哪些三个不同质数的积?
- 9一件夹克按成本价提高50%后标价,然后按标价的八折出售,每件仍盈利20元,这批夹克每件的成本价是多少元?
- 10爷爷70大寿,亲朋好友都前来祝贺.大家祝爷爷“福如东海,寿比南山”,可爷爷却叹道“?”我说“?”
- 11某管道由甲乙两人单独施工分别需要30天,20天完成.现在两队从两端同时施工,需要几天铺好?
- 12一、单选题:每题只有一个正确答案,请将答案填写在后面的答题表中(本题有30小题,每小题2分,共60分) 1.地球自转一周
- 13判断函数f(x)=log2^(根号下x^2+1 -x)的奇偶性
- 14英语选择--do you think he will come tonight?--oh,yes.It's_____ t
- 15求要像《紫藤萝瀑布》借景抒情作文,想《贝壳》一样的以物悟理作文,想《走一步,再走一步》以事悟理作文


