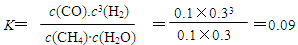用CO合成甲醇(CH3OH)的化学反应方程式为CO(g)+2H2(g)⇌CH3OH(g)△H<0.按照相同的物质的量投料
 891020112022-10-04 11:39:541条回答
891020112022-10-04 11:39:541条回答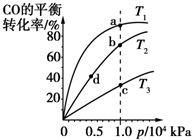 用CO合成甲醇(CH3OH)的化学反应方程式为CO(g)+2H2(g)⇌CH3OH(g)△H<0.按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )
用CO合成甲醇(CH3OH)的化学反应方程式为CO(g)+2H2(g)⇌CH3OH(g)△H<0.按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )A.正反应速率:v(a)>v(c) v(b)>v(d)
B.平衡时a点一定有n(CO):n(H2)=1:2
C.平衡常数:K(a)>K(c) K(b)=K(d)
D.平均摩尔质量:
. |
| M |
. |
| M |
. |
| M |
. |
| M |

已提交,审核后显示!提交回复
共1条回复
 sucharthu 共回答了23个问题
sucharthu 共回答了23个问题 |采纳率87%- 解题思路:A、根据温度、压强对化学反应速率的影响判断a和c、b和d的反应速率大小;
B、由于加入的一氧化碳和氢气的物质的量关系不知,无法判断达到平衡时a点一氧化碳和氢气的物质的量关系.;
C、根据反应为放热反应,温度越高,一氧化碳的转化率越低判断温度大小;再根据温度越高,化学平衡常数越小,判断各点的平衡常数关系;
D、CO转化率的越大,n总越小,由M=[M/n]判断.A、b、d两点的温度相同,但b点的压强大于d点,故v(b)>v(d),a、c两点的压强相同,但c点的温度高,则v(a)<v(c),故A错误;
B、平衡时一氧化碳和氢气的物质的量与投入的二者的物质的量有关,题中数据无法计算a点一氧化碳和氢气的物质的量,故B错误;
C、该反应的正反应为放热反应,温度升高,平衡向逆反应方向移动,CO的平衡转化率减小,结合图象知,T1<T2<T3,b、d温度相同,所以平衡常数相同,即K(b)=K(d);温度T1<T3,温度越高,该反应的平衡常数越小,所以K(a)>K(c),故C正确;
D、CO转化率的越大,n总越小,由M=[M/n]可知,a点n总小,则M(a)>M(c),M(b)>M(d),故D错误.
故选C.点评:
本题考点: 化学平衡的影响因素;转化率随温度、压强的变化曲线.
考点点评: 本题考查了温度、压强对反应速率和平衡状态的影响以及平衡常数的有关判断和计算,题目难度中等,该题是高考中的常见题型,试题综合性强,在注重对学生基础知识的巩固和训练的同时,侧重对学生基础知识的巩固和训练,有利于调动学生的逻辑推理能力和发散思维能力,提高学生灵活运用基础知识解决实际问题的能力. - 1年前
相关推荐
- Ⅰ:工业上用CO2和H2在一定条件发生如下反应合成甲醇并放出大量的热:CO2(g)+3H2(g)⇌CH3OH(g)+、H
 Ⅰ:工业上用CO2和H2在一定条件发生如下反应合成甲醇并放出大量的热:CO2(g)+3H2(g)⇌CH3OH(g)+、H2O(g)△H1 回答下列问题.
Ⅰ:工业上用CO2和H2在一定条件发生如下反应合成甲醇并放出大量的热:CO2(g)+3H2(g)⇌CH3OH(g)+、H2O(g)△H1 回答下列问题.
(1)已知:2H2(g)+O2(g)=2H2O(g)△H2
则反应2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g)△H=______(用含△H1、△H2表示)
(2)若反应温度升高,CO2的转化率______ (填“增大”“减小”或“不变”).
(3)写出在酸性环境中,甲醇燃料电池中的正极反应方程式______
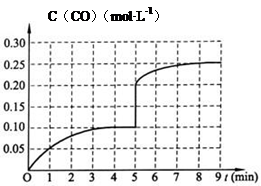
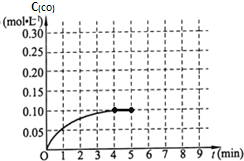
Ⅱ:生产甲醇的原料H2可用如下方法制得:CH4(g)+H2O(g)⇌CO(g)+3H2(g),一定温度下,将2mol CH4和4mol H2O通入容积为10L的密闭反应室中,反应中CO的物质的量浓度的变化情况如图所示,请回答下列问题:
(4)反应进行到4分钟到达平衡.请计算从反应开始到刚刚平衡,平均反应速率v(H2)为______;并求此反应在此温度下的平衡常数(在答题卡对应的方框内写出计算过程).
(5)在第5分钟时将容器的体积瞬间缩小一半后,若在第8分钟时达到新的平衡(此时CO的浓度约为0.25mol•L-1),请在图中画出第5分钟后H2浓度的变化曲线. caitaozeng1年前1
caitaozeng1年前1 -
 l1jw 共回答了13个问题
l1jw 共回答了13个问题 |采纳率69.2%解题思路:Ⅰ(1)根据已知方程利用盖斯定律计算2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g)△H;
(2)根据温度对平衡的影响分析;
(3)甲醇燃料电池,甲醇在负极失电子发生氧化反应,氧气在正极放电,酸性条件下生成水;
Ⅱ(4)根据图示可知4min反应达到平衡,平衡时CO的浓度为0.10mol/L,先计算用CO表示的速率,根据速率关系计算用氢气表示的速率;列出平衡浓度代入平衡常数表达式计算平衡常数;
(5)在第5分钟时将容器的体积瞬间缩小一半后,若在第8分钟时达到新的平衡(此时NO的浓度约为0.25mol•L-1),图象起点标对,拐点、平台、走势是绘制关键;先判断把容器的体积缩小一半的瞬间氢气的浓度,再结合平衡时的浓度作图.Ⅰ(1)①CO2(g)+3H2(g)⇌CH3OH(g)+、H2O(g)△H1
②2H2(g)+O2(g)=2H2O(g)△H2
根据盖斯定律,②×3-①×2得:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g)△H=3△H2-2△H1
故答案为:3△H2-2△H1;
(2)合成甲醇为放热反应,升高温度,平衡向吸热反应即逆反应方向移动,故二氧化碳的转化率减小;
故答案为:减小;
(3)甲醇燃料电池,甲醇在负极失电子发生氧化反应,氧气在正极放电,酸性条件下生成水,正极电极反应式为:O2+4e-+4H+═2H2O,
故答案为:O2+4e-+4H+═2H2O;
Ⅱ(4)根据图示可知4min反应达到平衡,平衡时CO的浓度为0.10mol/L,v(CO)=[0.1mol/L/4min]=0.025mol•L-1•min-1,
v(H2)=3v(CO)=0.025mol•L-1•min-1×3=0.075 mol•L-1•min-1;
CH4(g)+H2O(g)⇌CO(g)+3H2(g)
起始(mol•L-1)0.20.4
变化(mol•L-1)0.10.10.10.3
平衡(mol•L-1)0.10.30.10.3
K=
c(CO).c3(H2)
c(CH4)•c(H2O)=
0.1×0.33
0.1×0.3=0.09
故答案为:0.075 mol•L-1•min-1;0.09;
(5)把容器的体积缩小一半的瞬间CO的浓度变为0.20mol/L,氢气的浓度变为0.6mo/L,8min平衡后浓度CO浓度约为0.25mol/L,则
氢气浓度约为:0.75mol/L,第5分钟后H2浓度的变化曲线图象为: ;
;
故答案为: .
.点评:
本题考点: 用盖斯定律进行有关反应热的计算;化学平衡的影响因素;化学平衡的计算.
考点点评: 本题考查盖斯定律的应用、电极反应式的书写及化学反应速率的计算、平衡常数的计算、影响化学平衡的因素等知识,题目难度中等,注意掌握化学平衡、化学反应速率的概念及影响因素,画图时要注意5min时氢气的浓度和8min时氢气的浓度两个关键点.1年前查看全部
- Ⅰ.在一定条件下,科学家利用从烟道气中分离出CO 2 与太阳能电池电解水产生的H 2 合成甲醇,其过程如下图所示,试回答
Ⅰ.在一定条件下,科学家利用从烟道气中分离出CO 2 与太阳能电池电解水产生的H 2 合成甲醇,其过程如下图所示,试回答下列问题:

(1)该合成路线对于环境保护的价值在于 。
(2)15~20%的乙醇胺(HOCH 2 CH 2 NH 2 )水溶液具有弱碱性,上述合成线路中用作CO 2 吸收剂。用离子方程式表示乙醇胺水溶液呈弱碱性的原因 。
(3)CH 3 OH、H 2 的燃烧热分别为:△H=-725.5 kJ/mol、△H=-285.8 kJ/mol,写出工业上以CO 2 、H 2 合成CH 3 OH的热化学方程式: 。
Ⅱ.将燃煤废气中的CO 2 转化为甲醚的反应原理为:
2CO 2 (g) + 6H 2 (g) CH 3 OCH 3 (g) + 3H 2 O(g)
CH 3 OCH 3 (g) + 3H 2 O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO 2 的转化率见下表:投料比[n(H 2 ) / n(CO 2 )] 500 K 600 K 700 K 800 K 1.5 45% 33% 20% 12% 2.0 60% 43% 28% 15% 3.0 83% 62% 37% 22%
(4)该反应的焓变△H 0,熵变△S 0(填>、<或=)。
(5)用甲醚作为燃料电池原料,在碱性介质中该电池负极的电极反应式 。
(6)若以1.12 L·min -1 (标准状况)的速率向该电池中通入甲醚(沸点为-24.9 ℃),用该电池电解500 mL 2 mol·L -1 CuSO 4 溶液,通电0.50 min后,理论上可析出金属铜 g。 是你大爷的大爷1年前1
是你大爷的大爷1年前1 -
 seacy13 共回答了17个问题
seacy13 共回答了17个问题 |采纳率94.1%1年前查看全部
- 在一定条件下,科学家利用从烟道气中分离出CO2与太阳能电池电解水产生的H2合成甲醇,其过程如图所示,试回答下列问题:
在一定条件下,科学家利用从烟道气中分离出CO2与太阳能电池电解水产生的H2合成甲醇,其过程如图所示,试回答下列问题:
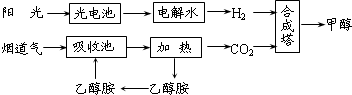
(1)该合成路线对于环境保护的价值在于______.
(2)15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作CO2吸收剂.用离子方程式表示乙醇胺水溶液呈弱碱性的原因:______.
(3)CH3OH(l)、H2的燃烧热分别为:△H=-725.5kJ/mol、△H=-285.8kJ/mol,写出工业上以CO2、H2合成CH3OH的热化学方程式:______.
(4)据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇也已成为现实.
2CO2(g)+6H2(g)⇌CH3CH2OH(g)+3H2O(g)下列叙述正确的是______.
a.使用Cu-Zn-Fe催化剂可大大提高生产效率
b.反应需在300℃进行可推测该反应是吸热反应
c.充入大量CO2气体可提高H2的转化率
d.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率. 宝刀06221年前1
宝刀06221年前1 -
 一支烟两支烟 共回答了17个问题
一支烟两支烟 共回答了17个问题 |采纳率94.1%解题思路:(1)根据二氧化碳产生的危害进行分析;
(2)氨基结合水电离平衡中的氢离子,促进水电离平衡正向进行,氢氧根离子浓度增大,溶液显碱性;
(3)利用盖斯定律计算反应热,并书写热化学方程式;
(4)根据催化剂、温度、浓度对化学反应速率和化学平衡的影响来分析解答,并注意吸热反应与反应的条件无关.(1)二氧化碳会产生温室效应,而本题中的反应恰好消耗了二氧化碳,有利于防止温室效应;
故答案为:减少烟道气中二氧化碳排放到空气中造成温室效应;
(2)乙醇胺水溶液呈弱碱性是取代基氨基结合氢离子,使溶液中的氢氧根离子浓度增大,反应的离子方程式为:HOCH2CH2NH2+H2O⇌HOCH2CH2NH3++OH-;
故答案为:HOCH2CH2NH2+H2O⇌HOCH2CH2NH3++OH-;
(3)甲醇和氢气的燃烧热书写其热化学方程式分别为:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l),△H1=-1451kJ/mol;
②2H2(g)+O2(g)=2H2O(l),△H2=-571.6KJ/mol,
根据盖斯定律,反应CO2(g)+3H2(g)═CH3OH(l)+H2O(l)
可以看成是方程式[3/2]×②-①×[1/2];所以△H=×[3/2](-571.6KJ/mol)-(-1451kJ/mol)×[1/2]=-131.9KJ/mol,
故答案为:CO2(g)+3H2(g)═CH3OH(l)+H2O(l),△H=-131.9KJ/mol;
(4)a、因催化剂能提高化学反应速率,加快反应进行,则在一定时间内提高了生产效率,故a对;
b、反应需在300℃进行是为了获得较快的反应速率,不能说明反应是吸热还是放热,故b错;
c、充入大量CO2气体,能使平衡正向移动,提高H2的转化率,故c对;
d、从平衡混合物中及时分离出产物,使平衡正向移动,可提高CO2和H2的转化率,故d对;
故选acd;
故答案为:acd;点评:
本题考点: 热化学方程式;化学平衡的影响因素;盐类水解的应用.
考点点评: 本题考查热化学方程式书写,燃烧热概念分析应用,流程分析,化学反应速率和化学平衡知识,易错点为利用化学平衡知识判断反应吸热还是放热时,一定要注意温度的变化使反应正向移动还是逆向移动,倘若给出的信息为温度条件则无法判断,升高温度化学平衡向吸热的方向移动,而吸热反应取决于反应物与生成物总能量的相对大小.题目难度中等.1年前查看全部
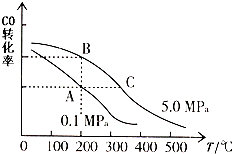
- (2012•闵行区二模)研究和开发CO2和CO的创新利用是环境保护和资源利用的双赢课题.CO可用于合成甲醇.在压强为0.
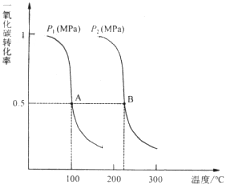 (2012•闵行区二模)研究和开发CO2和CO的创新利用是环境保护和资源利用的双赢课题.CO可用于合成甲醇.在压强为0.1MPa条件下,在体积为b L的密闭容器中充入a mol CO和2a mol H2,在催化剂作用下合成甲醇:CO(g)+2H2(g)⇌CH3OH(g),平衡时CO的转化率与温度、压强的关系如图:
(2012•闵行区二模)研究和开发CO2和CO的创新利用是环境保护和资源利用的双赢课题.CO可用于合成甲醇.在压强为0.1MPa条件下,在体积为b L的密闭容器中充入a mol CO和2a mol H2,在催化剂作用下合成甲醇:CO(g)+2H2(g)⇌CH3OH(g),平衡时CO的转化率与温度、压强的关系如图:
(1)压强P1、P2的大小关系为Pl______P2(填“大于”、“小于”或“等于”),A、B两点分别对应的平衡常数K1、K2的大小关系为K1______ K2(填“大于”、“小于”或“等于”).
(2)在温度为100℃、压强为Pl(MPa)条件下(恒温恒压),如果上述反应达平衡后,对此反应的说法一定正确的是______(选填答案编号).
a.2υ(CO)=υ(CH3OH)
b.n(CO):n(H2)=1:2
c.c(CO):c(H2):c(C H3OH)=l:2:1
d.平衡时混合气体的密度等于反应起始时的混合气体的密度
(3)在温度和容积不变的情况下,再向平衡体系中充入a mol CO(g)、2a mol H2(g),达到平衡时CO转化率______.(填“增大”、“不变”或“减小”,下同),平衡常数______.
(4)在某温度下,向一容积不变的密闭容器中充入2.5mol CO(g)、7.5mol H2(g),反应生成CH3OH(g),达到平衡时,CO转化率为90%,此时容器内压强为开始时压强的______倍. 龙祺儿1年前1
龙祺儿1年前1 -
 鬼门龙王傻aa 共回答了15个问题
鬼门龙王傻aa 共回答了15个问题 |采纳率93.3%解题思路:(1)根据定一议二原则,定温度同,再比较压强,即作垂直x轴的辅助线,比较平衡时CO的转化率,由此判断;
由图可知,压强一定时,随温度升高,CO的转化率降低,故升高温度平衡向逆反应移动,据此判断平衡常数大小;
(2)a.利用速率之比不等于化学计量数之比判断;
b.CO、H2的起始物质的量之比为1:2,等于化学计量数之比,平衡时n(CO):n(H2)=1:2;
c.计算平衡时据此反应的CO,进而计算生成的甲醇的物质的量、剩余CO的物质的量,据此计算c(CO):c(C H3OH),由b中分析可知,平衡时c(CO):c(H2)=1:2,据此解答;
d.反应混合气体的总质量不变,总的物质的量减小,平均摩尔质量增大,恒温恒压下,密度之比等于摩尔质量之比,据此判断;
(3)在温度和容积不变的情况下,再向平衡体系中充入a mol CO(g)、2a mol H2(g),等效为在原平衡的基础上增大一倍压强,平衡向正反应移动;
化学平衡常数只受温度影响,与浓度无关,温度不变,平衡常数不变;
(4)计算参加反应的CO的物质的量,利用差量法计算平衡时反应混合物的物质的量变化量,进而计算平衡时总的物质的量,利用恒温恒容下,压强之比等于物质的量之比解答.(1)温度相同时,作垂直x轴的辅助线,发现压强为P2的CO的转化率高,该反应正反应为体积减小的反应,压强增大平衡向体积减小的方向移动,即向正反应应移动,CO的转化率增大,所以P1<P2,
由图可知,压强一定时,随温度升高,CO的转化率降低,故升高温度平衡向逆反应移动,平衡常数减小,故K1>K2,
故答案为:小于;大于;
(2)a.速率之比不等于化学计量数之比,故a错误;
b.CO、H2的起始物质的量之比为1:2,等于化学计量数之比,平衡时n(CO):n(H2)=1:2,故b正确;
c.由图可知温度为100℃、压强为Pl(MPa)条件下(恒温恒压),反应达平衡时,CO的转化率为0.5,故参加反应CO的物质的量为0.5amol,由方程式可知,生成甲醇为0.5amol,故平衡时c(CO):c(C H3OH)=0.5a:0.5a=1:1,CO、H2的起始物质的量之比为1:2,等于化学计量数之比,平衡时c(CO):c(H2)=1:2,故平衡时c(CO):c(H2):c(C H3OH)=l:2:1,故c正确;
d.反应混合气体的总质量不变,总的物质的量减小,平均摩尔质量增大,恒温恒压下,密度之比等于摩尔质量之比,故密度增大,故d错误;
故答案为:bc;
(3)在温度和容积不变的情况下,再向平衡体系中充入a mol CO(g)、2a mol H2(g),等效为在原平衡的基础上增大一倍压强,平衡向正反应移动,CO的转化率增大,化学平衡常数只受温度影响,与浓度无关,温度不变,平衡常数不变,故答案为:增大;不变;
(4)参加反应的CO的物质的量为2.5mol×90%=2.25mol,则:
CO(g)+2H2(g)⇌CH3OH(g),物质的量减少△n
1 2
2.25mol 4.5mol
故平衡时总的物质的量为2.5mol+7.5mol-4.5mol=5.5mol,恒温恒容下压强之比等于物质的量之比,故平衡时容器内压强为开始时压强的[5.5mol/2.5mol+7.5mol]=0.55倍,
故答案为:0.55.点评:
本题考点: 转化率随温度、压强的变化曲线.
考点点评: 本题考查平衡常数、化学平衡计算、化学平衡的影响因素及读图能力等,综合性较大,难度中等,应加强平时知识的积累,注意利用定一议二原则分析图象.1年前查看全部
- 用CO合成甲醇的化学方程式为:CO(g)+2H 2 (g)⇌CH 3 OH(g)△H<0,按照相同的物质的量投料,测得C
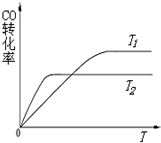
用CO合成甲醇的化学方程式为:CO(g)+2H 2 (g)⇌CH 3 OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( ) A.温度:T 1 >T 2 >T 3 B.正反应速率:υ(a)>υ(b)>υ(c) C.平衡常数:K(b)>K(d) D.CH 3 OH的体积分数ϕ(a)>ϕ(b)>ϕ(c) 
 hcbdda1年前1
hcbdda1年前1 -
 无须言 共回答了18个问题
无须言 共回答了18个问题 |采纳率94.4%A、:CO(g)+2H 2 (g)⇌CH 3 OH(g)△H<0,反应是放热反应,相同压强下,温度越高,平衡逆向进行,一氧化碳转化率越小,温度:T 1 <T 2 <T 3 ,故A错误;
B、反应是放热反应,相同压强下,温度越高,平衡逆向进行,温度:T 1 <T 2 <T 3 ,温度越高反应速率越大,所以正反应速率:υ(a)<υ(b)<υ(c),故B错误;
C、bd点是相同温度下的化学平衡,平衡常数随温度变化,温度不变,平衡常数不变,故C错误;
D、反应是放热反应,相同压强下,温度越高,平衡逆向进行,CH 3 OH的体积分数ϕ(a)>ϕ(b)>ϕ(c),故D正确;
故选D.1年前查看全部
- 甲醇具有开发和应用广阔的前景.工业上一般采用下列两种途径合成甲醇:
 甲醇具有开发和应用广阔的前景.工业上一般采用下列两种途径合成甲醇:
甲醇具有开发和应用广阔的前景.工业上一般采用下列两种途径合成甲醇:
途径Ⅰ:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H1
途径Ⅱ:CO(g)+2H2(g)⇌CH3OH(g)△H2
(1)上述反应符合“原子经济”规律的是______.
(2)下列各项中,能够说明反应Ⅱ已达到平衡的是______.
a.恒温、恒容条件下,容器内的压强不发生变化
b.一定条件下,CO、H2和CH3OH的浓度保持不变
c.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
d.一定条件下,单位时间内消耗1mol CO,同时生成1mol CH3OH
(3)如图是反应途径Ⅱ在不同温度下CO的转化率随时间变化的曲线.
①该反应的焓变△H2________0(填“>”、“<”或“=”).
②如表所列数据是反应途径Ⅱ在不同温度下的化学平衡常数(K).
请用化学平衡常数解释上面①中你的判断:______.温度 250℃ 350℃ K 2.041 0.012
(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-a kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H=-b kJ•mol-1
③H2O(g)=H2O(l)△H=-c kJ•mol-1
则,CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=[b−a−4c/2][b−a−4c/2]kJ•mol-1.
(5)用甲醇作燃料,KOH溶液作电解液,惰性电极材料组成的原电池工作时,其正极反应式______;负极反应式______. tim42mo1年前1
tim42mo1年前1 -
 y_oog64ev__l3841 共回答了22个问题
y_oog64ev__l3841 共回答了22个问题 |采纳率95.5%解题思路:(1)原子经济性主要是指原子利用率高,化合反应原子利用率是100%;
(2)可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析;
(3)①对于吸热反应,温度越高,K越大,反之越低,对于放热反应,温度越高,K越小,反之越大;
②根据温度对化学平衡移动的影响来回答判断即可;
(4)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标方程式,反应热越乘以相应的系数并进行相应的计算;
(5)根据燃料电池的工作原理规律:正极上是氧气得电子的还原反应,负极上是燃料失电子的氧化反应来回答.(1)反应Ⅱ属于化合反应,原子利用率是100%,符合“原子经济”规律,故答案为:Ⅱ;
(2)a.该反应是前后气体系数和不相等的反应,当恒温、恒容条件下,容器内的压强不发生变化,证明达到了平衡状态,故a正确;
b.一定条件下,CO、H2和CH3OH的浓度保持不变,是化学平衡状态的特征,故b正确;
c.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等,证明正逆反应速率相等,达到了平衡状态,故c正确;
d.一定条件下,单位时间内消耗1mol CO,同时生成1mol CH3OH,不能证明正逆反应速率相等,不一定达到了平衡状态,故d错误.
故选abc;
(3)①根据图示的数据可以知道,温度越高,K越小,所以反应是一个放热反应,故答案为:<;
②250℃的K值大于350℃的K值,说明升高温度,途径Ⅱ平衡向逆反应方向移动,因此,其正反应为放热反应,故答案为:250℃的K值大于350℃的K值,说明升高温度,途径Ⅱ平衡向逆反应方向移动,因此,其正反应为放热反应,△H2<0;
(4)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-a kJ•mol-1,
②2CO(g)+O2(g)=2CO2(g)△H=-b kJ•mol-1,
③H2O(g)=H2O(l)△H=-c kJ•mol-1,
根据盖斯定律可知,则[①−②+③×4/2]可得CH3OH(l)+O2(g)=CO(g)+2H2O(l),则△H=
(−a)−(−b)+(−c)×4
2kJ/mol=[b−a−4c/2]kJ/mol,
故答案为:[b−a−4c/2]kJ/mol;
(5)燃料电池的工作原理规律:正极上是氧气得电子的还原反应,在碱性环境下,电极反应式为:O2+2H2O+4e-=4OH-,负极上是燃料失电子的氧化反应,在碱性环境下,电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O,故答案为:O2+2H2O+4e-=4OH-;CH3OH-6e-+8OH-=CO32-+6H2O.点评:
本题考点: 化学平衡状态的判断;用盖斯定律进行有关反应热的计算;化学电源新型电池.
考点点评: 本题涉及电化学、热化学以及化学反应速率和平衡的影响因素、判断化学平衡的方法等知识,属于综合知识的考查,难度不大.1年前查看全部
- 在一定条件下,科学家利用从烟道气中分离出的CO2与太阳能电池电解水产生的H2合成甲醇(CH3OH)同时生成水,其过程如下
在一定条件下,科学家利用从烟道气中分离出的CO2与太阳能电池电解水产生的H2合成甲醇(CH3OH)同时生成水,其过程如下图所示,试回答下列问题:
(1)上述合成路线中用到15%~20%的乙醇胺(HOCH2CH2NH2),其水溶液具有弱碱性,它的作用是CO2吸收剂.乙醇胺由______种元素组成,其分子中碳、氢原子个数比为______.证明乙醇胺溶液呈碱性可用的试剂为______(只填一种).
(2)试写出上述合成线路中的任意两个化学反应的化学方程式:
①2H2O
2H2↑+O2↑通电 .2H2O;②______.
2H2↑+O2↑通电 .
(3)上述合成路线对于环境保护的价值在于______.
(4)上述合成线路中可以循环利用的物质为______. liang815001年前1
liang815001年前1 -
 rssme 共回答了18个问题
rssme 共回答了18个问题 |采纳率94.4%解题思路:(1)根据乙醇胺的化学式进行分析,
根据酸碱指示剂遇到酸性、碱性溶液的显色进行分析.
(2)①根据电解水的原理进行分析,
②根据题中的反应物、生成物书写方程式.
(3)根据二氧化碳产生的危害进行分析,
(4)根据乙醇胺在加热的条件下有分离出来了进行分析.(1)从乙醇胺的化学式可以看出,乙醇胺是由碳、氢、氧、氮四种元素组成的,而一个乙醇胺分子中有2个碳原子和7个氢原子,故答案为:4、2:7、
酸碱指示剂在酸性和碱性的液体中需显示不同的颜色,故答案为:无色酚酞;
(2)①水在通电的条件下生成氢气和氧气,故答案为:2H2O
通电
.
2H2↑+O2↑;
②氢气和二氧化碳反应生成甲醇和水,故答案为:3H2+CO2═CH3OH+H2O
(3)二氧化碳会产生温室效应,而本题中的反应恰好消耗了二氧化碳,故答案为:减少烟道气中二氧化碳排放到空气中造成温室效应;
(4)乙醇胺在加热后又从吸收池中分离出来,故答案为:乙醇胺点评:
本题考点: 书写化学方程式、文字表达式、电离方程式;二氧化碳对环境的影响;溶液的酸碱性测定;原子的有关数量计算;物质的元素组成.
考点点评: 在解此类方程式的书写题时,首先确定反应原理,然后再依据原理找出反应物、生成物和反应条件,根据方程式的书写规则书写方程式.通过该题,还需要掌握新知识现学现用的能力.1年前查看全部
- 甲醇是一种可再生能源,具有开发和应用的广阔前景.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)
甲醇是一种可再生能源,具有开发和应用的广阔前景.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)⇌CH3OH(g)△H1=-116kJ•mol-1
(1)下列有关上述反应的说法正确的是______.
a.恒温、恒容条件下,容器内的压强不发生变化则可逆反应达到平衡
b.一定条件下,H2的消耗速率是CO的消耗速率的2倍时可逆反应达到平衡
c.保持容器体积不变,升高温度可提高CO的转化率
d.使用合适的催化剂能缩短达到平衡的时间并提高CH3OH的产量
(2)在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律.图1是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系.
①在上述三种温度中,曲线Z对应的温度是______.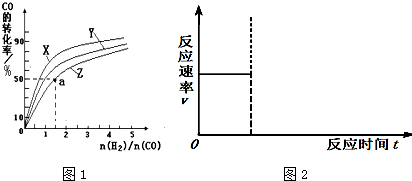
②利用图1中a点对应的数据,计算该反应在对应温度下的平衡常数K (写出计算过程).
③在答题卡相应位置上画出:上述反应达到平衡后,减小体系压强至达到新的平衡过程中,正逆反应速率与时间的变化关系图2并标注.
(3)已知:CO(g)+[1/2]O2(g)=CO2(g)△H2=-283kJ•mol-1H2(g)+[1/2]O2(g)=H2O(g)△H3=-242kJ•mol-1则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为CH3OH(g)+[3/2]O2(g)=CO2(g)+2H2O(g)△H=-651kJ•mol-1CH3OH(g)+[3/2]O2(g)=CO2(g)+2H2O(g)△H=-651kJ•mol-1. 刘小新1年前1
刘小新1年前1 -
 huhu龟 共回答了15个问题
huhu龟 共回答了15个问题 |采纳率86.7%解题思路:(1)根据反应方程式的特征,和平衡移动的相关知识,分析解答;
(2)①合成甲醇的反应是放热反应,温度升高,转化率降低;
②根据平衡常数的意义分析求解;
③上述反应达到平衡后,减小体系压强至达到新的平衡过程中,正逆反应速率都减小,且平衡正反应速率减小的幅度大,逆反应速率减小的幅度小,平衡逆向移动;
(3)根据盖斯定律和题中热化学方程式写出甲醇完全燃烧生成二氧化碳的热化学方程式;(1)a.恒温、恒容条件下,容器内的压强不发生变化,说明气体的总物质的量不变,则可逆反应达到平衡,故a正确;
b.一定条件下,H2的消耗速率是CO的消耗速率的2倍,都反映的是逆向,所以不一定达到平衡,故b错误;
c.保持容器体积不变,升高温度,平衡逆向移动,CO的转化率降低,故c错误;
d.使用合适的催化剂能缩短达到平衡的时间,平衡不移动,所以不改变CH3OH的产量,故d错误;故选:a;
(2)①根据反应CO(g)+2H2(g)⇌CH3OH(g)△H1=-116kJ•mol-1,是放热反应,温度越高,转化率越低,所以曲线Z对应的温度是270℃,
故答案是:270℃;
②根据图象可知CO的转化率为50%,H2的物质的量为1.5 mol
CO(g)+2H2(g)⇌CH3OH(g)
起始物质的量浓度(mol/L)11.5 0
转化物质的量浓度(mol/L)0.51 0.5
平衡物质的量浓度(mol/L)0.50.50.5
K=
c(CH3OH)
c2(H2)•c(CO)=
0.5mol/L
(0.5mol/L)2×0.5mol/L=4L2•mol−2
故答案为:4L2•mol-2;
③上述反应达到平衡后,减小体系压强至达到新的平衡过程中,正逆反应速率都减小,且平衡正反应速率减小的幅度大,逆反应速率减小的幅度小,平衡逆向移动
,所以图象为: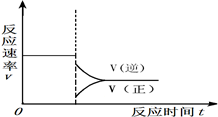 ,故答案为:
,故答案为: ;
;
(3)①CO(g)+2H2(g)⇌CH3OH(g)△H1=-116kJ•mol-1
②CO(g)+[1/2]O2(g)=CO2(g)△H2=-283kJ•mol-1
③H2(g)+[1/2]O2(g)=H2O(g)△H3=-242kJ•mol-1 根据盖斯定律:-①+②+③×2得:
CH3OH(g)+[3/2]O2(g)=CO2(g)+2H2O(g)△H=-651kJ•mol-1,
故答案是:CH3OH(g)+[3/2]O2(g)=CO2(g)+2H2O(g)△H=-651kJ•mol-1.点评:
本题考点: 化学平衡的影响因素;热化学方程式;转化率随温度、压强的变化曲线.
考点点评: 本题考查了影响反应速率的因素及反应平衡常数的计算、热化学方程式的书写等知识,注意盖斯定律的应用,本题难度中等1年前查看全部
- 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上采用如下反应合成甲醇:
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上采用如下反应合成甲醇:
CO(g)+2H2(g)⇌CH3OH(g),现模拟并分析该反应:
(1)能够说明该反应已达到平衡的是______:
a.恒温、恒容时,容器内的压强不再变化
b.恒温、恒容时,容器内混合气体的密度不再变化
c.一定条件下,CO、H2和CH3OH的浓度保持不变
d.一定条件下,单位时间内消耗2molH2的同时生成1mol CH3OH
(2)图1是该反应在不同温度下CO转化率随时间的变化曲线:
①该反应的△H______0(填“>”、“<”或“=”).
②T1和T2温度下的平衡常数:K1______K2(填“>”、“<”或“=”).
(3)2009年,长春应用化学研究所在甲醇燃料电池技术上获得新突破,原理如图2所示.
①甲醇完全燃烧的化学方程式2CH3OH+3O2
2CO2+4H2O点燃 2CH3OH+3O2.
2CO2+4H2O点燃
②请写出从C口通入O2发生的电极反应式______.
(4)用上述电池做电源,用图3装置电解饱和食盐水(C1、C2均为石墨电极).
①该反应的离子方程式2Cl-+2H2O
2OH-+H2↑+Cl2↑电解 .2Cl-+2H2O.
2OH-+H2↑+Cl2↑电解 .
②电解开始后在电极______的周围(填“C1”或“C2”)先出现红色. 太勤快累啊1年前1
太勤快累啊1年前1 -
 若曦1900 共回答了24个问题
若曦1900 共回答了24个问题 |采纳率79.2%解题思路:(1)可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析;(2))①先判断温度大小,然后根据温度对化学平衡的影响判断该反应的焓变;②该反应是放热反应,温度越高,平衡常数越小;(3)①甲醇与氧气反应生成二氧化碳和水,甲醇写出反应的化学方程式;②在甲醇燃料电池中,燃料甲醇作负极,发生失电子的氧化反应,氧气作正极,发生得电子的还原反应;(4)①电解饱和食盐水时,反应物为氯化钠和水,生成物为氢氧化钠、氢气和氯气,据此写出反应的离子方程式;②电解过程中,阳极氯离子失去生成氯气,阴极水电离的氢离子得到电子生成氢气,同时产生氢氧根离子.(1)a.由方程式可以看出,反应前后气体的物质的量不相等,只有达到平衡状态,容器压强不发生变化,表明正逆反应速率相等,反应达到平衡状态,故a正确;
b.恒温、恒容时,气体的总体积不变,反应前后都是气体,气体的总质量不变,所以气体的密度始终不变,混合气体密度不能作为判断平衡状态的依据,故b错误;
c、一定条件下,CO、H2和CH3OH的浓度保持不变,表明正逆反应速率相等,达到了平衡状态,故c正确;
d、一定条件下,单位时间内消耗2mol氢气,同时生成1molCH3OH,只能表明正反应速率,不能表示正逆反应速率相等,无法判断是否达到平衡状态,故d错误;
故选ac;
(2)①根据图可知T2时先达到平衡,所以T2>T1,温度升高,一氧化碳的转化率减小,说明该反应的正反应为放热反应,△H<0,
故答案为:<;
②该反应为放热反应,温度越高,化学平衡向着逆向移动,化学平衡常数减小,由于T2>T1,所以化学平衡常数:K1>K2,
故答案为:>;
(3)①甲醇与氧气点燃生成二氧化碳和水,反应的化学方程式为:2CH3OH+3O2
点燃
2CO2+4H2O,
故答案为:2CH3OH+3O2
点燃
2CO2+4H2O;
②原电池正极得到电子发生还原反应,该原电池中正极氧气得电子发生还原反应,其电极反应式为:O2+4e-+4H+=2H2O,
故答案为:O2+4e-+4H+=2H2O;
(4)①电解饱和食盐水生成氢氧化钠、氢气和氯气,反应的离子方程式为:2Cl-+2H2O
电解
.
2OH-+H2↑+Cl2↑,
故答案为:2Cl-+2H2O
电解
.
2OH-+H2↑+Cl2↑;
②电解反应中,阴极水电离的氢离子得到电子生成氢气,同时产生了氢氧根离子,所以在阴极C2 (连接电源负极的电极)先变红,
故答案为:C2.点评:
本题考点: 化学平衡状态的判断;原电池和电解池的工作原理;转化率随温度、压强的变化曲线.
考点点评: 本题考查了化学平衡状态判断、原电池与电解池工作原理等知识,题目难度中等,注意掌握原电池、电解池工作原理,能够正确判断电极并写出正确的电极反应,明确化学平衡状态的判断方法,试题有利于培养学生灵活应用所学知识的能力.1年前查看全部
- 已知C0和H2在一定条件下合成甲醇的反应为:CO(g)+2M2(g)⇌CH30H(g)现在容积均为1L的a、b、c三个密
已知C0和H2在一定条件下合成甲醇的反应为:CO(g)+2M2(g)⇌CH30H(g)现在容积均为1L的a、b、c三个密闭容器中分别充入1mol C0和2mol H2的混合气体,控制温度,进行反应,测得相关数据的关系如图1和图2所示.下列说法正确的是( )
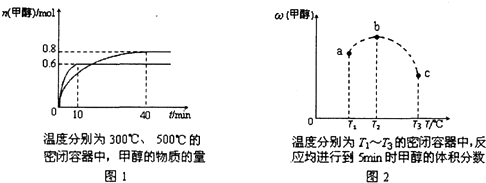
A.该反应的正反应的△H<0
B.反应进行到5min时,a容器中v(正)=v(逆)
C.升温或减压,可将b中的平衡状态转变成c中的平衡状态
D.达到平衡时,a、b、c中C0的转化率为b>a>c 孤光h1年前1
孤光h1年前1 -
 agd365 共回答了17个问题
agd365 共回答了17个问题 |采纳率82.4%解题思路:A、根据图1升判断出温度对平衡的影响,进而判断该反应的正反应是吸热反应还是放热反应,从图象可以看出,升高温度,甲醇的物质的量减少,说明正反应是放热反应;
B、根据图2,分析反应进行到5min时,a容器是否达到平衡状态来判断正逆反应速率的关系,反应进行到5min时,如达到平衡,升高温度甲醇的体积分数应达到最大值或减小,但图象中给出的是增大,说明还没有达到平衡状态;
C、b中的平衡状态转变成c中的平衡状态,甲醇的体积分数减小,说明平衡逆向移动,根据方程式的特点,升高温度或减压都可以;
D、根据温度对平衡的影响来判断,升高温度平衡逆向移动,CO的转化率减小.A、从图1可以看出,甲醇的物质的量为0.6mol的曲线大,说明反应温度高,升高温度,甲醇的物质的量减少,说明正反应是放热反应,故A正确;
B、从图2可以看出,反应进行到5min时,a容器的反应如达到平衡,升高温度,平衡向逆向移动,甲醇的体积分数应减小,但图象中给出的是增大,说明还没有达到平衡状态,故B错误;
C、b中的平衡状态转变成c中的平衡状态,甲醇的体积分数减小,说明平衡逆向移动,因为反应是放热反应,升高温度,平衡向逆向移动;又知反应物的化学计量数之和大于生成物的,增大压强,平衡逆向移动,故C正确;
D、达到平衡时,a、b、c三个容器的反应温度不同,a容器温度最低,c容器的反应温度最高,根据反应放热可判断出,升高温度,平衡逆向移动,甲醇的体积分数减小,故应为a>b>c,故D错误;
故选AC.点评:
本题考点: 物质的量或浓度随时间的变化曲线;产物的百分含量随浓度、时间的变化曲线.
考点点评: 本题考查化学平衡图象题,做题时注意从图象中曲线的变化趋势分析条件改变导致平衡移动的特点,本题难度较大.1年前查看全部
- 煤合成甲醇的工艺流程图
 朵朵_blue1年前1
朵朵_blue1年前1 -
 你的愚蠢让我郁闷 共回答了17个问题
你的愚蠢让我郁闷 共回答了17个问题 |采纳率94.1%煤与空气燃烧,加入水蒸气使之分解,反应生成氢气和一氧化碳、二氧化碳等,生成半水煤气.气体经过脱硫、变换、脱碳净化后脱除大部分的硫化氢和二氧化碳,氢气和一氧化碳、二氧化碳经铜锌系催化剂催化,高温反应生成甲醇.1年前查看全部
- 在一定条件下,科学家利用从烟道气中分离出的CO 2 与太阳能电池电解水产生的H 2 合成甲醇(CH 3 OH)同时生成水
在一定条件下,科学家利用从烟道气中分离出的CO 2 与太阳能电池电解水产生的H 2 合成甲醇(CH 3 OH)同时生成水,其过程如下图所示,试回答下列问题: 
(1)上述合成路线中用到15%~20%的乙醇胺(HOCH 2 CH 2 NH 2 ),其水溶液具有弱碱性,它的作用是CO 2 吸收剂.乙醇胺由______种元素组成,其分子中碳、氢原子个数比为______.证明乙醇胺溶液呈碱性可用的试剂为______(只填一种).
(2)试写出上述合成线路中的任意两个化学反应的化学方程式:
①______;②______.
(3)上述合成路线对于环境保护的价值在于______.
(4)上述合成线路中可以循环利用的物质为______. xhs5591年前1
xhs5591年前1 -
 晓若枫红 共回答了18个问题
晓若枫红 共回答了18个问题 |采纳率83.3%(1)从乙醇胺的化学式可以看出,乙醇胺是由碳、氢、氧、氮四种元素组成的,而一个乙醇胺分子中有2个碳原子和7个氢原子,故答案为:4、2:7、
酸碱指示剂在酸性和碱性的液体中需显示不同的颜色,故答案为:无色酚酞;
(2)①水在通电的条件下生成氢气和氧气,故答案为:2H 2 O
通电
.
2H 2 ↑+O 2 ↑;
②氢气和二氧化碳反应生成甲醇和水,故答案为:3H 2 +CO 2 ═CH 3 OH+H 2 O
(3)二氧化碳会产生温室效应,而本题中的反应恰好消耗了二氧化碳,故答案为:减少烟道气中二氧化碳排放到空气中造成温室效应;
(4)乙醇胺在加热后又从吸收池中分离出来,故答案为:乙醇胺1年前查看全部
- 工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)⇌CH3OH(g)△H
工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)⇌CH3OH(g)△H
(1)判断反应达到平衡状态的依据是______(填序号).
a. 生成CH3OH的速率与消耗CO的速率相等
b. 混合气体的密度不变
c. 混合气体的总物质的量不变
d. CH3OH、CO、H2的浓度都不再发生变化
(2)CO在不同温度下的平衡转化率与压强的关系如图1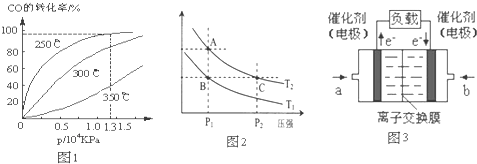
①该反应△H______0(填“>”或“<”).
②实际生产条件控制在250℃、1.3×104 kPa左右,选择此压强的理由是______.
(3)右图2表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A______C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A______C,由状态B到状态A,可采用______的方法(填“升温”或“降温”).
(4)一定条件下,0.5mol甲醇蒸气完全燃烧生成二氧化碳气体和液态水,放出Q KJ的热量.写出该反应的热化学方程式______.
(5)图3是甲醇燃料电池(电解质溶液为KOH溶液)结构示意图,写出 a处电极上发生的电极反应式______. loveyou薰衣草1年前1
loveyou薰衣草1年前1 -
 见鬼去吧99 共回答了14个问题
见鬼去吧99 共回答了14个问题 |采纳率92.9%解题思路:(1)a、都是正反应速率;
b、恒容密闭容器,反应前后都是气体,密度始终不变;
c、反应前后化学计量数之和不相等,物质的量不变,达到平衡状态;
d、浓度不变,正逆反应速率相等;
(2)①根据图示,温度升高,CO转化率降低,平衡向逆向移动;
②在1.3×104Kpa下,CO转化率已较高,再增大压强CO转化率提高不大,而生产成本增加,得不偿失;
(3)A、C两点温度一样,压强C点大于A点,故反应速率A<C;A、C两点的温度一样,故化学平衡常数不变;状态B到状态A,H2的体积分数增大,使平衡向逆向移动;
(4)2mol甲醇放出4Q热量,热化学方程式为:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l)△H=-4Q kJ/mol;
(5)甲醇燃料电池,氢氧化钾为电解质溶液,根据电子流动方向,a为阳极,电解反应为:CH3OH-6e-+8OH-=CO32-+6H2O.(1)a、生成CH3OH的速率与消耗CO的速率都是正反应速率,无法判断是否达到平衡状态,故a错误;
b、热情容积固定,气体的体积不变,故气体的密度变化变化,故b错误;
c、反应前后都是气体,化学计量数之和不相等,故混合气体的总物质的量不变,可以判断达到了平衡状态,故c正确;
d、反应物和生成物的浓度不变,生成速率等于消耗速率,正逆反应速率相等,达到了平衡状态,故d正确;
故选cd.
(2)①根据图1,压强相等情况下,升高温度,CO转化率降低,说明反应为放热,<0;
故答案为:<;
②、由于在1.3×104Kpa下,CO转化率已经较高,若再增大压强,CO转化率提高不大,反而造成生产成本增加,得不偿失;
故答案为:在1.3×104Kpa下,CO转化率已较高,再增大压强CO转化率提高不大,而生产成本增加,得不偿失.
(3)根据图2,A、C两点温度相同,C点的压强大于A点,故反应速率:A<C;由于温度相同,故A、C的化学平衡常数相等;B点氢气的含量小于A点的,反应放热,若要提高氢气的含量,必须升高温度;
故答案为:<,=,升温;
(4)2mol甲醇燃烧放出的热量为4Q,故甲醇燃烧的热化学方程式为:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l)△H=-4Q kJ/mol;
故答案为:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l)△H=-4Q kJ/mol;
(5)图3中,甲醇燃料电池,电解质溶液为KOH溶液,再根据电子流动方向,a为阳极,发生氧化反应,反应离子方程式:CH3OH-6e-+8OH-=CO32-+6H2O;
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O.点评:
本题考点: 化学平衡状态的判断;化学平衡建立的过程;化学反应速率与化学平衡图象的综合应用.
考点点评: 本题考查了化学平衡状态的判断,通过图示分析,获得合理数据,涉及了燃烧化学方程式的书写、电解反应书写,题量较多,难度稍大.1年前查看全部
- 工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)⇌CH3OH(g)
工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)⇌CH3OH(g)
(1)判断反应达到平衡状态的依据是(填字母序号,下同)______.
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的相对平均分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(2)下表所列数据是反应在不同温度下的化学平衡常数(K).
①由表中数据判断该反应的△H______0(填“>”、“=”或“<”);温度 250℃ 300℃ 350℃ K 2.041 0.270 0.012
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为______,此时的温度为______.
(3)要提高CO的转化率,可以采取的措施是______.
a.升温b.加入催化剂c.增加CO的浓度
d.加入H2加压e.加入惰性气体加压f.分离出甲醇. 情陷紫色1年前1
情陷紫色1年前1 -
 逼逼爱cc 共回答了15个问题
逼逼爱cc 共回答了15个问题 |采纳率93.3%解题思路:(1)可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析;
(2)①升高温度,可逆反应向吸热反应方向移动,根据平衡常数与温度变化关系确定焓变;
②转化率=
×100%,根据平衡浓度计算出平衡常数来确定温度;n(CO)(反应) n(CO)(反应开始)
(3)要提高CO的转化率,必须使可逆反应向正反应方向移动.(1)A.无论反应是否达到平衡状态,生成CH3OH的速率与消耗CO的速率始终相等,所以不能作为判断平衡状态的依据,故错误;
B.混合物的质量始终不变,容器的体积不变,所以混合气体的密度始终不变,所以不能作为判断平衡状态的依据,故错误;
C.反应前后,混合气体的物质的量改变,气体的质量不变,反应达到平衡状态时,混合气体的相对平均分子质量不变,所以能作为判断平衡状态的依据,故正确;
D.反应达到平衡状态时,CH3OH、CO、H2的浓度都不再发生变化,所以能作为判断平衡状态的依据,故正确;
故选CD;
(2)①升高温度,平衡向吸热方向移动,根据表格知,温度越高,化学平衡常数越小,说明平衡向逆反应方向移动,所以正反应是放热反应,即△H<0,
故答案为:<;
②平衡时一氧化碳的物质的量=0.2mol/L×2L=0.4mol,转化率=
n(CO)(反应)
n(CO)(反应开始)×100%=
(1−0.4)mol
2mol×100%=80%,
CO(g)+2H2(g)⇌CH3OH(g)单位为mol/L
反应开始 1mol/L 3mol/L0
反应 0.8mol/L 1.6mol/L 0.8mol/L
平衡 0.2mol/L 1.4mol/L 0.8mol/L
平衡常数K=
0.8mol/L
0.2mol/L.(1.4mol/L)2=2.04,所以是250℃;
故答案为:80%;250℃;
(3)a.该反应是放热反应,升高温度平衡向逆反应方向移动,故错误;
b.催化剂对平衡移动无影响,故错误;
c.增加CO的浓度,平衡向正反应方向移动,但CO的转化率降低,故错误;
d.加入H2加压,平衡向正反应方向移动,一氧化碳的转化率增大,故正确;
e.加入惰性气体加压,参加反应的气体压强不变,平衡不移动,故错误;
f.分离出甲醇,平衡向正反应方向移动,一氧化碳的转化率增大,故正确;
故选df.点评:
本题考点: 化学平衡状态的判断;化学平衡的影响因素;化学平衡的计算.
考点点评: 本题考查了影响化学平衡移动的因素、平衡状态的判断等知识点,易错选项是(3)C,注意加入CO虽然能使平衡向正反应方向移动,但一氧化碳的转化率降低,为易错点.1年前查看全部
- 甲醇是一种重要的化工材料,合成甲醇的主要反应为 CO(g)+2H2(g)可逆符号CH3OH(g) △H<0 在一定条件下
甲醇是一种重要的化工材料,合成甲醇的主要反应为 CO(g)+2H2(g)可逆符号CH3OH(g) △H<0 在一定条件下,反应达到平衡.在保证H2浓度不变的情况下,增大容器的体积,平衡移动方向为A 正 B 逆 C 不 D 无法判断
 lay821年前1
lay821年前1 -
 shmily851206 共回答了15个问题
shmily851206 共回答了15个问题 |采纳率100%选C,因为氢气的浓度没有变化,而CO和CH3OH的浓度是同等程度的改变(因为它们系数一样),故对反应平衡无影响.可类比于改变体积对反应H2(g) I2(g)=可逆=2HI(g)的平衡没影响.也可用平衡常数来进行严格的证明,假设开始平衡时三种物质的浓度分别为a、b、c,由公式PV=nRT变形得P=CRT,即浓度与压强成正比,设比例系数为x,则改变条件后的瞬间三种物质的浓度分别为ax,b,cx.显然后者已达平衡(与前平衡常数相等).故改变条件对平衡无影响.1年前查看全部
- 在恒容密闭容器中,由CO合成甲醇:CO(g)+2H2(g)⇌CH3OH(g),在其他条件不变的情况下,研究温度对反应的影
 在恒容密闭容器中,由CO合成甲醇:CO(g)+2H2(g)⇌CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是( )
在恒容密闭容器中,由CO合成甲醇:CO(g)+2H2(g)⇌CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是( )
A.平衡常数K=c(CH3OH) c(CO)c(H2)
B.该反应在T1时的平衡常数比T2时的小
C.任意时刻,T2温度下的反应速率均大于T1温度下的速率n(H2) n(CH3OH)
D.处于A点的反应体系从T1变到T2,达到平衡时增大 yjhydi1年前1
yjhydi1年前1 -
 ACELYL 共回答了19个问题
ACELYL 共回答了19个问题 |采纳率84.2%解题思路:A.化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写;
B.由图可知,T2温度下到达平衡所以时间较短,反应速率较快,故温度T2>T1.温度越高,平衡时甲醇的物质的量越小,说明升高温度平衡向逆反应方向移动,据此判断;
C.温度高,即时速率不一定高,影响速率的因素还原压强、浓度等,图象中曲线斜率越大,即时速率越高;
D.由图可知,处于A点的反应体系从T1变到T2,温度增大,平衡向逆反应方向移动,据此分析.A.CO(g)+2H2(g)⇌CH3OH(g)的平衡常数表达式k=
c(CH3OH)
c(CO)×c2(H2),故A错误;
B.由图可知,T2温度下到达平衡所以时间较短,反应速率较快,故温度T2>T1.温度越高,平衡时甲醇的物质的量越小,说明升高温度平衡向逆反应方向移动,化学平衡常数降低,在T1时的平衡常数比T2时的大,故B错误;
C.温度高,即时速率不一定高,曲线斜率越大,即时速率越高,故C错误;
D.由图可知,处于A点的反应体系从T1变到T2,温度增大,平衡向逆反应方向移动,氢气物质的量增大,甲醇的物质的量减小,
n(H2)
n(CH3OH)增大,故D正确;
故选D.点评:
本题考点: 化学平衡建立的过程;化学平衡常数的含义.
考点点评: 本题考查化学平衡图象、化学平衡影响因素、化学平衡常数等,难度中等,注意理解外界条件对化学平衡的影响,C选项为易错点,学生容易忽略平均速率与即时速率的区别.1年前查看全部
- CO可用于合成甲醇,一定温度下,向体积为2L的密闭容器中加入CO和H 2 ,发生反应CO(g)+2H 2 (g)⇌CH
CO可用于合成甲醇,一定温度下,向体积为2L的密闭容器中加入CO和H 2 ,发生反应CO(g)+2H 2 (g)⇌CH 3 OH(g),达平衡后测得各组分浓度如下:
①混合气体的平均相对分子质量______.物质 CO H 2 CH 3 OH 浓度(mol•L -1 ) 0.9 1.0 0.6
②列式并计算平衡常数K=______.
③若将容器体积压缩为1L,不经计算,预测新平衡中c(H 2 )的取值范围是______.
④若保持体积不变,再充入0.6molCO和0.4molCH 3 OH,此时v 正 ______v 逆 (填“>”、“<”“=”). 用户名可用1年前1
用户名可用1年前1 -
 432013 共回答了14个问题
432013 共回答了14个问题 |采纳率100%①图表数据分析可知,n(CO)=2L×0.9mol/L=1.8mol;n(H 2 )=2L×1.0mol/L=2mol;n(CH 3 OH)=2L×0.6mol/L=1.2mol;
混合气体的平均摩尔质量=
总重量
总物质的量 =
1.8mol×28g/mol+2mol×28g/mol+1.2mol×2g/mol
1.8mol+2mol+1.2mol =18.56g/mol;
所以混合气体的平均相对分子质量18.56,
故答案为:18.56;
②CO(g)+2H 2 (g)⇌CH 3 OH(g),由图表中物质平衡浓度可知,K=
0.6
0.9×1. 0 2 =0.67L 2 •moL -2 ;
故答案为:
0.6
0.9×1. 0 2 =0.67L 2 •moL -2 ;
③CO(g)+2H 2 (g)⇌CH 3 OH(g),若将容器体积压缩为1L,个物质浓度应变为原来的2倍,但压强增大,平衡向气体体积减小的方向进行,反应正向进行,平衡浓度小于2mol/L,所以氢气的平衡浓度应1mol•L -1 <c(H 2 )<2mol•L -1 ;
故答案为:1mol•L -1 <c(H 2 )<2mol•L -1 ;
④若保持体积不变,再充入0.6molCO和0.4molCH 3 OH,则 各物质浓度为
CO(g)+2H 2 (g)⇌CH 3 OH(g),
0.9+0.6=1.5 1.0 0.6+0.4=1
Q=
1
1.5× 1 2 =0.67=K
说明费用达到的平衡和原来的平衡状态相同,则V 正 =V 逆 ;
故答案为:=.1年前查看全部
- Ⅰ:工业上用CO 2 和H 2 在一定条件发生如下反应合成甲醇并放出大量的热:CO 2 (g)+3H 2 (g) CH
Ⅰ:工业上用CO 2 和H 2 在一定条件发生如下反应合成甲醇并放出大量的热:CO 2 (g)+3H 2 (g)
 CH 3 OH(g)+H 2 O(g) ΔH 1 回答下列问题。
CH 3 OH(g)+H 2 O(g) ΔH 1 回答下列问题。
(1)已知:2H 2 (g)+O 2 (g)=2H 2 O(g) ΔH 2
则反应2CH 3 OH(g)+3O 2 (g)=2CO 2 (g)+4H 2 O(g) ΔH= (用含ΔH 1 、ΔH 2 表示)
(2)若反应温度升高,CO 2 的转化率 (填“增大”“减小”或“不变”)。
(3)写出在酸性环境中,甲醇燃料电池中的正极反应方程式
Ⅱ:生产甲醇的原料H 2 可用如下方法制得:CH 4 (g) + H 2 O(g) CO(g) + 3H 2 (g),一定温度下,将2 mol CH 4 和4 mol H 2 O通入容积为10L的密闭反应室中,反应中CO的物质的量浓度的变化情况如图所示,请回答下列问题:
CO(g) + 3H 2 (g),一定温度下,将2 mol CH 4 和4 mol H 2 O通入容积为10L的密闭反应室中,反应中CO的物质的量浓度的变化情况如图所示,请回答下列问题: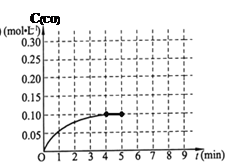
(4)反应进行到4分钟到达平衡。请计算从反应开始到刚刚平衡,平均反应速率v(H 2 )为 ;并求此反应在此温度下的平衡常数(在答题卡对应的方框内写出计算过程)。
(5)在第5分钟时将容器的体积瞬间缩小一半后,若在第8分钟时达到新的平衡(此时CO的浓度约为0.25 mol·L —1 ),请在图中画出第5分钟后H 2 浓度的变化曲线。 姓花情专1年前1
姓花情专1年前1 -
 豆亮 共回答了14个问题
豆亮 共回答了14个问题 |采纳率100%1年前查看全部
- CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g) ==CH3OH(g);ΔH3.
CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g) ==CH3OH(g);ΔH3.
CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g) CH3OH(g);ΔH3.现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1mol CO和2mol H2的混合气体,控温,进行实验,测得相关数据如下图1和图2.
a.该反应的ΔH3 0(选填“<”、“>”或“=”,下同),K1 K2.
b.将容器d中的平衡状态转变到容器c中的平衡状态,可采取的措施有 .
反应放热,所以ΔH3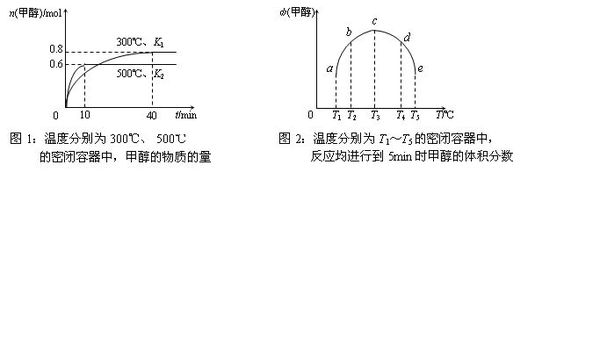
 ef124_60791年前1
ef124_60791年前1 -
 6f5c1k6d51 共回答了15个问题
6f5c1k6d51 共回答了15个问题 |采纳率80%1.k1和k2指在两种不同条件下的平衡常数
2.图2可以这样理从a到b带c甲醇的量都在上升,是因为T3的温度较高,反应较快最先达到平衡,T1和T2的温度虽然从理论上讲平衡的时候甲醇的量更高,但这个时候温度较T3低,反应慢,还没有达到平衡,实际上产生的甲醇量较少,所以这段温度范围内温度越高反应越快当然产物就越多了;T3之后嘛,上文说了,c点的时候已经平衡,所以后面温度更高的也达到平衡了,而正反应为放热反应,温度升高,平衡自然就向左移,产物的量就少了,不知这样能不能理解?后面你说的那种情况要么是参考答案错了,要么就是题目有问题,编辑排版的时候出了错误.1年前查看全部
- 水煤气是不是CH4?用水煤气合成辛烷 C8H18用水煤气合成甲醇 CH3OH我是要方程式。
 lilei39741年前3
lilei39741年前3 -
 yikan 共回答了21个问题
yikan 共回答了21个问题 |采纳率85.7%水煤气是CO和H2
CO+2H2=CH3OH 条件是CuO-ZnO-Cr2O3催化300-410摄氏度,20-32MPa1年前查看全部
- 科学家通过不断地努力,找到了CO合成甲醇的新方法.CO和H2在443K~473K温度下钴作催化剂,可生成碳原子数为5~8
科学家通过不断地努力,找到了CO合成甲醇的新方法.CO和H2在443K~473K温度下钴作催化剂,可生成碳原子数为5~8的烷烃.在390℃,300个大气压下,利用水煤气为原料,可以合成甲醇:CO(g)+2H2(g)⇌CH3OH(g).当CO和H2的比例不同时,对CO的转化及平衡混合物中甲醇的含量都有影响.以m表示H2和CO物质的量之比,a为CO的转化率,y为平衡混合物中CH3OH的体积分数,试推导出m,a,y之间的关系式.
 节约1年前0
节约1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 在一定条件下,科学家利用烟道气中分离出的CO 2 与太阳能电解水产生的H 2 合成甲醇,合成过程如下图所示,已知CH 3
在一定条件下,科学家利用烟道气中分离出的CO 2 与太阳能电解水产生的H 2 合成甲醇,合成过程如下图所示,已知CH 3 OH和H 2 的燃烧热分别为725.5 kJ·mol -1 和285.8 kJ·mol -1 ,下列说法正确的是  [ ]
[ ]①“阳光→光电池→电解水”是一个“光能→电能→化学能”的能量转化过程;
②该合成路线对于环境保护的价值在于能防止温室效应;
③乙醇胺(HOCH 2 CH 2 NH 2 )水溶液具有弱碱性,其原因可表示为
HOCH 2 CH 2 NH 2 +H 2 O HOCH 2 CH 2 NH 3 + +OH - ;
HOCH 2 CH 2 NH 3 + +OH - ;
④以CO 2 、H 2 合成CH 3 OH的热化学方程式:CO 2 (g)+3H 2 (g)==CH 3 OH(l) +H 2 O(l) △H=-131.9 kJ·mol -1
A.仅有①
B.仅有①②
C.仅有①②③
D.全部正确 loveqing8705041年前1
loveqing8705041年前1 -
 飞脚 共回答了9个问题
飞脚 共回答了9个问题 |采纳率77.8%D1年前查看全部
- 在一定条件下,科学家利用从烟道气中分离出CO2与太阳能电池电解水产生的H2合成甲醇,其过程如图所示,试回答下列问题:
在一定条件下,科学家利用从烟道气中分离出CO2与太阳能电池电解水产生的H2合成甲醇,其过程如图所示,试回答下列问题:
(1)该合成路线对于环境保护的价值在于______.
(2)15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作CO2吸收剂.用离子方程式表示乙醇胺水溶液呈弱碱性的原因______.
(3)CH3OH、H2的燃烧热分别为:△H=-725.5kJ/mol、△H=-285.8kJ/mol,写出工业上以CO2、H2合成CH3OH的热化学方程式:______. 精品贴图品1年前1
精品贴图品1年前1 -
 tibco 共回答了15个问题
tibco 共回答了15个问题 |采纳率86.7%解题思路:(1)根据二氧化碳产生的危害进行分析;
(2)氨基结合水电离平衡中的氢离子,促进水电离平衡正向进行,氢氧根离子浓度增大,溶液显碱性;
(3)利用盖斯定律计算反应热,并书写热化学方程式.(1)二氧化碳会产生温室效应,而本题中的反应恰好消耗了二氧化碳,有利于防止温室效应;
故答案为:有利于防止温室效应;
(2)乙醇胺水溶液呈弱碱性是取代基氨基结合氢离子,使溶液中的氢氧根离子浓度增大,反应的离子方程式为:HOCH2CH2NH2+H2O⇌HOCH2CH2NH3++OH-;
故答案为:HOCH2CH2NH2+H2O⇌HOCH2CH2NH3++OH-;
(3)甲醇和氢气的燃烧热书写其热化学方程式分别为:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H1=-1451kJ/mol;
②2H2(g)+O2(g)=2H2O(l)△H2=-571.6KJ/mol,
根据盖斯定律,[3/2]②-[1/2]①得反应CO2(g)+3H2(g)═CH3OH(l)+H2O(l),所以△H=[3/2]×(-571.6KJ/mol)-[1/2]×(-1451kJ/mol)=-131.9KJ/mol,
故答案为:CO2(g)+3H2(g)═CH3OH(l)+H2O(l)△H=-131.9KJ/mol.点评:
本题考点: 常见的能量转化形式;热化学方程式;弱电解质在水溶液中的电离平衡.
考点点评: 本题考查热化学方程式书写,燃烧热概念分析应用,流程分析,盖斯定律的应用等,难度中等.1年前查看全部
- 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H 2 (g)⇌CH
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H 2 (g)⇌CH 3 OH(g). 
(1)分析该反应并回答下列问题:
①平衡常数表达式为K=______.
②下列各项中,不能够说明该反应已达到平衡的是______(填序号).
A、恒温、恒容条件下,容器内的压强不发生变化
B、一定条件下,CH 3 OH分解的速率和CH 3 OH生成的速率相等
C、一定条件下,CO、H 2 和CH 3 OH的浓度保持不变
D、一定条件下,单位时间内消耗2mol CO,同时生成1mol CH 3 OH
(2)如图1是该反应在不同温度下CO的转化率随时间变化的曲线.
①该反应的焓变△H______0(填“>”、“<”或“=”).
②T 1 和T 2 温度下的平衡常数大小关系是K 1 ______K 2 (填“>”、“<”或“=”).
③若容器容积不变,下列措施可增加甲醇产率的是______.
A、升高温度
B、将CH 3 OH(g)从体系中分离
C、使用合适的催化剂
D、充入He,使体系总压强增大
(3)2009年10月,中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆.甲醇燃料电池的工作原理如图2所示.
①该电池工作时,b口通入的物质为______,c口通入的物质为______.
②该电池正极的电极反应式为:______.
③工作一段时间后,当6.4g甲醇完全反应生成CO 2 时,有______N A 个电子转移. 开心7771年前1
开心7771年前1 -
 ld6688990 共回答了23个问题
ld6688990 共回答了23个问题 |采纳率87%(1)①反应CO(g)+2H 2 (g)⇌CH 3 OH(g)的平衡常数K=
c(C H 3 OH)
c(CO)•c( H 2 ) 2 ,故答案为:
c(C H 3 OH)
c(CO)•c( H 2 ) 2 ;
②A.由方程式可以看出,反应前后气体的物质的量不相等,只有达到平衡状态,容器压强不发生变化,能判断反应达到平衡状态,故A错误;
B.一定条件下,CH 3 OH分解的速率和CH 3 OH生成的速率相等,即正逆反应速率相等,所以能判断反应达到平衡状态,故B错误;
C、一定条件下,CO、H 2 和CH 3 OH的浓度保持不变是平衡的标志,故C错误;
D、一定条件下,单位时间内消耗2molCO,同时生成1mol CH 3 OH,只能表明正反应速率,不能表示正逆反应速率相等,故D正确.
故选D.
(2)①反应CO(g)+2H 2 (g)⇌CH 3 OH(g)中,反应向右进行,一氧化碳的转化率增大,温度升高,化学平衡向着吸热方向进行,根据图中的信息可以知道:T 2 >T 1 ,所以该反应是放热反应,故答案为:<;
②对于放热反应,温度越高,化学平衡常数越小,T 2 >T 1 ,反之越大,所以K 1 >K 2 ,故答案为:>;
③A、若容器容积不变,升高温度,反应CO(g)+2H 2 (g)⇌CH 3 OH(g)平衡逆向移动,甲醇产率降低,故A错误;
B、将CH 3 OH(g)从体系中分离,反应CO(g)+2H 2 (g)⇌CH 3 OH(g)平衡正向移动,甲醇产率增大,故B正确;
C、使用合适的催化剂不会引起化学平衡的移动,甲醇的转化率不变,故C错误;
D、若容器容积不变,充入He,使体系总压强增大,单质各组分的浓度不变,化学平衡不移动,甲醇的转化率不变,故D错误;
故选B;
(3)①在甲醇燃料电池中,燃料甲醇作负极,氧气作正极,电解质中的阳离子移向正极,所以c口通入的物质为氧气,b口通入的物质为甲醇,故答案为:CH 3 OH;O 2 ;
②该电池正极是氧气发生得电子的还原反应,电极反应式为:O 2 +4e - +4H + =2H 2 O,故答案为:O 2 +4e - +4H + =2H 2 O;
③当6.4g即0.2mol甲醇完全反应生成CO 2 时,根据总反应:2CH 3 OH+3O 2 =2CO 2 +4H 2 O,消耗氧气0.3mol,转移电子1.2mol,即个数为1.2N A ,故答案为:1.2N A .1年前查看全部
- 工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)⇌CH3OH(g)
工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)⇌CH3OH(g)
(1)判断反应达到平衡状态的依据是(填字母序号)______
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的相对平均分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(2)下表所列数据是反应在不同温度下的化学平衡常数(K)
①该反应化学平衡常数表达式K=温度 250℃ 300℃ 350℃ K 2.041 0.270 0.012 c(CH3OH) c(CO)•c2(H2) c(CH3OH) c(CO)•c2(H2)
②由表中数据判断该反应的△H______0(填“>”、“=”或“<”);
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应后,达到平衡时测得C(CO)=0.2mol•L-1,此时的温度为______
(3)25℃101KPa下,1g液态甲醇完全燃烧生成CO2和液态水时放出热量22.68kJ,表示甲醇燃烧热的热化学方程式为CH3OH(l)+[3/2]O2(g)=CO2(g)+2H2O(l)△H=-725.76 kJ/molCH3OH(l)+[3/2]O2(g)=CO2(g)+2H2O(l)△H=-725.76 kJ/mol
(4)据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,该电池工作时负极电极反应式为______.若反应时消耗16g甲醇所产生的电能电解足量的CuSO4溶液,则将产生标准状况下的O2______升. cxx20021年前1
cxx20021年前1 -
 总摔手机 共回答了11个问题
总摔手机 共回答了11个问题 |采纳率90.9%解题思路:(1)可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析;
(2)①反应化学平衡常数是平衡时生成的浓度幂之积除以反应物浓度的幂之积;
②升高温度,可逆反应向吸热反应方向移动,根据平衡常数与温度变化关系确定焓变;
③根据平衡浓度计算出平衡常数来确定温度;
(3)1g液态甲醇完全燃烧生成CO2和液态水时放出热量22.68kJ,然后求出1mol放出的热量;
(4)负极发生氧化反应,根据电子守恒求产生标准状况下的O2.(1)A.无论反应是否达到平衡状态,生成CH3OH的速率与消耗CO的速率始终相等,所以不能作为判断平衡状态的依据,故错误;
B.混合物的质量始终不变,容器的体积不变,所以混合气体的密度始终不变,所以不能作为判断平衡状态的依据,故错误;
C.反应前后,混合气体的物质的量改变,气体的质量不变,反应达到平衡状态时,混合气体的相对平均分子质量不变,所以能作为判断平衡状态的依据,故正确;
D.反应达到平衡状态时,CH3OH、CO、H2的浓度都不再发生变化,所以能作为判断平衡状态的依据,故正确;
故选CD;
(2))①反应化学平衡常数是平衡时生成的浓度幂之积除以反应物浓度的幂之积,K=
c(CH3OH)
c(CO)•c2(H2),故答案为:
c(CH3OH)
c(CO)•c2(H2);
②升高温度,平衡向吸热方向移动,根据表格知,温度越高,化学平衡常数越小,说明平衡向逆反应方向移动,所以正反应是放热反应,即△H<0,
故答案为:<;
③CO(g)+2H2(g)⇌CH3OH(g)单位为mol/L
反应开始 1mol/L 3mol/L 0
反应 0.8mol/L 1.6mol/L 0.8mol/L
平衡 0.2mol/L 1.4mol/L 0.8mol/L
平衡常数K=[0.8mol/L
0.2mol/L.(1.4mol/L)2=2.04,所以是250℃;
故答案为:250℃;
(3)1mol放出的热量为725.76 kJ/mol,所以热化学方程式为 CH3OH(l)+
3/2]O2(g)=CO2(g)+2H2O(l)△H=-725.76 kJ/mol,
故答案为:CH3OH(l)+[3/2]O2(g)=CO2(g)+2H2O(l)△H=-725.76 kJ/mol;
(4)负极发生氧化反应,负极CH3OH-6e-+8OH-=CO32-+6H2O 依据电子守恒CH3OH~CO32-~6e-,16克甲醇物质的量为0.5mol,转移电子为3mol,依据电子守恒O2~4e-,则将产生标准状况下的O2物质的量为0.75mol,标准状况下氧气的体积=0.75mol×22.4L/mol=16.8L,故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;16.8.点评:
本题考点: 化学平衡状态的判断;热化学方程式;化学电源新型电池;化学平衡常数的含义.
考点点评: 本题考查了影响化学平衡移动的因素、平衡状态的判断等知识点.1年前查看全部
- (2014•上海模拟)能源短缺是人类面临的重大问题之一.甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上合成甲醇一
(2014•上海模拟)能源短缺是人类面临的重大问题之一.甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上合成甲醇一般采用以下反应:CO(g)+2H2(g)⇌CH3OH(g)+Q
下表所列数据是上述反应在不同温度下的化学平衡常数(K)
(1)在一定条件下将2mol CO和6mol H2充入2L的密闭容器中发生反应,5分钟后测得c(H2)=1.5mol/L,则此段时间内的反应速率(用CH3OH表达)______mol/(L•min).温度 250℃ 300℃ 350℃ K 2.041 0.270 0.012
(2)由表中数据分析可知,Q______0(填“>”、“<”或“=”).其它条件不变的情况下,若压缩容器的体积,则平衡______移动(“向正反应方向”“向逆反应方向”或“不”),化学平衡常数K______(填“增大”、“减小”或“不变”).
(3)在体积一定的密闭容器中,能说明该反应已处于化学平衡状态的是______(填编号).
a.V正(CO)=1/2V正(H2) b.混合气体的密度保持不变
c.反应体系中的热效应不再变化d.c(CO):c(CH3OH)=1:1
(4)寻找到合适的催化剂是实现反应工业化的关键.该反应使用催化剂无法实现的目标是______(填编号).
a.提高单位时间内甲醇的产量b.增大混合气体中甲醇的体积分数
c.缩短达到平衡所需时间d.提高一氧化碳的转化率. xcy2081年前1
xcy2081年前1 -
 asl8010 共回答了17个问题
asl8010 共回答了17个问题 |采纳率88.2%解题思路:(1)依据化学反应的三段式列式计算;
(2)平衡常数随温度变化,温度升高K减小说明温度升高平衡左移,逆向是吸热反应,正向是放热反应;反应特征CO(g)+2H2(g)⇌CH3OH(g)反应前后是气体体积减小的反应,增大压强平衡正向进行;
(3)化学平衡的标志是正逆反应速率相同,各组分百分含量不变,依据反应特征逐项分析判断;
(4)催化剂降低活化能,改变化学反应的反应速率,不能改变化学平衡.(1)依据化学平衡三段式列式得到
CO(g)+2H2(g)⇌CH3OH(g)
起始量(mol) 260
变化量(mol)1.5 31.5
5分钟量(mol) 0.5 2L×1.5mol/L=3mol 1.5
用CH3OH表达的反应速率=
1.5mol
2L
5min=0.15mol/L•min,
故答案为:0.15;
(2)表中数据分析可知随温度升高,平衡常数K减小,说明温度升高,平衡逆向进行,所以正向是放热反应,Q>>0,反应前后气体体积减小,依据平衡移动原理,增大压强平衡向气体体积减小的分析进行,所以压缩体积是增大压强,平衡正向进行;平衡常数随温度变化,不随浓度、压强等因素变化,所以K不变,
故答案为:>;向正反应方向;不变;
(3)反应达到平衡的标志是正逆反应速率相同,各组分含量保持不变;
a.V正(CO)=1/2V正(H2),正反应速率之比等于化学方程式中 计量数之比,仅表示反应正向进行,不能说明反应达到平衡,故a错误;
b.混合气体的密度保持不变,混合气体在乙定容密闭容器中进行,质量守恒,体积不变,反应过程中混合气体的密度始终不变,故b错误;
c.反应体系中的热效应不再变化,反应达到平衡反应的热量变化一定,平衡发生移动,反应的热量发生改变,证明反应达到平衡,故C正确;
d.c(CO):c(CH3OH)=1:1浓度相同,和起始量,变化量等有关,与平衡无直接关系,不能做平衡的标志,故d错误;
故答案为:c;
(4)寻找到合适的催化剂是实现反应工业化的关键,催化剂降低反应活化能,增大反应速率,但不改变化学平衡,
a.提高单位时间内甲醇的产量,反应速率增大,单位时间内生成甲醇增大,故a不符合;
b.增大混合气体中甲醇的体积分数,催化剂不改变化学平衡,体积分数不变,故b符合;
c.缩短达到平衡所需时间,催化剂加快反应速率,缩短到达平衡的时间,故c不符合;
d.提高一氧化碳的转化率,催化剂不改变平衡,反应物的转化率不变,故d符合;
故答案为:bd.点评:
本题考点: 化学平衡常数的含义;化学平衡的影响因素;化学平衡状态的判断.
考点点评: 本题考查了化学平衡常数的概念应用,化学平衡影响因素的分析判断,平衡标志的选择,化学反应速率影响因素的分析应用,题目难度中等.1年前查看全部
- 甲醇汽油是一种廉价、清洁的车用燃料,它的使用可以减少汽车尾气对环境的污染.某化工厂以甲烷(CH4)为原料合成甲醇(CH3
甲醇汽油是一种廉价、清洁的车用燃料,它的使用可以减少汽车尾气对环境的污染.某化工厂以甲烷(CH4)为原料合成甲醇(CH3OH)并将多余的氢气用于合成氨气(NH3).
(1)甲醇汽油属于______ (填混合物或纯净物)
(2)甲烷和水蒸气在一定条件下制得一氧化碳和氢气,此反应的方程式为CH4+H2O
CO+3H2一定条件下 .CH4+H2O.
CO+3H2一定条件下 .
(3)一氧化碳和氢气在一定条件下合成甲醇,此反应的化学方程式为CO+2H2
CH3OH一定条件下 .CO+2H2.
CH3OH一定条件下 .
(4)高温高压、催化剂的条件下,氮气氢气合成氨,此反应的化学方程式为N2+3H2
2NH3催化剂 .高温高压 N2+3H2.
2NH3催化剂 .高温高压  yyyyyyyy81年前1
yyyyyyyy81年前1 -
 perfume1222 共回答了15个问题
perfume1222 共回答了15个问题 |采纳率93.3%解题思路:根据题干提供的信息进行分析,甲醇汽油是混合物;根据反应物、反应条件和生成物即可写出有关反应的化学方程式;据此解答.(1)甲醇汽油是甲醇和汽油的混合物,故填:混合物;
(2)甲烷和水蒸气在一定条件下制得一氧化碳和氢气,故填:CH4+H2O
一定条件下
.
CO+3H2;
(3)一氧化碳和氢气在一定条件下合成甲醇,故填:CO+2H2
一定条件下
.
CH3OH;
(4)高温高压、催化剂的条件下,氮气氢气合成氨,故填:N2+3H2
催化剂
.
高温高压2NH3.点评:
本题考点: 甲烷、乙醇等常见有机物的性质和用途;纯净物和混合物的判别;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查了有关反应化学方程式的书写,写时要注意方程式的配平.1年前查看全部
- 用CO和H2合成甲醇的方程式
 微笑ㄉ小鱼儿1年前2
微笑ㄉ小鱼儿1年前2 -
 不懂的晴天 共回答了17个问题
不懂的晴天 共回答了17个问题 |采纳率88.2%CO+2H2==催化剂 加热==CH3OH1年前查看全部
- 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:
CO(g)+2H 2 (g) CH 3 OH(g)。
CH 3 OH(g)。
(1)分析该反应并回答下列问题:
① 平衡常数表达式为K=__________。
② 下列各项中,不能够说明该反应已达到平衡的是______________(填序号)。
a.恒温、恒容条件下,容器内的压强不发生变化
b.一定条件下,CH 3 OH分解的速率和CH 3 OH生成的速率相等
c.一定条件下,CO、H 2 和CH 3 OH的浓度保持不变
d.一定条件下,单位时间内消耗2mol CO,同时生成1mol CH 3 OH
(2)下图是该反应在不同温度下CO的转化率随时间变化的曲线。
① 该反应的焓变ΔH____________0(填“>”、“<”或“=”)。
② T1和T2温度下的平衡常数大小关系是K1____________K2(填“>”、“<”或“=”)。
③ 若容器容积不变,下列措施可增加甲醇产率的是______________。
a.升高温度 b.将CH 3 OH(g)从体系中分离 c.使用合适的催化剂 d.充入He,使体系总压强增大
(3)已知在常温常压下:
① 2CH 3 OH(l)+3O 2 (g)=2CO 2 (g)+4H 2 O(g) ΔH =-a kJ·mol -1
② 2CO(g)+O 2 (g)=2CO 2 (g) ΔH =-b kJ·mol -1
③ H 2 O(g)= H 2 O(l) ΔH=-c kJ·mol -1
则,CH 3 OH(l)+O 2 (g) =CO(g)+2H 2 O(l) ΔH=______________kJ·mol -1 。
(4)2009年10月,中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如图所示。
① 该电池工作时,b口通入的物质为____________, c口通入的物质为__________。
② 该电池正极的电极反应式为 ___________________________________。
③ 工作一段时间后,当6.4g甲醇完全反应生成CO 2 时,有___________N A 个电子转移。
(5)以上述电池做电源,用下图所示装置,在实验室中模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是(用相关的电极反应式和离子方程式表示):_________________________
 stones0081年前1
stones0081年前1 -
 我爱开车但是新手 共回答了23个问题
我爱开车但是新手 共回答了23个问题 |采纳率91.3%(1)①K=[CH 3 OH]/[CO][H 2 ] 2 ;②d
(2)① <;② >;③ b
(3)(b-a-4c)/2
(4)①CH 3 OH;O 2 ;②O 2 +4e - +4H + →2H 2 O;③ 1.2
(5)Al→Al 3+ +3e - ,Al 3+ +3HCO 3 - =Al(OH) 3 ↓+3CO 2 ↑1年前查看全部
- CO与H 2 在催化剂作用下合成甲醇的反应为:CO(g)+2H 2 (g) CH 3 OH(g)。在容积均为1L的a、b
CO与H 2 在催化剂作用下合成甲醇的反应为:CO(g)+2H 2 (g)  CH 3 OH(g)。在容积均为1L的a、b、c、d、e五个密闭容器中分别充入等量的1mol CO和2mol H 2 混合气体,控温。实验测得相关数据如下图1和图2。下列有关说法正确的是
CH 3 OH(g)。在容积均为1L的a、b、c、d、e五个密闭容器中分别充入等量的1mol CO和2mol H 2 混合气体,控温。实验测得相关数据如下图1和图2。下列有关说法正确的是 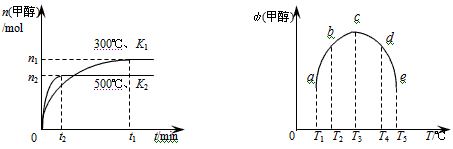 [ ]
[ ]A.该反应的正反应是气体体积减小的吸热反应
B.K 1 <K 2 (K为该条件下反应的平衡常数)
C.反应进行到5min时,a、b两容器中平衡正向移动,d、e两容器中平衡逆向移动
D.将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有升温或减压 ybp20001年前1
ybp20001年前1 -
 斑马Gabriel 共回答了20个问题
斑马Gabriel 共回答了20个问题 |采纳率90%D1年前查看全部
- 工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)⇌CH3OH(g)△H
工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)⇌CH3OH(g)△H
(1)判断反应达到平衡状态的依据是______(填序号).
a. 生成CH3OH的速率与消耗CO的速率相等
b. 混合气体的密度不变
c. 混合气体的相对平均分子质量不变
d. CH3OH、CO、H2的浓度都不再发生变化
(2)下表所列数据是反应在不同温度下的化学平衡常数(K).
①由表中数据判断△H______0 (填“>”、“=”或“<”).温度 250℃ 300℃ 350℃ K 2.041 0.270 0.012
②要提高CO的转化率,可以采取的措施是______(填序号).
a.升温 b.加入催化剂 c.增加CO的浓度
d.加入H2加压e.加入惰性气体加压f.分离出甲醇
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为______,此时的温度为______.以CH3OH表示该过程的反应速率v(CH3OH)=______mol/(L•min).
(3)图1表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A______C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A______C,由状态B到状态A,可采用______的方法(填“升温”或“降温”).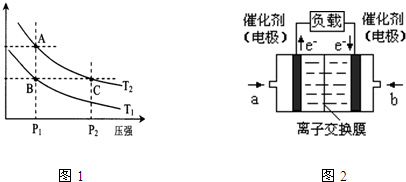
(4)一定条件下,0.5mol甲醇蒸气完全燃烧生成二氧化碳气体和液态水,放出QKJ的热量.写出该反应的热化学方程式______.图2是甲醇燃料电池(电解质溶液为KOH溶液)结构示意图,写出 a处电极上发生的电极反应式______. Ivyzhong2111年前1
Ivyzhong2111年前1 -
 ah1e 共回答了15个问题
ah1e 共回答了15个问题 |采纳率93.3%解题思路:(1)a、CH3OH的生成速率与CO的消耗速率都表示正反应速率;b、都为气体,容器的体积不变,混合气体的总质量不变,密度自始至终为定值;c、混合气体的总质量不变,随反应进行,混合气体的总的物质的量减小,即平均相对分子质量减小,最后为定值;d、可逆反应得到平衡,反应混合物的浓度、含量为定值;(2)①由表中数据可知,温度越高,平衡常数越小,说明升高温度平衡向逆反应移动,升高温度平衡向吸热反应移动;②要提高CO的转化率,平衡应向正反应移动,据此结合选项分析判断.注意若只增大CO浓度,平衡向正反应移动,CO的转化率降低;③计算平衡时CO的物质的量,n开始(CO)-n平衡(CO)=n转化(CO),利用转化率定义计算CO的转化率;计算该温度下的平衡常数,对比表中数据判断温度;根据v=△c△t计算v(CO,利用速率之比等于化学计量数之比计算v(CH3OH).(3)压强越大,反应速率越快;平衡常数只受温度影响,温度不变,平衡常数不变.平衡体系中H2的体积分数温度T1比T2时的低,说明T1比T2相比,平衡向正反应移动,该反应正反应为放热反应,故温度T1<T2;(4)0.5mol甲醇蒸气完全燃烧生成二氧化碳气体和液态水,放出QKJ的热量,据此根据热化学方程式书写原则书写;由图2中电子在外电路的移动可知,a为负极,b为正极,原电池负极发生氧化反应,CH3OH在负极放电,碱性条件放电生成碳酸根与水.(1)a、CH3OH的生成速率与CO的消耗速率都表示正反应速率,自始至终反应速率都按1:1进行,不能说明到达平衡,故a错误;
b、都为气体,容器的体积不变,混合气体的总质量不变,密度自始至终为定值,不能说明可逆反应到达平衡,故b错误;
c、混合气体的总质量不变,随反应进行,混合气体的总的物质的量减小,即平均相对分子质量减小,最后为定值,说明可逆反应到达平衡状态,故c正确;
d、CH3OH、CO、H2的浓度都不再发生变化,说明可逆反应到达平衡状态,故d正确.
故选:cd;
(2)①由表中数据可知,温度越高,平衡常数越小,说明升高温度平衡向逆反应移动,升高温度平衡向吸热反应移动,故正反应为放热反应,即△H<0,
故答案为:<;
②a.升高温度,平衡向逆反应移动,平衡时CO的转化率减小,故a错误;
b.加入催化剂,缩短到达平衡时间,平衡不移动,CO转化率不变,故b错误;
c.增加CO的浓度,平衡向正反应移动,平衡时CO的转化率减小,故c错误;
d.加入H2加压,平衡向正反应移动,平衡时CO的转化率增大,故d正确;
e.加入惰性气体加压,反应混合物的浓度不变,变化不移动,故e错误;
f.分离出甲醇,平衡向正反应移动,平衡时CO的转化率增大,故f正确.
故选:df;
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,
平衡时CO的物质的量为0.2mol/L×2L=0.4mol,所以CO的转化率为[2mol−0.4mol/2mol]×100%=80%;
对于可逆反应:CO(g)+2H2(g)⇌CH3OH(g)
开始(mol/L):1 3 0
变化(mol/L):0.8 1.6 0.8
平衡(mol/L):0.21.4 0.8
所以该温度下平衡常数k=[0.8
0.2×1.42=2.041,平衡常数只受温度影响,故该温度为250℃.
v(CO)=
1mol/L−0.2mol/L/10min]=0.08mol/(L•min),速率之比等于化学计量数之比,故v(CH3OH)=v(CO)=0.08mol/(L•min).
故答案为:80%;250℃;0.08;
(3)由图可知,C点压强比A点压强大,压强越大,反应速率越快,故反应速率A>C;
由图可知A、C两点温度相同,平衡常数只受温度影响,温度不变平衡常数不变,故平衡常数A=C;
由图可知,压强相同时,平衡体系中H2的体积分数温度T1比T2时的低,说明T1比T2相比,平衡向正反应移动,该反应正反应为放热反应,降低温度平衡向放热反应移动,故温度T1<T2,由状态B到状态A,可采用升温的方法,
故答案为:<;=;升温;
(4)0.5mol甲醇蒸气完全燃烧生成二氧化碳气体和液态水,放出QKJ的热量,热化学方程式为2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l)△H=-4Q kJ/mol;
由图2中电子在外电路的移动可知,a为负极,b为正极,原电池负极发生氧化反应,CH3OH在负极放电,碱性条件放电生成碳酸根与水,电解反应式为CH3OH-6e-+8OH-=CO32-+6H2O,
故答案为:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l)△H=-4Q kJ/mol;CH3OH-6e-+8OH-=CO32-+6H2O.点评:
本题考点: 化学平衡的计算;原电池和电解池的工作原理;化学平衡状态的判断.
考点点评: 本题考查平衡状态判断、平衡移动、平衡常数、反应速率计算、热化学方程式、原电池、化学平衡图象等,是化学反应速率与化学平衡的综合题目,难度不大,注重基础知识的考查,(4)中电极反应式的书写为难点、易错点,可以先写出较为简单的正极反应式,利用总反应式减去正极反应式即为负极反应式.1年前查看全部
- 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g)═CH3OH
 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g)═CH3OH(g) 下表为不同温度下的平衡常数(K)
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g)═CH3OH(g) 下表为不同温度下的平衡常数(K)
(1)该反应的平衡常数表达式K=温度 250℃ 300℃ 350℃ K 2.041 0.270 0.012 c(CH3OH) c(CO)c2(H2) ,△H______0(填“>”、“<”或“=”).c(CH3OH) c(CO)c2(H2)
(2)将1mol的H2 和 1mol 的 CO充入 1L 恒容密闭反应器中,达到平衡后,容器内的压强为开始时的60%,求CO的平衡转化率(写出计算过程).
(3)300℃时,将容器的容积压缩到原来的[1/2],在其他条件不变的情况下,对平衡体系产生的影响是______(填字母).
A.c(H2)减少
B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加
D.重新平衡时c(H2)/c(CH3OH)减小
(4)其他条件相同时,在上述三个温度下分别发生该反应.300℃时,H2的转化率随时间的变化如图所示,请补充完成350℃时H2的转化率随时间的变化示意图. user092511年前1
user092511年前1 -
 qq的海洋 共回答了27个问题
qq的海洋 共回答了27个问题 |采纳率88.9%解题思路:(1)依据化学方程式和平衡常数概念书写,依据平衡常数随温度变化判断反应能量变化;
(2)依据化学平衡三段式列式计算,气体压强之比等于气体物质的量之比;
(3)压缩体积相当于增大压强,反应前后气体体积减小的反应,结合平衡移动原理分析判断;
(4)由表中数据可知温度降低,化学反应速率减小,平衡正向移动,H2的转化率增大;温度升高,化学反应速率增大,平衡逆向移动,H2的转化率减小,结合变化绘制曲线变化.(1)K=
c(CH3OH)
c(CO)c2(H2)由表中数据可知温度升高,K值减小,说明平衡向逆反应方向移动,逆反应为吸热反应,正反应即为放热反应△H<0,
故答案为:
c(CH3OH)
c(CO)c2(H2);<;
(2)将1mol的H2 和 1mol 的 CO充入 1L 恒容密闭反应器中,达到平衡后,容器内的压强为开始时的60%,设一氧化碳反应物质的量x
2H2(g)+CO(g)═CH3OH(g)
起始量(mol) 1 1 0
变化量(mol) 2x x x
平衡量(mol) 1-2x 1-x x
1-2x+1-x+x=(1+1)×60%
x=0.4mol,
CO的平衡转化率=[0.4mol/1mol]×100%=40%;
答:CO的平衡转化率为40%;
(3)在其他条件不变的情况下,将容器的容积压缩到原来的 [1/2],体系压强增大,各组分浓度增大,平衡常数不变;
A、将容器的容积压缩到原来的 [1/2],各组分浓度均增大,故A错误;
B、将容器的容积压缩到原来的 [1/2],各组分浓度均增大,正逆反应速率都增大,故B错误;
C、将容器的容积压缩到原来的 [1/2],体系压强增大,化学平衡正向移动,CH3OH的物质的量增加,故C正确;
D、将容器的容积压缩到原来的 [1/2],体系压强增大,化学平衡正向移动,CH3OH 的物质的量增大,H2的物质的量减小,又处于同一容器V相同,所以c(H2)/c(CH3OH)减小,故D正确;
故答案为:CD;
(4)由表中数据可知温度降低,化学反应速率减小,平衡正向移动,H2的转化率增大;温度升高,化学反应速率增大,平衡逆向移动,H2的转化率减小,则350℃时H2的转化率随时间的变化示意图为 ,故答案为:
,故答案为: .
.点评:
本题考点: 化学平衡的计算;化学平衡的影响因素.
考点点评: 本题考查了化学平衡计算应用,平衡常数,转化率概念分析应用,影响平衡的因素和图象绘制方法,掌握基础是关键,题目难度中等.1年前查看全部
- 甲醇(CH 3 OH)是一种重要的化工原料,合成甲醇的主要反应为:CO(g)+2H 2 (g) CH 3 OH(g) △
甲醇(CH 3 OH)是一种重要的化工原料,合成甲醇的主要反应为:CO(g)+2H 2 (g)  CH 3 OH(g) △H=
CH 3 OH(g) △H=
-90. 8 kJ/mol
(1)该热化学方程式表达的意义是_______________。
(2)在一定条件下,上述反应在一密闭容器中达到平衡。该反应平衡常数的表达式为________________;结合该表达式分析,在保证H 2 浓度不变的情况下,增大容器的体积,平衡________(填字母)。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
(3)如图表示该反应在某一时间段中反应速率与反应过程的关系图(t2、t4、t5时刻改变的条件都只有一个,且各不相同)。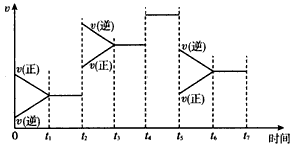
各阶段对应的平衡常数如表所示 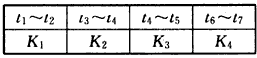
请判断K1、K2、K3、K4之间的关系为_________(用“>” “<”或“=”连接)。
(4)原料气的加工过程中常常混有一些CO 2 ,为了研究温度及CO 2 含量对该反应的影响,以CO 2 、CO和H 2
的混合气体为原料在一定条件下进行实验。实验数据见下表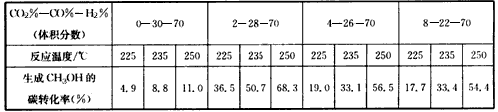
由表中数据可得出多个结论。
结论一:在一定条件下,反应温度越高,生成CH 3 OH的碳转化率_________________。
结论二:________________ 。 zhangdan95481年前1
zhangdan95481年前1 -
 菡萏76 共回答了30个问题
菡萏76 共回答了30个问题 |采纳率86.7%(1)1 mol CO(g)与2 mol H 2 (g)完全反应生成1mol CH 3 OH(g) 放出90.8 kJ的热量
(2)K=c(CH 3 OH)/[c(CO)·c 2 (H 2 )];C
(3)K1>K2=K3=K4
(4)越高;原料气含少量CO 2 有利于提高生成甲醇的碳转化率,CO 2 含量过高生成甲醇的碳转化率又降低1年前查看全部
- 求水煤气合成辛烷和水煤气合成甲醇的化学方程式.
 邢_12051年前1
邢_12051年前1 -
 水牛蜗牛还有我 共回答了17个问题
水牛蜗牛还有我 共回答了17个问题 |采纳率88.2%合成辛烷:8CO+17H2==C8H18+8H2O
合成甲醇:CO+2H2=CH3OH1年前查看全部
- (2013•韶关模拟)在一恒容的密闭容器中,由CO和H2合成甲醇:CO(g)+2H2(g)═CH3OH(g)△H
 (2013•韶关模拟)在一恒容的密闭容器中,由CO和H2合成甲醇:CO(g)+2H2(g)═CH3OH(g)△H
(2013•韶关模拟)在一恒容的密闭容器中,由CO和H2合成甲醇:CO(g)+2H2(g)═CH3OH(g)△H
①下列情形不能说明该反应已达到平衡状态的是______(填序号).
A.每消耗1mol CO的同时生成2mol H2
B.混合气体总物质的量不变
C.生成CH3OH的速率与消耗CO的速率相等
D.CH3OH、CO、H2的浓度都不再发生变化
②CO的平衡转化率(α)与温度、压强的关系如图所示.A、B两点的平衡常数K(A)______K(B)(填“>”、“=”或“<”,下同);由图判断△H______0.
③某温度下,将2.0mol CO和6.0mol H2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.25mol/L,则CO的转化率=______,此温度下的平衡常数K=______(保留二位有效数字). 孤独的人依然孤独1年前1
孤独的人依然孤独1年前1 -
 随风小侃 共回答了13个问题
随风小侃 共回答了13个问题 |采纳率76.9%解题思路:①达到化学平衡时,正逆反应速率相等,各个组分的浓度不随着时间的变化而变化,根据化学平衡的特征,由此衍生出的一系列物理量都不变,据此来判断;②化学反应的平衡常数随着温度的变化而变化,根据压强恒定,温度变化引起化学平衡移动的方向来判断化学反应的吸放热情况;③根据化学反应三行式来计算转化率和平衡常数.A.每消耗1molCO的同时生成2molH2,能证明正逆反应速率是相等的,故A错误;
B、该反应是一个前后气体系数和变化的反应,当混合气体总物质的量不变,达到额化学平衡状态,故B错误;
C.生成CH3OH的速率与消耗CO的速率相等,不能证明正逆反应速率是相等的,此时不一定达到化学平衡,故c正确
D.CH3OH、CO、H2的浓度都不再发生变化,是化学平衡状态的特征,故D错误.
故选C.
②根据图中CO的平衡转化率(α)与温度、压强的关系,A、B两点的温度是一样的,所以平衡常数相等,根据图示内容,压强不变,当温度升该时,一氧化碳的转化率逐渐减小,所以化学平衡向左移动,所以该反应是一个放热反应,故答案为:=;<;
③将2.0mol CO和6.0mol H2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.25mol/L,则
CO(g)+2H2(g)═CH3OH(g)
初始浓度:1.03.00
变化浓度:0.75 1.5 0.75
平衡浓度:0.25 1.5 0.75
CO的转化率[0.75/1]×100%=75%,此温度下的化学平衡常数K=
c(CH3OH)
c(CO)•c(H2)3=
0.75
0.25×1.52≈1.3,故答案为:1.3.点评:
本题考点: 化学平衡状态的判断;等效平衡;化学平衡的计算.
考点点评: 化学平衡状态的判断、化学反应速率以及化学平衡常数、转化率是现在考试的热点,注意三行式在计算中的应用,难度不大.1年前查看全部
- CO可用于合成甲醇,一定温度下,向体积为2L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g)⇌CH3OH(g
 莫非MM1年前0
莫非MM1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 水煤气合成辛烷(C8H18)的化学方程式?水煤气合成甲醇(CH3OH)的化学方程式
 plumgm1年前1
plumgm1年前1 -
 morsum 共回答了20个问题
morsum 共回答了20个问题 |采纳率95%8CO+17H2==C8H18+8H2O CO+2H2=CH3OH1年前查看全部
- (17分)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上采用如下反应合成甲醇:
(17分)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上采用如下反应合成甲醇:
CO(g)+2H 2 (g) CH 3 OH(g),现模拟并分析该反应:
CH 3 OH(g),现模拟并分析该反应:
(1)能够说明该反应已达到平衡的是_________:
a.恒温、恒容时,容器内的压强不再变化
b.恒温、恒容时,容器内混合气体的密度不再变化
c.一定条件下,CO、H 2 和CH 3 OH的浓度保持不变
d.一定条件下,单位时间内消耗2molH 2 的同时生成1 mol CH 3 OH
(2)右图是该反应在不同温度下CO转化率随时间的变化曲线: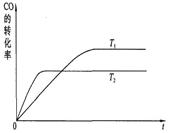
①该反应的△H____0(填“>”、“<”或“=”)。
②T 1 和T 2 温度下的平衡常数:K 1 ____K 2 (填“>”、“<”或“=”)。
(3)2009年,长春应用化学研究所在甲醇燃料电池技术上获得新突破,原理如图1所示。
①甲醇完全燃烧的化学方程式_______________________。
②请写出从C口通入O 2 发生的电极反应式___________________。
(4)用上述电池做电源,用图2装置电解饱和食盐水(C 1 、C 2 均为石墨电极)。
①该反应的离子方程式________________________。
②电解开始后在电极__________________的周围(填“C 1 ”或“C 2 ”)先出现红色。
 熊科1年前1
熊科1年前1 -
 移花接木半步癫 共回答了20个问题
移花接木半步癫 共回答了20个问题 |采纳率90%(1)ac(4分(4分,选一个对得2分,一对一错不得分):
(2)①<(2分) ②>(2分)
(3)①2CH 3 OH+3O 2 2CO 2 +4H 2 O(2分);②O 2 +4e - +4H + =2H 2 O(2分)
2CO 2 +4H 2 O(2分);②O 2 +4e - +4H + =2H 2 O(2分)
(4)2Cl - +2H 2 O Cl 2 ↑+H 2 ↑+2OH - (3分) C 2 (2分)
Cl 2 ↑+H 2 ↑+2OH - (3分) C 2 (2分)
(1)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以c正确。根据方程式可知,反应是体积减小的,因此压强也是减小的,所以a也能说明达到平衡状态。密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,b不正确。D中反应速率的方向是相同的,不正确。答案选ac。
(2)①根据图像可知,温度为t2的曲线首先达到平衡状态,说明反应速率快,因此t2大于t1。温度高,CO的转化率低,说明升高温度,平衡向逆反应方向移动,因此正反应是放热反应,即△H<0。
②升高温度,平衡向逆反应方向移动,因此平衡常数减小,即K 1 >K 2 。
(3)①甲醇完全燃烧的生成物是水和CO 2 。所以方程式为2CH 3 OH+3O 2 2CO 2 +4H 2 O。
2CO 2 +4H 2 O。
②氧气在反应中得到电子,因此在正极通入,又因为氢离子向正极移动,所以正极电极反应式为O 2 +4e - +4H + =2H 2 O。
(4)惰性电极电解饱和食盐水时,阳极是氯离子放电,产生氯气。阴极是氢离子放电,产生氢气,因此阴极周围水的电离平衡被破坏,溶液显碱性,显红色。由于C2和电源的负极相连,所以
C2是阴极,该电极周围溶液显红色。该反应的方程式为2Cl - +2H 2 O Cl 2 ↑+H 2 ↑+2OH - 。
1年前查看全部
Cl 2 ↑+H 2 ↑+2OH - 。
1年前查看全部
- 海底蕴藏着大量的“可燃冰”.用甲烷制水煤气(CO、H2),再合成甲醇来代替日益供应紧张的燃油.
 海底蕴藏着大量的“可燃冰”.用甲烷制水煤气(CO、H2),再合成甲醇来代替日益供应紧张的燃油.
海底蕴藏着大量的“可燃冰”.用甲烷制水煤气(CO、H2),再合成甲醇来代替日益供应紧张的燃油.
已知:
①CH4(g)+H2O(g)=CO(g)+3H2(g)△H1=+206.2kJ•mol-1
②CH4(g)+[1/2]O2(g)=CO(g)+2H2(g)△H2=-35.4kJ•mol-1
③CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H3=+165.0kJ•mol-1
(1)CH4(g)与CO2(g)反应生成CO(g)和H2(g)的热化学方程式为______.
(2)从原料、能源利用的角度,分析反应②作为合成甲醇更适宜方法的原因是______.
(3)水煤气中的H2可用于生产NH3,在进入合成塔前常用[Cu(NH3)2]Ac溶液来吸收其中的CO,防止合成塔中的催化剂中毒,其反应是:[Cu(NH3)2]Ac+CO+NH3⇌[Cu(NH3)3]Ac•CO△H<0,[Cu(NH3)2]Ac溶液吸收CO的适宜生产条件应是______.
(4)将CH4设计成燃料电池,其利用率更高,装置示意如图(A、B为多孔性石墨棒).持续通入甲烷,在标准状况下,消耗甲烷体积VL.
①0<V≤44.8L时,电池总反应方程式为______.
②44.8L<V≤89.6L时,负极电极反应为______.
③V=67.2L时,溶液中离子浓度大小关系为______. rslrsll1231年前1
rslrsll1231年前1 -
 望天叹 共回答了18个问题
望天叹 共回答了18个问题 |采纳率88.9%解题思路:(1)根据盖斯定律结合已知热化学方程式分析;
(2)从能量角度和原子利用率角度两个方面分析;
(3)已知正反应是气体物质体积减小的放热反应,据此分析;
(4)n(KOH)=2mol/L×2L=4mol,可能先后发生反应①CH4+2O2→CO2+2H2O、②CO2+2KOH=K2CO3+H2O、③K2CO3+CO2+H2O=2KHCO3;根据甲烷的量计算生成的二氧化碳的量,结合反应方程式判断反应产物及发生的反应.(1)根据盖斯定律可知,①×2-③可得CH4(g)+CO2(g)=2CO(g)+2H2(g),所以其△H=[(+206.2)×2-(+165.0)]kJ•mol-1=+247.4 kJ•mol-1,所以CH4(g)与CO2(g)反应生成CO(g)和H2(g)的热化学方程式为CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247.4 kJ•mol-1,
故答案为:CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247.4 kJ•mol-1;
(2)从能量角度比较,①是吸热反应,需要消耗更多能量,②是放热反应,不需要太多能量;从原子利用率角度,由于CO+2H2→CH3OH,①的产物中氢原子不可能全部变为CH3OH,而②的产物中所有原子都可能全部变为CH3OH;因此选②,甲烷不完全燃烧制合成气时放出热量,还得到物质的量之比为1:2的CO和H2的混合气体,能恰好完全反应生成甲醇,
故答案为:选择CH4不完全燃烧制合成气时,放出热量,同时得到的CO、H2物质的量之比为1:2,能恰好完全反应合成甲醇,符合绿色化学的“原子经济”原则;
(3)已知正反应是气态物质体积减小的放热反应,因此采用降低温度、增大压强能使平衡右移,提高CO的转化率,故答案为:低温、高压;
(4)n(KOH)=2mol/L×2L=4mol,可能先后发生反应①CH4+2O2→CO2+2H2O、②CO2+2KOH=K2CO3+H2O、③K2CO3+CO2+H2O=2KHCO3;
①当0<V≤44.8 L时,0<n(CH4)≤2mol,则0<n(CO2)≤2mol,只发生反应①②,且KOH过量,则电池总反应式为CH4+2O2+2KOH=K2CO3+3H2O,
故答案为:CH4+2O2+2KOH=K2CO3+3H2O;
②当44.8 L<V≤89.6 L,2mol<n(CH4)≤4mol,则2mol<n(CO2)≤4mol,发生反应①②③,得到K2CO3和KHCO3溶液,则负极反应式为CH4-8e-+9CO32-+3H2O=10HCO3-,
故答案为:CH4-8e-+9CO32-+3H2O=10HCO3-;
③当V=67.2 L时,n(CH4)=3mol,n(CO2)=3mol,则电池总反应式为3CH4+6O2+4KOH=K2CO3+2KHCO3+7H2O,则得到1molK2CO3和2molKHCO3的溶液,则c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).点评:
本题考点: 用盖斯定律进行有关反应热的计算;常见化学电源的种类及其工作原理;化学平衡的调控作用.
考点点评: 本题考查了运用盖斯定律计算焓变、热化学方程式的书写、评价物质合成方案、影响化学平衡的因素、燃料电池、溶液中离子浓度大小关系等重要考点,涉及的知识点较多,综合性较强,难度较大.1年前查看全部
- 能源短缺是人类面临的重大问题之一.甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上合成甲醇一般采用以下反应:CO(
能源短缺是人类面临的重大问题之一.甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上合成甲醇一般采用以下反应:CO(g)+2H 2 (g)⇌CH 3 OH(g)+Q
下表所列数据是上述反应在不同温度下的化学平衡常数(K)
(1)在一定条件下将2molCO和6molH 2 充入2L的密闭容器中发生反应,5分钟后测得c(H 2 )=1.5mol/L,则此段时间内的反应速率(用CH 3 OH表达)______mol/(L•min).温度 250℃ 300℃ 350℃ K 2.041 0.270 0.012
(2)由表中数据分析可知,Q______0(填“>”、“<”或“=”).其它条件不变的情况下,若压缩容器的体积,则平衡______移动(“向正反应方向”“向逆反应方向”或“不”),化学平衡常数K______(填“增大”、“减小”或“不变”).
(3)在体积一定的密闭容器中,能说明该反应已处于化学平衡状态的是______(填编号).
a.V 正 (CO)=1/2V 正 (H 2 )b.混合气体的密度保持不变
c.反应体系中的热效应不再变化d.c(CO):c(CH 3 OH)=1:1
(4)寻找到合适的催化剂是实现反应工业化的关键.该反应使用催化剂无法实现的目标是______(填编号).
a.提高单位时间内甲醇的产量b.增大混合气体中甲醇的体积分数
c.缩短达到平衡所需时间d.提高一氧化碳的转化率. smile咿人1年前1
smile咿人1年前1 -
 他家maomao 共回答了23个问题
他家maomao 共回答了23个问题 |采纳率87%(1)依据化学平衡三段式列式得到
CO(g)+2H 2 (g)⇌CH 3 OH(g)
起始量(mol) 260
变化量(mol)1.5 31.5
5分钟量(mol) 0.5 2L×1.5mol/L=3mol 1.5
用CH 3 OH表达的反应速率=
1.5mol
2L
5min =0.15mol/L•min,
故答案为:0.15;
(2)表中数据分析可知随温度升高,平衡常数K减小,说明温度升高,平衡逆向进行,所以正向是放热反应,Q>>0,反应前后气体体积减小,依据平衡移动原理,增大压强平衡向气体体积减小的分析进行,所以压缩体积是增大压强,平衡正向进行;平衡常数琐碎温度变化,不随浓度、压强等因素变化,所以K不变,
故答案为:>;向正反应方向;不变;
(3)反应达到平衡的标志是正逆反应速率相同,各组分含量保持不变;
a.V 正 (CO)=1/2V 正 (H 2 ),正反应速率之比等于化学方程式中 计量数之比,仅表示反应正向进行,不能说明反应达到平衡,故a错误;
b.混合气体的密度保持不变,混合气体在乙定容密闭容器中进行,质量守恒,体积不变,反应过程中混合气体的密度始终不变,故b错误;
c.反应体系中的热效应不再变化,反应达到平衡反应的热量变化一定,平衡发生移动,反应的热量发生改变,证明反应达到平衡,故C正确;
d.c(CO):c(CH 3 OH)=1:1浓度相同,和起始量,变化量等有关,与平衡无直接关系,不能做平衡的标志,故d错误;
故答案为:c;
(4)寻找到合适的催化剂是实现反应工业化的关键,催化剂降低反应活化能,增大反应速率,但不改变化学平衡,
a.提高单位时间内甲醇的产量,反应速率增大,单位时间内生成甲醇增大,故a不符合;
b.增大混合气体中甲醇的体积分数,催化剂不改变化学平衡,体积分数不变,故b符合;
c.缩短达到平衡所需时间,催化剂加快反应速率,缩短到达平衡的时间,故c不符合;
d.提高一氧化碳的转化率,催化剂不改变平衡,反应物的转化率不变,故d符合;
故答案为:bd.1年前查看全部
- (2010•陕西模拟)由CO与H2催化合成甲醇是生物质能利用的方法之一.
 (2010•陕西模拟)由CO与H2催化合成甲醇是生物质能利用的方法之一.
(2010•陕西模拟)由CO与H2催化合成甲醇是生物质能利用的方法之一.
(1)上述反应的催化剂常用第四周期两种金属元素的化合物,其中一种元素的原子L层电子数与最外层电子数之比为4:1,d轨道中的电子数与最外层电子数之比为5:1,它的元素符号为______,其+2价离子的核外电子排布式是______.
(2)根据等电子原理,写出CO分子的结构式______.
(3)甲醇催化氧化可得到甲醛.
①甲醇的沸点比甲醛的高,其主要原因是______;
②甲醛分子中碳原子轨道的杂化类型为______.甲醛分子的空间构型是______; 1mol甲醛分子中σ键的数目为______.
(4)上述反应的催化剂另一种是铜元素的化合物.已知铜的重要化合物胆矾CuSO4•5H2O可写成[Cu(H2O)4]SO4•H2O,其结构示意图如:下列说法正确的是______(填字母).
A.在上述结构示意图中,所有氧原子都采用sp3杂化
B.在上述结构示意图中,存在配位键、共价键和离子键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去. 提笔忘字郎1年前1
提笔忘字郎1年前1 -
 dongwei80 共回答了22个问题
dongwei80 共回答了22个问题 |采纳率86.4%解题思路:(1)L层电子数与最外层电子数之比为4:1,d轨道中的电子数与最外层电子数之比为5:1,该元素位于第四周期可知该元素为Zn,根据锌的原子序数和构造原理来书写基态Zn原子的核外电子排布式;
(2)根据等电子原理来书写CO的结构式;
(3)①利用氢键来解释物质的沸点;
②利用甲醛中的成键来分析碳原子的杂化类型;利用杂化类型来分析空间结构,并利用判断σ键的规律来分析σ键数目;
(4)根据结构示意图中氧原子是否都是饱和氧原子,存在O→Cu配位键,H-O、S-O共价键和Cu、O离子键,胆矾属于离子晶体以及胆矾晶体中水两类,一类是形成配体的水分子,一类是形成氢键的水分子等角度分析.(1)L层电子数与最外层电子数之比为4:1,L层不是最外层电子数为8,那么最外层电子数为2.d轨道中的电子数与最外层电子数之比为5:1,说明d轨道中的电子数为10.该元素位于第四周期可知该元素为Zn,故答案为:Zn;1s22s22p63s23p63d10或[Ar]3d10.
(2)依据等电子原理,可知CO与N2为等电子体,N2分子的结构式为N≡N,互为等电子体分子的结构相似,则CO的结构式为C≡O,故答案为:C≡O;
(3)①甲醇分子之间形成了分子间氢键,甲醛分子间只是分子间作用力,而没有形成氢键,故甲醇的沸点高;故答案为:甲醇分子之间形成氢键;
②甲醛分子中含有碳氧双键,共有3个σ键,则碳原子轨道的杂化类型为sp2杂化;因甲醛中碳原子采取sp2杂化,则分子的空间构型为平面三角形;1mol甲醛分子中含有2mol碳氢σ键,1mol碳氧σ键,故含有σ键的数目为3NA;
故答案为:sp2杂化;平面三角形;3NA;
(4)A.氧原子并不都是sp3杂化,该结构中的氧原子部分饱和,部分不饱和,杂化方式不同.从现代物质结构理论出发,硫酸根离子中S和非羟基O之间除了形成1个σ键之外,还形成了反馈π键.形成π键的电子不能处于杂化轨道上,O必须保留未经杂化的p轨道,就不可能是sp3杂化,故A错误;
B.在上述结构示意图中,存在O→Cu配位键,H-O、S-O共价键和Cu、O离子键,故B正确;
C.胆矾是五水硫酸铜,胆矾是由水合铜离子及硫酸根离子构成的,属于离子晶体,故C错误;
D.由于胆矾晶体中水两类,一类是形成配体的水分子,一类是形成氢键的水分子,结合上有着不同,因此受热时也会因温度不同而得到不同的产物,故D正确.
故选BD.点评:
本题考点: 原子核外电子排布;化学键;判断简单分子或离子的构型;“等电子原理”的应用;原子轨道杂化方式及杂化类型判断;氢键的存在对物质性质的影响.
考点点评: 本题主要考查核外电子排布式、等电子体原理、分子间作用力、杂化轨道、共价键类型、分子的平面构型,注重了对物质结构中常考考点的综合,学生易错点在电子排布中3d与4s的书写上及杂化类型的判断上.1年前查看全部
- (2011•上海模拟)CO和CO2都可以合成甲醇:CO+2H2→CH3OH;CO2+3H2→CH3OH+H2O,CO、C
(2011•上海模拟)CO和CO2都可以合成甲醇:CO+2H2→CH3OH;CO2+3H2→CH3OH+H2O,CO、CO2和H2可通过下列反应制备:①CH4+H2O(g)→CO+3H2;②CO+H2O(g)→CO2+H2;反应①的产物合成甲醇时H2过量,反应②的产物合成甲醇时H2不足.为了充分利用原料,可将两个反应的产物混合使用.
(1)以CH4、CO、H2O混合气体为原料气,在一定条件下充分反应,所得气体以合成甲醇,为使原子的利用率达到最高,则CH4、CO、H2O的最佳配比为______.
(2)若以100L CH4和H2O的混合气体为原料,制备CO、CO2和H2混合气体,当CH4和H2O均完全反应后,在相同条件下反应后气体的体积为______L(写范围).
(3)若反应①的气体产物共为V1L,则合成甲醇时H2过量0.25V1L;反应②的气体产物共为V2L,则合成甲醇时H2不足(H2少V2L).为了充分利用原料,可将两个反应的产物混合使用,则V1与V2最佳比例为______.
(4)在100L CH4和H2O的混合气体中,CH4所占的体积分数为x,反应后气体的体积为y(L),求:x的取值范围和气体产物的体积y(用含x的函数表达式) wuxiaoman1年前1
wuxiaoman1年前1 -
 阿tim 共回答了17个问题
阿tim 共回答了17个问题 |采纳率82.4%解题思路:(1)使原子利用率都达到100%,根据原子守恒,由甲醇的分子式可知,则混合气体中n(C):n(H):n(O)=1:4:1,据此计算;
(2)假定只发生反应CH4+H2O (g)→CO+3H2,生成的混合气体的体积最大,假定只发生CH4+2H2O(g)→CO2+4H2,生成的混合气体的体积最小,据此计算;
(3)根据反应②计算V2L气体中CO2、H2的体积,反应③合成甲醇剩余的氢气,与反应②生成的混合气体恰好发生反应④,据此计算;
(4)根据反应CH4+H2O (g)→CO+3H2和CH4+2H2O(g)→CO2+4H2进行计算.(1)使原子利用率都达到100%,根据原子守恒,由甲醇的分子式可知,则混合气体中n(C):n(H):n(O)=1:4:1,令CH4、CO、H2O的物质的量分别为xmol、ymol、zmol,则(x+y):(4x+2z):(y+z)=1:4:1,整理得x:y:z=2:1:2,故答案为:2:1:2;
(2)假定只发生反应CH4+H2O (g)→CO+3H2,生成的混合气体的体积最大,最大体积为100L×[4/2]=200L,假定只发生CH4+2H2O(g)→CO2+4H2,生成的混合气体的体积最小,最小体积为100L×[5/3]=166.7L,故反应后气体的体积为:166.7L<v<200L,
故答案为:166.7L≤v≤200L;
(3)反应②的气体产物共为V2L,则反应②生成的气体中CO2体积为0.5V2L,H2的体积为0.5V2L,反应③合成甲醇剩余的氢气,与反应②生成的混合气体恰好发生反应④,故0.5V2L:(0.5V2L+0.25V1L)=1:3,整理得V1:V2=4:1,故答案为:4:1;
(4)反应可能由3种情况:
①如H2O少量,则只发生:CH4+H2O (g)→CO+3H2,x的取值范围[1/2]<x<1,由差量法可知反应后的体积为100+100(1-x)×2=300-200x,
即:v=300-200x;
②如H2O过量,则只发生:CH4+2H2O(g)→CO2+4H2,x的取值范围0<x<[1/3],反应后气体为CO2、H2和H2O,由差量法可知反应后的体积为100+200x,
即:V=100+200x,
③如H2O与CH4均完全反应,x的取值范围[1/3]≤x≤[1/2],由差量法可知V=100+200x,
答:x的取值范围和气体产物的体积y分别为①[1/2]<x<1,v=300-200x;②0<x<[1/3],V=100+200x;③[1/3]≤x≤[1/2],V=100+200x.点评:
本题考点: 有关混合物反应的计算;化学平衡建立的过程.
考点点评: 本题考查混合物的计算,题目难道较大,注意差量法的运用,为解答该题的关键,注意把握相关反应的可能性.1年前查看全部
- 谁知道怎样用一氧化碳和氢气合成甲醇,甲醇燃烧后的产物是什么
 ff的十三1年前1
ff的十三1年前1 -
 狼行无声 共回答了20个问题
狼行无声 共回答了20个问题 |采纳率90%1)主要化学反应、CO+H2CH3OH(g)当有二氧化碳存在时,二氧化碳按下列反应生成甲醇CO2+H2CO+H2O(g)CO+H2CH3OH(g)两步反应的总反应式为:CO2+3H2CH3OH+H2O(2)典型的副反应2CO+4H2--------CH3OCH3+H2OCO+3H2------CH4+H2O4CO+8H2------C4H9OH+3H2O甲醇充分燃烧后的产物是二氧化碳和水,不充分燃烧产物还有一氧化碳.1年前查看全部
- 合成甲醇反应体系中通入少量CO2有利于维持催化剂Cu2O的量不变,原因是(用化学方
 jessie5211年前1
jessie5211年前1 -
 ahwuxs 共回答了19个问题
ahwuxs 共回答了19个问题 |采纳率100%Cu+CO2=CO+CuO 加入少量CO2的原因是使反应平衡:CO+CuO =Cu+CO2向左移动,从而使氧化铜的量不变……1年前查看全部
- 一氧化碳和氢气合成甲醇的反应热问题
 找一个出口1年前1
找一个出口1年前1 -
 江湖小跺 共回答了19个问题
江湖小跺 共回答了19个问题 |采纳率94.7%理论上一氧化碳和氢气以1比2的比例反应制得甲醇,反应为放热反应,甲醇燃烧可以放热,所以甲醇是很好的能源,为再生能源1年前查看全部
- CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)=CH3OH(g),(1)下表所列数据是反应在不同温度下的化学平
CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)=CH3OH(g),(1)下表所列数据是反应在不同温度下的化学平衡常数(K).
温度250°C300°C350°CK2.0410.2700.012在一定条件下,将2molCO和6molH2充入2L的密闭容器中发生反应,5分钟后测得c(CO)=0.4mol/L,计算此段时间的反应速率(用H2表示)_____mol/(L. love_52081年前1
love_52081年前1 -
 留意者 共回答了19个问题
留意者 共回答了19个问题 |采纳率100%摩尔下
CO(g)+2H2(g)=CH3OH(g
初始 2 6 0
反应 x 2x
末 2*0.4 6-2x
总反应量CO x=2-2*0.4=1.2mol
则H2 2x=1.2*2=2.4 反应速率为 2.4/(2*5)=0.24mol/(L*min)1年前查看全部
- 甲烷与氧气合成甲醇是吸热还是放热?
 ghjd3123kuu1年前3
ghjd3123kuu1年前3 -
 司马无剑 共回答了23个问题
司马无剑 共回答了23个问题 |采纳率91.3%CH4+1/2O2——>CH3OH
显然是1.5mol的气体转化为1mol的气体,反应是熵减小的;假如反应还是吸热的,就无法在热力学上自发进行,实现工业化也就无从谈起了.而事实上此反应已经大量用于生产,因此这个反应显然只能是放热的.1年前查看全部
- 研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题.CO可用于合成甲醇,
研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题.CO可用于合成甲醇,
研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题.(1)CO可用于合成甲醇.在体积可变的密闭容器中充入4molCO和8molH2,在催化剂作用下合成甲醇:CO(g)+2H2(g) CH3OH(g)(Ⅰ),平衡时CO的转化率与温度、压强的关系如右图所示:①该反应的逆反应属于________反应;(填“吸热”或“放热”).②在0.1Mpa 、100℃的条件下,该反应达到平衡时容器体积为开始容器体积的_________倍.(结果保留两位小数点)③在温度和容积不变的情况下,再向平衡体系中充入4molCO,8molH2,达到平衡时CO转化率_______(填“增大”,“不变”或“减小”),平衡常数K_______(填“增大”,“不变”或“减小”). 蓝色妖姬02091年前1
蓝色妖姬02091年前1 -
 1841008 共回答了22个问题
1841008 共回答了22个问题 |采纳率86.4%你那里不是有答案么,你想问什么啊亲?1年前查看全部
- 工业上在合成塔中采用下列反应合成甲醇:
 工业上在合成塔中采用下列反应合成甲醇:
工业上在合成塔中采用下列反应合成甲醇:
CO(g)+2H2(g)⇌CH3OH(g)△H=Q kJ/mol
(1)判断该可逆反应达到平衡状态的标志是(填字母序号)______.
a、生成CH3OH的速率与消耗CO的速率相等b、混合气体的密度不变
c、CH3OH、CO、H2的浓度都不再发生变化d、混合气体的平均相对分子质量不变
(2)下表所列数据是该可逆反应在不同温度下的化学平衡常数(K)
①由表中数据判断Q______0(填“>”、“<”或“=”),该反应在______(填“较高”或“较低”)温度下有利于自发进行.温度 250℃ 300℃ 350℃ K 2.041 0.270 0.012
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应后,达到平衡测得c(CO)=0.2mol/L,此时对应的温度为_______;CO的转化率为______.
(3)请在图中画出压强不同,平衡时甲醇的体积分数(φ)随温度(T)变化的两条曲线(在曲线上标出P1、P2、,且p1<P2)
(4)要提高CO的转化率且提高反应速率,可以采取的措施是______(填字母序号).
a、升温b、加入催化剂c、增加CO的浓度 d、通入H2加压e、通人惰性气体加压f.、分离出甲醇
(5)已知一定条件下,CO与H2在催化剂的作用下生成5molCH3OH时,能量的变化为454kJ.在该条件下,向容积相同的3个密闭容器中,按照甲、乙、丙三种不同的投料方式加人反应物,测得反应达到平衡时的有关数据如下:
下列说法正确的是______(填字母序号).容器 甲 乙 丙 反应物投入量 1molCO
2molH21molCH3OH 2molCH3OH 平衡
时数
据CH3OH的浓度(mol•L-1) c1 c2 c3 反应吸收或放出的能量(KJ) a b c 体系压强(Pa) P1 P2 P3 反应物转化率 α1 α2 α3
A、2c1>c3B、a+b<90.8C、2P2<P3D、α1+α3<1. 7sv61年前1
7sv61年前1 -
 yue_jia 共回答了18个问题
yue_jia 共回答了18个问题 |采纳率83.3%解题思路:(1)化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断,得出正确结论;
(2)①依据平衡常数随温度变化分析,结合平衡移动原理分析热量变化;
②依据化学平衡的三段式列式计算,依据转化率概念计算得到;根据浓度计算出平衡常数,再判断温度;
(3)增大压强,平衡正向移动;甲醇的体积分数(φ)增大;升高温度,平衡逆向移动,甲醇的体积分数(φ)减小,依此作图;
(4)a.升温,反应速率加快,平衡逆向移动,CO的转化率减小;
b.加入催化剂,反应速率加快,平衡不移动,CO的转化率不变;
c.增加CO的浓度,反应速率加快,平衡正向移动,但CO的转化率减小;
d.通入H2加压,反应速率加快,平衡正向移动,CO的转化率增大;
e.通人惰性气体加压,反应速率不变,平衡不移动,CO的转化率不变;
f.分离出甲醇,反应速率减慢,平衡正向移动,CO的转化率增大;
(5)A.甲、丙相比较,把甲等效为开始加入1molCH3OH,丙中甲醇的物质的量为甲的2倍,压强增大,对于反应CH3OH(g)⇌CO(g)+2H2(g),平衡向生成甲醇的方向移动;
B.由题目可知生成1molCH3OH的能量变化为[454/5]=90.8kJ,甲、乙平衡状态相同,令平衡时甲醇为nmol,计算反应热数值,据此判断;
C.比较乙、丙可知,丙中甲醇的物质的量为乙的2倍,压强增大,对于反应CH3OH(g)⇌CO(g)+2H2(g),平衡向生成甲醇的方向移动;
D.甲、乙处于相同的平衡状态,则α1+α2=1,由C的分析可知α2>α3,据此判断.(1)CO(g)+2H2(g)⇌CH3OH(g)
a.生成CH3OH是正反应,消耗CO也是正反应,故a错误;
b.密度=[总质量/体积],总质量一定,体积一定,故混合气体的密度不变不能说明反应达平衡状态,故b错误;
c.达到化学平衡状态时,各物质的浓度不再发生变化,故CH3OH、CO、H2的浓度都不再发生变化能说明反应达平衡状态,故c正确;
d.平均相对分子质量=[总质量/总物质的量],总质量一定,总物质的量会变,故混合气体的平均相对分子质量不变能说明反应达平衡状态,故d正确;
故答案为:cd;
(2)①依据图表数据可知,随温度升高,平衡常数减小,说明平衡逆向进行,逆向是吸热反应,正向放热反应,故Q<0;
故答案为:<;
△G=△H-T△S,△H<0,△S<0,故低温有利于自发进行,
故答案为:<;低温;
②c(CO)=0.2mol/L,物质的量为0.4mol;
CO (g)+2H2 (g)⇌CH3OH (g)
起始量(mol) 2 6 0
变化量(mol) 1.6 3.21.6
平衡量(mol) 0.4 2.8 1.6
c(CO)=[0.4/2]=0.2mol/L,c(H2)=[2.8/2]=1.4mol/L,c(CH3OH )=[1.6/2]=0.8mol/L,
此时的平衡常数为:K=[1.6/0.2×1.4×1.4]≈2.041,所以温度为250℃,
CO的转化率=[1.6/2]×100%=80%,
故答案为:250℃;80%;
(3)增大压强,平衡正向移动;甲醇的体积分数(φ)增大;升高温度,平衡逆向移动,甲醇的体积分数(φ)减小,
故答案为: ;
;
(4)a.升温,反应速率加快,平衡逆向移动,CO的转化率减小,故a错误;
b.加入催化剂,反应速率加快,平衡不移动,CO的转化率不变,故b错误;
c.增加CO的浓度,反应速率加快,平衡正向移动,但CO的转化率减小,故c错误;
d.通入H2加压,反应速率加快,平衡正向移动,CO的转化率增大,故d正确;
e.通人惰性气体加压,反应速率不变,平衡不移动,CO的转化率不变,故e错误;
f.分离出甲醇,反应速率减慢,平衡正向移动,CO的转化率增大,故f错误;
故答案为:d;
(5)A.甲、丙相比较,把甲等效为开始加入1molCH3OH,丙中甲醇的物质的量为甲的2倍,压强增大,对于反应CH3OH(g)⇌CO(g)+2H2(g),平衡向生成甲醇的方向移动,故2c1<c3,故A错误;
B.由题目可知生成1molCH3OH的能量变化为[454/5]=90.8kJ,甲、乙平衡状态相同,令平衡时甲醇为nmol,对于甲容器,a=90.8n,等于乙容器b=90.8(1-n),故a+b=90.8,故B错误;
C.比较乙、丙可知,丙中甲醇的物质的量为乙的2倍,压强增大,对于反应CH3OH(g)⇌CO(g)+2H2(g),平衡向生成甲醇的方向移动,故2p2>p3,故C错误;
D.甲、乙处于相同的平衡状态,则α1+α2=1,由C的分析可知α2>α3,所以a1+a3<1,故D正确,
故答案为:D.点评:
本题考点: 等效平衡;化学平衡的影响因素;化学平衡状态的判断.
考点点评: 本题考查平衡状态的判断、化学平衡的计算、平衡常数的计算等,综合性较强,难度中等,题量超大.1年前查看全部
大家在问
- 1主课满分120,英语65,副科满分50,全部40以上,物理满分70,得了45
- 2Thought the dancer,Tai Lihua,is deaf,she dances___most of th
- 3(2012•吴江市)把下面的硬纸板,按照虚线折叠,能围成一个正方体的是( )号图形.
- 4质量=密度*体积 如果质量单位是千克体积单位应该用什么?升还是毫升?升与立方米和立方分米,立方毫米的关系是什么?体积间的
- 5这段话如何写得更有文采啊?(用英语)
- 6(2013•杨浦区一模)将一颗质地均匀的骰子连续投掷两次,朝上的点数依次为b和c,则函数f(x)=x2+2bx+c图象与
- 7某兴趣小组利用自由落体运动测定重力加速度,实验装置如图所示.倾斜的球槽中放有若干个小铁球,闭合开关K,电磁铁吸住第1个小
- 8黎明小学的同学为在青藏的孩子送去衣服、文具、书籍.虽然这些东西都
- 9不要让无聊的事破坏你的心情用英语怎么说
- 10把一条绳子对折3次后,每段长1.5米,问绳子长几米.求方程解,
- 11燃烧塑料放出那些有害气体?
- 12如图,工人师傅从一块正方形铁皮上剪下四个圆作为冲击垫圈,要求每个圆的面积是4πcm²,废铁皮的边长至少为多少?
- 13向你学到很多的英文
- 14在距地面高为h处,同时以相等的初速度V0分别平抛、竖直上抛、竖直下抛一质量相等的物体m,当它们从抛出到落地时,比较它们的
- 15白细胞可以自由穿过毛细血管壁吗