R元素1.42g与氧元素组成2.38g氧化物X,或组成3.66g的氧化物Y,则X,Y的化学式是
 NOWFTM2022-10-04 11:39:541条回答
NOWFTM2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 闹春红杏 共回答了14个问题
闹春红杏 共回答了14个问题 |采纳率92.9%- R2O3和R2O7
(原题)好像是天原杯奥林匹克题!
1.42gR元素可与氧元素组成2.38 g氧化物X,或组成3.66 g氧化物Y,则X、Y的化学式可能是().
(A)R2O和R2O5 (B)R2O3和R2O5
(C)R2O3和R2O7 (D)R2O和R2O3
X中,氧元素质量为2.38-1.42=0.94g
Y中,氧元素质量为3.66-1.42=2.24g
2.24÷0.94=2.38
而四个备选答案中,各种物质含R均为2,则氧之比最接近2.38的即为答案
故,选C - 1年前
相关推荐
- +2价的R元素的一个原子的质量是mg,该元素的硝酸盐的式量为M,则W克该硝酸盐中硝酸根离子的数目是?
+2价的R元素的一个原子的质量是mg,该元素的硝酸盐的式量为M,则W克该硝酸盐中硝酸根离子的数目是?
答案是2W(M-124)/Mm
为什么不是2W/M啊? 茅家埠的鱼1年前1
茅家埠的鱼1年前1 -
 逆行的鸟 共回答了18个问题
逆行的鸟 共回答了18个问题 |采纳率100%根据原子个数比来计算,必须先计算出R元素的离子个数,则硝酸根离子的数目是其两倍.
所以应该是:{W×〔(M-124)/M〕/m}×2=2W(M-124)/Mm1年前查看全部
- 关于化合价的2道科学题目1.CH4.nH2O(可燃冰)中C的化合价2.某物质的化学式是HnRO2n-1,则R元素相同价态
关于化合价的2道科学题目
1.CH4.nH2O(可燃冰)中C的化合价
2.某物质的化学式是HnRO2n-1,则R元素相同价态的与氧形成的化合物的化学式不可能是( )
A.RO2 B.R2O C.R2O3 D.R2O7
1.A.-4 B.+3 C.+1 D.-1 烟波飘渺1年前4
烟波飘渺1年前4 -
 allfusdo 共回答了21个问题
allfusdo 共回答了21个问题 |采纳率90.5%1.-4.只用看CH4部分,后面结晶水不考虑,H为+1
2.R为3n-2价.
故R可为1,4,7价.故C不满足
选C1年前查看全部
- 已知R元素的某种同位素,能形成离子化合物AmRn····
已知R元素的某种同位素,能形成离子化合物AmRn····
已知R元素的某种同位素,能形成离子化合物AmRn,该晶体中一个R微粒的核外电子数为a,核内中子数为b,则该同位素原子组成的表示式为?网上说(http://zhidao.baidu.com/question/315272980.html)R的价态就是m 那要是像FeS AlN这种物质情何以堪啊··解释不通啊 halibut1年前1
halibut1年前1 -
 半吊子鱼 共回答了15个问题
半吊子鱼 共回答了15个问题 |采纳率93.3%人家的回答是正确的.但那是针对一般情况.像Fe、S、N是可以变价的.Fe有0、+2、+3、+4、+6价.S有-2、0、+4、+6价.N有-3、0、+2、+3、+4、+5价.1年前查看全部
- 在R元素的氧化物中,R元素与氧元素的质量比为4比1,R的相对原子质量为m,则R在此氧化物中的化合价是 ( )
 季节有毒1年前2
季节有毒1年前2 -
 心纯如茗 共回答了18个问题
心纯如茗 共回答了18个问题 |采纳率88.9%答案:+m/32
解析:设化合物为RxOy,R化合价为+Z
则有:质量比:mx:16y=4:1
化合价:zx=2y
z=+m/321年前查看全部
- R,X两种元素间能形成多种化合物,已知其中一种元素化合物RX中R元素的质量分数为46.7%,那么下列化合物R元素的质量分
R,X两种元素间能形成多种化合物,已知其中一种元素化合物RX中R元素的质量分数为46.7%,那么下列化合物R元素的质量分数大于46.7%的是( )
A.RX2 B.R2X3 C.R2X D.R2X5 gxhyue1年前1
gxhyue1年前1 -
 不要封偶啊03 共回答了19个问题
不要封偶啊03 共回答了19个问题 |采纳率94.7%这样看 A RX2
B RX1.5
C RX0.5
D RX2.5
因为RX是46.7%
则R的质量分数越大,R的相对数量越大,X相对数量越少
所以C1年前查看全部
- 1.R为某无可变化合价的金属元素,R的氯化物的相对分子质量为m.它的氢氧化合物的相对分子质量为n,则R元素的化合价为?
1.R为某无可变化合价的金属元素,R的氯化物的相对分子质量为m.它的氢氧化合物的相对分子质量为n,则R元素的化合价为?
2.A.B俩种化合物均由R合X俩种元素组成,在化合物A和B中,R元素的质量分数分别为50%、40%,若A的化学式为RX2(2是X的下标,电脑打不出来),则B的化学式为? 11655856811年前1
11655856811年前1 -
 seashell825 共回答了19个问题
seashell825 共回答了19个问题 |采纳率89.5%1、 设化合价为x氯化物RClx氢氧化物为R(OH)x
x=(m-n)/(35.5-17)=(m-n)/18.5
2、设R和X的原子量分别为y、x,
对A,y/(y+2x)=0.5,则y=2x,对B,y/(y+nx)=0.4,解得,n=3,B的化学式为RX31年前查看全部
- 金属元素氯化物含氯的质量分数是74.78%,且R原子量是47.9,则氯化物中,R元素的化合价是——
金属元素氯化物含氯的质量分数是74.78%,且R原子量是47.9,则氯化物中,R元素的化合价是——
急 priscilla_jing1年前1
priscilla_jing1年前1 -
 tdown 共回答了11个问题
tdown 共回答了11个问题 |采纳率90.9%设化合价为x ,化学式为RClx.
35.5x/(47.9+35.5x)=74.78% x=4
R元素的化合价是+41年前查看全部
- 相对原子质量方面的!有M1 M2 M3三种含R元素的化合物 其中R%(表示R元素在化合物中所占的质量分数)分别为40%
相对原子质量方面的!
有M1 M2 M3三种含R元素的化合物 其中R%(表示R元素在化合物中所占的质量分数)分别为40% 40% 45% ,M1 M2 M3 三种物质的相对分子质量分别为180.60 .16 则 R元素的相对原子质量为( )
A 71 B 36 C 24 D 12 qq5409056521年前1
qq5409056521年前1 -
 gsswyp 共回答了22个问题
gsswyp 共回答了22个问题 |采纳率95.5%180*40%=72
60*40%=24
16*45%=7.2
M3的数据有误.
可能是C或D.(要看M3的数据来定)
如果M3中R的含量是75%
16*75%=12
D是正确的.1年前查看全部
- 化合价为奇数的某金属R的氧化物中,R元素和氧元素的质量比为9:8,求R的氯化物中R元素和氯元素的质量比.
 nbma1年前2
nbma1年前2 -
 躲进小楼成一筒 共回答了16个问题
躲进小楼成一筒 共回答了16个问题 |采纳率100%解析:
因为某金属R的化合价为奇数,所以设其氧化物为 R2Ox(x为该金属的化合价)
设R的相对原子质量为 M
则质量比 R:O = 2*M :x*16 = 9:8
2*M * 8 = x*16 * 9
解得:
M = 9x
一般的奇数价态为 +1,+3,+5,+7
讨论:
(1)当x = 1时,M = 9(相对原子质量为9的元素最可能的是 铍Be元素的同位素,但Be为+2价,不符合题意,舍去)
(2)当x = 3时,M = 27(相对原子质量为27的元素最可能的是 铝Al,Al为+3价,符合题意)
其氯化物(AlCl3)中R与Cl质量比 = 27 :35.5*3 = 9:35.5
(3)当x = 5时,M = 45(相对原子质量为45的元素最可能的是 钪Sc,但Sc为+3价,不符合题意,舍去)
(4)当x = 7时,M = 63(相对原子质量为63的元素最可能的是 钴Co 镍Ni 铜Cu 锌Zn,但它们都没有+7价化合物存在,不符合题意,舍去)
所以该元素 为 Al;其氯化物(AlCl3)中R与Cl质量比 = 27 :35.5*3 = 9:35.51年前查看全部
- 在一定条件下,RO3n-和I-可发生如下反应:RO3n-+6I-+6H+=R-+3I2+3H2O,则RO3n-中R元素的
在一定条件下,RO3n-和I-可发生如下反应:RO3n-+6I-+6H+=R-+3I2+3H2O,则RO3n-中R元素的化合价为( )
在一定条件下,RO3n-和I-可发生如下反应:RO3n-+6I-+6H+=R-+3I2+3H2O,则RO3n-中R元素的化合价为( +5 )
电荷守恒是
前面的电荷总数=后米的电荷总数
还是
反应前后正电荷总数=负电荷总数 mei1681年前2
mei1681年前2 -
 一代萎人 共回答了15个问题
一代萎人 共回答了15个问题 |采纳率93.3%正电荷总数=负电荷总数1年前查看全部
- 某金属元素R与硫酸形成的化学式为Rn(SO4)m,如果R元素化合价不变.那么R的氯化物,氧化物化学式为什么?
某金属元素R与硫酸形成的化学式为Rn(SO4)m,如果R元素化合价不变.那么R的氯化物,氧化物化学式为什么?
、氧化物、氯化物的化学式, dingding_me1年前4
dingding_me1年前4 -
 太极张3 共回答了26个问题
太极张3 共回答了26个问题 |采纳率100%R2(SO4)Cl3
R2O3
因为SO4为-2价,所以n=2,则m=31年前查看全部
- 某元素R在氧化物中的化合价为+4价,其中氧元素的质量分数占50%,则R元素的相对原子质量为------.
 有鱼出没1年前1
有鱼出没1年前1 -
 梦短 共回答了20个问题
梦短 共回答了20个问题 |采纳率95%因为R在氧化物中的化合价为+4价,所以其氧化物的化学式为RO2
且氧元素的质量分数占50%,可得氧化物的式量为32/0.5=64
所以R的相对原子质量为64-32=32
基本可以确定R为S1年前查看全部
- 某元素R的氯化物的式量为m,它的相同价态的硝酸盐的式量为n,则R元素的化合价为多少?
 keke9851年前2
keke9851年前2 -
 加德 共回答了22个问题
加德 共回答了22个问题 |采纳率81.8%答:由于氯离子和硝酸根离子都是-1价,设元素M 化合价为+x,相对原子质量为y 则R的氯化物的化学式写作RClx,R的硝酸盐的化学式写作R(NO3)x 则
m=y+35.5*x
n=y+62*x
解方程得
x=(n-m)/26.51年前查看全部
- 若R元素的一种粒子的结构示意图为 ,则下列说法中正确的是 [ ] A.该
若R元素的一种粒子的结构示意图为  ,则下列说法中正确的是
,则下列说法中正确的是[ ]
A.该粒子的核外有2个电子层
B.R元素是金属元素
C.该粒子是了阳离子
D.该粒子的最外层有8个电子 hmzkic1年前1
hmzkic1年前1 -
 空手道七段 共回答了13个问题
空手道七段 共回答了13个问题 |采纳率84.6%A1年前查看全部
- 23gR元素的单质能和8g氧气恰好完全反映,在生成的氧化物中R元素显+1价,则该氧化物的相对分子质量为多少?
 sscaft1年前1
sscaft1年前1 -
 涯粽 共回答了12个问题
涯粽 共回答了12个问题 |采纳率91.7%23g是1mol钠,8g是0.25mol氧气,所以组成应该是R2O2或者是R2O(写反应式得出的结果),上面的2都是边上的小2.要不就生成这种,要不生成就是另一种,然后求出来R的分子质量是46或者23.我也不知道对不对,因为我都大二了,高中学的忘的也差不多了~你看看吧~1年前查看全部
- 在一定条件下,RO3-与R-可发生反应:RO3-+5R-+6H+═3R2+3H2O,下列关于R元素的叙述中,正确的是(
在一定条件下,RO3-与R-可发生反应:RO3-+5R-+6H+═3R2+3H2O,下列关于R元素的叙述中,正确的是( )
A. 元素R位于周期表中第ⅤA族
B. RO3-中的R只能被还原
C. R2在常温常压下一定是气体
D. 若1molRO3-参与该反应,则转移的电子的物质的量为5mol txdxxx1年前1
txdxxx1年前1 -
 uyex1z 共回答了22个问题
uyex1z 共回答了22个问题 |采纳率95.5%解题思路:A、由反应方程式可知,R的最低负价为-1,则其最高正价为+7价,族序数等于最高正化合价.
B、RO3-中R为+5价,R的最低负价为-1,R最高正价为+7价,元素处于中间价态既具有氧化性又具有还原性.
C、若R为I或Br也可以发生如上反应.
D、反应中R元素化合价由+5价降低为0,据此计算.A、由反应方程式可知,R的最低负价为-1,则其最高正价为+7价,族序数等于最高正化合价,元素R应位于第ⅦA族,故A错误;
B、RO3-中R为+5价,R的最低负价为-1,R最高正价为+7价,元素处于中间价态既具有氧化性又具有还原性,故B错误;
C、若R为Cl,单质为气体,若R为I或Br也可以发生如上反应,碘为固体,溴为液体,故C错误;
D、反应中R元素化合价由+5价降低为0,若1molRO3-参与该反应,则转移的电子的物质的量为1mol×(5-0)=5mol,故D正确.
故选:D.点评:
本题考点: 氧化还原反应的计算.
考点点评: 考查学生氧化还原反应、元素性质与物质关系以及根据信息提取知识的能力等,难度中等,关键根据离子方程式判断R的最低负价为-1,最高正价为+7价.是对所学知识的综合运用与能力考查,是一道不错的能力考查题目.1年前查看全部
- 某+3价元素R的氧化物中R元素和氧元素的质量比为9:8则R元素的相对原子质量为
 原路返回1年前1
原路返回1年前1 -
 高高瘦高个 共回答了18个问题
高高瘦高个 共回答了18个问题 |采纳率94.4%设R2O3 R元素的相对原子质量为x
有 2x:(16×3)=9:8
x=271年前查看全部
- 已知R元素相对原子质量为96,在其氧化物中R元素与氧元素的质量比为2:1,则该氧化物的化学式为( )
已知R元素相对原子质量为96,在其氧化物中R元素与氧元素的质量比为2:1,则该氧化物的化学式为( )
A. RO3
B. RO2
C. R2O3
D. RO wnbaby1年前1
wnbaby1年前1 -
 happy300911 共回答了16个问题
happy300911 共回答了16个问题 |采纳率87.5%解题思路:根据氧化物可知该物质只有两种元素,可设出氧化物的化学式,利用元素质量分比来列式解答.设氧化物的化学式为RxOy,
由氧化物中R元素与氧元素的质量比为2:1,
已知R元素相对原子质量为96,
则96×x:16×y=2:1
解得x:y=1:3
即氧化物的化学式为RO3,
故选A.点评:
本题考点: 有关化学式的计算和推断.
考点点评: 本题考查化学式的推断,学生可用正向思维方法来解答,将未知的看为已知的,并熟悉元素质量比的计算方法来解答.1年前查看全部
- 6.4g某物质R完全燃烧生成8.8gCO2,化学反应方程式是2R+3O2 点燃 2CO2+4H2O,计算R元素组成
 xxchris1年前3
xxchris1年前3 -
 lyb1759 共回答了18个问题
lyb1759 共回答了18个问题 |采纳率100%反应方程式都出来了,前面的这些数值就没有必要了,根据反应方程式就可以得出结果:
由原子守恒定律:
右边生成物都知道了总共2个C、8个O、8个H
左边肯定也是一样,扣去氧气中6个氧
还剩下2个C、2个O、8个H
得出R的组成C一个,H4个、O一个1年前查看全部
- R元素的一种粒子的结构示意图为,则下列说法不正确的是( )
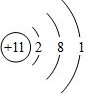 R元素的一种粒子的结构示意图为,则下列说法不正确的是( )
R元素的一种粒子的结构示意图为,则下列说法不正确的是( )
A.该粒子容易得电子
B.该粒子的核外有3个电子层
C.R元素为金属元素
D.R元素的原子有11个电子 3984852381年前1
3984852381年前1 -
 爱吃猫的小鱼 共回答了19个问题
爱吃猫的小鱼 共回答了19个问题 |采纳率84.2%解题思路:根据原子结构示意图表示方法:小圆圈和圈内的数字表示原子核和核内质子数;弧线表示电子层,弧线上的数字该电子层上的电子数;依据原子结构示意图的特点:金属元素的最外层电子数一般少于4,易失去最外层电子形成阳离子;进行解答.A、由粒子结构示意图可知R元素为金属元素,易失去最外层电子,故A说法不正确;
B、由粒子结构示意图可知:该粒子的核外有3个电子层;故B说法正确;
C、依据原子结构示意图的特点:金属元素的最外层电子数一般少于4,所以R元素为金属元素;故C说法正确;
D、由粒子结构示意图可知:圈内的数字表示核内质子数=电子数=11,故D说法正确;
故选A.点评:
本题考点: 原子结构示意图与离子结构示意图.
考点点评: 本题考查学生对粒子结构示意图知识的理解与在解题中灵活应用的能力.1年前查看全部
- 24ml0.05mol/L的Na2SO3恰好与20ml0.02mol/L的K2R2O7完全反应 则R元素在还原产物中的化
24ml0.05mol/L的Na2SO3恰好与20ml0.02mol/L的K2R2O7完全反应 则R元素在还原产物中的化合价为
 kobenz1年前2
kobenz1年前2 -
 柔情葑訫 共回答了25个问题
柔情葑訫 共回答了25个问题 |采纳率88%24*0.05*2=20*0.02*2*(6-X)
X=+3
则R元素在还原产物中的化合价为+31年前查看全部
- 某种金属元素R与碳酸根结合成的化合物的化学式为R2(CO3)3,则R元素的化合价为 价
某种金属元素R与碳酸根结合成的化合物的化学式为R2(CO3)3,则R元素的化合价为 价
则该价态R元素的氢氧化物的化学是为 ,该价态R元素的氯化物的化学式为 .
已知某物质MSO4的式量为160,则M元素的相对原子质量是 .
某化合物的化学式为HnRO2n,则R得化合价为 价,若R的相对原子质量为A,则化合物HnRO2n的式量为 .
一种紫色物质BaCuSi2O6,其中Si呈 价,写出相同价态硅元素的氧化物的化学式. 杨达1年前1
杨达1年前1 -
 qp417xp 共回答了17个问题
qp417xp 共回答了17个问题 |采纳率94.1%R的化合价为+3价.R(OH)3,RCl3 M=160-96=64
R的化合价为+n价.式量为n+A+32n=33n+A
Si为+4价 SiO21年前查看全部
- 在HaRO2a-2中,R元素的化合价为______
在HaRO2a-2中,R元素的化合价为______
将20毫升氢气和氧气的混合气体点燃,充分反应后,恢复到常温,剩余气体为5毫升,则原混合气体中氢气和氧气的体积比可能是_____
A.1:1 B.2:1 C.3:1 D.3:2 duijiaiduiji1年前1
duijiaiduiji1年前1 -
 柏桦 共回答了19个问题
柏桦 共回答了19个问题 |采纳率94.7%1、2*(2a-2)=a+R R=3a-4 (氧为-2价,氢为-1价)
2、反映掉15毫升氢氧比例为2:1
剩余可能是氢,也可能是氧,因此
可能的比例为3:1或1:1
答案选A、C1年前查看全部
- 某金属元素R的碳酸盐化学式为R2(CO3)3,则R元素的化合价为____价,R元素的氢氧化物的化学式为_________
某金属元素R的碳酸盐化学式为R2(CO3)3,则R元素的化合价为____价,R元素的氢氧化物的化学式为___________.氯化物的化学式为_________.它的硫酸盐化学式是_________
 jamilia1年前2
jamilia1年前2 -
 蓝夜灵 共回答了20个问题
蓝夜灵 共回答了20个问题 |采纳率95%+3价
R(OH)3
RCL3
R2(SO4)31年前查看全部
- 240ml含0.8molNa2SO3溶液400ml1mol/L的K2R2O7反应 则R元素在还原产物中的化合价
240ml含0.8molNa2SO3溶液400ml1mol/L的K2R2O7反应 则R元素在还原产物中的化合价
还有一题
又9.6克Cu与适量浓硝酸反应 铜全部作用后收集到NO2 NO共5.6L标况,则消耗销酸的物质的量为多少?反应产生的NO2 NO体积各为多少
详细
解答 男人的隐私1年前1
男人的隐私1年前1 -
 妖精385 共回答了22个问题
妖精385 共回答了22个问题 |采纳率100%1、0.8molNa2S(+4)O3~0.4molK2R(+6)2O7
↓2e ↑ 4e
↓ ↑ ↓R变两价
Na2S(+6)O4~0.4mol R2 R(+4)
1.6mole 1.6mole
2、氧化:9.6g(0.15mol)Cu→Cu2+ 共0.3mole
还原:HN(+5)O3→N(+2)O 3e
xmol 3x
HN(+5)O3→N(+4)O2 e
ymol y
5.6L标况~0.25mol
物料守恒:x+y=0.25
得失电子守恒:3x+y=0.3
x=0.025mol y=0.225mol
∴NO~0.56L NO2~5.041年前查看全部
- R元素的单质0.9g,与足量盐酸反应生成RCl3和1.12L(标况)氢气;又知该元素原子核内有14个中子.
R元素的单质0.9g,与足量盐酸反应生成RCl3和1.12L(标况)氢气;又知该元素原子核内有14个中子.
通过计算确定元素符号 一灌到天亮1年前3
一灌到天亮1年前3 -
 wo99053 共回答了17个问题
wo99053 共回答了17个问题 |采纳率94.1%根据题意可得方程式:2R + 6HCl = 2RCl3 + 3H2↑,设R的摩尔质量为xg/mol
2xg 67.2L
0.9g 1.12L
解得:x=27.
由于原子质量数数值上等于其摩尔质量近似整数值,所以R的质量数A=27,再由于中子数N=14,所以R的质子数Z=27-14=13,R为Al.1年前查看全部
- 某金属元素R的氧化物中,R元素与氧元素的质量比为9:8,R的相对原子质量为27,通过计算推测R的氧化物的化学式是( )
某金属元素R的氧化物中,R元素与氧元素的质量比为9:8,R的相对原子质量为27,通过计算推测R的氧化物的化学式是( )
A. RO
B. R2O
C. R3O4
D. R2O3 wsdhb1年前3
wsdhb1年前3 -
 wxp0002 共回答了21个问题
wxp0002 共回答了21个问题 |采纳率100%解题思路:根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.某金属元素R的氧化物中,R元素与氧元素的质量比为9:8,R的相对原子质量为27,设该氧化物的化学式为RxOy,则27x:16y=9:8,x:y=2:3,故该氧化物的化学式为R2O3.
故选:D.点评:
本题考点: 元素质量比的计算.
考点点评: 本题难度不大,考查同学们灵活运用化学式的有关计算进行分析问题、解决问题的能力.1年前查看全部
- 求R元素的原子序数.71、某元素R的最高价氧化物的水化物的化学式为HxROy,气态氢化物的化学式为HxR.已知1molH
求R元素的原子序数.
71、某元素R的最高价氧化物的水化物的化学式为HxROy,气态氢化物的化学式为HxR.已知1molHxROy比1molHxR质量多64g.已知1molHxROy中R的原子核外电子总数比1molHxROy中氢原子和氧原子核外电子总数少16mol.求R元素的原子序数. haoren11051年前5
haoren11051年前5 -
 麦沙拉 共回答了16个问题
麦沙拉 共回答了16个问题 |采纳率87.5%由 【1molHxROy比1molHxR质量多64g 】 这个条件可知
两个摩尔质量从差为Oy=64 所以16y=64 所以y=4
由 【1molHxROy中R的原子核外电子总数比1molHxROy中氢原子和氧原子核外电子总数少16mol 】这个条件可知 R+16=x+8y (y=4),所以
R-x=16【其中R为R的原子序数,即质子数,也是其原子的核外电子数】
若x=1,R=17
若x=2,则R=18(为Ar,不满足)
若x=3,R=19(为K,不满足)
若x=4,R=20(为Ca,也不满足)
所以R=17,为Cl元素,HxR为HCl,HxRO4为HClO4,高氯酸.1年前查看全部
- R元素一个原子的质量是a克,M元素的相对原子质量为A
R元素一个原子的质量是a克,M元素的相对原子质量为A
R元素的一个原子的质量是a克,M元素的相对原子质量为A,化合物RM2的式量为B,则W克RM2中含有M的原子个数为 szzuoyou1年前4
szzuoyou1年前4 -
 citydweller6 共回答了28个问题
citydweller6 共回答了28个问题 |采纳率82.1%1、R元素的一个原子的质量是a克,则RW2的相对分子质量为NA*a+2A.
W克RM2的分子数目为:NA*W/(NA*a+2A)
那么M的原子个数为2NA*W/(NA*a+2A)
2、RW2的式量为B,W克RM2的分子数目为:NA*W/B
那么M的原子个数为2NA*W/B1年前查看全部
- 已知R元素的原子有三个电子层,其最高价氧化物分子式为RO3,则R元素的名称为
已知R元素的原子有三个电子层,其最高价氧化物分子式为RO3,则R元素的名称为
硫
氯
硒
硅
请说明原因 2000wuhan1年前1
2000wuhan1年前1 -
 obeistern 共回答了17个问题
obeistern 共回答了17个问题 |采纳率88.2%硫
三个电子层排除硒
RO3说明6价
只能是硫1年前查看全部
- R元素原子的最外层电子数为2,下列关于R原子和R离子的说法正确的是( )
R元素原子的最外层电子数为2,下列关于R原子和R离子的说法正确的是( )
A. 化学性质相同
B. 电子层数相同
C. 相对原子质量相同
D. 最外层电子数相同 shanrbi1年前1
shanrbi1年前1 -
 feifei654321 共回答了17个问题
feifei654321 共回答了17个问题 |采纳率100%解题思路:通过比较原子和离子的性质依次分析4个选项,即可A、元素的化学性质主要由最外层电子决定,R离子与R原子最外层电子数不同,所以化学性质不同,故A错.
B、R离子的形成是由于失去最外层两个电子形成的,故R离子比R原子电子层数要少一层,故B错误;
C、R原子失去两个电子形成R离子,因为电子的质量非常小,可忽略不计,故C正确;
D、R原子的最外层电子数是2,而R离子的最外层电子数是8,故D错误;
故选C点评:
本题考点: 原子和离子的相互转化.
考点点评: 本题考查原子和离子的性质,尤其是最外层电子数与电子层数,同学们要能熟练应用1年前查看全部
- 某种元素R形成碱的化学式为R(OH)3,则R元素对应的原子结构示意图可能是
 长兔子1年前3
长兔子1年前3 -
 conki 共回答了12个问题
conki 共回答了12个问题 |采纳率100%R为+3价,可能是铝,铁,铬,1年前查看全部
- 某元素R的氧化物的式量为M,该氧化物中R元素的化合价为+4价,则R的相对原子质量是
 闲者没事干1年前1
闲者没事干1年前1 -
 shmily19870808 共回答了20个问题
shmily19870808 共回答了20个问题 |采纳率80%该氧化物是R2O4,对于碳族元素,由于组成的因素应该化简为RO2,那么R的相对原子质量就是(M-2×15.99),对于某些过渡金属元素,他们形成的自己为+4价的氧化物由于物质的组成,一定是2个R原子配4个氧原子的话,那么化学式只能写成R2O4,于是R的相对原子质量就是
(M-4×15.99)/2.1年前查看全部
- 求HnKO3n+2中R元素的化合价!
 海心已碎1年前1
海心已碎1年前1 -
 终恋江湖 共回答了15个问题
终恋江湖 共回答了15个问题 |采纳率86.7%你那K是R吧?根据化合价代数和为零,计算的结果是R的化合价为5n+4,n为原子个数,不为负数或者小数,并且化合价数小于8,所以n=0,则R的化合价为+4价1年前查看全部
- 在R元素的氧化物中,R元素与氧元素的质量比为4比1,R的相对原子质量为m,则R在此氧化物中的化合价是
在R元素的氧化物中,R元素与氧元素的质量比为4比1,R的相对原子质量为m,则R在此氧化物中的化合价是
为什么是:m×2/(4×16)=m/32 弄个cc来贴图1年前2
弄个cc来贴图1年前2 -
 粉色淘鑫 共回答了11个问题
粉色淘鑫 共回答了11个问题 |采纳率81.8%可假设1mol该氧化物含有1mol氧原子,则1mol该氧化物中R所占的相对质量为64,化合价为+2.所以R的化合价/相对质量=2/64=1/32.1年前查看全部
- 某氧化物的分子式为RxOy,它的相对分子质量是M,则R元素的相对原子质量是( )
 melody_tian1年前1
melody_tian1年前1 -
 xuqiwu1 共回答了18个问题
xuqiwu1 共回答了18个问题 |采纳率88.9%(M-16y)/x1年前查看全部
- 科学 (5 14:18:43)某物质的化学式为Hn+1 RO2n+2,相对原子质量为m,R元素的相对原子质量为多少?R元
科学 (5 14:18:43)
某物质的化学式为Hn+1 RO2n+2,相对原子质量为m,R元素的相对原子质量为多少?R元素的化合价为多少? ccckoisk1年前3
ccckoisk1年前3 -
 燕之初 共回答了12个问题
燕之初 共回答了12个问题 |采纳率91.7%n=1时,H2SO4,该物质相对分子质量是98,
相对原子质量是32,R的化合价是+61年前查看全部
- 求HnRO3n+2中R元素的化合价
 wupeng11891年前1
wupeng11891年前1 -
 花飞小花 共回答了23个问题
花飞小花 共回答了23个问题 |采纳率78.3%R=(3n+2)*2-n1年前查看全部
- 已知R元素的原子有四个电子层,其最高价氧化物分子式为RO3,R元素是
 赌坊917号1年前3
赌坊917号1年前3 -
 rens0jk2kj0ng 共回答了25个问题
rens0jk2kj0ng 共回答了25个问题 |采纳率88%RO3说明R为+6价 第VI族元素,四个电子层.Se硒1年前查看全部
- A,B两种化合物都是由元素R和氧元素组成的A化合物中含R元素50%B化合物中含R元素40%若A化合物的化学式为RO2B
 岫出远山1年前2
岫出远山1年前2 -
 chen陈 共回答了12个问题
chen陈 共回答了12个问题 |采纳率100%A为二氧化硫,B为三氧化硫.1年前查看全部
- 0.2mol某元素R的单质与足量的盐酸反应,在标准状况下生成6.72LH2.等量的R元素的单质与足量氧气化合,生成10.
0.2mol某元素R的单质与足量的盐酸反应,在标准状况下生成6.72LH2.等量的R元素的单质与足量氧气化合,生成10.2gR元素的最高价氧化物.求R的相对原子质量及在元素周期表中的位置.
 magicdeman1年前6
magicdeman1年前6 -
 sure44cn 共回答了17个问题
sure44cn 共回答了17个问题 |采纳率94.1%解题思路:根据电子转移的关系可知R的化合价,根据化合价可知氧化物的化学式,根据质量和物质的量可求得R的相对原子质量及在元素周期表中的位置.n(H2)=[6.72L/22.4L/mol]=0.3mol,
根据2H+
得2e−
H2,
则生成0.3molH2共需0.6mol电子,
即0.2mol金属可失去0.6mol电子,
所以金属的化合价为+3价,
氧化物的化学式为R2O3,
M(R2O3)=[10.2g/0.1mol]=102g/mol,
所以M(R)=[102−3×16/2]=27,
为Al元素,在周期表第三周期ⅢA族.
答:R的相对原子质量为27,位于周期表第三周期ⅢA族.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查元素的相对原子质量的计算,题目难度不大,注意从氧化剂、还原剂得失电子的数目关系判断元素的化合价,根据化合价正确判断氧化物的化学式为解答该题的关键.1年前查看全部
- 已知R元素的相对原子质量为96,在其氧化物中R元素与氧元素的质量比为2:1,则该氧化物的化学示为
 tomcattxd1年前4
tomcattxd1年前4 -
 andychum 共回答了20个问题
andychum 共回答了20个问题 |采纳率80%RO3
96/2=48
48/16=31年前查看全部
- 挑老师的刺:老师出作业题让同学们算:.求出R为何种元素后 已知R有一种同位素 中子数与质子数相等.我的问题是:说R元素有
挑老师的刺:
老师出作业题让同学们算:.求出R为何种元素后 已知R有一种同位素 中子数与质子数相等.
我的问题是:说R元素有一种同位素这种说法对不对 问周围人他们都说是对的 我感觉不对 火龙哥1年前1
火龙哥1年前1 -
 知识人智 共回答了26个问题
知识人智 共回答了26个问题 |采纳率100%这种说法本身就有问题,同位素是相对的,不能孤立起来说.我们可以说R有两种核素,他们互为同位素,但不可以说R有两种同位素.同位素是一个相对的概念.
不过你说的这个地方是不会命题的,同位素作为高中的四同之一,主要考察你是否了解其概念,相应的作出判断.1年前查看全部
- R的最高价含氧酸的化学式为HnRO2n-2,则R元素气态氢化物的化学式为?
R的最高价含氧酸的化学式为HnRO2n-2,则R元素气态氢化物的化学式为?
有个答案为H3n-12R,是否正确呢?求详解 雪环1年前3
雪环1年前3 -
 素心千顷 共回答了16个问题
素心千顷 共回答了16个问题 |采纳率81.3%一般讲,非金属元素的最高价与最低价的绝对值之和为8.
所以HnRO2n-2中R为 + ( 3n - 4 ) 价,则其负价就是 - [ 8 - ( 3n - 4 ) ] = - ( 12 - 3n ) 价.在气态氢化物中氢为+1价,R是负价,所以写做:H(12-3n)R(括号中的12-3n写在H元素符号的右下角).
假设n=1,则其最高价含氧酸为HR,不合理.
假设n=2,则为H2RO2,R最高价为+2价,最低价为-6价,不合理.
假设n=3,则为其最高价含氧酸为H3RO4,气态氢化物为H3R,合理.(可能是P元素等)
假设n=4,则为H4RO6,R最高价为+8价,不合理.
看到你的补充了,不能是H(3n-12)R.1年前查看全部
- 下列说法正确的是( )A. 非金属元素R所形成的含氧酸盐(NaROb)中的R元素必定呈现正价B. 只有非金属能形成含氧
下列说法正确的是( )
A. 非金属元素R所形成的含氧酸盐(NaROb)中的R元素必定呈现正价
B. 只有非金属能形成含氧酸或含氧酸盐
C. 除稀有气体外的非金属元素都能生成不同价态的含氧酸
D. 非金属的最高价含氧酸都具有强氧化性 平静19841年前4
平静19841年前4 -
 半面人 共回答了20个问题
半面人 共回答了20个问题 |采纳率95%解题思路:A.Na为+1价,R应为正价;
B.金属性较弱的金属也可形成含氧酸或含氧酸盐;
C.O、F不存在含氧酸;
D.碳酸、硅酸等不具有强氧化性.A.由化合价代数和为0可知,Na为+1价,R应为正价,故A正确;
B.金属性较弱的金属也可形成含氧酸或含氧酸盐,如铝、锰等,故B错误;
C.O、F不存在含氧酸,故C错误;
D.碳酸、硅酸等不具有强氧化性,故D错误.
故选A.点评:
本题考点: 非金属在元素周期表中的位置及其性质递变的规律.
考点点评: 本题考查元素周期律知识,为高考常见题型和高频考点,侧重于学生的分析能力和基本概念知识的综合理解和运用的考查,难度不大,注意相关基础知识的积累.1年前查看全部
- 某氢化物的分子式为R2H2氢元素的质量占7.7%R元素的原子量为( )
某氢化物的分子式为R2H2氢元素的质量占7.7%R元素的原子量为( )
A 4 B 8 C 16 D 12 星光无限00发1年前2
星光无限00发1年前2 -
 1桔梗 共回答了19个问题
1桔梗 共回答了19个问题 |采纳率84.2%设R元素的原子量为X,则:
2/(2X+1×2)= 7.7%
7.7%(2X+2)= 2
0.154X = 1.846
X ≈ 12
所以,答案是:D 121年前查看全部
- 某含氧酸的化学式为HnRO2n,其式量为M,则R元素的相对原子质量是____,酸根的化合价是____.
 知子之来之1年前1
知子之来之1年前1 -
 的老城区显 共回答了20个问题
的老城区显 共回答了20个问题 |采纳率90%氢显+1价,氧显-2价,设化合物HnRO2n中R元素化合价为x,根据化合物中各元素化合价代数和为0,则(+1)×n+x+(-2)×2n=0,解得x=+3n;
设R元素的相对原子质量为y,则1×n+y+16×2n=M,解得y=M-33n1年前查看全部
- 某元素R的原子核外最外层电子数为5个,R元素不可能形成的钠盐的化学式是()
某元素R的原子核外最外层电子数为5个,R元素不可能形成的钠盐的化学式是()
1.NARO 2.NA2RO2 3.MARO2 4.NA2RO3 5.NARO3 6MA3RO4 7.NAH2RO4 8.NA2HRO4
最好还能给个过程和判断的方法,我现在这里谢过了 igki31年前1
igki31年前1 -
 oo信息 共回答了22个问题
oo信息 共回答了22个问题 |采纳率86.4%化合价为+5或者-3
1.2.3.4.不行
5.6.7.8可以1年前查看全部
- R元素的氧化物相对分子质量 142,其中氧原子相对原子质量和 80,R原子核16粒子不带电,儿核电荷数为15 求
R元素的氧化物相对分子质量 142,其中氧原子相对原子质量和 80,R原子核16粒子不带电,儿核电荷数为15 求
2.R元素化合价 babylady111年前3
babylady111年前3 -
 贫血的蚂蚁 共回答了19个问题
贫血的蚂蚁 共回答了19个问题 |采纳率94.7%P2O5
化合价为-3,+5 ,在P2O5中显示+5价1年前查看全部
大家在问
- 1两个工程队合作一项工程,12天可以完成.两队合作3天后,甲队调走,乙队继续做15天才完成.……
- 2小明在计算时,把除数56看成了65,商17余24,正确结果是多少?
- 3求写一篇英文Email,两到三句话,记得写格式
- 420-19+18-17+16-15+14-13+12-11+10-9+8-7+6-5+4-3+2-
- 5词义转变了的英语新词汇现在有许多英语词汇,原来是这个词义,随着时代的发展,这个词有了另外的意思.可以举几个例子吗?5个以
- 6So when ordering out,we are supposed to exclude
- 7如图所示,跳伞员在降落伞打开一段时间以后,在空中做匀速运动.若跳伞员在无风时竖直匀速下落,着地速度大小是4.0m/s.当
- 8(2013•和平区一模)某初中校共有学生1200名,各年级男、女生人数如下表:
- 9你眼中苦难与幸福之间的关系
- 10α是直角三角形的一个锐角,则根号下(cos^2α-2cosα+1)的值是多少
- 11现有①四氧化三铁,②空气,③铁粉,④氯酸钾,⑤液态氧,⑥水,⑦氯化钾,⑧海水等物质,
- 1216.(共6分)利用如下图所示的装置收集以下8种气体:①H2、②C12、③CH4、④HCl、⑤NH3、⑥NO、⑦SO2
- 13已知集合A={x∈N|[12/6−x]∈N}用列举法表示集合A=______.
- 14将下列句子改为否定句We will go to the cinema this afternoon.I am from
- 15初一英语翻译:She likes hamburgers,but I don't like,I think hamburg
