硫化钠溶液和新制氯水的化学方程式
 回家坐74路公交车2022-10-04 11:39:542条回答
回家坐74路公交车2022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 非凡非凡80 共回答了21个问题
非凡非凡80 共回答了21个问题 |采纳率90.5%- Cl2+Na2S==2NaCl+S↓
- 1年前
 dgwdhjlwp 共回答了26个问题
dgwdhjlwp 共回答了26个问题 |采纳率- 新制氯水中只含Cl2和H2O分子
向硫化钠水溶液中滴加氯水:溶液变浑浊。S2-+Cl2=2Cl-+S↓. - 1年前
相关推荐
- 室温下,0.1mol/L的硫化钠溶液和0.1mol.L的碳酸钠溶液,碱性更强的是_______,其原因是________
室温下,0.1mol/L的硫化钠溶液和0.1mol.L的碳酸钠溶液,碱性更强的是_______,其原因是________。
已知:H2S:Ki1=1.3×10-7 Ki2=7.1×10-15
H2CO3:Ki1=4.3×10-7 Ki2=5.6×10-11
为什么这个用的是k2比较的 这跟电离什么关系 不解
 rbz19801年前1
rbz19801年前1 -
 秉烛上网被封 共回答了22个问题
秉烛上网被封 共回答了22个问题 |采纳率90.9%酸越弱,相应的钠盐越容易水解,溶液的碱性越强。根据电离常数可知,硫化氢的Ki2小于碳酸的Ki2,硫化钠更易水解,即硫化钠溶液的碱性更强。
都是二元酸,这里是比较二元的酸的电离,而不是HS-和HCO3-哈。1年前查看全部
- 硫酸铁中加入过量硫化钠溶液的离子方程式
 vivianq1年前1
vivianq1年前1 -
 梦幻般mm 共回答了22个问题
梦幻般mm 共回答了22个问题 |采纳率77.3%2Fe3++3S2-=2FeS(黑色沉淀)+2S(黄色或白色沉淀)1年前查看全部
- 0.1mol/L硫化钠水溶液怎么配
 a13you1年前2
a13you1年前2 -
 东冲 共回答了26个问题
东冲 共回答了26个问题 |采纳率88.5%用天平量取0.78克硫化钠,在小烧杯中用少量水溶解,移入100毫升容量瓶中,加水至刻度即可.(为防止水解可以加入少量氢氧化钠)1年前查看全部
- 氯化银转化成硫化银是否可逆氯化银中滴加硫化钠,氯化银转化为硫化银.这个反应是可逆的吗?(作业上面打了可逆符号,我也不知道
氯化银转化成硫化银是否可逆
氯化银中滴加硫化钠,氯化银转化为硫化银.这个反应是可逆的吗?(作业上面打了可逆符号,我也不知道是不是错了) reena0091年前3
reena0091年前3 -
 jornathan 共回答了27个问题
jornathan 共回答了27个问题 |采纳率96.3%可逆符号只是代表这个反应可以向逆向发生,当溶液中NaCl浓度极大时,Ag2S是有可能转化AgCl的.我想,题目应该是考虑 到了这个反应,才用的可逆符号的.
满意请采纳(手机版点“满意”即可)1年前查看全部
- 硫化钠溶液与氯化铁溶液反应离子方程式是什么?2氯离子+3硫离子=Fe2S3 请问哪里错了?
 最喜欢阳春三月1年前1
最喜欢阳春三月1年前1 -
 zpc533 共回答了19个问题
zpc533 共回答了19个问题 |采纳率89.5%应该说Fe3+可以氧化S2-,先考虑2Fe3+ + S2- =======S(沉淀)+2Fe2+
但是也会有Fe2S3沉淀的存在.
一般说来,Fe3+具有较强的氧化性,而S2-则具有还原性,因此当Fe3+与S2-相遇时,Fe3+能将S2-氧化成S,而自身被还原为Fe2+,即发生反应:
2Fe3++S2-=2Fe2++S↓
Fe3+在酸性条件下,其氧化性要比在碱性条件下强.在FeCl3溶液中加入Na2S,此时Fe3+过量,溶液呈酸性.因此,应发生上述反应.但如果反过来,将FeCl3加入Na2S溶液,Na2S过量,溶液呈碱性,此时Fe3+氧化性减弱.Fe3+和S2-会结合成溶解度极小的Fe2S3沉淀,即:
2Fe3++3S2-=Fe2S3↓
总之哪个过量对反应也是有影响的,因为FeCl3酸性,而Na2S是碱性的1年前查看全部
- 硫化钠固体加入含有氯化铜、氯化镍的盐酸溶液中的反应顺序及生成物.就这么多分了,
 lnqwe1年前2
lnqwe1年前2 -
 qxl1124 共回答了17个问题
qxl1124 共回答了17个问题 |采纳率82.4%硫化钠固体加入含有氯化铜、氯化镍的盐酸溶液中的反应顺序及生成物
1.先是硫化钠和盐酸作用生产硫化氢,强酸至弱酸
2 然后和氯化铜作用生成硫化铜沉淀
3 再和氯化镍反应生成硫化镍1年前查看全部
- 用硫化钠溶液加入到硫酸铝中将得到什么产物
 lanqianwei371年前1
lanqianwei371年前1 -
 1221326358 共回答了14个问题
1221326358 共回答了14个问题 |采纳率85.7%双水解.硫酸钠,氢氧化铝,硫化氢1年前查看全部
- 等浓度等体积等温度的硫酸钠,硫化钠,是什么亚硫酸氢钠所含带电微粒的数目从多到少的顺序
 tengpray1年前1
tengpray1年前1 -
 yaxiaxia 共回答了18个问题
yaxiaxia 共回答了18个问题 |采纳率88.9%Na2SO4 Na2S NaHSO3
不考虑水解
1个 Na2SO4 有 3个离子 2个Na+ 和1个SO42-
Na2S 有 3个离子 2个Na+ 和1个S2-
NaHSO3 有 2个离子 1个Na+ 和1个 HSO3-
因此 NaHSO3 的离子数是最小的
而S2- +H2O===可逆===HS- +OH- 增加了一个离子
因此 Na2S离子数比Na2SO4 多
从多到小 Na2S >Na2SO4 >NaHSO31年前查看全部
- 如何用硫化钠制亚硫酸钡而且要一步反应
 aa也有HLL的背1年前4
aa也有HLL的背1年前4 -
 冷箭心 共回答了22个问题
冷箭心 共回答了22个问题 |采纳率81.8%钡盐加入亚硫酸钠溶液中加热反应,生成沉淀、过滤,干燥制得.
亦可用二氧化硫气通入氢氧化钡溶液中进行中和反应,生成沉淀,过滤,干燥制得1年前查看全部
- 硫化铵,硫化钠,硫化钾,硫化钙,请排列还原性由高至低,排列水溶液中稳定性由高至低.
 形式桔子1年前1
形式桔子1年前1 -
 278348705 共回答了23个问题
278348705 共回答了23个问题 |采纳率78.3%还原性:(NH4)2S=Na2S=K2S>CaS
稳定性:都挺稳定的,不会分解……如果你是问溶液的碱性强弱,那么:
Na2S=K2S>(NH4)2S>CaS
如果你问的是水解的程度,那么:
(NH4)2S>CaS>Na2S=K2S
我解释一下,碱性Na2S和K2S最强,是因为NH4+结合了S2-水解生成的OH-,而CaS的溶解度太小,使得微量的S2-水解的OH-浓度很小.
而水解的程度,因为(NH4)2S中阴阳离子都要水解,会相互促进,所以其水解程度最大;而CaS由于溶解度小,溶液中S2-的浓度很低,所以水解程度比Na2S和K2S高.1年前查看全部
- 1L 0.15mol/L的硫化钠溶液中通入1.12L硫化氢则混合溶液中各离子浓度大小关系是?
 zzh0081年前2
zzh0081年前2 -
 PrivateEyes 共回答了20个问题
PrivateEyes 共回答了20个问题 |采纳率95%首先标准状况下1.12L物质的量为0.05mol,所以Na2S+H2S=2NaHS,所以NaHS物质的量为0.1mol,硫化钠也是0.1mol,又因为NaHS水解大于电离,又同浓度硫化钠的碱性强于NaHS,所以硫离子水解强于氢硫酸根,所以浓度关系是c(Na+)>c(HS-)>c(S2-)>c(OH-)>c(H+)1年前查看全部
- 用硫化钠去除废水中的Hg2+的离子方程式是Hg2+ + S2- = HgS
用硫化钠去除废水中的Hg2+的离子方程式是Hg2+ + S2- = HgS
用硫化钠去除废水中的Hg2+的离子方程式是Hg2+ + S2- = HgS↓ 为什么NaS可以拆开?硫化物都可以拆开吗? lingmei10851年前1
lingmei10851年前1 -
 lulili5555 共回答了19个问题
lulili5555 共回答了19个问题 |采纳率100%氧化物都不能拆
硫化物,除了Na2S、K2S、(NH4)2S等能溶于水的要拆开,其他都难溶于水,不能拆
这个反应中,硫化钠属于可溶性的盐,所以要拆;HgS难溶于水,不能拆1年前查看全部
- 硫化钠与亚硫酸钠的混合液中加硫酸可能的反应原理?..
 ysmjl1年前1
ysmjl1年前1 -
 爱情永久么 共回答了21个问题
爱情永久么 共回答了21个问题 |采纳率85.7%2Na2S+Na2SO3+3H2SO4=3Na2SO4+3S↓+3H2O1年前查看全部
- PH:12的硫化钠溶液如何中和为PH7
 minyzou1年前2
minyzou1年前2 -
 sdh0919 共回答了26个问题
sdh0919 共回答了26个问题 |采纳率84.6%通入硫化氢到PH等于7就是了.1年前查看全部
- (1)用化学符号填空(1)氩气______ (2)二个钙离子______ (3)氯化镁______ (4)硫化钠____
(1)用化学符号填空
(1)氩气______ (2)二个钙离子______ (3)氯化镁______ (4)硫化钠______ (5)地壳中含量最高的金属元素和非金属元素形成的化合物______ (6)O2-(Ps:2-在右上角)上面数字2的意义______ (7)氯化铁______ bird20061年前0
bird20061年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 硫化钠溶于水的离子方程式是什么?
硫化钠溶于水的离子方程式是什么?
不要跟我拽什么词
S2-+2H2O==H2S+2OH-
不对的话怎么是对的? 凭栏山水寒1年前2
凭栏山水寒1年前2 -
 qooooo 共回答了14个问题
qooooo 共回答了14个问题 |采纳率92.9%硫化钠溶于水先发生电离反应
生成钠离子和硫离子
Na2S =2Na+ + S2-
之后S2-离子发生水解反应
S2-+H2O==HS=+OH-
HS-+H2O==H2S+OH-1年前查看全部
- 亚硫酸钠和硫化钠溶水后被稀硫酸酸化
亚硫酸钠和硫化钠溶水后被稀硫酸酸化
悬赏50分.
将xmol亚硫酸钠和 ymol硫化钠溶于水后,再加入稀硫酸酸化,其产物可能有3种情况.
1.生成物只有单质硫,硫酸钠和水.
2.生成物为二氧化硫,单质硫,硫酸钠和水.
3生成物为硫化氢,单质硫,硫酸钠和水.
请问这3种情况是怎么来的? 暗夜狂放1年前1
暗夜狂放1年前1 -
 干扰来源 共回答了20个问题
干扰来源 共回答了20个问题 |采纳率75%首先:你要明白
Na2SO3+H2SO4=Na2SO4+SO2+H2O(1)
Na2S+H2SO4=Na2SO4+H2S(2)
SO2+2H2S=3S+2H2O(3)
故:Na2SO3(SO2)---2Na2S(H2S)---3S
当:n(Na2SO3)=x,n(Na2S)=y
(1)x:y=1:2时,即y=2x时,仅生成单质硫,硫酸钠和水.
(2)x:y>1:2时,即y1年前查看全部
- 溴化碘与硫化钠的离子方程式
 sapphire211年前1
sapphire211年前1 -
 yya1 共回答了20个问题
yya1 共回答了20个问题 |采纳率85%IBr + S2- -----> S + I- + Br-1年前查看全部
- 硫化钠、亚硫酸钠混合溶液中滴加稀盐酸的方程式?
 yearnJJ1年前1
yearnJJ1年前1 -
 yinyuetingting 共回答了16个问题
yinyuetingting 共回答了16个问题 |采纳率87.5%Na2SO3+2Na2S+6HCl==3S沉淀+6NaCl+3H2O1年前查看全部
- 氯化铁与过量硫化钠反应的方程式是2Na2S+2FeCl3=4NaCl+FeCl2+S+FeS还是
氯化铁与过量硫化钠反应的方程式是2Na2S+2FeCl3=4NaCl+FeCl2+S+FeS还是
3Na2S+2FeCl3=6NaCl+Fe2S3,原理是什么? bobking1971年前1
bobking1971年前1 -
 3176521 共回答了18个问题
3176521 共回答了18个问题 |采纳率83.3%第一个,正3价的铁离子有氧化作用,而负二价的硫离子有还原作用,二者会发生氧化还原反应.1年前查看全部
- 2.某无色溶液可能含有下列钠盐中的几种:(A)氯化钠,(B)硫化钠,(C)亚硫酸钠,(D)硫酸钠,(
2.某无色溶液可能含有下列钠盐中的几种:(A)氯化钠,(B)硫化钠,(C)亚硫酸钠,(D)硫酸钠,(
E 硫酸钠 F.碳酸钠
向此溶液中加入适量稀硫酸,有浅黄色沉淀析出,同时有气体产生.此气体有臭鸡蛋气味,可使澄清的石灰水变浑浊,不能使品红试液褪色.根据上述实验现象回答下列问题:(1)不能使品红试液褪色,说明该气体中不含?(2)此无色溶液存在的钠盐是? 烈日阳光1年前6
烈日阳光1年前6 -
 df919 共回答了14个问题
df919 共回答了14个问题 |采纳率85.7%首先说下.D、E两个,肿么都是硫酸钠?应该有一个是硝酸钠吧?
(1)不能使品红褪色,则没有SO2,说明溶液中没有SO32-
(2)一定存在的钠盐为Na2S、NaNO3、Na2CO3
浅黄色沉淀析出:
3Na2S + 2NaNO3 + 8HCl ==== 8NaCl + 3S(沉淀) + 4H2O + 2NO(气体)
臭鸡蛋气味:
Na2S + 2HCl ==== 2NaCl + H2S(气体)
石灰水浑浊:
Na2CO3 + 2HCl ====2NaCl + H2O + CO2(气体)
CO2 + Ca(OH)2 ===CaCO3(沉淀) + H2O
p.s.亚硫酸钠可以和硫化钠反应生成S单质浅黄色沉淀,但因题中已经说了,不能使品红褪色,说明溶液中不含有SO32-,说明这个反应应该是不存在的.
再p.s.D、E均是Na2SO4,你看看题中是怎么写的?我觉得可能是NaNO3
但如果是别的什么,可能解题过程会有新变化,所以.如果认为回答有误的话,赶紧告诉我~1年前查看全部
- 如果在含锌和铅的碱性溶液里加入过量的硫化钠会有什么反应呢,
如果在含锌和铅的碱性溶液里加入过量的硫化钠会有什么反应呢,
在含铅和锌的碱性溶液里加入硫化钠沉淀的白色物是什么?
我加入的是硫化钠怎么会是硫酸铅呢,如果是硫化铅的话,那应该是黑色呢 了. 25053421年前1
25053421年前1 -
 jb4652 共回答了12个问题
jb4652 共回答了12个问题 |采纳率100%好吧,我看错了~sorry~
因为溶液碱性,生成的硫化铅,的确应该是黑色的,但沉淀在碱性溶液里立刻就被空气氧化为氢氧化铅Pb(OH)4(白色)了,因为氢氧化铅的溶度积小于硫化铅的溶度积,并且正4价的铅比正2价的铅更稳定.正2价的铅在溶液中可以存在(久了也会变质),但一旦转化为沉淀就很不稳定了.但是在碱性溶液里不是被氧化为PbS2,而是Pb(OH)4,因为Pb(OH)4比PbS2更难溶.所以白色物是氢氧化铅Pb(OH)4.1年前查看全部
- 我想用硫单质和氢氧化钠溶液(或氢氧化钾溶液)反应制备含结晶水的硫化钠(或硫化钾),请问1.两种物料配比为多少?
我想用硫单质和氢氧化钠溶液(或氢氧化钾溶液)反应制备含结晶水的硫化钠(或硫化钾),请问1.两种物料配比为多少?
2.实验操作时应注意什么?有什么危险性?我这里有防毒面具、橡胶手套、和护眼罩。
3.如何避免副产物的产生?
4.生成的硫化物和亚硫酸盐怎么用溶解度的知识分离,求具体操作。
本人高二学生,喜欢做化学实验和电学实验已多年了,请多多指教。
 海口人鱼精1年前2
海口人鱼精1年前2 -
 phhz32 共回答了22个问题
phhz32 共回答了22个问题 |采纳率81.8%不会,我初三都没毕业呢1年前查看全部
- 帮忙写几个化学反应的离子式1金属铝溶于盐酸2硫化钠溶于水3碳酸镁溶于硝酸4向废水中滴加饱和的FeCl3溶液制备Fe(OH
帮忙写几个化学反应的离子式
1金属铝溶于盐酸
2硫化钠溶于水
3碳酸镁溶于硝酸
4向废水中滴加饱和的FeCl3溶液制备Fe(OH)3胶体
5用小苏打治疗胃酸过多
6实验室用HCl(浓)与MnO2制Cl2
7用FeCL3溶液腐蚀印刷电路板
8用碳酸钠溶液吸收!少量!SO2 我在这里守侯1年前4
我在这里守侯1年前4 -
 喧嚣的尘埃 共回答了21个问题
喧嚣的尘埃 共回答了21个问题 |采纳率85.7%1.
2Al + 6H+ == 2Al3+ + 3H2(气体)
2.
S2- + H2O HS- + OH-
3.
MgCO3 + 2H+ == Mg2+ + H2O + CO2(气体)
4.
Fe3+ + 3Cl- + 3H2O ==(煮沸)== Fe(OH)3(胶体) + 3HCl(气体)
5.
HCO3- + H+ == H2O + CO2(气体)
6.
4H+ + 2Cl- + MnO2 ==(加热)== Mn2+ + Cl2(气体) + 2H2O
7.
Cu + 2Fe3+ == Cu2+ + 2Fe2+
8.
SO2 + CO32- == SO32- + CO21年前查看全部
- 请问,硫化铵和硫化钠,哪个溶于水中更加稳定?
请问,硫化铵和硫化钠,哪个溶于水中更加稳定?
这两种物质的低浓度水溶液能够长期保存吗? 涩靓脚裤1年前2
涩靓脚裤1年前2 -
 曾经心痛已成尘 共回答了17个问题
曾经心痛已成尘 共回答了17个问题 |采纳率100%硫化钠更稳定.因为硫化铵在水溶液中发生双水解反应,生成硫化氢和一水合氨,一水合氨会分解出氨,因此当浓度大是就直接有硫化氢气体和氨气生成.
硫化钠当然可以,因为它是固体,溶于水也不会蒸发或挥发.硫化铵不可以,因为它虽然不会挥发或蒸发,但它水解后的产物在常温下是气体,会挥发.1年前查看全部
- 硫化钠与硫化氢反应的化学方程式
 41276421年前3
41276421年前3 -
 caoguoyu 共回答了14个问题
caoguoyu 共回答了14个问题 |采纳率100%弱酸的正盐与该酸反应,生成酸式盐:Na2S+H2S=2NaHS1年前查看全部
- 请问,多硫化钠的还原性比硫化钠要强吗?
 flyingsunflower1年前1
flyingsunflower1年前1 -
 yueye820526 共回答了14个问题
yueye820526 共回答了14个问题 |采纳率71.4%Na2Sx和Na2S,硫的化合价分别是-2/x价和-2价.而多硫化钠反应后很容易生成硫单质,所以多硫化钠的还原性强一些.1年前查看全部
- 过氧化纳与硫化钠溶液反应生成了什么?
过氧化纳与硫化钠溶液反应生成了什么?
要化学方程式和离子方程式. 无味的咸菜1年前1
无味的咸菜1年前1 -
 区域经济67 共回答了16个问题
区域经济67 共回答了16个问题 |采纳率93.8%Na2O2+Na2s+2H2O==4NaOH+S(沉淀) Na2O2+s2-==4OH*+s(沉淀)1年前查看全部
- 硫化钠水解的离子方程式
 fly_不ee鸟1年前4
fly_不ee鸟1年前4 -
 风儿轻轻000 共回答了22个问题
风儿轻轻000 共回答了22个问题 |采纳率90.9%楼上的废话怎么那么多?!
人家要离子方程式,你给人家化学方程式,真晕.
一楼的也不对,二元离子要分步水解,正确的是:S2- + H2O = HS- + OH- .
绝对对.1年前查看全部
- 能使甲基橙呈红色的溶液指含什么离子.硫化钠溶液中能否使硫酸根离子钾离子氯离子铜离子共存
 冷面兰心1年前2
冷面兰心1年前2 -
 天空永远的灰 共回答了25个问题
天空永远的灰 共回答了25个问题 |采纳率88%甲基橙是酸碱指示剂 ,变红则是酸性溶液,即H+离子使得它变红
Na2S中S2-不和Cu2+共存,因为 S2- +Cu2+===CuS 黑色沉淀1年前查看全部
- 将亚硫酸钠与硫化钠的混合物若干克配成50克溶液,
将亚硫酸钠与硫化钠的混合物若干克配成50克溶液,
加入50克一定浓度足量的盐酸,放出气体0.448L(标况)混合液96.9克.求混合物中亚硫酸钠和硫化钠的物质的量各为? 集体去wwww1年前1
集体去wwww1年前1 -
 故事里的人007 共回答了22个问题
故事里的人007 共回答了22个问题 |采纳率81.8%因为Na2SO3+2HCl=2NaCl+SO2↑+H2O ① ,
Na2S+2HCl=2NaCl+H2S↑②,
SO2+2H2S=3S↓+2H2O ,
因此,放出的气体是SO2或H2S.
根据质量守恒定律可知,m(S)+m(气体)=(50g+50g)-96.9g=3.1g,
(1)当放出的气体是SO2时,n1(SO2)=0.448L/(22.4L/mol)=0.02mol,
则m1(SO2)=0.02mol*64g/mol=1.28g,
所以m(S)=3.1g-1.28g=1.82g,
SO2 + 2H2S = 3S↓ + 2H2O
1mol~2mol~3*32g
n2(SO2)~n(H2S)~1.82g
列比例式解得:n2(SO2)=0.019mol,n(H2S)=0.038mol
故n(SO2)=n1(SO2)+n2(SO2)=0.039mol
根据化学方程式①知,n(Na2SO3)=n(SO2)=0.039mol,
根据化学方程式②知,n(Na2S)=n(H2S)=0.038mol.
(2)当放出的气体是H2S时,n1(H2S)=0.448L/(22.4L/mol)=0.02mol,
则m1(H2S)=0.02mol*34g/mol=0.68g,
所以m(S)=3.1g-0.68g=2.42g,
SO2 + 2H2S = 3S↓ + 2H2O
1mol~2mol~3*32g
n(SO2)~n2(H2S)~2.42g
列比例式解得:n(SO2)=0.0252mol,n2(H2S)=0.0504mol
故n(H2S)=n1(H2S)+n2(H2S)=0.0704mol
根据化学方程式①知,n(Na2SO3)=n(SO2)=0.0252mol,
根据化学方程式②知,n(Na2S)=n(H2S)=0.0704mol.
答:混合物中亚硫酸钠与硫化钠的物质的量为0.039mol、0.038mol,或混合物中亚硫酸钠与硫化钠的物质的量为0.0252mol、0.0704mol.1年前查看全部
- 1%硫化钠水溶液密封避光能长期保存吗?加入硫代硫酸钠或亚硫酸钠能够维持其水溶液的稳定性吗?
 xiaoran1701年前2
xiaoran1701年前2 -
 星期啊就一 共回答了19个问题
星期啊就一 共回答了19个问题 |采纳率89.5%硫化钠具有还原性,长期密闭保存应该问题不大,如果加入硫代硫酸钠,或亚硫酸钠,都是还原剂,不知对你最终用途是否有影响.1年前查看全部
- 在氯化铁中加入硫化钠.化学方程式.
在氯化铁中加入硫化钠.化学方程式.
已知Fe 3+ 具有较强的氧化性,而S 2- 具有一定的还原性.向氯化铁溶液中,逐滴加入硫化钠溶液,出现的实验现象:先是溶液中出现白色(或淡黄色、或乳白色)浑浊,后出现黑色浑浊.
化学方程式:____________
离子方程式:____________ ljfljy1年前4
ljfljy1年前4 -
 快乐着你的快乐1 共回答了17个问题
快乐着你的快乐1 共回答了17个问题 |采纳率76.5%既然题目说了,Fe3+有氧化性,S2-有还原性,首先考虑可能的产物,Fe3+被还原为Fe2+,S2-被氧化为S沉淀(题目中的淡黄色或乳白色沉淀);然后思考后来出现的黑色浑浊可能是啥,推测可能是FeS.
写方程式相对就简单了:
2Fe3+ + S2- = 2Fe2+ + S↓,Fe2+ + S2- = FeS↓.
2FeCl3 + Na2S = 2FeCl2 + 2NaCl + S↓,FeCl2 + Na2S = FeS↓ + 2NaCl.1年前查看全部
- 硫化钠和亚硫酸钠为什么要共存?硫离子不是负二价,而亚硫酸钠中硫又是正四价,两者应该发生归中反应,生成硫单质吗?为什么它们
硫化钠和亚硫酸钠为什么要共存?
硫离子不是负二价,而亚硫酸钠中硫又是正四价,两者应该发生归中反应,生成硫单质吗?为什么它们不反应,而要共存呢?
但是为什么必须要在酸性条件下才可以呢?
那么,硫化氢和亚硫酸钠共存吗? nkkn20001年前2
nkkn20001年前2 -
 shi0897 共回答了18个问题
shi0897 共回答了18个问题 |采纳率88.9%四价硫只有在酸性条件下才有氧化性,能斯特方程是大学中学到的,见无机化学,硫化氢和亚硫酸钠能反应生成S沉淀,硫化氢电离出H离子,使溶液成酸性1年前查看全部
- 在1升0.01mol/L铅离子溶液中加入0.050molEDTA及0.001mol硫化钠,此溶液能否有PbS沉淀生成
 slslb1年前2
slslb1年前2 -
 西域狂人 共回答了19个问题
西域狂人 共回答了19个问题 |采纳率84.2%查下EDTA-Pb的K稳和PbS的Ksp一算就成了~1年前查看全部
- (10分)某无色溶液可能含有下列钠盐中的几种: A.氯化钠 B.硫化钠 C.亚硫酸钠 D.硫代硫酸钠 (E)硫酸钠 (F
(10分)某无色溶液可能含有下列钠盐中的几种:
Na 2 S 2 O 3 +H 2 SO 4 ="==" Na 2 SO 4 +SO 2 ↑+S↓+H 2 O)A.氯化钠 B.硫化钠 C.亚硫酸钠 D.硫代硫酸钠 (E)硫酸钠 (F)碳酸钠.向此溶液中加入适量稀硫酸,有浅黄色的沉淀析出,同时有气体产生.此气体有臭鸡蛋气味,可使澄清的石灰水变浑浊,不能使品红试液褪色。(已知:硫代硫酸钠的化学式为Na 2 S 2 O 3 , 硫代硫酸钠与稀硫酸的反应式为:
根据上述实验现象回答下列问题
(1)不能使品红试液褪色,说明该气体中不含____________(填分子式).[来源:Z|xx|k.Com]
(2)此无色溶液中至少可能存在哪几种钠盐?请写出全部可能的情况(填写相应的字母).
第一种情况是______ ______,第二种情况是____ ________,第三种情况是_________ ___,第四种情况是______ ______.
(可不填满,也可补充) halfgood1年前1
halfgood1年前1 -
 exotiq 共回答了21个问题
exotiq 共回答了21个问题 |采纳率90.5%(10分)(每空2分)
(1)SO 2
(2)B C F BDF BCDF (填出三种情况给满分)
略1年前查看全部
- 1.下列离子方程式为什么错了?正确的写法是?硫化钠溶液呈酸性:S2- + H2O==HS- + OH-硫酸铜溶液呈酸性:
1.
下列离子方程式为什么错了?正确的写法是?
硫化钠溶液呈酸性:S2- + H2O==HS- + OH-
硫酸铜溶液呈酸性:Cu2+ + 2H2O==(可逆符号) Cu(OH)2(沉淀符号)+2H+
2.
将可溶性淀粉溶于热水制成的淀粉溶液,该溶液可能不具有的性质是
A.电泳
B.布朗运动
C.聚沉
D.显色反应
A 该溶液不是胶体吗?电泳不是胶体的性质吗?还有为什么会发生聚沉和显色反应呢?
3.
在t℃温度时,饱和的氢氧化镁溶液的pH为11(设溶液密度为1g/cm,Kw=1*10^-14),它的溶解度为
A.5*10^-4g
B.2.9*10^-3g
C.1.45*10^-3g
D.5.8*10^-2g
4.
摩尔质量为ag/mol的某物质在室温下的溶解度为bg,此时测得饱和溶液的密度为cg/mol.则该饱和溶液的物质的量浓度为
A.1000bc/a(100+b) mol/L
B.a/10bc mol/L
C.a(100+b)/1000bc mol/L
D.10bc/a mol/L 蝴蝶忘川1年前1
蝴蝶忘川1年前1 -
 xsyocr 共回答了10个问题
xsyocr 共回答了10个问题 |采纳率70%1.硫化钠显酸性是因为硫离子水解,水解方程式要用可逆号
硫酸铜显酸性也是因为水解,但水解反应一般程度都非常地小,所以生成的难溶物质一般不用沉淀符号,同样气体也不用
2.可溶性淀粉溶于热水制成淀粉胶体,应具有胶体的性质,但胶体中的分散质为高分子化合物的单个分子,不带有电荷,因而无电泳现象.
淀粉溶液中加碘化钾溶液,加入碘化钾就是加入电解质,所以发生聚沉
显色的话加入碘单质就能看到了
3.假设有1L这样的溶液
n(OH-)=1*10^-11/1*10^-14=1*10^-3 mol
那么n(Mg2+)=0.5n(OH-)=5*10^-4 mol
m(Mg(OH)2)=(5*10^-4)*(58)=2.9*10^-2 g
则Mg(OH)2溶解度为 (2.9*10^-2/(1000-2.9*10^-2))*100 约等于 2.9*10^-3
4溶液密度打错了吧,是cg/ml
假设溶液中有100g水,那么就有bg溶质
总质量 b+100 g
那么溶液体积V=(b+100)/c ml
而溶质的物质的量n= b/a mol
那么溶质的物质的量浓度 c=n/(V/1000)= 1000(b/a)/ ((b+100)/c)=1000bc/a(100+b) mol/L1年前查看全部
- 下列物质中能与H2S反应,但不能与氯水反应的是:A氯化铁溶液 B二氧化硫饱和溶液 C硫化钠饱和溶液 D 氯化亚铁溶液
 无心出岫20071年前2
无心出岫20071年前2 -
 leiwo 共回答了14个问题
leiwo 共回答了14个问题 |采纳率71.4%楼上说的有问题,A氯化铁铁显+3价,有一定氧化性,硫化氢中的硫为-2价可被氧化成S单质,但+3并非铁最高价,Na2FeO4中的铁就显+6价,只是氯水氧化性没有+6价的铁强,无法将Fe3+氧化到+6价1年前查看全部
- 硫化钠和浓硫酸、稀硫酸反应的方程式分别怎么写
 枉自称侠若许年1年前1
枉自称侠若许年1年前1 -
 大海中的一滴水0 共回答了14个问题
大海中的一滴水0 共回答了14个问题 |采纳率85.7%Na2S + 5 H2SO4(浓)H2S(气体) + Na2SO41年前查看全部
- 由碳酸钠、硫酸钠和硫化钠(Na2S)组成的混合物中,氧元素的质量分数为22%,则钠元素的质量分数为?
由碳酸钠、硫酸钠和硫化钠(Na2S)组成的混合物中,氧元素的质量分数为22%,则钠元素的质量分数为?
答案:46%
求过程
这个题我会了。请回答这个问题:
在天平两边各放一个盛有36.5g质量分数为20%的盐酸的烧杯。现将一定量的两种物质分别放入烧杯中,反应恰好完全,此时天平仍保持平衡,则加入的物质可能是
MgO和MgCO3
为什么 amigg1年前1
amigg1年前1 -
 小乖1111 共回答了13个问题
小乖1111 共回答了13个问题 |采纳率100%MgCO3 + 2HCl = MgCl2 + H2O + CO2气体
注意,生成的CO2逸出,相当于溶液的增重就是MgO
即40g的MgO相当于84g的MgCO31年前查看全部
- 硫化钠溶液通入硫化氢中反应的离子方程式是什么?
 王越0241年前1
王越0241年前1 -
 6814785 共回答了17个问题
6814785 共回答了17个问题 |采纳率88.2%S2- +H2S=HS-1年前查看全部
- 0.1mol∕L硫化钠溶液中各离子浓度大小关系
 麟山玄妙堂1年前2
麟山玄妙堂1年前2 -
 那夜花谢 共回答了16个问题
那夜花谢 共回答了16个问题 |采纳率81.3%S2-会水解
S2- + H2O HS- + OH-
HS- + H2O H2S + OH-
S2-两步水解,使得溶液显碱性,故c(OH-)>c(H+)
但由于水解是微弱的,且第一步水解程度大于第二步水解,故c(S2-)>c(HS-),且由方程式看出,两步都产生了OH-,故c(OH-)>c(HS-),Na+始终未放生变化.
故c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)1年前查看全部
- 沉淀溶解平衡的问题2滴0.1mol/L的硫化钠,5滴0.1mol/L的铬酸钾,混合后稀释至5mL,再加入2滴0.1mol
沉淀溶解平衡的问题
2滴0.1mol/L的硫化钠,5滴0.1mol/L的铬酸钾,混合后稀释至5mL,再加入2滴0.1mol/L硝酸铅溶液,观察首先生成黄色沉淀还是黑色沉淀?离心沉降后向清液中加2滴0.1mol/L硝酸铅溶液,会出现什么沉淀?
我的问题是,实验的时候我看到先生成的是黄色沉淀,后来清液中生成的也是黄色的.但是硫化铅的沉淀溶解系数小于铬酸铅的,为什么先生成铬酸铅?是我看错了?后来清液中的铬酸铅是怎么生成的. bud021年前1
bud021年前1 -
 784562560 共回答了19个问题
784562560 共回答了19个问题 |采纳率94.7%(Ag2CrO4),但实际上KCl溶液中产生沉淀时c(Ag+) 要远小于Ag2CrO4中银离子的浓度,因此KCl溶液中先有沉淀.这类题目不能光看Ksp,还要注意盐的形式 AB1年前查看全部
- 请问把含量60的硫化钠固体碱片配制成质量百分比为17%的溶液要加多少水,有蒸汽加温
 烟雨迢迢1年前1
烟雨迢迢1年前1 -
 yzjxf 共回答了19个问题
yzjxf 共回答了19个问题 |采纳率94.7%是质量分数60% 吧,杂质可溶于水不,还有,固体的质量没有说 假定杂质溶于水 ,固体质量为A A*60% = (X+A)*17% X=2.53A1年前查看全部
- 【化学--选修2:化学与技术】Ⅰ.硫化钠主要用于皮革、毛纺、高档纸张、染料等行业.生产硫化钠大多采用
【化学--选修2:化学与技术】Ⅰ.硫化钠主要用于皮革、毛纺、高档纸张、染料等行业.生产硫化钠大多采用
【化学--选修2:化学与技术】
Ⅰ.硫化钠主要用于皮革、毛纺、高档纸张、染料等行业.生产硫化钠大多采用无水芒硝(Na2SO4)-炭粉还原法,其流程示意图如图1所示: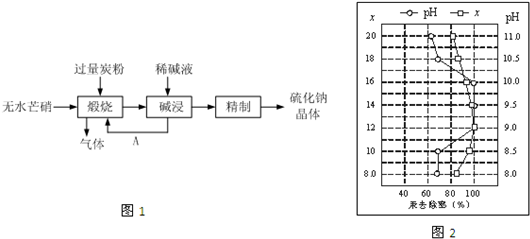
(1)上述流程中若煅烧所得气体为等物质的量的CO和CO2,写出煅烧时发生的总的化学反应方程式为3Na2SO4+8C
3Na2S+4CO2↑+4CO↑高温 .3Na2SO4+8C.
3Na2S+4CO2↑+4CO↑高温 .
(2)上述流程中采用稀碱液比用热水更好,理由是______.
(3)皮革工业废水中的汞常用硫化钠除去,汞的去除率与溶液的pH和x(x 代表硫化钠的实际用量与理论用量的比值)有关(如图2所示).为使除汞效果最佳,应控制的条件是______、______.
(4)取硫化钠晶体(含少量NaOH)加入到硫酸铜溶液中,充分搅拌.若反应后测得溶液的pH=4,则此时溶液中c( S2-)=______.(保留两位有效数字)(已知:常温时CuS、Cu(OH)2的Ksp分别为8.8×10-36、2.2×10-20)
Ⅱ.纳米氧化亚铜(Cu2O)是一种用途广泛的光电材料,常用的制备方法有电化学法、湿化学法等.
其中电化学法可用铜棒和石墨作电极,电解Cu(NO3)2稀溶液制备.
(5)电化学法制备Cu2O时,铜棒做______极,阴极生成Cu2O的电极反应式为______.
 青青果香1年前1
青青果香1年前1 -
 shalerbi1 共回答了22个问题
shalerbi1 共回答了22个问题 |采纳率95.5%制备硫化钠晶体的流程为:无水芒硝(Na2SO4)与碳在高温煅烧反应:3Na2SO4+8C
高温
.
3Na2S+4CO2↑+4CO↑,由于硫离子水解,则用稀碱溶液浸泡煅烧产物得硫化钠溶液,通过精制获得硫化钠晶体,
(1)根据题干信息,硫酸钠与碳反应生成等物质的量的CO和CO2,C元素化合价从0价被氧化成+4、+2价,化合价升高至少为:(4-0)+(2-0)=6,硫酸钠中+6价S元素被还原为-2价,化合价降低了8价,则化合价变化的最小公倍数为24,则硫酸钠的系数为3,一氧化碳、二氧化碳的系数为4,然后根据质量守恒定律配平,配平后的化学方程式为:3Na2SO4+8C
高温
.
3Na2S+4CO2↑+4CO↑,
故答案为:3Na2SO4+8C
高温
.
3Na2S+4CO2↑+4CO↑;
(2)上述流程中采用稀碱液比用热水更好,硫化钠溶液中硫离子水解显碱性,水解过程是吸热反应,加热促进水解进行,稀碱溶液能起到抑制水解的作用,
故答案为:热水会促进Na2S水解,而稀碱液能抑制Na2S水解;
(3)依据图象中曲线分析,汞去除率最佳PH和x的取值是x=12 pH介于9~10之间时汞的去除率最大,接近100%,
故答案为:x=12; pH介于9~10之间;
(4)取硫化钠晶体(含少量NaOH)加入到硫酸铜溶液中,充分搅拌,若反应后测得溶液的pH=4,c(OH-)=10-10mol/L,
常温时CuS、Cu(OH)2的Ksp分别为8.8×10-36、2.2×10-20,
根据氢氧化铜的溶度积可得:Ksp=c(Cu2+)×c2(OH-)=2.2×10-20,解得:c(Cu2+)=
2.2×10?20
(10?10)2mol/L=2.2mol/L,
根据硫化铜的溶度积可得:Ksp=c(Cu2+)c(S2-)=8.8×10-36,
则此时溶液中c( S2-)=
8.8×10?36
2.2mol/L=4.0×10-36mol/L,
故答案为:4.0×10-36mol/L;
(5)电解Cu(NO3)2稀溶液制备Cu2O时,阴极生成Cu2O,铜离子化合价降低被还原,电极方程式为:2Cu2++2e-+H2O═Cu2O+2H+,溶液中铜离子浓度减小,则阳极应该为铜,以补充消耗的铜离子,
故答案为:阳;2Cu2++2e-+H2O═Cu2O+2H+.1年前查看全部
- 问一道化学计算(有过程)将亚硫酸钠和硫化钠的混合物若干克配置成50g溶液,加入50克一定浓度,足量的盐酸,放出气体0.4
问一道化学计算(有过程)
将亚硫酸钠和硫化钠的混合物若干克配置成50g溶液,加入50克一定浓度,足量的盐酸,放出气体0.448L(标况),混合液为96.9克,求混合物中亚硫酸钠和硫化钠的物质的量 大家聚聚1年前1
大家聚聚1年前1 -
 clarkchung 共回答了19个问题
clarkchung 共回答了19个问题 |采纳率89.5%因为Na2SO3+2HCl=2NaCl+SO2↑+H2O ① ,
Na2S+2HCl=2NaCl+H2S↑②,
SO2+2H2S=3S↓+2H2O ,
因此,放出的气体是SO2或H2S.
根据质量守恒定律可知,m(S)+m(气体)=(50g+50g)-96.9g=3.1g,
(1)当放出的气体是SO2时,n1(SO2)=0.448L/(22.4L/mol)=0.02mol,
则m1(SO2)=0.02mol*64g/mol=1.28g,
所以m(S)=3.1g-1.28g=1.82g,
SO2 + 2H2S = 3S↓ + 2H2O
1mol~2mol~3*32g
n2(SO2)~n(H2S)~1.82g
列比例式解得:n2(SO2)=0.019mol,n(H2S)=0.038mol
故n(SO2)=n1(SO2)+n2(SO2)=0.039mol
根据化学方程式①知,n(Na2SO3)=n(SO2)=0.039mol,
根据化学方程式②知,n(Na2S)=n(H2S)=0.038mol.
(2)当放出的气体是H2S时,n1(H2S)=0.448L/(22.4L/mol)=0.02mol,
则m1(H2S)=0.02mol*34g/mol=0.68g,
所以m(S)=3.1g-0.68g=2.42g,
SO2 + 2H2S = 3S↓ + 2H2O
1mol~2mol~3*32g
n(SO2)~n2(H2S)~2.42g
列比例式解得:n(SO2)=0.0252mol,n2(H2S)=0.0504mol
故n(H2S)=n1(H2S)+n2(H2S)=0.0704mol
根据化学方程式①知,n(Na2SO3)=n(SO2)=0.0252mol,
根据化学方程式②知,n(Na2S)=n(H2S)=0.0704mol.
答:混合物中亚硫酸钠与硫化钠的物质的量为0.039mol、0.038mol,或混合物中亚硫酸钠与硫化钠的物质的量为0.0252mol、0.0704mol.1年前查看全部
- 硫化钠的电离硫酸氢钠的电离乙醛与氢气的加成反应乙醛的催化氧化乙醛的银镜反应乙二酸与乙醇的反应乙酸与乙二醇的反应葡萄糖的银
硫化钠的电离
硫酸氢钠的电离
乙醛与氢气的加成反应
乙醛的催化氧化
乙醛的银镜反应
乙二酸与乙醇的反应
乙酸与乙二醇的反应
葡萄糖的银镜反应
葡萄糖与新制氢氧化铜的反应
油酸甘油酯的氢化
油脂的水解反应
乳酸的自身成环反应 jornden1年前2
jornden1年前2 -
 jeaplong 共回答了14个问题
jeaplong 共回答了14个问题 |采纳率92.9%Na2S == 2Na+ + S2- 硫离子的水S2- + H2O == HS- + OH- 水的电离:H2O == H+ + OH-硫离子的水解的 OH- 抑制水的电离所以 c( HS- ) > c( H+ )
CH3CHO+H2=催化剂,加热=CH3CH2OH1年前查看全部
- 那些溶液必须用橡胶塞?1.氢氧化钠溶液2.水玻璃3.硫化钠溶液4.碳酸钠溶液5.氯化铵溶液6.澄清石灰水7.浓硫酸
 fyraul1年前1
fyraul1年前1 -
 生存意义 共回答了14个问题
生存意义 共回答了14个问题 |采纳率71.4%只要是碱性溶液 都必须用橡胶塞
1 碱性
2 碱性
3 碱性
4 碱性
5 酸性
6 碱性
7 酸性
123461年前查看全部
- 以废硫化碱液和硫磺为原料,合成硫代硫酸钠时,首先要合成二硫化钠,在这一步上有什么关键点,比如温度,浓度等,
 落叶常飞1年前1
落叶常飞1年前1 -
 会tt的_鱼 共回答了21个问题
会tt的_鱼 共回答了21个问题 |采纳率95.2%碱性环境.1年前查看全部
大家在问
- 1有哪些句式,例如主谓宾句式
- 2除了地球,还有其他星球有生物生存吗?
- 3求名校课堂数学七年级下册北师大版的答案
- 4光明小学原来体育达标人数是没达标人数得5分之3后来有60民同学达标这时达标人数是没达标人数的11∕9.光民
- 5三分之一×五分之一 +五分之一 ×七分之一 +七分之一 ×九分之一 +……+九十七分之一 ×九十九分之一
- 6硫酸钠和水反应生成?电离方程式怎么写?
- 7把邮票给我们英语怎么说
- 8硫化钠与过氧化氢反应,硫化钠与过氧化氢反应,硫化钠与过氧化氢反应,
- 9语文语法中的主谓宾等
- 10硫化钠与稀硫酸反应会生成硫单质吗?
- 11金属钠与硫反应的生成物:硫化钠(Na2S)通常情况下是什么颜色?什么体?
- 12硫化钠反应生成硫单质的化学方程式
- 13修改病句:小明光荣地加入了少先队员
- 14某次数学竞赛,共有20道题没做或做错倒扣2分,小聪得72分,他做错了( (写出计算过程)
- 15AB=AC AD=BC 角A等于20度 求角BDC
