铜锌合金溶不溶解于稀硝酸铜不能和盐酸或硫酸反应 怎么能和硝酸反应
 遇到ni2022-10-04 11:39:545条回答
遇到ni2022-10-04 11:39:545条回答
已提交,审核后显示!提交回复
共5条回复
 薄荷-红茶 共回答了13个问题
薄荷-红茶 共回答了13个问题 |采纳率92.3%- 盐酸或硫酸通常称为非氧化性酸,他们与金属反应置换出氢气,硝酸是常见的氧化性酸,与金属发生复杂的氧化还原反应:
3Cu+8HNO3(稀)====3Cu(NO3)2+2NO↑+4H2O
3Zn+8HNO3(稀)=3Zn(NO3)2+2NO+4H2O (此反应视浓度不同有几种) - 1年前
 屏弃而不用 共回答了14个问题
屏弃而不用 共回答了14个问题 |采纳率- 栀子瑶,你知不知道要尊重科学,虽然我不知道这个问题,但你的化学方程式一定有问题!(化学方程式注意问题--1.必以客观事实为基础 2.遵循质量守恒定律)
- 1年前
 家在dy 共回答了18个问题
家在dy 共回答了18个问题 |采纳率- 都会反应的
Cu+HNO3(稀)====3Cu(NO3)2+2NO↑+4H2O
Zn+HNO3(稀的)=Zn(HNO3)2+NO+H2O - 1年前
 龙少爷1314 共回答了9个问题
龙少爷1314 共回答了9个问题 |采纳率- 能 稀硝酸的氧化性很强
- 1年前
 zxfod 共回答了4个问题
zxfod 共回答了4个问题 |采纳率- 可以反应,
而且反应速度比纯铜或纯锌与稀硝酸的反应要快。 - 1年前
相关推荐
- 两块同样重的铜锌合金,一块中铜与锌质量的比是2:5,另一块中铜与锌质量的比是1:3,现将两块合金合成一块,求新合金中铜与
两块同样重的铜锌合金,一块中铜与锌质量的比是2:5,另一块中铜与锌质量的比是1:3,现将两块合金合成一块,求新合金中铜与锌质量的比.
 名字别太长1年前3
名字别太长1年前3 -
 江湖游医wwd 共回答了19个问题
江湖游医wwd 共回答了19个问题 |采纳率89.5%一块的铜含量是2/7,锌含量是5/7,另一块铜含量是1/4,锌含量是3/4.两块合成一块,且原两块重量相同,直接把2块的铜、锌含量分别相加:合成后的铜含量2/7+1/4=8/28+7/28=15/28,锌含量5/7+3/4=20/28+21/28=41/28.15/28:41/28=15:41.1年前查看全部
- 有一块铜锌合金,铜和锌重量的比是19:2,现在加入8克锌,共得到新合金176克,求锌合金中铜与锌的比.
 twtyvte1年前4
twtyvte1年前4 -
 sarah15 共回答了17个问题
sarah15 共回答了17个问题 |采纳率88.2%19X+2X+8=176
21X=168
X=8
19X=152
2X+8=24
152:24=19:31年前查看全部
- 两块同样重的铜锌合金,一块中铜与锌质量的比是2:5,另一块中铜与锌质量的比是1:3,现将两块合金合
两块同样重的铜锌合金,一块中铜与锌质量的比是2:5,另一块中铜与锌质量的比是1:3,现将两块合金合
求多种办法 蛋汤19841年前1
蛋汤19841年前1 -
 相思似剪刀 共回答了16个问题
相思似剪刀 共回答了16个问题 |采纳率81.3%8:20和7:21
所以15:411年前查看全部
- 16g铜锌合金与200g稀硫酸溶液恰好完全反应生成0.49gH2稀H2SO4中溶质质量分数化学高手进啊~
 一衣带雪1年前1
一衣带雪1年前1 -
 lixiangtong 共回答了19个问题
lixiangtong 共回答了19个问题 |采纳率89.5%设该稀硫酸溶液中含有硫酸x克
Zn+H2SO4=ZnSO4+H2
98 2
x 0.49
98/x=2/0.49
x=24.01
该稀硫酸的质量分数=24.01/200*100%=12%1年前查看全部
- 黄铜是铜锌合金,它可以用来制造机器、电器零件及日用品.为测定某黄铜中铜的质量分数,现取10g该样品粉碎,加入到50g稀硫
黄铜是铜锌合金,它可以用来制造机器、电器零件及日用品.为测定某黄铜中铜的质量分数,现取10g该样品粉碎,加入到50g稀硫酸中,恰好完全反应,测得剩余固体质量为3.5g.计算:
(1)黄铜样品中铜的质量分数.
(2)稀硫酸中溶质的质量分数. 贫苦dd的泪1年前1
贫苦dd的泪1年前1 -
 znmao 共回答了21个问题
znmao 共回答了21个问题 |采纳率85.7%样品中铜的质量为3.5g,锌的质量=10g-3.5g=6.5g
所以 黄铜样品中铜的质量分数=3.5g/10g=35%
设稀硫酸中溶质的质量分数为x
Zn + H2SO4 = ZnSO4 + H2↑
65 98
6.5g 50g*x
65/6.5g=98/50g*x
x=19.6%1年前查看全部
- 尊敬的网友!我想知道铜锌合金中的锌能否彻底溶于NaoH溶液中,只剩下铜,请做过实验的朋友指导!
 没钱ww好了1年前1
没钱ww好了1年前1 -
 junwu92 共回答了17个问题
junwu92 共回答了17个问题 |采纳率88.2%不能,所有溶液化学反应都有个平衡度,即某反应到一定程度时,反应物的量和生成物的量之比会趋于一个值,就是动态平衡点.1年前查看全部
- 小明同学为测定某铜锌合金的组成,取10g该合金经粉碎后放入烧杯中,然后加入100g溶质质量分数为20%的过量的稀硫酸,充
小明同学为测定某铜锌合金的组成,取10g该合金经粉碎后放入烧杯中,然后加入100g溶质质量分数为20%的过量的稀硫酸,充分反应后烧杯中剩余物质总质量为109.8g.试回答下列问题:
(1)写出加入稀硫酸的过程中观察到的一项实验现象______.
(2)实验过程中,小红同学提出了一个观点:“反应前后,烧杯中物质的总质量发生了变化,所以此反应不符合质量守恒定律”.你认为她的观点正确吗?______(填“正确”“不正确”之一),简述你的理由______.
(3)试通过计算,求最后所得溶液的质量(写出相应计算过程,结果精确到0.1g). gaiying1年前1
gaiying1年前1 -
 109493227 共回答了23个问题
109493227 共回答了23个问题 |采纳率95.7%解题思路:(1)铜锌合金中的锌可以和稀硫酸反应,所以能够观察到气体生成,固体减少,可以据此解答该题;
(2)该反应中生成了氢气,而氢气逸散到空气中没有称量,所以不能仅仅根据表面现象来判断该反应不符合质量守恒定律,可以据此解答;
(3)根据质量守恒定律可以知道反应前后减少的质量即为生成的氢气的质量,然后结合反应的化学方程式可以计算出消耗的锌的质量,进而完成解答即可.(1)铜锌合金中的锌可以和稀硫酸反应,所以能够观察到气体生成,固体减少;
(2)该反应中生成了氢气,而氢气逸散到空气中没有称量,所以不能仅仅根据表面现象来判断该反应不符合质量守恒定律,所以小红的观点不正确;
(3)根据质量守恒定律,由题意可知反应中生成氢气的质量:10g+100g-109.8g=0.2g;
设铜锌合金中锌的质量为x
Zn+H2SO4═ZnSO4+H2↑
652
x0.2g
[65/x]=[2/0.2g]
解得:x=6.5g
反应后所得溶液的质量为:6.5g+100g-0.2g=106.3g
答:最后所得溶液的质量为106.3g
故答案为:(1)固体减少,生成气体;
(2)不正确;产生的气体散失到空气中;
(3)106.3g.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.1年前查看全部
- 为了测定某铜锌合金中锌的质量分数,某同学利用该合金与稀硫酸反应,进行了三次试验,所得相关实验数据如
为了测定某铜锌合金中锌的质量分数,某同学利用该合金与稀硫酸反应,进行了三次试验,所得相关实验数据如
为了测定某铜锌合金中锌的质量分数,某同学利用该合金与稀硫酸反应,进行了三次试验,所得的相关实验数据记录如下(不计实验中产生的误差):
第一次 第二次 第三次
所取合金的质量 /g 25 25 25
所用稀硫酸的质量/g 125 160 100
生成的氢气的质量/g 0.4 0.4 0.4
(1)计算该铜锌合金中锌的质量分数.
(2)从上表数据分析,当所取合金与所用稀硫酸的质量比为——,合金中的锌与稀硫酸恰好完全反应. shforever1年前1
shforever1年前1 -
 liuzi6667 共回答了18个问题
liuzi6667 共回答了18个问题 |采纳率72.2%设该铜锌合金中锌的质量为
Zn+H2SO4=ZnSO4+H2↑
65 2
X 0.4g
65/X=2/0.4g
X= 13g
该铜锌合金中锌的质量分数=13g/25g *100%=52%
当所取合金与所用稀硫酸的质量比为1:4,合金中的锌与稀硫酸恰好完全反应.1年前查看全部
- 炼出铜锌合金的化学式?
 玉搔头1年前1
玉搔头1年前1 -
 三手神猿36 共回答了17个问题
三手神猿36 共回答了17个问题 |采纳率94.1%铜锌合金,既然是合金,那属于物理合成,没有化学式.要写也只有写成CU+ZN,
黄铜矿有化学式CuFeS2.1年前查看全部
- 两块同样质量的铜锌合金,第一块中铜与锌的比是2:5,另一块合金中铜与锌的比是1:3. 现将两块合金合成
两块同样质量的铜锌合金,第一块中铜与锌的比是2:5,另一块合金中铜与锌的比是1:3. 现将两块合金合成
一块,求新合金中铜与锌的比. 口吕品田1年前2
口吕品田1年前2 -
 富贵就要xx 共回答了21个问题
富贵就要xx 共回答了21个问题 |采纳率85.7%设质量为x,则第一块含铜2x/7,含锌5x/7
第二块含铜x/4含锌3x/4
比(2x/7+x/4)(5x/7+3x/4)=15/411年前查看全部
- 两块同样质量的铜锌合金,第一块中铜与锌的比是2∶5,另一块合金中铜与锌 的比是1∶3.
两块同样质量的铜锌合金,第一块中铜与锌的比是2∶5,另一块合金中铜与锌 的比是1∶3.
现将两块合金合成一块,求新合金中铜与锌的比
不用方程 niuxiangdong1年前1
niuxiangdong1年前1 -
 矛尾猿 共回答了19个问题
矛尾猿 共回答了19个问题 |采纳率100%第一块中铜占总的比=2÷(2+5)=2/7
第二块中铜占总的比=1÷(1+3)=1/4
所以新合金中铜与锌的比=(2/7+1/4):(1-2/7+1-1/4)=15:411年前查看全部
- 为了测定某铜锌合金中锌的质量分数某同学某同学利用该合金与稀盐酸反应,其中有一次是恰好完全反应
为了测定某铜锌合金中锌的质量分数某同学某同学利用该合金与稀盐酸反应,其中有一次是恰好完全反应
所取合金的质量/g 10 10 20所用稀硫酸的质量/g100 80 80
剩余质量 g 109.8 89.8 99.8
求
合金和hcl恰好完全反应的比值
求合金中zn的质量分数 越投越勇1年前1
越投越勇1年前1 -
 剪轻萝 共回答了15个问题
剪轻萝 共回答了15个问题 |采纳率86.7%合金和hcl恰好完全反应的比值 10g:80g=1:8
生成氢气的质量为 10g+80g-89.8g=0.2g
Zn + H2SO4 === ZnSO4 + H2↑
65 2
x 0.2g
65/x=2/0.2g
x=6.5g
合金中zn的质量分数 6.5g/10g*100%=65%1年前查看全部
- 为了测定某铜锌合金的组成,某校化学课外活动小组利用该合金粉末与稀硫酸反应,进行了三次实验,所得相关实验数据记录如下:
为了测定某铜锌合金的组成,某校化学课外活动小组利用该合金粉末与稀硫酸反应,进行了三次实验,所得相关实验数据记录如下:
第一次 第二次 第三次
所取合金的质量/g 10 10 20
所用稀硫酸的质量/g 60 80 50
生成氢气的质量 0.2 0.2 0.2
所取合金与稀硫酸的质量比是______时,合金中的锌与稀硫酸中的硫酸恰好完全反应.
计算该铜锌合金中的铜的质量分数.
计算稀硫酸的浓度与配制后溶液溶剂的质量分数. 我爱荷塘1年前1
我爱荷塘1年前1 -
 云中燕99 共回答了18个问题
云中燕99 共回答了18个问题 |采纳率88.9%从三次实验中可以看出第一第二次酸过量,第三次合金过量,以第一次反应计算铜不会与稀硫酸反应释放出氢气,而锌会,那么 Zn + H2SO4 ---- ZnSO4 + H2 65.4 98 2 x y 0.2 ...1年前查看全部
- 某化学兴趣小组为了测定某黄铜(铜锌合金)中铜的质量,现取10g该黄铜样品碎屑,把80g稀硫酸四等分,然后分4次加入药品中
某化学兴趣小组为了测定某黄铜(铜锌合金)中铜的质量,现取10g该黄铜样品碎屑,把80g稀硫酸四等分,然后分4次加入药品中,每次充分反映后都经过滤、干燥、称量,测的实验数据如下
1 表格中m的值为
2、黄铜样品中铜的质量分数是
3、反应前后稀硫酸中溶质的质量分数是
 stusmpdd10_sina11年前1
stusmpdd10_sina11年前1 -
 gxiang223 共回答了20个问题
gxiang223 共回答了20个问题 |采纳率80%1.表格中m的值为3.2g;
2、黄铜样品中铜的质量分数=3.2g/10g*100%=32%;
3、反应前稀硫酸中溶质的质量分数是x
Zn + H2SO4=ZnSO4+H2
65 98
(10-3.2)g x*60g
65/98=6.8g/x*60g
x=17.1%1年前查看全部
- 某铜锌合金20g与一定量的质量分数为10%的稀硫酸恰好完全反应,将反应后的溶液过滤得到13.5g固体
某铜锌合金20g与一定量的质量分数为10%的稀硫酸恰好完全反应,将反应后的溶液过滤得到13.5g固体
最多能得到多少克氢气?反应的稀硫酸的质量为多少克?反应后所得的溶液的质量分数是多少?若配置该实验所用的稀硫酸,需要98%的浓硫酸多少毫升?需要水多少毫升? fifahome1年前1
fifahome1年前1 -
 xwyli0505 共回答了17个问题
xwyli0505 共回答了17个问题 |采纳率82.4%根据单质锌与稀硫酸的反应化学方程式可得到:过滤后滤渣全为铜单质,那么锌质量为6.5克为突破口,根据化学方程式设出稀硫酸与氢气质量!列比例得出稀硫酸质量为98克,反应后溶液中硫酸锌质量为16.1克故为16.1/【反应前反应物的(6.5+9.8)克】=15.4%;配置该实验的稀硫酸所需98%浓硫酸和水的体积,根据溶液稀释前后溶质质量保持不变求得,可设需98%浓硫酸与水的体积,根据质量=体积x密度(98%浓硫酸密度为1.84克/毫升)解得需98%浓硫酸约5.43毫升,水=稀溶液质量-浓浓液质量=98克-10克=88克!1年前查看全部
- 10g黄铜(铜锌合金)与100g稀硫酸恰好完全反应,生成氢气0.2g.则该合金铜的质量分数是多少?稀硫酸的溶质质量分数是
10g黄铜(铜锌合金)与100g稀硫酸恰好完全反应,生成氢气0.2g.则该合金铜的质量分数是多少?稀硫酸的溶质质量分数是多少?
 hellozsz1年前1
hellozsz1年前1 -
 水仙香片 共回答了18个问题
水仙香片 共回答了18个问题 |采纳率88.9%设Zn质量为x 设H2SO4质量为yZn+H2SO4=ZnSO4+H2(气)65 98 2x y 0.2g65/2=x/0.2gx=6.5g98/2=y/0.2gy=9.8gm(Cu)=m(合金)-m(Zn)=10g-6.5g=3.5gCu%=3.5g/10g*100%=35%H2SO4%=9.8g/100g*100%=9.8% 答:该合金铜的...1年前查看全部
- 将一定质量的铜锌合金加入100g稀硫酸中,恰好完全反应,生成氢气0.2g.
将一定质量的铜锌合金加入100g稀硫酸中,恰好完全反应,生成氢气0.2g.
⑴所用稀硫酸的溶质质量分数是多少?
⑵生成溶液中溶质是
⑶生成溶液中溶质质量分数是多少? steven352621年前1
steven352621年前1 -
 钱不等于资金 共回答了20个问题
钱不等于资金 共回答了20个问题 |采纳率100%Zn+H2SO4=ZnSO4+H2
65 98 161 2
z x y 0.2g
x=9.8g y=16.1g z=6.5g
(1)H2SO4%=9.8g/100g×100%=9.8%
(2)铜锌合金中,只有锌与稀硫酸反应,生成硫酸锌.
(3)ZnSO4%=16.1g/(6.5+100-0.2)g×100%=15%1年前查看全部
- 取铜锌合金65g,放入盛有360g稀硫酸(足量)的容器中充分反应,生成氢气0.8g.试计算(请写出解题过程):
取铜锌合金65g,放入盛有360g稀硫酸(足量)的容器中充分反应,生成氢气0.8g.试计算(请写出解题过程):
(1)该合金中锌的质量.
(2)反应的溶液蒸发掉多少克水后可变成20%的硫酸锌溶液? 火柴棍1年前1
火柴棍1年前1 -
 qingtiantaiyang 共回答了17个问题
qingtiantaiyang 共回答了17个问题 |采纳率100%解题思路:(1)根据金属的活动性锌>氢>铜,放入稀硫酸中的铜锌合金中只有锌与硫酸反应放出氢气,因此,可利用放出氢气的质量计算出合金中的锌的质量;
(2)充分反应后的溶液中硫酸锌的质量可根据反应的化学方程式,由放出氢气的质量而求得,然后利用溶质硫酸锌与溶液的质量关系计算出硫酸锌的质量分数达20%时溶液的质量,再与反应后所得溶液质量相比,两溶液质量差即为蒸发水的质量.设原混合物中锌的质量为x,生成的硫酸锌的质量为y
Zn+H2SO4=ZnSO4+H2↑
65 161 2
x y 0.8g
[65/x=
161
y=
2
0.8g]
x=26g y=64.4g
(2)硫酸锌的质量分数为20%时溶液的质量=[64.4g/20%]=322g
蒸发水的质量=360g+26g-0.8g-322g=63.2g
答:(1)该合金中锌的质量为26g.
(2)反应的溶液蒸发掉63.2g水后可变成20%的硫酸锌溶液.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 根据化学方程式能表示反应中各物质的质量比,利用反应中某物质的质量可计算反应中其它物质的质量.1年前查看全部
- 铜锌合金比两块质量相等的铜锌合金,第一块中铜与锌的比是3:2,另一块中铜与锌的比是1:3.现将两块合金合成一块,求新合金
铜锌合金比
两块质量相等的铜锌合金,第一块中铜与锌的比是3:2,另一块中铜与锌的比是1:3.现将两块合金合成一块,求新合金中铜与锌的比. tianmalzh1年前1
tianmalzh1年前1 -
 丽丽宝贝88 共回答了18个问题
丽丽宝贝88 共回答了18个问题 |采纳率83.3%假设1合金有3块铜,2块锌,另一块是1和3
一共有铜4块,锌5块.
4:51年前查看全部
- 一块铜锌合金重210克,铜与锌的比是3:2,如果再溶入30克锌,这时铜与锌的比是多少?
 weier_1271年前1
weier_1271年前1 -
 朕在墙头等红杏 共回答了19个问题
朕在墙头等红杏 共回答了19个问题 |采纳率89.5%锌的质量:108/(2+3)*2=43.2克 (总质量除以总比例再乘以锌的比例)
43.2+30=73.2 克
铜的质量:108-43.2=64.8克
铜锌比例:64.8:73.2化为最简比率为:54:611年前查看全部
- 两块铜锌合金,第一块比例是1:4,第二块是3:7,合成一块后比多少?
两块铜锌合金,第一块比例是1:4,第二块是3:7,合成一块后比多少?
凹 coldwind9231年前1
coldwind9231年前1 -
 贝贝驼 共回答了16个问题
贝贝驼 共回答了16个问题 |采纳率93.8%如果两块铜锌合金的质量相等,则
合成一块后铜锌之比
=(1/5+3/10):(4/5+7/10)
=(1/2):(3/2)
=1:31年前查看全部
- 有块铜锌合金,其中铜与锌的比是3:4,如果再加入5千克铜,熔铸成新的合金68千克,新合金中铜与锌的比是______.
 zxf3151年前1
zxf3151年前1 -
 pplkcscs2111 共回答了17个问题
pplkcscs2111 共回答了17个问题 |采纳率82.4%解题思路:先求出加入5千克铜之前铜锌合金的重量,再根据“铜和锌的比例是3:4”,把铜看作3份,锌看作4份,那么合金是(3+4)份,由此求出一份是多少,进而求出原来合金铜的千克数与锌的千克数,进而求出新合金中铜的千克数,由此写出新合金中铜与锌的比,化简即可.原来合金的千克数是:68-5=63 (千克),
新合金中铜的千克数:
63÷(3+4)×3+5,
=63÷7×3+5,
=27+5,
=32(千克),
新合金中锌的千克数:68-32=36(千克),
新合金中铜与锌的比是:32:36=8:9,
答:新合金中铜与锌的比是8:9,
故答案为:8:9.点评:
本题考点: 比的应用.
考点点评: 解答此题的关键是利用按比例分配的方法求出原来合金中铜的千克数,再用铜的总千克数比合金中锌的千克数即可.1年前查看全部
- 一块质量8克,的铜锌合金与96.85克稀盐酸恰好反应,反应产生的氢气和反应时间关系如图.求合金中铜质量分数是多少?(结果
一块质量8克,的铜锌合金与96.85克稀盐酸恰好反应,反应产生的氢气和反应时间关系如图.求合金中铜质量分数是多少?(结果精确到0.1%)氢气质量在五分钟为0.10克.
 阑风珊影1年前0
阑风珊影1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 某铜锌合金加入100G稀盐酸,反应完全后,称的剩余物质质量为98.9克,问该合金中铜的质量分数.
 欧琼1年前1
欧琼1年前1 -
 烛影摇红123 共回答了17个问题
烛影摇红123 共回答了17个问题 |采纳率88.2%数据不对
改正后Hi我
铜与盐酸不反应
Zn + 2HCl === ZnCl2 + H2↑1年前查看全部
- 一块铜锌合金,其中铜与锌的质量比是3比4.如果再加入5千克铜可制成新合金68kg,
一块铜锌合金,其中铜与锌的质量比是3比4.如果再加入5千克铜可制成新合金68kg,
新合金中,铜和锌的比是多少? 秦歌子1年前3
秦歌子1年前3 -
 Mr_xQ 共回答了19个问题
Mr_xQ 共回答了19个问题 |采纳率78.9%原来合金质量为:68-5=63KG,所以,原来合金铜、锌质量分别为:63x3/7=27Kg.和63x4/7=36kg.
新合金铜质量为:27+5=32kg,锌还是36kg,所以,铜和锌的比是32:36=8:91年前查看全部
- 有一块铜锌合金,铜和锌质量的比是19:2,现在加入12克锌,得新合金159克.新合金中铜与锌质量比
 linyfy1年前1
linyfy1年前1 -
 百度比昂 共回答了14个问题
百度比昂 共回答了14个问题 |采纳率100%原来铜和锌质量 159-12=147克
铜 147×19/(19+2)=133克
锌 159-133=26克
新合金中铜与锌质量比 133:261年前查看全部
- 铜锌合金20克 加入50克稀硫酸恰好完全反应,剩余物质为69.8克 求该合金中通的质量分数
 xiaojun7505191年前1
xiaojun7505191年前1 -
 wddzb 共回答了27个问题
wddzb 共回答了27个问题 |采纳率85.2%设xgZn 根据质量守恒我们知道溶液质量减少的量就是氢气的质量为0.2g 即n=m/M=0.1mol Zn+H2SO4==ZnS O4+H2 有Zn与氢气比1:1即Zn也1mol.m=n*M=0.1*65=6.5g 铜为13.5g 百分含量65%1年前查看全部
- 某学习小组为测量铜锌合金的组成,称取20g该合金加入100mL某浓度的稀硫酸溶液中,反应完全后,测得生成气体体积为4.4
某学习小组为测量铜锌合金的组成,称取20g该合金加入100mL某浓度的稀硫酸溶液中,反应完全后,测得生成气体体积为4.48L(已换算成标准状况下的体积),往反应后残余固体的烧杯中再次加入稀硫酸,无气泡生成.请你根据他们测得数据计算:
(1)该合金中铜和锌的质量分数
(2)硫酸溶液的物质的量溶度最低为多少? red_satan1年前1
red_satan1年前1 -
 kiss_kknd 共回答了14个问题
kiss_kknd 共回答了14个问题 |采纳率85.7%(1)Cu不和稀硫酸反应、则反应方程式为
Zn+H2SO4═ZnSO4+H2↑
nH2=V/Vm=4.48/22.4=0.2mol=nZn
mZn=nZn*65=0.2*65=13g
Zn的质量分数=mZn/20=65%
Cu的质量分数=35%
(2)设稀硫酸刚好完全反应
nH2S04=nH2=0.2mol
c=n/v=0.2/0.1=2mol/L1年前查看全部
- “假黄金”欺骗了很多人,“假黄金”的主要成分是铜锌合金.下列区别真假黄金的方法中不正确的是( )
“假黄金”欺骗了很多人,“假黄金”的主要成分是铜锌合金.下列区别真假黄金的方法中不正确的是( )
A.根据外观判断
B.测量金属的密度
C.在火焰上灼烧,观察颜色的变化
D.放在稀硫酸中,如果有气泡产生,说明黄金是假的 phjwj1年前1
phjwj1年前1 -
 baby52310 共回答了20个问题
baby52310 共回答了20个问题 |采纳率95%解题思路:真假黄金的颜色均为黄色,密度不同,灼烧时Cu易被氧化生成黑色的CuO,且Zn与稀硫酸反应生成氢气,而金不能,以此来解答.A.外观上颜色相同,不能区别,故A错误;
B.金的密度大,而Cu、Zn的密度小,则相同体积时质量不同,可区别,故B正确;
C.灼烧时看表面颜色,铜能与氧气反应生成黑色的氧化铜,而金不与氧气反应,故可以鉴别,故C正确;
D.真黄金与稀硫酸不反应,则放在稀硫酸中,如果有气泡产生,说明黄金是假的,因含Zn与稀硫酸反应,可区别,故D正确;
故选A.点评:
本题考点: 物质的检验和鉴别的基本方法选择及应用.
考点点评: 本题考查物质的鉴别和检验的基本方法选择,为高频考点,把握金属的性质为解答的关键,注意不同金属的密度、金属活泼性等即可解答,题目难度不大.1年前查看全部
- 按如图所示的装置进行实验:A极是铜锌合金,B极是纯铜,电解质溶液中含有足量的铜离子,通电一段时间后,若A极恰好全部溶解,
 按如图所示的装置进行实验:A极是铜锌合金,B极是纯铜,电解质溶液中含有足量的铜离子,通电一段时间后,若A极恰好全部溶解,此时B极质量增加7.68g,溶液质量增加0.03g,则A合金中Cu、Zn的物质的量之比为( )
按如图所示的装置进行实验:A极是铜锌合金,B极是纯铜,电解质溶液中含有足量的铜离子,通电一段时间后,若A极恰好全部溶解,此时B极质量增加7.68g,溶液质量增加0.03g,则A合金中Cu、Zn的物质的量之比为( )
A.4:1
B.3:1
C.2:1
D.1:1 niuniu09141年前1
niuniu09141年前1 -
 砍你丫的 共回答了14个问题
砍你丫的 共回答了14个问题 |采纳率92.9%解题思路:该装置是电解池,阳极上金属失电子发生氧化反应,阴极上铜离子得电子发生还原反应,所以阴极上增加的质量是铜的质量,溶液中增加的质量为溶解锌的质量与通过相同电子时析出铜的质量差,根据质量差可以计算溶解的锌的物质的量,再根据氧化还原反应中得失电子数相等计算合金中铜的物质的量,从而计算铜和锌的原子个数之比.B极上析出的是铜,B极质量增加7.68g,其物质的量=[7.68g/64g/mol]=0.12mol;
阳极上溶解锌时,阴极上析出铜,所以溶液质量增加的质量为锌和铜的质量差,溶液质量增加0.03g,即锌和铜的质量差为0.03g.
设锌的物质的量为x,则:
Zn+Cu2+═Zn2++Cu 质量增加
1mol 1g
x0.03g
x=0.03mol.
即合金中锌的物质的量是0.03mol.
根据氧化还原反应中得失电子数相等知,阳极上锌和铜失去的电子数等于阴极上铜离子得到的电子,设合金中铜的物质的量为y,则:
0.03mol×2+2y=0.12mol×2
y=0.09mol,
所以合金中铜和锌的物质的量之比为0.09mol:0.03mol=3:1,所以铜和锌的原子个数之比是3:1,
故选:B.点评:
本题考点: 电解原理.
考点点评: 本题考查电解原理,侧重于电解的计算,注意把握两极的变化,从差量法与守恒的角度解答该题,题目难度中等.1年前查看全部
- 有一块铜锌合金,铜与锌的质量比是19:2,现在加入8克锌后得到新合金176克.新合金中铜与锌的质量比是多少
有一块铜锌合金,铜与锌的质量比是19:2,现在加入8克锌后得到新合金176克.新合金中铜与锌的质量比是多少
优质课堂难点探究数学 bamiyang_2001年前1
bamiyang_2001年前1 -
 lunshizhe 共回答了15个问题
lunshizhe 共回答了15个问题 |采纳率93.3%原合金质量=176-8=168
原合金铜的质量=168*(19/21)=152
原合金锌的质量=168-152=16
新合金的铜锌质量比=152:(16+8)=152:24=19:31年前查看全部
- 铜锌合金加入硝酸银的化学式是什么
铜锌合金加入硝酸银的化学式是什么
急须.快 lovebdb1年前1
lovebdb1年前1 -
 您的ID已过期 共回答了14个问题
您的ID已过期 共回答了14个问题 |采纳率92.9%生成Ag和Cu(NO3)2和Zn(NO3)2,但得看铜、锌和硝酸银的具体含量.因为锌还会使Cu(NO3)2析出铜.1年前查看全部
- 初三化学题目,求解,写过程“黄铜”是铜锌合金,具有较机械性能,比纯铜耐腐蚀,街头许多“金色”饰品就是用它来制作的.现取2
初三化学题目,求解,写过程
“黄铜”是铜锌合金,具有较机械性能,比纯铜耐腐蚀,街头许多“金色”饰品就是用它来制作的.现取20.0g某种黄铜投入154.7g某浓度的稀硫酸中,完全反应后剩余的溶液和参与固体总质量为174.5g.请计算:
1.产生氢气的质量为多少g
2.这种黄铜中铜的质量分数为多少
3.剩余溶液中溶质的质量分数是多少?写出计算过程,结果精确到0.1%
某同学在实验室用含碳酸钙80%的石灰石和溶质质量分数为10%的稀盐酸恰好完全反应制取8.8g二氧化碳(杂质不与盐酸反应).问:
1.他需取用这种石灰石多少克?
2.所用10%的稀盐酸多少克?
3.反应后溶液中溶质质量分数?
金属钠跟硫酸铜溶液发生如下反应:2Na+2H2O+CuSO4=Na2SO46Cu(OH)2↓+H2↑,向73.7g硫酸铜溶液中加入2.3g钠,恰好反应完全(溶剂水有剩余).试计算:
1.得到的沉淀是纯净物的Cu(OH)2,它的质量是多少?
2.生成氢气的质量是多少?
3.反应停止后,滤去沉淀,所得溶液中溶质的质量分数是多少?
 stevenjing1年前1
stevenjing1年前1 -
 zhou827 共回答了22个问题
zhou827 共回答了22个问题 |采纳率90.9%“黄铜”是铜锌合金,具有较机械性能,比纯铜耐腐蚀,街头许多“金色”饰品就是用它来制作的.现取20.0g某种黄铜投入154.7g某浓度的稀硫酸中,完全反应后剩余的溶液和参与固体总质量为174.5g.请计算:
1.产生氢气的质量为多少g
20+154.7-174.5=0.2g
2.这种黄铜中铜的质量分数为多少
2 65
--- = ---
0.2 x
X=6.5g
C%=(20-6.5)/20=67.5%
某同学在实验室用含碳酸钙80%的石灰石和溶质质量分数为10%的稀盐酸恰好完全反应制取8.8g二氧化碳(杂质不与盐酸反应).问:
1.他需取用这种石灰石多少克?
44/8.8=100/x
X=20g
20/80%=25G
2.所用10%的稀盐酸多少克?
44/8.8=2X36.5/Y
Y=14.6G
14.6/10%=146G
3.反应后溶液中溶质质量分数?
44/8.8=111/Z
Z=22.2G
C=22.2/(25+146-8.8)=13.687%
金属钠跟硫酸铜溶液发生如下反应:2Na+2H2O+CuSO4=Na2SO4+Cu(OH)2↓+H2↑,向73.7g硫酸铜溶液中加入2.3g钠,恰好反应完全(溶剂水有剩余).试计算:
1.得到的沉淀是纯净物的Cu(OH)2,它的质量是多少?
2X23/2.3=98/X
X=4.9G
2.生成氢气的质量是多少?
2X23/2.3=2/X
X=0.1G
3.反应停止后,滤去沉淀,所得溶液中溶质的质量分数是多少?
2X23/2.3=142/X
X=7.1G
C=7.1/(73.7+2.3-4.9-0.1)=10%1年前查看全部
- 一块质量为20克的铜锌合金与49克20%的稀硫酸完全反应,所得到的溶液中溶质质量分数为多少?
 zhangning9847111年前1
zhangning9847111年前1 -
 弋鱽弦 共回答了18个问题
弋鱽弦 共回答了18个问题 |采纳率100%设合金中含锌的质量为X,反应生成硫酸锌的质量为Y、生成氢气的质量为Z
49克20%的稀硫酸中含硫酸的质量=49g*20%=9.8g
Zn + H2SO4 = ZnSO4 + H2↑
65 98 161 2
X 9.8g Y Z
X=6.5g
Y=16.1g
Z=0.2g
所得到的溶液中溶质质量=6.5g+49g-0.2g=55.3g
所得到的溶液中溶质质量分数=16.1g/55.3g*100%=29.1%
答:所得到的溶液中溶质质量分数为29.1%1年前查看全部
- 按如图所示装置进行实验:A极是铜锌合金,B极为纯铜,电解质中含有足量的铜离子.通电一段时间后,若A极恰好全部溶解,此时B
按如图所示装置进行实验:A极是铜锌合金,B极为纯铜,电解质中含有足量的铜离子.通电一段时间后,若A极恰好全部溶解,此时B极质量增加7.68g,溶液质量增0.03g,则合金中Cu、Zn原子个数比为( )
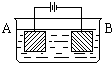 A. 4:1
A. 4:1
B. 3:1
C. 2:1
D. 任意比 龙翔九洲凤相随1年前1
龙翔九洲凤相随1年前1 -
 山丹丹开花红艳艳 共回答了20个问题
山丹丹开花红艳艳 共回答了20个问题 |采纳率90%解题思路:该装置是电解池,阳极上金属失电子发生氧化反应,阴极上铜离子得电子发生还原反应,所以阴极上增加的质量是铜的质量,溶液中增加的质量为溶解锌的质量与通过相同电子时析出铜的质量差,根据质量差可以计算溶解的锌的物质的量,再根据氧化还原反应中得失电子数相等计算合金中铜的物质的量,从而计算铜和锌的原子个数之比.B极上析出的是铜,B极质量增加7.68g,其物质的量=[7.68g/64g/mol]=0.12mol;
阳极上溶解锌时,阴极上析出铜,所以溶液质量增加的质量为锌和铜的质量差,溶液质量增加0.03g,即锌和铜的质量差为0.03g.
设锌的物质的量为x,则:
Zn+Cu2+=Zn2++Cu 质量增加
1mol1g
x0.03g
x=0.03mol.
即合金中锌的物质的量是0.03mol.
根据氧化还原反应中得失电子数相等知,阳极上锌和铜失去的电子数等于阴极上铜离子得到的电子,设合金中铜的物质的量为y,则:
0.03mol×2+2y=0.12mol×2
y=0.09mol,
所以合金中铜和锌的物质的量之比为0.09mol:0.03mol=3:1,所以铜和锌的原子个数之比是3:1,
故选B.点评:
本题考点: 电解原理.
考点点评: 本题考查电解原理,侧重于电解的计算,注意把握两极的变化,从差量法与守恒的角度解答该题,题目难度中等.1年前查看全部
- 为了测定某铜锌合金(即Cu、Zn混合物)中锌的质量分数,某同学利用该合金与稀硫酸反应,进行了三次实验,所得相关数据记录
为了测定某铜锌合金(即Cu、Zn混合物)中锌的质量分数,某同学利用该合金与稀硫酸反应,进行了三次实验,所得相关数据记录
(1)从上表数据分析,当所取合金与所用稀硫酸的质量比为______时.表示合金中的锌与稀硫酸中的硫酸恰好完全反应.第一次 第二次 第三次 所取合金质量/g 25 25 50 所用稀硫酸质量/g 100 160 100 生成氢气质量1g 0.4 0.4 0.4
(2)试计算铜锌合金中铜的质量分数. 遇时1年前1
遇时1年前1 -
 锦衣卫的干活 共回答了20个问题
锦衣卫的干活 共回答了20个问题 |采纳率85%解题思路:(1)铜、锌合金中铜和稀硫酸不反应只有锌和稀硫酸反应,第二次和第一次所取的合金质量相同,第二次所用的稀硫酸比第一次多,而两次生成的气体质量相同,说明两次所取的合金中的锌都完全反应了,由此可以知道25g合金只能生成0.4g氢气;第三次和第一次比较可知100g稀硫酸完全反应只能产生0.4g气体,从而可以判断出稀硫酸和合金恰好完全反应的质量比;
(2)根据氢气的质量结合反应的化学方程式可以计算出锌的质量,进而求出铜的质量分数即可.(1)铜、锌合金中铜和稀硫酸不反应只有锌和稀硫酸反应,第二次和第一次所取的合金质量相同,第二次所用的稀硫酸比第一次多,而两次生成的气体质量相同,说明两次所取的合金中的锌都完全反应了,由此可以知道25g合金只能生成0.4g氢气;第三次和第一次比较可知100g稀硫酸完全反应只能产生0.4g气体,综上可以知道:25g合金中的锌和100g稀硫酸可恰好完全反应,即合金和稀硫酸的质量比为25g:100g=1:4;
(2)设25g铜锌合金中含有锌的质量为x
Zn+H2SO4═ZnSO4+H2↑
65 2
x 0.4g
[65/x=
2
0.4g],
x=13g
铜合金中铜的质量分数为:
25g−13g
25g×100%=48%;
答:铜合金中铜的质量分数为48%.
故答案为:(1)1:4;
(2)48%.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 此题考查的是根据化学方程式的有关计算,学会运用控制变量法来正确的分析处理表中的数据是解答此题的关键.1年前查看全部
- 为了测定某铜锌合金的组成,某校化学课外活动小组利用该合金粉末与稀硫酸反应,进行了三次实验,所得相关的实验数据记录如下:
为了测定某铜锌合金的组成,某校化学课外活动小组利用该合金粉末与稀硫酸反应,进行了三次实验,所得相关的实验数据记录如下:
(1)写出有关反应的化学方程式;第一次 第二次 第三次 所取合金的质量/g 10 10 20 所用稀硫酸的质量/g 50 80 50 生成氢气的质量/g 0.2 0.2 0.2
(2)从上表数据分析,当所取合金与所用稀硫酸的质量比为______时,表明合金中的锌与稀硫酸恰好完全反应.(提示:铜与稀硫酸不反应)
(3)试计算该铜锌合金中锌的质量分数.
(4)计算当所用合金与稀硫酸恰好完全反应时,所得溶液中溶质的质量分数. celine_chen1年前1
celine_chen1年前1 -
 _raojc0bso5a8_0_ 共回答了20个问题
_raojc0bso5a8_0_ 共回答了20个问题 |采纳率90%解题思路:(1)由于铜与稀硫酸不反应,故铜锌合金与稀硫酸的反应,为锌与稀硫酸的反应,可直接写出反应方程式;
(2)从三次实验数据可知,第一、第二次反应中稀硫酸过量,第三次反应中锌过量,又因为第三次反应中硫酸产生的氢气恰好为0.2g,所以第一次反应中合金中的锌与稀硫酸恰好完全反应,从而得出它们的质量比.
(3)根据第一次实验产生氢气的质量和其所取用的稀硫酸与合金样品的质量,可求出合金中锌的质量;
(4)根据(3)中化学方程式的比例关系,求出溶质的质量,及溶液的总量,代入公式可以求出恰好完全反应后所得溶液中溶质的质量分数.(1)Zn+H2SO4→ZnSO4+H2↑;
(2)由于合金中的锌与稀硫酸恰好完全反应所取合金与所用稀硫酸分别为10g,50g,故其质量比为1:5;
故答案为:1:5.
(3)设合金中锌的质量为x,生成硫酸锌质量为y.
Zn+H2SO4→ZnSO4+H2↑
65 161 2
xy 0.2g
∴x:65=0.2g:2,
解之得:x=6.5g,
该铜锌合金中锌的质量分数为:[6.5/10]×100%=65%;
(4)y:161=0.2g:2,
解之得:y=16.1g,
所得溶液中ZnSO4的质量分数:[16.1g/6.5g+50g−0.2g]×100%=28.6%.
答:(3)该铜锌合金中锌的质量分数为65%;
(4)所得溶液中ZnSO4的质量分数为28.6%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算;酸的化学性质.
考点点评: 本题是借助于数学模型,利用图表的方式来分析和解决化学计算中的有关问题,要求学生有较强的识图能力和数据分析能力.1年前查看全部
- 有一块铜锌合金,其中铜和锌的比2:3.现知道再加入6克锌,熔化后共得新合金36克,新合金中铜和锌的比是多少?
 桔子昏了1年前1
桔子昏了1年前1 -
 fyq216 共回答了18个问题
fyq216 共回答了18个问题 |采纳率94.4%解题思路:现知道再加入6克锌,熔化后共得新合金36克,可得原合金的克数,又知道原合金铜锌的比,计算出原铜锌的克数,加入锌后再计算,得出新合金铜和锌的比.解法一:
加入的6克锌相当于新合金的6÷36=[1/6],
原来的合金是新合金是1-[1/6]=[5/6],
铜没有变,占新合金的[5/6]÷(2+3)×2=[1/3],
新合金中的锌占1-[1/3]=[2/3],
所以新合金中的铜和锌的比是[1/3]:[2/3]=1:2;
解法二:
原来的合金重36-6=30(克),
原来的合金每份重30÷(2+3)=6(克),
含铜6×2=12(克),含锌6×3=18(克),
新合金中的合金比12:(18+6)=[1/2],即铜:锌=1:2.
答:新合金中铜和锌的比是1:2.点评:
本题考点: 比的应用.
考点点评: 第二种解法易于理解,解答此题的关键是找出不变量.1年前查看全部
- 市面上有不法分子用黄铜(铜锌合金)制成假黄金首饰行骗,极大损害了消费者的利益.根据你所学的化学知识,下列哪种化学试剂无法
市面上有不法分子用黄铜(铜锌合金)制成假黄金首饰行骗,极大损害了消费者的利益.根据你所学的化学知识,下列哪种化学试剂无法鉴别用黄铜做成的假黄金首饰( )
A.稀盐酸
B.稀硫酸
C.硫酸铜溶液
D.硫酸铝溶液 hanqilu_30001年前1
hanqilu_30001年前1 -
 对影徘徊 共回答了16个问题
对影徘徊 共回答了16个问题 |采纳率87.5%解题思路:在金属活动性顺序中,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来.A、合金中的锌能与盐酸反应生成氢气,表面冒气泡,故A正确;
B、合金中的锌能与稀硫酸反应生成氢气,表面冒气泡,故B正确;
C、合金中的锌能与硫酸铜反应生成铜,表面有红色物质析出,故C正确;
D、铜和锌都不与硫酸铝反应,无法证明,故D错误.
故选D.点评:
本题考点: 金属的化学性质.
考点点评: 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行.1年前查看全部
- 铜锌合金制成的假金元宝欺骗行人的事件屡有发生,下列不易区别其真伪的方法是( )
铜锌合金制成的假金元宝欺骗行人的事件屡有发生,下列不易区别其真伪的方法是( )
A.测定密度
B.放入稀硫酸中
C.放入盐酸中
D.观察外观 kissbenben1年前1
kissbenben1年前1 -
 拉夫堡 共回答了22个问题
拉夫堡 共回答了22个问题 |采纳率95.5%解题思路:利用物质性质上的差异可以很方便地区别它们.A.测定密度,铜锌合金密度小于黄金,测定密度时会发现二者密度不同,密度小者为假,故A正确;
B.放入稀硫酸中,锌与稀硫酸反应生成气体,而黄金与稀硫酸不反应,故B正确;
C.放入盐酸中,锌与盐酸反应生成氢气,而黄金与盐酸不反应,故C正确;
D.观察外观,由于二者的颜色基本一致,所以难于比较为真假,故D错误;
故选D.点评:
本题考点: 金属与合金在性能上的主要差异.
考点点评: 本题考查了真假黄金的鉴别,题目难度不大,可以依据金属的性质进行.1年前查看全部
- 科学两题卡!1.有一块铜锌合金28克,和100克某稀硫酸溶液恰好完全反应,生成氢气0.8克,求合金中铜质量分数和硫酸溶液
科学两题卡!
1.有一块铜锌合金28克,和100克某稀硫酸溶液恰好完全反应,生成氢气0.8克,求合金中铜质量分数和硫酸溶液中的溶质质量分数(主要是化学式)
2.还有就是铜和氧化铜和稀盐酸的化学反应式是什么啊? 番茄菠菜蛋蛋1年前1
番茄菠菜蛋蛋1年前1 -
 石油女工 共回答了15个问题
石油女工 共回答了15个问题 |采纳率100%1.铜与稀硫酸不反应ZN+H2SO4=ZNSO4+H2 0.8g氢气是0.4MOL即锌物资的量为0.4MOL 0.4*64=25.6g 25.6/28=91.45%硫酸更容易,照着这算就行,我就不算了
2.铜与盐酸不反应CuO+2HCl=CuCl2+H2↑1年前查看全部
- 了测定某铜锌合金中锌的质量分数,某同学利用该合金与稀硫酸反应,进行了三次试验,所得相关实验数据如下表(实验中误差不计)
了测定某铜锌合金中锌的质量分数,某同学利用该合金与稀硫酸反应,进行了三次试验,所得相关实验数据如下表(实验中误差不计)
第一次 第二次 第三次
所取合金的质量/g 25 25 50
所用稀硫酸的质量/g 125 160 100
生成氢气的质量/g 0.4 0.4 0.4
(1)计算该铜锌合金中锌的质量分数.
(2)从上表数据分析,当所取合金与所用的稀硫酸的质量比为————时,表示合金中的锌与稀硫酸中的硫酸恰好完全反应, 气不扬1年前1
气不扬1年前1 -
 氤氲郁 共回答了16个问题
氤氲郁 共回答了16个问题 |采纳率75%(1)由第一次、第二次所产生的氢气质量相同可知两次反应皆为完全反应.由题意得:
设铜锌合金中锌的质量为Xg
H2SO4+Zn===H2+ZnSO4
65 2
X 0.4g
0.4g/2=X/65
x/65=0.2g
x=13g
铜锌合金中锌的质量分数=13g/25g=52%
由题意得出
M铜锌合金/稀硫酸=25g/100g
M铜锌合金/M稀硫酸=1/4
M铜锌合金:M稀硫酸=1:4
答:铜锌合金中锌的质量分数为52%,当所取合金与所用的稀硫酸的质量比为1:4时,表示合金中的锌与稀硫酸中的硫酸恰好完全反应.1年前查看全部
- 铜锌合金10G与100G稀硫酸完全反应,烧杯中剩余物质总质量109.2G求铜的质量分数反应后所得溶液的质量分数.
 随心派uu1年前1
随心派uu1年前1 -
 upstones 共回答了23个问题
upstones 共回答了23个问题 |采纳率100%生成氢气的质量=10+100-109.2=0.8克,
生成氢气的物质的量=0.8/2=0.4摩
则反应掉的锌的物质的量也是0.4摩,
反应掉锌的质量=0.4×65=26克
生成0.8克氢气需要锌26克>10克,所以铜锌合金10克,说明题目有点不对头.1年前查看全部
- 不法分子常常用金光闪闪的“金元宝”(铜锌合金)来蒙骗人们,下列鉴别方法中错误的是(填代号)______ (A.加盐酸
不法分子常常用金光闪闪的“金元宝”(铜锌合金)来蒙骗人们,下列鉴别方法中错误的是(填代号)______(A.加盐酸B.测密度C.用火烧D.看颜色);你认为其中较简单易行的鉴别方法是(填代号)______,详细的鉴别过程为:______.  蓝逃1年前1
蓝逃1年前1 -
 九月素素 共回答了19个问题
九月素素 共回答了19个问题 |采纳率94.7%A、放入盐酸中,锌与盐酸反应生成氢气,有气体放出者为假,可以区别真伪,故A正确;
B、测定密度,铜锌合金密度小于黄金,测定密度时会发现二者密度不同,密度小者为假,可以区别真伪,故B正确,但是这种方法比较麻烦;
C、铜锌合金中的铜和氧气会生成黑色的氧化铜,而金不会与氧气反应,现象不同,可以区别真伪,故C正确;
D、由于二者的颜色都是金黄色的,观察颜色不能比较真假,故D错误.
故答案为:D;A(或C);将“金元宝”放入装有适量稀盐酸的烧杯中,表面有气泡产生,证明是假的(或将“金元宝”用火烧,表面变黑的是假的).1年前查看全部
- (7分)“黄铜”是铜锌合金,具有较强机械性能,街头许多“金色”饰品就是用它来制作的。某研究性学习小组为了测定黄铜中铜的质
(7分)“黄铜”是铜锌合金,具有较强机械性能,街头许多“金色”饰品就是用它来制作的。某研究性学习小组为了测定黄铜中铜的质量分数,称取20g黄铜样品,放入烧杯中,然后加入某浓度的稀盐酸100 g(足量),用玻璃棒搅拌至不再产生气泡为止(反应的化学方程式为:Zn+2HCl====ZnCl 2 +H 2 ↑),称量剩余物质的总质量为119.8g。请计算:
⑴实验过程中,产生氢气的质量 __ ,你的计算依据是 。
⑵该铜锌合金中铜的质量分数。 tyhg123451年前1
tyhg123451年前1 -
 给自己的未来 共回答了29个问题
给自己的未来 共回答了29个问题 |采纳率89.7%(7分)
⑴0.2g 2分
设反应消耗锌的质量为m(Zn)
⑵Zn+2HCl====ZnCl 2 +H 2 ↑
65 2
m(Zn) 0.2g 2分
m(Zn)=65×0.2g/2
="6.5g " 2分
w(Cu)=20g-6.5g/20g×100% 1分
=67.5 %
答: 该铜锌合金中铜的质量分数为67.5 %。
略1年前查看全部
- 某化学小组利用如图所示装置测定铜锌合金样品中锌的质量分数(图中固定装置已略去)探究过程如下:
 某化学小组利用如图所示装置测定铜锌合金样品中锌的质量分数(图中固定装置已略去)探究过程如下:
某化学小组利用如图所示装置测定铜锌合金样品中锌的质量分数(图中固定装置已略去)探究过程如下:
I连接实验装置并检查装置气密性
II向B中加入质量为m的铜锌合金粉末,由注射器A向B缓缓加入稀硫酸,待B中不再有气体产生气体时,夹紧弹簧夹,立即移出D中导管,准确读取并记录量筒内水的体积.
III经过滤等操作,准确称量并记录B中剩余固体物质的质量.
IV该小组的甲同学根据反应前后B中固体物质的质量计算样品中锌的质量分数;乙同学认定量筒内测得水的体积
即为反应生成气体的体积,并利用该气体在常温下的密度,根据化学方程式进行相关计算,得到样品中锌的质量分数.请回答下列问题:
(1)Ⅲ中,正确的操作顺序是:过滤、______、______、称量.
(2)通过误差分析,化学小组发现乙同学所用数据不可靠.造成该数据不可靠的原因及其对计算结果的影响是:
①II中,移出D中的导管内留存有水,导致计算结果偏小.
②______.
…
(3)日常生活中为方便使用通常将金属制成合金,伍角币为钢芯镀铜、一元币为钢芯镀镍(Ni)合金
①铸造以上硬币用到的材料都是______材料
②选择铸造硬币的材料不需要考虑的因素是______(填序号).
A.金属的导电性B.金属的耐腐蚀性
C.金属的硬度D.金属价格与硬币面值的吻合度
③以上硬币涉及到Fe、Cu、Al、Ni(镍),已知Ni能够发生如下反应:
Ni+H2SO4=NiSO4+H2↑Fe+NiCl2=Ni+FeCl2
四种金属活动性由强到弱的顺序为______(用元素符号表示). bobolin1年前1
bobolin1年前1 -
 aicrebecca 共回答了19个问题
aicrebecca 共回答了19个问题 |采纳率100%(1)从铜和硫酸锌溶液的混合物中得到铜,先进行过滤,得到沾有硫酸锌溶液的铜,再进行洗涤除去表面的硫酸锌,再进行干燥除去水即可;(2);由于锌与硫酸反应生成硫酸锌和氢气时,放出热量,如果没等冷却到室温,根...1年前查看全部
- 取20g铜锌合金于烧杯中,向其中加入一定质量的溶质质量分别为9.8%的稀硫酸,恰好完全反应后,生成
取20g铜锌合金于烧杯中,向其中加入一定质量的溶质质量分别为9.8%的稀硫酸,恰好完全反应后,生成
0.2g气体
1.该合金中铜的质量分数
2.完全反应后所得溶液中溶质的质量分数(结果精确到0.1%) 829pub1年前1
829pub1年前1 -
 啊啊地 共回答了17个问题
啊啊地 共回答了17个问题 |采纳率82.4%Zn+H2SO4=ZnSO4+H2↑
65 98 161 2
X Z Y 0.2,X=6.5克;Y=16.1克;Z=9.8克.硫酸溶液质量=9.8/9.8%=100克
1、铜的质量分数=(20-6.5)/20=67.5%
2、溶质的质量分数=16.1/(100+6.5-0.2)=15.1%1年前查看全部
- 比理解应用题有一块铜锌合金,其中铜与锌的比是2:3,现在加入锌6克,共得到新合金36克,求在新合金中铜与锌的比.
 tyjyag1年前2
tyjyag1年前2 -
 freetsinghua 共回答了23个问题
freetsinghua 共回答了23个问题 |采纳率87%2:3,现在加入锌6克,共得到新合金36克,
求在新合金中铜与锌的比.
[(36-6)*2/5]:[(36-6)*3/5+6]=1:2
在新合金中铜与锌的比1:2.1年前查看全部
- 为什么铜锌合金用化学式写出来后只有锌而没铜呢?
为什么铜锌合金用化学式写出来后只有锌而没铜呢?
如题,谁能告诉小弟下! 回耳闻1年前1
回耳闻1年前1 -
 benben_bear 共回答了19个问题
benben_bear 共回答了19个问题 |采纳率94.7%是不是你的那个反应条件中铜并不参与反应?
铜的化学性质比较稳定,如果是高中化学题什么的,有可能就是我说的情况了,真正参与反应的只是合金中的某些成分.
比如说铜就不能和盐酸反应,如果把合金丢入盐酸中,就只有锌参与反应,铜不参与,化学式中自然就没铜了1年前查看全部
大家在问
- 1给下面一列分式:x的立方/y,-x的五次方/y的平方,x的7次方/y的立方,-x的9次方/y的4次方,...(其中x≠0
- 2to+现在完成时的用法
- 3电大管理会计试题1、为保证管理会计信息质量对决策有用,通常要求将有关的未来信息估计误差控制在决策者 可以接受的一定可信区
- 4高中数学考试题已知斜率为-1且过点(2,1)的直线l与圆C:(x-1)的平方+Y的平方=4 相交与A,B俩点。(1)求直
- 5谁知道形容女人既有学问、又做得一手好饭、又平易近人,还楚楚动人的词、句或是诗词的,求教!
- 6They dicides what they will do next.改为同义句 They dicides _____
- 7英语翻译明天早上就要用了,帮忙翻译下这段话.碉堡象征着我们每一个人都是不可分的,不可缺少的,我们团结在一起守护着我们的友
- 8(x减9)乘12分之1=8解方程
- 9高中化学重要的工业生产反应有哪些?
- 10已知,如图AB,CD,EF互相平分点O,求证:<AEC=<BFD
- 11品味下面句子运用修辞手法的表达效果.
- 12那次以前和那次以后都是成语吗?这是两个成语吗?是的话请用这两个成语分别造一句.
- 13多个定语从句并列时第二个句子的关系词是否可省略
- 14斜面长为20m,高为2.4m,其机械效率为80%.某人将重为104N的物体从底端拉到顶端.求(1
- 15(1)用如图甲的电路图测电源的电动势和内电阻,提供的器材如图乙所示.某次实验数据作出的U-I图线如图丙所示.
