硫铁矿又称黄铁矿,是生产硫酸的原料,其主要成分为FeS2.850℃~900℃时,硫铁矿在纯净的氧气中煅烧,可能发生下列反
 tt深圳010102022-10-04 11:39:541条回答
tt深圳010102022-10-04 11:39:541条回答① 3FeS2+8O2→Fe3O4+6SO2 ② 4FeS2+11O2→2Fe2O3+8SO2
⑵480 g纯净的FeS2在氧气中完全反应,若所得固体中,Fe和O的物质的量之比
n(Fe)∶n(O)=4∶a,此时消耗氧气b mol.
② b的最小值为_______▲ ____.

已提交,审核后显示!提交回复
共1条回复
 平安成都 共回答了12个问题
平安成都 共回答了12个问题 |采纳率100%- 从题目给出的反应方程式可以看出,FeS2中S元素消耗O2不管按照哪个反应进行都是一样多的(因为都是生成SO2),耗氧量多少关键是看Fe元素最后转化成什么.
如果转化为含O较少的Fe3O4,消耗氧就少;反之转化成含O较多的Fe2O3,则消耗O2就多.
480gFeS2物质的量为480g÷120g/mol=4mol,其中的含8molS原子和4molFe原子,S转化为SO2消耗8molO2,则Fe消耗的O2就是(b-8)mol,根据题意可知n(Fe) : n(O) = 4 : a = 4 : 2(b-8),解得:2b = a+16.
当FeS2全部生成含氧的质量分数较大的Fe2O3时,消耗氧最多,Fe2O3中n(Fe) : n(O) = 4 : a = 2 : 3,也就是a = 6,此时2b = a+16 = 22,b = 11.
当FeS2全部生成含氧的质量分数较小的Fe3O4时,消耗氧最少,Fe2O3中n(Fe) : n(O) = 4 : a = 3 : 4,也就是a = 16/3,此时2b = a+16 = 64/3,b = 32/3.
这是因为要解释a与b的关系才这样算的,如果只是要求出耗氧量的最小值,完全可以根据反应方程式计算得出.
3FeS2+8O2→Fe3O4+6SO2
3 8
4 x
x = 32/3
4FeS2+11O2→2Fe2O3+8SO2
4 11
4 y
y = 11 - 1年前
相关推荐
- 石膏:重晶石:绿矾:明矾:硫铁矿:
 chenmq1年前2
chenmq1年前2 -
 猢猢 共回答了14个问题
猢猢 共回答了14个问题 |采纳率92.9%CaSO4.2H2O
BaSO4
FeSO4.7H2O
KAl(SO4)2.12H2O
FeS1年前查看全部
- 1吨Fes2质量分数为60%的硫铁矿(杂质不含硫),在一定条件下反应制得 吨98%的浓硫酸(社第一部反映损失2%S 95
1吨Fes2质量分数为60%的硫铁矿(杂质不含硫),在一定条件下反应制得 吨98%的浓硫酸(社第一部反映损失2%S 95%
 藏青朱槿1年前1
藏青朱槿1年前1 -
 年轻一次 共回答了18个问题
年轻一次 共回答了18个问题 |采纳率94.4%60% ×1000= 600KG Fes2
600 ×[ [32×2] ÷[64+56]]×[1-0.02]=313.6KG S1年前查看全部
- 高一学的都忘了:硫铁矿是工业上制硫酸的主要原料。硫铁矿氧化培烧的化学反应如下:3FeS2+8O2=Fe2O3+6SO2.
高一学的都忘了:硫铁矿是工业上制硫酸的主要原料。硫铁矿氧化培烧的化学反应如下:3FeS2+8O2=Fe2O3+6SO2. 4FeS2+11O2=2Fe2O3+8SO2.若48molFeS2完全反应耗用氧气2934.4L(标准状况),计算反应产物中Fe3O4与Fe2O3物质的量之比。要过程,我有答案。
 337ff31年前1
337ff31年前1 -
 finwind 共回答了18个问题
finwind 共回答了18个问题 |采纳率83.3%用十字交叉法2934.4LO2是131mol若48molFeS2全部生成Fe3O4,耗氧气8*16=128mol 实际消耗氧气 131mol若48molFeS2全部生成Fe2O3,耗氧气11*12=132mol十...1年前查看全部
- 含硫40%的硫铁矿,燃烧时损失FeS(2) 5%,问生产1吨98%的硫酸需这种矿石多少吨
 gksheng1年前1
gksheng1年前1 -
 垃圾的很 共回答了20个问题
垃圾的很 共回答了20个问题 |采纳率75%设生产1吨98%的硫酸需这种矿石m吨
4FeS2 + 11 O2 === 2 Fe2O3 + 8SO2
4 8
(1-40%-5%)m x=2*(1-40%-5%)m
S + O2 == SO2
1 1
0.4m y=0.4m
根据硫守恒
1吨98%的硫酸中硫酸的质量为0.98t
SO2---SO3----------------------------H2SO4
1 1
2*(1-40%-5%)m +0.4m 0.98
所以2*(1-40%-5%)m +0.4m =0.98
计算出m的值就可以了1年前查看全部
- 有关[苯]的一道合成题写出用苯 硫铁矿石 煤 空气 水 和必要的催化剂为原料和催化剂,制取苯磺酸 和硝基苯的化学方程式
 656471a1年前2
656471a1年前2 -
 山东小二哥 共回答了15个问题
山东小二哥 共回答了15个问题 |采纳率86.7%无非是要得到硫酸和硝酸
制硫酸
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
2SO2 + O2 =V2O5= 2SO3
再用硫酸吸收后的发烟硫酸 稀释 SO3 + H2O = H2SO4
制硝酸
C + H2O =高温= CO + H2
N2 + 3H2 = 2NH3
4NH3 + 5O2 =催化剂= 4NO + 6H2O
2H2O + 4NO + 3O2 = 4HNO3
然后与苯反应即可
苯磺酸直接由发烟硫酸制得
C6H6 + H2SO4·SO3 = C6H5SO3H + H2SO4
硝基苯
C6H6 + HONO2 =H2SO4(浓)= C6H5-NO2 + H2O1年前查看全部
- 高中化学计算题,很重要的一题硫铁矿石(主要成分FeS2)用于工业制硫酸,其排出的矿渣在一定条件下以磁性铁为主.经磁选获得
高中化学计算题,很重要的一题
硫铁矿石(主要成分FeS2)用于工业制硫酸,其排出的矿渣在一定条件下以磁性铁为主.经磁选获得精矿,可直接用于高炉炼铁.已知某精矿的主要成分是磁性铁(Fe3O4)和Fe2O3及杂质(杂质不含铁、硫、氧元素,且杂质不耗氧).请回答下列问题:
59.煅烧硫铁矿常用富氧空气.从沸腾炉排出的气体成分如下表.如果精矿中铁、氧的物质的量之比为n(Fe)∶n(O)=5∶7,则富氧空气中O2和N2的体积比为---------?
气体 SO2 N2 O2
物质的量(mol)10586
 冰雪无迹1年前1
冰雪无迹1年前1 -
 AK_gg 共回答了22个问题
AK_gg 共回答了22个问题 |采纳率95.5%假设生成5molFe的氧化物,同时生成10molSO2
消耗O2的物质的量为(7/2)+10=27/2mol
于是原有O2:(27/2)+6=39/2mol
原有N2:58mol
于是所求=(39/2)/58=39/1161年前查看全部
- 硫酸在生产中有广泛的应用,某厂以硫铁矿为主要原料生产硫酸。
硫酸在生产中有广泛的应用,某厂以硫铁矿为主要原料生产硫酸。

已知:①550℃时,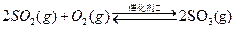

②一定温度下,硫铁矿在空气中煅烧可能发生下列反应(设空气中 与
与 的体积
的体积
比为4:1): ,
,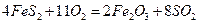
(1) 550℃时,6.4 g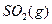 与足量
与足量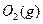 充分反应生成
充分反应生成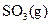 ,放出热量
,放出热量
9.83 kJ
(填“大于”、“等于”或“小于”)o
(2)欲使反应①的平衡向正反应方向移动,下列措施可行的是 。(填字母)
a.向平衡混合物中充入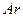 b.向平衡混合物中充入
b.向平衡混合物中充入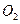
c.改变反应的催化剂d.降低反应的温度
(3)为使 完全生成
完全生成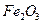 ,生产时要使用过量的
,生产时要使用过量的
空气,则当空气过量50%时,所得炉气中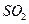 的
的
体积分数是多少?
(4)720 g纯净的 在空气中完全煅烧,所得固体
在空气中完全煅烧,所得固体
中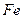 和
和 的物质的量之比n(
的物质的量之比n(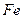 ):n(
):n( )="6:"
)="6:" 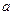 ,
,
此时消耗空气为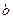 mol。
mol。
①试写出易与口的关系式: 。
②请在右图中画出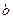 与
与 的关系曲线。
的关系曲线。 sdmg1年前1
sdmg1年前1 -
 月夜路灯 共回答了23个问题
月夜路灯 共回答了23个问题 |采纳率87%(1)小于(2)bd
(3)设FeS 2 为1 mol,完全煅烧需要的 n (O 2 ) =" 2.75" mol,生成 n (SO 2 ) =" 2" mol;
空气过量50%,所需空气为:2.75 ÷ 0.2 × 1.5 =" 20.625" mol;
SO 2 体积分数为:2 ÷ ( 20.625 + 2- 2.75) = 10.0%
(4)① b = 2.5 a + 60
②端点为(8,80)、(9,82.5)之间的一条线段
略1年前查看全部
- 1t含硫48%的硫铁矿制成硫酸,在吸收氨气制成硫酸氨,在理论上可制硫酸氨( )吨
1t含硫48%的硫铁矿制成硫酸,在吸收氨气制成硫酸氨,在理论上可制硫酸氨( )吨
A.1.98 t B2.52t C.2.14 t D.2.26 t
请给出具体原因和过程 songt19791年前1
songt19791年前1 -
 孟云 共回答了16个问题
孟云 共回答了16个问题 |采纳率100%“理论上”的意思是硫元素不损耗……
原硫铁矿中硫元素质量为1t*48%=0.48t,制成硫酸后硫元素质量仍为0.48t
硫酸铵【你打错字了】中硫元素的质量分数为32/132【S/(NH4)2SO4】,实际有硫元素0.48t,因此可制得硫酸铵质量
0.48t/(32/132)=1.98t
因此选A1年前查看全部
- 硫铁矿高温下空气氧化产生二氧化硫:4FeS 2 +11O 2 →8SO 2 +2Fe 2 O 3 设空气中N 2 、O
硫铁矿高温下空气氧化产生二氧化硫:4FeS 2 +11O 2 →8SO 2 +2Fe 2 O 3 设空气中N 2 、O 2 的含量分别为0.800和0.200(体积分数,以下气体含量均用体积分数表示),试完成下列各题:
(1)1.00mol FeS 2 完全氧化,需要空气的体积(标准状况)为__________L
(2)55L空气和足量FeS 2 完全反应后,气体体积(同温同压)变为__________L
(3)用空气氧化FeS 2 产生的气体混合物中,O 2 的含量为0.0800,计算SO 2 的含量。
(4)设FeS 2 氧化产生的气体混合物为100L,其中O 2 为aL,SO 2 为bL。
① 写出a和b的关系式
② 在下图中画出a和b的关系曲线(FeS 2 氧化时,空气过量20%)
说明:为方便作图,纵坐标用13b表示
 哈哈哈haha1年前1
哈哈哈haha1年前1 -
 lrdd8 共回答了13个问题
lrdd8 共回答了13个问题 |采纳率84.6%1年前查看全部
- 工业上煅烧硫铁矿制取硫酸,若要生产1.6t百分之98的浓硫酸,需要标准状况下的空气(设空气中氧气占1/5)
工业上煅烧硫铁矿制取硫酸,若要生产1.6t百分之98的浓硫酸,需要标准状况下的空气(设空气中氧气占1/5)
多少立方米?
答案是3360,怎么算的? 胖法海1年前1
胖法海1年前1 -
 不要爱上我 共回答了23个问题
不要爱上我 共回答了23个问题 |采纳率82.6%4FeS2+11O2==高温==2Fe2O3+8SO2
2SO2+O22SO3(注意可逆号)
SO3+H2O==H2SO4
则需要三氧化硫1.6×98%/98×1000=16mol;
需要氧气=(8+22)=30mol;
需要空气=30×5×22.4=3360L;
自己算算,思路就是这样.
有问题请追问!1年前查看全部
- 工业上用含80% FeS 2 的硫铁矿制取硫代硫酸钠,涉及到的化学反应如下(杂质不与O 2 、盐酸反应):
工业上用含80% FeS 2 的硫铁矿制取硫代硫酸钠,涉及到的化学反应如下(杂质不与O 2 、盐酸反应):
4FeS 2 +11O 2 2Fe 2 O 3 +8SO 2 ①
2Fe 2 O 3 +8SO 2 ①
FeS 2 +2HCl→ FeCl 2 +H 2 S↑+S↓②
2H 2 S+SO 2 → 3S+2H 2 O③
2NaOH+SO 2 →Na 2 SO 3 +H 2 O④
Na 2 SO 3 +S Na 2 S 2 O 3 ⑤
Na 2 S 2 O 3 ⑤
通过分析上述反应,进行计算:
(1)若在某密闭容器中加入150 g上述硫铁矿,并通入10 mol含氧气体积分数为0.4的富氧空气,按反应①充分反应后得到的气体中SO 2 的体积分数为__________(计算结果保留3位小数)。
(2)若以上各步反应的转化率均为100%,则150 g上述硫铁矿理论上最多可制得Na 2 S 2 O 3 ___ g。
(3)若NaOH溶液吸收SO 2 的吸收率为90%,其它反应的转化率均为100%,则150 g上述硫铁矿最多可制得Na 2 S 2 O 3 多少g(写出计算过程,计算结果保留1位小数)?
(4)若反应②、④的转化率为90%,其它反应的转化率均为100%,要制得Na 2 S 2 O 3 最多,则原料中FeS 2 在反应①和②中的理论质量配比为多少(写出计算过程,计算结果保留3位小数)? ahzyf20031年前1
ahzyf20031年前1 -
 sweetbeantt 共回答了16个问题
sweetbeantt 共回答了16个问题 |采纳率93.8%(10分)
(1)0.216(2分)。(2)158 g(2分)。(3)149.7 g(3分)。(4)1.475(3分)
略1年前查看全部
- 以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3•6H2O)的某种工艺流程如下:
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3•6H2O)的某种工艺流程如下:

回答下列问题:
(1)硫铁矿“焙烧”中反应的化学方程式为:3FeS2+8O2
□+6SO2,则□中的化学式为______,反应中化合价升高的元素有______.焙烧 .
(2)“酸溶”中反应的化学方程式为______
(3)“过滤”后滤液中金属阳离子有(写离子符号)______
(4)“氧化”中反应的离子方程式为______. 冷雨下不完1年前1
冷雨下不完1年前1 -
 我变成了他的公主 共回答了17个问题
我变成了他的公主 共回答了17个问题 |采纳率82.4%解题思路:硫铁矿通入空气煅烧生成的铁的氧化物依据化学方程式定量关系和一种守恒判断为四氧化三铁,加入盐酸溶解过滤得到滤液为氯化铁、氯化亚铁溶液,通入氯气氧化亚铁离子,通过蒸发浓缩冷却结晶过滤洗涤得到氯化铁晶体粗品;
(1)依据元素守恒计算书写化学式,标注因素化合价判断化合价升高的元素;
(2)四氧化三铁和盐酸反应生成氯化铁、氯化亚铁和水;
(3)过滤得到溶液中含有亚铁离子、铁离子;
(4)氯气氧化亚铁离子生成铁离子.硫铁矿通入空气煅烧生成的铁的氧化物依据化学方程式定量关系和一种守恒判断为四氧化三铁,加入盐酸溶解过滤得到滤液为氯化铁、氯化亚铁溶液,通入氯气氧化亚铁离子,通过蒸发浓缩冷却结晶过滤洗涤得到氯化铁晶体粗品;
(1)依据元素守恒计算书写化学式为Fe3O4,标注因素化合价判断化合价升高的元素为Fe、S,故答案为:Fe3O4;Fe、S;
(2)四氧化三铁和盐酸反应生成氯化铁、氯化亚铁和水,反应的化学方程式为:Fe3O4+8HCl=2FeCl3+FeCl2+4H2O,故答案为:Fe3O4+8HCl=2FeCl3+FeCl2+4H2O;
(3)四氧化三铁和盐酸反应生成氯化铁、氯化亚铁和水,过滤得到溶液中含有亚铁离子、铁离子,故答案为:Fe2+、Fe3+;
(4)氯气氧化亚铁离子为铁离子,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查了物质分离和提纯的方法,实验操作,流程分析,掌握物质性质和除杂原则是解题关键,题目较简单.1年前查看全部
- 接触法制硫酸的生产过程中焙烧硫铁矿(含FeS2)时发生的主要化学反应是( )
接触法制硫酸的生产过程中焙烧硫铁矿(含FeS2)时发生的主要化学反应是( )
A.FeS2
FeS+S△ .
B.4FeS2+11O2
2Fe2O3+8SO2△ .
C.4FeS2+15O2
2Fe2O3+8SO3△ .
D.4FeS2+3O2
2Fe2O3+8S△ . honshu1年前1
honshu1年前1 -
 moonwei 共回答了20个问题
moonwei 共回答了20个问题 |采纳率95%解题思路:由工业制硫酸的工艺流程可知,铁矿石在沸腾炉中燃烧生成二氧化硫和氧化铁,接触室中二氧化硫催化氧化为三氧化硫,吸收塔中吸收三氧化硫生成硫酸;所以生产过程中焙烧硫铁矿(含FeS2)时发生的主要化学反应是铁矿石在沸腾炉中燃烧生成二氧化硫和氧化铁,采用最小公倍数法利用质量守恒定律即可解答.接触法制硫酸的生产过程中焙烧硫铁矿(含FeS2),是铁矿石在沸腾炉中燃烧生成二氧化硫和氧化铁,FeS2+O2→Fe2O3+SO2,以Fe元素为标准,其最小公倍数为2,FeS2的化学计量数为2,Fe2O3的化学计量数为1,SO2的化学计量...
点评:
本题考点: 工业制取硫酸.
考点点评: 本题主要考查了接触法制硫酸的生产过程中焙烧硫铁矿反应原理,熟悉反应原理掌握最小公倍数法配平是解答的关键,题目难度不大.1年前查看全部
- 以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3•6H2O)的工艺流程如下:
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3•6H2O)的工艺流程如下:
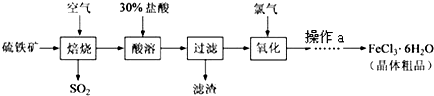
回答下列问题:
(1)在一定条件下,SO2转化为SO3的反应可表示为2SO2(g)+O2(g)⇌2SO3(g),该反应的平衡常数表达式为K=K=c2(SO3) c(O2)•c2(SO2) K=;过量的SO2与NaOH溶液反应的化学方程式为______.c2(SO3) c(O2)•c2(SO2)
(2)用36.5%(密度为1.2g•cm-3)的盐酸的配制500mL的9mol/L的盐酸,所需玻璃仪器是______.
A.玻璃棒B.烧杯C.托盘天平D.量筒E.500mL容量瓶F.胶头滴管
(3)酸溶及后续过程中均需保持盐酸过量,其目的是______、______.
(4)通氯气氧化后时,发生的主要反应的离子方程式为______;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为______(写化学式).
(5)操作a为______、过滤、洗涤、干燥. maaya1年前1
maaya1年前1 -
 beanb 共回答了14个问题
beanb 共回答了14个问题 |采纳率85.7%解题思路:(1)依据化学平衡常数概念写出计算式;用平衡状态下生成物浓度的幂次方乘积除以反应物浓度的幂次方乘积;过量二氧化硫和氢氧化钠溶液反应生成亚硫酸氢钠;
(2)根据溶液配制的仪器进行解答;
(3)原料中的硫化亚铁酸浸后生成的氯化铁是目标物质,加入过量盐酸是抑制铁离子的水解,使更多的铁元素转化为氯化亚铁;
(4)氯气是强氧化剂,可以氧化亚铁离子;尾气依据流程图分析判断,有氯气和盐酸挥发出的氯化氢气体;
(5)由溶液获得晶体需加热蒸发、冷却结晶.(1)在一定条件下,SO2转化为SO3的反应为2SO2+O2
催化剂
.
△2SO3,该反应的平衡常数表达式为K=
c2(SO3)
c(O2)•c2(SO2);
过量的SO2与NaOH溶液反应的化学方程式为:SO2+NaOH=NaHSO3;
故答案为:K=
c2(SO3)
c(O2)•c2(SO2);SO2+NaOH=NaHSO3;
(2)用36.5%(密度为1.2g•cm-3)的盐酸的配制500mL的9mol/L的盐酸,用量筒量浓盐酸、在烧杯中溶解,用玻璃棒引流注入容量瓶,用胶头滴管定容,所以用到主要的玻璃仪器有:量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管,
故答案为:ABDEF;
(3)酸溶及后续过程中均需保持盐酸过量,其目的是使氧化铁溶解为氯化铁,抑制铁离子的水解;
故答案为:提高铁元素的浸出率;抑制Fe3+水解;
(4)通氯气氧化后时,氯气氧化亚铁离子为铁离子,发生的主要反应的离子方程式为:Cl2+2Fe2+=2Cl-+2Fe3+;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为过量的氯气和盐酸溶液中挥发出的氯化氢气体;
故答案为:Cl2+2Fe2+=2Cl-+2Fe3+;Cl2 、HCl;
(5)由溶液获得晶体需加热蒸发、冷却晶体,故答案为:蒸发浓缩、再冷却结晶.点评:
本题考点: 铁盐和亚铁盐的相互转变;化学平衡常数的含义;配制一定物质的量浓度的溶液;制备实验方案的设计.
考点点评: 本题考查了化学平衡的平衡常数计算式书写,流程步骤中的操作目的和反应现象、反应产物的分析判断,尾气的成分判断和处理方法,题目难度中等.1年前查看全部
- 硫铁矿在焙烧后产出的铁渣的含铁量和硫铁矿的含硫量的关系怎么算假设是这个公式:4FeS2+11O2=2Fe2O3+8SO2
硫铁矿在焙烧后产出的铁渣的含铁量和硫铁矿的含硫量的关系怎么算假设是这个公式:4FeS2+11O2=2Fe2O3+8SO2
如题,硫酸沸腾焙烧里面的, jjzxz6661年前1
jjzxz6661年前1 -
 奔腾的芯 共回答了16个问题
奔腾的芯 共回答了16个问题 |采纳率87.5%该题只能假设硫铁矿中的杂质不含S、Fe元素,且焙烧过程中杂质没有质量损失才可以计算.
设硫铁矿质量分数为X,
那么单位重量硫铁矿中的黄铁矿重量为(64+56)/64*X,杂质重量为1-(64+56)/64*X
黄铁矿经焙烧生成氧化铁的重量为(64+56)/64*X*160*2/(4*(64+56))=1.25X
焙烧后铁渣的总重量为(64+56)/64*X*160*2/(4*(64+56))+1-(64+56)/64*X=1-0.625X
烧渣中铁的重量为1.25X*112/160=0.875X
所以:烧渣中铁的品位为0.875X/(1-0.625X)1年前查看全部
- 硫铁矿(主要成分FeS2)是一种铁矿石,用1000吨含二硫化铁60%的硫铁矿,理论上可以炼出几吨铁.用什么物质还原铁
 法律反抗牢1年前1
法律反抗牢1年前1 -
 liubaomin 共回答了13个问题
liubaomin 共回答了13个问题 |采纳率84.6%用CO还原
1000*60%*56/120=280t1年前查看全部
- 在硫酸的工业制法中,下列生产操作与说明的原因二者都正确的是 A.硫铁矿燃烧前需将矿粒粉碎,这样易于向沸腾炉中投料 B.炉
在硫酸的工业制法中,下列生产操作与说明的原因二者都正确的是
A.硫铁矿燃烧前需将矿粒粉碎,这样易于向沸腾炉中投料 B.炉气进入接触室之前需要净化、干燥,因为炉气中的杂质易与SO 2 反应 C.SO 2 氧化为SO 3 时需使用催化剂,这样可提高SO 2 的转化率 D.接触室的反应温度控制在400~500 ℃,因为在该温度范围内催化剂的活性较高  反抢女生tt1年前1
反抢女生tt1年前1 -
 joycehua 共回答了21个问题
joycehua 共回答了21个问题 |采纳率95.2%D
1年前查看全部
- 二氯化锡-重铬酸钾容量法快速测定硫铁矿中全铁量 为什么会偏高
 每天都换1年前1
每天都换1年前1 -
 musicbug 共回答了19个问题
musicbug 共回答了19个问题 |采纳率89.5%你中间加氯化汞了吗?如果加硫和汞会反应所以结果偏高1年前查看全部
- (5分)自来水厂常用氯气杀菌消毒,用明矾、氯化铁等絮凝剂净化水。以硫铁矿(主要成分为FeS 2 )为原料制备氯化铁晶体(
(5分)自来水厂常用氯气杀菌消毒,用明矾、氯化铁等絮凝剂净化水。以硫铁矿(主要成分为FeS 2 )为原料制备氯化铁晶体(FeCl 3 •6H 2 O)的工艺流程如下:
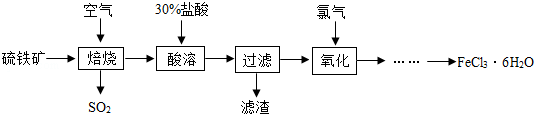
回答下列问题:
⑴实验室过滤操作中玻璃棒的作用是___________。
⑵流程中需用30%的盐酸“酸溶”焙烧后的残渣。若要配制7.4吨质量分数为30%的盐酸,需要质量分数为37%的浓盐酸_________吨,由浓溶液配制稀溶液时,计算的依据是____________________________。
⑶二氧化硫能形成酸雨,危害环境。常用下列方法除去:
方法1.将含二氧化硫的废气通入氨水中吸收二氧化硫。氨水的pH______7(填写“>”“=”或“<”)。
方法2.将含有二氧化硫的废气通入石灰石悬浊液中,在空气作用下生成硫酸钙和二氧化碳,从而除去二氧化硫。写出反应的化学方程式:_____________。 emmawaiting1年前1
emmawaiting1年前1 -
 永无休止1 共回答了16个问题
永无休止1 共回答了16个问题 |采纳率100%⑴引流; ⑵6 ;溶液稀释前后溶质质量不变; ⑶ >; 2CaCO 3 +2SO 2 +O 2 =2CaSO 4 +2CO 2
1年前查看全部
- 一道接触法制硫酸的计算题!含FeS2为a%的硫铁矿d t,在接触法制硫酸过程中,损失硫为c%,接触室中SO2的转化率为e
一道接触法制硫酸的计算题!
含FeS2为a%的硫铁矿d t,在接触法制硫酸过程中,损失硫为c%,接触室中SO2的转化率为e%,可制得浓度为b%的硫酸多少吨? 一辈子恋你1年前1
一辈子恋你1年前1 -
 小楼一夜下大雪 共回答了22个问题
小楼一夜下大雪 共回答了22个问题 |采纳率90.9%设:可制得浓度为b%的硫酸为x
FeS2中S的质量分数是32*2/120*100%=53.3%
S-------------------------------------H2SO4
32 98
d*a%*53.3%*(1-c%)*e% x*b%
x=[98*53.3%*d*a%*(1-c%)e%]/32b%1年前查看全部
- 1.现有1000t纯度为80%的硫铁矿用来生产硫酸,拖SO2氧化成SO3的转化率为90%,三氧化硫的吸收率为95%,则1
1.现有1000t纯度为80%的硫铁矿用来生产硫酸,拖SO2氧化成SO3的转化率为90%,三氧化硫的吸收率为95%,则1000t这种硫铁矿可产生98%的硫酸多少t?
2.含有FeS280%的硫铁矿为原料制取硫酸,若煅烧过程中损失硫4%,SO2氧化成SO3是,转化率为98%,SO3被吸收生成硫酸时要损耗2%,求生成1000t98%的浓硫酸,要消耗硫铁矿多少t? ugijkcghjkgchy1年前1
ugijkcghjkgchy1年前1 -
 幽幽MM 共回答了15个问题
幽幽MM 共回答了15个问题 |采纳率86.7%1、硫铁矿为FeS 应用元素守恒 相对分子质量为88 假设为1000g 计算结束后转化为t 即可 1000*80%/88=9.1mol这就是so2 转化为so3 为9.09*.9=8.2 8.2*0.95/0.98=7.93 这么多mol的硫酸 转化为g 再转化为t即可
2、原理同上 这次反过来 用除法即可 同时 用s元素的质量守恒 1000*98%/98*32/0.98/0.98/0.96 所得数目就是s元素的质量 然后换算到fes中即可1年前查看全部
- 用含10%杂质的硫铁矿FeS2,经接触法制硫酸.在制备过程中,SO2的转化比为98%,SO2转化为SO3和
用含10%杂质的硫铁矿FeS2,经接触法制硫酸.在制备过程中,SO2的转化比为98%,SO2转化为SO3和
SO3转化为硫酸时分别损失4%和5%.求500吨矿石能制多少吨硫酸? heitianshi1年前2
heitianshi1年前2 -
 遛马村遛狗 共回答了23个问题
遛马村遛狗 共回答了23个问题 |采纳率100%根据S元素守恒的原理,得,FeS2~2 SO2~2 SO3~2 H2SO4,设FeS2的物质的量为X,则,X~98%*2X~96%*98%*2X~95%*96%*98%*2X.X=m/M=500*90%*10^6/120=3.75*10^6,所以H2SO4的质量=%95*96%*98%*3.75*10^6=32.84568吨1年前查看全部
- (2012•闵行区二模)硫铁矿石(主要成分FeS2)用于工业制硫酸,其排出的矿渣在一定条件下以磁性氧化铁为主.经磁选获得
(2012•闵行区二模)硫铁矿石(主要成分FeS2)用于工业制硫酸,其排出的矿渣在一定条件下以磁性氧化铁为主.经磁选获得精矿,可直接用于高炉炼铁.已知某精矿的主要成分是磁性氧化铁( Fe3O4)和Fe2O3及杂质(杂质不含铁、硫、氧元素,且杂质不耗氧).请回答下列问题:
(1)某硫铁矿石中(杂质不含铁、硫)含硫的质量分数是0.360,则该硫铁矿石中含铁元素的质量分数是______(答案用小数表示,保留3位小数).
(2)如用上述硫铁矿石制硫酸,矿渣经磁选获得精矿,直接用于高炉炼铁,当制得98.0%的硫酸1.92吨时(不考虑硫的损失),则炼铁厂(不计选矿及炼铁时铁的损耗)最多可生产含碳4.00%的生铁______吨(答案保留3位小数).
(3)煅烧硫铁矿常用富氧空气.从沸腾炉排出的气体成分如下表.如果精矿中铁、氧的物质的量之比为n (Fe):n(O)=5:7,则富氧空气中O2和N2的体积比(最简单的整数比)为______.
(4)炼铁厂生产的生铁常用于炼钢.取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224mL(标准状况下).气体 SO2 N2 O2 物质的量 10 58 6
A计算此钢样粉末中铁和碳的物质的量之比为______(最简单的整数比).
B再取三份不同质量的上述钢样粉末分别加到100mL相同浓度的稀H2SO4中,充分反应后,测得的实验数据如下表所示:
则该硫酸溶液的物质的量浓度为______.实验序号 Ⅰ Ⅱ Ⅲ 加入钢样粉末的质量(g) 2.812 5.624 8.436 生成气体的体积(L)(标准状况) 1.120 2.240 2.800
C若在上述实验II中继续加入m g钢样粉末,计算反应结束后剩余的固体质量为多少?(写出必要的步骤,答案保留3位小数). 血色残梦1年前0
血色残梦1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 一道江苏某年的化学高考题以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:大家可
一道江苏某年的化学高考题
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
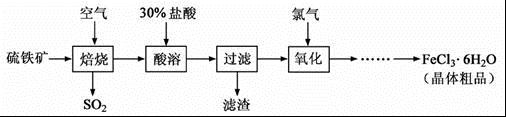
大家可以去查原题啊,它有一问的答案是 提高铁元素浸出率,抑制铁离子水解。难道提高铁元素浸出率不就是抑制铁离子水解吗?为什么要设两空
 s1310602301年前1
s1310602301年前1 -
 colorfulfeather 共回答了13个问题
colorfulfeather 共回答了13个问题 |采纳率76.9%据魔方格专家权威分析,试题“以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工..”主要考查你对 工业生产其他物质(工业制备碳酸锂,硫酸钡等化工原理),亚铁盐(二价铁离子) 等考点的理解。
(1);
(2)提高铁元素的浸出率;抑制Fe3+水解
(3)Cl2+2Fe3+==2Cl-+2Fe3+;Cl2、HCl
望采纳谢谢...1年前查看全部
- 含FeS2 70%的硫铁矿在煅烧时有2%的硫因损失而混入炉渣,则2t这种硫铁矿可制得98%的硫酸多少吨?
 benben20721年前1
benben20721年前1 -
 agou84 共回答了27个问题
agou84 共回答了27个问题 |采纳率92.6%2*0.7*0.533*0.98*3.03/0.98=2.261T
这个结果是元素平衡的结果,太理论化了,实际损耗参数也不能是2%.
如果是现实情况的话,我想硫酸产量应该在2吨以下.1年前查看全部
- 含有40%的硫化亚铁的硫铁矿250吨中,含硫多少吨
 greenappletree1年前2
greenappletree1年前2 -
 沧海升龙 共回答了21个问题
沧海升龙 共回答了21个问题 |采纳率90.5%FeS质量就是40%X250=100t
在FeS中S的质量分数是32/56+32=36.36%
36.36%X100t=36.36t
剩下的60%含S吗?含的话就不是上面这个数了1年前查看全部
- 将7g含杂质的硫铁矿充分灼烧,最后得到固体物质4.8g,求这种矿石中FeS2的质量分数(要有过程)
将7g含杂质的硫铁矿充分灼烧,最后得到固体物质4.8g,求这种矿石中FeS2的质量分数(要有过程)
A.25.7% B.35.7% C.45.7% D.55.7% qingchx1年前1
qingchx1年前1 -
 0362123 共回答了15个问题
0362123 共回答了15个问题 |采纳率100%设混合物中含FeS2xg:
2FeS2----Fe2O3 △m
240 160 80
xg 7g-4.8g
得:240 / xg = 80 / 2.2g
得:x = 6.6
w(FeS2) = 6.6g / 7g * 100% = 94.3%
题目数据应该错了.1年前查看全部
- 硫酸用途很广,工业上通常用煅烧硫铁矿(FeS2)制硫酸.
硫酸用途很广,工业上通常用煅烧硫铁矿(FeS2)制硫酸.
(1)含FeS2 85%的硫铁矿中,硫元素的含量为______(保留二位小数);
(2)若硫铁矿煅烧时损失率为2%,二氧化硫只有92%转化为三氧化硫,三氧化硫的吸收率为95%,则欲制取100吨98%的浓硫酸,需要上述含FeS2 85%的硫铁矿多少? 兜兜飘1年前1
兜兜飘1年前1 -
 567123 共回答了23个问题
567123 共回答了23个问题 |采纳率95.7%解题思路:(1)FeS2的含量乘以FeS2中硫的质量分数;
(2)根据反应的转化关系式计算,关系式为:FeS2~2SO2~2SO3~2H2SO4.(1)FeS2的含量乘以FeS2中硫的质量分数,85%×
2×32
56+2×32×100%=0.45,故答案为:0.45;
(2)反应的转化关系式为:FeS2~2SO2~2SO3~2H2SO4,设需要上述含FeS2 85%的硫铁矿xt,则
FeS2 ~2SO2 ~2SO3 ~2H2SO4.
120g 196g
xt×85%×98%×92%×95% 100t×98%
x=82.41t,
答:需要上述含FeS2 85%的硫铁矿82.41t.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查化学方程式的计算,题目难度中等,注意关系式法的利用.1年前查看全部
- 硫铁矿制取硫酸方程式谢谢```
 yuan03161年前1
yuan03161年前1 -
 heyang79 共回答了26个问题
heyang79 共回答了26个问题 |采纳率92.3%4FeS2+11O2===2Fe2O3+8SO2
2SO2+O22SO3
SO3+H2O==H2SO41年前查看全部
- 燃烧硫铁矿产生二氧化硫气体,为提高二氧化硫的速率,下列措施可行的是
燃烧硫铁矿产生二氧化硫气体,为提高二氧化硫的速率,下列措施可行的是
A.不断添加硫铁矿 B.向炉内吹氧气 C.使用氧化铁做催化剂
为什么选B,那么这么说为什么A就不对了? vmek9dhtao1年前2
vmek9dhtao1年前2 -
 子吟13 共回答了19个问题
子吟13 共回答了19个问题 |采纳率94.7%增加 化学反应速率中 提高反应物的浓度是很重要的一种方式 但是溶剂和固体看成浓度为1 不会改变1年前查看全部
- 煅烧硫铁矿(主要成份是FeS2),可获得制取硫酸所需的SO2
煅烧硫铁矿(主要成份是FeS2),可获得制取硫酸所需的SO2
煅烧硫铁矿(主要成份是FeS2),可获得制取硫酸所需的SO2,反应为:
4FeS2+11O2====2Fe2O3+8SO2,为了提高SO2的生成速率,下列措施可行的是:
A.增加硫铁矿的投入量
B.向炉内喷氧气,增加氧气的浓度
C.降低温度
D.增大压强
D为什么错了.. 乱跳舞1年前1
乱跳舞1年前1 -
 lyxinsha 共回答了21个问题
lyxinsha 共回答了21个问题 |采纳率90.5%增大压强不明确,这里可以加入稀有气体,反应速率不变
增大压强改变反应速率,主要是使气体的单位体积浓度增加
本质是浓度的改变
如果是稀有气体加入,浓度不变,反应速率不变1年前查看全部
- 将7克含杂质的硫铁矿充分灼烧,最后得到固体物质4.8g,这种矿石中FeS2的质量分数为
将7克含杂质的硫铁矿充分灼烧,最后得到固体物质4.8g,这种矿石中FeS2的质量分数为
A25.7% B35.7% C45.7% D55.7% wssosaka1年前1
wssosaka1年前1 -
 guo1912 共回答了17个问题
guo1912 共回答了17个问题 |采纳率82.4%4FeS2+11O2=2Fe2O3+8SO2.减少质量= 8S-6 O
2*120.160
X.7-4.8=2.2
X=240*2.2/160=3.3
矿石中FeS2的质量分数为=3.3/7=47.14%1年前查看全部
- 请问硫铁矿的化学式怎么写?
 恒泰11年前1
恒泰11年前1 -
 肉中刺00 共回答了19个问题
肉中刺00 共回答了19个问题 |采纳率89.5%FeS21年前查看全部
- 把1g含脉石(SiO2)的硫铁矿样品在氧气中灼烧,反应完全后得残渣0.78g,则此黄铁矿的纯度是 A,33% B,66%
把1g含脉石(SiO2)的硫铁矿样品在氧气中灼烧,反应完全后得残渣0.78g,则此黄铁矿的纯度是 A,33% B,66% C,78%
把1g含脉石(SiO2)的硫铁矿样品在氧气中灼烧,反应完全后得残渣0.78g,则此黄铁矿的纯度是
A,33% B,66% C,78% D,88%
为什么此题中生成的是正三价的 铁,而在别的题目中,铁在氧气中生成四氧化三铁,在空气中点燃生成三氧化二铁 qihuoyj1年前3
qihuoyj1年前3 -
 ljzhang 共回答了16个问题
ljzhang 共回答了16个问题 |采纳率81.3%4FeS2+11O2==2Fe2O3+8SO2 质量减小
480 320 160
x 1-0.78
x=0.66
黄铁矿的纯度是0.66/1*100%=66%
是B.
注意:Fe在纯O2中点燃,得到Fe3O4.
铁在空气中不能燃烧,只能加热缓慢氧化,得到铁锈(Fe2O3)
在空气中灼烧含铁物质得到的是Fe2O31年前查看全部
- 把1g含脉石(SiO2)的硫铁矿样品在氧气中灼烧,反应完全后得残渣0.78g,则此黄铁矿的纯度是
把1g含脉石(SiO2)的硫铁矿样品在氧气中灼烧,反应完全后得残渣0.78g,则此黄铁矿的纯度是
A,33% B,66% C,78% D,88%
我需要详细的解法 hexinoo1年前1
hexinoo1年前1 -
 pzw4850 共回答了16个问题
pzw4850 共回答了16个问题 |采纳率93.8%4FeS2+11O2==2Fe2O3+8SO2 质量减小
480 320 160
x 1-0.78
x=0.66
黄铁矿的纯度是0.66/1*100%=66%
正确答案是B.1年前查看全部
- 求二氧化硫转化工段英文文献!求一篇英文文献,内容关于硫铁矿制硫酸的,最好是二氧化硫转化工段的内容,可提供搜索连接,
 江阳1年前1
江阳1年前1 -
 eobk 共回答了16个问题
eobk 共回答了16个问题 |采纳率87.5%硫铁矿制酸新工艺,属于硫铁矿焙烧制酸和烧渣选取铁矿技术领域.包括原料处理和焙烧工序,焙烧工序中硫铁矿经焙烧炉在750~800℃氧化焙烧.另一种硫铁矿制酸新工艺还包括原料处理和焙烧工序,其特征在于硫铁矿经脱硫焙烧后的烧渣在550~570℃下经还原剂还原.本发明通过简单的制酸工艺改进和烧渣的还原处理,能够将硫铁矿烧渣内的铁转化为可磁选的四氧化三铁,使用弱磁磁选机分选能够得到极高品位的铁矿粉,烧渣中铁矿的磁选率能够达到95~96%,不仅能够提高硫酸制酸企业烧渣处理的经济效益,还可以缓解我国钢铁企业的原料紧张的局面,提高我国资源的利用效率.本发明可适用各种品位硫铁矿制酸企业的制酸和选矿工艺.
1、焙烧技术的自主创新和装备的国产化
焙烧工艺是硫铁矿制酸工艺中核心技术,也是生产中事故多发的部位,在当时我国仅有两套大型硫铁矿制酸装置中的焙烧技术和关键设备都是进口的,因本项目无外汇来源,故必须立足技术的自主创新和装备国产化.
(1)工艺流程:焙烧工序国外流程是焙烧炉——废锅——电除器;而国内流程是:焙烧炉——废锅——旋风除尘器——电除尘器.国内技术比国外多一道旋风除尘,要多消耗动力.考虑到本项目使用硫精砂(超细矿)为原料,焙烧炉烧渣全部随炉气带出.加之当时南化引进电除尘器开得不好,酸洗净化改水洗作业,大量污水外排,污染环境,为此本项目采用国内流程.
(2)焙烧炉:炉子设计因原料而异.铜陵项目用超细矿,国内无此经验,而南化引进鲁奇公司设计的焙烧炉恰好也是细矿,经消化吸收又结合本项目原料特性略作调整,取得了先进工艺指标和宽松调节范围.对其不足处:如炉内盘管移热方式由水的强制循环改为自然循环;炉子床层供料点由三处进料改为二处进料(一处定量,一处自调);硫精砂落料点位置由床层的边缘移至中部>?诵薷氖贡荷章?煽俊⒓蚧?侄啪?缚笤诖膊闵隙鸦?投氯?BR> (3)废热锅炉:硫铁矿制酸因炉气带渣尘都采用水管型锅炉,按炉气在炉内走向分横流(水平流)型和W流(错流)型两种.国内只有W型废热锅炉,具有重量轻、体积小等优点,但因气流流向和速度多变,炉管和隔板抗磨性差,致后期管子爆裂事故不断,为焙烧工序最薄弱环节.为此本项目以国内最有经验杭州锅炉厂作为攻关合作伙伴,他们消化吸收国外技术,增设前置炉气沉降塞,分离大颗粒渣尘,从而减缓对下流炉管磨蚀,与此同时还出重金购买上硫厂防磨蚀专有技术,使管子和隔板局部防磨蚀得到加强,基本实现在大修期内不爆管目标.
(4)电除尘器:电除尘器作为最后一道除尘设备,将出设备炉气含尘降至200mg/m3 以下,这样下游冷却洗涤系统只排放少量含尘稀酸即可达到平衡,否则将排放大量含尘酸性废水.当时南化和上硫厂二台电除尘器都没开好,为此本项目以国内最有经验的上海冶金矿山机械厂作为攻关合作伙伴,他们借鉴引进专利设计结构合理,耐温高的除尘器壳体,又借凭他们多年从事硫酸电除尘器设计经验,配置极板和极线,使电除尘器投运后其性能超过引进设备.加之进电除尘前气体经过一道又一道除尘,含尘较低,这样即使出现一个电场(共三电场)故障停开,仍能确保工艺指标.
2、用好引进设备为今后大型硫酸装置国产化打下基础
本项目利用加拿大政府贷款按规定从加方采购不锈钢转化器、酸冷却器、管式酸喷淋器等设备,又由加方转口引进SO2主风机、稀酸泵、浓酸泵等,这些设备均较先进.
为节约用汇,SO2主风机单机无备机操作,设计采取措施提高干吸塔除雾效率,确保安全运行;转化器壳体不能承受较大管道推力,设计对进出转化器大口径高温气体管道均采用波形补偿器补偿,大大减少管道的热应力和为回收干吸工序的低位能热,在中间吸收塔系统酸侧,设计增设锅炉给水预热器与酸冷却器并联使用,使用效果很好.以上技术在国内首次应用均取得了成功经验.
引进的不锈钢转化器具有结构合理、紧凑和重量轻特点,经消化吸收创新,设计出结构简单、体形更小、重量更轻的转化器,在国内迅速得到推广.一些机泵的特性和选材等关键技术也被国内所吸引,为今后大型硫酸装置国产化打下基础.
3、做好废副利用,建设环境友好型社会
铜陵磷铵厂毗邻城市,紧靠长江又处在城市取水口的上游,因而治理好环境更显得重要.本项目从利用好废副入手,重点抓废气治理和废液回用.顺利通过环保部门验收并得到好评.
废渣:硫酸装置排放烧渣,因其残留硫含量低,全部售给水泥企业作辅料利用,且有不菲的收入.
废气:硫酸装置采用二转二吸工艺,转化器一段的一部分和四段使用活性较好的进口催化剂,提高转化率,确保尾气达标排放.细矿干燥尾气采用湿法洗涤,比起其它企业用干法除尘环境卫生状况有明显改善.
废液:硫酸装置采用酸洗净化工艺,只排放少量含尘稀酸,经澄清后送磷酸装置回用,既回收硫酸,又无废液排除,铜陵厂至今仍停开厂区内污水处理装置,这在国内是罕见的.
在1994年我国硫酸产量约1500万吨(其中硫铁矿制酸约占80%),是由500多家企业700多套装置生产的,可见当时我国硫酸装置规模很小,又存在工艺技术落后和环境治理差等问题.本项目首次以自主技术,实现装置的大型化;采用沸腾焙烧、余热回收、酸洗净化和二转二吸先进工艺;环境治理达标并实现单系列、单主机、年累计300天以上操作的良好业绩.本项目投运对推进我国硫酸工业的发展和技术进度具重要意义.为此获得国家“八五”科技攻关嘉奖,国家科技进步二等奖.化工部科技进步一等奖和优秀设计一等奖等奖项.
时隔10年,又为铜陵硫酸二期和宁国两家企业各设计一套年产20万吨硫铁矿制酸装置,并在此基础上再创新.采用横流式锅炉替代W型锅炉;板式冷却器系统替代间冷器;全新的干吸系统替代传统系统;自主开发的不锈钢转化器;节能型开工预热器和先进的DCS系统等.两套装置都已顺利投产.为硫酸行业中又添一支技术先进的生力军.1年前查看全部
- 工业上以硫铁矿为原料制硫酸所产生的尾气中含有SO 2 ,为便于监控,实施环境保护,下列适合测定硫酸尾气SO 2 含量的试
工业上以硫铁矿为原料制硫酸所产生的尾气中含有SO 2 ,为便于监控,实施环境保护,下列适合测定硫酸尾气SO 2 含量的试剂是( )
A.品红溶液 B.浓硫酸 C.碘水、淀粉溶液 D.以上都能  以后再送1年前1
以后再送1年前1 -
 稻草狗 共回答了18个问题
稻草狗 共回答了18个问题 |采纳率77.8%C
A项只适合定性判断SO 2 的存在,不能用来定量计算SO 2 的含量;C项可以用碘水来定量滴定,淀粉可以充当指示剂的作用,C项正确。1年前查看全部
- 煅烧硫铁矿使用的沸腾炉的主要优点是什么?
 娃哈哈l3451年前1
娃哈哈l3451年前1 -
 kx32165498 共回答了18个问题
kx32165498 共回答了18个问题 |采纳率100%首先所谓 硫铁矿 貌似叫 黄铁矿
答:使黄铁矿充分与空气接触 提高SO2的产量 沸腾炉还可以加热.1年前查看全部
- 充分煅烧50g硫铁矿样品,将生成的so2和24go2混合,并在一定条件下反应,将反应后的混合气体用冰水冷却得40g无色晶
充分煅烧50g硫铁矿样品,将生成的so2和24go2混合,并在一定条件下反应,将反应后的混合气体用冰水冷却得40g无色晶体,剩余气体和过量h2s充分反应得44g固体,求(1)so2转化成so3的百分率(2)样品中含fes2的百分含量
 怕我1年前2
怕我1年前2 -
 songheqiu 共回答了16个问题
songheqiu 共回答了16个问题 |采纳率100%设样品中含 S 元素 x gS+O2==SO2(此式不是化学反应方程式,表示硫元素转化而已)则生成 SO2 2x g第二步反应生成 SO3 40 g(冰水只是冷却作用,没跟SO3反应)2SO2+O2==2SO3则有32 g SO2 和16g O2 参与反应第三步反应生...1年前查看全部
- 煅烧粉碎的硫铁矿有利二氧化硫的生成为什么不能用勒沙特列原理解释
 dafwe3321年前1
dafwe3321年前1 -
 cchoonrain 共回答了11个问题
cchoonrain 共回答了11个问题 |采纳率81.8%勒沙特列原理是讲平衡反应的,而硫铁矿燃烧不是一个平衡反应,这个反应很彻底.
粉碎硫铁矿只加速了燃烧过程,没有影响平衡.
另外,通常认为固相的浓度是恒定的,与加入数量无关.因此,即便是一个平衡反应,改变固相的数量和形态通常都不会影响化学平衡.1年前查看全部
- 在氧气中灼烧0.44g硫铁矿,生成的二氧化硫经过一系列变化最终转化为硫酸,用20ml 0.5mol/l的烧碱溶液恰好完全
在氧气中灼烧0.44g硫铁矿,生成的二氧化硫经过一系列变化最终转化为硫酸,用20ml 0.5mol/l的烧碱溶液恰好完全中和这些硫酸,则原混合物中的硫百分含量约为
A 36% B 46% C 53% D 22% 美丽大方的朋友1年前1
美丽大方的朋友1年前1 -
 trsmedia 共回答了29个问题
trsmedia 共回答了29个问题 |采纳率86.2%(0.02*0.5/2)*32/0.44
A1年前查看全部
- 工业上用硫铁矿来制取硫酸 已知沸腾炉中FeS2的损失率为4%,接触室中硫的损失率为2%,计算1000kg含FeS280%
工业上用硫铁矿来制取硫酸 已知沸腾炉中FeS2的损失率为4%,接触室中硫的损失率为2%,计算1000kg含FeS280%的硫铁矿可制得98%的浓硫酸多少kg
 wuchengming03051年前1
wuchengming03051年前1 -
 _g_lat8_f4vo1e10 共回答了17个问题
_g_lat8_f4vo1e10 共回答了17个问题 |采纳率94.1%X=1000*80%*(1-2%-4%)/120*2/98%/98=320Kg1年前查看全部
- 从矿物学资料查得:当蓝矾溶液渗入地下遇硫铁矿FeS2时,可以生成辉铜矿Cu2S,同时还生成硫酸亚铁和硫酸.化学方程式如下
从矿物学资料查得:当蓝矾溶液渗入地下遇硫铁矿FeS2时,可以生成辉铜矿Cu2S,同时还生成硫酸亚铁和硫酸.化学方程式如下:
14CuSO4 + 5FeS2 +12H2O == 7Cu2S + 5FeSO4 + 12H2SO4
在上述反应中,氧化剂是 ,还原剂是 ,氧化产物与还原产物的物质的量之比是 ;生成1molCu2S时转移电子 mol .
这里有很多元素变价,转移电子用单线桥表不清楚的感觉,光是算电子守恒就有点晕乎
S元素到底是如何变价, rumengjinan1年前1
rumengjinan1年前1 -
 luckyboyhao 共回答了24个问题
luckyboyhao 共回答了24个问题 |采纳率87.5%首先你应该明白氧化还原的实质:其本质在高中阶段就是化合价的升降相等、得电子失电子相等.在一个特别复杂的反应或者是说多种元素变价的时候你不用怕,需要做的就是把每一种元素的化合价标出来,分析它们是怎么变化的,以这个反应为例:铜的化合价就是从+2到+1.而硫的化合价有三种:-2、-1、+6这种情况最好判断,当出现三种价态时要么是中间向两边变,要么是两边向中间变,啥意思呢?就是这里硫的化合价-1是中间价态那么一定是-1到-2,-1到+6 这是规律记住就行了,一个铜降低一价14个铜降低14价,一个硫从-1到-2降低一价,七个硫降低七价,现在一共降低14+7=21价,很明显剩下的三个-1价硫升到+6价,一个硫升高7价三个硫升高21价,现在升高降低相等了,很明显氧化剂为FeS2,还原剂为CuSO4和FeS2,你也可以知道生成了7molCu2S转移21mol电子,那么生成1mol的话转移3mol电子,氧化产物是FeSO4注意这里只有三个硫是从-1到+6的所以氧化产物与还原产物之比为3:71年前查看全部
- 关于金属铁、铜,下列说法中:①自然界中均有游离态单质存在②炼铁的矿石主要有赤铁矿、磁铁矿、硫铁矿
关于金属铁、铜,下列说法中:①自然界中均有游离态单质存在②炼铁的矿石主要有赤铁矿、磁铁矿、硫铁矿
③工业炼铁的主要设备是沸腾炉④炼铁中所用还原剂是CO⑤生铁、钢、黄铜都属于合金⑥铁的颜色是银白色,铜显紫红色⑦铜常温下可溶于稀硝酸,
上述说法正确的是( )
A①④⑤⑥⑦
B②④⑥
C③④⑥⑦
D全部
求详解.谢谢.
 只讲标准普通话1年前1
只讲标准普通话1年前1 -
 eeeliu 共回答了21个问题
eeeliu 共回答了21个问题 |采纳率85.7%错误.Fe、Cu都没有游离态.正确.赤铁矿Fe2O3,磁铁矿Fe3O4,硫铁矿FeS2错误.沸腾炉主要应用于接触法制硫酸,作为FeS2制SO2的发生装置正确.Fe2O3 + 3 CO ==高温== 2 Fe + 3 CO2
正确.生铁、钢、黄铜分别属于铁合金、铁合金、铜合金.错误.纯铁是银白色,铁粉是黑色.以偏概全.正确.3 Cu + 8 HNO3(稀) = 3 Cu(NO3)2 + 2 NO↑+ 4 H2O
不知道选哪个.你看着办吧1年前查看全部
- 有关接触法制硫酸,下列说法中不正确的是 A.用硫和硫铁矿均可为原料 .
有关接触法制硫酸,下列说法中不正确的是 A.用硫和硫铁矿均可为原料 .
A,用硫和硫铁矿均可为原料; B,SO2转化为SO3需要催化剂和加热条件下进行;
C,SO3可用水直接吸收; D,热交换器可对生成气体冷却,对原料气加热. jamiemym1年前5
jamiemym1年前5 -
 bullarm 共回答了14个问题
bullarm 共回答了14个问题 |采纳率92.9%本题答,案选C,因为工业上的SO3不可用水直接吸收,会产生酸雾,应该用浓硫酸吸收.1年前查看全部
- 硫铁矿高温下空气氧化产生二氧化硫:4FeS2+11O2→8SO2+2Fe2O3
硫铁矿高温下空气氧化产生二氧化硫:4FeS2+11O2→8SO2+2Fe2O3
硫铁矿高温下空气氧化产生二氧化硫:4FeS2+11O2→8SO2+2Fe2O3,设空气中N2、O2的含量分别为0.800和0.200(体积分数,以下气体含量均用体积分数表示),试完成下列各题:
(4)设FeS2氧化产生的气体混合物为100L,其中O2为aL,SO2为bL.
① 写出a和b的关系式
② 在右图中画出a和b的关系曲线(FeS2氧化时,空气过量20%)
空气过量20%,怎么算? wzhdan1年前1
wzhdan1年前1 -
 zzrt01 共回答了22个问题
zzrt01 共回答了22个问题 |采纳率81.8%气体混合物为100L,其中O2为aL,SO2为bL,所以N2为(100-a-b)L
4FeS2+11O2→8SO2+2Fe2O3 所以反应的氧气为11/8bL
反应前氧气(a+11/8b)L
空气中N2、O2的含量分别为0.800和0.200,所以(100-a-b):(a+11/8b)=4:1
得20a+13b=200,又因为a、b均大于等于0,所以a属于0到20,b属于0到200/13
因为参与反应的气体为氧气,所以空气过量20%可以理解为氧气过量20%
所以11/8b :a= 4 :1 所以a=11/321年前查看全部
- 应用苯、硫铁矿石、空气、水为原料和必要的催化剂制取苯磺酸和硝基苯的化学方程式
 好个大脚1年前1
好个大脚1年前1 -
 youran03 共回答了16个问题
youran03 共回答了16个问题 |采纳率93.8%其实就是考察硫酸工业与硝酸工业还有苯的硝化和磺酸化.
4FeS2 + 11O2 = 2Fe2O3 + 8SO2(高温煅烧)
2SO2 + O2 = 2SO3(可逆,催化剂,加热)
SO3 + H2O = H2SO4
2H2O = 2H2 + O2(电解)
N2 + 3H2 = 2NH3(可逆,高温、高压、催化剂)
4NH3 + 5O2 = 4NO + 6H2O(催化剂、加热)
C6H6 + HO-NO2 → C6H5-NO2 + H2O(浓硫酸,55~60℃)
C6H6 + HO-SO3H → C6H5-SO3H + H2O(60~70℃)1年前查看全部
- 工业上以硫铁矿为原料制硫酸所产生的尾气除了含有N 2 、O 2 外,还含有SO 2 、微量的SO 3 和酸雾。某课外兴趣
工业上以硫铁矿为原料制硫酸所产生的尾气除了含有N 2 、O 2 外,还含有SO 2 、微量的SO 3 和酸雾。某课外兴趣小组设计了如图所示流程来探究硫酸厂尾气的成分。请回答: 
(1)C中炽热铜网可以检验和除去的气体是______________。
(2)①A装置可用于测定硫酸尾气中SO 2 的含量,其中应盛装试剂可能是___________。
A.NaOH溶液、酚酞试液
B.KMnO4溶液、稀H 2 SO 4
C.碘水、淀粉溶液
D.氨水、酚酞试液
②SO 2 是引发酸雨的主要气体之一,因此尾气吸收须经过处理才能排人到大气之中。一般方法是将尾气循环使用后通入氨水中进行吸收。试写出其中可能发生的两个氧化还原反应的化学方程式: ______________,________________。
(3)B中装有碱性干燥剂,D中收集到一种较为纯净的气体。试设计一实验验证其为氮气。 tdzv6_5cuf6b8_c1年前1
tdzv6_5cuf6b8_c1年前1 -
 赖皮猫猫 共回答了25个问题
赖皮猫猫 共回答了25个问题 |采纳率80%(1)O 2
(2)①BC;②2H 2 SO 3 +O 2 = 2H 2 SO 4 ;2(NH 4 ) 2 SO 3 +O 2 = 2(NH 4 ) 2 SO 4
(3)将点燃的镁条插入D中,燃烧完后,加入适量的水,并用湿润的红色石蕊试纸检验生成的气体,若试纸变蓝,说明D中为氮气1年前查看全部
- 硫铁矿与氧气反应方程式
 yjhui19801年前2
yjhui19801年前2 -
 21141582 共回答了20个问题
21141582 共回答了20个问题 |采纳率85%4FeS2+11O2=2Fe2O3+8SO2
工业制硫酸时,课本给的方程式.条件:高温.1年前查看全部
大家在问
- 1一件令我感动的事 作文
- 2The islanders __________ fishing, so they value the waters a
- 3六年级英语作文(过去式的形式):去年假期,你去哪里游玩了?请你把它写成书信的形式告诉你的笔友拜托了
- 4英语翻译亲爱的Anniina,好久不见!我高中的第一年终于在今天结束了,昨天和今天是期末考试,接下来的7月和8月要放暑假
- 5已知:4x2+5x-1=0,求代数式(2x+1)2-x(x-1)+(x+2)(x-2)的值.
- 6为什么要加入稀盐酸?
- 7通计一舟,
- 8妈妈先买了5元4角的西红柿,又买了7元8角的苹果,妈妈一共花了多少元?
- 9I kept him reading the text so that he could recite it quick
- 10关于Al2O3+N2+3C→2ALN+3CO
- 11举反例证明举一反例证明命题"如果两个三角形的三个角分别相等,且有两条边也相等,那么这两个三角形一定全等"是假命题.好的回
- 12根据意思写成语或词语意思:1.没有地方可以让自己藏起来,形容十分羞愧 ( )2.恳切的希望或请求 ( )
- 13是不是所有的的动词后加ing都可作为的形容词,那么加ed呢
- 14百尺竿头,更进一步 意义相同的诗句
- 15问几个四字词语的英文 知恩图报 严谨笃学 志存高远 出类拔萃

