某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.在0.1mol•L-
 qt77y2022-10-04 11:39:541条回答
qt77y2022-10-04 11:39:541条回答 某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.在0.1mol•L-1 MgSO4、0.05mol•L-1 Al2(SO4)3的混合溶液中滴加0.5mol•L-1 NaOH溶液,借助氢离子传感器和相应分析软件,测得溶液的pH随NaOH溶液的加入变化情况如图所示.
某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.在0.1mol•L-1 MgSO4、0.05mol•L-1 Al2(SO4)3的混合溶液中滴加0.5mol•L-1 NaOH溶液,借助氢离子传感器和相应分析软件,测得溶液的pH随NaOH溶液的加入变化情况如图所示.(1)为精确控制加入NaOH溶液的体积,可将NaOH溶液置于______中滴加.(填仪器名称)
(2)图中有三个pH增加缓慢的阶段,第一阶段(a点前)对应的实验现象是______.
(3)对第二阶段(b、c之间)溶液pH变化缓慢的本质,做出如下推测,请补充推测2和3:
推测1:生成Mg(OH)2沉淀,消耗OH-;
推测2:______;
推测3:______.

已提交,审核后显示!提交回复
共1条回复
 飞旅 共回答了22个问题
飞旅 共回答了22个问题 |采纳率81.8%- 解题思路:由图象可知,PH变化缓慢的主要原因应为:生成Mg(OH)2沉淀,消耗OH-;生成Al(OH)3沉淀消耗OH-; Al(OH)3沉淀溶解,消耗OH-三种可能,至于哪一阶段为那种可能,应与 Al(OH)3、Mg(OH)2二者的溶解度有关.
(1)精确控制加入NaOH溶液的体积,应用精确度0.01ml的滴定管,又NaOH呈碱性,故选用碱式滴定管,故答案:碱式滴定管;
(2)由图象可知,PH变化缓慢的主要原因应为:生成Mg(OH)2沉淀,消耗OH-;生成Al(OH)3沉淀消耗OH-; Al(OH)3沉淀溶解,消耗OH-三种可能,第一阶段(a点前)应该是生成沉淀消耗了滴下去的氢氧化钠,故现象为:生成白色沉淀并逐渐增多,故答案:生成白色沉淀并逐渐增多;
(3)根据分析可知,PH变化缓慢的主要原因应为:生成Mg(OH)2沉淀,消耗OH-;生成Al(OH)3沉淀消耗OH-; Al(OH)3沉淀溶解,消耗OH-三种可能,
故答案:生成Al(OH)3沉淀消耗OH-;Al(OH)3沉淀溶解,消耗OH-.点评:
本题考点: 镁、铝的重要化合物.
考点点评: 主要考查了学生根据图象分析反应过程的能力,解题关键还在于熟悉有关镁铝的性质. - 1年前
相关推荐
- 化学题求解答,急!学校研究性学习小组测定Cu-Fe合金、Fe-Zn合金和Fe-Al合金中铁的质量分数,实验室只提供一瓶未
化学题求解答,急!
学校研究性学习小组测定Cu-Fe合金、Fe-Zn合金和Fe-Al合金中铁的质量分数,实验室只提供一瓶未标明质量分数的稀硫酸和必要的仪器.他们取其中一种合金的粉末5.6g与足量该硫酸充分反应,经测定,产生了气体ag.(1)相同质量的锌与铁,产生氢气多的金属是(2)当a大於0.2g时,粉末为(3)当粉末为Cu-Fe合金时,其中铜为80%,消耗10g稀硫酸时恰好反应,求稀硫酸中溶质质量分数为多少?主要第三问,要过程
 fxj751年前1
fxj751年前1 -
 宫本川子 共回答了21个问题
宫本川子 共回答了21个问题 |采纳率81%(3)百分之19.6
解析:1-百分之80=百分之20
百分之20*5.6g=1.12g 为铁的质量
Fe+H2SO4=FeSO4+H2
56 98
1.12 X
X=1.96
1.96/10=0.196=百分之19.61年前查看全部
- 高中生研究性学习报告中开题计划或报告这部分怎么写?
高中生研究性学习报告中开题计划或报告这部分怎么写?
我们的课题是近视.
前面的主体部分(调查分析比较、过程照片等)已经有人写了,我负责的是通知上写的“开题计划或报告”,上网查了后都是内容涵盖了很多主体部分了的.
所以有没有人能简洁点告诉我怎么简洁点写这部分呢? 苦丁茶茶1年前1
苦丁茶茶1年前1 -
 蓝色的小树叶 共回答了13个问题
蓝色的小树叶 共回答了13个问题 |采纳率100%其实毕业设计很也不是那么难的,只要你多花点时间,多查点资料,还是可以自己完成的.1年前查看全部
- (2010•苏州二模)某课外研究性学习小组的同学,通过实验测定浓硫酸吸水性的有关数据,绘制成如图所示的函数图象,其中横坐
 (2010•苏州二模)某课外研究性学习小组的同学,通过实验测定浓硫酸吸水性的有关数据,绘制成如图所示的函数图象,其中横坐标表示时间,纵坐标可表示:①溶质质量分数、②溶液的质量、③溶液的体积④溶液中所含水的质量.其中可能正确的是( )
(2010•苏州二模)某课外研究性学习小组的同学,通过实验测定浓硫酸吸水性的有关数据,绘制成如图所示的函数图象,其中横坐标表示时间,纵坐标可表示:①溶质质量分数、②溶液的质量、③溶液的体积④溶液中所含水的质量.其中可能正确的是( )
A.①②④
B.①②③
C.②③④
D.①③④ 123chah1年前1
123chah1年前1 -
 有妻有妾 共回答了15个问题
有妻有妾 共回答了15个问题 |采纳率100%解题思路:解答时根据浓硫酸的性质及溶质质量分数、溶液的组成来分析并解答该题;浓硫酸具有吸水性,能吸收空气中的水分而使溶液变稀.浓硫酸能够吸收空气中的水蒸气而使硫酸的质量分数降低,所以随着时间的延长溶液中水的质量要增加,溶质的质量要增加,溶液的体积也随之增加,但是由于溶质的质量不变而溶剂的质量增加,所以溶质的质量分数要降低,即坐标系中的纵坐标可以表示:②溶液的质量、③溶液的体积④溶液中所含水的质量.即选项C是正确的.
故选C.点评:
本题考点: 酸的物理性质及用途;溶质的质量分数.
考点点评: 熟练掌握常见的酸的性质,知道浓硫酸具有吸水性,敞口放置于空气中由于吸收了水蒸气而使溶液中溶质的质量分数变小.1年前查看全部
- Fe、Cu都是人类较早使用的金属,某校化学研究性学习小组的同学运用实验的手段研究Fe、Cu以及化合物的相关性质.请你参与
Fe、Cu都是人类较早使用的金属,某校化学研究性学习小组的同学运用实验的手段研究Fe、Cu以及化合物的相关性质.请你参与研究并回答下列问题:
(1)甲同学取一束细铜丝用砂纸打磨后在酒精灯上加热至红热,再伸到Cl 2 的集气瓶中.你认为甲同学在实验中应该观察到的现象是______.
(2)乙同学为验证Fe在冷的浓HNO 3 中发生钝化但能和热的浓HNO 3 反应,设计了如图所示的实验,请你指出其中的两处错误:______、______;纠正上述错误后,请你从绿色化学的角度出发,对装置2提出改进建议,使装置2既能控制反应的进行,又能减少氮氧化物的排放:______.
(3)丙同学在Fe和浓HNO 3 反应后的溶液中加入一块Cu片,Cu片逐渐溶解,反应一段时间后不再溶解(Cu有剩余).
①丙同学依据反应现象得出Cu片溶解的原因是和HNO 3 发生反应.他依据的反应现象是______.
②丁同学认为丙同学的结论不完全正确.他的理由是______.
(4)请你设计实验证明在加入Cu片并反应完全后的溶液中含有Fe 2+ 但不含有Fe 3+ .说明具体的操作和实验现象______.
 散漫的倦1年前1
散漫的倦1年前1 -
 秋月天 共回答了21个问题
秋月天 共回答了21个问题 |采纳率90.5%(1)铜在氧气中不燃烧,在氯气中能燃烧产生棕黄色烟,故答案为:铜在氯气在燃烧产生棕黄色烟;
(2)加热液体时,试管内的液体超过试管的三分之一,超过三分之一时,加热过程中容易产生暴沸,造成安全事故;加热液体的试管不与桌面成45°角向上倾斜,不能竖直向上;改进后的铜丝容易抽拉,即容易控制反应的进行,从而减少氮氧化物的排放,将装置2中的铁片改成一段为螺旋状的铁丝,螺旋状的一端深入硝酸中,另一端伸出橡胶塞,既能控制反应的进行又能减少氮氧化物的排放;
故答案为:两只试管中的液体均超过试管容积的
1
3 ;加热液体的试管不与桌面成45°角向上倾斜;将装置2中的铁片改成一段为螺旋状的铁丝,螺旋状的一端深入硝酸中,另一端伸出橡胶塞;
(3)①二氧化氮能和水反应生成硝酸和一氧化氮,当溶液中硝酸过量时,抑制二氧化氮的溶解,所以可看到气体呈红棕色,故答案为:试管上部出现红棕色气体;
②硝酸过量时,铁和硝酸反应生成三价铁,三价铁和铜能反应生成二价铁离子和铜离子,从而使铜片溶解,发生反应为2Fe 3+ +Cu=Cu 2+ +2Fe 2+ ,
故答案为:铁和硝酸反应后的溶液中可能含有硝酸,但一定含有铁离子,铁离子液可以和铜反应使铜溶解;
(4)取适量反应后的溶液放入试管中,加入KSCN溶液无明显现象,再加入少量氯水,溶液变红则证明溶液中含有Fe 2+ 但不含Fe 3+ ,
故答案为:取适量反应后的溶液放入试管中,加入KSCN溶液无明显现象,再加入少量氯水,溶液变红则证明溶液中含有Fe 2+ 但不含Fe 3+ .1年前查看全部
- Ⅰ.某研究性学习小组用10g胆矾制取CuO,并证明CuO可以催化H 2 O 2 的分解反应.
Ⅰ.某研究性学习小组用10g胆矾制取CuO,并证明CuO可以催化H 2 O 2 的分解反应.
(1)首先制备CuO,实验步骤如下,请完成缺少的步骤:
①称取10g胆矾,放入小烧杯中,再加水溶解;②向小烧杯中滴加NaOH溶液,至产生大量沉淀;③用酒精灯在石棉网上加热小烧杯,至沉淀物完全黑色;④将以上混合物过滤,洗涤,______,然后研细;⑤检查④中洗涤是否完全的操作是______.
(2)用图1所示,按表中设计实验方法,证明CuO能催化7%H 2 O 2 溶液的分解,并与MnO 2 的催化效果进行比较.
①从设计原理看,实验中的待测数据是______.实验序号 双氧水体积 催化剂 待测数据 a 15mL 无 b 15mL 0.5g CuO c 15mL 0.5g MnO 2
②为探究CuO在实验b中是否起催化作用,除与
a比较外,还应补充以下实验(不必写具体操作):
A.证明CuO化学性质在反应前后是否改变;
B.______.
Ⅱ.摩尔盐[(NH 4 ) 2 SO 4 -FeSO 4 -6H 2 O]
在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂.某研究性学习小组用图2所示的实验装置来制取摩尔盐,实验步骤如下,回答下列问题:
(1)用30%的NaOH溶液和废铁屑(含少量油污、铁锈、FeS等)混合、煮沸、冷却、分离,将分离出的NaOH溶液装入③中.
(2)利用容器②的反应,向容器①中通入氢气,应关闭活塞______,打开活塞______(填字母).向容器①中通人氢气的目的是______.
(3)待锥形瓶中的铁屑快反应完时,关闭活塞B、C,打开活塞A,继续产生的氢气会将锥形瓶中的硫酸亚铁(含极少部分未反应的稀硫酸)压到饱和硫酸铵溶液的底部.在常温下放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵,抽滤,制得硫酸亚铁铵晶体.图3是抽滤装置的一部分,其中正确的是______.(填A或B)
(4)为了确定产品中亚铁离子的含量,研究小组用滴定法来测定.若取产品24.50g配成100mL溶液,取出10.00mL用0.1000mol-L -1 KMnO 4 酸性溶液滴定,消耗KMnO 4 溶液10.00mL.
已知高锰酸钾与Fe 2+ 的离子方程式为:MnO
+5Fe 2+ +8H + =Mn 2+ +5Fe 3+ +4H 2 O-4
试求产品中摩尔盐的质量分数______.(NH 4 ) 2 SO 4 -FeSO 4 -6H 2 O的相对分子质量为392. imsorrylove1年前1
imsorrylove1年前1 -
 口吕品田 共回答了19个问题
口吕品田 共回答了19个问题 |采纳率94.7%Ⅰ.(1)④、混合物过滤,洗涤,干燥后才能研细;
故答案为:干燥.
⑤、由工艺流程可知④中的CuO可能含有硫酸铜、硫酸钠杂质,取最后几滴洗涤液,加入BaCl 2 溶液,若无浑浊,证明沉淀已洗净.
故答案为:取最后几滴洗涤液,加入BaCl 2 溶液,若无浑浊,证明沉淀已洗净.
(2)①由表中信息可知,双氧水、催化剂一定,比较催化能力,相同时间内生成的气体体积越多(或产生相同体积气体所需要的时间越短),催化能力越强.所以应测量的数据为相同时间内产生气体的体积(或产生相同体积气体所需要的时间).
故答案为:相同时间内产生气体的体积(或产生相同体积气体所需要的时间).
②催化剂在反应前后,化学性质不变,质量不变.故还需CuO的质量在反应前后是否发生改变.
故答案为:CuO的质量在反应前后是否发生改变.
Ⅱ.(2)由装置图可知,向容器①中通入氢气,应关闭活塞A,打开活塞B、C.
硫酸铵溶液中的溶解O 2 ,容器①液面上部有O 2 ,Fe 2+ 易被氧化为Fe 3+ ,通入氢气赶走硫酸铵溶液中的溶解O 2 和容器①液面上部的O 2 ,防止Fe 2+ 被氧化为Fe 3+ .
故答案为:A;B、C;赶走硫酸铵溶液中的溶解O 2 和容器①液面上部的O 2 ,防止Fe 2+ 被氧化为Fe 3+ .
(3)布氏漏斗的颈下口斜口应与抽滤瓶的支管相对,有利于减压抽滤,故A正确,B错误.
故选:A.
(4)令24.50g产品中Fe 2+ 的物质的量为xmol,则:
5Fe 2+ ~~~~~~MnO 4 - ,
5 1
xmol0.01L×0.1000mol/L×10
所以x=
0.01L×0.1000mol/L×10 ×5
1 =0.05mol.
所以24.50g产品中(NH 4 ) 2 SO 4 ?FeSO 4 ?6H 2 O的为0.05mol,
所以24.50g产品中(NH 4 ) 2 SO 4 ?FeSO 4 ?6H 2 O的质量为0.05mol×392g/mol=19.6g.
所以24.50g产品中(NH 4 ) 2 SO 4 ?FeSO 4 ?6H 2 O的质量分数为
19.6g
24.50g ×100%=80%.
故答案为:80%.1年前查看全部
- (2008•镇江)某研究性学习小组对能量转化现象进行了研究,他们利用铁丝、镍铬丝、灵敏电流计等器材组成一个闭合电路,如图
 (2008•镇江)某研究性学习小组对能量转化现象进行了研究,他们利用铁丝、镍铬丝、灵敏电流计等器材组成一个闭合电路,如图所示,A点为铁丝和镍锤绞合在一起组成的加热点.用打火机给A点加热时,观察到灵敏电流计的指针发生了明显偏转,这一实验现象说明了______能可以转化成______能.
(2008•镇江)某研究性学习小组对能量转化现象进行了研究,他们利用铁丝、镍铬丝、灵敏电流计等器材组成一个闭合电路,如图所示,A点为铁丝和镍锤绞合在一起组成的加热点.用打火机给A点加热时,观察到灵敏电流计的指针发生了明显偏转,这一实验现象说明了______能可以转化成______能.  多事之冬1年前1
多事之冬1年前1 -
 李军8888 共回答了24个问题
李军8888 共回答了24个问题 |采纳率91.7%解题思路:不同形式的能之间在适当条件下是可以相互转化的.如图,用打火机给A点加热时,A点的温度升高,内能增加,这时,灵敏电流计的指针发生了明显的偏转,说明电路中有电流产生,也就是说,内能转化成了电能.
故答案为:内;电.点评:
本题考点: 能量的转化.
考点点评: 该题的关键是:由灵敏电流计的指针发生了明显的偏转,可以知道,闭合电路中有微小的电流产生.1年前查看全部
- (2012•天津)某研究性学习小组利用下列装置进行气体的制取,请分析并填空.
(2012•天津)某研究性学习小组利用下列装置进行气体的制取,请分析并填空.

(1)写出图中仪器a的名称: 。
(2)实验室用大理石和稀盐酸反应制取二氧化碳的化学方程式为 ,应选择制取并收集的装置为 (填字母)。
实验室用加热氯酸钾和二氧化锰混合物制取氧气,应选择发生装置为 (填字母);若用盛满水的F装置收集氧气,氧气应从导管 (填①或②)处通入F装置。
若锌和镁混合物的质量为4.8g与100g稀硫酸恰好完全反应,则该稀硫酸的溶质质量分数可能是 (填字母)。A.5% B.10% C.15% D.20%  jiletu1年前1
jiletu1年前1 -
 gaoshans 共回答了15个问题
gaoshans 共回答了15个问题 |采纳率80%(1)试管(2)CaCO 3 +2HCl=CaCl 2 +H 2 O+CO 2 ↑ B、D(3)A ②(4)B、C
本题主要考查氧气和二氧化碳的实验室制法,在常温下用石灰石和稀盐酸来制取二氧化碳,因此不需要加热.二氧化碳的密度比空气的密度大,能溶于水,因此只能用向上排空气法收集.如果用过氧化氢和二氧化锰制氧气,就不需要加热;如果用高锰酸钾或氯酸钾就需要加热.氧气不易溶于水,密度比空气的密度大,因此可以用排水法和向上排空气法收集.书写化学方程式时,要注意配平.如果4.8g全是金属镁,根据计算求最多需要硫酸的质量;如果4.8g全是金属锌,根据计算求最少需要硫酸的质量;因为是锌和镁混合物,因此硫酸的量介于两者之间。(1)试管是实验室常用的仪器(2)在常温下用石灰石和稀盐酸来制取二氧化碳,因此不需要加热.二氧化碳的密度比空气的密度大,能溶于水,因此只能用向上排空气法收集.碳酸钙和盐酸反应生成氯化钙和水和二氧化碳,配平即可;(3)如果用高锰酸钾或氯酸钾制氧气就需要加热,若用盛满水的F装置收集氧气,氧气应从导管②进入,因为氧气的密度比水的密度小;
(4)如果4.8g全是金属镁,根据Mg+H 2 SO 4 =MgSO 4 +H 2 ↑,计算求最多需要硫酸的质量是19.6g;如果4.8g全是金属锌,根据Zn+H 2 SO 4 =ZnSO 4 +H 2 ↑,计算求最少需要硫酸的质量是7.24g;因为是锌和镁混合物,因此硫酸的量介于两者之间;故答案为:BC。1年前查看全部
- 最近你所在的研究性学习小组就中学生上网情况进行了一次问卷调查,请根据下表以“你上网了吗”为题对这次问卷调查做一总结,介绍
最近你所在的研究性学习小组就中学生上网情况进行了一次问卷调查,请根据下表以“你上网了吗”为题对这次问卷调查做一总结,介绍你们的调查结果。
注意:1、词数150左右。人数 态度 原因 55% 赞同在课余时间多上网 网络打破了时空的界限,方便了人们的交流,扩大了视野。英特网极大丰富了学生课余生活。 30% 可以上网,但必须限时 因为休息不够会影响学习和成长发育 15% 不能上网 在他们看来多数学生上网不是学习,而是消遣、玩游戏、聊天等。因上网逃课的学生不在少数。 5% 拒绝接受问卷调查
2、可适当增加细节,使行文连贯。
3、文章的开头已给出,不计入总词数。 唱歌的女鬼1年前1
唱歌的女鬼1年前1 -
 q0ybfdj 共回答了20个问题
q0ybfdj 共回答了20个问题 |采纳率95%The coming of the Internet era has greatly affected our everyday life. The change caused by the Internet on school campus are even more obvious. In order to find out what middle school students think about going online, we, recently have made a survey of their views on it. We handed out 200 questionaires. The following are the results:
55% of the students think they’d like to surf the internet as much as possible in their spare time. In their opinion, the Internet is the biggest library in the world, which opens to anyone in any country. Through the Internet,they can easily get newest things. What’s more, it offers them a convenient way to communicate with each other, which greatly enriches their life outside their class.
30% of the students think surfing the net should be part of their life. But there must be a limit to it, for long hours on line without rest will affect their studies and even their growth.
15% of the students said No to it, thinking that, instead of reading on line, the majority chat or play PC games. Some bury themselves in the net bar, absent from school for several days. 5 % refused to co-operate.
略1年前查看全部
- 某研究性学习小组在调查人群中的遗传病时,以“研究××病的遗传方式”为子课题.下列子课题中最为简单可行且所选择的调查方法最
某研究性学习小组在调查人群中的遗传病时,以“研究××病的遗传方式”为子课题.下列子课题中最为简单可行且所选择的调查方法最为合理的是( )
A. 研究猫叫综合征的遗传方式,在学校内随机抽样调查
B. 研究青少年型糖尿病,在患者家系中调查
C. 研究艾滋病的遗传方式,在全市随机抽样调查
D. 研究红绿色盲的遗传方式,在患者家系中调查 yey1261年前1
yey1261年前1 -
 mingguo78 共回答了20个问题
mingguo78 共回答了20个问题 |采纳率95%解题思路:阅读题干可知,本题是与人类遗传病的调查有关的题目,根据选项涉及的具体内容分析判断.A、研究猫叫综合征的遗传方式,应在患者家系中调查,A错误;B、调查遗传病的遗传方式时,往往调查单基因遗传病的遗传方式,青少年型糖尿病是多基因遗传病,B错误;C、艾滋病是传染病,是由病毒传染引起的疾病,不是...
点评:
本题考点: 人类遗传病的监测和预防.
考点点评: 本题的知识点是调查某遗传病的遗传方式的方法与调查某遗传病的发病率的方法的不同,主要考查学生选用正确的方法调查人类遗传病的遗传方式的能力.1年前查看全部
- 下面是某历史研究性学习小组设计的示意图,最适合作为其标题的是
下面是某历史研究性学习小组设计的示意图,最适合作为其标题的是

a.《多样性的***文明》 b.《典型的*********》 c.《*********的演变》 d.《***的制约与平衡》  乡下表哥1年前1
乡下表哥1年前1 -
 wwewd5 共回答了23个问题
wwewd5 共回答了23个问题 |采纳率91.3%A
1年前查看全部
- 某研究性学习小组设计了如图所示的定量测定装置,其中B是圆筒状玻璃容器(带密封盖子),上面标有以厘米为单位的刻度,其他夹持
某研究性学习小组设计了如图所示的定量测定装置,其中B是圆筒状玻璃容器(带密封盖子),上面标有以厘米为单位的刻度,其他夹持装置已略去.小玲同学用这套装置按下列操作过程探究空气中氧气的体积分数:
①检查装置的气密性.
②容器A、B中加入水,使B中的液面在15cm处.
③将过量的铁粉平铺在电热板上,盖好容器.
④通电加热铁粉,待充分反应后,冷却到原来的状况,调整A的高度使容器A、B中的液面保持水平,记录液面刻度.
请回答下列问题:

(1)在操作①中检查装置气密性的最佳方法是______.
A.双手握住B容器,观察A中液面是否上升
B.双手握住B容器,观察A中是否有气泡产生
C.调整A的高度,观察A、B中的液体是否出现液面差,且保持不变
(2)该反应中,铁粉发生了______ 反应.
(3)在该同学的实验中,下列物质能代替铁粉的有______.
A.红磷B.木炭 C.铜粉D.硫粉
(4)操作④结束时,装置B中的液面最接近的刻度是______. 秋霞漫天1年前1
秋霞漫天1年前1 -
 123456saa 共回答了9个问题
123456saa 共回答了9个问题 |采纳率100%解题思路:(1)测定空气中氧气的含量时,要检查装置的气密性;
(2)根据氧化反应的定义判断;
(3)根据所选用的药品与氧气反应不能生成气体分析;
(4)根据氧气约占空气总体积的五分之一分析.(1)在操作①中检查装置气密性的方法是:盖紧B的盖子,使A中的水面高于容器B中的水面,放置一段时间,若A中的液面不下降,则证明其气密性良好.故答案为:C
(2)通电加热铁粉,铁与圆筒状玻璃容器内的氧气发生了氧化反应,故答案为:氧化
(3)所选用的药品与氧气反应不能生成气体,红磷与氧气反应生成五氧化二磷固体,故A正确,木炭与氧气反应生成二氧化碳气体,故B错误,铜粉与氧气反应生成氧化铜固体,故C正确,硫与氧气反应生成二氧化硫气体,故D错误,故选:A、C
(4)空气中氧气约占空气总体积的 [1/5],现有空气的体积为15cm长度,则氧气占3cm长度,所以反应结束时装置B中的液面最接近的刻度是12cm,所以本题答案为:12cm.点评:
本题考点: 测定空气里氧气含量的探究;量气装置;氧气与碳、磷、硫、铁等物质的反应现象.
考点点评: 本题主要考查空气中氧气含量方面的知识,解答时要注意测定氧气含量前,一定要检验装置的气密性.1年前查看全部
- 某研究性学习小组,从下列装置中选用部分装置组装后在实验室里制取氧气,并通过排水量来测定所收集到氧气的体积.
某研究性学习小组,从下列装置中选用部分装置组装后在实验室里制取氧气,并通过排水量来测定所收集到氧气的体积. 
(1)甲同学用一定质量的高锰酸钾制取氧气,反应的化学方程式为______,整套实验装置接口的正确连接顺序为a→______→______→______.
(2)实验过程中,甲同学观察到E装置中的水变为紫红色,这是因为______进入E装置并溶于水中的缘故.为了防止实验过程中出现上述现象,相应的改进措施是______.
(3)实验结束,乙同学意外发现收集到的氧气体积大于理论值,为此继续进行以下实验探究:
提出问题:出现“收集到的氧气体积大于理论值”的原因是什么?
作出猜想:猜想Ⅰ:可能是反应生成的二氧化锰分解放出氧气;
猜想Ⅱ:可能是反应生成的锰酸钾分解放出氧气;
猜想Ⅲ:______.请回答他做出猜想Ⅲ的理由是______.
实验验证:
实验一:取一定质量的二氧化锰于试管中,加热一段时间,冷却后测得固体残留物的质量不变.证明猜想______错误.
实验二:取一定质量的锰酸钾于试管中,加热一段时间______.综合实验一和实验二,证明猜想Ⅱ正确.
反思拓展:实验结束后,经过讨论、交流,丙同学用下列仪器和药品又设计了一个实验方案测定空气中氧气的体积分数.
①带瓶塞的1000mL圆底烧瓶②电子天平(称量精确度为0.01g)③酒精灯④某种较活泼的金属粉末(实验过程中需要用到的其他实验用品已省略,实验中有关物质的物理量数据为已知)他的实验步骤是:_____________.再利用实验数据和已知数据就可换算得出空气中氧气的体积分数. nicky25171年前1
nicky25171年前1 -
 殇岂独品 共回答了12个问题
殇岂独品 共回答了12个问题 |采纳率91.7%(1)高锰酸钾受热分解生成锰酸钾和二氧化锰和氧气,配平即可,方程式是2KMnO 4
△
.
K 2 MnO 4 +MnO 2 +O 2 ↑;通过排水量来测定所收集到氧气的体积,整套实验装置接口的正确连接顺序为a→f→e→g;
(2)甲同学观察到E装置中的水变为紫红色,这是因为:试管口没有放棉花团,高锰酸钾粉末进入导管的缘故;因此用高锰酸钾时,试管口要有一团棉花;
(3)作出猜想:化学反应前后元素的种类不变,因为锰酸钾和二氧化锰中都含有氧元素,所以可能是锰酸钾和二氧化锰共同放出氧气;
实验验证:冷却后测得二氧化锰的质量不变,证明猜想Ⅰ和Ⅲ错误;取少量锰酸钾于试管中加,热一段时间,冷却后测得锰酸钾的质量减少,证明猜想Ⅱ正确;
反思拓展:要测定空气中氧气的体积分数,实验方案步骤是:先用电子天平称出金属粉末的质量;再把金属粉末在带瓶塞的1000ml烧瓶灼烧,至氧气充分反应;再称量反应后金属粉末的质量,与反应前金属粉末的差值就是反应的烧瓶中氧气的质量,然后通过密度公式求氧气的体积,结合1000mL空气的体积计算出氧气的体积分数;
故答案为:
(1)2KMnO 4
△
.
K 2 MnO 4 +MnO 2 +O 2 ↑;f→e→g;
(2)高锰酸钾粉末;在试管口放一团棉花;
(3)作出猜想:可能是锰酸钾和二氧化锰均被分解放出氧气;锰酸钾和二氧化锰都含有氧元素;
实验验证:Ⅰ和Ⅲ;冷却后测得固体残留物的质量较原固体减少;
反思拓展:先用电子天平称出稍过量的金属粉末的质量,再把金属粉末放在带瓶塞的1000mL的圆底烧瓶中灼烧,至氧气完全反应;再称量反应后圆底烧瓶中固体物质的质量;最后通过密度公式求氧气的体积.1年前查看全部
- (2008•黑龙江)长时间使用的热水壶底部有一层水垢,主要成分是CaC03和Mg(OH)2.学校化学研究性学习小组同学通
(2008•黑龙江)长时间使用的热水壶底部有一层水垢,主要成分是CaC03和Mg(OH)2.学校化学研究性学习小组同学通过实验想测定水垢中CaC03的含量为多少.他们取200g水垢,加入过量的稀盐酸,同时测量5分钟(min)内生成CO2质量,测量数据如下表
计算:①4min后,水垢中的CaC03是否反应完全?时间/min 1 2 3 4 5 生成CO2的质量/g 30 50 60 66 66
②该水垢中CaC03的质量分数是多少? jsy0yy1年前1
jsy0yy1年前1 -
 已知的未知的 共回答了19个问题
已知的未知的 共回答了19个问题 |采纳率84.2%解题思路:根据是否继续产生二氧化碳对表中数据进行对比分析,可以确定碳酸钙完全反应时的时间.
由生成二氧化碳的质量根据碳酸钙与稀盐酸反应的化学方程式可以计算出水垢中碳酸钙的质量分数.①从测量数据表中看出,4分钟以后二氧化碳的质量不再增加,说明水垢中的CaC03已经反应完全,最后只能产生CO2气体66g.
②设水垢中CaC03的质量分数为x.
CaC03+2HCl═CaCl2+H2O+CO2↑
100 44
200g×x 66g
[100/44]=[200g×x/66g],
x=75%
答:4分钟后,水垢中的CaC03反应完全,该水垢中CaC03的质量分数为75%.点评:
本题考点: 实验探究物质的组成成分以及含量;实验数据处理或者误差分析的探究;碳酸钠、碳酸氢钠与碳酸钙;根据化学反应方程式的计算.
考点点评: 本题主要考查对表格数据比较分析能力和有关化学方程式的计算,难度较大.1年前查看全部
- 课题式研究性学习是培养学生创造性思维的良好方法,某研究性学习小组将下列装置如图链接,C、D、E、F、X、Y都是惰性电极。
课题式研究性学习是培养学生创造性思维的良好方法,某研究性学习小组将下列装置如图链接,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附件先显红色。试回答下列问题:

(1)电源A极的名称是 。
(2)甲装置中电解反应的总化学方程式: 。
(3)如果收集乙装置中产生的气体,相同状况下两种气体的体积比是 。
(4)欲用丙装置给铜镀银,G应该是 (填“铜”或“银”),电镀液的溶质是 (填化学式)。
(5)装置丁中的现象是 。 几度樱花开1年前1
几度樱花开1年前1 -
 gaoyen2001 共回答了18个问题
gaoyen2001 共回答了18个问题 |采纳率88.9%1年前查看全部
- 某校研究性学习小组的同学为了探究呼出的气体和吸入的空气中氧气,二氧化碳和水蒸气的含量是否相同,设计了简单的实验方案,其主
某校研究性学习小组的同学为了探究呼出的气体和吸入的空气中氧气,二氧化碳和水蒸气的含量是否相同,设计了简单的实验方案,其主要步骤如图,请根据图示回答问题.
(1)第一步应如何操作?______
(2)下表是他们的探究方案,请你填写完整.
探究内容 实验操作 实验现象 结论 判断依据 二氧化碳含量是否相同 ______ ______ ______ ______ 氧气含量是否相同 ______ ______ ______ ______ 水蒸气含量是否相同 ______ ______ ______ ______  舞蝶听花落1年前1
舞蝶听花落1年前1 -
 在所不惜t1971_07 共回答了17个问题
在所不惜t1971_07 共回答了17个问题 |采纳率94.1%解题思路:呼吸前后气体成分会有所变化,主要是呼吸后氧气含量降低,二氧化碳和水会有所增大.检验的方法采用对比实验的方法进行.(1)为创设对比实验的对比样品先要对对比的气体进行取样,设法收集空气与呼出的气体.故答案为:用排水法收集两瓶呼出的气体,另外收集两瓶空气;
(2)由实验目的探究呼出的气体与吸入的空气中氧气、二氧化碳和水蒸气的含量是否相同可知,该实验要进行对比的两实验对象是吸入的空气和呼出的气体;
(3)根据氧气能助燃的性质检验氧气含量;根据二氧化碳能使澄清石灰水变浑浊,检验二氧化碳的含量;利用水蒸气遇冷凝结的方法检验呼出气体中水蒸气的含量.
答案:
(1)用排水法收集两瓶呼出的气体,另外收集两瓶空气
(2)
探究内容 实验操作 实验现象 结论 判断依据
二氧化碳含量是否相同 将等量的澄清的石灰水分别滴入盛有呼出的气体和吸入空气的集气瓶中 石灰水浑浊的程度不同 人体呼出的气体比吸入的空气所含二氧化碳多 根据石灰水浑浊程度的不同判断二氧化碳的含量
氧气含量是否相同 将燃着的木条分别放入盛有呼出的气体和吸入的空气的集气瓶中 木条燃烧的情况不同 空气中氧气的含量比呼出的气体中氧气的含量高 根据木条燃烧情况的不同判断氧气的含量
水蒸气含量是否相同 取两块干冷的玻璃片,对着其中的一块呼气 玻璃片上的水雾不同 呼出的气体中水的含量比空气中水的含量高 根据玻璃片上水雾的不同判断水的含量点评:
本题考点: 吸入空气与呼出气体的比较.
考点点评: 呼吸前后气体成分会有所变化,主要是呼吸后氧气含量降低,二氧化碳和水会有所增大.检验的方法是采用对比实验的方法进行,依据已知的物质的性质分别对空气样品和呼出气体进行对比试验,现象不同判断气体成分的不同.1年前查看全部
- (2012•宜春一模)某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀.甲同学认为两者反应只生
(2012•宜春一模)某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀.甲同学认为两者反应只生成CuCO3一种沉淀;乙同学认为只生成Cu(OH)2一种沉淀;丙同学认为生成CuCO3和Cu(OH)2两种沉淀.(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)

Ⅰ、在探究沉淀物成分前,须将沉淀从溶液中分离并净化.具体操作为______、______、______.
Ⅱ、请用如图1所示装置,选择必要的试剂,定性探究生成物的成分.
(1)各装置连接顺序为______→______→______.
(2)装置C中装有试剂的名称是______.
(3)能证明生成物中有CuCO3的实验现象是______.
Ⅲ、若CuCO3和Cu(OH)2两者都有,可通过图2所示装置的连接(每个装置只使用一次),进行定量分析来测定其组成.
(1)各装置连接顺序为______→______→______→______;
(2)实验后还要通入过量的空气,其作用是______;
若沉淀样品的质量为m克,装置B质量增加了n克,则沉淀中CuCO3的质量分数为:(1-[49n/9m])×100%(1-[49n/9m])×100%;
若将C装置去掉,将导致测定结果中CuCO3的质量分数______(填“增大”、“减小”或“无影响”). 杨柳山枫1年前1
杨柳山枫1年前1 -
 一念之間 共回答了8个问题
一念之間 共回答了8个问题 |采纳率100%解题思路:Ⅰ、沉淀从溶液中分离并净化,要先把沉淀从溶液中过滤出,要洗去附着的杂质,然后干燥.
Ⅱ、利用加热的方法检验,氢氧化铜和碳酸铜加热分解得到氧化铜、水和二氧化碳,若有氢氧化铜可用无水硫酸铜检验,若有碳酸铜可用澄清的石灰水检验产生的二氧化碳,澄清石灰水变浑浊说明含有CuCO3;
Ⅲ、(1)实验开始时装置的空气中会有水蒸气和二氧化碳,若不排除被吸收装置吸收会对计算结果产生较大的误差,故开始时先用除去水和二氧化碳的空气将装置中的水蒸气和二氧化碳排除(注意实验结束氢氧化铜和碳酸铜加热分解后会在反应装置中残留二氧化碳和水蒸气,也应通过用除去水和二氧化碳的空气将装置中的水蒸气和二氧化碳赶出被吸收装置完全吸收);
(2)为保证样品加热分解生成的二氧化碳和水蒸气完全被吸收,应通入空气;
装置B质量增加了n克,说明分解生成ng水,根据水的质量计算沉淀中氢氧化铜的质量,沉淀质量减去氢氧化铜的质量等于碳酸铜的质量,再利用质量分数的定义计算;
由于空气中含有二氧化碳和水蒸气,应先通过盛有碱石灰的装置C吸收空气的中二氧化碳和水蒸气,若C装置去掉,装置B质量偏大.Ⅰ、沉淀从溶液中分离并净化,要先把沉淀从溶液中过滤出,要洗去附着的杂质,然后干燥除去沉淀中的水分,
故答案为:过滤、洗涤、干燥;
Ⅱ、(1)利用加热的方法检验,氢氧化铜和碳酸铜加热分解得到氧化铜、水和二氧化碳,若有氢氧化铜可用无水硫酸铜检验,若有碳酸铜可用澄清的石灰水检验产生的二氧化碳,
故答案为:A;C;B;
(2)装置C检验是否有水生成,可用无水硫酸铜检验,若无水硫酸铜变蓝色说明有水生成,验证沉淀中有氢氧化铜生成,否则沉淀中无氢氧化铜,
故答案为:无水硫酸铜;
(3)用澄清的石灰水检验是否产生二氧化碳,装置B中澄清石灰水变浑浊,说明生成二氧化碳,即说明含有CuCO3,
故答案为:装置B中澄清石灰水变混浊;
Ⅲ、(1)若CuCO3和Cu(OH)2两种沉淀都有,加热时生成CO2和H2O,定量检验时,可用浓硫酸吸收水,用碱石灰吸收二氧化碳,实验时,为减小误差,应排除空气中水和二氧化碳的干扰,并保证水和二氧化碳完全吸收,则实验仪器的连接顺序应为C A B E D(或C A B D E),
故答案为:C A B E D(或C A B D E);
(2)为保证样品加热分解生成的二氧化碳和水蒸气完全被吸收,应通入空气,将装置中滞留的H2O蒸汽赶入B中;
装置B质量增加了n克,说明分解生成ng水,水的物质的量为[n/18]mol,根据氢元素守恒可知氢氧化铜的物质的量为[n/18]mol,故氢氧化铜的质量为[n/18]mol×98g/mol=[49n/9]g,沉淀中CuCO3的质量分数为
m−
49n
9
m×100%=(1-[49n/9m])×100%,
由于空气中含有二氧化碳和水蒸气,应先通过盛有碱石灰的装置C吸收空气的中二氧化碳和水蒸气,若C装置去掉,装置B质量偏大,即吸收的水的质量偏大,求出氢氧化铜的质量偏大,则碳酸铜的质量偏小,将导致测定结果中CuCO3的质量分数减小;
故答案为:将装置中滞留的H2O蒸汽赶入B中;(1-[49n/9m])×100%;减小.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用;探究物质的组成或测量物质的含量.
考点点评: 本题考查了物质性质的探究实验设计和实验分析应用,物质性质的熟练掌握和实验基本操作是解题关键,题目难度中等.1年前查看全部
- 某校研究性学习小组的同学设计了简单的实验方案,验证呼出的气体与吸入空气成分的含量有什么不同,其主要操作步骤如表所示:请填
某校研究性学习小组的同学设计了简单的实验方案,验证呼出的气体与吸入空气成分的含量有什么不同,其主要操作步骤如表所示:请填写验证依据.
实验步骤 验证依据 (1)取两个空集气瓶,用玻璃片将瓶口盖好,这样两瓶空气样品就收集好了. 
(2)取另外两个集气瓶,用排水法收集两瓶人呼出的气体. (3)将燃着的小木条分别插入空气样品和呼出气体的样品中.
根据______现象,
判断______含量不同(4)向一瓶空气样品和一瓶呼出气体的样品中各滴入相同滴数的澄清石灰水,振荡.
根据______现象,
判断______含量不同(5)取两块干燥的玻璃片或镜片,对着其中一块哈气,对比观察.
根据______现象,
判断______含量不同 宝宝盼1年前1
宝宝盼1年前1 -
 xwx8172 共回答了19个问题
xwx8172 共回答了19个问题 |采纳率100%解题思路:人呼吸时把空气中的氧气转化为二氧化碳,同时从体内带出水蒸汽,人体呼出气体和空气中的氧气、二氧化碳、水蒸汽含量不同;氮气的含量基本不变,因为人体没有吸收氮气;呼出的气体与吸入空气相比,具有“两多一少”的特点,即与吸入的空气相比,二氧化碳、水蒸气含量增加,氧气含量减少;据此结合常见气体的检验方法进行分析解答即可.(3)氧气能支持燃烧,将燃着的木条分别插入空气样品和呼出气体的样品中,插入呼出气体中的木条立即熄灭,说明呼出的气体中氧气含量比空气中的少.
(4)二氧化碳能使澄清的石灰水变浑浊,向一瓶空气样品和一瓶呼出气体的样品中各滴入相同滴数的澄清石灰水,振荡,呼出气体中的澄清石灰水变浑浊,说明呼出的气体中二氧化碳含量比空气中的多.
(5)取两块干燥的玻璃片或镜片,对着其中一块哈气,对比观察,对着呼气的玻璃片上有水雾出现,说明呼出的气体中水蒸气含量比空气中的多.
故答案为:
实验步骤验证依据
(1)取两个空集气瓶,用玻璃片将瓶口盖好,这样两瓶空气样品就收集好了.
(2)取另外两个集气瓶,用排水法收集两瓶人呼出的气体.
(3)将燃着的小木条分别插入空气样品和呼出气体的样品中.
根据 燃着的木条是否熄灭的现象,
判断 氧气含量不同
(4)向一瓶空气样品和一瓶呼出气体的样品中各滴入相同滴数的澄清石灰水,振荡.
根据 澄清石灰水是否变浑浊的现象,
判断 二氧化碳含量不同
(5)取两块干燥的玻璃片或镜片,对着其中一块哈气,对比观察.
根据 玻璃片上是否有水雾出现的现象,
判断 水蒸气含量不同点评:
本题考点: 吸入空气与呼出气体的比较;常见气体的检验与除杂方法.
考点点评: 本题难度不大,了解人体吸入的空气与呼出的气体成分的区别、常见气体的检验方法是正确解答本题的关键.1年前查看全部
- 某研究性学习小组设计了如图所示的定量测定装置,其中B是圆筒状玻璃容器(带密封盖子),上面标有以厘米为单位的刻度,其他夹持
某研究性学习小组设计了如图所示的定量测定装置,其中B是圆筒状玻璃容器(带密封盖子),上面标有以厘米为单位的刻度,其他夹持装置已略去.小玲同学用这套装置按下列操作过程探究空气中氧气的体积分数:
①检查装置的气密性.
②容器A、B中加入水,使B中的液面在15cm处.
③将过量的铁粉平铺在电热板上,盖好容器.
④通电加热铁粉,待充分反应后,冷却到原来的状况,调整A的高度使容器A、B中的液面保持水平,记录液面刻度.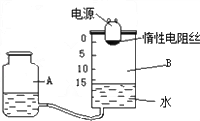
请回答下列问题:
(1)在操作①中检查装置气密性的最佳方法是 ___ .
A.双手握住B容器,观察A中液面是否上升
B.双手握住B容器,观察A中是否有气泡产生
C.调整A的高度,观察A、B中的液体是否出现液面差,且保持不变
(2)该反应中,铁粉发生了 ___ 反应.
(3)在该同学的实验中,下列物质能代替铁粉的有 _____ .
A.红磷B.木炭C.铜粉D.硫粉
(4)操作④结束时,装置B中的液面最接近的刻度是 ____ zhoutao_771年前1
zhoutao_771年前1 -
 灰色--- 共回答了25个问题
灰色--- 共回答了25个问题 |采纳率92%(1)C;
(2)氧化;
(3)A、C;
(4)12cm.1年前查看全部
- (13分)某研究性学习小组设计并进行了如下实验。
(13分)某研究性学习小组设计并进行了如下实验。
(1)甲组同学用下图装置制取干燥纯净的二氧化碳气体。
请回答下列问题:
①仪器X的名称是 ;有孔塑料隔板上的固体物质为 (填名称)。
②实验前,关闭活塞,向X中加入水使X中液面高于试管中的液面,一段时间后液面保持不变说明 。
③为除去CO 2 中混有的HCl气体,B装置中盛放饱和NaHCO 3 溶液,写出该反应的化学方程式: 。要得到干燥的CO 2 ,C装置应盛放 (填“试剂名称”)。
④装置B、C中所装试剂的顺序不可以颠倒,理由是: 。
(2)乙组同学围绕C还原CuO产生的红色固体是否一定是Cu进行探究。
【查阅资料】 ①在空气中高温灼烧时,CuO会分解生成Cu 2 O;Cu 2 O粉末呈红色,在高温下性质稳定;②Cu 2 O在酸性溶液中不稳定,如在稀硫酸中:Cu 2 O+H 2 SO 4 =CuSO 4 +Cu+ H 2 O。
【提出猜想】猜想Ⅰ:红色固体是Cu; 猜想Ⅱ:红色固体是Cu 2 O;猜想Ⅲ:红色固体是 。
【实验探究】同学们又分为两组,分别进行以下实验:
①第一组同学取一定质量的红色固体a g ,在空气中高温灼烧,直到质量不再发生改变,称量所得固体质量为b g 。并进行数据分析:若a = b,则猜想 成立;若b>a,则说明红色固体中一定含有 物质。
②第二组同学没有用测量质量的方法也得出了红色固体中含有Cu 2 O的结论。该同学设计的实验方法是 。(写出“实验操作、现象和结论”)
【解释与结论】 根据实验探究,可知C还原CuO时除了发生2CuO+C 2Cu +CO 2 ↑ 的反应外,还可能发生的化学反应方程式: 。
2Cu +CO 2 ↑ 的反应外,还可能发生的化学反应方程式: 。
【拓展延伸】同学们又就Cu 2 O是否具有氧化性展开了讨论,请你设计实验方案: 。
【实验反思】通过以上实验探究,你对“问题的发现与解决”有何认识? 。 mmyly1年前1
mmyly1年前1 -
 素发远心 共回答了20个问题
素发远心 共回答了20个问题 |采纳率85%(1)①长颈漏斗石灰石 ②装置气密性良好
③ NaHCO 3 +HCl==NaCl+H 2 O+CO 2 ↑浓硫酸
④若颠倒的话,出来的气体就不干燥了
(2)【提出猜想】 Cu 2 O和Cu的混合物
【实验探究】①Ⅱ Cu ② 取样,加入稀硫酸,若溶液变蓝,则含Cu 2 O
【解释与结论】4CuO+C CO 2 ↑+2Cu 2 O或5CuO+2C
CO 2 ↑+2Cu 2 O或5CuO+2C 2CO 2 ↑+Cu 2 O+3 Cu或 2Cu 2 O +C
2CO 2 ↑+Cu 2 O+3 Cu或 2Cu 2 O +C  CO 2 ↑+4Cu
CO 2 ↑+4Cu
【拓展延伸】 取样于玻璃管中,通入CO,加热,将产生的气体通入澄清的石灰水,若浑浊,则证明有氧化性(答案合理均可)。
【实验反思】 认真分析,实验证明
(1)根据认识实验仪器,制取二氧化碳一般用碳酸钙和盐酸,液面保持不变说明装置气密性良好,NaHCO 3 和氯化氢生成氯化钠和水,二氧化碳,二氧化碳可以用浓硫酸进行干燥
(2)猜想可以是单独两种物质和混合物三种情况分析,铜在空气中高温灼烧时和氧气会生成氧化铜,质量会增加;Cu 2 O在空气中高温灼烧时不发生变化;根据Cu 2 O在酸性溶液中不稳定进行判断1年前查看全部
- (2014•浙江模拟)为了改进教材中“做功与速度变化”实验的不足,某物理研究性学习小组设计了如图(a)所示的实验装置,如
(2014•浙江模拟)为了改进教材中“做功与速度变化”实验的不足,某物理研究性学习小组设计了如图(a)所示的实验装置,如图(b)为相对应的原理示意图.在带有刻度的圆弧形槽内放一很薄的比较光滑的塑料管A,弹簧的一端固定在塑料管A上,另一端与研究对象金属圆柱体接触,组成一弹射装置.金属圆柱体经弹簧做功后从塑料管的左端B弹出,在圆弧形槽内做匀减速直线运动,最后静止不动,通过位移d可以由圆弧形槽上刻度读出.该研究小组根据弹性势能公式E=[1/2]kx2,通过改变弹簧压缩量x来改变弹簧所做功w=[1/2]kx2,通过匀变速直线运动位移d求出金属圆柱体从B端射出时速度平方v02=2μgd.

(1)为了运用图象的直线探究做功与速度变化关系,若以弹簧压缩量平方x2为纵坐标,则应以______为横坐标.
(2)该研究小组通过改变x,多次测量d,得出如表所示的多组实验数据.试根据表中实验数据,在如图(c)所示的坐标上作出图线.根据图线得出______.
(3)若金属圆柱体的质量为m,弹簧的劲度系数为k,则根据所作图线可以求出______物理量.x/mm x2/mm2 d/mm 1 21 441 141 2 28 784 245 3 34 1156 356 4 39 1521 444
(4)试指出影响该实验精度的因素______(至少一个). 明天会更好8881年前1
明天会更好8881年前1 -
 txm2007 共回答了18个问题
txm2007 共回答了18个问题 |采纳率88.9%解题思路:(1)应用能量守恒定律求出函数表达式,然后确定坐标轴所表示的物理量.
(2)应用描点法作出图象,根据图象得出结论.
(3)根据图象的函数表达式与图象得出结论.
(4)根据实验原理与实验步骤分析实验误差.(1)对整个过程,由能量守恒定律可得:[1/2]kx2=2μgd,x2为横坐标,以金属圆柱体通过位移d为纵坐标作出的图象是直线.
(2)根据表中实验数据在坐标系内描出对应点,然后作出图象如图所示: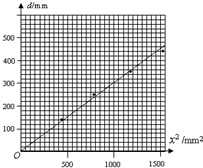
由图象可知,图象是一条直线,d与x2成正比,由此可得:在误差范围内,弹簧对物体做功与物体速度平方成正比.
(3)由[1/2]kx2=2μgd可知,d=[k/4μg]x2,由图象可以求出:金属圆柱体与圆弧形槽间动摩擦因数.
(4)塑料管A间有摩擦,测量x和d时存在误差等可以影响实验的精度.
故答案为:(1)金属圆柱体通过位移d;(2)图象如图所示;在误差范围内,弹簧对物体做功与物体速度平方成正比;
(3)金属圆柱体与圆弧形槽间动摩擦因数;(4)金属圆柱体与塑料管A间有摩擦,测量x和d时存在误差等.点评:
本题考点: 探究功与速度变化的关系.
考点点评: 本题考查了实验数据处理,知道实验原理、根据能量守恒定律求出函数表达式是正确解题的关键;应用图象法处理实验数据时,为使图象直观、便于实验数据处理,要选择合适的物理量,使作出的图象为直线.1年前查看全部
- 太阳能热水器具有安全、节能、经济和环保等优点.为有效利用太阳能,某研究性学习小组对“物体吸收太阳能的能力与表面颜色之间的
太阳能热水器具有安全、节能、经济和环保等优点.为有效利用太阳能,某研究性学习小组对“物体吸收太阳能的能力与表面颜色之间的关系”进行了实验研究:在两只相同的烧杯中装有质量和初温相同的水,烧杯外用一个黑色塑料袋和一个白色塑料袋密封,插入温度计(温度计的玻璃泡浸没在水中,大部分刻度露出可见),放在阳光下曝晒.每隔相同的时间读出温度计的示数,数据记录如下:
根据上述数据回答下列问题:塑料袋颜色 水的质量m(kg) 初温t0℃ 温度t1℃ 温度t2℃ 温度t3℃ … 黑色 1 15 22.3 27.8 31.5 … 白色 1 15 16.5 17.8 19 …
(1)这次实验过程中,采用的科学研究方法是 ______;
(2)通过上面的研究可以推断:太阳能热水器的集热管表面颜色以 ______为宜;
(3)小明家使用的太阳能热水器的说明书如图,若在太阳能热水器的水箱中装满水,中午在太阳照晒下每小时温度升高10℃,则该热水器中的水每小时吸收的热量是多少?该热水器中午每秒钟每平方米的面积上获得的太阳能是多少?容积 100L 集热箱的采光面积 1.5m2 效率 40% 使用年限 15年  幸福的妞妞1年前1
幸福的妞妞1年前1 -
 ON799 共回答了18个问题
ON799 共回答了18个问题 |采纳率100%解题思路:(1)本实验通过瓶内水温度的变化大小,得出水吸热多少,从而说明黑、白颜色物体的吸热能力,实验中让水的质量、容器、水的初温相同,只改变颜色,采用了控制变量法.
(2)在同样的条件下,黑色瓶内水温度的升高的多,水吸热多,说明黑颜色物体的吸热能力强,太阳能热水器的集热管表面颜色以黑色为宜;
(3)从表中知道热水器的容积,利用密度公式求出水的质量,又知道水温的变化和水的密度,利用吸热公式求水吸收的热量;
求出了水吸收的热量,又知道采光面积、热水器的吸热效率,求热水器中午每秒钟每平方米的面积上获得的太阳能.(1)本实验探究黑、白颜色物体的吸热能力,实验时让让水的质量、容器、水的初温相同,采用了控制变量法;
(2)通过实验说明黑颜色物体的吸热能力强,太阳能热水器的集热管表面颜色以黑色为宜;
(3)v=100L=100×10-3m3,
水的质量:
m=ρv=1×103kg/m3×100×10-3m3=100kg,
水吸收的热量:
Q吸=cm△t=4.2×103J/(kg•℃)×100kg×10℃=4.2×106J;
热水器中午每秒钟每平方米的面积上获得的太阳能为Q,
∵Q吸=Q×1.5×3600×40%,
∴Q=
Q吸
1.5×3600×40%=
4.2×106J
1.5×3600×40%=1944J.
故答案为:(1)控制变量;
(2)黑色;
(3)该热水器中的水每小时吸收的热量是4.2×106J,该热水器中午每秒钟每平方米的面积上获得的太阳能是1944J.点评:
本题考点: 热量的计算;物理学方法.
考点点评: 本题考查了密度公式、吸热公式,涉及到控制变量法和从提供的表格中搜集信息,属于难题.1年前查看全部
- (d013•鸡西模拟)某校化学研究性学习l组探究气体制取c实验原理与方法(如图1).
(d013•鸡西模拟)某校化学研究性学习l组探究气体制取c实验原理与方法(如图1).
(1)甲同学将课本c基础知识进行整理如下表,请大帮助他完成相关内容.
制取气体 所需药品 装置连接顺序 反应c化学方程式 氧气 氯酸钾和二氧化锰 ______ ______ 二氧化碳(干燥) 大理石和稀盐酸 ______ ______ 
(d)乙同学设计c实验装置(如图d),既可用于制取气体,又可用于验证物质性质.当打开01、关闭
0d时,利用中、Ⅱ装置可直接进行c实验是______(填序号).
①大理石与稀盐酸反应制取二氧化碳
②锌与稀硫酸反应制取氢气
(3)丙同学认为在不改变中、Ⅱ、Ⅲ装置c仪器及位置c前提下,该装置可用于过氧化钠 (N它dOd)与水反应制取氧气,另e产物为氢氧化钠,则该反应c化学方程式为:______;她c改进措施是______.
(d)丁同学打开0d、关闭01,利用中、Ⅲ装置来验证生成c二氧化碳中含有水蒸气,此时C中盛放c物质是______,可以观察到c现象是______.
(5)对用氯酸钾和二氧化锰c混合物制取Od后c固体残渣(假定已完全反应)作如下回收处理:
①通过以下四步实验操作回收二氧化锰.正确操作c先后顺序是______(填写选项序号).
它.烘干b.溶解c.过滤d.洗涤
②用所得氯化钾晶体配制50g质量分数为5%c氯化钾溶液,需要氯化钾c质量为______.
③过滤、蒸发时都需用到c仪器是______(填序号).
它.酒精灯B.烧杯C.玻璃棒D.漏斗E.量筒. 113234551年前1
113234551年前1 -
 ahuang62 共回答了18个问题
ahuang62 共回答了18个问题 |采纳率100%解题思路:(1)用氯酸钾和二氧化锰反应制取氧气需要加热反应,据此选择发生装置;又因氧气的密度大于空气的密度,并且不易溶于水,选择收集装置;然后写出化学反应式即可;大理石与稀盐酸反应制取二氧化碳,是固液在常温下反应,据此选择发生装置;根据二氧化碳密度大于空气的密度,易溶于水,选择收集装置;又因为要收集干燥的二氧化碳,所以要连接装置E;
(2)观察图示可知是固液在常温下的反应,并且收集气体的密度应小于空气的密度,然后选择即可;
(3)根据反应物是过氧化钠(Na2O2)与水,生成物是氧气和氢氧化钠写出化学反应式即可;因氧气密度比空气大,所以应将装置Ⅱ进出气体导管交换一下即可;
(4)根据检验水的存在可以用无水硫酸铜分析;
(5)①考查分离可溶物与不溶物的操作顺序,必须先过滤杂质,再溶解、烘干;
②需要根据公式:溶质质量分数=[溶质质量/溶液质量]×100%进行计算;
③要对比分析过滤和蒸发所用到的仪器.(6)用氯酸钾和二氧化锰反应制取氧气需要加热反应,我们可选用B作为发生装置;又因氧气的密度r于空气的密度,并且不易溶于水,可选口或D作为收集装置,该反应的化学方程式是rK口lO3
MnOr
.
△rK口l+3Or↑;r理石与稀盐酸反应制取二氧化碳,是固液在常温下反应,可用装置r作为发生装置;二氧化碳密度r于空气的密度,易溶于水,我们用装置D收集,又因为要收集干燥的二氧化碳,所以要在rD之间连接装置f;该反应的化学方程式是口r口O3+rH口l=口r口lr+HrO+口Or↑;
(r)根据装置I、Ⅱ的导管进出口顺序可知,装置Ⅱ只能用来收集密度比空气小的气体,因此利用装置I、Ⅱ可收集Hr.故选②;
(3)反应物是过氧化钠(NrrOr)与水,生成物是氧气和氢氧化钠,此反应的化学式是:rNrrOr+rHrO═0NrOH+Or↑;
她的改进措施是将装置Ⅱ中长导管接装置I出气管,打开K6、Kr;
(0)根据检验水的存在可以用无水硫酸铜,无水硫酸铜和水反应生成蓝色的硫酸铜晶体;
(5)①制取氧气实验结束后,剩余药品为:氯化钾和二氧化锰,氯化钾可溶于水而二氧化锰不溶于水,分离可溶物与不溶物而要获得不溶物的操作顺序为:溶解、过滤、洗涤、烘干;
②根据公式:溶质质量分数=[溶质质量/溶液质量]×600% 可知:溶质质量=50g×5%=r.5g;
③通过分析比较过滤和蒸发所用到的仪器,在过滤时用玻璃棒引流,蒸发时用玻璃棒搅拌.
故答案是:
(6)
制取气体 所需药品 装置连接顺序 反应的化学方程式
氧气 氯酸钾和二氧化锰 B口/BD rK口lO3
MnOr
.
△rK口l+3Or↑
二氧化碳(干燥) r理石和稀盐酸 rfD 口r口O3+rH口l=口r口lr+HrO+口Or↑(r)②
(3)rNrrOr+rHrO=0NrOH+Or↑;将装置Ⅱ中长导管接装置I出气管,打开K6、Kr;
(0)无水硫酸铜;固体变成蓝色;
(5)①b口dr;②r.5g;③口.点评:
本题考点: 制取气体的反应原理的探究;混合物的分离方法;常见气体的检验与除杂方法;气体的干燥(除水);实验室制取氧气的反应原理;二氧化碳的实验室制法;有关溶质质量分数的简单计算.
考点点评: 本题综合考查了学生的基本实验能力,涉及装置选择、连接、实验基本操作、化学计算等知识.要同学们具有综合的化学知识方可做好此题.1年前查看全部
- 某化学研究性学习小组对含有杂质的铁粉样品进行分析(杂质不与酸反应).
某化学研究性学习小组对含有杂质的铁粉样品进行分析(杂质不与酸反应).
取4份质量均为2.5g的样品,分别与同一浓度的盐酸反应,实验结果记录如表.试计算:
(1)每份样品中所含杂质的质量为______g.实验序号 加入盐酸体积/mL 剩余固体质量/g 1 10 1.8 2 20 1.1 3 30 0.5 4 50 0.5
(2)所用盐酸溶液的物质的量浓度为______mol•L-1. jeickey1年前1
jeickey1年前1 -
 523534682 共回答了24个问题
523534682 共回答了24个问题 |采纳率87.5%解题思路:Fe与盐酸发生反应:Fe+2HCl=FeCl2+H2↑,而杂化不与盐酸反应,由表中数据可知,加入30mL盐酸与加入40mL时剩余固体的质量都是0.5g,说明Fe完全反应,0.5g为不反应的杂化,第1组中盐酸完全反应,参加反应的Fe为2.5g-1.8g=0.7g,根据方程式计算n(HCl),再根据c=[n/V]计算.(1)Fe与盐酸发生反应:Fe+2HCl=FeCl2+H2↑,而杂化不与盐酸反应,由表中数据可知,加入30mL盐酸与加入40mL时剩余固体的质量都是0.5g,说明Fe完全反应,0.5g为不反应的杂化,
故答案为:0.5g;
(2)第1组中盐酸完全反应,参加反应的Fe为2.5g-1.8g=0.7g,则:
Fe+2HCl=FeCl2+H2↑
56g 2mol
0.7g n(HCl)
n(HCl)=[0.7g×2mol/56g]=0.025mol,故c(HCl)=[0.025mol/0.01L]=2.5mol/L,
故答案为:2.5.点评:
本题考点: 有关混合物反应的计算;化学方程式的有关计算.
考点点评: 本题考查混合物的有关计算、对实验数据的分析应用能力,关键是根据盐酸体积与剩余固体质量判断过量问题与杂质质量,比较基础.1年前查看全部
- 小明在研究性学习活动中,查阅到一种热敏电阻的阻值随温度变化的规律如下表,并将该型号的热敏电阻应用于如图11所示由“控制电
小明在研究性学习活动中,查阅到一种热敏电阻的阻值随温度变化的规律如下表,并将该型号的热敏电阻应用于如图11所示由“控制电路”和“工作电路”组成的恒温箱电路中.“控制电路”由热敏电阻R1、电磁铁(线圈阻值R0 = 50Ω)、电源U1、开关等组成,当线圈中的电流大于或等于20mA时,继电器的衔铁被吸合,右边工作电路则断开;“工作电路”由工作电源U2(U2 = 10V)、发热电阻R2(R2 = 5Ω)、导线等组成.问:
⑴工作电路工作时的电流为多大?
⑵若恒温箱的温度最高不得超过50℃,则控制电路的电源电压U1最小值为多大?
温度/℃
…
30
40
50
60
70
…
热敏电阻阻值/ Ω
…
350
300
250
210
175
…
如图所示,灯泡L标有“6V、6W”字样,滑动变阻器的最大值为R1,R2=12Ω,电源电压保持12V不变;
(1)调节滑动变阻器使小灯泡正常发光,求此时接入的滑动变阻器的阻值.
(2)保持滑动变阻器阻值不变,闭合开关S,求电流表的示数.
(3)断开开关S1,改变变阻器滑片P的位置使滑片移至c点时,电路的总功率为P1,当滑片移至a点,电路的总功率为P2,Rcb= R1,P1=2P2求滑动变阻器的最大阻值. 我渴望ww1年前0
我渴望ww1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2009•陕西)某校研究性学习小组的同学,在网上浏览到一条信息:“微生物燃料电池”能利用土壤中的电解质获得电能,供给某
(2009•陕西)某校研究性学习小组的同学,在网上浏览到一条信息:“微生物燃料电池”能利用土壤中的电解质获得电能,供给某种灯发光,如图甲所示,受此启发,他们用潮湿的土壤、铜片、锌片等制成了一个“土壤电池”,并测出有一定的电压,如图乙.那么“土壤电池电压的大小与哪些因系有关?”他们提出了以下猜想
猜想1:可能与铜片、锌片插入士壤的深度有关;
猜想2:可能与插人土壤的铜片和锌片之间的距离有关
为了验证猜想1,他们先在金属片上每隔2cm作好标记,再将铜片、锌片插人土壤中,保持它们之间的距离不变,改变两金属片插人土壤的深度,并记录相应的电压值,实验数据如下表:
(1)图丙是同学们最后一次测量时电压表的示数,请读出电压值,井填入上表空格中.锌片,铜片插入土壤深度cm 2 4 6 8 10 12 电压表示数V 0.6 0.61 0.63 0.66 0.69 ______
(2)请根据实验数据在图中作出图象.
(3)分析以上数据和图象,可以得出的初步结论是:______(写出一条即可).
(4)他们利用以上装置验证猜想2时,实验中应控制______不变,改变______,并依次记录电压表的示数.
 tianyuyoucai1年前1
tianyuyoucai1年前1 -
 怪怪不怪 共回答了21个问题
怪怪不怪 共回答了21个问题 |采纳率95.2%解题思路:(1)根据电压表的接线和读数分析.
(2)利用数学的描点法绘出电压和深度的图象
(3)用控制变量法进行分析,根据表格,在土壤性质不变情况下,分析土壤电池电压随铜片和锌片插入土壤深度与电压的关系.
(4)铜片和锌片插入土壤的深度不变情况下,电压随铜片和锌片距离变化而变化的关系.(1)根据两接线柱可以判断电压表使用的是0-3V的量程,电压表共分30格,所以每格表示0.1V,指针位于第7格,故读数为0.7V.故答案为:0.7V.(2)描出(2,0.6),(4,0.61),(6,0.63),(8,0.66),(10,0.69...
点评:
本题考点: 电压.
考点点评: 本题为实验探究设计题,答题时应仔细读题,明白材料中的信息,再根据要求一步一步的解答.使用了控制变量法,会设计合理的实验步骤进行推理.1年前查看全部
- (2003•黄石)某同学在研究性学习活动中,通过查阅资料、查到了一种由半导体材料做成的热敏电阻的阻值随温度变化的曲线,如
(2003•黄石)某同学在研究性学习活动中,通过查阅资料、查到了一种由半导体材料做成的热敏电阻的阻值随温度变化的曲线,如图1所示,并设计了如图2所示的电热敏电阻R(符合如图)和电磁继电器组成的温度自动控制装置.已知继电器的线型电阻R0为50Ω,左边电源电压为6V,当继电器线圈中的电流大于或等于20mA时,继电器的衔铁被吸合,右边发热电路则断开.问此温度自动控制装置安放在温箱中能将温度控制在多少℃?(要求写出计算过程)

 1984莹莹1年前1
1984莹莹1年前1 -
 我是枫叶 共回答了15个问题
我是枫叶 共回答了15个问题 |采纳率93.3%解题思路:当温度上升时,电阻R的阻值减小,电路中的电流增大,电磁铁的磁性增强,将衔铁吸下,电热丝电路断开,停止加热.过一段时间后,温度下降,电阻R的阻值增大,电路中的电流减小,电磁铁的磁性减弱,衔铁被弹簧拉起,电热丝电路接通,电热丝又开始工作加热,温度上升.当电流等于20mA时,求出总电阻,然后计算得到R,对应图象找出温度数值.当I=20mA=0.02A时,继电器衔铁被线圈吸合,发热电路断开,
根据欧姆定律可得,电路中的电阻:
R=[U/I]=[6V/0.02A]=300Ω,
∵串联电路中总电阻等于各分电阻之和,
∴此时热敏电阻:
R热=R-R0=300Ω-50Ω=250Ω,对应图象找出温度数值为50℃,
故能将温度控制在50℃.
答:此温度自动控制装置安放在温箱中能将温度控制在50℃.点评:
本题考点: 欧姆定律的应用;电阻的串联.
考点点评: 本题考查了串联电路的特点和欧姆定律的应用,关键是从题干中获取有用的信息和明白电磁继电器的原理.1年前查看全部
- 生物研究性学习小组的同学在进行遗传病调查时,发现一位男生患有两种遗传病,进一步调查后画出其家族的遗传病系谱图如图.下列说
 生物研究性学习小组的同学在进行遗传病调查时,发现一位男生患有两种遗传病,进一步调查后画出其家族的遗传病系谱图如图.下列说法错误的是( )
生物研究性学习小组的同学在进行遗传病调查时,发现一位男生患有两种遗传病,进一步调查后画出其家族的遗传病系谱图如图.下列说法错误的是( )
A.甲病的遗传方式属于常染色体显性遗传
B.从系谱图上可以看出甲病的遗传特点是家族中世代相传
C.Ⅱ7与Ⅱ8再生一个孩子是患甲病女儿的概率为[1/8]
D.已知Ⅱ3不是乙病基因的携带者,则乙病的类型为伴X染色体隐性遗传病 3951739801年前1
3951739801年前1 -
 smiletsr 共回答了19个问题
smiletsr 共回答了19个问题 |采纳率94.7%解题思路:1、阅读题干和遗传系谱图可知,本题是两对等位基因控制的遗传病,先分析系谱图判断遗传病的类型,写出相关基因型,再根据基因型进行概率计算.
2、人类遗传病判定口诀:双无生有为隐性,双有生无为显性;隐性遗传看女病,父子无病非伴性;显性遗传看男病,母女无病非伴性.A、Ⅱ7Ⅱ8均患甲病生出不患甲病的女儿和儿子,故甲病是常染色体显性遗传病,A正确;B、显性遗传病的发病率高,且代代相传,B正确;C、Ⅱ7的基因型为Aa,Ⅱ8的基因型为Aa,他们再生一个患甲病女儿的概率为34×12=38,...
点评:
本题考点: 常见的人类遗传病.
考点点评: 顺利解决此类问题,必须做到:(1)熟悉各种遗传方式的遗传特点;(2)在系谱图中迅速找到标志性的遗传特点;(3)情况不能确定时,要在可能性大小上仔细揣摩;(4)有时还要注意利用假设来反推,从而得到正确结论.1年前查看全部
- 某学校的研究性学习小组在实践活动中了解到,某石材厂有一批石灰石原料,其所含的杂质既不溶于水,也不溶于盐酸。为了测定该石灰
某学校的研究性学习小组在实践活动中了解到,某石材厂有一批石灰石原料,其所含的杂质既不溶于水,也不溶于盐酸。为了测定该石灰石的纯度,该研究性学习小组取用4g这种石灰石样品,用实验室现有稀盐酸40g分4次加入。每次充分反应后,经过滤、干燥等操作。操作后称量固体物质的质量。每次稀盐酸的用量及剩余固体的质量见下表。(假设过滤、干燥等操作过程,固体物质不受损耗) 稀盐酸的用量剩余固体的质量第一次加入10g3.0g第二次加入10g2.0g第三次加入10g1.0g第四次加入10g0.4g计算:
(1)该石灰石样品的纯度是多少?
(2)三、四次产生的二氧化碳的质量共为多少? 酷酷的男孩1年前1
酷酷的男孩1年前1 -
 baoguobin815 共回答了18个问题
baoguobin815 共回答了18个问题 |采纳率83.3%90%;0.704g1年前查看全部
- 下图是某研究性学习小组设计的示意图,最适合作为其标题的是 [ ] A.《
下图是某研究性学习小组设计的示意图,最适合作为其标题的是  [ ]
[ ]a.《多样性的***文明》
b.《典型的*********》
c.《*********的演变》
d.《***的制约与平衡》 01065001年前1
01065001年前1 -
 福哥15 共回答了20个问题
福哥15 共回答了20个问题 |采纳率95%A1年前查看全部
- 某学校兴趣小组组织开展一次研究性学习活动,估算地球周围大气层空气的分子个数。他们通过网上搜索,查阅得到以下几个物理量的数
某学校兴趣小组组织开展一次研究性学习活动,估算地球周围大气层空气的分子个数。他们通过网上搜索,查阅得到以下几个物理量的数据:地球半径R=6.4×10 6 m,地球表面的重力加速度g=9.8m/s 2 ,大气压强P 0 =1.0×10 5 Pa,空气的摩尔质量M=2.9×10 -2 kg/mol,阿伏加德罗常数N A =6.0×10 23 /mol。根据以上数据能估算出地球周围大气层空气的分子个数,只需要估算出个数的数量级。  maweiliufang1年前0
maweiliufang1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2012•高安市一模)某研究性学习小组的同学将不同的实心物体浸没在水中后放手,发现有的物体上升到水面,有的物体下沉到容
(2012•高安市一模)某研究性学习小组的同学将不同的实心物体浸没在水中后放手,发现有的物体上升到水面,有的物体下沉到容器底部,有的静止在水中不动,为了研究实心物体质量和体积对此现象的影响,他们用水做实验,记录实验数据如下表:
(1)李明同学分析比较实验序号1与4和2与5的数据现象,得出结论:在液体中,物体的上升和下降跟它的体积无关,跟它质量有关,且质量小的物体上升,质量大的物体下降.刘华同学分析比较实验序号1与4和2与5的数据及现象,得出结论:在液体中,物体的上升和下降跟它的质量无关,跟它的体积有关,且体积大的物体上升,体积小的物体下降.实验序号 物块 质量m/g 积体V/cm3 现象 1 A 7.5 30 上升到水面 2 B 25 50 上升到水面 3 C 24 24 静止在水中 4 D 21 12 下降到底部 5 E 100 40 下降到底部
请辨断:李明的结论是______的,刘华的结论是______的.(填“正确”、“错误”)
(2)进一步综合分析表中的数据及现象,并归纳得出结论:
当______时,液体中的物体上升;
当______时,液体中的物体悬浮在液体中;
当______时,液体中的物体下沉.
(3)由此我们可知,潜艇是在排水体积______,浮力______(选填“变大”“不变”“变小”),通过水舱______(选填“注水”或“排水”)从而实现下潜的. 已经幸福1年前1
已经幸福1年前1 -
 lflcm 共回答了21个问题
lflcm 共回答了21个问题 |采纳率90.5%解题思路:(1)要判断李明的结论是否正确,分析比较实验序号1与4和2与5的数据现象,看采用控制变量法能否得出“在液体中,物块的上升和下降跟它的体积无关,跟它的质量有关,且质量小的物 块上升,质量大的物块下降”的结论;同样要判断刘华的结论也采用同样的方法.
(2)综合分析表中的数据,计算物块的质量与体积的比值得出物块的密度,和水的密度比较,进一步推理得出结论;
(3)潜水艇是通过改变自重实现浮与沉的.(1)要研究在液体中,物块的上升和下降跟它的体积、质量是否有关,需要采用控制变量法,在物块的质量相同时,比较物块的体积,但分析实验序号1与4和2与5的数据现象,发现每组数据的质量和体积都不同,没有控制变量,因此无法得出“在液体中,物块的上升和下降跟它的体积无关;跟它的质量有关,且质量小的物 块上升,质量大的物块下降”的结论,所以李明的结论是错误的;同理刘华的结论也是错误的;
(2)分析表中的数据,在液体中上升的物块的共同特征是:物块的质量与体积的比值小于水的密度1g/cm3;在液体中下降的物块的共同特征是:物块的质量与体积的比值大于水的密度1g/cm3;静止在水中的物块的共同特征是:物块的质量与体积的比值等于水的密度1g/cm3;由此可得:
浸没在液体中的物体:
当ρ物<ρ液 时,液体中的物体上升;
当ρ物=ρ液时,液体中的物体悬浮在液体中;
当 ρ物>ρ液时,液体中的物体下沉.
(3)潜艇在水中,排开水的体积不变由阿基米德原理可知受到的浮力不变;当水舱注水时潜艇重力增大,当F浮<G时,而实现下潜.
故答案为:
(1)错误,错误;
(2)ρ物<ρ液 ,ρ物=ρ液,ρ物>ρ液
(3)不变,不变,注水.点评:
本题考点: 物体的浮沉条件及其应用.
考点点评: 本题考查了学生对物体浮沉条件的掌握和运用,当某物理量的影响因素有多个时,分析和探究过程以及实验结论的表述都要利用好控制变量法.1年前查看全部
- 归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:归纳正确的是(
归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:归纳正确的是( )
①常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则有c(Na + )+c(H + )=c(OH - )+c(CH 3 COO - )
②对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的百分含量一定增加
③常温下,AgCl在同物质的量浓度的CaCl 2 和NaCl溶液中的溶解度相同
④常温下,已知醋酸电离平衡常数为K a ;醋酸根水解平衡常数为K h ;水的离子积为K w ;则有:K a •K h =K w
⑤电解精炼铜时,电解质溶液中铜离子浓度不变.A.①④ B.①②④ C.①②④⑤ D.①②③④  珍妮小白1年前1
珍妮小白1年前1 -
 djfksdfs54f 共回答了24个问题
djfksdfs54f 共回答了24个问题 |采纳率91.7%①反应后的溶液中存在的离子有:Na + 、H + 、OH - 、CH 3 COO - ,根据电荷守恒可知:c(Na + )+c(H + )=c(OH - )+c(CH 3 COO - ),故①正确;
②对已建立化学平衡的某可逆反应,若减小生成物,平衡向着正向移动,但是生成物浓度会减小,故②错误;
③CaCl 2 和NaCl溶液中都含有氯离子,都抑制了氯化银的溶解,且氯离子浓度越大,其抑制程度越大,所以AgCl在相同物质的量浓度的CaCl 2 和NaCl溶液中的溶解度不同,故③错误;
④K a =
c( H + )•c(C H 3 CO O - )
c(C H 3 COOH) 、K h =
c(C H 3 COOH)•c(O H - )
c(C H 3 CO O - ) ,K a •K h =
c( H + )•c(C H 3 CO O - )
c(C H 3 COOH) ×
c(C H 3 COOH)•c(O H - )
c(C H 3 CO O - ) =c(OH - )×c(H + )=K w ,故④正确;
⑤电解精炼铜过程中,阳极活泼性较强的杂质铁、锌等先放电,而阴极只有铜离子得到电子生成铜,所以阳极溶解的铜与阴极析出的铜的物质的量不相等,溶液中铜离子浓度发生了变化,故⑤错误;
故选A.1年前查看全部
- 为研究水滑石的组成、结构和性质,某校研究性学习小组取得了二种牌号的水滑石样品拟进行探究,请你参与探究并回答相关问题。
为研究水滑石的组成、结构和性质,某校研究性学习小组取得了二种牌号的水滑石样品拟进行探究,请你参与探究并回答相关问题。

(1)甲同学取天然水滑石样品进行恒重分析,已知天然水滑石的化学式可表示为:6MgO·Al 2 O 3 ·CO 2 ·12H 2 O,取0.1mol水滑石进行加热时,温度与剩余固体质量的关系如下图,平行线上的数字表示残留固体的质量。
当温度在0~280℃质量不变,是什么原因: 。
A→B减少的物质及其物质的量为: ;
C→D减少的物质及其物质的量为: ;
D处化学组成为: 。
(2)乙组取的CA(美国化学文摘)登记号为12304-65-3 的合成水滑石样品,现只知其化学式为:Mg a Al b (OH) C (CO 3 ) d , a+b+c+d="25," a、b、c、d为正整数。取该水滑石样品0.1mol,用1mol/L盐酸使其完全溶解。
①消耗盐酸的体积至少为: L(用字母表示);
②若参加反应的盐酸的物质的量与生成CO 2 的物质的量之比为18∶1,则该水滑石的化学式为: 。 sgdfhfgjgjkgs1年前1
sgdfhfgjgjkgs1年前1 -
 jun jin 共回答了20个问题
jun jin 共回答了20个问题 |采纳率100%(1)天然水滑石在温度低于280℃是稳定的;0.4molH 2 O;0.1molCO 2 ;6MgO·Al 2 O 3 ;
(2)①0.1c+0.2d或0.2a+0.3b;②Mg 6 Al 2 (OH) 16 CO 3
(1)可减轻的部分包括水和二氧化碳。根据每次减轻的质量判断失重的成分。
(2)根据氢氧根、碳酸根和盐酸反应的比例判断,或者根据最后剩成氯化镁、氯化铝中金属离子和氯离子的比例也可判断。1年前查看全部
- (7分)“黄铜”是铜锌合金,具有较强机械性能,街头许多“金色”饰品就是用它来制作的。某研究性学习小组为了测定黄铜中铜的质
(7分)“黄铜”是铜锌合金,具有较强机械性能,街头许多“金色”饰品就是用它来制作的。某研究性学习小组为了测定黄铜中铜的质量分数,称取20g黄铜样品,放入烧杯中,然后加入某浓度的稀盐酸100 g(足量),用玻璃棒搅拌至不再产生气泡为止(反应的化学方程式为:Zn+2HCl====ZnCl 2 +H 2 ↑),称量剩余物质的总质量为119.8g。请计算:
⑴实验过程中,产生氢气的质量 __ ,你的计算依据是 。
⑵该铜锌合金中铜的质量分数。 tyhg123451年前1
tyhg123451年前1 -
 给自己的未来 共回答了29个问题
给自己的未来 共回答了29个问题 |采纳率89.7%(7分)
⑴0.2g 2分
设反应消耗锌的质量为m(Zn)
⑵Zn+2HCl====ZnCl 2 +H 2 ↑
65 2
m(Zn) 0.2g 2分
m(Zn)=65×0.2g/2
="6.5g " 2分
w(Cu)=20g-6.5g/20g×100% 1分
=67.5 %
答: 该铜锌合金中铜的质量分数为67.5 %。
略1年前查看全部
- 英语研究性学习如何提高写作能力摘要
 lumei0071年前1
lumei0071年前1 -
 sdfsgdfhrth3 共回答了19个问题
sdfsgdfhrth3 共回答了19个问题 |采纳率84.2%学习英语没有捷径可言,要学会调整心态,自我总结学习方法,以下作为一个过来人总结的学习方法
1.坚持不懈,从不间断.每天至少看 15-20 分钟的英语,早晨和晚上是学英语的最好时间.
2.方法要灵活多样.一种方式学厌了,可以变换其他的方式,以便学而不厌.
3.上下相连,从不孤立.记忆英语要结合上下文,不要孤立的记单词和短语,要把握句中的用法.
4.熟记常用语,确保准确无误.把常用的交际用语背熟,熟能生巧.
5.尽量用第一人称来记忆习惯用语和句型,以便记忆牢固.
6.多方位多角度来学英语.经常读报、听广播、看外语电影、听外语讲座、读课本和别人交谈等方式来练习英
7.敢于开口说英语,不要怕说错.只要敢说,就一定能学好.
8.要创设情景,加强交际训练.语言的运用离不开场景的强化训练,只有交际,才能学好.
9.勤奋和持续坚持..多背,课文范例,背得越多越好,越熟越好;大多数人学不好英语根本的原因是懒惰和三天打鱼两天晒网
10.把英语当成一门声音而不是文字来学.英语首先是一门声音,敢说,加入英语学习,天天说,大胆说,大声说,不怕错,错了及时纠正.
11.环境很重要,学英语要有固定的语言环境,天天说,效果会倍增的,我就是这么学过来的1年前查看全部
- (2006•安徽)学校研究性学习小组选择探究“CuSO4溶液显蓝色与什么离子有关”作为研究课题,以下是他们提交的实验方案
(2006•安徽)学校研究性学习小组选择探究“CuSO4溶液显蓝色与什么离子有关”作为研究课题,以下是他们提交的实验方案,其中不需要做的实验是( )
A. 观察Na2SO4、K2SO4溶液的颜色
B. 观察CuCl2、Cu(NO3)2溶液的颜色
C. 向CuSO4溶液中滴加适量的NaOH溶液,静置后观察溶液颜色
D. 加水稀释后观察溶液的颜色 rebeccazl1年前1
rebeccazl1年前1 -
 ddmddmdd 共回答了23个问题
ddmddmdd 共回答了23个问题 |采纳率91.3%解题思路:在硫酸铜溶液中存在硫酸根和铜离子,若要观察使硫酸铜溶液呈现蓝色的离子,应分别观察含有铜离子的溶液和含有硫酸根的溶液颜色,还应该观察使铜离子沉淀后溶液的颜色,这样能够证明究竟是什么离子使溶液显色.无需要观察溶液稀释后的颜色.A、Na2SO4、K2SO4溶液无色,说明SO42-不显色,所以该选项能证明CuSO4溶液显蓝色不是由SO42-离子造成的,此项不合题意;
B、CuCl2、Cu(NO3)2溶液中无SO42-,而有Cu2+,溶液颜色呈蓝色,说明Cu2+显蓝色,所以该选项能证明CuSO4溶液显蓝色不是由SO42-离子造成的,此项不合题意;
C、CuSO4溶液与NaOH溶液混合后生成Cu(0H)2沉淀和Na2SO4溶液,此时溶液中无Cu2+,而有SO42-,振荡后静置,溶液颜色消失,说明SO42-不显色,所以该选项能证明CuSO4溶液显蓝色不是由SO42-离子造成的,此项不合题意;
D、加水稀释CuSO4溶液后,溶液中仍既有Cu2+又有SO42-,所以颜色变浅并不知是哪个离子引起的,故该选项对证明CuSO4溶液显蓝色不是由SO42-离子造成的无意义,此项符合题意;
故选:D.点评:
本题考点: 实验探究物质的性质或变化规律;科学探究的基本方法.
考点点评: 某些溶液显特有的颜色是因为含有某种离子的原因,即某些离子是有色的,如:Cu2+显蓝色,Fe2+显浅绿色1年前查看全部
- 某研究性学习小组选取学校附近鱼塘中5种不同的生物(A、B、C、D、E)进行了研究:一是对它们消化道内食物的组成进行分析;
某研究性学习小组选取学校附近鱼塘中5种不同的生物(A、B、C、D、E)进行了研究:一是对它们消化道内食物的组成进行分析;二是请专家对这5种生物体内的两种主要污染物含量进行了测定。其结果见下表: 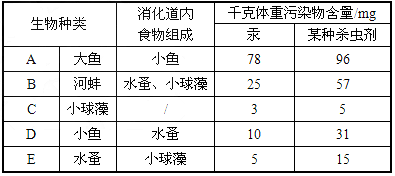
(1)根据表中提供的信息,以食物网形式表示5种生物之间的营养关系(以A、B、C、D、 E代表5种生物)___________。
(2)写出该食物网中最长的一条食物链。_________________。
(3)鱼是人们的美味佳肴,原来爱吃大鱼的人较多,现在很多人更喜欢吃小鱼了。你认为主要原因是什么?____________________。 guosys1年前1
guosys1年前1 -
 cmxenglish 共回答了15个问题
cmxenglish 共回答了15个问题 |采纳率86.7%1年前查看全部
- (2010•安徽)11月22日,某地理研究性学习小组在观测房屋采光状况时,发现甲楼阴影恰好遮住乙楼三层中部(如图所示),
(2010•安徽)11月22日,某地理研究性学习小组在观测房屋采光状况时,发现甲楼阴影恰好遮住乙楼三层中部(如图所示),在甲楼顶层GPS测得纬度为31.8366°、经度为117.2179°、高度为96m.回答7~8题.

7.隔25小时再次观测时,甲楼阴影可遮挡乙楼( )
8.此后一个月内( )
A.法国进入冷饮畅销期
B.广东省进入雨季
C.澳大利亚播种冬小麦
D.云南省昼短夜长 junehorse1年前1
junehorse1年前1 -
 百合预 共回答了19个问题
百合预 共回答了19个问题 |采纳率89.5%解题思路:主要考查了太阳直射点的回归运动,11月22日,太阳直射点位于南半球,此后一个月内,太阳直射点位于南半球并向南回归线移动,此时北半球为冬季,由此判断地理现象的正确性.A、北半球夏半年,法国冷饮畅销,故不符合题意;
B、北半球夏半年,广东省进入雨季,故不符合题意;
C、澳大利亚播种季节为北半球春季,故不符合题意;
D、云南省昼短夜长为北半球冬季,故正确.
故选:D.点评:
本题考点: 地球公转的方向、轨道、周期和速度.
考点点评: 本题难度适中,属于知识性试题,解题的关键是掌握太阳直射点的回归运动及地理现象的判断.1年前查看全部
- 某校研究性学习小组,为了分析2012年某小国的宏观经济形势,查阅了有关材料,得到2011年和2012年1-5月该国CPI
某校研究性学习小组,为了分析2012年某小国的宏观经济形势,查阅了有关材料,得到2011年和2012年1-5月该国CPI同比(即当年某月与前一年同月比)的增长数据(见下表),但2012年3,4,5三个月的数据(分别记为x,y,z)没有查到,有的同学清楚记得2012年1-5月的CPI数据成等差数列.
(Ⅰ)求x,y,z的值;
(Ⅱ)求2012年1-5月该国CPI数据的方差;
(Ⅲ)一般认为,某月CPI达到或超过3个百分点就已经通货膨胀,而达到或超过5个百分点则严重通货膨胀.现随机的从下表2011年的五个月和2012年的五个月的数据中各抽取一个数据,求相同月份2011年通货膨胀,并且2012年严重通货膨胀的概率.附表:2011年和2012年1-5月CPI数据(单位:百分点 注:1个百分点=1%)
年份
月份1 2 3 4 5 2011 2.7 2.4 2.8 3.1 2.9 2012 4.9 5.0 x y z  heming_011年前1
heming_011年前1 -
 faxking 共回答了26个问题
faxking 共回答了26个问题 |采纳率92.3%解题思路:(Ⅰ)根据题意,结合等差数列的性质,可得该数列的公差为0.1,进而可得x、y、z的值;(Ⅱ)由(Ⅰ)的结论可得2012年中1-5月全部数据,先计算出5个数据的平均数,进而由方差公式计算可得答案;(Ⅲ)根据题意,用(m,n)表示随机地从2011年的五个月和2012年的五个月的数据中各抽取一个数据的基本事件,由列举法可得抽取数据的情况,分析可得事件“相同月份2011年通货膨胀,并且2012年严重通货膨胀”包含的基本事件的数目,由古典概型公式,计算可得答案.(Ⅰ)依题意得4.9,5.0,x,y,z成等差数列,所以公差d=5.0-4.9=0.1,
故x=5.0+0.1=5.1,y=x+0.1=5.2,z=y+0.1=5.3;
(Ⅱ)由(Ⅰ)知2012年1~5月该国CPI的数据为:4.9,5.0,5.1,5.2,5.3,
∴
.
x=5.1,
∴s2=
1
5[(4.9−5.1)2+(5.0−5.1)2+(5.1−5.1)2+(5.2−5.1)2+(5.3−5.1)2]=0.02;
(Ⅲ)根据题意,用m表示2011年的数据,n表示2012年的数据,则(m,n)表示随机地从2011年的五个月和2012年的五个月的数据中各抽取一个数据的基本事件,
则所有基本事件有:(2.7,4.9),(2.7,5.0),(2.7,5.1),(2.7,5.2),(2.7,5.3),
(2.4,4.9),(2.4,5.0),(2.4,5.1),(2.4,5.2),(2.4,5.3),
(2.8,4.9),(2.8,5.0),(2.8,5.1),(2.8,5.2),(2.8,5.3),
(3.1,4.9),(3.1,5.0),(3.1,5.1),(3.1,5.2),(3.1,5.3),
(2.9,4.9),(2.9,5.0),(2.9,5.1),(2.9,5.2),(2.9,5.3);共25个基本事件;
其中满足相同月份2011年通货膨胀,并且2012年严重通货膨胀的基本事件有(3.1,5.0),(3.1,5.1),(3.1,5.2),(3.1,5.3),有4个基本事件;
∴P=[4/25]=0.16,即相同月份2011年通货膨胀,并且2012年严重通货膨胀的概率为0.16.点评:
本题考点: 数列的应用.
考点点评: 本题考查古典概型的计算,涉及等差数列的性质、平均数、方差的计算与列举法的应用;注意在列举时做到不重不漏,同时要正确计算.1年前查看全部
- (2009•大庆)某研究性学习小组的同学为了解某地区的地质情况,从实地取回两块样品A和B,进行如下图所示的实验(图中部分
(2009•大庆)某研究性学习小组的同学为了解某地区的地质情况,从实地取回两块样品A和B,进行如下图所示的实验(图中部分反应产物被略去).

(1)请你根据上图实验现象推断下列物质的化学式.A:______;B:______.
(2)写出下列转化的化学方程式.
E→G:CO2+C
2CO高温 .CO2+C;
2CO高温 .
C→D:______;
A+G→I:3CO+Fe2O3
2Fe+3CO2高温 .3CO+Fe2O3.
2Fe+3CO2高温 .
(3)所加试剂X可能是氧化物、酸、碱、盐中的______. 闲时逛逛1年前1
闲时逛逛1年前1 -
 水果布丁6 共回答了23个问题
水果布丁6 共回答了23个问题 |采纳率82.6%解题思路:(1)根据J溶液是浅绿色,所以J中有亚铁离子,金属单质和X会生成亚铁离子,所以I就是铁,D是红褐色的沉淀,所以D是氢氧化铁,H是碱,C是黄色的溶液,是由红色固体A和盐酸反应生成的,所以C是氯化铁,A就是氧化铁;氧化铁和气体G会生成铁单质,G是由E和碳高温生成的,所以G是一氧化碳,E是二氧化碳,F会与水生成碱,所以F是氧化钙,B主要成分是碳酸钙,将推出的物质验证即可;
(2)根据(1)中推出的反应物、生成物书写方程式;
(3)根据铁和X反应生成的是亚铁离子进行分析.(1)J溶液是浅绿色,所以J中有亚铁离子,金属单质和X会生成亚铁离子,所以I就是铁,D是红褐色的沉淀,所以D是氢氧化铁,H是碱,C是黄色的溶液,是由红色固体A和盐酸反应生成的,所以C是氯化铁,A就是氧化铁;氧化铁和气体G会生成铁单质,G是由E和碳高温生成的,所以G是一氧化碳,E是二氧化碳,F会与水生成碱,所以F是氧化钙,B主要成分是碳酸钙,经过验证各种物质都满足转换关系,故答案为:Fe2O3CaCO3
(2)二氧化碳和碳在高温的条件下生成一氧化碳,故答案为:CO2+C
高温
.
2CO
氯化铁和氢氧化钙反应生成氢氧化铁沉淀和氯化钙,故答案为:2FeCl3+3Ca(OH)2═2Fe(OH)3↓+3CaCl2
氧化铁和一氧化碳在高温的条件下生成铁和二氧化碳,故答案为:3CO+Fe2O3
高温
.
2Fe+3CO2
(3)铁在置换反应中才能转化成亚铁离子,所以X是酸或盐,故答案为:酸或盐.
故答案为:
(1)Fe2O3CaCO3
(2)CO2+C
高温
.
2CO
2FeCl3+3Ca(OH)2═2Fe(OH)3↓+3CaCl2;3CO+Fe2O3
高温
.
2Fe+3CO2
(3)酸或盐点评:
本题考点: 物质的鉴别、推断;化学式的书写及意义;书写化学方程式、文字表达式、电离方程式.
考点点评: 在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质题中的转换关系推导剩余的物质,最后进行验证即可.1年前查看全部
- 某生物研究性学习小组,在对沂山某地域内的动、植物种类进行调查后,绘制了如图所示食物关系图.请据图回答下列问题.
 某生物研究性学习小组,在对沂山某地域内的动、植物种类进行调查后,绘制了如图所示食物关系图.请据图回答下列问题.
某生物研究性学习小组,在对沂山某地域内的动、植物种类进行调查后,绘制了如图所示食物关系图.请据图回答下列问题.
(1)若要构成一个生态系统,还需增加的成分有______.
(2)蛇与鹰之间的生态学关系是______;处在第三营养级的生物有______.
(3)若蜘蛛获得10千焦的能量,则最少需从蝴蝶中获取______千焦的能量.若该区域受到某种重金属污染,一段时间后体内积存该物质最多的生物是______.
(4)沂山生物种类及数量能够较长时间保持一种动态平衡,原因是______.
(5)给农作物施肥过多会出现“烧苗”现象.原因是:施肥过多造成土壤溶液浓度______根细胞细胞液浓度,使根细胞______. 3439760841年前1
3439760841年前1 -
 yzg1692 共回答了9个问题
yzg1692 共回答了9个问题 |采纳率88.9%解题思路:一个完整的生态系统包括生物部分和非生物部分,而生物部分由生产者(植物)、消费者(动物)和分解者(细菌、真菌)组成.
在一般情况下,生态系统中各种生物的数量和所占的比例是相对稳定的.这说明生态系统具有一定的自动调节能力,能调节维持生态系统中各种生物的动态平衡,但这种调节能力是有一定限度的.
植物细胞吸水和失水的原理是细胞外部溶液的浓度大于细胞内部浓度时细胞失水,细胞外部溶液的浓度小于细胞内部浓度时细胞吸水.(1)食物网中含有生态系统中的生产者和消费者,要构成生态系统,还要有分解者和非生物部分.
(2)鹰捕食蛇为食,它们是捕食关系,同时,鹰和蛇又都以野兔和田鼠为食,它们还存在竞争关系.凡是以初级消费者为食物的都属于第三营养级,所以,图中属于第三营养级的有蜘蛛、食虫鸟、蛇、鹰.
(3)能量在生态系统中的传递效率为10%~20%,所以,蜘蛛获得l0千焦的能量,则最少需从蝴蛛中获取10÷20%=50千焦的能量,要按照最大能量传递效率计算.在生态系统中,一些有害物质(如重金属、化学农药等),通过食物链在生物体内不断积累的过程.因为这些有害物质化学性质稳定,在生物体内是难以分解、无法排出的,所以随着营养级的升高而不断积累,在该区域中,鹰所处的营养级最高,所以,含有的重金属最多.
(4)在一般情况下,生态系统中各种生物的数量和所占的比例是相对稳定的.这说明生态系统具有一定的自动调节能力,能调节维持生态系统中各种生物的动态平衡,但这种调节能力是有一定限度的.
(5)植物细胞吸水和失水的原理是细胞外部溶液的浓度大于细胞内部浓度时细胞失水,细胞外部溶液的浓度小于细胞内部浓度时细胞吸水.若一次性给农作物施肥过多,会使土壤溶液浓度过高,大于植物细胞溶液的浓度,植物细胞不能吸水,反而会失水,导致植物因失水而萎蔫,造成“烧苗”现象.
故答案为:(1)分解者,非生物部分;
(2)捕食关系和竞争关系;蜘蛛、食虫鸟、蛇、鹰;
(3)50;鹰;
(4)生态系统具有一定的自动调节能力;
(5)大于;失水点评:
本题考点: 生态系统中的食物链和食物网;生态系统的组成及各部分的作用;某些有害物质沿食物链积累.
考点点评: 掌握生态系统的组成、生态系统中各种生物之间的关系、生态系统的自动调节能力是解题的关键.1年前查看全部
- 某学校开展研究性学习活动,一组同学获得了下面的一组实验数据: 现准备用下列四个函数中的一个近似地表示这些数据的规律,其中
某学校开展研究性学习活动,一组同学获得了下面的一组实验数据: 
现准备用下列四个函数中的一个近似地表示这些数据的规律,其中最接近的一个是 [ ]A.y=2x-2
B.y=( ) x
) x
C.y=log 2 x
D.y=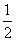 (x 2 -1)
(x 2 -1)  卖男孩的大火柴1年前1
卖男孩的大火柴1年前1 -
 aahdj 共回答了20个问题
aahdj 共回答了20个问题 |采纳率100%D1年前查看全部
- 某中学化学研究性学习小组利用以下装置制取并探究氨气的性质
某中学化学研究性学习小组利用以下装置制取并探究氨气的性质
[A中发生反应的化学方程式:2NH 4 Cl+Ca(OH) 2 2NH 3 ↑+2H 2 O+CaCl 2 ] 。
2NH 3 ↑+2H 2 O+CaCl 2 ] 。 
【实验探究】
(1)A中的反应___(填“是”或“不是”)氧化还原反应。
(2)A装置还可用于制取____气体(只填一种)。
(3)若有10.7 g NH 4 Cl固体,最多可制取NH 3 (标准状况)的体积是____L(NH 4 Cl 的摩尔质量为53.5
g·mol -1 )。
(4)实验室收集氨气的方法是___。
(5)C、D装置中颜色会发生变化的是___(填“C”或“D”)。
(6)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是___。
(7)为防止过量氨气造成空气污染,需要在上述装置的末端增加一个尾气处理装置,合适的装置是____(填“F”或“G”)。
【知识拓展】
(8)生石灰与水反应生成Ca(OH) 2 并放出热量[化学方程式为CaO+H 2 O==Ca(OH) 2 ]。实验室利用此原理,往生石灰中滴加浓氨水,可以快速制取氨气。你认为生石灰可用下列 ___物质代替(填序号)。
A.碱石灰(NaOH与CaO的固体混合物)
B.NaOH固体
C.硫酸溶液
D.石灰石(CaCO 3 )
【知识应用】
(9) 2010年11月9日晚,我省宁德市一冷冻厂发生氨气泄漏事件,500多居民深夜大转移。假如你在现场,你会采用什么自救方法? 二三加人1年前1
二三加人1年前1 -
 机构的士的 共回答了13个问题
机构的士的 共回答了13个问题 |采纳率92.3%(1)不是
(2) O 2 (或氧气,其他合理答案即可)
(3)4. 48
(4)向下排空气法
(5)D
(6)有白烟生成
(7)F
(8)A B
(9)
①用湿毛巾捂住口鼻,并迅速撤离。
②低头弯腰,往低处跑,迅速撤离。
③逆风奔跑,迅速撤离。
④戴上防毒面具,迅速撤离。1年前查看全部
- (2009•朝阳)某校研究性学习小组用如图装置进行镁条在空气中燃烧的实验.当燃烧停止、冷却后打开止水夹、进入集气瓶中水的
(2009•朝阳)某校研究性学习小组用如图装置进行镁条在空气中燃烧的实验.当燃烧停止、冷却后打开止水夹、进入集气瓶中水的体积约占集气瓶体积的70%.请回答:
(1)如图A仪器的名称是烧杯烧杯;冷却后打开止水夹,水能进入集气瓶的原因是镁条燃烧消耗了集气瓶内的气体,使瓶内的压强减小镁条燃烧消耗了集气瓶内的气体,使瓶内的压强减小.
(2)如果镁条只和空气中的氧气反应,则进入集气瓶中水的体积最多不超过其容积的2121%.现进入集气瓶中水的体积约为其容积的70%,根据空气的组成可推出减少的气体中有氮气.
【发现问题】氮气是怎么减少的呢?
【作出假设】氮气与镁条反应而减少.
【查阅资料】镁条在氮气中能燃烧,产物为氮化镁(Mg3N2)固体.请你写出该反应的化学方程式3Mg+N2
Mg3N23Mg+N2点燃 .
Mg3N2,氮化镁中氮元素的化合价为-3-3价.点燃 .
【交流反思】通过上述探究,你对燃烧的有关知识有了什么新的认识?(写一条即可)燃烧不一定都需要有氧气参加燃烧不一定都需要有氧气参加. 維拉1年前1
維拉1年前1 -
 骑猪逛夜市 共回答了17个问题
骑猪逛夜市 共回答了17个问题 |采纳率88.2%(1)基本仪器之一烧杯;原因同课本中“探究空气中氧气含量”实验原理相同,固体燃烧消耗了集气瓶内的气体,使瓶内的压强减小
(2)如果只和空气中氧气反应那么不会超过21%,因为空气中氧气占21%;“镁条在氮气中能燃烧,产物为氮化镁(Mg3N2)固体”由化学方程式书写步骤可写出;镁通常显+2价,在化合物中,化合价的代数之和为0,可计算出氮化合价.通过此实验可知,燃烧不一定需要氧气;氮气也未必不支持燃烧
故正确答案:
(1)烧杯;镁条燃烧消耗了集气瓶内的气体,使瓶内的压强减小
(2)21
【查阅资料】3Mg+N2
点燃
.
Mg3N2;-3
【交流反思】燃烧不一定都需要有氧气参加(或氮气也能支持某些物质的燃烧)1年前查看全部
- (2014•蓟县一模)(一)为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2.已知:
(2014•蓟县一模)(一)为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2.已知:
2CO(g)+O2(g)═2CO2(g);△H=566kJg•moL-1
2H2(g)+O2(g)═2H2O(g)△H=483.6kJ g•moL-1
H2O(g)═H2O(I);△H=44.0kJg•moL-1
(1)氢气的燃烧热为______kJg•moL-1
(2)写出CO和H2O(g)作用生成CO2和H2的热化学方程式______.
(二)在一固定容积的密闭容器中进行着如下反应:CO2(g)+H2(g)⇌CO(g)+H2O(g)其平衡常数K和温度t的关系如下:
(1)K的表达式为:t℃ 700 800 850 1000 1200 K 2.6 1.7 1.0 0.9 0.6 K=
,c(CO)•c(H2O) c(CO2)•c(H2) K=;
,c(CO)•c(H2O) c(CO2)•c(H2)
(2)该反应的正反应为______反应(“吸热”或“放热”)
(3)能判断该反应是否已经达到化学平衡状态的是:______
A.容器中压强不变 B.混合气体中CO浓度不变
C.v(H2)正=v(H2O)逆 D.c(CO2)=c(CO)
(4)在850℃时,可逆反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),在该容器内各物质的浓度变化如下:
计算:3min-4min达到平衡时CO的平衡浓度c3和CO2(g)的转化率,要求写出简单的计算过程(c3精确到小数点后面三位数)时间/min CO2(mol/L) H2(mol/L) CO(mol/L) H2O(mol/L) 0 0.200 0.300 0 0 2 0.138 0.238 0.062 0.062 3 c1 c2 c3 c3 4 c1 c2 c3 c3  冰竹chendeqin2631年前1
冰竹chendeqin2631年前1 -
 迷惑的古惑 共回答了21个问题
迷惑的古惑 共回答了21个问题 |采纳率90.5%解题思路:(一)(1)由2H2(g)+O2(g)═2H2O(g)△H=-483.6KJ/mol、H2O(g)═H2O(l)△H=-44.0KJ/mol来计算;
(2)利用2CO(g)+O2(g)═2CO2(g)△H=-566KJ/mol、2H2(g)+O2(g)═2H2O(g)△H=-483.6KJ/mol结合盖斯定律来写出CO和 H2O(g)作用生成CO2和H2的热化学方程式;
(二)(1)平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积;
(2)平衡常数与温度的关系判断平衡移动方向进行分析判断吸热放热;
(3)根据化学平衡状态的特征-正逆反应速率相等,各组分含量保持不变进行判断;
(4)依据容器中浓度变化结合化学平衡的三段式列式计算,结合平衡常数不随温度变化,根据转化率公式进行计算.(一)(1)由2H2(g)+O2(g)═2H2O(g)△H=-483.6KJ/mol、2H2O(g)═2H2O(l)△H=-88.0KJ/mol,即2mol氢气燃烧生成液态水,放出的热量为483.6kJ+88kJ=571.6kJ,
则1mol氢气燃烧生成液态水时放出的热量为285.8kJ,
故答案为:285.8;
(2)由①2CO(g)+O2(g)═2CO2(g)△H=-566KJ/mol、②2H2(g)+O2(g)═2H2O(g)△H=-483.6KJ/mol,
根据盖斯定律可知[①−②/2]得CO(g)+H2O(g)═CO2(g)+H2(g),△H=
−566kJ/mol−(−483.6kJ/mol)
2=-41.2kJ/mol,
即热化学反应方程式为CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.2kJ/mol,
故答案为:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.2kJ/mol;
(二)(1)平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,所以K=
c(CO)•c(H2O)
c(CO2)•c(H2),
故答案为:
c(CO)•c(H2O)
c(CO2)•c(H2);
(2)温度越高,K值越小,说明升温平衡向逆反应方向移动,故正反应为放热反应,
故答案为:放热;
(3)A.因该反应为反应前后气体体积不变的反应,故容器中压强不变不能作为平衡状态的判据,故A错误;
B.混合气体中CO浓度不变,表明各组分的浓度不再变化,达到了平衡状态,故B正确;
C.v(H2)正=v(H2O)逆,说明正逆反应速率相等,能作为平衡状态的判据,故C正确;
D.c(CO2)=c(CO)不能判断化学平衡状态,和起始量有关,故D错误;
故答案为:BC;
(4)
CO2(g)+H2(g)⇌CO(g)+H2O(g)
起始浓度/mol•L-10.20.300
变化浓度/mol•L-1:c3 c3 c3c3
平衡浓度/mol•L-1:0.2-c30.3-c3c3c3
由题意知,850℃时,K=1.0,即
K=
c(CO)•c(H2O)
c(CO2)•c(H2)=
c32
(0.2−c3)(0.3−c3)=1.0,
解得c3=0.12mol/L,
二氧化碳的转化率=[0.12mol/L/0.2mol/L]×100%=60%,
故答案为:0.12mol/L;60%.点评:
本题考点: 热化学方程式;化学平衡状态的判断;化学平衡的计算.
考点点评: 本题主要考查热化学方程式、温度对化学平衡、化学平衡常数的影响,化学平衡常数的计算,化学平衡的标志判断,难度不大,考查学生分析和解决问题的能力.1年前查看全部
- 了测定黄铜(铜,锌混合物)的组成,某研究性学习小组称取黄铜样品10g,向其中加入19.5百分号的稀硫酸50g
了测定黄铜(铜,锌混合物)的组成,某研究性学习小组称取黄铜样品10g,向其中加入19.5百分号的稀硫酸50g
完全反应后,称得烧杯中剩余的物质质量为59.9g.
①10g+50g-59.9g=0.1g表示( )的质量
②样品中铜的质量分数为( )
③通过计算反应后的溶液溶质中有无硫酸
麻烦哪位高手给我细细讲解下,我的化学真的不好~ 2727843451年前1
2727843451年前1 -
 clmmiky 共回答了17个问题
clmmiky 共回答了17个问题 |采纳率76.5%①10g+50g-59.9g=0.1g表示( 生成氢气 )的质量
铜与稀硫酸不反应
Zn+H2SO4=ZnSO4+H2
65 98 2
x y 0.1g
65/x=98/y=2/0.1g
x=3.25g
y=4.9g
②样品中铜的质量分数为(10g-3.25g)/10g*100%=67.5%
50g*19.5%=9.75g>4.9g
③反应后的溶液溶质中有硫酸1年前查看全部
- 甲、乙两位同学组成研究性学习小组来研究物体的超重和失重现象.他们在运动着的一升降机内做实验,站在体重计上的甲同学从体重计
甲、乙两位同学组成研究性学习小组来研究物体的超重和失重现象.他们在运动着的一升降机内做实验,站在体重计上的甲同学从体重计上发现了自已的体重增加了20%,于是乙同学对该过程中升降机的运动情况作出了如下判断,其中可能正确的是( )
A. 升降机以0.8g的加速度加速下降
B. 升降机以0.2g的加速度加速上升
C. 升降机以0.2g的加速度减速下降
D. 升降机以0.8g的加速度减速上升 Nàpishtim1年前1
Nàpishtim1年前1 -
 robin915 共回答了13个问题
robin915 共回答了13个问题 |采纳率84.6%解题思路:体重计的示数显示人对体重计的压力大小;1.超重:物体对支持物的压力(或对悬绳的拉力)大于物体所受重力的现象叫做超重. 2.失重:物体对支持物的压力(或对悬绳的拉力)小于物体所受重力的现象叫做失重.根据牛顿第三定律,人对升降机的压力和升降机对人的支持力大小相等,方向相反并且总是作用在同一条直线上,故支持力N等于1.2mg;
对人受力分析,受到重力和向上的支持力,根据牛顿第二定律,有
N-mg=ma
即
1.2mg-mg=ma
故
a=0.2g,竖直向上;
当速度向上时,人加速上升;
当速度向下时,人减速下降;
故选BC.点评:
本题考点: 牛顿运动定律的应用-超重和失重.
考点点评: 本题关键是要明确超重只是物体对支撑物的压力或者对悬挂物的拉力变大了,实际重力是不变的,然后根据牛顿第二定律列式求解即可.1年前查看全部
- 某化学研究性学习小组的同学将43.75g石灰石(杂质SiO2不参加反应,也不溶于水)放入一定质量的某稀盐酸中,恰好完全反
某化学研究性学习小组的同学将43.75g石灰石(杂质SiO2不参加反应,也不溶于水)放入一定质量的某稀盐酸中,恰好完全反应,过滤(滤液损失不计),得到114g滤液,再向其中加入163.5g水,结果就得到了10%的溶液作为路面保湿剂.计算原稀盐酸中溶质的质量分数.
 jingle0301年前1
jingle0301年前1 -
 zmjmm 共回答了20个问题
zmjmm 共回答了20个问题 |采纳率90%解题思路:根据最后所得的溶液质量以及溶质质量分数可以求出溶质的质量,利用该质量可以利用方程式求出氯化钙的质量,依次为突破口分析解答即可;反应后溶液中溶质氯化钙的质量为(114g+163.5g)×10%=27.75g
设石灰石中碳酸钙的质量是x 反应的氯化氢质量是y 生成二氧化碳的质量是z
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 11144
xy27.75g z
[100/x=
73
y=
111
27.75g=
44
z]
x=25g y=18.25g z=11g
则加入盐酸的质量为114g+11g-25g=100g,故所采用的盐酸溶质质量分数为:[18.25g/100g]×100%=18.25%
答:盐酸中溶质的质量分数为18.25%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 此题是对化学方程式计算的综合考查,解题的关键是对氯化钙的计算和利用质量守恒定律对盐酸溶液的计算;1年前查看全部
- 1.某研究性学习小组调查发现,甲、乙两工厂排放的污水各含下列离子:H、Cu、K、NO3、OH中的三种离子(两厂有一种相同
1.某研究性学习小组调查发现,甲、乙两工厂排放的污水各含下列离子:H、Cu、K、NO3、OH中的三种离子(两厂有一种相同离子).若将两厂的污水按一定比例混合,沉淀后污水会变成无色澄清中性溶液.下列说法正确的是:
A.OH和Cu来自同一工厂 B.H和OH来自同一工厂
C.Cu和K来自同一工厂 D.H和Cu来自同一工厂
(两厂排放的污水中所含的离子分别是什么?为什么共同含有的离子是NO3-不是K+啊
2.下列离子能在PH=2的无色溶液中大量共存的是()
A .SO4 Fe Na OH
B.K SO4 Cu NO3
C.Cl K SO4 Na
D.Ca Cl CO3 Na
3.下列各组物质,只需用组内溶液相互混合就能鉴别出来的是
A K2SO4 BaCL2 NaNO3 NaCL
B HCL Na2CO3 BaCL2 Na2SO4
C KOH Na2SO4 CuSO4 HCL
D KCL AgNO3 KNO3 NaCL
这个答案是多选的 为什么选B C 白色海浪1年前1
白色海浪1年前1 -
 简单最靠得住 共回答了15个问题
简单最靠得住 共回答了15个问题 |采纳率100%1.甲:H+ Cu2+ NO3- 乙:K+ OH- NO3-
思路:H+与OH-,Cu2+与OH-不共存,可以肯定H+与Cu2+来自同一工厂
污水中的离子一定有阴离子有阳离子(溶液显电中性),阴离子必是NO3-
可确定甲为:H+,Cu2+,NO3-
乙肯定有OH-,K+,排除可知剩下的一种是NO3-
2.pH=2,代表溶液呈酸性,有H+
A中OH-不行,而且Fe离子与OH-反应
D中CO3 2- 不行,且Ca2+与CO3 2-反应
3.B都是无色透明溶液,先用小试管取样,任取一种,分别加入其它试管中,4种情况:
(1)一个有气泡,其他两个无现象.取的是HCl,有气泡的是Na2CO3,.再取Na2CO3分别加入剩余两种试剂的样品,有白色沉淀的是BaCl2,无现象的是Na2SO4.
(2)一个有气泡,一个有沉淀,一个无现象.取的是Na2CO3,有气泡的是HCl,有沉淀的是BaCl2,无现象的是Na2SO4.
(3)一个有沉淀,其他两个无现象.取的是BaCl2,有沉淀的是Na2CO3.再取Na2CO3分别加入剩余两种试剂,有气泡的是HCl,无现象的是Na2SO4.
(4)均无现象.取的是Na2SO4.在剩下的三种中任取一种,加入其它两种,情况有三:
1.一个有气泡,一个无现象.取的是HCl,有气泡的是Na2CO3,无现象的是BaCl2.
2.一个有气泡,一个有沉淀.取的是Na2CO3,有气泡的是HCl,有沉淀的是BaCl2.
3.一个无现象,一个有沉淀.取的是BaCl2,无现象的是HCl,有沉淀的是Na2CO3.
C CuSO4,是蓝色溶液,其他均为无色,可直接判断出CuSO4.
将CuSO4加入剩余三种溶液中,有蓝色沉淀生成的是KOH.之后将剩下的两种先后加入有沉淀的试液中,蓝色沉淀消失的是HCl,无现象的是Na2SO4.
好累---1年前查看全部
大家在问
- 1降低温度化学反应向右移动什么意思
- 2(2014•邵阳)实验室的药品是按物质分类的方式存放,四个药品柜,已存放了下列药品,现学校实验室新购进一瓶硝酸,正确存放
- 3宇宙中有没有外星人?说说你的看法!
- 4求一句简单的自我介绍
- 5苯甲醛的结构式
- 6若x>y,则-2x-1 -2y-1 利用不等式性质
- 7鲁滨逊的人物形象(30字)
- 8Fe(CN)6 3+ 有什么作用?能检验什么物质?
- 9如图,已知AB=CD,AD=CB,点E,F分别是AB,CD的中点,请填空说明下列判断成立的理由:(1)
- 10appreciate怎么读
- 11I want be中be的词性是什么?
- 12this,parents,is,from,your,letter,the连词成句
- 13猴子吃桃问题.猴子第一天摘下若干个桃子,当即吃了一半,还不过瘾,又多吃了一个.第二天早上又将剩下的桃子吃掉一半,又多吃了
- 14学生们坐在教室里等待老师。翻译。用现在分词作伴随状语
- 15氯酸钾分解得到的产物除氧气外还有氯化钾.氯酸钾、氯化钾这两种含氯化合物中氯元素的化合价分别为?


