在K2CR2O7法测定亚铁盐中Fe的含量实验中重铬酸钾为什么可用来直接配制标准溶液
 audrey_zw2022-10-04 11:39:542条回答
audrey_zw2022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 十年021 共回答了19个问题
十年021 共回答了19个问题 |采纳率84.2%- K2CR2O7不会发生水解反应,因为重铬酸是强酸,且无色,.
而且K2CR2O7中CR为+6价,具有氧化性会与亚铁反应,再根据溶液颜色的变化,可以确定反应完成没有. - 1年前
 tinycheng 共回答了2139个问题
tinycheng 共回答了2139个问题 |采纳率- 因为重铬酸钾很稳定,不易变质,也不易吸水。
固体试剂中,重铬酸钾的含量是稳定的,不会变化。
像盐酸这类物质,必须先标定。因为它易挥发,浓度不稳定。 - 1年前
相关推荐
- SO2和K2Cr2O7在水溶液或酸性溶液中可以反应吗?
SO2和K2Cr2O7在水溶液或酸性溶液中可以反应吗?
如果可以,请写出化学反应方程式.
如果不可以,请讲清原因.
可不可以写化学方程式?
我怎么配不平啊? 7wazi1年前1
7wazi1年前1 -
 billycao 共回答了15个问题
billycao 共回答了15个问题 |采纳率80%重铬酸根在酸性环境中,氧化性强,可以把SO2氧化:
3SO2 + Cr2O72- + 2H+ = 2Cr3+ + 3SO42- + H20
楼上的离子方程式,写错了!重铬酸钾是强电解质,要拆开.而且配平错了.1年前查看全部
- 配置0.1mol/L Na2S2O3溶液500ml,今欲用K2Cr2O7为其基准物标定其浓度,应秤取多少克K2Cr2O7
配置0.1mol/L Na2S2O3溶液500ml,今欲用K2Cr2O7为其基准物标定其浓度,应秤取多少克K2Cr2O7基准物?
配置0.1mol/L Na2S2O3溶液500ml,用K2Cr2O7为基准物标定其浓度,应秤取多少克K2Cr2O7基准物? jy051346941年前0
jy051346941年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- K2Cr2O7法测定铁矿石中的铁时,滴定前为什么加入H3PO4
 zgahdyzy1年前2
zgahdyzy1年前2 -
 日月云行 共回答了19个问题
日月云行 共回答了19个问题 |采纳率100%是为了使Fe3+生成稳定的[Fe(HPO4)2]-,降低Fe3+/Fe2+电对的电势,从而使滴定突跃范围增大,从而减少终点误差,而且[Fe(HPO4)2]-无色,消除了Fe3+的黄色对观察终点的影响1年前查看全部
- C2H5OH,K2Cr2O7,H2SO4能否以此监测司机是否喝酒?
 嗷嗷嗷嗷1年前2
嗷嗷嗷嗷1年前2 -
 我很好的123 共回答了23个问题
我很好的123 共回答了23个问题 |采纳率87%可以
K2Cr2O7是橙红色的
与乙醇反应后变成绿色
所以可以
反应方程式:2 K2Cr2O7 + 8 H2SO4 + 3 CH3CH2OH == 3 CH3COOH + 2 Cr2(SO4)3 + 11 H2O + 2 K2SO41年前查看全部
- (2013•石家庄二模)实验室可用K2Cr2O7固体与浓盐酸混合加热制备氯气(K2Cr207被还原为Cr3+).
(2013•石家庄二模)实验室可用k2cr2o7固体与浓盐酸混合加热制备氯气(k2cr207被还原为cr3+).
(1)k2cr2o7与浓盐酸反应的化学方程式为k2cr2o7+14hcl(浓)
2kcl+2crcl3+3cl2↑+7h2o△ .k2cr2o7+14hcl(浓);若反应中转移3mol e-,则消耗______mol k2cr2o7
2kcl+2crcl3+3cl2↑+7h2o△ .
(2)稀盐酸与k2cr2o7固体混合加热没有氯气生成.为探究影响氯气生成的因素,某化学兴趣小组进行如下实验:
①提出假设假设1:cl-浓度对再应有影响;
假设2:h+浓度对反应有影响;
假设3:______.
②设计实验方案,进行实验.写出实验步骤及预期现象和结论.限***实验试剂:浓盐酸、稀盐酸、浓硫酸、naoh溶液、k2cr2o7固体、nacl固体、湿润的淀粉ki试纸实验步骤 预期现象和结论 步骤1:向盛有固体k2cr2o7的a、b两试管中分别加入一定量的稀硫酸 步骤2:______ ______ 步骤3:______ ______  371121521年前1
371121521年前1 -
 第六维命 共回答了20个问题
第六维命 共回答了20个问题 |采纳率85%解题思路:(1)根据题意,Cr被还原为Cr3+,Cl-被氧化为Cl2,然后依据氧化还原反应电子得失守恒和原子守恒可写出方程式.依据方程式,消耗1mol K2Cr2O7转移电子6mol,转移3mol电子时消耗0.5molK2Cr2O7;
(2)①根据假设1和假设2,假设3应为假设1、2的综合;
②依据假设,可知步骤1为对照实验标准,步骤2、3应分别改变氯离子浓度、氢离子浓度,改变氯离子浓度可通过加入NaCl实现,改变氢离子浓度可通过加入浓硫酸实现,然后用湿润的淀粉KI实质检验是否产生Cl2.(1)Cr元素化合价变化为:K2Cr2O7→CrCl3,化合价由+6→+3价,一个Cr原子得3个电子,两个Cr原子得6个电子;Cl元素的化合价变化为:HCl→Cl2,化合价由-1价→0价,一个原子失去一个电子,所以其最小公倍数为6,K2Cr2O7的系数为1,作还原剂的 HCl的系数为6,再根据原子守恒判断其它分子的计量数,根据元素守恒,生成物中的未知物为水.所以该方程式为:K2Cr2O7+14HCl═2KCl+2CrCl3+3Cl2↑+7H2O,
根据以上分析可知,转移6mol电子生成3mol氯气、同时还原1molK2Cr2O7,则转移3mol电子消耗0.5molK2Cr2O7,
故答案为:K2Cr2O7+14HCl(浓)
△
.
2KCl+2CrCl3+3Cl2↑+7H2O;0.5;
(2)①根据假设1和假设2可知假设3应为:Cl-浓度、H+浓度对反应都有影响,
故答案为:Cl-浓度、H+浓度对反应都有影响;
②依据假设可知:步骤1为对照实验标准,步骤2、3中分别改变Cl-浓度、H+浓度,可通过加入NaCl实现改变Cl-浓度,可通过加入浓硫酸改变H+浓度,然后用湿润的淀粉KI实质检验是否产生Cl2,
故答案为:
步骤2:向A试管中加入适量NaCl固体,加热,把湿润的淀粉KI试纸放在试管口附近㈠若试纸变蓝,则假设1成立;
㈡若试纸未变蓝,则假设2或3成立
步骤3:向B试管中加入适量浓硫酸,加热,把湿润的淀粉KI试纸放在试管口附近㈠若试纸变蓝,则假设2成立
㈡若试纸未变蓝,结合步骤2中的㈡,则假设3成立.点评:
本题考点: 性质实验方案的设计.
考点点评: 本题考查性质实验方案设计与评价,涉及氧化还原反应方程式书写及计算、化学实验原理、实验设计、化学实验操作等知识,题目难度中等,注意掌握氧化还原反应的实质及配平方法,明确物质性质实验方案设计与评价方法.1年前查看全部
- 氧化还原反应计算!24L浓度为0.05mol/L的Na2SO3溶液恰好与20L浓度为0.02mol/L的K2Cr2O7溶
氧化还原反应计算!
24L浓度为0.05mol/L的Na2SO3溶液恰好与20L浓度为0.02mol/L的K2Cr2O7溶液完全反应.已知Na2SO3被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为(+3) 爱人在中原1年前1
爱人在中原1年前1 -
 stcjt 共回答了18个问题
stcjt 共回答了18个问题 |采纳率100%这是一个简单的得失电子守恒的计算题 我将这种题目的解法步骤写给你看 你就会了化合价升高 S:+4→+6 失电子总数为2e-*24*0.05mol = 2.4mole-化合价降低 Cr:+6→x 得电子总数为(6-x)e-*20*0.02*2mol(特...1年前查看全部
- (2012•资阳二模)重铬酸钾(K2Cr2O7)是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO•Cr
(2012•资阳二模)重铬酸钾(k2cr2o7)是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为feo•cr2o3)为原料生产重铬酸钾.实验室模拟工业法用铬铁矿制k2cr2o7的主要工艺如图所示.反应器中涉及的主要反应是:
6feo•cr2o3+24naoh+7kclo3
12na2cro4+3fe2o3+7kcl+12h2o△ .
试回答下列问题:
(1)在反应器①中,有na2cro4生成,同时fe2o3转变为nafeo2,杂质sio2、al2o3与纯碱反应的原理相同均转变为可溶性盐.写出氧化铝与碳酸钠反应的化学方程式:______.
(2)操作⑤中加酸酸化后cro42-转化为cr2o72-,写出转化的离子方程式:______.
(3)步骤③中测定ph值的操作为:______.
(4)某同学设计的检验上述工艺流程④的滤渣中fe、al、si元素成分的探究实验如下,请帮助完成该实验,并填写表中空格:
(5)称取重铬酸钾(其式量为294)试样2.5000g配成250ml溶液,用移液管取出25.00ml于碘量瓶中,加入10ml 2mol/l h2so4和足量碘化钾(铬的还原产物为cr3+),放置于暗处5min,然后加入100ml水,加入3ml淀粉指示剂,用0.1200mol/l na2s2o3标准溶液滴定(i2+2s2o32-=2i-+s4o62-).操作步骤 实验现象 结论 ①取滤渣样少量于试管中,加足量稀hcl,搅拌,静置. 试管中仍有固体物质 固体为______ ②操作①后,过滤;在滤液中加入过量的______. 有红褐色沉淀产生 沉淀为fe(oh)3 ③将操作②后的红褐色沉淀滤去,在滤液中通入足量co2. ______ 生成物为al(oh)3
①配制溶液时所需的玻璃仪器除烧杯、玻璃棒外,还需______和______.
②若实验***用去na2s2o3标准溶液40.00ml,则所得产品中重铬酸钾的纯度为(设整个过程中其他杂质不参与反应)______.(保留2位小数) Alex-s1年前1
Alex-s1年前1 -
 dww446 共回答了17个问题
dww446 共回答了17个问题 |采纳率88.2%解题思路:(1)依据杂质SiO2、Al2O3与纯碱反应的原理相同均转变为可溶性盐写出化学方程式;
(2)酸化后CrO42-转化为Cr2O72-,依据原子守恒和电荷守恒写出离子方程式;
(3)依据PH试纸的使用方法分析回答;
(4)过量的酸溶液中反应生成沉淀说明是硅酸沉淀;加入过量氢氧化钠溶液反应生成红褐色沉淀氢氧化铁;偏铝酸盐通入过量二氧化碳反应生成白色沉淀为氢氧化铝;
(5)①依据溶液配制的步骤分析需要的玻璃仪器;
②根据反应:I2+2S2O32-=2I-+S4O62-,碘单质遇到淀粉时,溶液的蓝色消失,据此来回答并计算纯度.依据反应过程的离子方程式的定量关系计算,注意溶液体积变化;(1)杂质SiO2、Al2O3与纯碱反应的原理相同均转变为可溶性盐,氧化硅和碳酸钠加热反应生成硅酸钠和二氧化碳,所以氧化铝和碳酸钠反应的化学方程式为:Al2O3+Na2CO3=2NaAlO2+CO2↑;
故答案为:Al2O3+Na2CO3=2NaAlO2+CO2↑;
(2)操作⑤中加酸酸化后CrO42-转化为Cr2O72-,转化的离子方程式为:2CrO42-+2H+=Cr2O72-+H2O;
故答案为:2CrO42-+2H+=Cr2O72-+H2O;
(3)PH试纸的实验方法是取一段pH试纸置于表面皿上,用玻璃棒蘸取待测液点在试纸的中部,变色后再将试纸与标准比色卡进行比较,
故答案为:取一段pH试纸置于表面皿上,用玻璃棒蘸取待测液点在试纸的中部,再将试纸与标准比色卡进行比较;
(4)检验上述工艺流程④的滤渣中Fe、Al、Si元素成分的探究实验过程是利用过量盐酸反应能生成沉淀的是硅酸根离子,生成沉淀硅酸,剩余溶液中加入过量氢氧化钠溶液出现红褐色沉淀氢氧化铁,铝离子生成偏铝酸钠,在滤液中通入过量二氧化碳反应生成白色沉淀氢氧化铝;
故答案为:
硅酸(或H2SiO3)
NaOH溶液(或其它强碱溶液)
白色胶状沉淀生成 (4)①配制溶液时,在烧杯中溶解物质后,盐玻璃棒转移溶液到250ml容量瓶中,最后用胶头滴管定容,所以所需的玻璃仪器除烧杯、玻璃棒外,还需250 mL容量瓶,胶头滴管;
故答案为:250 mL容量瓶,胶头滴管;
②根据反应:I2+2S2O32-=2I-+S4O62-,当滴加最后一滴硫代硫酸钠溶液时,碘单质恰好完全反应,溶液蓝色褪去,达到滴定终点,由反应Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;I2+2S2O32-=2I-+S4O62-可得反应的关系式为Cr2O72-~3I2~6S2O32-,根据关系式计算.
Cr2O72-~3I2~6S2O32-
1mol 6mol
n 0.1200×40×10-3mol
则250ml含重铬酸钾的物质的量为n=
0.1200×40×10−3mol
6×10,则所得产品中重铬酸钾纯度为
0.1200×40×10−3×10×294
6×2.5000×100%=94.08%;
故答案为:94.08%;点评:
本题考点: 探究物质的组成或测量物质的含量;镁、铝的重要化合物;铁的氧化物和氢氧化物.
考点点评: 本题考查物质性质和组成的实验分析应用,有关盐的水解以及滴定实验等方面的综合知识,要求学生具有分析和解决问题的能力,难度较大.1年前查看全部
- K2Cr2O7与C2H6O反应的化学表达式
 wanglianbei1年前2
wanglianbei1年前2 -
 手放错了地方 共回答了20个问题
手放错了地方 共回答了20个问题 |采纳率75%2 K2Cr2O7 + 3 C2H5OH + 8 H2SO4 = 2 K2SO4 + 3 CH3COOH + 11 H2O + 2 Cr2(SO4)3
乙醇被氧化为乙酸1年前查看全部
- K2Cr2O7与Fe,FeO,Fe2O3,Fe3O4的反应方程式
 natkingcole1年前1
natkingcole1年前1 -
 随身携带爱 共回答了12个问题
随身携带爱 共回答了12个问题 |采纳率100%k2cr2o7不能与铁、氧化亚铁、氧化铁、四氧化三铁直接反应,而是先将铁变成二价铁,二价铁才和(酸性)重铬酸钾溶液反应: 6FeCl2 + k2Cr2O7 + 14HCl = 6FeCl3 + 2CrCl3 + 2kCl + 7H2O1年前查看全部
- K2Cr2O7+Pb(NO3)2=
 pigdd1年前1
pigdd1年前1 -
 蚊子敢hh队 共回答了26个问题
蚊子敢hh队 共回答了26个问题 |采纳率88.5%=2Cr(NO3)3+5PbO2+2NO2+4KNO31年前查看全部
- 以 K2Cr2O7 为基准物,用碘量法标定 Na2S2O3 溶液的浓度时,滴定速度过快,并过早读出滴定管读数,会产生正偏
以 K2Cr2O7 为基准物,用碘量法标定 Na2S2O3 溶液的浓度时,滴定速度过快,并过早读出滴定管读数,会产生正偏差还是负偏差 ?为什么?
 carriezjy1年前1
carriezjy1年前1 -
 东方龙哥_xx 共回答了20个问题
东方龙哥_xx 共回答了20个问题 |采纳率100%C指硫代硫酸钠的浓度,m指重铬酸钾的质量,M指重铬酸钾的摩尔质量,V指滴定时消耗硫代硫酸钠的标准溶液体积ml,V0指的是空白试验消耗的硫代硫酸钠标准溶液的体积ml.C=6*1000*m/{(v-V0)*M}滴定度速度过快导致K2Cr2O7基准物与待测物质未反应完全,基准物还残留在待测物质中,在过早度数造成度数V偏大,从而计算的浓度偏小,产生负偏差.1年前查看全部
- K2Cr2O7+C2H5oH+H2SO4=CH3COOH+K2SO4+Cr2SO4+H2O配平系数是多少急
 beckhamseven1年前1
beckhamseven1年前1 -
 等吧 共回答了14个问题
等吧 共回答了14个问题 |采纳率92.9%2K2Cr2O7+5C2H5oH+4H2SO4=5CH3COOH+2K2SO4+2Cr2SO4+9H2O1年前查看全部
- 24ml0.05mol/L的NaSO3溶液恰好与20ml0.02mol/L的K2Cr2O7溶液腰完全反应.已知Na2SO
24ml0.05mol/L的NaSO3溶液恰好与20ml0.02mol/L的K2Cr2O7溶液腰完全反应.已知Na2SO3被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为
 天地公子661年前1
天地公子661年前1 -
 huanghcx 共回答了12个问题
huanghcx 共回答了12个问题 |采纳率100%+3
不用想的,Cr2O72-还原产物一定是Cr3+,一定要记下来.1年前查看全部
- 机动车驾驶员酒后驾车将受到处罚.检测驾驶员是否饮酒,可用一种装有重铬酸钾(K2Cr2O7)的仪器.在
机动车驾驶员酒后驾车将受到处罚.检测驾驶员是否饮酒,可用一种装有重铬酸钾(K2Cr2O7)的仪器.在
K2Cr2O7中Cr元素的化合价是( )
A.+2
B.+3
C.+6
D.+7 cd抄手1年前1
cd抄手1年前1 -
 wzjhyy 共回答了17个问题
wzjhyy 共回答了17个问题 |采纳率94.1%解题思路:根据在化合物中正负化合价代数和为零,结合重铬酸钾的化学式进行解答本题.钾元素显+1价,氧元素显-2价,设铬元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)×2+x+(-2)×7=0,则x=+6价.
故选:C.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题难度不大,掌握利用化合价的原则(化合物中正负化合价代数和为零)计算指定元素的化合价的方法即可正确解答本题.1年前查看全部
- H2O2+K2Cr2O7+H2SO4 =Cr2(SO4)3+K2SO4+O2+H2O
H2O2+K2Cr2O7+H2SO4 =Cr2(SO4)3+K2SO4+O2+H2O
同志们 有这个反应么?用离子守恒方法 coupler1111年前1
coupler1111年前1 -
 袁snow 共回答了13个问题
袁snow 共回答了13个问题 |采纳率92.3%3 H2O2 + K2Cr2O7 + 4 H2SO4 = Cr2(SO4)3 + K2SO4 + 3 O2 + 7 H2O
Cr化合价降低3×2=6价,O化合价升高1×2=2价
所以H2O2 与 K2Cr2O7化学计量数之比是6:2 = 3:1
3 H2O2 + K2Cr2O7 + H2SO4 —— Cr2(SO4)3 + K2SO4 + O2 + H2O
再用观察法配平其他的即可
3 H2O2 + K2Cr2O7 + 4 H2SO4 = Cr2(SO4)3 + K2SO4 + 3 O2 + 7 H2O1年前查看全部
- 12mL浓度为0.1mol/L的Na2SO3溶液,恰好与10mL溶液浓度为0.04mlo/L的K2Cr2O7溶液,完全反
12mL浓度为0.1mol/L的Na2SO3溶液,恰好与10mL溶液浓度为0.04mlo/L的K2Cr2O7溶液,完全反应,通过计算确定Cr元素在还原产物中的化合价为______.
 猕猴桃19771年前3
猕猴桃19771年前3 -
 diandao2006 共回答了17个问题
diandao2006 共回答了17个问题 |采纳率100%+31年前查看全部
- 24ml浓度为0.05mol/L的Na2SO3溶液,恰好与20ml浓度为0.02mol/L的K2Cr2O7溶液反应,生成
24ml浓度为0.05mol/L的Na2SO3溶液,恰好与20ml浓度为0.02mol/L的K2Cr2O7溶液反应,生成Na2SO4,则元素Cr在还原产物中的化合价是多少?
 高度无奈1年前1
高度无奈1年前1 -
 ww1979 共回答了12个问题
ww1979 共回答了12个问题 |采纳率83.3%Cr在还原产物中的化学价为(+3)
在该反应中只有S和Cr参加反应:
其中Na2SO3和K2Cr2O7的摩尔质量比为:(24*0.05)/(20*0.02)=3/1
且生成Na2SO4
则其化学反应式为:3Na2SO3+K2Cr2O7=3Na2SO4+2KCrO2
即Cr在还原产物中化学价为(+3)
二: 氧化还原反应
只有硫元素和铬元素参与
其摩尔比为24*0.05/(20*0.02*2)=3/2
则3S(4+)+2Cr(6+)~~3S(6+)+2Cr(3+)
我也是高一的 化学不咋好 如果我有说错的地方拜托你和我联系一下. OK?1年前查看全部
- 高中化学氧化还原反应部分将1.74gFe3O4完全溶解在50mL 1mol/L的H2SO4中,然后加入K2Cr2O7溶液
高中化学氧化还原反应部分
将1.74gFe3O4完全溶解在50mL 1mol/L的H2SO4中,然后加入K2Cr2O7溶液25ml,恰好使溶液中的Fe2+全部氧化成Fe3+,Cr2O72-离子全部还原成Cr3+,则K2Cr2O7浓度为
A.0.05mol/L B.0.1mol/L C.0.2mol/L D.0.3mol/L
题中“Fe2+全部氧化成Fe3+”,我不太懂,Fe3O4和H2SO4反应不是生成三价Fe吗?
我算下来是D,望高手赐教,
请简述理由, fantony1年前1
fantony1年前1 -
 姐妹们我爱你6 共回答了22个问题
姐妹们我爱你6 共回答了22个问题 |采纳率86.4%首先你把四氧化三铁没弄懂,四氧化三铁也可看陈是一个氧化亚铁一个三氧化二铁,所以他和硫酸反应,生成了硫酸亚铁,和硫酸铁~~~~~在仔细算算吧1年前查看全部
- 将0.84g Fe完全溶解在100mL 1mol?L-1稀H2SO4中,然后加入K2Cr2O7溶液25mL,恰好使溶液中
将0.84g Fe完全溶解在100mL 1mol?L-1稀H2SO4中,然后加入K2Cr2O7溶液25mL,恰好使溶液中的Fe2+全部氧化为
将0.84g Fe完全溶解在100mL 1mol?L-1稀H2SO4中,然后加入K2Cr2O7溶液25mL,恰好使溶液中的Fe2+全部氧化为Fe3+,Cr2O
全部转化为Cr3+,则K2Cr2O7溶液的物质的量浓度为( )2?7
A.0.2 mol?L-1
B.0.15 mol?L-1
C.0.1 mol?L-1
D.0.05 mol?L-1
 steamedbread1年前1
steamedbread1年前1 -
 zbycc 共回答了16个问题
zbycc 共回答了16个问题 |采纳率87.5%0.84gFe的物质的量为n=[m/M]=[0.84g/56g/mol]=0.015mol,100ml1mol/L的硫酸中硫酸的含量为n=c×v=1mol/L×0.1L=0.1mol,根据方程式:Fe+H2SO4=FeSO4+FeSO4+H2↑,0.015molFe完全反应需要硫酸0.015mol,硫酸过量0.085mol,生成Fe2+0.015mol,在氧化还原反应6Fe2++Cr2O7 2-+14H+=6Fe3++2Cr3++7H2O中需氢离子[0.015mol/6×14=0.035mol硫酸过量,0.015molFe2+变为Fe3+,电子转移0.015mol,Cr2O72-全部还原为Cr3+,Cr由原来的+6价降为+3价,所以参加反应的Cr为:
0.015
6?3]mol=0.005mol,1molK2Cr2O7中有2molCr,所以K2Cr2O7的物质的量就应该为0.005mol÷2=0.0025mol,物质的量浓度:c=[n/v]=[0.0025mol/0.025L]=0.1mol/L,
故选C.1年前查看全部
- 高二化学; 用化学语填空: 重铬酸钾(K2Cr2O7) 水解离子方程式( )
 xjhgd1年前1
xjhgd1年前1 -
 cattle110 共回答了21个问题
cattle110 共回答了21个问题 |采纳率81%解析:
2- + H2O = 2- + 2+(=表示可逆符号)
加酸有利于2-生成,加碱有利于-生成.1年前查看全部
- 高一化学将3.48g四氧化三铁完全溶解在100ml, 1 mol/L的硫酸中,然后加入K2Cr2O7溶液25ml,恰好使
高一化学
将3.48g四氧化三铁完全溶解在100ml, 1 mol/L的硫酸中,然后加入K2Cr2O7溶液25ml,恰好使溶液中的亚铁离子全部氧化成三价铁离子,Cr2O7(2-)全部转化成Cr(3+),则K2Cr2O7溶液的物质的量浓度是?
要过程 v56666ee1年前1
v56666ee1年前1 -
 胡嘉伟 共回答了17个问题
胡嘉伟 共回答了17个问题 |采纳率82.4%3.48gFe3O4为0.015mol
每molFe3O4中只有1molFe是2价的
所以亚铁离子失去电子的数目为0.015mol
每molK2Cr2O7能够得到6mol电子
所以只需0.0025molK2Cr2O7就够了
所以K2Cr2O7得物质的量浓度为0.1mol/L1年前查看全部
- 将0.1936g的k2cr2o7溶 于水酸化后加入过量的ki,析出的I2用na2s2o3滴定,i消耗 33.
将0.1936g的k2cr2o7溶 于水酸化后加入过量的ki,析出的I2用na2s2o3滴定,i消耗 33.
求c(na2s2o3)= LOVE万人迷1年前1
LOVE万人迷1年前1 -
 红头山木 共回答了9个问题
红头山木 共回答了9个问题 |采纳率100%消耗33.61 mL?应该是这个题吧?
Cr2O7 2- +6I- + 14H+ = 2 Cr3+ +3 I2 + 7 H2O
I2 + 2 S2O32- = 2 I- + S4O62-
1 K2Cr2O7 3 I2 6 Na2S2O3
所以(cV)硫代硫酸钠 ÷ (m/M)重铬酸钾 ÷1000 = 6/1
所以c(Na2S2O3) = 6×0.1936 ÷(294.19×33.61)×1000 = 0.1175 mol/L1年前查看全部
- 重铬酸钾溶液的保存期限测定沉积物中TOC的含量所用的重铬酸钾溶液,C(1/6K2Cr2O7)=o.4mol/l,如何保存
重铬酸钾溶液的保存期限
测定沉积物中TOC的含量所用的重铬酸钾溶液,C(1/6K2Cr2O7)=o.4mol/l,如何保存?能保存多久? sglr3171年前1
sglr3171年前1 -
 小蜗牛935 共回答了22个问题
小蜗牛935 共回答了22个问题 |采纳率95.5%置于密闭的细口试剂瓶中即可.注意是玻璃瓶哦.
即在室温下,磨口密闭试剂瓶,重铬酸钾溶液可无限期放置.1年前查看全部
- 下列说法不正确的是( )A.在铜-锌-稀硫酸的原电池中加入K2Cr2O7主要目的是去极化B.用丙酮与盐酸的
下列说法不正确的是( )A.在铜-锌-稀硫酸的原电池中加入K2Cr2O7主要目的是去极化B.用丙酮与盐酸的
下列说法不正确的是( )
A.在铜-锌-稀硫酸的原电池中加入K2Cr2O7主要目的是去极化
B.用丙酮与盐酸的混合液作展开剂,对Fe3+与Cu2+用纸层析法分离时,Fe3+移动较快
C.制取乙酸乙酯实验时边反应边把生成的乙酸乙酯蒸馏出去的目的是使平衡向右移动
D.H2O2分解产生O2的实验中,加入MnO2的目的是促进平衡向右移动
 恬灵1年前1
恬灵1年前1 -
 枪kk 共回答了24个问题
枪kk 共回答了24个问题 |采纳率87.5%A.K2Cr2O7有强氧化性,能防止阴极上产生氢气,故A正确;
B.Fe3+与Cu2+的扩散速度不同,可用层析法分离,故B正确;
C.把生成的乙酸乙酯蒸馏出去,降低生成物的浓度可以使平衡向右移动,故C正确;
D.二氧化锰做催化剂,催化剂不能改变平衡移动,故D错误.1年前查看全部
- K2Cr2O7中的Cr的化合价怎么求?
 行者呵呵1年前2
行者呵呵1年前2 -
 石榴紫玉 共回答了11个问题
石榴紫玉 共回答了11个问题 |采纳率100%K的化合价是+1价,O的化合价是-2价,Cr的化合价是x
根据化合价代数和为0
则2×(+1)+2x+7×(-2)=0
解得x=+6
所以Cr的化合价是+6价1年前查看全部
- 某芳烃其分子式为C9H12,以K2Cr2O7和浓H2SO4氧化后可得一种二元酸.将原来的芳烃进行硝化,所得的一元硝基
某芳烃其分子式为C9H12,以K2Cr2O7和浓H2SO4氧化后可得一种二元酸.将原来的芳烃进行硝化,所得的一元硝基
化合物有三种.试推出该芳烃的结构式. 艾露恩的祝福1年前2
艾露恩的祝福1年前2 -
 睛天mm 共回答了18个问题
睛天mm 共回答了18个问题 |采纳率83.3%是间位二甲苯1年前查看全部
- kmno4,k2cr2o7,br2,h2o2中,为什么选用双氧水来氧化亚铁离子?
kmno4,k2cr2o7,br2,h2o2中,为什么选用双氧水来氧化亚铁离子?
即大学无机化学实验书第51页思考题第三题,本人化学角烂, 紫荷_雨1年前1
紫荷_雨1年前1 -
 hjvkvghgcx 共回答了18个问题
hjvkvghgcx 共回答了18个问题 |采纳率94.4%还原产物是水,不引入杂质离子1年前查看全部
- 实验室常利用K2Cr2O7和浓H2SO4配制洗液.一位同学在缺少浓H2SO4的情况下,想到了用HClO4代替浓H2SO4
实验室常利用K2Cr2O7和浓H2SO4配制洗液.一位同学在缺少浓H2SO4的情况下,想到了用HClO4代替浓H2SO4配制
请你评价这样做是否合理. dsafghbdsfk1年前1
dsafghbdsfk1年前1 -
 高高1982 共回答了15个问题
高高1982 共回答了15个问题 |采纳率93.3%HClO4氧化性太强了吧,缺少浓硫酸的脱水行1年前查看全部
- 亚硫酸钠与重铬酸钾K2Cr2O7如何反应
 jtwxh55151年前1
jtwxh55151年前1 -
 linyuaimei 共回答了13个问题
linyuaimei 共回答了13个问题 |采纳率100%K2Cr2O7+3Na2S03+4H2SO4===Cr2(SO4)3+4H2O+3Na2SO4+K2SO41年前查看全部
- k2cr2o7+(nh4)2fe(so4)2的反映方程是什么啊?
 nbmghjghj1年前2
nbmghjghj1年前2 -
 y60002527 共回答了18个问题
y60002527 共回答了18个问题 |采纳率94.4%生成硫酸铁,硫酸铬,硫酸铵,硫酸钾,水,1年前查看全部
- 用K2Cr2O7测铁时,为什么要加入硫酸-磷酸混合酸溶液?
 wang510701年前1
wang510701年前1 -
 建建狗 共回答了15个问题
建建狗 共回答了15个问题 |采纳率93.3%硫酸能减缓空气对亚铁的氧化作用,且能控制酸度,磷酸能与滴定过程中生成的三价铁离子生成无色络合物,降低了三价到二价铁的电极电位,消除了三价铁对指示剂的氧化,使滴定终点清晰准确.1年前查看全部
- 配平 k2cr2o7 + ki + h2so4---k2so4+ cr2(so4)3+ i2+ h2o
 xingyexinyongka1年前1
xingyexinyongka1年前1 -
 234510 共回答了10个问题
234510 共回答了10个问题 |采纳率80%1 6 7 4 1 3 71年前查看全部
- k2cr2o7 与h2so4 和KI 的化学方程式
 yewei04511年前1
yewei04511年前1 -
 duihy 共回答了27个问题
duihy 共回答了27个问题 |采纳率100%K2Cr2O7+7H2SO4+6KI=Cr2(SO4)3+3I2+7H2O+4K2SO41年前查看全部
- (2013•江苏三模)用氯化铁浸出重铬酸钾(K2Cr2O7)滴定法测定钛精粉试样中单质铁的质量分数[ω(Fe)%],实验
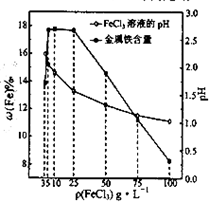 (2013•江苏三模)用氯化铁浸出重铬酸钾(K2Cr2O7)滴定法测定钛精粉试样中单质铁的质量分数[ω(Fe)%],实验步骤如下:
(2013•江苏三模)用氯化铁浸出重铬酸钾(K2Cr2O7)滴定法测定钛精粉试样中单质铁的质量分数[ω(Fe)%],实验步骤如下:
步骤1:称取试样0.100g于250mL洗净的锥形瓶中.
步骤2:加入FeCl3溶液100mL,迅速塞上胶塞,用电磁搅拌器30min.
步骤3:过滤,用水洗涤锥形瓶和滤渣各3~4次,洗液全部并入滤液中.
步骤4:将滤液稀释至500mL,再移去100mL稀释液于锥形瓶中,加入20mL硫酸和磷酸的混合酸,加0.5%二苯胺磺酸钠指示剂4滴.
步骤5:以K2Cr2O7标准溶液滴定至出现明显紫色为终点.发生的反应为:Cr2O72-+6Fe2++14H+=2Cr3++Fe3++7H2O.
步骤6:重复测定两次.
步骤7:数据处理.
(1)步骤2中加入FeCl3溶液后锥形瓶中发生反应的离子方程式为______,迅速塞上胶塞的原因是______.
(2)步骤3中判断滤纸上残渣已洗净的方法是______.
(3)实验中需用到100mL浓度为0.01mol•L-1K2Cr2O7标准溶液,配置时用到的玻璃仪器有______.称量K2Cr2O7固体前应先将其烘干至恒重,若未烘干,对测定结果的影响是______(填“偏高”、“偏低”、或“无影响”):滴定时,K2Cr2O7溶液应置于______(填仪器名称)中.
(4)科研人员确定FeCl3溶液的最佳浓度,选用100mL不同浓度的FeCl3溶液(FeCl3溶液均过量)溶解同一钛精粉试样,其余条件控制相同,得到测定结果如图所示.则FeCl3溶液的浓度[用ρ(FeCl3)表示]范围应为______g•L-1,浓度过低或过高时测定结果偏低的原因分别是______. yxy_qzkz1年前1
yxy_qzkz1年前1 -
 sonic0320 共回答了20个问题
sonic0320 共回答了20个问题 |采纳率90%解题思路:(1)钛精粉试样中含单质铁,加入氯化铁溶液反应生成氯化亚铁,迅速塞上胶塞防止生成的亚铁离子被氧气氧化;
(2)依据检验氯化铁溶液中的氯离子的存在分析判断是否洗涤干净;
(3)依据溶液配制的实验过程中的操作步骤分析选择所需仪器;若未烘干会增大标准液的体积,造成测定结果偏高,K2Cr2O7溶液是强氧化剂,能腐蚀橡胶管,应盛在酸式滴定管中;
(4)依据图象变化曲线分析,FeCl3溶液的浓度在5-25g/L时铁的质量分数最大,浓度低溶解速率慢,浓度高溶液酸性强和铁发生反应;(1)钛精粉试样中含单质铁,加入氯化铁溶液反应生成氯化亚铁,反应的离子方程式为:2Fe3++Fe=3Fe2+,迅速塞上胶塞防止生成的亚铁离子被氧气氧化;
故答案为:2Fe3++Fe=3Fe2+,防止Fe2+被空气中的氧气氧化;
(2)依据检验氯化铁溶液中的氯离子的存在分析判断是否洗涤干净,实验设计方案为:取最后一次洗涤滤出液,滴加硝酸银溶液,若无白色沉淀证明已洗净;
故答案为:取最后一次洗涤滤出液,滴加硝酸银溶液,若无白色沉淀证明已洗净;
(3)溶液配制的实验过程中的操作步骤为计算,称量、溶解、转移、洗涤定容,选择所需玻璃仪器为烧杯、玻璃棒、100ml容量瓶、胶头滴管;若未烘干会增大标准液的体积,造成测定结果偏高,K2Cr2O7溶液是强氧化剂,能腐蚀橡胶管,应盛在酸式滴定管中;
故答案为:100ml容量瓶,烧杯,玻璃棒,胶头滴管,偏高,酸式滴定管;
(4)依据图象变化曲线分析,FeCl3溶液的浓度在5g/L-25g/L时铁的质量分数最大,测定误差小,浓度低时溶解速率慢,单质铁未全部反应,浓度高溶液酸性强和铁发生反应;
故答案为:5-25,浓度过低时溶解速率过慢,单质铁未完全反应;浓度过高时溶液酸性强,溶液中H+与单质铁反应;点评:
本题考点: 探究物质的组成或测量物质的含量.
考点点评: 本题考查了物质含量的实验分析验证,物质性质和实验基本操作是解题关键,题目难度中等.1年前查看全部
- 乙醇与酸性KMnO4溶液或K2Cr2O7溶液反应现象
乙醇与酸性KMnO4溶液或K2Cr2O7溶液反应现象
现象是什么?
乙醇最终被 为 . Gabriel261年前1
Gabriel261年前1 -
 wshy0011 共回答了18个问题
wshy0011 共回答了18个问题 |采纳率83.3%乙醇被氧化成二氧化碳,酸性高锰酸钾褪色,K2Cr2O7变成绿色.
- -最好不要这么做,反应会很剧烈1年前查看全部
- K2Cr2O7和H2O2反应产物是什么呢?
K2Cr2O7和H2O2反应产物是什么呢?
为什么假如NaOH之后又变回先前的颜色了呢?
写出方程式。 outleft1年前3
outleft1年前3 -
 pingzi147 共回答了19个问题
pingzi147 共回答了19个问题 |采纳率94.7%生成CrO5
K2Cr2O7 + 4H2O2 + 2H+ → 2CrO5 + 5H2O
CrO5显蓝色,加氢氧化钠后氢离子被消耗,而且CrO5不稳定,平衡逆向移动,所以会恢复先前的颜色1年前查看全部
- 可用于滴定碘的标准溶液是: A H2SO4 B KBrO3 C Na2S2O3 D K2Cr2O7
 zxyouygq19831年前1
zxyouygq19831年前1 -
 tsui_james 共回答了18个问题
tsui_james 共回答了18个问题 |采纳率100%明显是B,滴定碘只能有一个正离子,还不能沉淀1年前查看全部
- 乙醇被重铬酸钾(K2Cr2O7)氧化 检验司机是否酒后驾驶.
乙醇被重铬酸钾(K2Cr2O7)氧化 检验司机是否酒后驾驶.
该反应催化剂 还原剂 分别是什么 反应中 K2Cr2O7能否用CUO代替 tofz_252rt_2ecd1年前5
tofz_252rt_2ecd1年前5 -
 LAZZIO 共回答了15个问题
LAZZIO 共回答了15个问题 |采纳率86.7%催化剂是浓硫酸,还原剂是乙醇.
反应中不能用氧化铜代替重铬酸钾溶液,因为乙醇和氧化铜的反应需要加热,生成乙醛气体有污染,且反应速率不及与重铬酸钾溶液快.考虑到科学事实和实际情况,在交警的工作中是不会采取用氧化铜的.1年前查看全部
- k2Cr2O7在与HCl作用时生成Cr3 和Cl2而Cl2能将CrO2-氧化成CrO42-这两个反应有无矛盾 为什么
 wenjin1年前1
wenjin1年前1 -
 高原的瑶瑶 共回答了22个问题
高原的瑶瑶 共回答了22个问题 |采纳率90.9%不矛盾啊,氯气会走了去,它是气体,溶到水里的极少.所以反应可以进行.1年前查看全部
- K2Cr2O7+HCl(浓)→KCl+CrCl3+Cl2↑+H2O
 aaayf1年前4
aaayf1年前4 -
 猫工 共回答了19个问题
猫工 共回答了19个问题 |采纳率94.7%按电子得失守恒法配平:每生成1molCl2,需失去2mol电子,每1molK2Cr2O7反应,需得到6mol电子(每个Cr需3个电子,两个Cr需6个电子),根据电子得失守恒,K2Cr2O7系数为1,Cl2系数为3,其他根据元素守恒用观察法,KCl系数为2,CrCl3系数为2,然后HCl系数为14,最后H2O的系数为7.即:K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2+7H2O1年前查看全部
- K2Cr2O7与乙醇的反应.K2Cr2O7与乙醇 2K2Cr2O7+3CH3CH2OH+8H2SO4--2Cr2(SO4
K2Cr2O7与乙醇的反应.
K2Cr2O7与乙醇 2K2Cr2O7+3CH3CH2OH+8H2SO4--2Cr2(SO4)3+3CH3COOH+2K2SO4+11H2O 酒后驾车就是这个方程式吗?氧化剂 和还原剂分别是什么? 一次ll易1年前1
一次ll易1年前1 -
 nanwangjin 共回答了17个问题
nanwangjin 共回答了17个问题 |采纳率88.2%对的,氧化剂是是重铬酸钾,还原剂是乙醇.1年前查看全部
- K2Cr2O7溶液中加入AgNO3溶液发生离子互换反应,生成转红色沉淀且溶液的PH减小,则生成砖红色沉淀的化学方程式是什
K2Cr2O7溶液中加入AgNO3溶液发生离子互换反应,生成转红色沉淀且溶液的PH减小,则生成砖红色沉淀的化学方程式是什么,理由
 0129876543211年前2
0129876543211年前2 -
 E网情身 共回答了20个问题
E网情身 共回答了20个问题 |采纳率90%2AgNO3 + K2Cr2O7 = Ag2CrO7(沉淀) + 2KNO3.
重铬酸银是砖红色粉末.也就是那个沉淀.
很高兴为您解答1年前查看全部
- Na2SO3和K2Cr2O7反应生成什么?请写出方程式来,
 9855281年前1
9855281年前1 -
 唐朝66 共回答了13个问题
唐朝66 共回答了13个问题 |采纳率84.6%3Na2SO3+K2Cr2O7+4H2SO4=3Na2SO4+K2SO4+Cr2(SO4)3+4H2O1年前查看全部
- 强氧化剂都有什么?硝酸HNO3,浓硫酸H2SO4,高锰酸钾K2MnO4,二氧化锰MnO2,重铬酸钾K2Cr2O7,二氧化
强氧化剂都有什么?
硝酸HNO3,浓硫酸H2SO4,高锰酸钾K2MnO4,二氧化锰MnO2,重铬酸钾K2Cr2O7,二氧化铅PbO2,双氧水H2O2,氯气CIO2,除了这些还有什么? 风浅云绻1年前6
风浅云绻1年前6 -
 天堂和地狱之门 共回答了20个问题
天堂和地狱之门 共回答了20个问题 |采纳率80%过二硫酸铵(NH4)2S2O8 铋酸钠 NaBiO3
高铁酸钾K2FeO4 再加上 PbO2 都可在酸性溶液中氧化Mn2+到MnO4- (有的需要Ag+作为催化剂) 都是著名的强氧化剂 ()
F2 XeF2 XeF4 XeF6 XeO3 XeO4 高氙酸盐 (XeO42-)
HBrO4 高溴酸 H5IO6 高碘酸 HClO4(必须热浓)
O3
双氧水H2O2不行
都不行就电解吧.电解是最有力的氧化还原手段.
楼上的那次溴酸:HBrO
次碘酸:HIO 根本就不稳定.
过氧化物只能算作中等强度的氧化剂 .MnO4-可以氧化它们到O2的.1年前查看全部
- kMnO4,K2Cr2O7,Hclo,Pbo2,Mno2,H2O2,Na2O2,Ko2,Ho2,HNo3,H2SO4,O
kMnO4,K2Cr2O7,Hclo,Pbo2,Mno2,H2O2,Na2O2,Ko2,Ho2,HNo3,H2SO4,O3,Cl2,Na2FeO4
氧化性顺序 zz的声音1年前1
zz的声音1年前1 -
 好可怕呀 共回答了34个问题
好可怕呀 共回答了34个问题 |采纳率100%问题是什么啊,麻烦详细些1年前查看全部
- 已知在K2Cr2O7的溶液中存在着如下平衡:Cr2O72-(橙色)+H2O⇌2CrO42-(黄色)+2H+,加入下列物质
已知在K2Cr2O7的溶液中存在着如下平衡:Cr2O72-(橙色)+H2O⇌2CrO42-(黄色)+2H+,加入下列物质能使溶液变为橙色的是( )
A.氨水
B.硫酸
C.NaOH
D.水 kktt军1881年前1
kktt军1881年前1 -
 是光一定会灿烂 共回答了21个问题
是光一定会灿烂 共回答了21个问题 |采纳率81%解题思路:根据反应方程式知,若要使溶液变为橙色,则加入的物质能使平衡向逆反应方向移动,据此分析解答.A.加入氨水,氨水和氢离子反应使平衡向正反应方向移动,溶液变为黄色,故A错误;
B.加入硫酸,硫酸根离子和Cr2O72-不反应,氢离子浓度增大,平衡向逆反应方向移动,溶液变为橙色,故B正确;
C.加入NaOH,NaOH和氢离子反应使平衡向正反应方向移动,溶液变为黄色,故C错误;
D.加水稀释溶液,促进Cr2O72-水解,所以平衡向正反应方向移动,橙色变浅,故D错误;
故选B.点评:
本题考点: 影响盐类水解程度的主要因素.
考点点评: 本题考查了影响化学平衡移动的因素,注意根据题意分析平衡的移动方向,题目难度不大.1年前查看全部
- 1.称取0.4903g纯K2Cr2O7,用水溶解并稀释至100.00mL.移取25.00mL,加入H2SO4及KI,以N
1.称取0.4903g纯K2Cr2O7,用水溶解并稀释至100.00mL.移取25.00mL,加入H2SO4及KI,以Na2S2O3溶液滴定至终点,消耗25.00mL.计算此Na2S2O3溶液的浓度.
[Mr(K2Cr2O7)=294.2].
G1143
2. 用双硫腙分光光度法测Pb2+,已知Pb2+的质量浓度为0.080 mg/50 mL,用2 cm比色皿于520 nm 处测得T=53.0%,计算吸光系数和摩尔吸光系数[Ar(Pb)=207.2].
3.称取纯NaHCO3 1.008g,溶于适量水中,然后往此溶液中加入纯固体NaOH 0.3200g,最后将溶液移入250mL容量瓶中,稀释至标线.移取此溶液50.0mL,以 0.100mol/L HCl溶液滴定.计算:(1)以酚酞为指示剂滴定至终点时,消耗HCl溶液多少毫升?(2)继续加入甲基橙指示剂滴定至终点时,又消耗HCl溶液多少毫升?
[Mr(NaHCO3) = 84.00,Mr(NaOH) = 40.00]
4.用重铬酸钾法测定铁,称取矿样 0.2500 g,滴定时消耗 K2Cr2O7标准溶液23.68 mL,此K2Cr2O7标准溶液 25.00 mL 在酸性介质中与过量的 KI 作用后,析出的 I2需用 20.00 mL 的 Na2S2O3溶液滴定,而此 Na2S2O3 1.00 mL 相当于 0.01587 g I2.请计算矿样中 Fe2O3的质量分数.[Mr(Fe2O3)= 159.7,Mr(I2)= 253.8] 524211年前1
524211年前1 -
 怕怕小西瓜 共回答了26个问题
怕怕小西瓜 共回答了26个问题 |采纳率96.2%同学,课程作业要独立完成啊!1年前查看全部
- 2K2Cr2O7 + 3C2H5OH + 8H2SO4 = 2Cr2(SO4)3 + 3CH3COOH + 2K2SO4
2K2Cr2O7 + 3C2H5OH + 8H2SO4 = 2Cr2(SO4)3 + 3CH3COOH + 2K2SO4 + 11H2O
反应中,还原剂是——,氧化产物是—— ccju1年前1
ccju1年前1 -
 架子鼓书 共回答了22个问题
架子鼓书 共回答了22个问题 |采纳率90.9%分析啊:化合价升高的是还原剂
化合价降低的是氧化剂
K2Cr2O7:中的Cr:+7---+3,降低,是氧化剂
乙醇中:C化合价升高,为还原剂
氧化产物为乙酸(CH3COOH)1年前查看全部
- 在K2Cr2O7溶液中加入Pb(NO3)2溶液会发生什么反应
 钱旺之王1年前2
钱旺之王1年前2 -
 nbc7442 共回答了17个问题
nbc7442 共回答了17个问题 |采纳率94.1%2Pb2+ +Cr2O72- +H2O===2PbCrO4↓+2H+1年前查看全部
大家在问
- 1let you and ____ do it together A I B my C me D mine 不都是主格吗
- 2一几何体的三视图如图:(I)画出它的直观图,并求其体积;(II)你能发现该几何体的哪些面互相垂直?试一一列出并说明理由.
- 3根据拼音写汉字或给加线的汉字注音
- 4both的用法
- 5有一批树苗,原计划40人去栽树,每人栽15颗,后来增加10人去栽树,每人比原计划少栽几颗树?用比例解
- 6从Zn,BaCl2,Fe(OH)3,CaCO3,NaOH,CuCl2,CaO,H2O,H2SO4 等物质中,选出适当的的
- 71.在正三棱锥中,已知侧面都是直角三角形,那么正三棱锥的斜高为a时,正三棱锥的高为( )
- 8千字开头和万字开头的诗句有哪些?
- 9已知P是∠AOB的平分线上一点,PC⊥OA,PD⊥OB,垂足分别为C、D
- 10已知sinx=4a-3,求a的取值范围
- 11在线求指导:把下面这段话改写成一
- 12明天要交T.T(我不知道怎么发图) 有直角等腰三角形△ABC ∠BAC=90° 画∠ABC的角平分线交AC边于点D 过点
- 13白日做梦所对应的成语,如小和尚念经---有口无心
- 14在有关俄罗斯的叙述错误的是( ) A.世界上面积最大的国家 B.地势东高西低,地形西部以平原为主,东部多高原、山地
- 15A是B的2 倍多1,C是A的2倍,已知三个数的和是121,求A,B,C各是多少?
