硝酸铵(化学式为NH4NO3)在农业与工业生产中有重要作用,下列有关硝酸铵的说法正确的是( )
 wuupp2022-10-04 11:39:541条回答
wuupp2022-10-04 11:39:541条回答A.它属于氧化物
B.其相对分子质量是80g
C.它可用作复合肥
D.其中氮、氢元素的质量比是7:1

已提交,审核后显示!提交回复
共1条回复
 思念漫溢 共回答了16个问题
思念漫溢 共回答了16个问题 |采纳率81.3%- 解题思路:A、根据氧化物的概念进行分析判断.
B、相对分子质量单位是“1”,不是“克”,常常省略不写.
C、根据含有氮元素的肥料称为氮肥进行分析判断.
D、根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析判断.A、硝酸铵(化学式为NH4NO3)由三种元素组成,不属于氧化物,故选项说法错误.
B、相对分子质量单位是“1”,不是“克”,故选项说法错误.
C、硝酸铵中含有氮元素,属于氮肥,不属于复合肥,故选项说法错误.
D、硝酸铵中氮、氢元素的质量比是(14×2):(1×4)=7:1,故选项说法正确.
故选:D.点评:
本题考点: 常见化肥的种类和作用;从组成上识别氧化物;相对分子质量的概念及其计算;元素质量比的计算.
考点点评: 本题难度不大,考查同学们结合新信息、灵活运用化学式的含义与有关计算进行分析问题、解决问题的能力. - 1年前
相关推荐
- (1)多少克硫酸铵中的氮元素与100g硝酸铵中氮元素的治疗量相等 (2)100g硝酸铵中含氧元素的质量相等
 鹤妹妹1年前2
鹤妹妹1年前2 -
 Applys 共回答了23个问题
Applys 共回答了23个问题 |采纳率95.7%(24/80)X100=(24/132)X xg
第二题方法一样1年前查看全部
- 一道初三化学题 ! 求解 .1吨化肥市场价格:尿素CO(NH2)2 1080元 ,硝酸铵 NH4NO3 810元 ,碳酸
一道初三化学题 ! 求解 .
1吨化肥市场价格:尿素CO(NH2)2 1080元 ,硝酸铵 NH4NO3 810元 ,碳酸氢铵 NH4HC03 330元 ,分别用1000元买化肥 ,买那种化肥含氮元素质量最多 ? ( 通过计算说明 )
有计算过程最好 。 jdzsw1年前5
jdzsw1年前5 -
 爱不懂_ff 共回答了17个问题
爱不懂_ff 共回答了17个问题 |采纳率94.1%尿素:1000/1080*(28/60)=0.432吨
硝酸铵:1000/810*(28/80)=0.324吨
碳酸氢铵1000/330*(14/79)=0.537吨1年前查看全部
- 1二氧化碳和氢氧化钠.2氧化铁盒硫酸.3氢氧化氯盒盐酸.4铝和盐酸.5铝和盐酸.6氯氧化镁盒氧化钠7硝酸铵盒氢氧化钙8氯
1二氧化碳和氢氧化钠.2氧化铁盒硫酸.3氢氧化氯盒盐酸.4铝和盐酸.5铝和盐酸.6氯氧化镁盒氧化钠7硝酸铵盒氢氧化钙8氯化钡和硝酸银.9硝酸钠和氯化镁.10硫酸镁和硝酸钡.
有的貌似不能配,
要指出来。
要配平 kk9111年前2
kk9111年前2 -
 想飞_2006 共回答了14个问题
想飞_2006 共回答了14个问题 |采纳率92.9%CO2+2NaOH=Na2CO3+H2O.2 Fe2O3+3H2SO4=fe2(so4)3+3H2O 第3个是什么啊.氢氧化氯?氢氧化铝把,3
Al(OH)3+3HCl=AlCl3+3H2O Al(OH)3+3H+=Al3++3H2O
4 2AL+6HCL=2ALCL3+3H2↑ 6不会发生反应,7Ca(OH)2+2NH4NO3=Ca(NO3)2+2H2O+2NH3↑
8BaCl2+2AgNO3=Ba(NO3)2+2AgCl↓.9也不发生反应.终于第10了 MgSO4+Ba(OH)2=Mg(OH)2↓+BaSO4↓.写完了,不过想说一句话,写化学式最好自己多琢磨.写多了才会记得住1年前查看全部
- “硝酸铵溶于水后温度要降低”这其中发生了什么能量转化
“硝酸铵溶于水后温度要降低”这其中发生了什么能量转化
最好附上解释,可以追加分数
我指的是 能量转化 如 XX能→XX能 怎么爱都不够1年前1
怎么爱都不够1年前1 -
 ohoo 共回答了23个问题
ohoo 共回答了23个问题 |采纳率95.7%热能→化学能(化学键所具有的能量)
因为断开原子之间的化学键需要吸收能量,而形成新的化学键需要放出能量(水合键).1年前查看全部
- 硝酸铵为什么加热易爆炸好像分解产生一氧化二氮和水,然后氨气又被氧化成氮气、氧气和水.但是为什么会爆炸?硝酸铵碰撞就爆炸.
硝酸铵为什么加热易爆炸
好像分解产生一氧化二氮和水,然后氨气又被氧化成氮气、氧气和水.但是为什么会爆炸?
硝酸铵碰撞就爆炸...
碳酸铵受热也分解,为什么不爆炸? ff晴雨1年前1
ff晴雨1年前1 -
 overnights 共回答了17个问题
overnights 共回答了17个问题 |采纳率94.1%加热时反应速度很快
瞬间产生大量气体 而且这是放热反应 瞬间放出大量热量 所以爆炸1年前查看全部
- 1.硝酸铵受撞击而爆炸时的能量转换
1.硝酸铵受撞击而爆炸时的能量转换
____能转化____,再转化____
2.汽油和柴油在有限的空间内剧烈燃烧发生爆炸时的能量转换.
____能转化____,再转化____
4.上诉情况在能量的互相转化过程中有什么共同点?但不同的结果.你有什么启发?
3.汽车以汽油或柴油作为燃料来推动汽车前进的过程中的能量转换
____能转化____,再转化____ anger821年前3
anger821年前3 -
 fffff-a 共回答了21个问题
fffff-a 共回答了21个问题 |采纳率95.2%1.化学能转化为热能,再转化为机械能
2.3同上
共同点:释放化学能转化为机械能
启发:不同外部条件和利用方式产生不同结果1年前查看全部
- 既然浓硫酸稀释时放热,那么这个过程是不是发生了化学反应?为什么浓硫酸稀释放热而硝酸铵吸热?我在稀释浓盐酸和硝酸的时候发现
既然浓硫酸稀释时放热,那么这个过程是不是发生了化学反应?为什么浓硫酸稀释放热而硝酸铵吸热?我在稀释浓盐酸和硝酸的时候发现也是放热的,是不是全部的酸溶于水都放热?那为什么不强调浓盐酸稀释的时候要往水中倒呢?
哦,写错了,是酸倒入水中。 萍水相逢10121年前4
萍水相逢10121年前4 -
 irewo 共回答了22个问题
irewo 共回答了22个问题 |采纳率95.5%物质溶解于水,通常经过两个过程:一种是溶质分子(或离子)的扩散过程,需要吸收热量;另一种是溶质分子(或离子)和溶剂(水)分子作用,形成溶剂(水合)分子(或水合离子)的过程,放出热量.当放出的热量大于吸收的热量时,溶液温度就会升高,如浓硫酸、氢氧化钠、氧化钙(生石灰)等;当放出的热量小于吸收的热量时,溶液温度就会降低,如硝酸铵等;当放出的热量等于吸收的热量时,溶液温度不变,如盐、蔗糖.
所以也不一定全部的酸溶于水都放热
浓硫酸溶于水放出大量热是因为浓硫酸分子跟水分子强烈结合,生成一系列稳定的水合物,并放出大量的热:H2SO4 + nH2O == H2SO4·nH2O(n=2 4 6)
但盐酸溶于水放热少 故不强调浓盐酸稀释的时候要往水中倒1年前查看全部
- 1.60千克尿素〔CO(NH2)2〕中含有氮元素多少千克?在多少千克硝酸铵(NH下标4NO3)中含氮元素和60千克尿素中
1.60千克尿素〔CO(NH2)2〕中含有氮元素多少千克?在多少千克硝酸铵(NH下标4NO3)中含氮元素和60千克尿素中所含氮元素质量相等?
 douqhworks1年前1
douqhworks1年前1 -
 sandymiao98 共回答了24个问题
sandymiao98 共回答了24个问题 |采纳率87.5%题目是60千克尿素吧?
尿素的相对分子质量为12+16+2x(14+2)=60
其中氮元素占28/60=7/15
那么60千克中含氮元素 60x7/15=28千克
NH4NO3相对分子质量为14+4+14+16x3=80
其中氮元素占28/80
那么已知了60千克尿素含氮28千克
那么28除以28/80=80千克
也就是80千克硝酸铵中得氮元素和60千克尿素中氮元素质量相等1年前查看全部
- 多少克尿素【co(NH2)2】的含氮量与160g硝酸铵的含氮量相当. 硝酸铵的化学式是NH4NO3
多少克尿素【co(NH2)2】的含氮量与160g硝酸铵的含氮量相当. 硝酸铵的化学式是NH4NO3
谢谢
 onlyren1年前1
onlyren1年前1 -
 饭岛嫒 共回答了18个问题
饭岛嫒 共回答了18个问题 |采纳率94.4%可以设尿素质量为x.则
(2*14 / 60 )*x =(2*14 /80 )*160
解得,尿素的质量x= 120g1年前查看全部
- 760g尿素[CO(NH2)2]中含氮元素多少克?与多少克硝酸铵(NH4NO3)含氮元素的质量相等?
760g尿素[CO(NH2)2]中含氮元素多少克?与多少克硝酸铵(NH4NO3)含氮元素的质量相等?
急得很, 0201443241年前2
0201443241年前2 -
 辉哥在线 共回答了21个问题
辉哥在线 共回答了21个问题 |采纳率95.2%12+16+(14+2)*2=60
所以尿素相对分子质量为60
所以760/60 * 28=354.6666667g 再让这个数除以硝酸铵中氮元素的质量分数35%,就得硝酸铵的质量.1年前查看全部
- 化学的几道计算题~1.某尿素每千克含N元素0.45千克,则该尿素纯度?2.600千克尿素与多少千克花费硝酸铵肥效相当?
 mazhiwei7771年前1
mazhiwei7771年前1 -
 rsecho 共回答了20个问题
rsecho 共回答了20个问题 |采纳率90%1.尿素的化学式为:CO(NH2)2
其中氮元素的百分含量为:
2×14/(12+16+28+4)=0.46
该尿素每千克含氮元素0.45千克,
则纯度为:0.45/0.46=0.97=97%
2.600kg的尿素含氮的质量为:
600kg×0.46=276kg
硝酸铵NH4NO3中的氮元素百分含量为:
2×14/(2×14+4+3×16)=0.35
要与600kg尿素肥效相同(即含氮量相同),
即需:276kg/0.35=788.57kg1年前查看全部
- 1.多少克硝酸铵所含氮元素与12g尿素所含氮元素质量相当?
1.多少克硝酸铵所含氮元素与12g尿素所含氮元素质量相当?
2.多少克四氧化三铁所含铁元素质量与16g三氧化二铁所含铁元素质量相当?
3.多少质量的碳酸氢铵所含氮元素与120kg尿素所含氮元素质量相当? 寒窗清梦1年前2
寒窗清梦1年前2 -
 鱼鱼鱼520 共回答了16个问题
鱼鱼鱼520 共回答了16个问题 |采纳率93.8%1,NH4NO3,分子量为14+1*4+14+16*3=80,N含量为28/80
CON2H4,分子量为12+16+14*2+1*4=60,N含量为28/60
因此X*28/80=12*28/60,算出硝酸铵质量为16g.
2,Fe3O4,分子量为56*3+16*4=232,铁含量为56*3/232=21/29
Fe2O3,分子量为56*2+16*3=160,铁含量为56*2/160=7/10
因此X*21/29=16*7/10,Fe3O4为15.47g.
3,NH4HCO3,分子量为14+1*4+1+12+16*3=79,N含量为14/79
CON2H4,分子量为12+16+14*2+1*4=60,N含量为28/60
因此X*14/79=120*28/60,算出碳酸氢铵为316Kg.1年前查看全部
- 70KG硝酸铵中含有多少氮元素 多少千克尿素[CO(NH)2)2]与70KG硝酸铵中所含氮元素的质量相当
 grannywang1年前1
grannywang1年前1 -
 穿鱼的女子 共回答了18个问题
穿鱼的女子 共回答了18个问题 |采纳率94.4%你好
N 14 H 1 O 16
以上是各元素的相对原子质量
NH4NO3 硝酸铵的分子式
NH4NO3 =2N+4H+3O=2*14+4*1+16*3=80
80就是硝酸铵的相对分子质量
第1问.
70KG硝酸铵中含有多少氮元素
所以N得重量就是 (70KG/80)*14=12.25 KG
第二问
尿素
相对分子质量为
(NH2)2CO =16*2+12+16=60
设 x KG 的尿素[CO(NH)2)2]与70KG硝酸铵中所含氮元素的质量相当
列式 为
( x/60)*14 = (70KG/80)*14
x = 52.5 祝福学业有成1年前查看全部
- 多少克尿素中含有70g的氮元素?多少千克的硝酸铵与1200kg的尿素中所含氮元素的质量相等
多少克尿素中含有70g的氮元素?多少千克的硝酸铵与1200kg的尿素中所含氮元素的质量相等
快 Eddy_liu1年前1
Eddy_liu1年前1 -
 kiki66 共回答了15个问题
kiki66 共回答了15个问题 |采纳率100%尿素的含氮量是28/60,所以150克尿素中含有70g的氮元素
1200kg的尿素中所含氮元素的质量是560千克,硝酸铵的含氮量是35%,所以硝酸铵质量为1600千克1年前查看全部
- 已知化肥硝酸铵的化学式 NH4NO3 (所有数字是小写的).试求
已知化肥硝酸铵的化学式 NH4NO3 (所有数字是小写的).试求
《1》硝酸铵中N、H、O三种元素的质量比,7:1:4(我已经求出来了)
《2》为了保证某一农作物获得3.5kg氮元素,则需要硝酸铵质量为多少?(要写出过程)
《3》某硝酸铵样品中 NH4NO3 (数字小写)的纯度为90%,求此样品中氮元素的质量分数.(杂志不含氮元素)
俄..第一问 答案看错了,是7:1:12 .好心人直接答第二、三问就好 cklh_10041年前1
cklh_10041年前1 -
 他朝相忘烟水里 共回答了18个问题
他朝相忘烟水里 共回答了18个问题 |采纳率88.9%(1)质量比求错了,应该是:
14*2:1*4:16*3=7:1:12
(2)含N质量分数为:14*2/(14*2+1*4+16*3)=7/20,设需要硝酸铵x kg
x*7/20=3.5
解得x=10
(3)含N质量分数=纯度*纯物质N质量分数=90%*7/20=31.50%1年前查看全部
- 在密闭的仪器内,双氧水和二氧化锰,水和硝酸铵,水和氢氧化钠,水和生石灰,哪个反应后会使仪器内的气压小于外界气压
 苏0051年前1
苏0051年前1 -
 fabio2005 共回答了20个问题
fabio2005 共回答了20个问题 |采纳率90%h2o和naoh1年前查看全部
- 一定条件下,硝酸铵受热分解的未配平的化学方程式为NH4NO3=HNO3+N2+H2O,求被氧化与被还原的原子数之比,过程
 cwwp1年前1
cwwp1年前1 -
 mysticist 共回答了15个问题
mysticist 共回答了15个问题 |采纳率93.3%铵根离子中的N是负三价,硝酸根中的N是正五价,发生归中反应,都得到0价的N,电荷守恒,上升的总价态要等于下降的总价态,3(上升)*5(原子数)=5(下降)*3(原子数),因此被氧化与被还原的原子数之比为5:3.1年前查看全部
- 根据硝酸铵(NH4NO3)化学式计算 160千克硝酸铵中含氮元素多少千克?
 制造ss1年前2
制造ss1年前2 -
 troyaynait 共回答了17个问题
troyaynait 共回答了17个问题 |采纳率88.2%硝酸铵中氮元素的质量分数为28/80*100%=35%
160*35%=56kg
160千克硝酸铵中含氮元素56kg1年前查看全部
- 某硝酸铵样品中NH4NO3的质量分数为90%(杂质不含氮).计算该氮肥样品中氮元素的质量分数______.
 怎么会爱上你1年前1
怎么会爱上你1年前1 -
 lctjane 共回答了17个问题
lctjane 共回答了17个问题 |采纳率100%解题思路:混合物中某元素的质量分数=纯净物中该元素的质量分数×混合物中该纯净物的纯度.解法一:样品中氮元素的质量分数为
[14×2/80]×100%×90%=31.5%.
故答案为31.5%.
解法二:设样品的质量为a,则样品中的NH4NO3的质量为90%a.
则含有的氮元素的质量为90%a×[14×2/14×2+4+16×3]×100%=0.315a.
则氮元素在样品中的质量分数为[0.315a/a]×100%=31.5%
故答案为31.5%点评:
本题考点: 物质组成的综合计算;常见化肥的种类和作用;有关化学式的计算和推断.
考点点评: 本题主要考查和混合物中某元素的质量分数的计算,难度较大.1年前查看全部
- 某硝酸铵[NH4NO3]样品中含一种杂质,经分析样品中氮元素的质量分数为36%,该样品中所含杂质可能是( )
某硝酸铵[NH4NO3]样品中含一种杂质,经分析样品中氮元素的质量分数为36%,该样品中所含杂质可能是( )
A. (NH4)2SO4
B. CO(NH2)2
C. NH4HCO3
D. NaCl 痴心绝对0051年前1
痴心绝对0051年前1 -
 piaoliang3213 共回答了13个问题
piaoliang3213 共回答了13个问题 |采纳率92.3%解题思路:首先计算纯净物硝酸铵中氮元素的质量分数,然后与样品中氮的质量分数相比,看谁的高.若样品中的高,则杂质中氮的质量分数必定高于硝酸铵中的;若样品中的低,则杂质中氮的质量分数必然低于硝酸铵中的.纯净硝酸铵[NH4NO3]中氮元素的质量分数=[28/80]×100%=35%
A、(NH4)2SO4中氮元素的质量分数=[28/132]×100%=21.2%
B、CO(NH2)2中氮元素的质量分数=[28/60]×100%=46.7%
C、NH4HCO3中氮元素的质量分数=[14/79]×100%=17.8%;
D、NaCl中不含氮元素;
样品中氮元素的质量分数为36%>35%,若样品中的高,则杂质中氮的质量分数必定高于硝酸铵中的;
故选B.点评:
本题考点: 有关化学式的计算和推断;元素的质量分数计算.
考点点评: 将质量分数的计算与生活实际相联系;计算时要理清各个量之间的关系,再结合题意进行分析解答.1年前查看全部
- (2012•大庆模拟)硝酸铵是农业生产中常用的化学肥料.为测定某含有少量NaNO3的硝酸铵样品中NH4NO3的纯度,取&
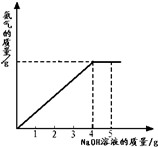 (2012•大庆模拟)硝酸铵是农业生产中常用的化学肥料.为测定某含有少量NaNO3的硝酸铵样品中NH4NO3的纯度,取 2.0g 该硝酸铵样品于容器中,滴入5.0g 20%的NaOH溶液.发生如下反应:NH4NO3+NaOH=NaNO3+NH3↑+H2O.反应过程中放出的氨气质量及加入的NaOH溶液的质量的关系如图所示:完成有关计算:
(2012•大庆模拟)硝酸铵是农业生产中常用的化学肥料.为测定某含有少量NaNO3的硝酸铵样品中NH4NO3的纯度,取 2.0g 该硝酸铵样品于容器中,滴入5.0g 20%的NaOH溶液.发生如下反应:NH4NO3+NaOH=NaNO3+NH3↑+H2O.反应过程中放出的氨气质量及加入的NaOH溶液的质量的关系如图所示:完成有关计算:
(1)样品中硝酸铵的质量分数;
(2)所得溶液中NaNO3的质量分数(保留两位小数). wwID不能取太长1年前1
wwID不能取太长1年前1 -
 纺织工人 共回答了20个问题
纺织工人 共回答了20个问题 |采纳率95%解题思路:(1)从图中可看出氢氧化钠溶液滴加到4克时硝酸铵恰好完全反应,根据参加反应的氢氧化钠的质量求出硝酸铵的质量,即可解答;
(2)根据参加反应的氢氧化钠的质量求出生成的硝酸钠的质量,用生成的硝酸钠的质量+原有的硝酸钠的质量为所得溶液中硝酸钠的质量;用样品的质量+所加氢氧化钠溶液的质量-氨气的质量(氨气的质量可根据氢氧化钠的质量求出)为所得溶液的质量;再根据溶质质量分数计算公式即可求出所得溶液中硝酸钠的质量分数.设2.0g样品中含NH4NO3的质量为ⅹ,反应生成 NaNO3的质量为 y,
反应生成的NH3的质量为z,则
NH4NO3 +NaOH=NaNO3 +NH3↑+H2O
80 40 85 17
ⅹ4g×20% yz
[80/x=
40
4g×20%],[40/4g×20%]=[85/y],[40/4g×20%=
17
z]
ⅹ=1.6g
y=1.7g
z=0.34g
(1)样品中NH4NO3的质量分数为:
1.6g
2g×100%=80%;
(2)反应后所得溶液中NaNO3的质量分数为:
1.7g+(2g−1.6g)
2g+5g−0.34g×100%=31.5%
答:(1)样品中NH4NO3的质量分数为80%;
(2)反应后所得溶液中NaNO3的质量分数为31.5%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 做本道题时要将4克氢氧化钠溶液和5克氢氧化钠溶液区分清,不能乱用,参加反应的氢氧化钠溶液的质量是4克,所加的氢氧化钠溶液的质量是5克.1年前查看全部
- 10℃时硝酸铵的溶解度为140克.10℃将52克硝酸铵放入35克水中充分溶解求所得饱和溶液的质量
 小筱筱1年前4
小筱筱1年前4 -
 三途之河 共回答了25个问题
三途之河 共回答了25个问题 |采纳率84%10℃下,35克水最多溶解硝酸铵=35*140/100=49g,现在52>49,所以可得饱和溶液49+25=84g1年前查看全部
- 下列关于化肥的一些说法,正确的是( ) A.氯化钾是一种复合肥料 B.所有氮肥加入熟石灰能闻到刺激性气味 C.硝酸铵的
下列关于化肥的一些说法,正确的是( ) A.氯化钾是一种复合肥料 B.所有氮肥加入熟石灰能闻到刺激性气味 C.硝酸铵的含氮量比尿素[化学是CO(NH 2 ) 2 ]高 D.农家肥与化肥综合使用,有利于保护环境  zy8111081年前1
zy8111081年前1 -
 v688 共回答了21个问题
v688 共回答了21个问题 |采纳率85.7%A、氯化钾中含有钾元素,属于钾肥.故选项说法错误.
B、铵态氮肥与碱性物质混合会产生刺激性气味,尿素不与熟石灰反应,加入熟石灰能不会闻到刺激性气味,故选项说法错误.
C、硝酸铵(NH 4 NO 3 )中氮元素的质量分数是
14×2
80 ×100%=35%,尿素中氮元素的质量分数是
14×2
60 ×100%≈46.7%;故硝酸铵的含氮量比尿素低,故选项说法错误.
D、要合理地使用化肥,将农家肥与化肥综合使用,有利于保护环境,故选项说法正确.
故选D.1年前查看全部
- 写出下列物质溶于水的电离方程式(1)氢氧化钙(2)硫酸铝(3)硝酸铵(4)硫酸氢钠
 shellyhxh1年前2
shellyhxh1年前2 -
 hzlopo 共回答了15个问题
hzlopo 共回答了15个问题 |采纳率86.7%1:ca+ OH-
2:AL3+ SO4 2-
3:NH4+ NO3-
4:HSO4- NA+1年前查看全部
- 硝酸铵加热反应生成什么?怎么验证其生成物?
 zht9191911年前5
zht9191911年前5 -
 vickymei 共回答了18个问题
vickymei 共回答了18个问题 |采纳率94.4%硝酸铵加热分
1,110度时
NH4NO3=加热==NH3+HNO3
2,185~200度时
NH4NO3=加热==N2O↑+2H2O
3,230度以上
2NH4NO3=加热==2N2↑+O2↑+4H2O
400度以上温度
4NH4NO3=加热==3N2+2NO2+8H2O
NH3的检验:使用红色石蕊试剂
O2的检验:用为烧尽的木条
N2的检验:N2太稳定,用排除法检验.
HNO3的检验:观察有白雾产生
NO2的检验:观察颜色,通入水中
H2O的检验:无水硫酸铜1年前查看全部
- 为什么硝酸铵不能与碱性物质混合施用
 pp886ok1年前3
pp886ok1年前3 -
 尚善若水SSRS 共回答了14个问题
尚善若水SSRS 共回答了14个问题 |采纳率85.7%硝酸铵中的铵根离子会与碱性物质中电离出的氢氧根离子发生复分解反应,产生氨气,使硝酸铵得肥效损失.1年前查看全部
- 草木灰(k2co3)为什么不能与硝酸铵混合使用
草木灰(k2co3)为什么不能与硝酸铵混合使用
没 ruofengli1年前3
ruofengli1年前3 -
 iiii2 共回答了20个问题
iiii2 共回答了20个问题 |采纳率90%草木灰中含有K2CO3,和氮肥施用会分解N元素,形成氨气,造成氮损失,这个其实是平衡问题
氮肥有无机氮肥和有机氮肥之分,一般来说,无机氮肥不能和碱性肥料混和使用
NH4NO3(硝酸铵)它们中含有(NH4)+离子,(NH4)+离子在碱性条件下(OH-)会生成易挥发的NH3(氨气)逸出,从而使氮元素损失:
(NH4)+ +(OH)- =NH3 +H2O
石灰主要成分是Ca(OH)2(熟石灰),溶于水电离出(OH)-离子,故不能与氮肥混用
而草木灰主要成分为K2CO3,溶于水电离出(CO3)2-离子,(CO3)2-离子在水中会水解产生(OH)-离子:
(CO3)2- + H2O = (HCO3)- + (OH)-
因而也不能与氮肥混用.1年前查看全部
- 利用元素的化合价的性质,写出硫化锌.氟化银 .氯化钡 .硫酸 .氢氧化铜 .硝酸铵的化学式.
利用元素的化合价的性质,写出硫化锌.氟化银 .氯化钡 .硫酸 .氢氧化铜 .硝酸铵的化学式.
利用元素的化合价的性质,写出硫化锌 .氟化银 .氯化钡 .硫酸 .氢氧化铜 .硝酸铵的化学式. 622826491年前1
622826491年前1 -
 shmilyforjmq 共回答了22个问题
shmilyforjmq 共回答了22个问题 |采纳率86.4%ZnS 硫化锌 AgF 氟化银 BaCl2 氯化钡 H2SO4 硫酸 Cu(OH)2 氢氧化铜 NH4NO3硝酸铵1年前查看全部
- 只有离子团组成的化合物例如硝酸铵中同一元素才有多种化合价吗?
 15196011年前2
15196011年前2 -
 taitsi 共回答了18个问题
taitsi 共回答了18个问题 |采纳率83.3%不是的,比如说金属化合物Fe3O4里边Fe就有两种化合价+2价和+3价.1年前查看全部
- 化学→为什么硝酸铵可以促进水的电离?
化学→为什么硝酸铵可以促进水的电离?
什么会结合水中的氢氧根?是铵根还是水解来的氢离子? ti_a_mo1年前5
ti_a_mo1年前5 -
 kk小虾米 共回答了19个问题
kk小虾米 共回答了19个问题 |采纳率94.7%H2O===OH- + H+
NH4+ + OH- ==NH3.H2O
NH4+结合了水的OH-,使平衡向正方向移动1年前查看全部
- 某不纯的化肥经化验的氮的含量为31.5%已知其中只有硝酸铵NH4NO3为含氮化何物,则NH4NO3的质量分数为多少?
 13000023004001年前1
13000023004001年前1 -
 fgfgffgf 共回答了18个问题
fgfgffgf 共回答了18个问题 |采纳率83.3%设化肥的质量为100g.
其中氮的质量为:100gx31.5%=31.5g
NH4NO3中氮的质量分数=(14x2)/14x2+1x4+16x3=35%
NH4NO3的质量=31.5g/35%=90g
NH4NO3的质量分数=90g/100g=90%1年前查看全部
- (2012•东城区一模)硝酸铵(NH4NO3)的外观与氯化钠很相似,均为白色固体.区别它们的一种方法是将两者分别隔绝空气
(2012•东城区一模)硝酸铵(NH4NO3)的外观与氯化钠很相似,均为白色固体.区别它们的一种方法是将两者分别隔绝空气加热,氯化钠不分解,硝酸铵能分解.硝酸铵分解得到的气体不可能是( )
A.NH3
B.SO2
C.NO2
D.N2 Lydia_t1年前1
Lydia_t1年前1 -
 uu觅者 共回答了15个问题
uu觅者 共回答了15个问题 |采纳率93.3%解题思路:根据质量守恒定律,化学反应前后,元素的种类不变进行分析.化学反应前后元素的种类不变,硝酸铵中有氮元素、氢元素、氧元素三种元素,故分解后得到的气体中只能含有这三种元素.
故选B点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本题考查了质量守恒定律,明白元素的种类在化学反应前后不变是解决本题的关键.1年前查看全部
- 下列溶液中,呈碱性的是()硫酸钠溶液氯化铁溶液硝酸钾溶液硝酸铵溶液是酸性 D是么?
 喝饱水的鱼1年前1
喝饱水的鱼1年前1 -
 弊绝风清 共回答了16个问题
弊绝风清 共回答了16个问题 |采纳率87.5%B
D好像也是
强酸弱碱嘛1年前查看全部
- 书上写 “硝酸铵溶于水吸热 降温”“硝酸铵的溶解度随温度的升高而升高”
书上写 “硝酸铵溶于水吸热 降温”“硝酸铵的溶解度随温度的升高而升高”
如果在100g水中溶20g硝酸铵 达到饱和 硝酸铵溶水吸热 溶液降温 ;则降温后溶解度也随之降低 会有硝酸铵固体析出 ——这种猜想对吗 我有点饿1年前2
我有点饿1年前2 -
 grace00 共回答了31个问题
grace00 共回答了31个问题 |采纳率90.3%降温速度要快于溶解速度.假如温度t时,100g水溶解20g硝铵达到饱和,那么将20g硝铵投入100g水中,它会边降温边溶解.由于降温速度快于溶解速度,所以,达到某一平衡点后,总有部分硝铵无法溶解,直至外界温度使溶液温度又逐渐升高,它才会继续溶解剩余部分.当回升至t时,全部溶解.
所以,溶解过程中,会发现是逐渐溶解掉的,而不是溶解后又析出.1年前查看全部
- 60克硝酸铵(NH4NO3)中含氮元素( )
60克硝酸铵(NH4NO3)中含氮元素( )
要有计算过程或推理过程
在线等,急!!!!!!!!!!! sxpsxp1581年前2
sxpsxp1581年前2 -
 邹飞 共回答了22个问题
邹飞 共回答了22个问题 |采纳率86.4%硝酸铵相对分子质量14+4*1+14+16*3=80
内氮元素分子质量14*2=28
则60G硝酸铵中氮元素=60*(28/80)=21g1年前查看全部
- 谁知道硝酸铵分解的五个不同的化学方程式?(要反映条件!)
谁知道硝酸铵分解的五个不同的化学方程式?(要反映条件!)
2楼的,分解不是反应么?
我听说有一本书叫什么,“化学八十五讲”上面好现有硝酸分解的五个方程式,不知哪位大仙帮我找一下,谁找到了,寡人赠25分! 2ghm1年前1
2ghm1年前1 -
 胡同拐子 共回答了19个问题
胡同拐子 共回答了19个问题 |采纳率100%条件就太复杂拉!有的反应可以在不同条件下发生,不一定要严格地按照某一条件进行.
但方程式是可以写的.负三价铵无论如何会变价,一般是升到零价.
硝酸中正五价的氮就不一定了.可能生成正四价、正二价、正一价和水,也可能生成正一价、零价和氧气.若是五价氮直接降零价还生不出氧气那就见鬼了.根据这些大概去配平一下就知道啦!1年前查看全部
- 2L0.4mol/L的硝酸铵和5L0.1mol/L的氢氧化钡混合,溶液中各离子浓度
2L0.4mol/L的硝酸铵和5L0.1mol/L的氢氧化钡混合,溶液中各离子浓度
A.c(NO3 -)>c(OH -)>c(NH4 +)>c(Ba 2+)
B.c(NO3 -)>c(Ba 2+)>c(OH -)>c(NH4 +)
原因
三楼的,OH-有1MOL,NH4+有0.8MOL,而Ba2+是0.5MOL,那么c(Ba 2+) ws00101年前5
ws00101年前5 -
 zhutianli 共回答了19个问题
zhutianli 共回答了19个问题 |采纳率94.7%0.8mol NO3 - 0.8mol NH4+ 1mol OH - 0.5mol Ba2+
由于有向外排除 并且不同溶液混合体积不一定为简单相加 溶液体积不定
发生反应为 NH4+ 与 OH - 1:1进行
0.8mol NH4+ 1mol OH - 变为 0.8mol NH3 0.8molH2O 0.2molOH -
现在溶液含
0.8mol NO3 - 0.2molOH - 0.5mol Ba2+(0.4mol Ba(NO3)2 1molBa(OH)2 )
溶液体积V
c=n/V 显然 为B1年前查看全部
- 将20ml 0.4mol/l的硝酸铵溶液跟50ml 0.1mol/l的Ba(OH)2混合,则混合液各离子浓度大小
将20ml 0.4mol/l的硝酸铵溶液跟50ml 0.1mol/l的Ba(OH)2混合,则混合液各离子浓度大小
麻烦写清楚点,我怕看不懂,
我要的是离子浓度大小比较 sisipy1年前1
sisipy1年前1 -
 a5426599 共回答了22个问题
a5426599 共回答了22个问题 |采纳率95.5%c(NO3-)=0.4*20/70=8/70
c(Ba2+)=50*0.1/70=5/70
c(NH4+)=0
c(OH-)=(50*2*0.1-20*0.4)/70=2/70
c(H+)=Kw/c(OH-)1年前查看全部
- 溶液1.将氢氧化钠溶于水,溶液温度 ( ),而将硝酸铵溶于水,溶液的温度( ),这是物质溶解时的热现象.2.将氢氧化钠溶
溶液
1.将氢氧化钠溶于水,溶液温度 ( ),而将硝酸铵溶于水,溶液的温度( ),这是物质溶解时的热现象.
2.将氢氧化钠溶于水,溶液温度( ),而将硝酸铵溶于水,溶液的温度( ),这是物质溶解时的热现象.
3.某温度下,某物质的溶解度为25克,则该溶质的饱和溶液中溶质、溶剂、溶液的质量之比为( )
A.1:2:3 B.1:4:5 C.5:3:2 D.2:3:4 ff1231年前2
ff1231年前2 -
 jiashh 共回答了22个问题
jiashh 共回答了22个问题 |采纳率95.5%2升高,降低.3B,溶解度是指该物质在100克水中最多能溶解的质量.本题中溶质为25克,容剂为100克,溶液为125克,三者之比是1:4:51年前查看全部
- 在二氧化碳中,碳元素与氧元素的质量之比为——,硝酸铵中,氮元素的质量分数为——,尿素中氮元素的质量分数为——
 prwyczy1年前1
prwyczy1年前1 -
 迷恋海的深蓝 共回答了21个问题
迷恋海的深蓝 共回答了21个问题 |采纳率85.7%在二氧化碳中,碳元素与氧元素的质量之比 = 12:(16×2) = 3:8
NH4NO3中,N的质量分数 = 14÷(14+4+14+3×16) ×100% = 17.5%
尿素CO(NH2)2,N的质量分数 = 28÷(12+16+14×2+4) ×100%= 46.7%1年前查看全部
- 可溶性盐是不是只有在碳酸盐中钾盐,钠盐,铵盐才可溶?还有如果说KNO3一般不参与复分解反应,那么是不是硝酸钠,硝酸铵都不
可溶性盐
是不是只有在碳酸盐中钾盐,钠盐,铵盐才可溶?
还有如果说KNO3一般不参与复分解反应,那么是不是硝酸钠,硝酸铵都不参与复分解反应?
 小rongrangel1年前1
小rongrangel1年前1 -
 yyy20100 共回答了19个问题
yyy20100 共回答了19个问题 |采纳率84.2%不是 所有的钾盐,钠盐,铵盐都可以溶
判断复分解反应是否可以进行看三点
1、生成物有水;
2、生成物有气体;
3、生成物有难溶物体;
符合以上三点任何一点都可以进行
否则就不能进行1年前查看全部
- 化学推断题一道.计算硝酸铵(NH₄NO₃)中氮元素的质量分数,多少g硝酸铵中的含氮量与790g碳酸氢铵(NH₄HCO₃)
化学推断题一道.
计算硝酸铵(NH₄NO₃)中氮元素的质量分数,多少g硝酸铵中的含氮量与790g碳酸氢铵(NH₄HCO₃)中含氮量相等. chelsea_fan1年前1
chelsea_fan1年前1 -
 世间精品男人 共回答了17个问题
世间精品男人 共回答了17个问题 |采纳率82.4%NH4NO3的相对分子质量为80,所以氮元素的质量分数为0.35
NH₄HCO₃的相对分子质量为79,也就是10mol的碳酸氢铵,碳酸氢铵中只含1个氮,硝酸铵中含两个,所以需要5mol硝酸铵,也就是400g1年前查看全部
- ①.1kg碳酸氢铵中,所含氮元素的质量与多少千克硝酸铵中所含氮元素的质量相等【计算题】
①.1kg碳酸氢铵中,所含氮元素的质量与多少千克硝酸铵中所含氮元素的质量相等【计算题】
②.某元素与硝酸铵根结合的化合物其相对分子质量为m,相同价态的该元素与硫酸根结合的化合物其相对分子质量为n,用m和n来表示该元素的化合价,请写出来.【通过计算导出】
请尽快~最好是今天到明天早上~ huzhiliang1年前2
huzhiliang1年前2 -
 wangcls 共回答了21个问题
wangcls 共回答了21个问题 |采纳率90.5%NH4HCO3中,N的质量分数为14/(14+5+60)=14/79
NH4NO3中,N的质量分数为28/(28+4+48)=28/80
1kg碳酸氢铵中N元素质量为14/79*1kg=14/79kg
14/79kg/ 28/80=80/158=40/79kg
你的第二题是不是打错了,不存在硝酸铵根,我用硝酸根来算了
设此元素化合价为x,此元素设为M,此元素质量为a
M(NO3)x 相对分子质量为a+(14+48)x=m a+62x=m
M(SO4)x/2 相对分子质量为a+96x/2=n a+48x=n x=(m-n)/141年前查看全部
- 跟7.9千克碳酸氢铵含氮量相当的硝酸铵的质量是
跟7.9千克碳酸氢铵含氮量相当的硝酸铵的质量是
A.8千克 B.2千克 C.4千克 D.16千克
给下计算过程谢~ zhuenqi1年前1
zhuenqi1年前1 -
 飞鸟与猪 共回答了18个问题
飞鸟与猪 共回答了18个问题 |采纳率66.7%NH4HCO3,分子量79,含氮18%,NH4NO3,分子量80,含氮量35%
7.9 *18% = x *35%
x等于4
所以选C1年前查看全部
- 把aL含硫酸铵、硝酸铵的混合溶液分成两等份,一份用b mol烧碱刚好把NH3全部赶出,另一份用氯化钡溶液完全反应,消耗c
把aL含硫酸铵、硝酸铵的混合溶液分成两等份,一份用b mol烧碱刚好把NH3全部赶出,另一份用氯化钡溶液完全反应,消耗c mol BlCl2,则原溶液中c(NO3-)为( )
A.b-2c/a mol/L
B.2b-4c/a mol/L
C.2b-c/a mol/L
D.2c-4b/a mol/L
c(NO3-)到底是如何算的, xiejinghe1年前3
xiejinghe1年前3 -
 wldshen 共回答了16个问题
wldshen 共回答了16个问题 |采纳率93.8%由“另一份用氯化钡溶液完全反应,消耗c mol BlCl2”知每一份中含有c mol硫酸铵,所以第一份与烧碱反应的
硫酸铵也为c mol ,第一份c mol 硫酸铵消耗的烧碱为2c mol,故与烧碱反应的硝酸铵为(b-2c) mol,即第一份c(NO3-)=(b-2c)/(a/2)=(2b-4c)/a mol/L ,将溶液等分并不改变其浓度,原溶液中c(NO3-)也为(2b-4c)/a mol/L .1年前查看全部
- ?请高手帮忙算一下,化学题!:为给庄稼施氮肥,须27kg尿素[CO(NH2)2],若换成硝酸铵(NH4NO3),达到..
?请高手帮忙算一下,化学题!:为给庄稼施氮肥,须27kg尿素[CO(NH2)2],若换成硝酸铵(NH4NO3),达到...
?请高手帮忙算一下,化学题!:为给庄稼施氮肥,须27kg尿素[CO(NH2)2],若换成硝酸铵(NH4NO3),达到同样效果,用多少千克 海艺hhxx1年前2
海艺hhxx1年前2 -
 Alan_love_u2000 共回答了22个问题
Alan_love_u2000 共回答了22个问题 |采纳率90.9%27kg尿素含有的氮元素质量 = 27*28/60 = 12.6kg
所以需要硝酸铵的质量 = 12.6/(28/80) = 36kg
即需要36千克硝酸铵.1年前查看全部
- 尿素[CO(NH2)2]和硝酸铵(NH4NO3)都是优质氮肥.(1)CO(NH2)2的相对分子质量为多少?(2)NH4N
尿素[CO(NH2)2]和硝酸铵(NH4NO3)都是优质氮肥.(1)CO(NH2)2的相对分子质量为多少?(2)NH4NO3中氮元素的质量分数为多少?(3)多少千克的NH4NO3与30㎏的尿素所含氮元素的质量相等?
 cckj1年前1
cckj1年前1 -
 tryinggirl 共回答了17个问题
tryinggirl 共回答了17个问题 |采纳率100%1.60
2.28÷80=35%
3.35%X=30×28/60
x=25kg1年前查看全部
- 某菜农原计划在每亩菜地施用硝酸铵(NH4NO3)16千克,
某菜农原计划在每亩菜地施用硝酸铵(NH4NO3)16千克,
现改施尿素CO(NH2)2
若要达到同样的施肥效果,则每亩菜地应施尿素多少千克 放爱飞翔1年前1
放爱飞翔1年前1 -
 foxhcl 共回答了12个问题
foxhcl 共回答了12个问题 |采纳率75%现在算氮的质量分数 NH4NO3中为 28/80
CO(NH2)2中为 28/60
设应施尿素X千克,X*28/60=16*28/80 X=16*60/80=121年前查看全部
- 在 硝酸银溶液中加入氨水,开始在 硝酸铵溶液中出现( 1)反应的 离子方程式为( 2),继续滴入氨水则(3 ),反应的化
在 硝酸银溶液中加入氨水,开始在 硝酸铵溶液中出现( 1)反应的 离子方程式为( 2),继续滴入氨水则(3 ),反应的化学方程式为(4 ),边滴边振荡直滴到(5 )为止,再加入乙醛溶液后,水溶液加热的 现象是(6),化学方程式为 (7)
 cctvsonic1年前4
cctvsonic1年前4 -
 清风明月a 共回答了19个问题
清风明月a 共回答了19个问题 |采纳率94.7%1:白色沉淀(白色!不是黑色氧化银!)
2:Ag(+) + NH3.H2O == AgOH + NH4(+) (括号内为电荷角标)
3:沉淀逐渐减少
4:AgOH + 2NH3.H20 == Ag(NH3)2OH + 2H2O
5:沉淀刚好完全溶解(注意是刚好!)
6:出现光亮的银附着在试管底
7:2Ag(NH3)2OH + HCHO =水浴加热= 2Ag(沉淀箭号)+ HCOONH4 +3NH3 + H20 (注意氨没有气体箭号!)
没法弄角标……凑合看吧……好好学习吧!这块是高考要点!1年前查看全部
大家在问
- 12的一次方+2的二次方+2的三次方+2的四次方+…+2十八次方=?
- 2下列说法不正确的是( )A.四碳酸、五碳糖、六碳糖等都是多糖B.蔗糖、麦芽糖是植物体内含有的重要二糖C.糖原、淀粉分别
- 3一本《童话故事》有80页每页25行,平均每行23个字这本《童话故事》有多少个字
- 4y=cos2 x-asin x+b(x大于等于0,小于2π),且函数最大值为0,最小值为-4
- 5(2012•长沙)水绵生活在淡水中,无根、茎、叶的分化.从分类学上来看,水绵属于( )
- 6已知太阳、地球质量和日地距离,求日地间万有引力
- 7英语翻译Enter or paste a list of email addresses below (one emai
- 8已知a-b=-1,ab=3,求a3b-2a2b2+ab3的值.
- 9麻烦老师解答:The children wake up
- 10填空题,填写合适的词,一( )龙舟
- 11南极最丰富的自然资源是( )A. 海洋资源B. 生物资源C. 矿产资源D. 淡水资源
- 12如图所示,一根轻质细杆的两端分别固定着A、B两个小球,在杆上的O点装一光滑水平轴,已知两球质量均为m,AO=l,BO=2
- 13若单项式-m²n的3n+5次方与m²n的4x+3次方的和还是单项式,试求x的值
- 14人类的生活和工农业生产都离不开水.如图是自来水厂净水过程示意图.自来水厂生产自来水时,使用的净水方法有 A.沉
- 15如果-mxy的n-1的绝对值的次方是关于xy的一个单项式,且系数是2,次数是3.求m、n的值.
