蛇纹石矿可看作由MgO、Fe2O3、Al2O3、SiO2组成.由蛇纹石制碱式碳酸镁的实验步骤如下:
 fl86232022-10-04 11:39:541条回答
fl86232022-10-04 11:39:541条回答
室温下,相关金属氢氧化物沉淀的KSP见下表1
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| (溶度积)KSP | 4.0×10-38 | 1.25×10-33 | 1.8×10-11 |
A. 在滤液I中,不能加过量的Ca(OH)2是为了防止Al(OH)3溶解和Mg2+沉淀
B. 滤液I中,加Ca(OH)2后Al3+比Fe3+先沉淀完全
C. 室温下,用Ca(OH)2把滤液I的pH调节到4.7时,Al3+刚好沉淀完全
D. 称18.2g碱式碳酸镁【aMgCO3•b Mg(OH)2•cH2O】高温加热分解得到6.6g CO2和8.0g MgO,由此可知a=3、b=1、c=3

已提交,审核后显示!提交回复
共1条回复
 我是左岸 共回答了17个问题
我是左岸 共回答了17个问题 |采纳率94.1%- 解题思路:A、Al(OH)3能溶于强碱,Mg2+不能提前沉淀;
B、根据Ksp分析,化学式相似的,Ksp越小,越易形成沉淀;
C、根据氢氧化铝的Ksp可以求出Al3+刚好沉淀完全时的PH;
D、确定产品aMgCO3•bMg(OH)2•cH2O中a、b、c的值,需要测定的数据是①样品质量;②MgO质量;③生成CO2的质量(或体积);④生成水的质量;A、Al(OH)3能溶于强碱,Mg2+不能提前沉淀,所以不能加过量的Ca(OH)2;故A正确;
B、根据Ksp分析,化学式相似的,Ksp越小,越易形成沉淀,已知Fe(OH)3的Ksp小,所以Fe(OH)3先形成沉淀,故B错误;
C、Al3+刚好沉淀完全时c(Al3+)=1.0×10-5 mol•L-1,则c(OH-)=
3
Ksp
c(Al3+)
=
3
1.25×10-33
1.0×10-5
=5×10-10mol•L-1,所以c(H+)=2×10-5mol•L-1
,所以PH=4.7,即pH调节到4.7时,Al3+刚好沉淀完全,故C正确;
D、m(样品)=18.2g,m(CO2)=6.6g,m(MgO)=8.0g,碱式碳酸镁分 aMgCO3・bMg(OH)2・cH2
高温
.
O (a+b)MgO+aCO2↑+(b+c)H2O↑,根据质量守恒得:m(H2O)=18.2g-6.6g-8.0g=3.6g,则n(MgO)═0.2mol,n(CO2)═0.15mol,n(H2O)═0.2mol,得:a:b:c=0.15:0.05:0.15=3:1:3,所以a=3、b=1、c=3,故D正确;
故选B.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题主要考查了沉淀溶解平衡原理,Ksp的有关计算,元素化合物中金属铝、铁的性质,解题时需熟知物质间的反应原理. - 1年前
相关推荐
- 蛇纹石由MgO、Al2O3、SiO2、Fe2O3组成.现取一样品溶于过量盐酸下列正确的是()
蛇纹石由MgO、Al2O3、SiO2、Fe2O3组成.现取一样品溶于过量盐酸下列正确的是()
A.沉淀X是混合物 B.溶液中的阳离子主要是Mg2+.Al3+.Fe3+ C.该蛇纹石化学式可能为Mg2Al2Fe3Si2O12 D.向溶液中滴加氢氧化钠溶液,到沉淀最大时过滤得到固体是纯净物. wangfeng8411301年前1
wangfeng8411301年前1 -
 ccyd_007 共回答了17个问题
ccyd_007 共回答了17个问题 |采纳率94.1%A、错误.由于MgO、Al2O3、Fe2O3都能溶于盐酸,所以沉淀只有SiO2,纯净物B、正确.MgO、Al2O3、Fe2O3溶于盐酸,分别得到离子Mg2+、Al3+、Fe3+,还有过量的H+C、错误.化合价总和不为0,D、错误.沉淀质量最大时,固体为Mg(OH)2...1年前查看全部
- 蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成的.由蛇纹石制取碱式碳酸镁的实验步骤如下
蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成的.由蛇纹石制取碱式碳酸镁的实验步骤如下

(4)可循环的物质是_______
答案为什么是Ca(OH)2、CO2 樱花飘浪1年前1
樱花飘浪1年前1 -
 六脉 共回答了16个问题
六脉 共回答了16个问题 |采纳率93.8%第二次加入Ca(OH)2时通入CO2产生的沉淀物B为Al2O3、CaCO3.CaCO3可以回收产生CO2和Ca(OH)2.Mg(HCO3)2热解也会产生CO2.
方程式我没写出,沉淀物A为Fe(OH)3.
希望这回答你能满意.1年前查看全部
- 蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成
蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成
http://zhidao.baidu.com/question/66149364.html?an=0&si=1
这道题,请每道题的答案都帮我解释一下 落花似雪1年前2
落花似雪1年前2 -
 suns2122 共回答了11个问题
suns2122 共回答了11个问题 |采纳率90.9%1)蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2,和HCl反应,前三者会溶解,所以有Mg2+,Fe3+,Al3+2)当氢氧化钙过量时,溶液碱性会升高,那么Al(OH)3会溶解,由于Mg(OH)2在pH为9.4时开始沉淀,所以碱性升高时Mg(OH)2会开...1年前查看全部
- (2013•广东模拟)蛇纹石是一种含水的富镁硅酸盐矿物的总称,可以看作由MgO、Fe2O3、Al2O3、SiO2组成.实
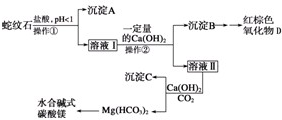 (2013•广东模拟)蛇纹石是一种含水的富镁硅酸盐矿物的总称,可以看作由MgO、Fe2O3、Al2O3、SiO2组成.实验室以蛇纹石为原料制取水合碱式碳酸镁,已知:
(2013•广东模拟)蛇纹石是一种含水的富镁硅酸盐矿物的总称,可以看作由MgO、Fe2O3、Al2O3、SiO2组成.实验室以蛇纹石为原料制取水合碱式碳酸镁,已知:
实验步骤如下:氢氧化物 Fe(OH)3 Al(OH)3 Mg(OH)2 开始沉淀的pH 1.5 3.3 9.4 完全沉淀的pH 3.7 5.2 11.0
(1)实验室完成操作①所用到的玻璃仪器有:______.
(2)操作②中应控制溶液pH的合理范围是______(填序号).
A.小于1.5B.1.5~3.3C.7~8D.大于9.4
(3)检验溶液Ⅱ中是否含有Fe3+的操作与结论是:______.
(4)从沉淀混合物B中制取D,应加入一种试剂进行分离,其反应的离子方程式为:
______,再进行______、洗涤、______(依次填写实验操作名称). lida1741年前1
lida1741年前1 -
 隐舞忍 共回答了13个问题
隐舞忍 共回答了13个问题 |采纳率100%解题思路:(1)蛇纹石可以看作由MgO、Fe2O3、Al2O3、SiO2组成,其中MgO、Fe2O3、Al2O3溶于盐酸生成盐和水,二氧化硅不和盐酸反应,沉淀A为SiO2,分离固体和溶液的方法是过滤;
(2)操作②是控制溶液PH,使铁离子和铝离子沉淀,镁离子不沉淀,控制溶液pH小于9.4,但不能使氢氧化铝溶解;
(3)Fe3+离子的检验方法是:取少量溶液Ⅱ,加入硫氰酸钾后,观察溶液是否变血红色;
(4)依据转化关系分析,过程为了制备水合碱式碳酸镁,所以操作②氢氧化钙需要适量,控制溶液pH小于9.4,不能沉淀镁离子,且使铝离子和铁离子全部生成沉淀,判断沉淀B为氢氧化铝、氢氧化铁,得到红色氧化物,需要加入过量氢氧化钠溶液溶解氢氧化铝为偏铝酸钠溶液,过滤得到氢氧化铁沉淀,加热得到氧化铁.(1)蛇纹石由MgO、Fe2O3、Al2O3、SiO2组成,其中MgO、Fe2O3、Al2O3溶于盐酸生成盐和水,二氧化硅不和盐酸反应,沉淀A为 SiO2,分离固体和溶液用过滤的方法,过滤所用玻璃仪器为:玻璃棒、漏斗、烧杯,
故答案为:玻璃棒、漏斗、烧杯;
(2)依据转化关系分析实验目的,过程为了制备碳酸镁,所以操作②氢氧化钙需要适量,控制溶液pH小于9.4,不能沉淀镁离子,且使铝离子和铁离子全部生成沉淀,氢氧化铝是两性氢氧化物,所以碱不能过量,所以pH应控制在7-8最合适,故答案为:C;
(3)取少量溶液Ⅱ于试管中,加入KSCN溶液,若无明显现象,说明溶液Ⅱ不含Fe3+;若溶液变红色,说明溶液Ⅱ含有Fe3+,
故答案为:取少量溶液Ⅱ于试管中,加入KSCN溶液,若无明显现象,说明溶液Ⅱ不含Fe3+;若溶液变红色,说明溶液Ⅱ含有Fe3+;
(4)从沉淀混合物B中制取D,实验流程为了制备碳酸镁,所以操作2氢氧化钙需要适量,控制溶液pH小于9.4,不能沉淀镁离子,且使铝离子和铁离子全部生成沉淀,判断沉淀B为氢氧化铝、氢氧化铁,加热得到红色氧化物,判断氢氧化铁得到红色物质推断为氧化铁,所以需要加入过量氢氧化钠溶液溶解氢氧化铝为偏铝酸钠溶液,反应的离子方程式为:OH-+Al(OH)3═AlO2-+2H2O,过滤得到氢氧化铁沉淀,加热得到氧化铁实现,
故答案为:OH-+Al(OH)3═AlO2-+2H2O;过滤;加热.点评:
本题考点: 镁、铝的重要化合物;铁的氧化物和氢氧化物;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查对工艺流程的理解、物质分离提纯、实验条件的控制、离子检验与实验方案设计等,题目较为综合,需要学生具备扎实的基础,是对学生总能力的考查,题目难度中等.1年前查看全部
- 蛇纹石矿可看作由MgO、Fe2O3、Al2O3、SiO2组成.由蛇纹石制碱式碳酸镁的实验步骤如下:
蛇纹石矿可看作由MgO、Fe2O3、Al2O3、SiO2组成.由蛇纹石制碱式碳酸镁的实验步骤如下:

室温下,相关金属氢氧化物沉淀的KSP见下表1
注:①lg2=0.3,②溶液中某离子的浓度小于1.0×10-5 mol•L-1,可认为该离子沉淀完全.下列说法不正确的是( )氢氧化物 Fe(OH)3 Al(OH)3 Mg(OH)2 (溶度积)KSP 4.0×10-38 1.25×10-33 1.8×10-11
A.在滤液I中,不能加过量的Ca(OH)2是为了防止Al(OH)3溶解和Mg2+沉淀
B.滤液I中,加Ca(OH)2后Al3+比Fe3+先沉淀完全
C.室温下,用Ca(OH)2把滤液I的pH调节到4.7时,Al3+刚好沉淀完全
D.称18.2g碱式碳酸镁【aMgCO3•b Mg(OH)2•cH2O】高温加热分解得到6.6g CO2和8.0g MgO,由此可知a=3、b=1、c=3 ljq838181年前1
ljq838181年前1 -
 找点儿乐子 共回答了14个问题
找点儿乐子 共回答了14个问题 |采纳率92.9%解题思路:A、Al(OH)3能溶于强碱,Mg2+不能提前沉淀;
B、根据Ksp分析,化学式相似的,Ksp越小,越易形成沉淀;
C、根据氢氧化铝的Ksp可以求出Al3+刚好沉淀完全时的PH;
D、确定产品aMgCO3•bMg(OH)2•cH2O中a、b、c的值,需要测定的数据是①样品质量;②MgO质量;③生成CO2的质量(或体积);④生成水的质量;A、Al(OH)3能溶于强碱,Mg2+不能提前沉淀,所以不能加过量的Ca(OH)2;故A正确;
B、根据Ksp分析,化学式相似的,Ksp越小,越易形成沉淀,已知Fe(OH)3的Ksp小,所以Fe(OH)3先形成沉淀,故B错误;
C、Al3+刚好沉淀完全时c(Al3+)=1.0×10-5 mol•L-1,则c(OH-)=
3
Ksp
c(Al3+)
=
3
1.25×10−33
1.0×10−5
=5×10-10mol•L-1,所以c(H+)=2×10-5mol•L-1
,所以PH=4.7,即pH调节到4.7时,Al3+刚好沉淀完全,故C正确;
D、m(样品)=18.2g,m(CO2)=6.6g,m(MgO)=8.0g,碱式碳酸镁分aMgCO3・bMg(OH)2・cH2
高温
.
O (a+b)MgO+aCO2↑+(b+c)H2O↑,根据质量守恒得:m(H2O)=18.2g-6.6g-8.0g=3.6g,则m(MgO)═0.2mol,n(CO2)═0.15mol,n(H2O)═0.2mol,得:a:b:c=0.15:0.05:0.15=3:1:3,所以a=3、b=1、c=3,故D正确;
故选B.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题主要考查了沉淀溶解平衡原理,Ksp的有关计算,元素化合物中金属铝、铁的性质,解题时需熟知物质间的反应原理.1年前查看全部
- 蛇纹石矿可以看作由MgO、Fe2O3、Al2O3和SiO2组成.某实验小组设计如图甲流程欲分别制得单质Al、Fe、Mg和
蛇纹石矿可以看作由MgO、Fe2O3、Al2O3和SiO2组成.某实验小组设计如图甲流程欲分别制得单质Al、Fe、Mg和Si.

有关氢氧化物沉淀的pH见下表:
(1)写出不溶物B在生产中的一种用途:______.金属阳离子 氢氧化物开始沉淀时的pH 氢氧化物完全沉淀时的pH Fe3+ 1.9 3.2 Mg2+ 9.4 11.6
(2)操作⑤中调节pH到5~6时,可以用到的试剂(填序号)______.
a. NaOH溶液b.氨水c. MgOd. Mg (OH)2
(3)从滤液H制取金属Mg的流程如图乙:
Ⅰ.流程中由滤液H中得到MgCl2•6H2O的方法是______过滤、洗涤;
Ⅱ.在干燥的HCl气流中加热MgCl2•6H2O制取无水氯化镁的原因是______.(应用离子方程式和简要文字说明)
Ⅲ.冶炼镁的方法用化学方程式表示为MgCl2
Mg+Cl2↑电解 .熔融 MgCl2.
Mg+Cl2↑电解 .熔融  xgz5011年前1
xgz5011年前1 -
 快乐飞翔 共回答了17个问题
快乐飞翔 共回答了17个问题 |采纳率94.1%解题思路:蛇纹石矿加盐酸溶解,发生反应的化学方程式为MgO+2HCl=MgCl2+H2O,Fe2O3+6HCl=2FeCl3+3H2O,Al2O3+6HCl=2AlCl3+3H2O,SiO2不与盐酸反应,以固体形式先除去,因此,不溶物B为SiO2,滤液A中除了Mg2+外,还有的金属离子是Al3+和Fe3+,加入过量烧碱,滤液E为偏铝酸钠溶液,通入过量二氧化碳反应生成氢氧化铝沉淀,加热分解生成氧化铝,用电解法冶炼可生成铝;沉淀D为Fe(OH)3和Mg(OH)2,加入过量盐酸生成氯化铁和氯化铝,调节溶液pH=5~6时,促进铁离子水解,生成氢氧化铁沉淀,滤液H为氯化镁溶液,在HCl氛围中加热、蒸发结晶可得MgCl2•6H2O,脱水生成MgCl2,电解可得Mg.(1)不溶物B为SiO2,常用于制造玻璃、光导纤维等,故答案为:制造玻璃、光导纤维;
(2)操作⑤中加入的物质能和盐酸反应,且不引进新的杂质,氧化镁、氢氧化镁难溶于水,但能与酸反应,可起调节pH作用,调节溶液pH=5~6时,促进铁离子水解,生成氢氧化铁沉淀,而ab都引入新的杂质,故答案为:cd;
(3)Ⅰ.由溶液得到晶体,应经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作,故答案为:蒸发浓缩、冷却结晶;
Ⅱ.镁离子易水解生成氢氧化镁和氢离子,发生Mg2++2H2O⇌Mg(OH)2+2H+,在氯化氢气流中加热该固体时,氢离子浓度增大,抑制镁离子水解生成氢氧化镁,
故答案为:Mg2++2H2O⇌Mg(OH)2+2H+,通入HCl,使C(H+)增大,抑制Mg2+的水解成Mg(OH)2,确保生成MgCl2;
Ⅲ.镁是活泼金属,应采用电解其熔融盐的方法冶炼,所以工业上用电解熔融氯化镁的方法冶炼镁,反应方程式为:MgCl2
电解
.
熔融Mg+Cl2↑,
故答案为:MgCl2
电解
.
熔融Mg+Cl2↑.点评:
本题考点: 制备实验方案的设计.
考点点评: 本题考查了实验设计,涉及金属的冶炼、盐类的水解、离子方程式的书写等知识点,是高考中的常见题型,试题综合性强,难度较大,学生不易得分.这类试题涉及的情景新颖,还时常出现一些化工术语.这类题目是通过对某种重要化工产品的工业生产流程图的分析,以物质的制备、分离、提纯为试题环境,以元素化合物知识、实验基本操作、化学反应原理、化学化学平衡原理、水解原理、绿色化学观点、安全生产的知识为考查目标,以信息的获取、加工、整合和新情境下实际问题的分析、综合、解决及经济的视角分析实际生产中的各种问题为考查能力目标.1年前查看全部
- (2013•武威)祁连玉因盛产于祁连山而得名(如图).地质学鉴定其矿物是蛇纹石,其化学式为Mg6[Si4O10](OH)
 (2013•武威)祁连玉因盛产于祁连山而得名(如图).地质学鉴定其矿物是蛇纹石,其化学式为Mg6[Si4O10](OH)8,则Mg6[Si4O10](OH)8中Si元素的化合价是( )
(2013•武威)祁连玉因盛产于祁连山而得名(如图).地质学鉴定其矿物是蛇纹石,其化学式为Mg6[Si4O10](OH)8,则Mg6[Si4O10](OH)8中Si元素的化合价是( )
A.+1
B.+2
C.+3
D.+4 wszjk1年前1
wszjk1年前1 -
 amandaphy 共回答了15个问题
amandaphy 共回答了15个问题 |采纳率100%解题思路:根据在化合物中正负化合价代数和为零,结合蛇纹石的化学式进行解答本题.镁元素显+2价,氧元素显-2价,氢氧根显-1价,设硅元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+2)×6+4x+(-2)×10+(-1)×8=0,则x=+4价.
故选D.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题难度不大,掌握利用化合价的原则(化合物中正负化合价代数和为零)计算指定元素的化合价的方法即可正确解答本题.1年前查看全部
- 蛇纹石是一种含水的富镁硅酸盐矿物的总称,可以看作由MgO、Fe 2 O 3 、Al 2 O 3 、SiO 2 组成。实验
蛇纹石是一种含水的富镁硅酸盐矿物的总称,可以看作由MgO、Fe 2 O 3 、Al 2 O 3 、SiO 2 组成。实验室以蛇纹石为原料制取水合碱式碳酸镁,已知:
氢氧化物 Fe(OH) 3 Al(OH) 3 Mg(OH) 2 开始沉淀的pH 1.5 3.3 9.4 完全沉淀的pH 3.7 5.2 11.0
实验步骤如下: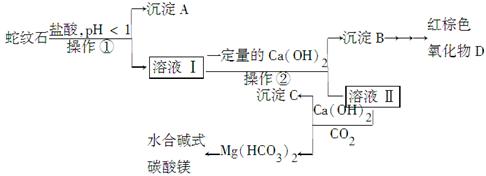
(1)实验室完成操作①所用到的玻璃仪器有:________。
(2)操作②中应控制溶液pH的合理范围是________(填序号)。
A.小于1.5 B.1.5~3.3 C.7~8 D.大小9.4
(3)检验溶液Ⅱ中是否含有Fe 3 + 的操作与结论是______________________。
(4)从沉淀混合物B中制取D,应加入一种试剂进行分离,其反应的离子方程式为________,再进行________、洗涤、________(依次填写实验操作名称)。 没名的城市1年前1
没名的城市1年前1 -
 sdytrg 共回答了16个问题
sdytrg 共回答了16个问题 |采纳率93.8%(1)玻璃棒、漏斗、烧杯
(2)C
(3)取少量溶液Ⅱ于试管中,加入KSCN溶液,若无明显现象,说明溶液Ⅱ不含Fe 3 + ;若溶液变红色,说明溶液Ⅱ含有Fe 3 +
(4)OH - +Al(OH) 3 =AlO 2 — +2H 2 O 过滤、加热或灼烧
(1)操作①是过滤,所以需要的玻璃仪器是玻璃棒、漏斗、烧杯。
(2)操作②的目的是沉淀铁离子和铝离子,但不能沉淀镁离子,所以根据沉淀的pH可知,应控制溶液pH的合理范围是5.2~9.4,答案选C。
(3)检验铁离子的试剂是KSCN溶液,即取少量溶液Ⅱ于试管中,加入KSCN溶液,若无明显现象,说明溶液Ⅱ不含Fe 3 + ;若溶液变红色,说明溶液Ⅱ含有Fe 3 + 。
(4)B中沉淀是氢氧化铝和氢氧化铁,由于氢氧化铝是两性氢氧化物,所以得到氢氧化铁的方法是加入氢氧化钠溶液,过滤即可,反应的离子方程式是OH - +Al(OH) 3 =AlO+2H 2 O;由于在氢氧化铁表面有吸附的离子,所以在过滤之后还需要洗涤,最后加热或灼烧。1年前查看全部
- 大家帮我看看这蛇纹石有价值吗昨天拿去给鉴定的,大家帮我看看这有价值吗?有多少价值蛇纹石(玉)毛料肉眼观察(颜色、形状、总
大家帮我看看这蛇纹石有价值吗
昨天拿去给鉴定的,大家帮我看看这有价值吗?有多少价值
蛇纹石(玉)毛料
肉眼观察(颜色、形状、总质量等)
颜色:表皮为黄白色,擦口处为黄绿色;形状:不规则快状;总质量:参考重量约23KG;规格:41.0 X 28.0 X 22.0(CM);光泽:蜡状光泽至玻璃光泽:透明度:微透明-半透明.
密 度:2.57 ( +0.23,-0.13 ) g/cm 3 .
光性特征:非均质集合体.
多 色 性:无.
折 射 率:1.560 1.570(+0.004,-0.070) .
双折射率:不可测.
紫外荧光:长波:无至弱绿;短波:无.
吸收光谱:不特征.
放大检查:黑色矿物包体,白色条纹,叶片状、纤维状交织结构.
大家帮我看看哈,先给100分,说的好我再追加100分, 胆小怕鬼1年前1
胆小怕鬼1年前1 -
 ml6gua 共回答了15个问题
ml6gua 共回答了15个问题 |采纳率86.7%蛇纹石为中低档宝石类
如果特殊有故事,或者造型比较奇特,或许有观赏价值,很少有收藏价值
不排除有人喜欢,所以这东西要“看对眼”,石头“眼缘”很重要,自己喜欢就好1年前查看全部
- 江苏省东海县矿产丰富,除了水晶制品名扬天下外,蛭石、蛇纹石等矿石储量大,品位高,其相关的耐火、保温隔热材料(主要成分为M
江苏省东海县矿产丰富,除了水晶制品名扬天下外,蛭石、蛇纹石等矿石储量大,品位高,其相关的耐火、保温隔热材料(主要成分为MgO、Al2O3)工业也较发达.
某中学化学探究小组通过查阅相关资料,对蛭石的组成进行了实验探究.
I、相关资料:①蛭石的成分可看成是由MgO、Fe2O3、Al2O3、SiO2组成
②氢氧化物开始沉淀及沉淀完全时的pH
Ⅱ、相关实验:氢氧化物 Fe(OH)3 Mg(OH)2 Al(OH)3 沉淀的pH范围 1.5-4.1 9.4-12.4 3.3-5.2 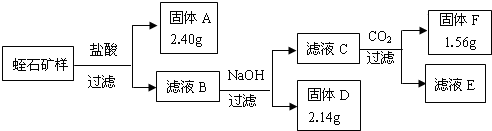
Ⅲ、实验数据:
①矿石样品质量为:8.22g②每次转化所得固体成分只有一种
请你根据以上内容和中学化学知识回答以下问题
(1)写出由D制一种红色颜料的化学方程式:2Fe(OH)3
Fe2O3+3H2O△ .2Fe(OH)3
Fe2O3+3H2O△ .
(2)工业上的耐火材料通常由F及滤液E进一步转化而成,请你分析滤液E中可能含有成分,设计一个从滤液E制取耐火材料的实验方法:______
(3)滤液B和NaOH溶液反应时,应控制溶液的pH在7-8之间,这是因为:______
(4)通过计算,写出用氧化物的形式表示蛭石组成的化学式______. a2869227751年前1
a2869227751年前1 -
 曹敏00 共回答了26个问题
曹敏00 共回答了26个问题 |采纳率88.5%解题思路:蛭石的成分可看成是由MgO、Fe2O3、Al2O3、SiO2,每次转化所得固体成分只有一种,由工艺流程图可知固体A为SiO2;滤液B含有氯化镁、氯化铁、氯化铝等,滤液B加入氢氧化钠溶液,由氢氧化铁、氢氧化镁、氢氧化铝开始沉淀及沉淀完全时的pH值可知,固体D为氢氧化铁,滤液C含有氯化镁、偏铝酸钠、氯化钠;滤液C通入二氧化碳,可知固体F为氢氧化铝,滤液E含有氯化镁、氯化钠等.
(1)D为氢氧化铁可以制备氧化铁红色颜料.
(2)滤液E含有氯化镁、氯化钠等,向滤液中加入足量的NaOH溶液,最后进行高温灼烧可得氧化镁.
(3)根据表中数据,控制溶液的pH在7~8之间,Mg2+没有变化,Al3+转化为AlO2-,只有Fe3+沉淀.
(4)固体A为SiO2质量为2.4g,利用原子守恒,结合氢氧化铁、氢氧化铝沉淀质量计算8.22g中含有氧化铁、氧化铝的质量,再计算氧化镁的质量,进而计算MgO、Al2O3、Fe2O3、SiO2 的物质的量之比.据此书写化学式.蛭石的成分可看成是由MgO、Fe2O3、Al2O3、SiO2,每次转化所得固体成分只有一种,由工艺流程图可知固体A为SiO2;滤液B含有氯化镁、氯化铁、氯化铝等,滤液B加入氢氧化钠溶液,由氢氧化铁、氢氧化镁、氢氧化铝开始沉淀及沉淀完全时的pH值可知,固体D为氢氧化铁,滤液C含有氯化镁、偏铝酸钠、氯化钠;滤液C通入二氧化碳,可知固体F为氢氧化铝,滤液E含有氯化镁、氯化钠等.
(1)D为氢氧化铁可以加热分解制备氧化铁红色颜料,反应方程式为2Fe(OH)3
△
.
Fe2O3+3H2O.
故答案为:2Fe(OH)3
△
.
Fe2O3+3H2O.
(2)滤液E含有氯化镁、氯化钠等,向将所得的滤液E中加入足量的NaOH溶液,再进行过滤、洗涤、干燥,得氢氧化镁沉淀,最后进行高温灼烧氢氧化镁可以生成氧化镁,制取耐火材料.
故答案为:向将所得的滤液E中加入足量的NaOH溶液,再进行过滤、洗涤、干燥,最后进行高温灼烧.
(3)根据表中数据,控制溶液的pH在7~8之间,Mg2+没有变化,Al3+转化为AlO2-,只有Fe3+沉淀,保证沉淀只有Fe(OH)3.
故答案为:根据表中数据,控制溶液的pH在7~8之间,Mg2+没有变化,Al3+转化为AlO2-,只有Fe3+沉淀,保证沉淀只有Fe(OH)3.
(4)固体A为SiO2质量为2.4g,物质的量为[2.4g/60g/mol]=0.04mol;
D为氢氧化铁,质量为2.14g,物质的量为[2.14g/107g/mol]=0.02mol,根据铁元素守恒可知氧化铁物质的量为0.01mol,质量为0.01mol×160g/mol=1.6g;
F为氢氧化铝,质量为1.56g,物质的量为[1.56g/78g/mol]=0.02mol,根据铝元素守恒可知氧化铝物质的量为0.01mol,质量为0.01mol×102g/mol=1.02g;
故氧化镁的质量为8.22g-2.4g-1.6g-1.02g=3.2g,物质的量为[3.2g/40g/mol]=0.08mol,
所以n(MgO):n(Al2O3):n(Fe2O3):n(SiO2 )=0.04mol:0.01mol:0.01mol:0.02mol=4:1:1:2.
所以用氧化物的形式表示蛭石组成的化学式为8MgO•Al2O3•Fe2O3•4SiO2.
故答案为:8MgO•Al2O3•Fe2O3•4SiO2.点评:
本题考点: 镁、铝的重要化合物;铁的氧化物和氢氧化物;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查Mg、Al、Fe、Si等元素化合物知识与物质的分离提纯的应用、物质的量计算等知识点,难度中等,理解工艺流程图是解题关键,是对知识的综合运用与对学生能力考查.1年前查看全部
大家在问
- 1I often do my homework in the evening.(对画线部分提问)in the evenin
- 2求分式方程和分式乘法答案,1.分别求下列各个分式当x=4,y=5时的值3x^2-xy/9x^2-6xy+y2x^2-4y
- 3已知三点A(3,-6,4),B(-5,2,3),C(16,x,y)共线,则x+y的值为多少?
- 4如图,在正方体ABCD-A1B1C1D1中,E、F分别为BC、CC1的中点,则异面直线AB1与EF所成的角的大小是___
- 5一个圆锥容器,容器内水的深度为圆锥高的一半,再注入70毫升水恰好该容器装满,现在容器内有多少毫升水?
- 6小学六年级试卷上的一道题经理给甲乙丙丁发奖金,甲得的是另外三人总数的一半,乙得的是另外三人的三分之一,丙得的是另外三人的
- 7世界上为什么会形成不同的语言?到底是由什么造成的?各种语言之间有没有共性?共同特点是什么?
- 85.23立方米=( )千米( )立方分米
- 9(2009•吴中区一模)为了解决垃圾的处理问题,不少城市建设了垃圾焚烧发电厂,以改善目前用填埋方式处理垃圾对环境产生的不
- 10填关联词 李老师( )严格要求我们,( )以身作则,事事都做我们的榜样.
- 11请帮我写10个did you开头的句子,
- 12楷书和行楷是两种常用的,写行楷字能帮助我们把字写得更灵活流畅,提高书写进度 这句话错在哪里?
- 13描写战争的诗句,并写出出处和作者!
- 14俯视的反义词是什么?
- 15如图所示,足够长的水平粗糙轨道与固定在水平面上的光滑弧形轨道在P点相切,质量为m的滑块B静止于P点;质量为2m的滑块A由
