VIA族元素 的氢化物中稳定性最好的元素是什么
 zlldmm2022-10-04 11:39:543条回答
zlldmm2022-10-04 11:39:543条回答
VIA族元素 的氢化物中稳定性最好的元素是什么
是氧么 怎么判断啊 同族的 非金属性减弱 那么 最开始的 吸引氢的能力强?
是氧么 怎么判断啊 同族的 非金属性减弱 那么 最开始的 吸引氢的能力强?

已提交,审核后显示!提交回复
共3条回复
 iloveyou冯飞 共回答了18个问题
iloveyou冯飞 共回答了18个问题 |采纳率88.9%- 是氧元素
同一主族元素,非金属性越强,吸引电子的能力也越强,和氢组成的化合物越稳定
氧和氢反应生成的水,其热稳定性仅次于氟化氢,在1200度的温度只有很少量分解,在2200度才会明显分解. - 1年前
 yadananny 共回答了290个问题
yadananny 共回答了290个问题 |采纳率- 是氧,非金属性越强,最低价氢化物越稳定
- 1年前
 始终如一 共回答了65个问题
始终如一 共回答了65个问题 |采纳率- 氧,半径小,键长小,所以键能大。
- 1年前
相关推荐
- 硒为第四周期VIA族元素,根据它在周期表中的位置推断,硒可能具有的性质为( ) A.单质硒在通常状况下是气体 B.Se
硒为第四周期VIA族元素,根据它在周期表中的位置推断,硒可能具有的性质为( ) A.单质硒在通常状况下是气体 B.SeO 3 的水化物呈碱性 C.H 2 Se比H 2 S稳定 D.硒元素有+4、+6、-2三种常见价态  笑到醉了1年前1
笑到醉了1年前1 -
 云飞浪卷 共回答了21个问题
云飞浪卷 共回答了21个问题 |采纳率90.5%A.氧族元素从上到下单质的熔沸点逐渐升高,S在常温下为固体,则Se为固体,故A错误;
B.SeO 3 为酸性氧化物,对应的水化物为H 2 SeO 4 ,溶液呈酸性,故B错误;
C.同主族元素从上到下元素的非金属性逐渐减弱,对应氢化物的稳定性逐渐减弱,则稳定性:H 2 Se<H 2 S,故C错误;
D.硒为第四周期VIA族元素,与S元素在周期表同一主族,常见化合价有+4、+6、-2三种常见价态,与S相似,故D正确.
故选D.1年前查看全部
- 硒为第四周期VIA族元素,根据它在周期表中的位置推断,硒可能具有的性质为( )
硒为第四周期VIA族元素,根据它在周期表中的位置推断,硒可能具有的性质为( )
A.单质硒在通常状况下是气体
B.SeO3的水化物呈碱性
C.H2Se比H2S稳定
D.硒元素有+4、+6、-2三种常见价态 jiqinghua1年前1
jiqinghua1年前1 -
 底特律之斌宝 共回答了15个问题
底特律之斌宝 共回答了15个问题 |采纳率80%解题思路:硒为第四周期VIA族元素,与O、S等元素在周期表同一主族,根据元素周期律的递变规律解答该题.A.氧族元素从上到下单质的熔沸点逐渐升高,S在常温下为固体,则Se为固体,故A错误;
B.SeO3为酸性氧化物,对应的水化物为H2SeO4,溶液呈酸性,故B错误;
C.同主族元素从上到下元素的非金属性逐渐减弱,对应氢化物的稳定性逐渐减弱,则稳定性:H2Se<H2S,故C错误;
D.硒为第四周期VIA族元素,与S元素在周期表同一主族,常见化合价有+4、+6、-2三种常见价态,与S相似,故D正确.
故选D.点评:
本题考点: 元素周期律和元素周期表的综合应用.
考点点评: 本题考查元素在周期表中的位置以及性质的递变规律,题目难度不大,注意同主族元素性质的相似性和递变性.1年前查看全部
- 下图中A、B、C、D四条曲线分别表示IVA、VA、VIA、VIIA族元素的气态氢化物的沸点,其中表示VIA族元素气态氢化
下图中A、B、C、D四条曲线分别表示IVA、VA、VIA、VIIA族元素的气态氢化物的沸点,其中表示VIA族元素气态氢化物沸点的是曲线
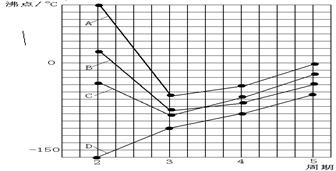
A.A B.B C.C D.D 排子沙1年前1
排子沙1年前1 -
 rouroubin 共回答了25个问题
rouroubin 共回答了25个问题 |采纳率92%A
1年前查看全部
- 有几类题我老拿不准1、关于通过一些实验现象比较两者的酸性,金属性啊,稳定性啊,有哪些是可以比较的?比如说VIA族的稳定性
有几类题我老拿不准
1、关于通过一些实验现象比较两者的酸性,金属性啊,稳定性啊,有哪些是可以比较的?比如说VIA族的稳定性是不是无法比较?我北京考生,我们经常会有一道选择题是考类似的,然后老拿不准.题老给表格,每行一个方程式,然后跟着结论.一般会问下列错误的是.我就想知道有哪些问题是可以通过哪些反应比较出来的?比如苯酚钠和醋酸,就可以比较苯酚醋酸酸性.这个问题要求总结的强一点
2、有的选择题给一个陌生的复杂的方程式,然后问氧化剂还原剂的啊,得失电子数啊,有时可能会给一个电化学方程式,这样的选择题我也老拿不准.首先,有的物质都是没见过的,比如一个反映物,有铜元素,有铁元素,有氧元素的,我根本不敢确定铜是+1还是+2,铁是+2还是+3,氧是-1还是-2.还有当有多个含同种元素的反应物反应是,根本不敢确定哪个物质的这个元素被还原或氧化的,所以问得失电子数就会觉得很蒙,即便我选出来了,我也觉得我是蒙的,比如铜很少有+1的,我就蒙+2,但我根本不知道为什么不是+1价,然后蒙的话一个是正确率低,一个是心里很不爽
3、还有一类是07年北京卷第26题的(3)问的是P在CL2中燃烧,其中一种产物的各原子最外层不全是8电子结构.这类题我总觉得挺蒙的.即使我写出来我也有一种蒙的感觉,心里很不塌实,影响做后面的.那题答案是PCL5,我就纳闷,为什么不是PCL3,当时即使我写的是PCL5,我也不塌实.我不知道是基础知识该背的没背,还是哪出问题了?像那类书写陌生氧化还原方程式的都还好,根据所说的电子数,酸缄性来书写配平,写完了还能检查看对不对, pzxing1年前1
pzxing1年前1 -
 lixin198225 共回答了16个问题
lixin198225 共回答了16个问题 |采纳率93.8%酸性强弱比较:同周期的从左到右元素氧化性增强,对应元素最高价氧化物对应的水化物酸性越强:H3PO4苯酚>碳酸氢根
化学价怎么判断:可以根据其他元素判断:H2O2氧是-1价,CU2O氧化亚铜,同时+1价,CH4甲烷里碳是+4价,不会根据其他元素,像O一般都是-2价,(除了过氧化物里面是-1价),铁:FeO里铁+2价,Fe2O3里铁是+3价,而Fe3O4实际上是FeO*Fe2O3,就是说一个铁原子是+2价,两个是+3价
判断原子几电子结构:首先先要认识到该原子最外层有几个电子,像P最外层有5个电子,再看共用电子的数目:若PCL3中P与3个CL公用电子对,那么周围应是5+3=8个电子,而PCL5中P与5个CL公用电子,那么周围有5+5=10个电子,不满足8电子稳定,而H一般2个电子稳定.1年前查看全部
- 已知硒(Se)是元素周期表中第四周期VIA族元素,关于硒的性质判断肯定不正确的是( ) A.硒的非金属性比硫强 B.硒
已知硒(Se)是元素周期表中第四周期VIA族元素,关于硒的性质判断肯定不正确的是( ) A.硒的非金属性比硫强 B.硒的最高价氧化物对应水化物的化学式是H 2 SeO 4 C.硒的氢化物的稳定性比硫化氢差 D.硒的常见化合价为-1、-2、+3、+4、+6  爱玫瑰-刺猬1年前1
爱玫瑰-刺猬1年前1 -
 ads521ok 共回答了13个问题
ads521ok 共回答了13个问题 |采纳率100%A.同主族元素,从上到下非金属性减弱,则硒的非金属性比硫弱,故A错误;
B.第VIA族元素的最高价为+6价,则硒的最高价氧化物对应水化物的化学式是H 2 SeO 4 ,故B正确;
C.同主族元素,从上到下非金属性减弱,则气态氢化物的稳定性减弱,所以硒的氢化物的稳定性比硫化氢差,故C正确;
D.第VIA族元素的最高价为+6价,最低价为-2价,还有+2、+4价,故D错误;
故选AD.1年前查看全部
- 为什么IIA族比IIIA族E值高,VA族比VIA族E值高?(设E是不同元素的气态原子失去最外层一个电子所需要的能量)
 zhuzhulong1年前2
zhuzhulong1年前2 -
 vv2007 共回答了17个问题
vv2007 共回答了17个问题 |采纳率100%第二主族价电子是ns2
第三主族价电子是ns2np1
第二主族最外层s轨道处于排满的状态,而第三主族最外层没有排满,所以IIA的E值高
同理
VA族价电子是ns2np3
VIA族价电子是ns2np4
VA族的p轨道处于半充满状态,所以比VIA族的E高
总之最外层电子处于全排满或半充满状态是,比较稳定,E比较大.
s轨道全充满时有两个电子
p轨道全充满时有6个电子,半充满是有3个电子1年前查看全部
- 元素周期表的规律R的气态氢化物的水溶液呈酸性,可能是VIA族或VIIA族元素,为什么,这是怎么推出来的?
 qunyan15011年前3
qunyan15011年前3 -
 阿弥陀佛53534 共回答了19个问题
阿弥陀佛53534 共回答了19个问题 |采纳率94.7%换句话说 VIA族或VIIA族元素的气态氢化物的水溶液呈酸性.你就记住好了1年前查看全部
大家在问
- 1一个三位数个位数字是b,百位数字是个位与十位数字之和,如何表示这个三位数?
- 2久经诀别的故乡的久经逝去的春天 怎样理解
- 3我们在黑暗中永远看不见光明 用英语怎么说
- 4将一块圆锥形蛋糕沿着高垂直于底面切成两半,表面积比原来增加了36平方厘米,测的圆锥形蛋糕
- 56个盒子里分别装着巧克力和糖果,其中有四盒糖果,2盒巧克力,盒里的块数分别是:4、8、10、16.
- 6将一块圆锥形糕点沿着高垂直于底面切成两半,表面积比原来增加了36平方厘米,测得圆
- 7《醉赠刘二十八使君》,诗中 二十八使君 ,是哪个朝代的人?
- 8若物体在运动过程中受到的合外力不为零,则() A物体的加速度一定为零 B物体的加速度方向一定变化
- 9物体所受合外力越大,加速度越大 这句话说得对不对?
- 101.如果函数y=-x+m^2与y=4x-1的图象交与x轴,则实数m的值等于()
- 11s王强参加数学竞赛的准考证是一个三位数,其中十位数字比百位数字的2倍少1,百位数字是个位数字的2\3,又知三
- 12这句话该怎么翻译:这篇文章基本没有引用任何数据,在隐私问题上的观点描述,都是基于作者本身的认识,未必能个客观的反映出大众
- 13The woman shouted in the shop with great anger,___her finger
- 14“全面”“完整”地概括高中常见的各种有颜色的化学试剂,化学物质的“具体颜色”!
- 15They enjoyed themselves in the zoo yesterday 同义句
