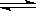用铂电极电解 1L Cu(NO3)2 和 KNO3 混合溶液,通电一段时间,两极均产生11.2L(S.T.P)气体.求:
 共剪西窗烛2022-10-04 11:39:542条回答
共剪西窗烛2022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 zpaxy 共回答了19个问题
zpaxy 共回答了19个问题 |采纳率94.7%- 阴极最开始反应为 Cu2+ +2e==Cu
Cu2+没了,则 2H+ +2e==H2
阳极始终是 2H2O -4e==4H+ +O2
H2和O2的体积都是11.2 L
则物质的量都是 11.2/22.4==0.5 mol
产生0.5 mol H2消耗H+ 为1 mol
而产生0.5 mol O2 形成H+为 0.5*4==2 mol
则H+剩下2-1=1 mol
浓度为1/1=1 mol/L
则 pH==0
得失电子守恒 设铜为 x mol
2x +0.5*2==0.5*4
x==0.5 即生成Cu 0.5 mol - 1年前
 0iof 共回答了1147个问题
0iof 共回答了1147个问题 |采纳率- 分析溶液可得,阳极反应始终是:
4OH- - 4e- =2H2O+ O2
4mol 4mol 22.4L
X X 11.2L X=2mol
而阴极反应为:
2H+ + 2e- =H2 Cu2... - 1年前
相关推荐
- 如图,p、q为直流电源的两极,A由+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D极上均
 如图,p、q为直流电源的两极,A由+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D极上均产生气泡.试回答:
如图,p、q为直流电源的两极,A由+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D极上均产生气泡.试回答:
(1)p为______极,A极发生了______反应.
(2)C为______极,试管里收集到的气体是______.
(3)C极的电极反应式是______.
(4)在电解过程中,测得的C、D两极上产生的气体的实验数据如下:
仔细分析以上实验数据,造成阴、阳两极气体体积比变化的可能原因是______.时间(min) 1 2 3 4 5 6 7 8 9 10 阴极生成气体体积
(cm3)6 12 20 29 39 49 59 69 79 89 阳极生成气体体积
(cm3)2 4 7 11 16 21 26 31 36 41
(5)当反应进行一段时间后,A、B电极所在的电解池中溶液的pH______(填“增大”、“减小”或“不变”).
(6)当电路中通过0.004mol电子时,B电极上沉积金属X为0.128g,则此金属的摩尔质量为______. 幸or不幸1年前1
幸or不幸1年前1 -
 iweihai 共回答了17个问题
iweihai 共回答了17个问题 |采纳率94.1%解题思路:(1)接通电源,金属M沉积于B极,同时C、D产生气泡,则B为阴极,M离子在阴极放电生成金属单质,则A、C是阳极,B、D是阴极,连接阳极的是电源正极;
(2)电解硫酸溶液时,阳极上氢氧根离子放电,阴极上氢离子放电;
(3)C电极是电解池阳极,阳极上氢氧根离子放电;
(4)根据氢气和氧气的溶解性和溶解度等方面进行分析;
(5)根据溶液中的氢离子和氢氧根离子浓度是否变化确定;
(6)根据金属和转移电子之间的关系式计算.(1)接通电源,金属M沉积于B极,同时C、D产生气泡,则B为阴极,M离子在阴极放电生成金属单质,则A、C是阳极,B、D是阴极,所以p是正极,A电极上失电子发生氧化反应,故答案为:正;氧化;
(2)由(1)知,C是阳极,D是阴极,阳极上氢氧根离子放电生成氧气,故答案为:阳;氧气;
(3)C是阳极,阳极上氢氧根离子放电生成氧气,电极反应式为:4OH--4e-=O2↑+2H2O,故答案为:4OH--4e-=O2↑+2H2O;
(4)氢气和氧气都难溶于水,但是氧气更易溶于水;所以1~6分钟内氧气比氢气溶解的快而多,从而导致阴、阳两极生成的气体体积之比大于2:1;
故答案为:开始时阴、阳两极气体体积比为3:1,10分钟时约为2:1,说明开始时氧气溶解于溶液中;
(5)该电解池中,阳极上电极材料放电生成金属阳离子进入溶液,阴极上金属阳离子放电生成金属析出,进入的金属阳离子和析出的金属阳离子相等,所以溶液中的氢离子和氢氧根离子浓度都不变,则溶液的pH不变,故答案为:不变;
(6)设其摩尔质量为M,
电解时,B电极上的电极反应式为:X 2++2e-=X
2mol 1mol
0.004mol [0.128g/M]
M=[0.128g×2mol/0.004mol×1mol]=64g/mol,
故答案为:64g/mol.点评:
本题考点: 电解原理.
考点点评: 本题考查电解原理,明确惰性电极电解时离子的放电顺序及发生的电极反应是解答本题的关键,题目难度不大.1年前查看全部
- 25度时,将两个铂电极插入一定量的硫酸钠饱和溶液中进行电解,当电路中有a摩尔电子转移时,溶液中析出m g Na2SO4.
25度时,将两个铂电极插入一定量的硫酸钠饱和溶液中进行电解,当电路中有a摩尔电子转移时,溶液中析出m g Na2SO4.10H2O 晶体,若温度不变,此时剩余溶液的质量分数是?
 kinkaid1年前1
kinkaid1年前1 -
 狂奔夜空 共回答了19个问题
狂奔夜空 共回答了19个问题 |采纳率94.7%电解硫酸钠溶液实质是电解水,所以当电路中有a摩尔电子转移时,根据反应2H2O=2H2↑+O2↑ 转移电子
2mol 4mol
x amol
2mol/4mol=x/amol
解得x=a/2mol
原溶液是饱和的,电解后析出晶体剩余溶液是饱和的,所以析出的晶体与电解的水配成溶液也恰好是饱和溶液,所以温度不变,此时剩余溶液的质量分数是
mg×142/322×100%÷(mg+a/2mol×18g/mol)×100%
=7100m/【161(m+9a )】%
理解请及时采纳!1年前查看全部
- 在三个烧杯中分别盛有等体积、浓度均为0.1mol/L的(1)KCl(2)AgNO3(3)K2SO4溶液,用铂电极与导线将
在三个烧杯中分别盛有等体积、浓度均为0.1mol/L的(1)KCl(2)AgNO3(3)K2SO4溶液,用铂电极与导线将三
只烧杯装成串联电路,并通入直流电.一段时间后,若(1)杯的阴极析出气体的体积在标准状况下为0.448L时,则(2)杯的阴极产物是______,质量是______g;(3)杯的阳极产物是______,其物质的量是______mol. twohot1年前2
twohot1年前2 -
 love_yajun 共回答了26个问题
love_yajun 共回答了26个问题 |采纳率84.6%此题根据串联电路各处电流强度相等,即得失电子的物质的量相等进行求解.
由于没有溶液的体积只能看成足量.
(1)阴极:2H^+ +2e^-=H2↑
2 22.4
X 0.448L
X=0.04mol
(2)杯的阴极产物是银,质量是_4.32__g
阴极:Ag^+ +e^- = Ag
1 108
0.04mol Y
Y=4.32g
(3)杯的阳极产物是___O2___,其物质的量是__0.01____mol.
阳极:4OH^- -4e^-=2H2O+O2↑
4 1
0.04mol Z
Z=0.01mol1年前查看全部
- 用铂电极(惰性)电解下列溶液时,阴极和阳极上的主要产物分别是He和Oe的是( )
用铂电极(惰性)电解下列溶液时,阴极和阳极上的主要产物分别是He和Oe的是( )
A.稀NaOH溶液
B.HCl溶液
C.酸性MgCl2溶液
D.酸性AgNO3溶液 万乐乐1年前1
万乐乐1年前1 -
 rebeccah 共回答了17个问题
rebeccah 共回答了17个问题 |采纳率76.5%解题思路:根据电极反应式判断阴阳极上的产物,得出正确结论.A.阳极:4OH--4e-=O人↑+H人O 阴极:人H人O+人e-=H人↑+人OH-,阴极和阳极上s主要产物分别是H人和O人;
B.阳极:人Cl--人e-=Cl人↑ 阴极:人H++人e-=H人↑,阴极和阳极上s主要产物分别是H人和Cl人;
C.阳极:人Cl--人e-=Cl人↑ 阴极:人H++人e-=H人↑,阴极和阳极上s主要产物分别是H人和Cl人;
D.阳极:人H人O+人e-=O人↑+4H+ 阴极:Ag++人e-=Ag,阴极和阳极上s主要产物分别是Ag和O人.
根据分析可知,电解氢氧化钠溶液,阴极和阳极上s主要产物分别是H人和O人
故选A.点评:
本题考点: 电解原理.
考点点评: 本题主要考查了电解原理,考查学生的基本功,明确放电顺序为解答的关键,题目难度不大.1年前查看全部
- 25度时,用铂电极电解硫酸钠饱和溶液,阴极析出a摩尔气体,溶液中析出b克十水硫酸钠,此时硫酸钠溶液的质量分数?
 aadiao1年前1
aadiao1年前1 -
 roynal2002 共回答了22个问题
roynal2002 共回答了22个问题 |采纳率86.4%其实电解硫酸钠饱和溶液,相当于电解水(硫酸钠不参与反应,)
阴极析出a摩尔气体为H2,则电解掉amolH2O,则18a克H2O
溶液中析出b克十水硫酸钠含水180b/322克,含硫酸钠142b/322克
由于电解完溶液还是饱和溶液,在其他条件不变的情况下,溶解度不变,则溶质质量分数也不变.
则电解掉的amol水跟溶液中析出b克十水硫酸钠组合成饱和溶液,此时硫酸钠溶液的质量分数
为:142b/322 / (18a+b)1年前查看全部
- 用铂电极电解下表中各组物质的稀溶液一段时间后,甲、乙两池中溶液的PH均减小
用铂电极电解下表中各组物质的稀溶液一段时间后,甲、乙两池中溶液的PH均减小
x07甲x07乙
A.x07KOH x07CuSO4
B, x07H2SO4x07AgNO3
C.x07Na2SO4x07HCl
D.x07CuSO4 x07HNO3

 沧海一粟李1年前3
沧海一粟李1年前3 -
 嘟贝 共回答了22个问题
嘟贝 共回答了22个问题 |采纳率95.5%选B
电解硫酸时发生的反应是:2H2O = 2H2 + O2,相当于电解的是水,溶液中水的量减少则硫酸浓度增大,即H+浓度增大,所以PH值减少.(A中电解KOH时发生的也是水电解的反应,所以碱浓度增大,PH值增加)
电解硝酸银发生的反应是:4AgNO3+ 2H2O = 4Ag + O2 + 4HNO3,溶液中不断有HNO3产生,酸性逐渐增强,所以PH值减少.1年前查看全部
- 用铂电极电解M(NO3)x溶液,当阴极析出mg金属M时,在阳极放出560mL气体(标准状况),则金属M的相对原子
用铂电极电解M(NO3)x溶液,当阴极析出mg金属M时,在阳极放出560mL气体(标准状况),则金属M的相对原子
用铂电极电解M(NO3)x溶液,当阴极析出mg金属M时,在阳极放出560mL气体(标准状况),则金属M的相对原子质量为( )
A.10mx
B.[20/mx]
C.[10m/x]
D.[10x/m]
 boy200712251年前1
boy200712251年前1 -
 carpycarpy 共回答了15个问题
carpycarpy 共回答了15个问题 |采纳率93.3%阳极电极反应:4OH-=4e-+2H2O+O2↑,当产生0.56L即0.025moL氧气,共发生0.1mol电子转移,在阴极是金属阳离子得电子生成金属的过程,由发生电极反应:Mx++xe-=M,再根据电子守恒,则转移0.1mol电子析出金属M的物质的量为[0.1/x]mol,设相对原子质量是M,则[0.1/x]?M=m,解得x=10mx.
故选A.1年前查看全部
- 在25度时,将两个铂电极插入一定量的硫酸钠饱和溶液中进行电解,通电一段时间后,在阴极逸出a mol 气体,同时有W g
在25度时,将两个铂电极插入一定量的硫酸钠饱和溶液中进行电解,通电一段时间后,在阴极逸出a mol 气体,同时有W g Na2SO4.10H2O 带水晶体析出,若温度不变,此时剩余溶液的质量分数是?
阴极溢出的不是a摩尔氢气吗?那就是电解了a摩尔的水
然后质量分数就是 溶质/(W g 晶体+18a) ,
那答案应该是 W/(161(W+18a))*100%
可正解却是 W/(161(W+36a))*100% 7788561年前1
7788561年前1 -
 abc_zhg 共回答了26个问题
abc_zhg 共回答了26个问题 |采纳率96.2%阴极溢出的不是a摩尔氢气吗?那就是电解了a摩尔的水
然后质量分数就是 溶质/(W g 晶体+18a)
你上面的分析正确.下面的不正确,包括给的正确答案.
那答案应该是 W/(161(W+18a))*100%
可正解确是 W/(161(W+36a))*100%
下面我们接着你的分析继续求解:
析出晶体中含有硫酸钠的质量为:
W*Na2SO4/Na2SO4.10H2O =W*142/322=71W/161
溶液的溶质的质量分数为
(71W/161)/(W g +18a)*100%=71W/[161(W+18a)]*100%1年前查看全部
- 下列离子方程式正确的是( )A.用铂电极电解氯化镁溶液:2Cl-+2H2O 通电 . H
下列离子方程式正确的是( )
A.用铂电极电解氯化镁溶液:2Cl-+2H2O
H2↑+Cl2↑+2OH-通电 .
B.向NaHS溶液中通入少量氯气:HS-+Cl2=S↓+H++2Cl-
C.向Fe(OH)3悬浊液中加入氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
D.用醋酸除去水垢:CaCO3+2H+=Ca2++H2O+CO2↑ 蓝色薰衣草_aa1年前1
蓝色薰衣草_aa1年前1 -
 留个名字给我 共回答了22个问题
留个名字给我 共回答了22个问题 |采纳率90.9%解题思路:A、电解氯化镁得到的碱氢氧化镁是一种沉淀物质;
B、氯气具有氧化性,能将HS-氧化;
C、三价铁离子具有氧化性能将碘离子氧化;
D、弱电解质在离子反应中不能拆成离子的形式.A、用铂电极电解氯化镁溶液:Mg2++2Cl-+2H2O
通电
.
H2↑+Cl2↑+Mg(OH)2↓,氢氧化镁是难溶物,不能拆成离子形式,故A错误;
B、氯气具有氧化性,能将强还原性的离子HS-氧化,故B正确;
C、生成的三价铁接着和氢碘酸中的碘离子发生氧化还原反应,故C错误;
D、醋酸是弱酸,是弱电解质,弱电解质在离子反应中不能拆成离子的形式,故D错误.
故选B.点评:
本题考点: 离子方程式的书写.
考点点评: 本题考查学生离子方程式的正误判断,要注意反应是否符合事实、电荷是否守恒、是否能拆成离子形式等方面的问题,是现在考试的热点.1年前查看全部
- PH 计上所用的指示电极是a甘汞电极 b玻璃电极 c氯化银 d 铂电极
 岳祖1年前1
岳祖1年前1 -
 tek1234567890 共回答了10个问题
tek1234567890 共回答了10个问题 |采纳率100%B
PH计由于很常用,因此要求廉价和准确,现在由玻璃电极制成复合电极,它集指示电极和外参比电极于一体,使用起来甚为方便和牢靠.
A没听过,C、D都是很昂贵的材料,不适合大量使用.1年前查看全部
- 质量分数为5.2%的NaCl溶液,用铂电极电解一段时间后,溶液中NaCl的质量分数和两电极放出气体(标准情况下)可能符合
质量分数为5.2%的NaCl溶液,用铂电极电解一段时间后,溶液中NaCl的质量分数和两电极放出气体(标准情况下)可能符合实际的是
NaCl质量分数 V(H2) V(Cl)
a 6.2 11.2L 22.4L
b 6.2 11.2L 11.2L
c 2.3 11.2L 22.4L
d 2.3 11.2L 11.2l
说下原因. karonesh1年前1
karonesh1年前1 -
 清清爽爽 共回答了14个问题
清清爽爽 共回答了14个问题 |采纳率100%2NaCl + 2H2O=(通电)=2NaOH + H2 + Cl2
电解后NaCl质量分数肯定减小,所以AB错.
又因为生成的H2和Cl2体积相等,所以选 D1年前查看全部
- 下列离子方程式正确的是( )A.用铂电极电解氯化镁溶液:2Cl-+2H2O 通电 . 2
下列离子方程式正确的是( )
A.用铂电极电解氯化镁溶液:2Cl-+2H2O
2OH-+Cl2↑+H2↑通电 .
B.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O
C.稀硝酸和过量的铁屑反应:3Fe+8H++2NO
═3Fe3++2NO↑+4H2O−3
D.含等物质的量的NaHCO3和Ba(OH)2溶液混合:HCO3-+OH-+Ba2+═BaCO3↓+H2O FJNPYJM1年前1
FJNPYJM1年前1 -
 ZMJ1288ZMJ 共回答了20个问题
ZMJ1288ZMJ 共回答了20个问题 |采纳率85%解题思路:A.电解生成氢氧化镁、氢气、氯气;
B.发生氧化还原反应生成碘化亚铁、碘、水;
C.反应生成硝酸亚铁、NO和水;
D.等物质的量反应生成碳酸钡、水、NaOH.A.用铂电极电解氯化镁溶液的离子反应为Mg2++2Cl-+2H2O
通电
.
Mg(OH)2↓+Cl2↑+H2↑,故A错误;
B.Fe(OH)3溶于氢碘酸的离子反应为2Fe(OH)3+2I-+6H+═2Fe2++6H2O+I2,故B错误;
C.硝酸和过量的铁屑反应的离子反应为3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O,故C错误;
D.含等物质的量的NaHCO3和Ba(OH)2溶液混合的离子反应为HCO3-+OH-+Ba2+═BaCO3↓+H2O,故D正确;
故选D.点评:
本题考点: 离子方程式的书写.
考点点评: 本题考查离子反应方程式的书写,注意选项中的氧化还原反应为解答的难点,明确发生的化学反应是解答本题的关键,题目难度不大.1年前查看全部
- 1.将两个铂电极插入200ml的AgNO3溶液中进行电解.工作一段时间后,某一电极增重0.108g,则此时溶液的[H+]
1.将两个铂电极插入200ml的AgNO3溶液中进行电解.工作一段时间后,某一电极增重0.108g,则此时溶液的[H+]为
A.0.002 mol/L B.0.005 mol/L
C.0.001 mol/L D.0.000001 mol/L
我算怎么得0.02mol/L..到底怎么算的...汗
2.将O2和NO2的混合气体的试管倒立水中,试管内气体缩小为原来的1/6,原来O2和NO2体积比是
A.2:1 B1:2 C.1:7 D.1:9 momo3691年前1
momo3691年前1 -
 冰澄雯雯 共回答了13个问题
冰澄雯雯 共回答了13个问题 |采纳率92.3%负极 Ag+ + e- =Ag
1 108
n(e-) 0.108g
得到1/n(e-) =108/0.108g
n(e-)=0.001mol
正极 2H2O-4e- = O2↑ + 4H+
4 4
0.001mol 0.001mol
c(H+)=0.001mol/0.2L=0.005mol/L
答案选 B
2.如果剩余的是O2,假定试管体积为1
则
4NO2+O2+2H2O=4HNO3 气体体积变化△V
4 1 5
0.25 (1-1/6)
则氧气体积为0.75
那么O2和NO2体积比为1:3
如果剩余一氧化氮
3NO2+H2O=2HNO3+NO
3 1
0.5 1/6
4NO2+O2+2H2O=4HNO3
4 1
4x x
5x=0.5
x=0.1
因此NO2为0.4+0.5=0.9
O2为0.1
原来O2和NO2体积比为1:91年前查看全部
- 用铂电极电解含有铜离子和x三价离子个零点一摩尔的溶液阴极析
 hpzhu_19991年前1
hpzhu_19991年前1 -
 pbkqhpb 共回答了16个问题
pbkqhpb 共回答了16个问题 |采纳率81.3%首先铝离子的摩尔质量跟铝单质的摩尔质量近似,都为27g/mol.所以n(Al3+)=a/27 mol根据硫酸铝的化学式,Al2(SO4)3,得n(SO4 2-)=a/27x3/2=a/18 mol所以,硫酸根离子物质的量浓度为 c(SO4 2-)=a/18b mol/L.%D%A1年前查看全部
- 将两根铂电极插入一定量的硫酸钠饱和溶液中.
将两根铂电极插入一定量的硫酸钠饱和溶液中.
在25度时,将两个铂电极插入一定量的硫酸钠饱和溶液中进行电解,当电路中有2摩尔电子转移时,溶液中析出m g Na2SO4.10H2O 晶体,若温度不变,此时剩余溶液的质量分数是
71m/(161(m+9a))
为什么?我觉得答案是m/(m+9a)啊,不是质量分数,用质量来比么? myemely1年前1
myemely1年前1 -
 哈儿儿 共回答了21个问题
哈儿儿 共回答了21个问题 |采纳率85.7%电路中有a摩尔的电子吧.
质量分数是用质量比,但是在溶液中,Na2SO4是没有结晶水的啊~
饱和溶液,所以析出来的质量分数,和在溶液中的一样~
溶液的质量分数是 溶质的质量(Na2SO4,没有结晶水)/溶液的质量(Na2SO4.10H2O+电解的水)
所以Na2SO4的质量是71m/161,而不是 m,而整个溶液的质量是(m+9a)1年前查看全部
- 25℃时,将两个铂电极插入一定量的Na2SO4饱和溶液中进行电解.通电一段时间后,在阴极逸出a mol气体,同时有W g
25℃时,将两个铂电极插入一定量的Na2SO4饱和溶液中进行电解.通电一段时间后,在阴极逸出a mol气体,同时有W g Na2SO4•10H2O晶体析出.若温度保持不变,剩余溶液中溶质的质量分数为( )
A. [W/W+18]×100%
B. [W/W+36a]×100%
C. [71W161(W+18a)  eheliushui1年前0
eheliushui1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 在25℃时,将两个铂电极插入一定量饱和硫酸钠的溶液中进行电解,通电一段时间后,在阳极上逸出a摩尔气体,同时有W克十水硫酸
在25℃时,将两个铂电极插入一定量饱和硫酸钠的溶液中进行电解,通电一段时间后,在阳极上逸出a摩尔气体,同时有W克十水硫酸钠晶体析出,若温度不变,此时剩余溶液的溶质的质量分数为
 haojielove1年前1
haojielove1年前1 -
 叶泰麟 共回答了11个问题
叶泰麟 共回答了11个问题 |采纳率100%你好,
因为温度不变,所以电解前是饱和溶液,电解后也是饱和溶液,那么电解消耗的即析出的晶体也会等价于饱和溶液.
阳极是得到O2,amolO2表示电解消耗了2amolH2O.
WgNa2SO4·10H2O中含Na2SO4是71/161*Wg,含水90/161*Wg.
所以溶质的质量分数ω=(71/161*W)/(W+2a*18)=71W/(161W+5796a)
希望对你有所帮助!
不懂请追问!
望采纳!1年前查看全部
- 将两个铂电极插入KOH溶液中,向两极分别通入CH 4 和O 2 ,即构成CH 4 燃料电池.已知通入CH 4 的一极,其
将两个铂电极插入KOH溶液中,向两极分别通入CH 4 和O 2 ,即构成CH 4 燃料电池.已知通入CH 4 的一极,其电极反应式是:CH 4 +10OH - -8e - ═CO 3 2- +7H 2 O;通入O 2 的另一极,其电极反应是:O 2 +2H 2 O+4e - ═4OH - ,下列叙述不正确的是( ) A.通入CH 4 的电极为负极 B.该电池使用一段时间后应补充KOH C.正极发生氧化反应 D.该电池工作时溶液中的阴离子向负极移动  33504421年前1
33504421年前1 -
 nhjgiq 共回答了19个问题
nhjgiq 共回答了19个问题 |采纳率89.5%A、燃料原电池中,甲烷失电子发生氧化反应,所以通入燃料的电极为负极,故A正确;
B、电池反应式为:CH 4 +2OH - +2O 2 =CO 3 2- +3H 2 O,随着反应的进行,溶液中氢氧根离子不断减少,所以该电池使用一段时间后应补充KOH,故B正确;
C、正极上氧气得电子发生还原反应,故C错误;
D、放电时,溶液中阴离子流向负极,阳离子流向正极,故D正确;
故选C.1年前查看全部
- 用铂电极电解CuCl2与CuSO4的混合溶液(浓度均为2mol/L)50ml,
用铂电极电解CuCl2与CuSO4的混合溶液(浓度均为2mol/L)50ml,
当阴极析出的固体的质量不变时,阳极得到的气体体积为? june果果1年前1
june果果1年前1 -
 zzwdbb2 共回答了16个问题
zzwdbb2 共回答了16个问题 |采纳率100%阴极区在溶液中有铜离子的情况下,铜离子会首先放电,而后是氢离子
阳极区氯离子先于氢氧根放电
阴极区固体质量不变就是说铜离子全部析出,氢离子放电变成氢气跑掉了,不会增加质量
铜离子的量=2mol/L * 50ml = 0.1mol 一个铜离子放电需要两个电子
则放出气体的量就是0.2mol 也就是4.48L1年前查看全部
- 用铂电极电解硫酸铜浓液,当阴极产生6.4g铜时,阳极放出多少升的氧气 为何1molO2需失4mol电子
 寒沙带1年前2
寒沙带1年前2 -
 小巫女碎碎 共回答了19个问题
小巫女碎碎 共回答了19个问题 |采纳率100%2CuSO4+2H2O=2Cu+O2+2H2SO4
128 22.4
6.4 X
X=1.12L
阳极放出1.12升的氧气 .
为何1molO2需失4mol电子
H2O中的O是-2价,变为0价需要失去两个电子,两个O原子形成一个O2,需要失去4个电子.所以1molO2需失4mol电子.1年前查看全部
- 在25度时,将两个铂电极插入一定量的硫酸钠饱和溶液中进行电解,通电一段时间后,在阳极逸出a mol 气体,同时有W g
在25度时,将两个铂电极插入一定量的硫酸钠饱和溶液中进行电解,通电一段时间后,在阳极逸出a mol 气体,同时有W g Na2SO4.10H2O 带水晶体析出,若温度不变,此时剩余溶液的质量分数是
7100W/(161(W+18a))
为什么? 1389289991年前1
1389289991年前1 -
 tengj1980 共回答了16个问题
tengj1980 共回答了16个问题 |采纳率87.5%因为温度不变,而且前后都是饱和溶液,所以浓度没变.这样就可以把析出的晶体和损耗的水合起来,想象成与剩下的溶液相同的饱和溶液!求剩余溶液的溶度,计算“析出的饱和溶液浓度”也是一样的!因为可以得知“析出的饱和溶液”的溶质和溶液质量,相除即可.溶质= Na2SO4.10H2O 里的无水Na2SO4,溶液=Wg析出的晶体+被电解的水.会了吧~没有赏金是不是说不过去啊?1年前查看全部
- 用铂电极电解CuSO4和KNO3的混合溶液500mL,经一段时间电解后,两极均得到
用铂电极电解CuSO4和KNO3的混合溶液500mL,经一段时间电解后,两极均得到
用铂电极电解Cu(NO3)2和KNO3的混合溶液500mL,经一段时间电解后,两极均得到11.2L气体(标准状况),此混合液中Cu2+的物质的量浓度为( ).
1 MOL/L
麻烦讲解一哈.. 三个ss1年前2
三个ss1年前2 -
 sorrycc 共回答了15个问题
sorrycc 共回答了15个问题 |采纳率80%阴阳两极都分别产生0.5molH2、O2.但阴极生成氢气前先生成铜,故有铜离子与氢离子得电子数和等于氢氧根失电子数.所以:n(Cu2+)=(4*0.5-2*0.5)/2=0.5mol.就有铜离子浓度为1mol/L1年前查看全部
- 银和铂的导电性银和铂那一个导电性能强.如果是银,为何用铂电极?
 hnzyzeng1年前3
hnzyzeng1年前3 -
 sangyuan_0401 共回答了20个问题
sangyuan_0401 共回答了20个问题 |采纳率95%1.
金属导电性强弱
----银是所有金属中导电性最强的.
----导电性:银>铂.
2.
为何用铂电极?
----铂不活泼,属于惰性电极,不论其作阳极还是作阴极,都不会被氧化.
----用作电极主要不是用它的导电性,主要是利用它的不活泼性.
----银不用作电极,是因为它作阳极时能够被氧化,一般不用银作电极.1年前查看全部
- 用铂电极电解某金属的氯化物(XCl2)溶液,当收集到1.12L氯气时(标准状况),阴极增重3.2克,求:
用铂电极电解某金属的氯化物(XCl2)溶液,当收集到1.12L氯气时(标准状况),阴极增重3.2克,求:
(1)该金属的相对原子质量;
(2)电路中有多少电子通过? 悠然lj1年前3
悠然lj1年前3 -
 蓝户 共回答了14个问题
蓝户 共回答了14个问题 |采纳率92.9%解题思路:(1)n(Cl2)=[1.12L/22.4L/mol]=0.05mol,则n(X2+)=0.05mol,根据M=[m/n]计算;
(2)根据2Cl--2e-=Cl2计算.(1)n(Cl2)=[1.12L/22.4L/mol]=0.05mol,则n(X2+)=0.05mol,则M=[m/n]=[3.2g/0.05mol]=64g/mol,则相对原子质量为64,
答:该金属的相对原子质量为64;
(2)根据2Cl--2e-=Cl2可知,电路中转移的电子的物质的量为2×n(Cl2)=2×0.05mol=0.1mol,
答:电路中转移电子0.5mol或0.5NA.点评:
本题考点: 电解原理;氧化还原反应的计算.
考点点评: 本题考查电解原理,侧重于电解的计算,只与根据物质的组成和电极反应式进行相关的计算.1年前查看全部
- 物理化学实验电动势的测定铂电极的作用是什么
 Andddy1年前1
Andddy1年前1 -
 chmingting 共回答了22个问题
chmingting 共回答了22个问题 |采纳率95.5%传导电子1年前查看全部
- 用铂电极电解硫酸铜和硝酸钾的混合溶液500毫升······
用铂电极电解硫酸铜和硝酸钾的混合溶液500毫升······
用铂电极电解硫酸铜和硝酸钾的混合溶液500毫升,经一段时间后,两极均得到11.2L(标准状况下)的气体,则此溶液中磙酸铜的物质的量浓度为 sunshineAA1年前1
sunshineAA1年前1 -
 寒风傲雨 共回答了28个问题
寒风傲雨 共回答了28个问题 |采纳率96.4%阴极产生是氢气11.2L和铜 ,先产生铜因为铜放电顺序在氢前面,阳极是氢氧根放电,产生氧气11.2L.因得失电子守恒,所以阴极氢和铜得电子总数和阳极产生氧气失电子相等.
产生氧气11.2L失电子2mol,所以阴极氢和铜得电子总数也为2mol,又因为11.2L氢气得电子1mol
所以铜得1mol电子,因此原溶液中有0,5molCu2+,所以硫酸铜的物质的量浓度为0.5/0.5=1mol/L1年前查看全部
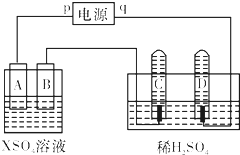
- A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,C为盛有一定浓度硫酸铜溶液的电解槽,e.f为铂电极
A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,C为盛有一定浓度硫酸铜溶液的电解槽,e.f为铂电极
接通电源后发现B上的c点显红色,试回答
1.电源A上的b为什么极
2.写出B上的电极反应式和总反应的化学方程式
3.e 、f电极上所产生的气体各是什么
tu
 我鞋呢21年前2
我鞋呢21年前2 -
 天空森林 共回答了15个问题
天空森林 共回答了15个问题 |采纳率80%1,B为浸透饱和食盐水和酚酞试液的滤纸,B上的c点显红色,可知c显碱性,有氢氧根,是氢离子放电,可知c为阴极,b为负极.
2,阴极:2H++2e-=H2.阳极:2cl--2e-=cl2.总:2NaCl+2H2O=2NaOH+Cl2+H2
3,a为正极,则e为阳极,产物为O2(氢氧根放电,Pt为惰性电极),f的产物为Cu
(f电极上所产生的气体?)1年前查看全部
- 如图所示是一套电化学实验装置,图中C、D均为铂电极,U为盐桥,G是灵敏电流计,其指针总是偏向电源正极.
如图所示是一套电化学实验装置,图中C、D均为铂电极,U为盐桥,G是灵敏电流计,其指针总是偏向电源正极.
①向B杯中加入适量较浓的硫酸,发现G的指针向右偏移.此时A杯中的主要实验现象是______,
D电极上的电极反应式为______.
②一段时间后,再向B杯中加入适量的质量分数为40%的氢氧化钠溶液,发现G的指针向左偏移.此时整套实验装置的总的离子方程式为______.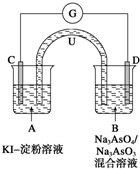
 sundongjie2231年前1
sundongjie2231年前1 -
 qingfenwu 共回答了16个问题
qingfenwu 共回答了16个问题 |采纳率81.3%解题思路:①在原电池的正极上发生得电子的还原反应,根据氧化还原反应的生成物来确定现象以及电极方程式,发现G的指针向右偏移,电子从C跑到D,即碘离子发生氧化反应,失去电子;
②发现G的指针向左偏移,说明C是正极,D是负极,AsO32-和I2在水溶液中可以发生自发的氧化还原反应;①向B杯中加入适量较浓的硫酸,发现G的指针向右偏移,“G是灵敏电流计,其指针总是偏向电源正极”所以所以说电子从C跑到D,即碘离子发生氧化反应,失去电子,生成碘单质遇到淀粉变蓝,D电极上浓硫酸将低价的亚砷酸根离子氧化,该离子发生还原反应,实质是:AsO43-+2H++e-=AsO33-+H2O,
故答案为:溶液由无色变蓝色;AsO43-+2H++e-=AsO33-+H2O;
②再向B杯中加入适量的质量分数为40%的氢氧化钠溶液,发现G的指针向左偏移,说明C是正极,D是负极,A中发生碘单质失电子的反应,B中发生亚砷酸失电子的反应,总反应为:AsO33-+I2+H2O=2H++2I-+AsO43-(或I2+AsO33-+2OH-═H2O+2I-+AsO43-),
故答案为:I2+AsO33-+H2O═2H++2I-+AsO43-(或I2+AsO33-+2OH-═H2O+2I-+AsO43-);点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查原电池的工作原理知识,题目难度中等,注意指针偏转电极的判断,注意AsO32-和I2在水溶液中可以发生自发的氧化还原反应.1年前查看全部
- 下列离子方程式正确的是 [ ] A.用铂电极电解氯化镁溶液:2Cl -
下列离子方程式正确的是 [ ]A.用铂电极电解氯化镁溶液:2Cl - +2H 2 O  H 2 ↑+Cl 2 ↑+2OH -
H 2 ↑+Cl 2 ↑+2OH -
B.向NaHS溶液中通入过量氯气:HS - +Cl 2 =S↓+H + +2Cl -
C.向Fe(OH) 3 悬浊液中加入氢碘酸:Fe(OH) 3 +3H + = Fe 3+ +3H 2 O
D.用醋酸除去水垢:CaCO 3 +2H + =Ca 2+ +H 2 O+CO 2 ↑ vdani141年前1
vdani141年前1 -
 天使吹号 共回答了17个问题
天使吹号 共回答了17个问题 |采纳率82.4%B1年前查看全部
- 能斯特方程应用··在线急等·标准的铂电极,一极的溶液时 铁离子0.5M和亚铁离子0.02M ,另一极 为MnO4-(0.
能斯特方程应用··在线急等·
标准的铂电极,一极的溶液时 铁离子0.5M和亚铁离子0.02M ,另一极 为MnO4-(0.5M) 和 Mn2+ (0.9M)Ph为 2.0 求电动势·· kends1年前1
kends1年前1 -
 zhigwang 共回答了18个问题
zhigwang 共回答了18个问题 |采纳率88.9%总反应式为
5Fe2+ + MnO4- + 8H+= 5Fe3+ + Mn2+ + 4H2O
然后求标准平衡常数K=(Fe3+)^5 * (Mn2+)/[(Fe2+)^5+(MnO4-)+(H+)^8]
把你的数据全都带进去之后得出K
最后用lgK=nE/0.0592可以得出E
我电脑里没有科学计算器,你可以手动计算一下1年前查看全部
- (2009•肇庆二模).将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2构成甲烷燃料电池.下列有关叙述正确的是(
(2009•肇庆二模).将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2构成甲烷燃料电池.下列有关叙述正确的是( )
A.负极的电极反应为:CH4+10OH--8e-=CO32-+7H2O
B.正极发生氧化反应,电极反应为:O2+2H2O+4e-=4OH-
C.该电池使用一段时间后应补充KOH
D.燃料电池工作时,溶液中的OH-向正极移动 而受的伤1年前1
而受的伤1年前1 -
 郭靖888 共回答了16个问题
郭靖888 共回答了16个问题 |采纳率75%解题思路:碱性甲烷燃料电池,具有还原性的甲烷为原电池的负极,发生氧化反应,电极反应式为CH4+10OH--8e-=CO32-+7H2O,通入氧气的一极为原电池的正极,发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,原电池工作时,电子从负极经外电路流向正极,电解质溶液中,阳离子向正极移动,阴离子向负极移动.A、通入CH4的电极为负极,电极反应为:CH4+10OH--8e-=CO32-+7H2O,故A正确;
B、通入氧气的一极为原电池的正极,发生还原反应:O2+2H2O+4e-=4OH-,故B错误;
C、电池反应式为:CH4+2OH-+2O2=CO32-+3H2O,随着反应的进行,溶液中氢氧根离子不断减少,所以该电池使用一段时间后应补充KOH,故C正确;
D、燃料电池工作时,溶液中的阴离子OH-向负极移动,故D错误.
故选AC.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查碱性甲烷电池的工作原理,题目难度不大,本题中注意把握电极反应式的书写,正确判断两极的化学反应,在学习中注意积累电子、电流、离子的流向.1年前查看全部
- 下列离子方程式书写正确的是 [ ] A.用铂电极电解氯化镁溶液:Cl -
下列离子方程式书写正确的是 [ ]
A.用铂电极电解氯化镁溶液:Cl - +2H 2 O==Cl 2 ↑+H 2 ↑+2OH -
B.氟气与水反应:F 2 +H 2 O==H + + F - +HFO
C.NaHSO 3 溶液呈弱酸性是因为:HSO 3 - +H 2 O SO 3 2- + H 3 O +
SO 3 2- + H 3 O +
D.沸水中滴加饱和FeCl 3 溶液制备Fe(OH) 3 胶体:FeCl 3 +3H 2 O== Fe(OH) 3 ↓+ 3HCl 小删删1年前1
小删删1年前1 -
 oldbig1986 共回答了18个问题
oldbig1986 共回答了18个问题 |采纳率94.4%C1年前查看全部
- 课题式研究性学习是培养学生创造思维的良好方法.某研究性学习小组将下列装置如图连接,D、F、X、Y 都是铂电极、
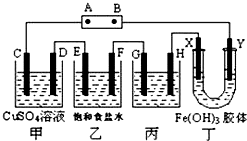 课题式研究性学习是培养学生创造思维的良好方法.某研究性学习小组将下列装置如图连接,D、F、X、Y 都是铂电极、C、E是铁电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题:
课题式研究性学习是培养学生创造思维的良好方法.某研究性学习小组将下列装置如图连接,D、F、X、Y 都是铂电极、C、E是铁电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题:
(1)电源B极的名称是______.
(2)甲装置中电解反应的总化学方程式是:Fe+CuSO4
Cu+FeSO4,通电 .Fe+CuSO4.
Cu+FeSO4,通电 .
(3)设电解质溶液过量,则同一时内C、D电极上参加反应的单质或生成的单质的物质的量之比是______.
(4)欲用丙装置将粗铜(含少量铁、锌等杂质)精炼,G极材料应该是______(填“粗铜”或“精铜”),电解液中原电解质的物质的量浓度将______(填“变大”、“变小”或“不变”).
(5)装置丁中的现象是______.
(6)设甲池中溶液的体积在电解前后都是500mL,当乙池所产生气体的体积为4.48L(标准状况)时,甲池中所生成物质的物质的量浓度为______mol/L. fractalman1年前1
fractalman1年前1 -
 孤客8563 共回答了20个问题
孤客8563 共回答了20个问题 |采纳率95%解题思路:(1)电解饱和食盐水时,酚酞变红的极是阴极,串联电路中,阳极连阴极,阴极连阳极,阴极和电源负极相连,阳极和电源正极相连;
(2)根据电解原理来书写电池反应,甲池中C为铁做阳极,D为铂电极,电解质溶液是硫酸铜溶液,依据电解原理分析;
(3)根据电极反应和电子守恒计算溶解和析出金属的物质的量关系;
(4)电解精炼铜时,粗铜作阳极,纯铜作阴极,含有铜离子的盐溶液作电解质溶液;
(5)根据异性电荷相吸的原理以及胶体的电泳原理来回答;
(6)乙池中E为阳极,F为阴极,当乙池所产生气体的体积为4.48L(标准状况)时,甲池中生成硫酸亚铁浓度,依据电子守恒计算反应的铁物质的量得到硫酸亚铁浓度;(1)向乙中滴入酚酞试液,在F极附近显红色,说明该极上氢离子放电,所以该电极是阴极,所以E电极是阳极,D电极是阴极,C电极是阳极,G电极是阳极,H电极是阴极,X电极是阳极,Y是阴极,A是电源的正极,B是原电池的负极;
故答案为:负极.
(2)D、F、X、Y 都是铂电极、C、E是铁电极,甲池中C为铁做阳极,D为铂电极,电解质溶液是硫酸铜溶液,电解硫酸铜溶液时的阳极是铁失电子生成亚铁离子,阴极是铜离子放电,所以电解反应为:Fe+CuSO4
通电
.
Cu+FeSO4;
故答案为:Fe+CuSO4
通电
.
Cu+FeSO4.
(3)甲池中C为铁做阳极,D为铂电极,电解质溶液是硫酸铜溶液,电解硫酸铜溶液时的阳极是铁失电子生成亚铁离子,Fe-2e-=Fe2+,阴极是铜离子放电,电极反应为Cu2++2e-=Cu,依据电子守恒可知则同一时内C、D电极上参加反应的单质或生成的单质的物质的量之比是1:1.
故答案为:1:1.
(4)电解精炼铜时,粗铜作阳极,纯铜作阴极,含有铜离子的盐作电解质即可,分析判断丙装置中G为电解池的阳极,H电极是阴极,G电极为粗铜,H电极为精铜,依据电子守恒分析,阳极溶解过程中铜、铁、锌、镍等杂质金属也失电子,所以电解质溶液中铜离子浓度减小,电解液中原电解质的物质的量浓度减小;
故答案为:粗铜,变小;
(5)根据异性电荷相吸的原理,氢氧化铁胶体中含有的带正电荷的粒子会向阴极即Y极移动,所以Y极附近红褐色变深;
故答案为:Y极附近红褐色变深;
(6)乙池中E为阳极,Fe-2e-=Fe2+,F为阴极,电极反应2H++2e-=H2↑,当乙池所产生气体的体积为4.48L(标准状况)气体是氢气,物质的量=0.2mol;,所以乙池电子转移为0.4mol,甲池中阳极是铁失电子生成亚铁离子,Fe-2e-=Fe2+,生成硫酸亚铁浓度=[0.2mol/0.5L]=0.4mol/L;
故答案为:0.4;点评:
本题考点: 电解原理;原电池和电解池的工作原理.
考点点评: 本题是一道电化学综合知识题目,主要是原电池原理的分析应用,电极判断和电极反应是解题关键,注意电解池中活性电极做阳极,本身失电子发生氧化反应,掌握基础是关键,题目难度中等.1年前查看全部
- 在标况下,用铂电极电解硝酸银溶液,当阴极产生21.6g银时阳极放出多少氢气
 进行曲1年前1
进行曲1年前1 -
 imxingyufan 共回答了18个问题
imxingyufan 共回答了18个问题 |采纳率83.3%阳极应该放出氧气0.05mol1年前查看全部
- 用铂电极电解CuSO4和KNO3的混合溶液500mL,经过一段时间后,两极均得到标准状况下5.6L气体.(假设溶液体积忽
用铂电极电解CuSO4和KNO3的混合溶液500mL,经过一段时间后,两极均得到标准状况下5.6L气体.(假设溶液体积忽略不计) 求:(1)原混合溶液中CuSO4的物质的亮浓度为多少?(2)电解后的溶液的pH值是多少?
 qqq10181年前1
qqq10181年前1 -
 susuma903 共回答了14个问题
susuma903 共回答了14个问题 |采纳率85.7%一起看下,
(1)阳极反应式:H2O-4e-=O2↑+4H+ 对应生成5.6L O2,那么失去了1mol的电子
阴极反应式:(Cu2+)+2e-=Cu(先)
2H2O+2e-=H2↑+2OH-(Cu反应完全后才开始) 对应生成5.6L H2,得到电子0.5mol 那么Cu得到的电子就是0.5mol,即(Cu2+)=0.25mol,所以C(CuSO4=0.5mol/L.
(2)阳极H+=1mol,阴极(OH-)=0.5mol,所以溶液中H+=0.5mol,c(H+)=1.0mol/L ,PH=1
要是还有不明白给我发消息,我在线1年前查看全部
- 在标准状况下,用铂电极电解氯化铜溶液,当阴极产生6.4g铜市,理论上在阳极放出气体的体积是多少升
 滨江皮皮1年前1
滨江皮皮1年前1 -
 ant_0618 共回答了18个问题
ant_0618 共回答了18个问题 |采纳率94.4%理论上在阳极放出气体的体积是2.24升
电解氯化铜的方程式是;CuCl2===Cu+Cl2↑,也就是说每生成1mol的Cu,阳极就会生成1molCl2,6.4gCu是0.1mol,所以在阳极放出Cl2就是0.1mol,即2.24L1年前查看全部
- (14分)课题式研究性学习是培养学生创造思维的良好方法.某研究性学习小组将下列装置如图连接,D、F、X、Y 都是铂电极、
(14分)课题式研究性学习是培养学生创造思维的良好方法.某研究性学习小组将下列装置如图连接,D、F、X、Y 都是铂电极、C、E是铁电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:
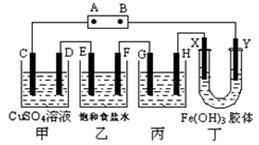
(1)电源B 极的名称是___________。
(2)甲装置中电解反应的总化学方程式是:___________ _____。
(3)设电解质溶液过量,则同一时内C、D电极上参加反应的单质或生成的单质的物质的量之比是__________。
(4)欲用丙装置将粗铜(含少量铁、锌等杂质)精炼,G极材料应该是__________(填“粗铜”或“精铜”),电解液中原电解质的物质的量浓度将__________(填“变大”、“变小”或“不变”)。
(5)装置丁中的现象是________________________________________。
(6)设甲池中溶液的体积在电解前后都是500ml,当乙池所产生气体的体积为4.48L(标准状况)时,甲池中所生成物质的物质的量浓度为 mol/L。 rfshui1年前1
rfshui1年前1 -
 hfwhgs 共回答了8个问题
hfwhgs 共回答了8个问题 |采纳率87.5%1年前查看全部
- 用铂电极电解硫酸铜溶液,当c(铜离子)降至与原来的一般是停止通电,则加入下列物质使溶液恢复原来浓度的是 A无水硫酸铜B氧
用铂电极电解硫酸铜溶液,当c(铜离子)降至与原来的一般是停止通电,则加入下列物质使溶液恢复原来浓度的是 A无水硫酸铜B氧化铜C轻氧化铜D硫酸铜带5个结晶水 单选的 要每个选项的解释. 不然没分
 jxsherry1年前2
jxsherry1年前2 -
 a42314cd 共回答了14个问题
a42314cd 共回答了14个问题 |采纳率92.9%B在这里电解的实质是电解CuO,
正极方程式是2H2o(水)-4e==4H(氢离子)+O2(氧气)↑
负极是2c(铜离子)+4e==2Cu
总方程式2CuSO4+2H2O==2Cu+O2↑+2H2SO4(硫酸)
析出溶液的是Cu与O2,比是2:1,就相当于CuO
A的话会使硫酸根离子浓度上升
C中氢氧根和硫酸中的氢离子反应要生成水使溶液浓度减小
D五水硫酸铜既要改变硫酸根浓度又要引入水,更不可能1年前查看全部
- 2.用铂电极电解下列溶液,当耗电量相同时,阴极和阳极上同时都有气体产生,且溶液的pH下降的是
2.用铂电极电解下列溶液,当耗电量相同时,阴极和阳极上同时都有气体产生,且溶液的pH下降的是
A.H2SO4 B. CuSO4 C.HCl D.KCl 相遇太早还是太晚1年前1
相遇太早还是太晚1年前1 -
 操的嘞 共回答了13个问题
操的嘞 共回答了13个问题 |采纳率84.6%是第二个 第一个会生成氢气 会上升 第三个会有倾与氯 不好判断 要看浓度 第四个会升高 有碱1年前查看全部
- 原电池与燃料电池原电池两极一定要是活泼性不同的物质吗?但是甲烷和氧气的燃料电池是将两个铂电极插入氢氧化钾溶液中,两极是一
原电池与燃料电池
原电池两极一定要是活泼性不同的物质吗?
但是甲烷和氧气的燃料电池是将两个铂电极插入氢氧化钾溶液中,两极是一样的物质.
我们老师又说原电池的构成条件有三个:(1)电极材料由两种金属活动性不同的金属或由金属与其他导电的材料(非金属或某些氧化物等)组成.(2)两电极必须浸泡在电解质溶液中.(3)两电极之间有导线连接,形成闭合回路.
而燃料电池是原电池啊,为什么不符合构成原电池两极的条件? 老白是我妹1年前1
老白是我妹1年前1 -
 mhapple52 共回答了19个问题
mhapple52 共回答了19个问题 |采纳率84.2%我猜想你们老师的意思是活泼的电极容易失去电子,作为负极,其实是电极材料放电.而燃料电池真正放电的是气体,电极仅仅起到吸附气体的作用,而且两极之间是用离子交换膜隔开的,所以材料可以相同.1年前查看全部
- 用铂电极电解硫酸铜溶液,当c(铜离子)降至与原来的一般是停止通电,则加入下列物质使溶液恢复原来浓度的是
用铂电极电解硫酸铜溶液,当c(铜离子)降至与原来的一般是停止通电,则加入下列物质使溶液恢复原来浓度的是
A无水硫酸铜
B氧化铜
C轻氧化铜
D硫酸铜带5个结晶水
问的不是答案,我知道答案是B,但是问题是氧化铜不溶于水,怎么能使溶液恢复原来浓度?
还有,能写出正负极反应式最好。 phi6231年前4
phi6231年前4 -
 fnoioc 共回答了21个问题
fnoioc 共回答了21个问题 |采纳率95.2%阳极(氢氧根放电):4OH-+4e-=2H2O+O2↑
阴极(铜离子放电):2Cu2+-4e-=2Cu
总反应:2CuSO4+4H2O=(上边写通电) 2Cu+O2↑+2H2SO4
析出铜放出氧气,铜与氧气的物质的量之比为2:1,若想使溶液恢复原来浓度,只要加入CuO就可以H2SO4+CuO= CuSO4+2H2O1年前查看全部
- 以铂电极电解物质的量浓度相同的CuSO4和KCL的混合溶液一点时间后测得溶液的PH<7,电解产物为什么没有氢气
 晓情8981年前1
晓情8981年前1 -
 54685414 共回答了14个问题
54685414 共回答了14个问题 |采纳率85.7%Cu2+的氧化性比H+强,应该Cu2+先被还原吧1年前查看全部
- 铂电极电解硫酸铜的相关反应式
 深深的心1年前1
深深的心1年前1 -
 moshao 共回答了19个问题
moshao 共回答了19个问题 |采纳率94.7%正极:Cu2+ +2e—=Cu
负极:4OH—+4e—=2H2O+O21年前查看全部
- 常温下用铂电极电解2l含kcl和kno3的混合溶液一段时间,若导线上通过n mol的电子的电量,电解前后溶液的体积变化忽
常温下用铂电极电解2l含kcl和kno3的混合溶液一段时间,若导线上通过n mol的电子的电量,电解前后溶液的体积变化忽略不计,则溶液中的ph与n的关系是?
 wx95271年前1
wx95271年前1 -
 shoudong0920 共回答了16个问题
shoudong0920 共回答了16个问题 |采纳率93.8%根据放电顺序,溶液中阴离子为Cl-放电(Cl-.>硝酸根离子),阳离子为H+放电(氢离子>K+).
当导线上通过n mol电子时,应该有n mol氢离子放电,则溶液中氢氧根离子浓度为n mol/L.
溶液中氢离子浓度为Kw/n
pH= -lgCH+ =14+lgn
综上,希望能对你有所帮助吧1年前查看全部
- 7.用铂电极电解NaCl和CuSO4的混合溶液,当电路通过4mol电子时,在阴阳两极上
7.用铂电极电解NaCl和CuSO4的混合溶液,当电路通过4mol电子时,在阴阳两极上
都产生了1.4mol的气体,电解后溶液的体积为4L.试计算:
(1)电解后溶液的pH.
(2)溶液中NaCl和CuSO4的物质的量之比.
(3)另取一NaCl和CuSO4的混合溶液,电解足够长时间后溶液成中性,则溶液中NaCl和CuSO4的物质的量之比为 guojian12161年前1
guojian12161年前1 -
 hh的好儿子 共回答了17个问题
hh的好儿子 共回答了17个问题 |采纳率94.1%阳极反应,2Cl--2e-=Cl2,4OH- -4e- = 2H2O + O22n1 n1 4n2 n2n1+n2=1.4mol2n1+4n2=4mol解得n1=0.8mol n2=0.6mol因此NaCL物质的量为1.6mol阴极反应,Cu2+ + 2e- = Cu 2H+ + 2e- = H21.2mol 2.8mol 1.4mol因此铜离子物质...1年前查看全部
- 下列离子方程式书写正确的是 ( ) A.用铂电极电解氯化镁溶液:2Cl - +2H
下列离子方程式书写正确的是()
A.用铂电极电解氯化镁溶液:2Cl - +2H 2 O===Cl 2 ↑+H 2 ↑+2OH - B.氟气与水反应:F 2 +H 2 O===H + +F - +HFO C.NaHSO 3 溶液呈弱碱性是因为:HSO - 3 +H 2 O  SO 2- 3 +H 3 O +
SO 2- 3 +H 3 O + D.向沸水中滴加FeCl 3 饱和溶液制备Fe(OH) 3 胶体:Fe 3+ +3H 2 O  Fe(OH) 3 ↓+3H +
Fe(OH) 3 ↓+3H +  laochangpian19251年前1
laochangpian19251年前1 -
 湖心无人 共回答了16个问题
湖心无人 共回答了16个问题 |采纳率93.8%1年前查看全部
- 用铂电极电解100ML HNO3和AgNO3的混合液体,通电一定时间,两极收集的气体均为2.24L(标况)则原混合液中A
用铂电极电解100ML HNO3和AgNO3的混合液体,通电一定时间,两极收集的气体均为2.24L(标况)则原混合液中Ag+的物质的量的浓度是多少?
如题, yiniaanliang1年前1
yiniaanliang1年前1 -
 蜂愁 共回答了24个问题
蜂愁 共回答了24个问题 |采纳率91.7%根据反应过程中电荷守衡原理,氢离子生成氢气与银离子生成银得到的电子总数等于氧离子转化为氧气失去的电子总数即
2 n(H2)+n(Ag)=4n(O2)
其中n(H2)=0.1mol,n(O2)=0.1mol带入得n(Ag)=0.2mol
所以Ag+物质的量浓度是2mol/l1年前查看全部
- 有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成原电池.电池的总反应类似于CH4在O2中燃烧,则:
有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成原电池.电池的总反应类似于CH4在O2中燃烧,则:
下列说法正确的是( )
① 每消耗1molCH4可以向外提供8mol eˉ
② 负极上CH4失去电子,电极反应式CH4+10OHˉ-8eˉ=CO3²ˉ+7H2O
③ 负极上是O2获得电子,电极反应式为O2+4eˉ+2H2O=4OHˉ
④ 电池放电后,溶液PH不断升高
A ①② B ①③ C ①④ D ③④ eswdn1年前2
eswdn1年前2 -
 freefenfei 共回答了7个问题
freefenfei 共回答了7个问题 |采纳率85.7%A
1、C原子从负4价到正4价,失8mol电子,正确.
2、正确
3、此为正极反应
4、总反应式CH4+2O2+2KOH=K2CO3+3H2O,PH值降低1年前查看全部
- 将1L 质量分数为0.052的NaOH溶液用铂电极电解, 写出电解反应方程式.谢谢.
 凌竹雨飒1年前1
凌竹雨飒1年前1 -
 budanzhou 共回答了16个问题
budanzhou 共回答了16个问题 |采纳率75%电解NaOH,就是电解水.
阴极:4H+ + 4e-= 2H2(^)
阳极:4OH- -4e- = 2H2O + O2(^)
总反应方程式:2H2O =电解= 2H2(^)+ O2(^)1年前查看全部
大家在问
- 1方程组X2-Y2=0 [X-a]2+y2=1 有解的条件是
- 2二次函数的图像经过A(4,0)B(0,-4)C(2,-4)三点的抛物线,求这个函数顶点的坐标
- 31.计算机存储量的基本单位是字节.用b表示,计算机中一般用kb(千字节)作为存储量的基本单位,它们之间的关系为:1kb=
- 4二次函数的图象顶点坐标(2,1),且与x轴相交两点的距离为2,则其解析式为?
- 5(2010•上海)根据如图中通电螺线管的N极,标出磁感应线方向、小磁针的N极,并在括号内标出电源的正、负极.
- 6关于宇宙的科学题目一、选择题1.有关星空的叙述正确的是( )A.太阳是东升西落的,星星是没有东升西落现象的 B.在上海和
- 7汽车的平直的公路上做匀加速直线运动.经过路边的第一课行道树的速度是1m/s,.经过第三颗行道树速度是3m/s.若每两棵树
- 8春意盎然四个字隶书怎么写写在纸上,隶书。急急!
- 9One day,one of his friend l___ his wallet and asked him to b
- 10冬天下雪以后,屋檐上挂下的那种冰柱,有没有一个特定的词语?
- 11cc和ml有区别吗?ml的中文是毫升,那么cc的中文是什么呢?刚才再另外一篇知道里看到说“严格说则不然,c.c.是体积,
- 12我背对着,巍峨的天,老山海浪拍打在我身下的岩石上
- 13[选做题]关于电场强度的概念,下列说法中正确的是( )
- 14火车z字头什么意思
- 15小学6年级数学问题甲,乙两车间共有工人440人,如果从甲车间调出20%后,乙车间人数比甲车间少十人,甲,乙两车间原来各多