1mol溴化镁中含2mol溴镁键,这句话对吗
 zhanglidety2022-10-04 11:39:541条回答
zhanglidety2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 原路返回 共回答了17个问题
原路返回 共回答了17个问题 |采纳率88.2%- 错
溴化镁是离子化合物,由阴阳离子(Mg2+、Br-)构成,不存在共价键.
电离方程式:MgBr2 =Mg2+ + 2Br-
1mol溴化镁中含1molMg2+、2molBr-
希望能帮到您 - 1年前
相关推荐
- 海洋是人类的母亲.浩瀚的海洋不仅繁衍着无数水生生物,还蕴藏着丰富的化学资源,如氯化钠、氯化钙、氯化镁、溴化镁等大量的无机
海洋是人类的母亲.浩瀚的海洋不仅繁衍着无数水生生物,还蕴藏着丰富的化学资源,如氯化钠、氯化钙、氯化镁、溴化镁等大量的无机盐.
(1)请设计两种鉴别海水和蒸馏水的方法(物理方法和化学方法,只需说明原理).
物理方法:______;
化学方法:______.
(2)海水“晒盐”得到的粗盐中含有少量的泥沙等不溶性杂质,可采取下列步骤除去.请在括号内填上相应的操作步骤.( 溶解 )→( 过滤 )→______.
(3)以海水和石灰乳为原料制取金属镁的生产流程为:请你分别写出生成氢氧化镁和镁的化学反应方程式:
(1)生成氢氧化镁:______;
(2)生 成 镁:MgCl2
Mg+Cl2↑通电 .MgCl2.
Mg+Cl2↑通电 .
 UFDFJ1年前1
UFDFJ1年前1 -
 雪山飛糊 共回答了19个问题
雪山飛糊 共回答了19个问题 |采纳率78.9%解题思路:欲正确解答本题,须知海水与蒸馏水的区别,以及粗盐提纯的方法.海水中的镁主要存在于氯化镁中,首先要把镁离子沉淀出来,然后制成纯净的氯化镁溶液,最后电解氯化镁可得到金属镁.根据发生的反应原理和质量守恒定律完成相应化学方程式.(1)蒸馏水中没有杂质,而海水中含有氯化钠、氯化钙、氯化镁、溴化镁等大量的无机盐;所以鉴别海水和蒸馏水的方法:
物理方法:将液体加热蒸发,有固体析出的是海水,无固体析出的是蒸馏水.化学方法:分别加入氢氧化钠溶液,有沉淀产生的是海水,无沉淀产生的是蒸馏水.
(2)所得的粗盐中含有不溶性杂质,可采取下列步骤除去:先把粗盐溶解,再用过滤的方法滤去杂质,然后蒸干水分,得到纯净的NaCl.
(3)海水中的氯化镁能和碱溶液反应生成氢氧化镁沉淀,化学方程式为:MgCl2+Ca(OH)2=CaCl2+Mg(OH)2↓;从海水中过滤分离出沉淀,氢氧化镁能溶于稀盐酸,制得纯净的氯化镁溶液,化学方程式为:Mg(OH)2+2HCl=MgCl2+2H2O;然后电解氯化镁,便能得到金属镁,化学方程式为:MgCl2
通电
.
Mg+Cl2↑.
故答案为:(1)将液体加热蒸发,有固体析出的是海水,无固体析出的是蒸馏水;分别加入氢氧化钠溶液,有沉淀产生的是海水,无沉淀产生的是蒸馏水;
(2)蒸发结晶;
(3)MgCl2+Ca(OH)2=CaCl2+Mg(OH)2↓;MgCl2
通电
.
Mg+Cl2↑.点评:
本题考点: 对海洋资源的合理开发与利用;氯化钠与粗盐提纯;书写化学方程式、文字表达式、电离方程式.
考点点评: 题主要考查学生对海水与蒸馏水性质的认识.以及对粗盐提纯的实验操作的熟悉沉淀.1年前查看全部
- 向氯化钠,溴化镁,碘化钾的混合溶液中通入一定量氯气,若溶液中含溴,则一定不会有碘离子.有两种解释:
向氯化钠,溴化镁,碘化钾的混合溶液中通入一定量氯气,若溶液中含溴,则一定不会有碘离子.有两种解释:
1由于I-的还原性比Br-强即cl2先和I-反应完才和Br-反应,既然存在单质溴了,那么I-一定已经反应完了,所以溶液中一定不存在I-.
2溴单质可以置换出碘化钾中的碘
所以有溴单质就不会又碘离子
哪种对? 一条没有泪的鱼1年前2
一条没有泪的鱼1年前2 -
 meiguimiren 共回答了26个问题
meiguimiren 共回答了26个问题 |采纳率80.8%1对.
因为氧化剂与多种还原剂反应时,氧化剂先氧化还原性强的,只有还原性强的被完全氧化后,氧化剂才能氧化还原性弱的.
由于氯气是氧化剂,碘离子和溴离子是还原剂,I^-还原性>Br^-,所以氯气先氧化I^-,当I^-完全氧化后,才能氧化Br^-,所以1对.1年前查看全部
- 浩瀚的海洋不仅繁衍着无数生生物,还蕴藏着丰富的化学资源,如氯化钠、氯化镁、溴化镁等大量的无机盐.
浩瀚的海洋不仅繁衍着无数生生物,还蕴藏着丰富的化学资源,如氯化钠、氯化镁、溴化镁等大量的无机盐.
(1)请设计两种鉴别海水和蒸馏水的方法(只需说明原理)
方法一:______.
方法二:______.
(2)由此所得的粗盐中含有不溶性杂质,可采取下列步骤除去.请在括号内填上相应的操作步骤.
( ______)→( ______)→蒸发结晶 xazx20081年前1
xazx20081年前1 -
 明月几时月 共回答了11个问题
明月几时月 共回答了11个问题 |采纳率90.9%(1)①加AgNO 3 如果产生沉淀即存在Cl - ,说明是海水.蒸馏水则不会;
②海水有各种杂质,为混合物,蒸发会有结晶;而蒸馏水为纯净物,蒸发无杂质.
另外:虽然实际可以用品尝的方法鉴别两种物质,但中学阶段一般不推荐,亦认为错误方法.除非在厨房的试验中才可以品尝,请各位同学注意.
故答案为:加硝酸银溶液,有白色沉淀生成的是海水另一种为蒸馏水;蒸发有结晶的是海水,无结晶的则是蒸馏水.
(2)所得的粗盐中含有不溶性杂质,可采取下列步骤除去:先把粗盐溶解,再用过滤的方法滤去杂质,然后蒸干水分,得到纯净的NaCl.
故答案为:溶解,过滤.1年前查看全部
- (2004•重庆)浩瀚的海洋不仅繁衍着无数生生物,还蕴藏着丰富的化学资源,如氯化钠、氯化镁、溴化镁等大量的无机盐.
(2004•重庆)浩瀚的海洋不仅繁衍着无数生生物,还蕴藏着丰富的化学资源,如氯化钠、氯化镁、溴化镁等大量的无机盐.
(1)请设计两种鉴别海水和蒸馏水的方法(只需说明原理)
方法一:______.
方法二:______.
(2)由此所得的粗盐中含有不溶性杂质,可采取下列步骤除去.请在括号内填上相应的操作步骤.
( ______)→( ______)→蒸发结晶 爱过就忘1年前1
爱过就忘1年前1 -
 delat 共回答了15个问题
delat 共回答了15个问题 |采纳率80%解题思路:欲正确解答本题,须知海水与蒸馏水的区别,以及粗盐提纯的方法.(1)①加AgNO3如果产生沉淀即存在Cl-,说明是海水.蒸馏水则不会;
②海水有各种杂质,为混合物,蒸发会有结晶;而蒸馏水为纯净物,蒸发无杂质.
另外:虽然实际可以用品尝的方法鉴别两种物质,但中学阶段一般不推荐,亦认为错误方法.除非在厨房的试验中才可以品尝,请各位同学注意.
故答案为:加硝酸银溶液,有白色沉淀生成的是海水另一种为蒸馏水;蒸发有结晶的是海水,无结晶的则是蒸馏水.
(2)所得的粗盐中含有不溶性杂质,可采取下列步骤除去:先把粗盐溶解,再用过滤的方法滤去杂质,然后蒸干水分,得到纯净的NaCl.
故答案为:溶解,过滤.点评:
本题考点: 物质的鉴别、推断;氯化钠与粗盐提纯.
考点点评: 本题主要考查学生对海水与蒸馏水性质的认识.以及对粗盐提纯的实验操作的熟悉沉淀.1年前查看全部
- 溴化镁中溴元素的化合价是 feso4中fe元素的化合价是
 qian_john1年前1
qian_john1年前1 -
 小小雅阁布 共回答了16个问题
小小雅阁布 共回答了16个问题 |采纳率93.8%溴化镁 中溴是-1 硫酸亚铁中 Fe是+21年前查看全部
- 写出氧化钠 氯化铝 溴化镁的化学式
 shenhp12141年前2
shenhp12141年前2 -
 sbqw0123 共回答了22个问题
sbqw0123 共回答了22个问题 |采纳率90.9%Na2O
AlCl3
MgBr21年前查看全部
- 浩瀚的海洋不仅繁衍着无数水生生物,还蕴藏着丰富的化学资源,如氯化钠、氯化钙、氯化镁、溴化镁等大量的无机盐.
浩瀚的海洋不仅繁衍着无数水生生物,还蕴藏着丰富的化学资源,如氯化钠、氯化钙、氯化镁、溴化镁等大量的无机盐.
(1)请设计两种方法鉴别海水和蒸馏水的方法(只需说明原理)
方法一:______
方法二:______
(2)海水“晒盐”得到的粗盐中含有少量的泥沙等不溶性杂质,可采取以下步骤除去.请在括号内填上相应的步骤.____________蒸发结晶.
在实验中完成粗盐的提纯实验,老师提供了烧杯、药匙、玻璃棒、铁架台、酒精灯、坩埚钳、蒸发皿、胶头滴管和滤纸等几种可供选择的实验仪器,要完成该实验还需要下列仪器中的______(填写一种仪器的代号)
A.集气瓶B.漏斗C.燃烧匙D.试管夹
(3)通过以上步骤处理后,往往还含氯化镁、氯化钙等可溶性杂质,现对其进行提纯,主要操作流程如下: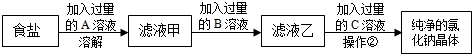
操作②的名称是______,A是______,B是______,C是______.(选择合适序号填空)
A.Na2CO3B.K2CO3C.H2SO4D.HCl E.NaOH
(4)海水淡化是国际上研究的热点问题,我国科学家在利用高分子膜进行海水淡化的研究上取得了一些成绩.高分子膜在海水淡化过程中的作用______.
(5)利用食盐可制得纯碱,我国科学家侯德榜创造了著名的纯碱生产方法“联合制碱法”.
①“联合制碱法”制得纯碱的过程,用化学方程式可简要表示为:NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl,2NaHCO3
Na2CO3+CO2↑+H2O△ .NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl,2NaHCO3.
Na2CO3+CO2↑+H2O△ .
②该过程中,为什么氨盐水比食盐水更容易吸收二氧化碳______.
③氨盐水吸收二氧化碳后,生成物中为什么碳酸氢钠比氯化铵晶体先析出______. 浮云傲水1年前1
浮云傲水1年前1 -
 badjojo81 共回答了20个问题
badjojo81 共回答了20个问题 |采纳率80%解题思路:(1)鉴别海水和蒸馏水的关键就是检验盐类物质的存在,可以使用物理或化学方法;
(2)除去粗盐中含有少量的泥沙等不溶性杂质,可以采用过滤的方法;
(3)除去氯化钠中含有的氯化镁、氯化钙等可溶性杂质,需选择合适的除杂试剂,要求反应后不能引入新的杂质;
(4)利用高分子膜进行海水淡化实质上就是“筛子”原理;
(5)可从纯碱的生产过程进行分析“联合制碱法”,综合考虑到酸碱中和、固体物质的溶解度等问题.(1)海水中含有大量的盐,而蒸馏水仅仅是一种物质,所以可以使用加硝酸银溶液的方法或蒸发的方法,所以本题答案为:滴入硝酸银溶液观察是否有沉淀产生,蒸发观察是否有固体析出;
(2)除去粗盐中含有少量的泥沙等不溶性杂质,可以采用过滤的方法,首先使物质溶于水,然后过滤,再进行蒸发,所以本题答案为:溶解,过滤;
(3)除去氯化钠中含有的氯化镁、氯化钙等可溶性杂质,选择的除杂试剂不能引入新的杂质,且后加的试剂能把前面多余的试剂反应掉,要除去氯化镁,可加入氢氧化钠,要除去氯化钙,可加入碳酸钠,多余的氢氧化钠和碳酸钠可以用盐酸除去,经蒸发得到食盐的晶体,所以本题答案为:蒸发,E,A,D;
(4)海水淡化就是除去海水中含有的盐类物质,利用高分子膜进行海水淡化实质上就是“筛子”原理,只能允许水分子通过而不允许盐的离子通过,所以本题答案为:只允许水分子通过不允许盐离子通过;
(5)①根据已有知识写出该反应的原理,所以本题答案为:NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl,2NaHCO3
△
.
Na2CO3+CO2↑+H2O;
②可以从酸碱中和的角度考虑吸收二氧化碳的难易,所以本题答案为:氨水显碱性,二氧化碳溶于水形成碳酸,二者发生中和反应,提高对二氧化碳的吸收能力;
③氨盐水吸收二氧化碳后,生成物碳酸氢钠比氯化铵晶体先析出,是与物质的溶解度大小有关,所以本题答案为:碳酸氢钠比氯化铵溶解度小.点评:
本题考点: 物质的鉴别、推断;混合物的分离方法;碳酸钠、碳酸氢钠与碳酸钙.
考点点评: 此题综合考查了海水晒盐和海水制碱的知识,完成此题,需要以课本知识为依据.所以同学们在平时的学习中要加强基础知识的储备,能够灵活应用.1年前查看全部
- 化学电子式用电子式表示溴化镁的形成过程
 njhebin1年前1
njhebin1年前1 -
 君君笑 共回答了16个问题
君君笑 共回答了16个问题 |采纳率87.5%2Br(周围七个点,一侧为一个点)+Mg(一侧两个点)→ [Br(周围八个点)]- Mg2+ [Br(周围八个点)]-
记得溴离子加中括号1年前查看全部
- 浩瀚的海洋不仅繁衍着无数水生生物,还蕴藏着丰富的化学资源,如氯化钠、氯化钙、氯化镁、溴化镁等大量的无机盐.
浩瀚的海洋不仅繁衍着无数水生生物,还蕴藏着丰富的化学资源,如氯化钠、氯化钙、氯化镁、溴化镁等大量的无机盐.
(1)请设计两种鉴别海水和蒸馏水的方法(只需说明原理).
方法一:______;
方法二:______.
(2)海水“晒盐”得到的粗盐中含有少量的泥沙等不溶性杂质,可采取下列步骤除去.请在括号内填上相应的操作步骤.(______)→(______)→蒸发结晶.
在实验室中完成粗盐的提纯实验,老师提供了烧杯、药匙、玻璃棒、铁架台、酒精灯、坩埚钳、蒸发皿、胶头滴管和滤纸等几种可供选择的实验仪器,要完成该实验还需要下列仪器中的______(填写一种仪器的代号).
A.集气瓶B.漏斗C.燃烧匙D.试管夹. qaz1421年前1
qaz1421年前1 -
 xiaocynic 共回答了16个问题
xiaocynic 共回答了16个问题 |采纳率93.8%解(1)根据蒸馏水是纯净物,基本不含杂质,而海水是混合物,含有较多的钙镁离子化合物,根据组成的不同,确定鉴别方法,故答案为:将液体加热蒸发,有固体析出的是海水,没有固体析出的是蒸馏水;分别加入氢氧化钠溶液,有沉淀产生的是海水,没有沉淀产生的是蒸馏水,
(2)粗盐的提纯实验要在溶液中进行,然后将将不溶性杂质滤去,经过蒸发结晶即可得到晶体,故答案为:溶解,过滤,
除了题中给出的仪器,还需要有支撑滤纸来制作过滤器的装置,也就是漏斗,故答案为:B.1年前查看全部
- 下列化合物完全由与氖原子的核外电子排布相同的离子形成的是 a溴化镁 b硫化钠 c氯化钠 d氧化钠
 菜干1年前3
菜干1年前3 -
 yuan1021jie 共回答了14个问题
yuan1021jie 共回答了14个问题 |采纳率100%答案选:d.
氖原子核外有十个电子,原子层两层,内层两个电子,外层八个电子,是一种八隅体稳定结构.
某些离子的核外结构和氖原子一样那么这个离子所对应的元素必定是与氖原子时同一周期的非金属或下一周期的非金属.
如题设:钠是第三周期元素,核外有是一个电子,电子层分为三层,最外层一个电子很容易失去.
氧是第二周期元素,核外有六个电子,容易得到两个电子形成八电子稳定结构.1年前查看全部
- 金属铷与溴化镁溶液反应,会不会生成br2
 野猪穿裤1年前3
野猪穿裤1年前3 -
 jasonye 共回答了19个问题
jasonye 共回答了19个问题 |采纳率78.9%不会生成Br2,也不会生成Mg的,因为铷的性质比Na还要活泼,与水溶液不能置换出金属单质.1年前查看全部
- 与氖原子的核外电子排布相同的离子跟与氩原子的核外电子排布相同的离子形成的化合物 溴化镁为什么不是
 吾芊吾挂1年前2
吾芊吾挂1年前2 -
 yh651017 共回答了19个问题
yh651017 共回答了19个问题 |采纳率78.9%与氩原子排布相同的阴离子有S2-,Cl-,没有Br-哦,Br-的电子排布是与Kr相同哦的1年前查看全部
- 1mol溴化镁含几摩尔化学键
 e81001年前1
e81001年前1 -
 沪蓉高速 共回答了18个问题
沪蓉高速 共回答了18个问题 |采纳率88.9%都是离子键1年前查看全部
- 金属铷与碘化钾溴化镁溶液反应的离子方程式
 elena1051年前1
elena1051年前1 -
 山泉绕屋 共回答了20个问题
山泉绕屋 共回答了20个问题 |采纳率90%1、KI:2Rb+2H2O==2RbOH+H2↑
2、MgBr2:Mg2+ +2OH-==Mg(OH)2↓1年前查看全部
- 溴化镁和过量氨水反应的化学方程式
 离心草1年前3
离心草1年前3 -
 neocozhu 共回答了25个问题
neocozhu 共回答了25个问题 |采纳率88%MgBr2 + 2NH3.H2O = Mg(OH)2 ↓+ 2NH4B1年前查看全部
- 溴化镁化学式右下角的2的含义
 常vv1年前4
常vv1年前4 -
 gaoshan44 共回答了20个问题
gaoshan44 共回答了20个问题 |采纳率95%二代表一个mg离子要和两个br离子成离子键,才可以使溴化镁整体成中性,不带电若是mgbr,则整个粒子带负一价电,就不可以了,因而二的含义应该就是与mg离子成键的br的个数,当然,这只是个人观点,希望对你有所帮助1年前查看全部
大家在问
- 1阅读下面一段文字,完成⑴-⑵题。(4分)
- 2果△A1B1C1与△ABC关于y轴对称,若△ABC面积为S1,△A1B1C1面积为S2,则S1,S2的大小关系为
- 3若错误请给出正解.价值是使用价值的基础和物质承担者.
- 4如果一棵树比另一棵树年龄大那么它的年轮就一定比另一棵树多吗?
- 5七年级上册科学阶梯作业本章自测第19页第3大题第30小题
- 6advise的用法.Could you please advise a schedule for the intervi
- 7给下面一则新闻拟写标题。(10个字以内)
- 8果园里有桃树500棵,比苹果树多九分之一,苹果树有多少棵?(用算数和方程两种)苹果树有多少棵?
- 9用奇怪得意不好意思弯弯曲曲取长补短明白聪明自言自语断断续续拔苗助长这些词题目自拟
- 10—Look,I’ve bought some bread,including your favorite flavor.
- 11含有数字的名言必须含有数字
- 12来一句用比喻的修辞手法描写山水的诗句?
- 13正己烷与环己烷能形成共沸么?这两种物质的混合物如何分离?
- 14雪的记忆 作文
- 15一、填空题(为什么要填这个答案):
