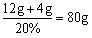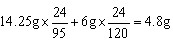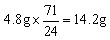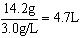苦卤中通入氯气产生红棕色液体的离子方程式是什么啊?
 爱知乐2022-10-04 11:39:541条回答
爱知乐2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 你是地瓜 共回答了21个问题
你是地瓜 共回答了21个问题 |采纳率81%- 2Br-+CL2==Br2+2CL-
- 1年前
相关推荐
- 今有A,B,C,D,四种元素,其中A元素是1826年一位法国青年科学家发现的.他在研究海水制盐时,往剩余的副产物苦卤中通
今有A,B,C,D,四种元素,其中A元素是1826年一位法国青年科学家发现的.他在研究海水制盐时,往剩余的副产物苦卤中通入氯气后发现溶液颜色变深,若经进一步提取,可得一种红棕色溶液,有刺鼻的臭味.B,C,D的原子电子层排布均不超过3个电子层.D原子核内的质子数正好等于C原子核内质子数的2倍,而它们最外层电子层上的电子数恰好相等.D原子的最内电子层上电子数则是B原子核外电子数的2倍.四种元素分别为:A________________B___________________C__________________D__________________ 由上述某元素的单质与另两种元素的化合物反应生成两种酸的化学方程式是____________________________
为什么B和C不可以是氢和氦 一定要是氧和硫?
假设D原子最外电子层的电子数为x,为什么就有 2+8+x=2(2+x)?
说错了 是为什么不可以是氦和硼 www03711年前3
www03711年前3 -
 clei510 共回答了16个问题
clei510 共回答了16个问题 |采纳率93.8%D原子核内的质子数正好等于C原子核内质子数的2倍,而它们最外层电子层上的电子数恰好相等
氢和氦最外层电子层上的电子数不相等,氢最外层是1个,氦是2个
最外层电子层上的电子数恰好相等表示属于同一族
在题中就分别属于第二和第三周期,根据D原子核内的质子数正好等于C原子核内质子数的2倍,质子数=核外电子数
所以2+8+x=2(2+x)
【仙剑问情】团队Edogawa_Ai_为您解答,如满意请采纳,如有疑惑请追问,谢谢O(∩_∩)O1年前查看全部
- 海洋是个巨大的资源宝库,它不仅孕育着无数的生命,还含有大量的化学物质.海水经过晒盐后得到粗盐和苦卤,提纯后的食盐中还含有
海洋是个巨大的资源宝库,它不仅孕育着无数的生命,还含有大量的化学物质.海水经过晒盐后得到粗盐和苦卤,提纯后的食盐中还含有硫酸钠、氯化镁、氯化钙等可溶性杂质,他们在溶液中主要以S
、Ca2+、Mg2+的形式存在,为将这些杂质离子除净,应加入过量的氯化钡、氢氧化钠、碳酸钠等物质将其转化为沉淀,过滤除去;再加入适量的盐酸,得到精盐水,最后经蒸发即得精盐.以下是某化工厂对海水进行综合利用的示意图1:O 2−4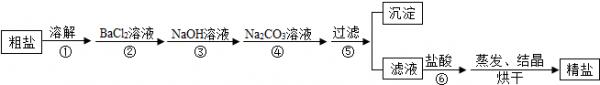
(1)在粗盐提纯的实验中,主要操作步骤是______、______、蒸发.蒸发过程中玻璃棒的作用是______.
(2)在利用粗盐制备精盐过程的第⑥步操作中,加入适量盐酸的目的是______.
(3)在制备精盐的过程中,氯化钡和碳酸钠溶液的添加顺序是否可以颠倒______,理由是______.
(4)长岛的海水淡化采用的方法是膜法,如图2所示,对淡化膜右侧的海水加压,水分子可以透过淡化膜进入左侧淡水池,而海水中的各种离子不能通过淡化膜,从而得到淡水,对加压后右侧海水成分变化进行分析,正确的是______(填序号).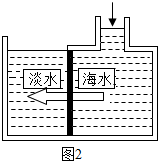
①溶质质量增加 ②溶液质量不变 ③溶剂质量减少 ④溶质质量分数不变,
通过对上述膜法淡化海水的原理的分析,你认为它与过滤有哪些相似之处______. 无敌抗生素1年前1
无敌抗生素1年前1 -
 华安保全 共回答了15个问题
华安保全 共回答了15个问题 |采纳率86.7%解题思路:(1)粗盐提纯步骤为:溶解→过滤→蒸发结晶;
(2)运用盐酸能和氢氧化钠反应、还能和碳酸钠反应的性质解答;
(3)运用碳酸钠即为了除去钙离子也为了除去氯化钡解答;
(4)运用对淡化膜右侧的海水加压,水分子可以透过淡化膜进入左侧淡水池,而海水中的各种离子不能通过淡化膜,从而得到淡水这一信息和过滤、淡化膜的区别和共同点解答解答.(1)粗盐提纯步骤为:溶解→过滤→蒸发结晶;蒸发时玻璃棒不断搅拌是为了受热均匀,防止局部受热造成液体飞溅,故(1)答案:溶解、过滤,防止局部受热造成液体飞溅.
(2)在提纯的过程中氢氧化钠和碳酸钠都要过量,氢氧化钠和盐酸反应生成氯化钠和水,碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,故(2)答案:除去过量的碳酸钠和氢氧化钠.
(3)碳酸钠和氯化钡反应生成碳酸钡沉淀和氯化钠,还能和钙离子结合成碳酸钙沉淀,故碳酸钠作用是既除去Ca2+,又除去多余的氯化钡所以不能颠倒,故(3)答案:不可以,碳酸钠作用是既除去Ca2+,又除去多余的氯化钡.
(4)对淡化膜右侧的海水加压,水分子可以透过淡化膜进入左侧淡水池,而海水中的各种离子不能通过淡化膜,从而得到淡水,所以右侧海水中的溶剂水减少了;过滤和淡化膜技术都是为了分离混合物,运用了筛选的思想,但膜的孔径大小不同.故(4)答案:膜法淡化海水和过滤在道理上是相似的,都是利用了筛选的思想,只是膜的孔径大小不同罢了.点评:
本题考点: 对海洋资源的合理开发与利用;过滤的原理、方法及其应用;溶液、溶质和溶剂的相互关系与判断;溶质的质量分数;酸的化学性质;氯化钠与粗盐提纯;盐的化学性质.
考点点评: 熟记过滤方法及原理、蒸发的操作的要求、盐酸的性质、碳酸钠的性质,会判断复分解反应发生的条件并熟练书写出相应的生成物.1年前查看全部
- 海水经过晒盐后得到粗盐和苦卤,重结晶后的食盐中还含有硫酸钠、氯化镁、氯化钙等可溶性杂质,他们在溶液中主要以SO42-、C
海水经过晒盐后得到粗盐和苦卤,重结晶后的食盐中还含有硫酸钠、氯化镁、氯化钙等可溶性杂质,他们在溶液中主要以SO42-、Ca2+、Mg2+的形式存在,为将这些杂质离子除净,应加入过量的氯化钡、氢氧化钠、碳酸钠等物质将其转化为沉淀,过滤除去;再加入适量的盐酸,得到精盐水,最后经蒸发即得精盐.以下是某化工厂对海水进行综合利用的示意图:
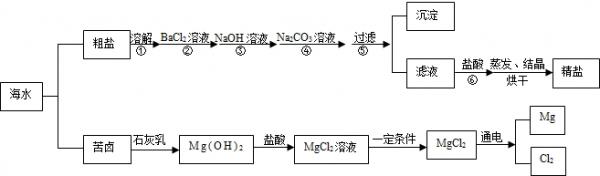
(1)在苦卤制镁的过程中加入了石灰乳(主要成分是氢氧化钙),石灰乳是用生石灰制得的,请写出制取石灰乳的化学方程式______.
(2)在制备精盐的过程中,氯化钡和碳酸钠溶液的添加顺序是否可以颠倒______,理由是______;
(3)在利用粗盐制备精盐过程的第⑥步操作中,加入适量盐酸的目的是______. beauty-ugly1年前1
beauty-ugly1年前1 -
 hrf268 共回答了19个问题
hrf268 共回答了19个问题 |采纳率89.5%解题思路:(1)石灰乳的主要成份是氢氧化钙,生石灰的主要成份是氧化钙,根据氧化钙与氢氧化钙的转化解答.
(2)根据氯化钡和碳酸钠在除杂过程中的作用解答.
(3)根据⑥步之前的溶液成份以及盐酸参与的反应解答.(1)石灰乳的主要成份是氢氧化钙,生石灰是氧化钙,生石灰与水反应生成氢氧化钙,故答案为:CaO+H2O═Ca(OH)2.
(2)氯化钡只能将硫酸根离子转化为沉淀,而碳酸钠既可以将钙离子沉淀,又可将钡离子沉淀,如果颠倒,多余的钡离子也就成了杂质,故答案为:不可以,碳酸钠既可以将钙离子沉淀,又可以将多余的钡离子沉淀.
(3)经过前面五步的反应,溶液中还有过量的碳酸钠和氢氧化钠,而它们对于氯化钠来说也是杂质,需要将其转化,又不能引入新的杂质,故答案为:除去多余的氢氧化钠和碳酸钠.点评:
本题考点: 氯化钠与粗盐提纯;物质除杂或净化的探究;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要考查了在粗盐提纯的过程中,加入的各种物质的作用以及顺序,逻辑性较强.1年前查看全部
- (09青岛)海水经过晒盐后得到粗盐和苦卤,重结晶后的食盐中还含有硫酸钠、氯化镁、氯化钙等可溶性杂质,他们在溶液中主要以S
(09青岛)海水经过晒盐后得到粗盐和苦卤,重结晶后的食盐中还含有硫酸钠、氯化镁、氯化钙等可溶性杂质,他们在溶液中主要以SO 4 2 - 、Ca 2+ 、Mg 2+ 的形式存在,为将这些杂质离子除净,应加入过量的氯化钡、氢氧化钠、碳酸钠等物质将其转化为沉淀,过滤除去;再加入适量的盐酸,得到精盐水,最后经蒸发即得精盐。以下是某化工厂对海水进行综合利用的示意图:

(1)在苦卤制镁的过程中加入了石灰乳(主要成分是氢氧化钙),石灰乳是用生石灰制得的,请写出制取石灰乳的化学方程式_________________________________________。
(2)在制备精盐的过程中,氯化钡和碳酸钠溶液的添加顺序是否可以颠倒________,理由是_____________________________________________________________________;
(3)在利用粗盐制备精盐过程的第⑥步操作中,加入适量盐酸的目的是__________
____________________________________________________________________。 whbn234501年前1
whbn234501年前1 -
 风华笑 共回答了22个问题
风华笑 共回答了22个问题 |采纳率100%(1)CaO + H 2 O ="=" Ca(OH) 2
(2)不可以。碳酸钠作用是既除去Ca 2+ ,又除去多余的氯化钡
(3)除去多余的氢氧化钠和碳酸钠
(1)氧化钙和水反应的化学方程式为:CaO+H 2 O═Ca(OH) 2 .
(2)在制备精盐的过程中,由于加入的氯化钡和碳酸钠都是过量的,加入碳酸钠一方面是除去Ca 2+ ,同时还除去多余的氯化钡.故填:不可以;碳酸钠作用是既除去Ca 2+ ,又除去多余的氯化钡.
(3)在利用粗盐制备精盐过程的第⑥步操作中,加入适量盐酸的目的是除去多余的氢氧化钠和碳酸钠.故填:除去多余的氢氧化钠和碳酸钠.1年前查看全部
- (2013•南宁三模)I.某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制
(2013•南宁三模)I.某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制取较纯净的氯化钾晶体及液溴,他们设计了如图1流程:
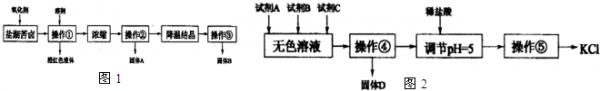
请根据以上流程,回答以下问题:
(1)操作①的名称为萃取、分液萃取、分液,溶剂可以选择:ACAC.A.四氯化碳B.乙醇C.苯D.己烯
(2)操作②要趁热过滤,所得固体A为MgSO4MgSO4(用化学式表示),操作③所得固体B为KClKCl.(用化学式表示)
Ⅱ.某同学提出一种新方案,对上述操作①后无色溶液进行除杂提纯,其方案如图2.
(3)无色溶液中先加试剂A(KOH),再加试剂B(BaCl2)最后加试剂C,若C为常见的盐,则试剂C为K2CO3K2CO3(用化学式表示),固体D的主要成分为Mg(OH)2、BaSO4、BaCO3Mg(OH)2、BaSO4、BaCO3(用化学式表示).
(4)用盐酸调节溶液pH=5的过程中,涉及的离子方程式有,:H++OH-═H2O和2H++CO32-=H2O+CO2↑2H++CO32-=H2O+CO2↑. 三渡1年前1
三渡1年前1 -
 qyh2 共回答了15个问题
qyh2 共回答了15个问题 |采纳率86.7%I.(1)图1流程操作为在盐湖苦卤的浓缩液中加入氧化剂应为氯气,可生成溴,通过萃取、分液的方法分离,利用碘易溶于有机溶剂的性质来进行提取,选择能提取碘的试剂除了对I2有强的溶解能力处,还必须难溶于水,否则不能进行分液分离,符合条件的有四氯化碳、苯,
故答案为:萃取、分液;AC;
(2)硫酸镁在高温下溶解度较小,氯化钾在高温时溶解度大,采用趁热过滤,能除去不溶性杂质硫酸镁,防止氯化钾冷去后析出,然后降温结晶可得氯化钾,
故答案为:MgSO4;KCl;
Ⅱ.(3)操作①后无色溶液含有K+、Mg2+、SO42-、Cl-以及实验的目的是制取较纯净的氯化钾晶体,需先用氢氧化钾除去Mg2+;再用氯化钡除去SO42-,最后再用碳酸钾除去过量的氯化钡,得到的沉淀为氢氧化镁、硫酸钡和碳酸钡,
故答案为:K2CO3;Mg(OH)2、BaSO4、BaCO3;
(3)溶液中含有过量的氢氧根离子、碳酸根离子,所以用盐酸除去过量的氢氧根离子、碳酸根离子,反应的相关离子方程式为H++OH-═H2O、2H++CO32-=H2O+CO2↑,
故答案为:2H++CO32-=H2O+CO2↑.1年前查看全部
- (2011•青岛模拟)某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制取较
(2011•青岛模拟)某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制取较纯净的氯化钾晶体及液溴,他们设计了如下流程:
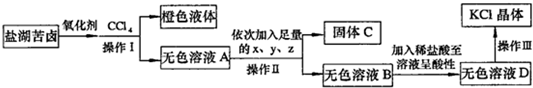
回答以下问题:
(1)操作Ⅰ的名称:______;要从橙色液体中分离出溴,所采取的操作需要的主要玻璃仪器除酒精灯和温度计外,还需要______;
(2)试剂z的化学式为______;检验SO42-已除尽的方法是______;
(3)写出操作Ⅲ的具体操作步骤______;
(4)某同学用如右图所示的实验装置制取氧化剂并将其通入盐湖苦卤中,装置b在实验中的作用是______
;若把上述装置中的a、b作为气体的发生、收集装置,装置c可任意改进,则根据下列提供的药品,用这套装置还可以制取的气体是______;若用上述装置中的a、b制取并收集NO,应将装置b如何改进______.
①制NH3:浓氨水和碱石灰 ②制SO2:Cu片和浓硫酸
③制NO:Cu片和稀硝酸 ④制O2:MnO2和双氧水. 帮你做多1年前1
帮你做多1年前1 -
 kec616 共回答了23个问题
kec616 共回答了23个问题 |采纳率95.7%解题思路:(1)操作Ⅰ为互不相溶的液体的分离,应为萃取分液,从橙色液体中分离出溴,应为蒸馏操作,以此判断所需要的仪器;
(2)除去溶液中的Mg2+、SO42-,应分别加入过量的BaCl2、KOH、K2CO3,检验SO42-已除尽,应加入BaCl2溶液,观察是否有沉淀生成;
(3)操作Ⅲ为蒸发操作,从操作要点分析;
(4)制备气体时要防止液体倒吸;根据反应装置不要加热的特点以及气体的收集方法判断还可制备的气体,根据NO的性质选择收集方法.(1)氧化剂应为氯气,通入氯气发生:Cl2+2Br-=2Cl-+Br2,加入CCl4,溴易溶于CCl4,溶液分层,用萃取、分液的方法分离;由于溴和CCl4的沸点不同,可用蒸馏的方法分离,蒸馏时用到的仪器有酒精灯、温度计、蒸馏烧瓶、冷凝管、牛角管、锥形瓶等,
故答案为:萃取、分液;蒸馏烧瓶、冷凝管、牛角管、锥形瓶;
(2)除去溶液中的Mg2+、SO42-,应分别加入过量的BaCl2、KOH、K2CO3,类似于粗盐的提纯,加入过量BaCl2可除去SO42-,
加入过量KOH溶液可除去Mg2+,最后加入K2CO3可除去BaCl2,检验SO42-已除尽的方法是取无色溶液D,加入BaCl2溶液,若没有白色沉淀,则SO42-已除尽,
故答案为:K2CO3;取无色溶液D,加入BaCl2溶液,若没有白色沉淀,则SO42-已除尽;
(3)操作Ⅲ为蒸发操作,,蒸发时将溶液倒入蒸发皿中并置于三脚架上;加热并用玻璃棒不断搅拌蒸发皿中的液体,直到出现较多晶体时,停止加热,注意不能直接蒸干,
故答案为:将溶液倒入蒸发皿中并置于三脚架上;加热并用玻璃棒不断搅拌蒸发皿中的液体,直到出现较多晶体时,停止加热;
(4)制备气体时要防止液体倒吸,b的作用为安全瓶,起到防止倒吸作用,由装置图可知,制备气体时不需要加热,并且生成的气体用向下排空气法收集,气体的密度比空气的小,只有氨气符合;NO只能用排水法收集,则b中应装满水.
故答案为:安全瓶;①;将b中装满水.点评:
本题考点: 氯、溴、碘及其化合物的综合应用;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查较为综合,涉及物质的制备和分离、物质的检验、蒸发以及气体的制备、收集等问题,本题难度中等,学习中注意相关基础知识的积累.1年前查看全部
- 海水是一个巨大的化学资源库,下列有关海水综合利用的说法不正确的是( ) A.在苦卤中加石灰乳过滤得沉淀,然后
海水是一个巨大的化学资源库,下列有关海水综合利用的说法不正确的是( )
A.在苦卤中加石灰乳过滤得沉淀,然后加盐酸,经浓缩、结晶、脱水、电解可以得到金属镁 B.从海水中可得到NaCl,电解熔融NaCl或其水溶液都可制得Cl 2 C.利用蒸馏原理从海水中提取淡水是海水淡化技术发展的新方向 D.将苦卤浓缩、氧化、鼓入热空气或水蒸气可提取溴  老酒酒酒1年前1
老酒酒酒1年前1 -
 iamtiancai 共回答了26个问题
iamtiancai 共回答了26个问题 |采纳率84.6%C
蒸馏法不是海水淡化技术的新方向。1年前查看全部
- (2013•南宁三模)I.某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制
(2013•南宁三模)I.某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制取较纯净的氯化钾晶体及液溴,他们设计了如图1流程:
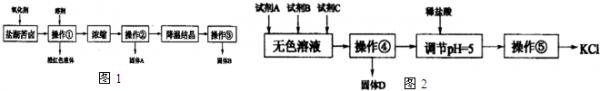
请根据以上流程,回答以下问题:
(1)操作①的名称为______,溶剂可以选择:______.A.四氯化碳B.乙醇C.苯D.己烯
(2)操作②要趁热过滤,所得固体A为______(用化学式表示),操作③所得固体B为______.(用化学式表示)
Ⅱ.某同学提出一种新方案,对上述操作①后无色溶液进行除杂提纯,其方案如图2.
(3)无色溶液中先加试剂A(KOH),再加试剂B(BaCl2)最后加试剂C,若C为常见的盐,则试剂C为______(用化学式表示),固体D的主要成分为______(用化学式表示).
(4)用盐酸调节溶液pH=5的过程中,涉及的离子方程式有,:H++OH-═H2O和______. 掌外1年前1
掌外1年前1 -
 蚂蚁伐大树 共回答了23个问题
蚂蚁伐大树 共回答了23个问题 |采纳率91.3%解题思路:I.图1流程操作为在盐湖苦卤的浓缩液中加入氧化剂应为氯气,可生成溴,通过萃取、分液的方法分离,浓缩后得到硫酸镁和氯化钾的混合液,经重结晶可得硫酸镁,过滤得到氯化钾溶液,经降温结晶,过滤可得到氯化钾;
Ⅱ.对上述操作①后无色溶液含有K+、Mg2+、SO42-、Cl-等离子,无色溶液中先加试剂A(KOH),以除去Mg2+,再加试剂B(BaCl2)以除去SO42-,最后加试剂K2CO3,可除去过量的钡离子,过滤可得到Mg(OH)2、BaSO4沉淀以及少量BaCO3沉淀,然后加入盐酸可除去过量的氢氧化钾和碳酸钾,经蒸发、浓缩、冷却结晶可得到氯化钾.I.(1)图1流程操作为在盐湖苦卤的浓缩液中加入氧化剂应为氯气,可生成溴,通过萃取、分液的方法分离,利用碘易溶于有机溶剂的性质来进行提取,选择能提取碘的试剂除了对I2有强的溶解能力处,还必须难溶于水,否则不能进行分液分离,符合条件的有四氯化碳、苯,
故答案为:萃取、分液;AC;
(2)硫酸镁在高温下溶解度较小,氯化钾在高温时溶解度大,采用趁热过滤,能除去不溶性杂质硫酸镁,防止氯化钾冷去后析出,然后降温结晶可得氯化钾,
故答案为:MgSO4;KCl;
Ⅱ.(3)操作①后无色溶液含有K+、Mg2+、SO42-、Cl-以及实验的目的是制取较纯净的氯化钾晶体,需先用氢氧化钾除去Mg2+;再用氯化钡除去SO42-,最后再用碳酸钾除去过量的氯化钡,得到的沉淀为氢氧化镁、硫酸钡和碳酸钡,
故答案为:K2CO3;Mg(OH)2、BaSO4、BaCO3;
(3)溶液中含有过量的氢氧根离子、碳酸根离子,所以用盐酸除去过量的氢氧根离子、碳酸根离子,反应的相关离子方程式为H++OH-═H2O、2H++CO32-=H2O+CO2↑,
故答案为:2H++CO32-=H2O+CO2↑.点评:
本题考点: 氯、溴、碘及其化合物的综合应用;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题综合考查物质的制备、分离和提纯的实验设计和评价,侧重于学生的分析能力和实验能力的考查,为高考常见题型和高频考点,注意把握物质的分离、提纯原理,根据实验流程解答该题,答题时要注意审题,把握实验的目的和原理.1年前查看全部
- 利用苦卤,石灰乳,稀盐酸怎样制得金属镁
利用苦卤,石灰乳,稀盐酸怎样制得金属镁
最好有方程式 倒吊的人1年前3
倒吊的人1年前3 -
 眯眼打鸟 共回答了17个问题
眯眼打鸟 共回答了17个问题 |采纳率94.1%先用苦卤和石灰乳反应,制得氢氧化镁
Ca(OH)2+MgCl2=Mg(OH)2+CaCl2
过滤得较纯的氢氧化镁
再用氢氧化镁和稀盐酸反应,得到纯的氯化镁
Mg(OH)2+2HCl=MgCl2+2H2O
在干燥的氯化氢气流中使氯化镁晶体脱水干燥(注意一定要是在干燥的氯化氢气流中,否则氯化镁晶体会变成氧化镁,氯化氢和水 方程式MgCl2·6H2O=MgO+2HCl+5H2O 条件为加热)
最后电解熔融的无水氯化镁
MgCl2=Mg+Cl2↑(条件为通电)1年前查看全部
- 直接加热Mg(OH)2得到MgO,在电解熔融Mgo制金属Mg,这样对于先把生石灰投入浓缩的苦卤中得到Mg(OH)2,
直接加热Mg(OH)2得到MgO,在电解熔融Mgo制金属Mg,这样对于先把生石灰投入浓缩的苦卤中得到Mg(OH)2,
然后加盐酸得到MgCl2溶液,析出得到MgCl2.6H2O,在HCl气氛中加热失水得到无水MgCl2,然后熔融电解来说是否更可行更方便快捷更安全?Need backup , fengzy1年前3
fengzy1年前3 -
 luben1010 共回答了16个问题
luben1010 共回答了16个问题 |采纳率93.8%第二种
MgO熔点很高,使其熔融所费能量太多,而MgCl2是离子晶体并且熔点低,熔融点解耗能少1年前查看全部
- 海洋约占地球表面积的71%,具有十分巨大的开发潜力.苦卤是海水提取食盐后的残液,利用苦卤可以制得金属镁等化工原料.下图是
海洋约占地球表面积的71%,具有十分巨大的开发潜力.苦卤是海水提取食盐后的残液,利用苦卤可以制得金属镁等化工原料.下图是我市某盐场苦卤中部分成分含量柱形图.试计算:
(1)若使100 g该苦卤中的MgCl 2 和MgSO 4 完全转化为Mg(OH) 2 沉淀,需要20% NaOH溶液多少克?
(2)将上述沉淀完全转化为无水MgCl 2 ,并在熔融状态下进行电解,可得金属镁多少克?氯气多少升(该条件下氯气密度为3.0 g/L)?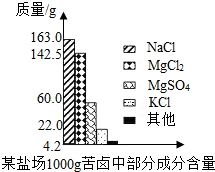
 一迷惑1年前1
一迷惑1年前1 -
 zengfox2002 共回答了14个问题
zengfox2002 共回答了14个问题 |采纳率85.7%(1)根据柱状图可知100g苦卤中氯化镁的质量为
142.5g×
100g
1000g =14.25g
设将氯化镁转化为氢氧化镁需要氢氧化钠的质量为x,生成氢氧化镁的质量为y.
MgCl 2 +2NaOH=Mg(OH) 2 ↓+2NaCl
95 80 58
14.25g xy
95
14.25g =
80
x =
58
y ,x=12g,y=8.7g
根据柱状图可知100g苦卤中硫酸镁的质量为
60g×
100g
1000g =6g
设将硫酸镁转化为氢氧化镁需要氢氧化钠的质量为z,生成氢氧化镁的质量为w.
MgSO 4 +2NaOH=Mg(OH) 2 ↓+Na 2 SO 4
120 80 58
6g z w
120
6g =
80
z =
58
w ,z=4g,w=2.9g
共需要氢氧化钠溶液的质量为
(12g+4g)÷20%=80g
(2)共生成氢氧化镁沉淀的质量为
8.7g+2.9g=11.6g
设生成金属镁的质量为m,生成氯气的质量为n.
由Mg(OH) 2 +2HCl=MgCl 2 +2H 2 O、MgCl 2
通电
.
Mg+Cl 2 ↑得
Mg(OH) 2 →MgCl 2 →Mg+Cl 2 ↑
58 24 71
11.6g m n
58
11.6g =
24
m =
71
n ,m=4.8g,n=14.2g
氯气的体积为
14.2g÷3.0g/L≈4.7L
答:(1)需要20%的氢氧化钠溶液80g.
(2)可得金属镁4.8g,氯气4.7L.1年前查看全部
- (2007•青岛)海水晒盐后得到的晶体是粗盐,剩余的液体称为苦卤,苦卤中除氯化钠外还含有多种成分,在食品、化工等方面有重
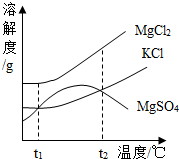 (2007•青岛)海水晒盐后得到的晶体是粗盐,剩余的液体称为苦卤,苦卤中除氯化钠外还含有多种成分,在食品、化工等方面有重要应用.请根据已知信息回答下列问题.
(2007•青岛)海水晒盐后得到的晶体是粗盐,剩余的液体称为苦卤,苦卤中除氯化钠外还含有多种成分,在食品、化工等方面有重要应用.请根据已知信息回答下列问题.
(1)如图是苦卤中有关物质的溶解度曲线,已知t1℃时,氯化镁和氯化钾的溶解度分别为M、N,则它们溶解度大小的关系为______:将苦卤加热到t2℃以上,根据溶解度曲线,首先析出的晶体应是______.
(2)化工厂利用苦卤制取生产镁的原料--无水氯化镁的生产流程如图: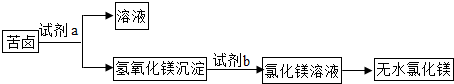
①在苦卤中加入试剂a可以选用______,要将氢氧化镁沉淀分离出来,应该采用的方法是______.验证苦卤中氯化镁已完全转化为氢氧化镁沉淀的方法是______.
②试剂b可以选用______(填溶质化学式),该步反应的化学方程式为______,该反应的基本反应类型是______反应. kan65411年前1
kan65411年前1 -
 01234567891011 共回答了14个问题
01234567891011 共回答了14个问题 |采纳率85.7%解题思路:根据固体的溶解度曲线可以:①比较不同物质在同一温度下的溶解度大小,②判断出物质的溶解度随温度变化的变化情况,从而确定通过降温、升温还是蒸发溶剂的方法使溶质从溶液中结晶析出;分离混合物的方法有过滤和结晶,过滤是一种把不溶性的物质和液体分开的一种方法;从苦卤中制取镁主要就是先把海水中的氯化镁转化成较纯净的氯化镁然后再通电熔融.(1)由于在t1℃时,氯化镁的溶解度大于氯化钾的溶解度,再就是在温度高于t2℃时,硫酸镁的溶解度最小,因此最先结晶析出,故答案为:M>N,硫酸镁
(2)①把海水中的氯化镁转化成氢氧化镁沉淀,是往海水中加熟石灰,氯化镁和氢氧化钙反应生成氢氧化镁沉淀,由于氢氧化镁不溶于水,因此可以采用过滤的方法使沉淀分离出来;证明苦卤中的氯化镁是否完全转化成氢氧化镁,可以向过滤后的溶液中滴加氢氧化钠溶液看是否有沉淀生成;故答案为:熟石灰;过滤;取少量滤液于试管中,滴加氢氧化钠溶液,无明显实验现象
②由于氢氧化镁是难溶性的碱,因此把它转化成氯化镁,只能采取加酸的方法,即酸碱中和,是复分解反应;故答案为:HCl,Mg(OH)2+2HCl=MgCl2+2H2O,复分解点评:
本题考点: 固体溶解度曲线及其作用;混合物的分离方法;结晶的原理、方法及其应用;晶体和结晶的概念与现象;反应类型的判定;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度较大,主要考查了固体溶解度曲线所表示的意义及海水制镁的有关知识.1年前查看全部
- (1)①海水晒盐可得到粗盐和苦卤,其中苦卤是食盐的______(填“饱和”或“不饱和”)溶液,理由是______.②利用
(1)①海水晒盐可得到粗盐和苦卤,其中苦卤是食盐的______(填“饱和”或“不饱和”)溶液,理由是______.②利用苦卤.石灰乳.稀盐酸可制得应用于飞机制造业的金属镁.其中发生反应的化学方程式是①______;②______;③______.
(2)一包从海水中获得的粗盐,其中含有少量的泥沙等不溶性杂质,可采用以下步骤除去______.______.______.课外活动小组对经过初步提纯的粗盐的成分进行探究,并将粗盐进一步提纯.
探究一:这包粗盐中还有什么杂质?
根据海水的成份和初步提纯的实验操作,估计粗盐中可能还有杂质是CaCl 2 和MgCl 2 ,现用实验验证这种推测:①取样并溶解,加入数滴NaOH溶液,目的是检验有没有(化学式)______,相关的反应方程式为______;②接着再加入数滴Na 2 CO 3 溶液,目的是检验其有没有(化学式)______,相关的反应方程式为______.实验证明,这包粗盐中含有的杂质是CaCl 2 .
探究二:这包粗盐中NaCl的质量分数是多少?
按下面步骤继续进行实验:①称取一定质量的样品;②将样品加水溶解制成粗盐溶液;③向粗盐溶液中加入过量某种试剂,过滤;④沉淀洗涤后小心烘干得到纯净固体A;⑤滤液在进行某一操作后,移入蒸发皿蒸发,得到纯净固体B;⑥称量实验中得到的某种固体.
②③⑤步骤中,都使用到同一仪器(填名称)______,在步骤②和⑤中使用这种仪器采用了相同操作,但目的不同,在步骤②中的目的是______,在步骤⑤中的目的是______.步骤③中加入试剂是(化学式)______,相关反应方程式为______.步骤⑤进行的“某一操作”是______,目的是______,相关反应方程式为______.步骤⑥中,你认为需要称量的固体是A还是B?______(填A或B)你不选择称量另一种固体的理由是______. smallcatjw1年前1
smallcatjw1年前1 -
 星雨_jiang 共回答了15个问题
星雨_jiang 共回答了15个问题 |采纳率93.3%(1)①苦卤是海水浓缩析盐后产生的其氯化钠含量小于总固形物质量的50%时的水溶液.在海盐生产中,海水在盐田里日晒蒸发浓缩,析出食盐,当卤水达到一定浓度时(28.5~30波美度),不再晒盐,该卤水称为苦卤.故苦卤是食盐的饱和溶液;
②苦卤的化学式为MgCl 2 ,石灰乳的主要成分是Ca(OH) 2 ,制作过程为:MgCI 2 ﹢Ca(OH) 2 =Mg(OH) 2 ↓﹢CaCl 2 ,Mg(OH) 2 ﹢2HCl=MgCl 2 ﹢2H 2 O,MgCl 2 =Mg﹢Cl 2 ↑.
故答案为:饱和,里面有析出的食盐晶体,MgCI 2 ﹢Ca(OH) 2 =Mg(OH) 2 ↓﹢CaCl 2 ,
Mg(OH) 2 ﹢2HCl=MgCl 2 ﹢2H 2 O,MgCl 2 =Mg﹢Cl 2 ↑.
(2)粗盐提纯的步骤为:①把含有泥沙的粗食盐完全溶解;
②过滤掉不溶于水的泥沙;
③蒸发掉水分,即得到氯化钠晶体.
故答案为:溶解,过滤,蒸发.
探究一:①因为氯化镁与氢氧化钠反应生成氢氧化镁沉淀,而氯化钙与氢氧化钠反应没有沉淀或气体生成,故加入数滴NaOH溶液,目的是检验有没有氯化镁.氯化镁与氢氧化钠反应的化学方程式为:MgCl 2 ﹢2NaOH=Mg(OH) 2 ↓﹢2NaCl;
②因为Na 2 CO 3 溶液与CaCl 2 反应生成碳酸钙沉淀,故加入数滴Na 2 CO 3 溶液,目的是检验其有没有氯化钙;
故答案为:MgCl 2 ,MgCl 2 ﹢2NaOH=Mg(OH) 2 ↓﹢2NaCl,CaCl 2 ,CaCl 2 +Na 2 CO 3 =CaCO 3 ↓+2NaCl.
探究二:②③⑤步骤中,都使用到同一仪器为玻璃棒.②中玻璃棒的作用是加速粗盐的溶解;③中玻璃棒的作用是;⑤中玻璃棒的作用是防止由于局部温度过高,造成液滴飞溅.
步骤③中加入试剂是Na 2 CO 3 ,碳酸钠与氯化钙反应的化学方程式为CaCl 2 +Na 2 CO 3 =CaCO 3 ↓+2NaCl;
步骤⑤进行的“某一操作”是加入适量或过量的稀盐酸,目的是除去过量的碳酸钠.反应的化学方程式为:Na 2 CO 3 +2HCl=2NaCl﹢H 2 O﹢CO 2 ↑.
步骤⑥中需要称量的固体是A,因为B中含有反应生成的氯化钠.
故答案为:玻璃棒;加速粗盐的溶解;防止由于局部温度过高,造成液滴飞溅.Na 2 CO 3 ;CaCl 2 +Na 2 CO 3 =CaCO 3 ↓+2NaCl;
加入适量或过量的稀盐酸,除去过量的碳酸钠,Na 2 CO 3 +2HCl=2NaCl﹢H 2 O﹢CO 2 ↑.
A,B中含有反应生成的氯化钠.1年前查看全部
- 今有A、B、C、D四种元素,其中A元素是1826年法国青年科学家巴拉尔发现的.他在研究海水制盐时,往剩余的副产物苦卤中通
今有A、B、C、D四种元素,其中A元素是1826年法国青年科学家巴拉尔发现的.他在研究海水制盐时,往剩余的副产物苦卤中通入氯气后发现溶液颜色变深,若经进一步提取,可得一种红棕色液体,有刺鼻的臭味.B、C、D的原子电子层排布均不超过3个电子层.D原子核内的质子数正好等于C原子核内质子数的2倍,而它们最外电子层上的电子数恰好相等.D原子的最内电子层上电子数是B原子核外电子数的2倍.则:
(1)四种元素分别是为:A______,B______,C______,D______.
(2)写出巴拉尔发现A元素单质的离子方程式:______.
(3)写出由上述某元素的单质与另外两种元素的化合物反应生成两种酸的化学方程式______. lorraine_xiao1年前1
lorraine_xiao1年前1 -
 心情如紫 共回答了25个问题
心情如紫 共回答了25个问题 |采纳率80%解题思路:A、B、C、D四种元素,A元素是一种红棕色液体,有刺鼻的臭味,则A单质是溴,则A元素是Br元素;B、C、D的原子电子层排布均不超过3个电子层,D原子核内的质子数正好等于C原子核内质子数的2倍,而它们最外电子层上的电子数恰好相等,说明C、D是同一主族元素,则C是O元素、D是S元素;D原子的最内电子层上电子数是B原子核外电子数的2倍,则B是H元素,即A是Br元素、B是H元素、C是O元素、D是S元素,再结合物质性质解答.A、B、C、D四种元素,A元素是一种红棕色液体,有刺鼻的臭味,则A单质是溴,则A元素是Br元素;B、C、D的原子电子层排布均不超过3个电子层,D原子核内的质子数正好等于C原子核内质子数的2倍,而它们最外电子层上的电子数恰好相等,说明C、D是同一主族元素,则C是O元素、D是S元素;D原子的最内电子层上电子数是B原子核外电子数的2倍,则B是H元素,即A是Br元素、B是H元素、C是O元素、D是S元素,
(1)通过以上分析知,A是Br元素、B是H元素、C是O元素、D是S元素,故答案为:Br;H;O;S;
(2)海水提溴的原理是利用Cl2将Br-氧化成Br2,离子方程式为Cl2+2Br-═2Cl-+Br2,故答案为:Cl2+2Br-═2Cl-+Br2;
(3)类比Cl2和水反应Cl2+H2O=HCl+HClO,所以Br2可以和H2O反应生成HBr和HBrO两种酸,反应方程式为Br2+H2O=HBr+HBrO,故答案为:Br2+H2O=HBr+HBrO.点评:
本题考点: 原子结构与元素的性质.
考点点评: 本题考查原子结构和元素性质,熟练掌握前36号元素原子结构是解本题关键,以A元素单质颜色及状态为突破口进行推断,知道物质的性质及物质之间的反应,题目难度不大.1年前查看全部
- 海水晒盐后得到的晶体是食盐,剩余的液体称为苦卤,苦卤中除氯化钠外还有多种成分,化工厂利用苦卤制取生产镁的原料,无水氯化镁
海水晒盐后得到的晶体是食盐,剩余的液体称为苦卤,苦卤中除氯化钠外还有多种成分,化工厂利用苦卤制取生产镁的原料,无水氯化镁的生产流程如下,请根据以下信息回答问题.
苦卤中加入试剂a,得到一溶液与氢氧化镁沉淀,向该氢氧化镁沉淀中加入试剂b,得到氯化镁溶液,进一步得到无水氯化镁.
问 在苦卤中加入的试剂a可以选用 ( )
要将氢氧化镁沉淀分离出来,应采用的方法是 验证苦卤中的氯化镁已完全转变为氢氧化镁沉淀的方法是 什么
试剂b可以选用什么溶液,该反应的化学方程式是什么, 茶韵1年前1
茶韵1年前1 -
 不分的依恋 共回答了19个问题
不分的依恋 共回答了19个问题 |采纳率78.9%分析:1、镁盐生成碱: 根据化学反应规律,盐+碱=新盐+新碱(条件:反应物是可溶性的盐和碱的溶液;生成物中有水或气体或沉淀生成.) 所以试剂a可以选用碱溶液,如氢氧化钠、氢氧化钙等溶液.2、验证苦卤中的氯化镁...1年前查看全部
- 海水经过晒盐后得到粗盐和苦卤,重结晶后的食盐中还含有硫酸钠、氯化镁、氯化钙等可溶性杂质,它们在溶液中主要以SO 4 2-
海水经过晒盐后得到粗盐和苦卤,重结晶后的食盐中还含有硫酸钠、氯化镁、氯化钙等可溶性杂质,它们在溶液中主要以SO 4 2- 、 Ca 2+ 、Mg 2+ 的形式存在,为将这些杂质离子除净,应加入过量的氯化钡、氯氧化钠、碳酸钠等物质将其转化为沉淀,过滤除去;再加入适量的盐酸,得到精盐水;最后经蒸发即得精盐。以下是某化工厂对海水进行综合利用的流程: 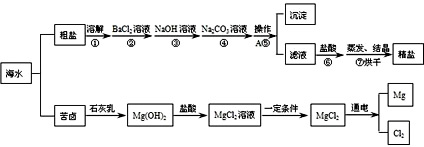
(1)在苦卤制镁的过程中加入了石灰乳(主要成分是氢氧化钙),石灰乳是用生石灰制得的,请写出制取石灰乳的化学方程式________________________。
(2)在制备精盐的过程中,氯化钡和碳酸钠溶液的添加顺序是否可以颠倒?____,理由是____________;
(3)在利用粗盐制备精盐过程的第⑥步操作中,加入适量盐酸的目的是_______________。 cqwn1年前1
cqwn1年前1 -
 shellings 共回答了17个问题
shellings 共回答了17个问题 |采纳率76.5%(1)CaO+H 2 O==Ca(OH) 2
(2)不可以;碳酸钠的作用是既除去Ca 2+ ,又除去多余的氯化钡
(3)除去多余的氢氧化钠和碳酸钠1年前查看全部
- (2011•上海模拟)海水日晒后得到的晶体是粗盐,剩余的液体称为苦卤,苦卤中除氯化钠外还含氯化镁、硫酸镁、氯化钾,在食品
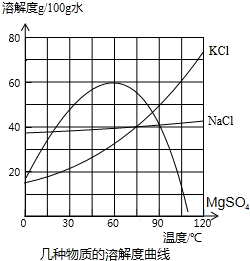 (2011•上海模拟)海水日晒后得到的晶体是粗盐,剩余的液体称为苦卤,苦卤中除氯化钠外还含氯化镁、硫酸镁、氯化钾,在食品、化工等方面有重要应用.
(2011•上海模拟)海水日晒后得到的晶体是粗盐,剩余的液体称为苦卤,苦卤中除氯化钠外还含氯化镁、硫酸镁、氯化钾,在食品、化工等方面有重要应用.
氯化镁在不同温度下的溶解度表
(1)请在溶解度曲线图上添加氯化镁的溶解度曲线温度℃ 0 60 90 120 溶解度(g/100g水) 50 60 70 80
(2)0℃时,______的溶解度最小.
(3)欲从氯化钠的饱和溶液中析出氯化钠晶体,最好采用______的方法
(4)60℃时,80g氯化镁饱和溶液中含溶质______g
(5)将60℃的苦卤继续加热蒸发,根据溶解度曲线,首先析出的晶体应是______. 凌飘飘1年前1
凌飘飘1年前1 -
 feng7er40 共回答了21个问题
feng7er40 共回答了21个问题 |采纳率90.5%(1)由表格中的氯化镁在不同温度下的溶解度表可知,各温度下的溶解度,故可在溶解度曲线图上添加氯化镁的溶解度曲线.
(2)由上图可知:0℃时,氯化钾的溶解度最小.
(3)因为氯化钠的溶解度受温度影响变化不大,故欲从氯化钠的饱和溶液中析出氯化钠晶体,最好采用蒸发溶剂的方法;
(4)60℃时,氯化镁的溶解度为60克,
则设80g氯化镁饱和溶液中含溶质的质量为x,
[x/80=
60g
160],故x=30克,
故80g氯化镁饱和溶液中含溶质30g;
(5)将60℃的苦卤继续加热蒸发,根据溶解度曲线,首先析出的晶体应是溶解度受温度影响较大的硫酸镁.
故答案为:(1)曲线如下
(2)KCl;
(3)蒸发溶剂;
(4)30;
(5)硫酸镁1年前查看全部
- 海洋约占地球表面积的71%,具有十分巨大的开发潜力.苦卤是海水提取食盐后的残液,利用苦卤可制得金属镁等
海洋约占地球表面积的71%,具有十分巨大的开发潜力.苦卤是海水提取食盐后的残液,利用苦卤可制得金属镁等
化工原料.某盐场的苦卤每100g含MgCl2 14.25g,含MgSO4 6g.试计算
(1)若使100g该苦卤中的MgCl2和MgSO4完全转化为Mg(OH)2沉淀,需要20%的NaOH溶液多少克?
(2)将上述沉淀完全转化为无水MgCl2,并在熔融状态下进行电解(化学方程式为MgCl2电解=熔融Mg+Cl2↑),可得金属镁多少克?氯气多少升(该条件小氯气密度为3.0g/L)? 秋冬的水滴1年前3
秋冬的水滴1年前3 -
 leonlv 共回答了16个问题
leonlv 共回答了16个问题 |采纳率93.8%(1)设100g苦卤中MgCl2、MgSO4完全转化为Mg(OH)2所需NaOH的质量为x、y
MgCl2+2NaOH=Mg(OH)2↓+2NaCl
95 80
14.25g x
x=12g
MgSO4+2NaOH=Mg(OH)2↓+2Na2SO4
120 80
6g Y
y=4 g
NaOH溶液的质量为(12g+4g)/20%=80g (2分)
(2)可得Mg质量为:l42.5g×24/95+6g×24/120=4.8g(2分)
生成Cl2质量为:4.8g×71/24=14.2g
则Cl2的体积为:14.2/3≈4.7 L(2分)1年前查看全部
- 如何从海水苦卤中提取大量微量元素如Br2,Au,Ag ,Pt,等等
 96446613laji1年前1
96446613laji1年前1 -
 流云888 共回答了14个问题
流云888 共回答了14个问题 |采纳率85.7%从海水苦卤中提取Br2,Au,Ag ,Pt等的方法很多,性质也根本不同,关键看你要做什么,有什么条件,形成了什么规模.1年前查看全部
- 利用苦卤,石灰乳,稀盐酸来制镁,发生的化学反应方程式?
利用苦卤,石灰乳,稀盐酸来制镁,发生的化学反应方程式?
三个方程式 wishvk1年前1
wishvk1年前1 -
 奶油化梅 共回答了23个问题
奶油化梅 共回答了23个问题 |采纳率82.6%先用苦卤和石灰乳反应,制得氢氧化镁
Ca(OH)2+MgCl2=Mg(OH)2+CaCl2
过滤得较纯的氢氧化镁
再用氢氧化镁和稀盐酸反应,得到纯的氯化镁
Mg(OH)2+2HCl=MgCl2+2H2O
在干燥的氯化氢气流中使氯化镁晶体脱水干燥(注意一定要是在干燥的氯化氢气流中,否则氯化镁晶体会变成氧化镁,氯化氢和水 方程式MgCl2·6H2O=MgO+2HCl+5H2O 条件为加热)
最后电解熔融的无水氯化镁
MgCl2=Mg+Cl2↑(条件为通电)1年前查看全部
- A、B、C、D是构成实验室中常见物质的四种元素,其中D元素是1826年一位法国科学家在研究海水制盐时发现的:他向苦卤中通
A、B、C、D是构成实验室中常见物质的四种元素,其中D元素是1826年一位法国科学家在研究海水制盐时发现的:他向苦卤中通入氯气,发现溶液颜色变深,经过进一步提取,得到了一种红棕色、有刺鼻气味的液体;C元素原子比D元素原子少1个电子层,但最外层电子数相同;A+ 和B2+ 都比C的离子少8个电子.根据以上信息回答:
写出A、B、C、D的元素符号:A B C D
试从原子结构角度分析:哪两种元素的原子最容易结合?并说明理由.
A+ 和B2+都有得电子趋势,从离子结构示意图分析,哪个更容易得到电子? 爱始于半夏1年前1
爱始于半夏1年前1 -
 leekingpig 共回答了20个问题
leekingpig 共回答了20个问题 |采纳率95%D 红棕色、有刺鼻气味的液体;D是 Br元素
C元素原子比D元素原子少1个电子层,但最外层电子数相同 同族的上一个周期
CL元素
A+ 和B2+ 都比C的离子少8个电子 A:Na B;Mg
最容易结合 金属性和非金属性最强的 Na和 Cl
Mg2+更容易 ,半径小,吸引电子能力强1年前查看全部
- Na2CO3#NaHCO3Na2CO3与NaHCO3哪一个热稳定性更强?苦卤是何物,混合还是纯净物?
 在雨中看雨停1年前1
在雨中看雨停1年前1 -
 qqjy2008 共回答了19个问题
qqjy2008 共回答了19个问题 |采纳率84.2%NaHCO3更稳定1年前查看全部
- 海洋约占地球表面积的71%,具有十分巨大的开发潜力.苦卤是海水提取食盐后的残液,利用苦卤可以制得金属镁等化工原料.如图是
 海洋约占地球表面积的71%,具有十分巨大的开发潜力.苦卤是海水提取食盐后的残液,利用苦卤可以制得金属镁等化工原料.如图是某盐场苦卤中部分成分含量柱形图.试计算:
海洋约占地球表面积的71%,具有十分巨大的开发潜力.苦卤是海水提取食盐后的残液,利用苦卤可以制得金属镁等化工原料.如图是某盐场苦卤中部分成分含量柱形图.试计算:
(1)若使100g该苦卤中的MgCl2和MgSO4完全转化为Mg(OH)2沉淀,需要熟石灰多少克?
(2)将上述沉淀完全转化为无水MgCl2,并在熔融状态下进行电解,可得金属镁多少克?氯气多少升(该条件下氯气密度为3.0g/L)? aurafrank1年前1
aurafrank1年前1 -
 20051820 共回答了20个问题
20051820 共回答了20个问题 |采纳率90%解题思路:(1)由柱状图可以知道100g苦卤中氯化镁和硫酸镁的质量;
由氯化镁和硫酸镁的质量根据与氢氧化钙反应的化学方程式可以计算出分别需要氢氧化钙的质量和需要氢氧化钙的总质量及分别生成氢氧化镁的质量和生成氢氧化镁的总质量;
(2)由氢氧化镁的质量根据与稀盐酸反应的化学方程式可以得到氯化镁的质量,进而得到金属镁和氯气的质量,结合氯气的密度可以得到氯气的体积.(1)根据柱状图可知100g苦卤中氯化镁的质量为
142.5g×
100g
1000g=14.25g
设将氯化镁转化为氢氧化镁需要氢氧化钙的质量为x,生成氢氧化镁的质量为y.
MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2
9574 58
14.25g xy
95
14.25g=
74
x=
58
y,
解之得:x=11.1g,y=8.7g
根据柱状图可知100g苦卤中硫酸镁的质量为
60g×
100g
1000g=6g
设将硫酸镁转化为氢氧化镁需要氢氧化钙的质量为z,生成氢氧化镁的质量为w.
MgSO4+Ca(OH)2=Mg(OH)2↓+CaSO4
12074 58
6g z w
120
6g=
74
z=
58
w
解之得:z=3.7g,w=2.9g
共需要氢氧化钙质量为11.1g+3.7g=14.8g
答:共需要熟石灰14.8克
(2)共生成氢氧化镁沉淀的质量为
8.7g+2.9g=11.6g
设生成金属镁的质量为m,生成氯气的质量为n.
由Mg(OH)2+2HCl=MgCl2+2H2O、MgCl2
通电
.
Mg+Cl2↑得
Mg(OH)2→MgCl2→Mg+Cl2↑
58 24 71
11.6g m n
58
11.6g=
24
m=
71
n,
解之得:m=4.8g,n=14.2g
氯气的体积为=
14.2g
3.0g/L≈4.7L
答:可得金属镁4.8g,氯气4.7L.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题主要考查有关化学方程式的计算,难度较大.解题过程中首先要对反应原理搞清楚,其次要对根据方程式进行计算的步骤熟悉.1年前查看全部
- (2007•南通)海洋约占地球表面积的71%,具有十分巨大的开发潜力.苦卤是海水提取食盐后的残液,利用苦卤可以制得金属镁
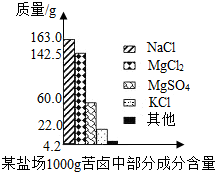 (2007•南通)海洋约占地球表面积的71%,具有十分巨大的开发潜力.苦卤是海水提取食盐后的残液,利用苦卤可以制得金属镁等化工原料.下图是我市某盐场苦卤中部分成分含量柱形图.试计算:
(2007•南通)海洋约占地球表面积的71%,具有十分巨大的开发潜力.苦卤是海水提取食盐后的残液,利用苦卤可以制得金属镁等化工原料.下图是我市某盐场苦卤中部分成分含量柱形图.试计算:
(1)若使100 g该苦卤中的MgCl2和MgSO4完全转化为Mg(OH)2沉淀,需要20% NaOH溶液多少克?
(2)将上述沉淀完全转化为无水MgCl2,并在熔融状态下进行电解,可得金属镁多少克?氯气多少升(该条件下氯气密度为3.0 g/L)? yoodoo20061年前1
yoodoo20061年前1 -
 _荆_棘_鸟_ 共回答了13个问题
_荆_棘_鸟_ 共回答了13个问题 |采纳率92.3%解题思路:(1)由柱状图可以知道100g苦卤中氯化镁和硫酸镁的质量;
由氯化镁和硫酸镁的质量根据与氢氧化钠反应的化学方程式可以计算出分别需要氢氧化钠的质量和需要氢氧化钠的总质量及分别生成氢氧化镁的质量和生成氢氧化镁的总质量;
由氢氧化钠的总质量根据氢氧化钠溶液的溶质质量分数可以计算出所需氢氧化钠溶液的质量.
(2)由氢氧化镁的质量根据与稀盐酸反应的化学方程式可以得到氯化镁的质量,进而得到金属镁的质量,结合氯气的密度可以得到氯气的体积.(1)根据柱状图可知100g苦卤中氯化镁的质量为
142.5g×[100g/1000g]=14.25g
设将氯化镁转化为氢氧化镁需要氢氧化钠的质量为x,生成氢氧化镁的质量为y.
MgCl2+2NaOH=Mg(OH)2↓+2NaCl
95 80 58
14.25g xy
[95/14.25g]=[80/x]=[58/y],x=12g,y=8.7g
根据柱状图可知100g苦卤中硫酸镁的质量为
60g×[100g/1000g]=6g
设将硫酸镁转化为氢氧化镁需要氢氧化钠的质量为z,生成氢氧化镁的质量为w.
MgSO4+2NaOH=Mg(OH)2↓+Na2SO4
120 80 58
6g z w
[120/6g]=[80/z]=[58/w],z=4g,w=2.9g
共需要氢氧化钠溶液的质量为
(12g+4g)÷20%=80g
(2)共生成氢氧化镁沉淀的质量为
8.7g+2.9g=11.6g
设生成金属镁的质量为m,生成氯气的质量为n.
由Mg(OH)2+2HCl=MgCl2+2H2O、MgCl2
通电
.
Mg+Cl2↑得
Mg(OH)2→MgCl2→Mg+Cl2↑
58 24 71
11.6g m n
[58/11.6g]=[24/m]=[71/n],m=4.8g,n=14.2g
氯气的体积为
14.2g÷3.0g/L≈4.7L
答:(1)需要20%的氢氧化钠溶液80g.
(2)可得金属镁4.8g,氯气4.7L.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题主要考查有关化学方程式的计算,难度较大.1年前查看全部
- 海水晒盐可得到粗盐和苦卤,其中苦卤是食盐的 (填"饱和"或"不饱和")溶液,理由是
 vywsol1年前3
vywsol1年前3 -
 喜欢小孩 共回答了19个问题
喜欢小孩 共回答了19个问题 |采纳率89.5%饱和溶液
海水晒盐其实就是把水分蒸发是食盐析出
只有饱和溶液才能有晶体析出1年前查看全部
- 苦卤和氧化钙制取氢氧化镁的化学方程式?
苦卤和氧化钙制取氢氧化镁的化学方程式?
其中苦卤含有NaCl MgCl2 MgSO4 KCl 给个化学方程式把
答对追分 依秋YQ1年前1
依秋YQ1年前1 -
 susanalan 共回答了18个问题
susanalan 共回答了18个问题 |采纳率94.4%CaO + H2O = Ca(OH)2
MgCl2 + Ca(OH)2 = Mg(OH)2 + CaCl21年前查看全部
- 海水提取NaCl,苦卤为什么可以直接蒸发除去
 缙云尘风1年前1
缙云尘风1年前1 -
 韩清靖 共回答了14个问题
韩清靖 共回答了14个问题 |采纳率100%因为他们蒸发需要的温度不同,苦卤是海水制盐工业的副产物,其中含有高浓度的钾、镁、溴和硫酸盐等有价值的矿物.O(∩_∩)O,希望对你有帮助,望采纳1年前查看全部
- 下列是海水综合应用中提取镁、溴的反应,属非氧化还原反应的是 A.苦卤中加入石灰乳MgCl 2 + Ca(OH) 2 =
下列是海水综合应用中提取镁、溴的反应,属非氧化还原反应的是
A.苦卤中加入石灰乳MgCl 2 + Ca(OH) 2 = CaCl 2 +Mg(OH) 2 B.苦卤中通入氯气2Br - + Cl 2 = 2Cl - + Br 2 C.氯碱工业电解食盐水2NaCl + 2H 2 O 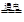 2NaOH + H 2 ↑+ Cl 2 ↑
2NaOH + H 2 ↑+ Cl 2 ↑ D.电解氯化镁MgCl 2 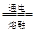 Mg + Cl 2 ↑
Mg + Cl 2 ↑ 奶油肚皮1年前1
奶油肚皮1年前1 -
 蓝蓝家 共回答了16个问题
蓝蓝家 共回答了16个问题 |采纳率87.5%A
1年前查看全部
- 工业上用苦卤为原料制碱式碳酸镁,可表示为aMgCO3·Mg(OH)2·bH2O.取4.84克碱式碳酸镁在坩埚中充分加热,
工业上用苦卤为原料制碱式碳酸镁,可表示为aMgCO3·Mg(OH)2·bH2O.取4.84克碱式碳酸镁在坩埚中充分加热,得到2.00克固体;另取4.84克碱式碳酸镁加入足量盐酸,可产生896 mL的气体(标况下).
(1)求a,b的值
 街头舞王1年前1
街头舞王1年前1 -
 yellowan 共回答了20个问题
yellowan 共回答了20个问题 |采纳率80%工业上用苦卤为原料制碱式碳酸镁,可表示为aMgCO3·Mg(OH)2·bH2O.取4.84克碱式碳酸镁在坩埚中充分加热,得到2.00克固体;另取4.84克碱式碳酸镁加入足量盐酸,可产生896 mL的气体(标况下).
(1)求a,b的值
MgCO3→CO2
1 : 1
x 0.896/22.4
x=0.04mol,3.36克
剩下的为1.48克Mg(OH)2·bH2O
aMgCO3·Mg(OH)2·bH2O →MgO
M 40
4.48 2.0
即4.48 克含镁元素0.05mol
即Mg(OH)2 0.05-0.04=0.01mol,0.58克
剩下水0.54克,0.03mol
即分子式4MgCO3·Mg(OH)2·3H2O
a=4,b=3 .1年前查看全部
- 海洋约占地球表面积的71%,具有十分巨大的开发潜力。苦卤是海水提取食盐后的残液,利用苦卤可以制得金属镁等化工原料。下图是
海洋约占地球表面积的71%,具有十分巨大的开发潜力。苦卤是海水提取食盐后的残液,利用苦卤可以制得金属镁等化工原料。下图是我市某盐场苦卤中部分成分含量柱形图。试计算: 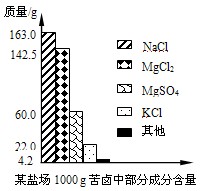
(1)若使100g该苦卤中的MgCl 2 和MgSO 4 完全转化为Mg(OH) 2 沉淀,需要20%NaOH溶液多少克?
(2)将上述沉淀完全转化为无水MgCl 2 ,并在熔融状态下进行电解,可得金属镁多少克?氯气多少升(该条件下氯气密度为3.0 g/L)? 靓是最基本的1年前1
靓是最基本的1年前1 -
 MaggieLJ 共回答了25个问题
MaggieLJ 共回答了25个问题 |采纳率84%1年前查看全部
- 氧化钙与苦卤中的什么成分反应生产氢氧化镁
 怎么搞得1年前1
怎么搞得1年前1 -
 uu丫 共回答了21个问题
uu丫 共回答了21个问题 |采纳率76.2%海水制盐剩下的苦卤主要成分是氯化镁溶液,氧化钙先与苦卤水反应生成氢氧化钙,氢氧化钙与氯化镁反应生成氢氧化镁1年前查看全部
- 工业上从海水中提取溴时,首先通氯气于pH为3.5左右晒盐后留下苦卤(富含Br-离子)中置换出Br2.
工业上从海水中提取溴时,首先通氯气于pH为3.5左右晒盐后留下苦卤(富含Br-离子)中置换出Br2.
为什么调节pH至3.5可提高Cl2的利用率? 海鸥HLB1年前1
海鸥HLB1年前1 -
 ywzhoujw 共回答了13个问题
ywzhoujw 共回答了13个问题 |采纳率100%蒸馏得到的产物是液溴和溴水的混合物.
为什么可以用分液的方法进行分离?液溴在哪层
液溴的密度大于溴水,在下层.1年前查看全部
- 关于利用苦卤,石灰乳,稀盐酸可制得应用于飞机制造业的金属镁
关于利用苦卤,石灰乳,稀盐酸可制得应用于飞机制造业的金属镁
利用苦卤,石灰乳,稀盐酸可制得应用于飞机制造业的金属镁,其中发生反应的化学方程式是?一共三个化学式 tanggang13141年前1
tanggang13141年前1 -
 jmd007 共回答了18个问题
jmd007 共回答了18个问题 |采纳率94.4%MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2
Mg(OH)2+2HCl=MgCl2+2H2O
MgCl2(熔融)=电解 Mg+Cl2↑1年前查看全部
大家在问
- 1数学口算的3.5.6.7.8.9.10.11页怎么写
- 2使用动滑轮为什么不能改变用力方向?
- 3如图,△ABC是等边三角形,∠1=∠2=∠3,AD=BE=CF,试说明△DEF是等边三角形
- 4读书 书带给了我们人类许多乐趣,也让我们懂得了许多道理.书就是大海,而我是小鱼,在大海中自由自在地遨
- 5关于高中量子论的一些概念问题一直困扰我诶= =说电子跃迁的半径啥的,是把原子核当成中心吗?为什么还有原子核的跃迁半径呢?
- 60.5,1,2,5,17,107,( ) 这是什么规律
- 7把home、near、where换其中一个字母变成另一个单词.
- 8把“一些运动包”翻译成中文,要两种回答
- 9煤矿井下二氧化碳浓度达到多少超标?
- 10在豌豆杂交实验中,高茎与矮茎杂交,F右中高茎和矮茎的比为y左y:右yy,上述实验结果出现的根本原因是( )
- 11普罗米修斯课文中的四字词语(4个)四对课文中的近义词【人教版】
- 12修改病句 笔记本电脑显示了快捷、稳定、方便而成为奥运新闻报道的重要工具
- 131/888888怎么求
- 14解一元一次方程的步骤是什么?
- 15直角三角形直角边为1.5和8,求另一条边和另外2个角的度数(求公式)