火法炼铜可以从黄铜矿(CuFeS2)或辉铜矿(Cu2S)中提取铜,发生如下反应:
 moon_男孩2022-10-04 11:39:541条回答
moon_男孩2022-10-04 11:39:541条回答
火法炼铜可以从黄铜矿(CuFeS2)或辉铜矿(Cu2S)中提取铜,发生如下反应:
①2CuFeS2+4O2
Cu2S+3SO2+2FeO
②2Cu2S+3O2
2Cu2O+2SO2
③2Cu2O+Cu2S
6Cu+SO2↑
下列说法正确的是( )
A. 反应②、③中,Cu2S都只做还原剂
B. 1mol CuFeS2生成1molCu,理论上消耗2.5mol O2
C. 1mol Cu2S和O2反应生成2molCu转移的电子数为4mol
D. 反应①中,共转移的电子数为16mol,CuFeS2中铜元素的化合价为+2
①2CuFeS2+4O2
| ||
②2Cu2S+3O2
| ||
③2Cu2O+Cu2S
| ||
下列说法正确的是( )
A. 反应②、③中,Cu2S都只做还原剂
B. 1mol CuFeS2生成1molCu,理论上消耗2.5mol O2
C. 1mol Cu2S和O2反应生成2molCu转移的电子数为4mol
D. 反应①中,共转移的电子数为16mol,CuFeS2中铜元素的化合价为+2

已提交,审核后显示!提交回复
共1条回复
 bgszcj 共回答了14个问题
bgszcj 共回答了14个问题 |采纳率100%- 解题思路:A.②中S元素的化合价升高,O元素的化合价降低;③中,Cu2S中Cu元素的化合价降低,S元素的化合价升高;
B.由反应可知,存在6Cu~3Cu2S~6CuFeS2~15O2,以此分析;
C.Cu元素由+1价降低为0,O元素的化合价降低,而S元素的化合价由-2价升高为+4价;
D.反应①中,Cu元素的化合价降低,O元素的化合价降低,S元素的化合价升高.A.②中S元素的化合价升高,O元素的化合价降低,Cu2S只做还原剂;③中,Cu2S中Cu元素的化合价降低,S元素的化合价升高,Cu2S既是还原剂又是氧化剂,故A错误;
B.由反应可知,存在6Cu~3Cu2S~6CuFeS2~15O2,则1mol CuFeS2生成1molCu,理论上消耗2.5molO2,故B正确;
C.Cu元素由+1价降低为0,O元素的化合价降低,而S元素的化合价由-2价升高为+4价,则转移的电子数为1mol×[4-(-2)]=6mol,故C错误;
D.反应①中,CuFeS2中铜元素的化合价为+2,Cu元素的化合价降低,O元素的化合价降低,S元素的化合价由-2价升高为+4价,2molCuFeS2反应转移电子为24mol,故D错误;
故选B.点评:
本题考点: 氧化还原反应的计算;氧化还原反应.
考点点评: 本题考查氧化还原反应及计算,明确反应中的元素的化合价变化是解答本题的关键,注意电子守恒、原子守恒的应用,选项D为易错点,题目难度较大. - 1年前
相关推荐
- 湿法炼铜与火法炼铜有什么区别
 qiao08241年前2
qiao08241年前2 -
 英格兰ll 共回答了15个问题
英格兰ll 共回答了15个问题 |采纳率93.3%定义不同
火法冶金 利用高温从矿石中提取金属或其化合物的冶金过程.此过程没有水溶液参加,故又称为干法冶金.
湿法冶金 利用某种溶剂,借助化学反应(包括氧化、还原、中和、水解及络合等反应),对原料中的金属进行提取和分离的冶金过程.又称水法冶金.
湿法炼铜一船适于低品位的氧化铜,生产出的精铜称为电积铜.
火法和湿法两种工艺的特点 比较火法和湿法两种铜的生产工艺,有如下特点:
(1)后者的冶炼设备更简单,但杂质含量较高,是前者的有益补充.
(2)后者有局限性,受制于矿石的品位及类型.
(3)前者的成本要比后者高.1年前查看全部
- 为什么Cu2S和O2的反应叫火法炼铜?而Fe和CuSO4的反应叫做湿法炼铜?
 panel1年前1
panel1年前1 -
 爱之风铃 共回答了28个问题
爱之风铃 共回答了28个问题 |采纳率89.3%因为Cu2S和O2的反应要用火加热,所以叫火法炼铜.Fe和CuSO4的反应需要在溶液中进行,所以叫湿法炼铜.1年前查看全部
- Cu2S是火法炼铜的重要原料之一
Cu2S是火法炼铜的重要原料之一
Cu2S是火法炼铜一种重要的原料,下面是由Cu2S冶炼铜及制取CuSO4·5H2O的流程图:
⑴Cu2S中铜元素的化合价为,火法炼铜的反应原理是(用化学方程式表示).
⑵Cu2O,CuO加入足量稀硫酸得到的体系A中看到溶液呈蓝色,且有红色物质生成,
请写出生成红色物质的离子方程式:.
⑶若将A中单质反应,操作加入试剂最好是 .
A. 加入适量的NaNO3 B.适量的 HNO3 C.适量的H2O2
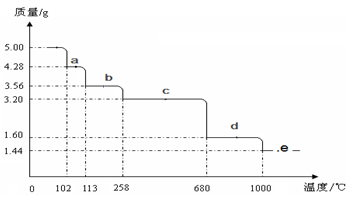
⑷若B溶液的体积为0.2L,电解B溶液一段时间后溶液的pH值由2变为1(体积变化忽略不计),此时电解过程中转移电子数的物质的量是.
⑸取5.0 g胆矾样品逐渐升高温度使其分解,分解过程的热重曲线如下图所示:通过计算确定258℃时发生反应的化学方程式,e点的化学式(计算过程略去).答案我知道,不用说答案,我只是第五问不明白,谁给我讲一下abcde都是啥,
 aggie1年前1
aggie1年前1 -
 gg梁 共回答了18个问题
gg梁 共回答了18个问题 |采纳率72.2%胆矾相对分子质量250,5.0g胆矾计0.02mol
根据这个可以算出a点处相对分子质量214,相应物质为CuSO4·3H2O
同理得到b点处物质为CuSO4·H2O(相对分子质量178)
c点处物质为CuSO4(相对分子质量160)
d点处物质为CuO(相对分子质量80)
从d到e说明CuO开始分解,分解产物是Cu2O,与图中数据吻合(相对分子质量144,注意Cu2O只有0.01mol)1年前查看全部
大家在问
- 1三个平面两两相交,为什么它们的公共直线可以有1条或3条?
- 21.5换算成分数
- 3边长是______米的正方形土地面积是1平方千米.
- 4如何求出二次函数2x^2+x-4的近似根
- 5材料概括分析题:阅读下面的文字,完成后面题目。(15分)
- 6火山喷发时的熔岩从何而来.既然说陆地是漂浮在海洋上的,而火山喷发出的熔岩来自地心,陆地与地心又有海洋隔着,那陆地上火山喷
- 7下图中△ABC被分为四块,其中三块的面积分别为4,6,12平方厘米,求四边形AEOF的面积.
- 8已知数列{an}的前n项和Sn=-n2+2kn(k∈N*),且Sn的最大值为4.
- 9甲、乙两车的速度比是5:6,所行路程比为3:4,则所用时间比是( ). 请详述理由和过程在给分
- 10CaCl2(CaCO3)除杂
- 11(1/2)初中物理,将刻度尺斜插入水中,从水面上看去,水中的尺子的刻度情况: 1变得疏了 2变得密了 3一...
- 12“你看,那浅浅的天河”这句诗的逗号去掉后表达效果会有变化吗?为什么?
- 13已知a2-4a+b2-[b/2]+[65/16]=0,则a2-4b=______.
- 14一张长方形铁皮,剪下两个圆和一块长方形,可以做成一个圆柱体,圆柱的直径是4分米,铁皮的面积是多少
- 15|x-3|与|2x-7|互为相反数,求x+y+3的值
