(11分)为探究实验室制乙烯及乙烯和溴水的加成反应。甲同学设计了如图所示的实验装置,并进行了实验。当温度升至170℃左右
 654zhang2022-10-04 11:39:541条回答
654zhang2022-10-04 11:39:541条回答| (11分)为探究实验室制乙烯及乙烯和溴水的加成反应。甲同学设计了如图所示的实验装置,并进行了实验。当温度升至170℃左右时,有大量气体产生,产生的气  体通入溴水中,溴水的颜色迅速褪去。甲同学认为达到了实验目的。 体通入溴水中,溴水的颜色迅速褪去。甲同学认为达到了实验目的。 乙同学仔细考察了甲同学的整个实验过程,发现当温度升到100℃左右时,无色液体开始变色,到160℃左右时,混合液全呈黑色,超过170℃后生成气体速度明显加快,生成的气体有刺激性气味。由此他推出,产生的气体中应有杂质,可能影响乙烯的检出,必须除去。据此回答下列问题: ⑴写出甲同学实验中两个反应的化学方程式: 、 。 ⑵乙同学观察到的黑色物质是 ,刺激性气体是 。乙同学认为刺激性气体的存在就不能认为溴水褪色是乙烯的加成反应造成的。原因是(用化学方程表示):___________ __________。 ⑶丙同学根据甲乙同学的分析,认为还可能有CO、CO 2 两种气体产生。为证明CO存在,他设计了如下过程(该过程可把实验中产生的有机产物除净):发现最后气体经点燃是蓝色火焰,确认有一氧化碳。  ①设计装置a的作用是 。 ②浓溴水的作用是 , 稀溴水的作用是 。 |

已提交,审核后显示!提交回复
共1条回复
 javamomo 共回答了16个问题
javamomo 共回答了16个问题 |采纳率100%- (11分)⑴ CH 3 CH 2 OH CH 2 =CH 2 ↑+H 2 O (2分) CH 2 =CH 2 +Br 2 →Br-CH 2 CH 2 -Br (2分)⑵ C(1分),SO 2 (1分),Br 2 +SO 2 +2H 2 O=2HBr+H 2 SO 4 (2分) ⑶①安全装置,...
- 1年前
相关推荐
- 为了探究弹簧的伸长量或压缩量与其所受弹力间的关系,小刚和小明两位同学利用课外活动时间到学校探究实验室分别设计并进行了如图
 为了探究弹簧的伸长量或压缩量与其所受弹力间的关系,小刚和小明两位同学利用课外活动时间到学校探究实验室分别设计并进行了如图甲、乙所示两组实验.甲图中是将弹簧的一端固定在水平木板左端,另一端用细绳绕过定滑轮挂钩码,旁边附有一竖直刻度尺,分别测出挂不同个数钩码(每一钩码质量为50g)时绳上一定点P对应刻度尺上的刻度;乙图是将同一弹簧竖直放在桌面上,上端放一小托盘(托盘质量为50g),向盘里加放钩码,也在旁边竖直放一刻度尺,测出托盘对应的刻度.实验的数据见下表(g=10m/s2).(图为示意图)
为了探究弹簧的伸长量或压缩量与其所受弹力间的关系,小刚和小明两位同学利用课外活动时间到学校探究实验室分别设计并进行了如图甲、乙所示两组实验.甲图中是将弹簧的一端固定在水平木板左端,另一端用细绳绕过定滑轮挂钩码,旁边附有一竖直刻度尺,分别测出挂不同个数钩码(每一钩码质量为50g)时绳上一定点P对应刻度尺上的刻度;乙图是将同一弹簧竖直放在桌面上,上端放一小托盘(托盘质量为50g),向盘里加放钩码,也在旁边竖直放一刻度尺,测出托盘对应的刻度.实验的数据见下表(g=10m/s2).(图为示意图)
从上表的数据分析可以得出弹簧伸长量(或压缩量)x与所受拉力(或压力)F的关系可以表示成 (均用符号)______;该弹簧的劲度系数(伸长或压缩单位长度所需要的力)为______N/m.实验甲 实验乙 钩码数 P点对应刻度/cm 钩码数 托盘对应刻度/cm 0 10.00 0 20.00 2 12.50 1 18.75 4 15.00 2 17.50 6 17.50 3 16.25  我们村1年前1
我们村1年前1 -
 未定式 共回答了15个问题
未定式 共回答了15个问题 |采纳率93.3%解题思路:在实验甲中,所挂钩码的重力等于弹簧的弹力,P点对应刻度的变化可知弹簧的伸长量.在实验乙中,托盘和钩码的重力之和等于弹簧的弹力,通过对应刻度的变化可知压缩量的变化.从实验甲中可以看出,弹力每增加1N,弹簧的伸长量增加2.5cm.从实验乙可以看出,弹力每增加0.5N,弹簧的压缩量增加0.25cm.可知弹力与形变量成正比,即F=kx.k=
F
x=
△F
△x=40N/m.
故本题答案为:F=kx,40.点评:
本题考点: 探究弹力和弹簧伸长的关系.
考点点评: 解决本题的关键能够从表格数据中发现弹力与形变量的关系,掌握胡克定律F=kx.1年前查看全部
- 甲、乙两同学为了探究实验室中久置的氢氧化钠固体是否变质,进行了如下实验。请与他们一起完成探究活动。
甲、乙两同学为了探究实验室中久置的氢氧化钠固体是否变质,进行了如下实验。请与他们一起完成探究活动。
【提出问题】氢氧化钠固体是否变质。
【实验探究】甲、乙两同学分别设计了不同的方案并加以实验。甲同学的方案及实验:
乙同学的方案及实验: 
(1)乙同学认为甲同学的结论不科学,其理由是_________________;
(2)乙同学的实验中,观察到的现象A应为____________________,该反应的化学方程式为___________________,氢氧化钠固体变质的原因是(用化学方程式表示)________________________;
【拓展应用】氢氧化钠固体应当密封保存;
(3)若要除去上述变质的氢氧化钠溶液中的杂质,应加入适量的________(填化学式)溶液而除去。 wxdcllong1年前1
wxdcllong1年前1 -
 woaisweet 共回答了18个问题
woaisweet 共回答了18个问题 |采纳率94.4%(1)碳酸钠溶液也显碱性(碳酸钠溶液的pH>7)
(2)有白色沉淀产生;Na 2 CO 3 +BaCl 2 ==BaCO 3 ↓+2NaCl;CO 2 +2NaOH==Na 2 CO 3 +H 2 O
(4)Ca(OH) 21年前查看全部
- 某化学实验活动小组的同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验。参与他们进行的探究活动:
某化学实验活动小组的同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验。参与他们进行的探究活动:
【提出问题】久置氢氧化钠固体的成分是什么?
【猜想与假设】
猜想Ⅰ:全部是NaOH;
猜想Ⅱ:全部是Na 2 CO 3 ;猜想Ⅲ: 。
【实验与探究】
(1)分析:暴露在空气中的氢氧化钠会变质,变质原因是(用化学方程式表示)______________________
(2)实验如下:实验操作步骤 实验现象 结论及解释 步骤一:取少量固体样品于试管中,加蒸馏水完全溶解,然后加入足量的_________。 实验过程中始终没有气泡产生。
则证明猜想 成立。步骤二:另取少量固体样品于试管中,加蒸馏水完全溶解,然后滴加氯化钡溶液。
实验过程中产生
则证明猜想Ⅱ或Ⅲ成立。此过程中发生反应的化学方程式为
_____________________
(3)为了进一步的验证猜想结果,小明同学提出如下实验方案:继续步骤二的实验,过滤,然后向滤液中滴加无色酚酞试液,若酚酞变红,则猜想_________成立;若酚酞不变红,则猜想______成立。
小华同学立即对小明同学的方案提出了质疑,通过查阅资料知道,氯化钡溶液呈中性,不能使无色酚酞试液变红,但碳酸钠溶液呈 性(填“酸”或“碱”),能使酚酞变红,因此他认为该方案的操作步骤中应该改进的是 。 当上131年前1
当上131年前1 -
 笑颜蓝淼 共回答了17个问题
笑颜蓝淼 共回答了17个问题 |采纳率100%NaOH和Na 2 CO 3 的混合物
(1)2NaOH + CO 2 = Na 2 CO 3 + H 2 O
(2)稀盐酸 Ⅰ 白色沉淀 Na 2 CO 3 +BaCl 2 =BaCO 3 ↓+2NaCl
(3)Ⅲ Ⅱ 碱 滴加过量氯化钡溶液
1年前查看全部
- 兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验。请你与他们一起完成以下探究活动:
兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验。请你与他们一起完成以下探究活动:

【对固体猜想】
猜想工:全部是NaOH;
猜想Ⅱ:全部是Na 2 CO 3 ;
猜想Ⅲ:是NaOH和Na 2 CO 3 混合物。
【实验和推断】
(1)若现象a为有气泡产生,则加入的A溶液是 ,说明氢氧化钠已经变质,有气泡产生反应的化学方程式是 。
(2)若A是CaCl 2 溶液,当实验现象a为 ,现象b为 ,则猜想Ⅱ成立。
【反思】久置的氢氧化钠变质的原因是(用化学方程式表示) 。 禅隐1年前1
禅隐1年前1 -
 75702260 共回答了10个问题
75702260 共回答了10个问题 |采纳率90%(1)盐酸 Na 2 CO 3 +2HCl=2NaCl+H 2 O+CO 2 ↑(或稀H 2 SO 4 等酸及其对应的化学方程式)
(2)有白色沉淀产生 无色酚酞不变色
【反思】CO 2 +2NaOH=Na 2 CO 3 +H 2 O
1年前查看全部
- 某小组为探究实验室制取氢气的方案,分别用等质量的金属A、B跟质量相同、溶质质量分数相同的稀硫酸反应,反应生成氢气的质量与
某小组为探究实验室制取氢气的方案,分别用等质量的金属A、B跟质量相同、溶质质量分数相同的稀硫酸反应,反应生成氢气的质量与时间的关系如图所示.分析图象得到的下列结论中,不合理的是(已知A、B在生成物中均显+2价)( )
 A. 相对原子质量A=B
A. 相对原子质量A=B
B. 反应结束后生成氢气的质量A=B
C. 金属的活动性A<B
D. 可能是A、B均反应完,硫酸有剩余 59665881年前1
59665881年前1 -
 bpwwemn 共回答了11个问题
bpwwemn 共回答了11个问题 |采纳率100%解题思路:观察金属和酸溶液反应的图象,进行分析可以得出:①得到的氢气的多少②金属的活动性强弱:反应过程需要的时间越短说明该金属的活动性越强.A、如果参加反应的金属均反应完,由于A、B在生成物中均显+2价,生成氢气的质量相等,那么相对原子质量A=B,故A合理;B、由图象可知,反应结束后生成氢气的质量A=B,故B合理;C、由图象可知,相同的时间内,A放出的氢...
点评:
本题考点: 金属活动性顺序及其应用;酸的化学性质;根据化学反应方程式的计算.
考点点评: 主要考查了金属和酸溶液的反应的图象从中可以得到什么样的信息,从而培养学生分析问题、解决问题的能力,加强学生对金属活动性顺序的理解.1年前查看全部
- 小组的同学为了探究实验室的一种黑色粉末和一瓶标签破损的无色溶液(如图)可能是什么物质,大胆猜想并设计实验进行验证,请你参
小组的同学为了探究实验室的一种黑色粉末和一瓶标签破损的无色溶液(如图)可能是什么物质,大胆猜想并设计实验进行验证,请你参与他们的探究.
发现问题:当把黑色粉末与无色溶液混合时,立即产生气泡.
查阅资料:初中化学实验室常见的黑色粉末有CuO、MnO 2 、Fe 3 O 4 、铁粉、炭粉等.
提出假设:黑色粉末是______,无色溶液是______.(只写一种假设)
设计实验:①向盛有少许黑色粉末的试管中加入适量试剂瓶中的无色溶液;②用试管收集气体;③检验气体(写出操作方法)______.
实验现象:______.
实验结论:(1)黑色粉末与无色溶液混合时发生反应的化学方程式是______;
(2)此气体是______,原假设______.
 hfivew1年前1
hfivew1年前1 -
 小秀的玫瑰 共回答了19个问题
小秀的玫瑰 共回答了19个问题 |采纳率100%标签的信息告诉我们溶液中溶质的一个微粒中含有两个氢原子,且黑色粉末CuO、MnO 2 、Fe 3 O 4 、铁粉、炭粉中有一种能与无色液体混合后生成气体,符合条件的常见无色液体有双氧水(H 2 O 2 )和稀硫酸(H 2 SO 4 ),其中黑色粉末二氧化锰与双氧水混合能放出氧气,可用带火星的木条来检验;黑色粉末铁粉能与稀硫酸反应生成氢气,可用燃着的木条来检验,若实验结论和理论结果一致,假设成立.
故答案为:
假设一:
[提出假设]二氧化锰(或MnO 2 );双氧水(或H 2 O 2 )
[设计实验]排水法(或向上排空气法);用带火星的木条伸入试管中
[实验现象]带火星的木条复燃
[实验结论]①氧气(或O 2 );成立
假设二:
[提出假设]:铁粉(或Fe)稀硫酸(或稀H 2 SO 4 )
[设计实验]排水法(或向下排空气法); 把燃着的木条移近试管口
[实验现象]气体燃烧,火焰呈淡蓝色
[实验结论]①氢气(或H 2 ); 成立.1年前查看全部
- (2014•德州一模)某化学实验活动小组的同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验.请你参与他们进行
(2014•德州一模)某化学实验活动小组的同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验.请你参与他们进行的探究活动:
【提出问题】久置氢氧化钠固体的成分是什么?
【猜想与假设】
猜想Ⅰ:全部是NaOH;
猜想Ⅱ:全部是Na2CO3;
猜想Ⅲ:______.
【实验与探究】
(1)实验如下:
(2)为了进一步的验证猜想结果,小明同学提出如下实验方案:继续步骤二的实验,过滤,然后向滤液中滴加无色酚酞试液,若酚酞变红,则猜想Ⅲ成立;若酚酞不变红,则猜想Ⅱ成立.实验操作步骤 实验现象 结论及解释 步骤一:取少量固体样品于试管中,加蒸馏水完全溶解,然后加入足量的稀盐酸. 实验过程中始终没有气泡产生.
则证明猜想______成立.步骤二:另取少量固体样品于试管中,加蒸馏水完全溶解,然后滴加氯化钡溶液.
实验过程中产生______.则证明猜想Ⅱ或Ⅲ成立.此过程中发生反应的化学方程式为______.
小华同学立即对小明同学的方案提出了质疑,通过查阅资料知道,氯化钡溶液呈中性,不能使无色酚酞试液变红,但碳酸钠溶液呈______性(填“酸”或“碱”),能使酚酞变红,因此他认为该方案的操作步骤中应该改进的是______.
【反思与交流】久置的固体氢氧化钠变质的原因是(用化学方程式表示)______. 凌晨74801年前1
凌晨74801年前1 -
 shx_998 共回答了15个问题
shx_998 共回答了15个问题 |采纳率86.7%解题思路:【猜想与假设】氢氧化钠若变质,其产物为碳酸钠,所以可以据此结合题中的猜想完成解答;
【实验与探究】(1)碳酸钠可以和稀盐酸反应生成气体,而氢氧化钠和稀盐酸反应时没有明显现象,氯化钡溶液和碳酸钠反应生成白色沉淀,可以据此解答该题;
(2)碳酸钠溶液与氢氧化钡溶液反应生成了氢氧化钠呈碱性,可以使酚酞变红,所以为了防止反应生成的氢氧化钠干扰实验应该加入过量的氯化钡溶液,可以据此进行解答;
【反思与交流】氢氧化钠溶液变质是由于和空气中的二氧化碳发生反应生成了碳酸钠的缘故,可以据此写出该反应的化学方程式.【猜想与假设】氢氧化钠若变质,其产物为碳酸钠,若氢氧化钠部分变质,则该固体为氢氧化钠和碳酸钠混合物;
【实验与探究】(1)碳酸钠可以和稀盐酸反应生成气体,所以若没有明显现象,则该固体中没有碳酸钠,即只有氢氧化钠,即猜想Ⅰ成立;
氯化钡溶液和碳酸钠反应生成白色沉淀碳酸钡和氯化钠,所以若观察到产生了白色沉淀,则说明在该固体中含有碳酸钠,即猜想Ⅱ或猜想Ⅲ成立;该化学方程式为:BaCl2+Na2CO3═BaCO3↓+2NaCl;
(2)通过查阅资料知道,氯化钡溶液呈中性,不能使无色酚酞试液变红,但碳酸钠溶液呈碱性,能使酚酞变红;而碳酸钠溶液与氢氧化钡溶液反应生成了氢氧化钠,可以是酚酞变红,所以为了防止碳酸钠干扰实验应该将步骤二中的氯化钡溶液改为加入过量的氯化钡溶液;
【反思与交流】氢氧化钠溶液变质是由于和空气中的二氧化碳发生反应生成了碳酸钠的缘故,该反应的化学方程式为:2NaOH+CO2═Na2CO3+H2O.
故答案为:
【猜想与假设】猜想Ⅲ:NaOH和Na2CO3
【实验与探究】(1)
实验操作步骤 实验现象 结论及解释
Ⅰ
白色沉淀 BaCl2+Na2CO3═BaCO3↓+2NaCl(2)碱; 滴加过量的氯化钡溶液;
【反思与交流】CO2+2NaOH═Na2CO3+H2O.点评:
本题考点: 实验探究物质的组成成分以及含量;证明碳酸盐;碱的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 在检验氢氧化钠是否是部分变质与检验是否变质是有区别的,检验变质只需用盐酸就可以了,而检验部分变质,还要检验是否有氢氧化钠,常用氯化钙溶液或是氯化钡溶液来进行检验.1年前查看全部
- 小红同学想探究实验室中碳酸钙和盐酸制取二氧化碳后废液中溶质的成分,请你一同参与探究并回答横线上的问题:
小红同学想探究实验室中碳酸钙和盐酸制取二氧化碳后废液中溶质的成分,请你一同参与探究并回答横线上的问题:
【提出问题】废液中的溶质是什么物质?
【作出猜想】小红认为废液中溶质只有CaCl2.
【查阅资料】CaCl2溶液呈中性.
【实验与结论】
(1)分别取少量该废液和CaCl2溶液加入到两支试管中,并向其中分别滴入无色酚酞试液做对比试验,结果两支试管中溶液均无色,于是小红认为自己的猜想是正确的.
(2)你认为小红的实验______(填“能”或“不能”)证明她的猜想,理由是______.
(3)如果要证明你的猜想是正确的,你选择______(填字母:A、石蕊试液 B、氢氧化钠溶液 C、稀盐酸 )来代替酚酞试液,理由是______.
(4)若实验证明了剩余的废液中有盐酸和氯化钙,向废液中加入过量的______,反应完成后过滤就可得到只含CaCl2一种纯质的溶液. yuanliling1年前1
yuanliling1年前1 -
 feiming2250 共回答了14个问题
feiming2250 共回答了14个问题 |采纳率92.9%解题思路:(2)显中性或显酸性的溶液不能使酚酞试液变色;
(3)显中性的溶液不能使石蕊试液变色,显酸性的溶液能使石蕊试液变红色,显碱性的溶液能使石蕊试液变蓝色;
(4)碳酸钙不溶于水,能和稀盐酸反应生成氯化钙、水和二氧化碳.(2)小红的实验不能证明她的猜想,理由是:即使废液中含有稀盐酸,也不能使酚酞试液变色,因此两支试管中溶液均无色,也不能说明废液中一定不含有稀盐酸.
故填:不能;稀盐酸不能使酚酞试液变色.
(3)因为氯化钙溶液显中性,不能使石蕊试液变色,而稀盐酸显酸性,能使石蕊试液变红色,因此向两支试管中分别滴加石蕊试液时,可以判断废液中是否含有稀盐酸.
故填:A;显中性的溶液不能使石蕊试液变色,显酸性的溶液能使石蕊试液变红色.
(4)向废液中加入过量的碳酸钙时,其中的盐酸和碳酸钙反应生成氯化钙、水和二氧化碳,反应完成后过滤就可得到只含氯化钙溶质的溶液.
故填:碳酸钙.点评:
本题考点: 实验探究物质的组成成分以及含量;酸的化学性质;盐的化学性质.
考点点评: 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.1年前查看全部
- 兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验.
兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验.

请你与他们一起完成以下探究活动:
对固体猜想:
猜想Ⅰ:全部是NaOH;
猜想Ⅱ:全部是Na2CO3;
猜想Ⅲ:是NaOH和Na2CO3混合物
实验和推断:
(1)若现象a为有气泡产生,则加入的A溶液是______,说明氢氧化钠已经变质,有气泡产生的化学反应的化学方程式是______.
(2)若A是Ca(OH)2溶液,现象a有白色沉淀,现象b为无色酚酞试液变红色,则白色沉淀为______(填化学式),该实验______(填“能”或“不能”)说明样品中有NaOH.
(3)若A是CaCl2溶液,当实验现象a为______,现象b为______,则猜想Ⅱ成立.
反思:
(1)久置的氢氧化钠变质的原因是(用化学反应方程式表示)______.
(2)在实验室里氢氧化钠需要密封保存.药品密封保存的原因很多,请你写出浓盐酸需要密封保存的原因______. a26700061年前1
a26700061年前1 -
 xiaoao 共回答了14个问题
xiaoao 共回答了14个问题 |采纳率85.7%解题思路:根据氢氧化钠的性质可知,氢氧化钠易于空气中的二氧化碳反应生成了碳酸钠和水.根据碳酸钠与酸、氢氧化钙、氯化钙的反应,分析实验的现象,书写反应的方程式、判断变质的情况等;根据浓盐酸的挥发性分析保存的方法.由氢氧化钠的性质可知,氢氧化钠易于空气中的二氧化碳反应生成了碳酸钠和水.
实验和推断:
(1)由于碳酸钠与酸反应生成了二氧化碳气体.所以,若现象a为有气泡产生,则加入的A溶液是盐酸(或硫酸),说明氢氧化钠已经变质,有气泡产生的化学反应的化学方程式是Na2CO3+2HCl═2NaCl+H2O+CO2↑;
(2)由于碳酸钠与Ca(OH)2溶液反应生成了碳酸钙沉淀和氢氧化钠,若A是Ca(OH)2溶液,现象a有白色沉淀,现象b为无色酚酞试液变红色,则白色沉淀为CaCO3,由于反应生成了氢氧化钠,该实验不能说明样品中有NaOH;
(3)若A是CaCl2溶液,氯化钙与碳酸钠反应生成了碳酸钙沉淀和和氯化钠,所以,当实验现象a为:有白色沉淀 产生,氯化钠溶液呈中性,所以,现象b为不变色,则猜想Ⅱ成立.
反思:
(1)久置的氢氧化钠变质的原因是氢氧化钠与空气中的二氧化碳反应,反应的方程式是:2NaOH+CO2=Na2CO3+H2O;
(2)在实验室里浓盐酸需要密封保存的原因是:浓盐酸易挥发.
故答为:实验和推断:(1)盐酸(或硫酸),Na2CO3+2HCl═2NaCl+H2O+CO2↑;(2)CaCO3,不能;(3)产生白色沉淀,不变色;反思:(1)2NaOH+CO2=Na2CO3+H2O;(2)浓盐酸易挥发.点评:
本题考点: 药品是否变质的探究;碱的化学性质.
考点点评: 本考点考查了氢氧化钠在空气中的变质情况,还考查了化学方程式的书写.实验探究题包括实验方法和过程的探究,实验结论和实验规律的探究等.本题通过实验资料和实验分析,得到了正确的结论,属于结论性探究.同学们要具体分析,综合掌握.1年前查看全部
- 兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验。请你与他们一起完成以下探究活动:
兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验。请你与他们一起完成以下探究活动:
【对固体猜想】猜想Ⅰ:全部是NaOH;猜想Ⅱ:全部是Na 2 CO 3 ;猜想Ⅲ:是NaOH和Na 2 CO 3 混合物。
【实验和推断】
(1)若现象a为有气泡产生,则加入的A溶液是________,说明氢氧化钠已经变质,有气泡产生的反应的化学方程式是______________。
(2)若A是Ca(OH) 2 溶液,现象a有白色沉淀,现象b为无色酚酞试液变红色,则白色沉淀为______(填化学式),有沉淀产生的反应的化学方程式是________________。该实验_______(填“能”或“不能”)说明样品中有NaOH。若“不能”说明理由____________。
(3)若A是CaCl 2 溶液,当实验现象a为______________,现象b为______________,则猜想Ⅱ成立。
(4)请设计一个实验证明猜想III成立(不能运用上面出现过的试剂),___________________。
【反思】久置的氢氧化钠变质的原因是(用化学方程式表示)_________________。 paopaomo1年前1
paopaomo1年前1 -
 sunnyxin1007 共回答了15个问题
sunnyxin1007 共回答了15个问题 |采纳率100%(1)盐酸;Na 2 CO 3 +2HCl==2NaCl+H 2 O+CO 2 ↑(或稀H 2 SO 4 等酸及其对应的化学方程式)
(2)CaCO 3 ;Ca(OH) 2 +Na 2 CO 3 ==CaCO 3 ↓+2NaOH;不能;还可能是生成的氢氧化钠使酚酞变红
(3)有白色沉淀产生;无色酚酞不变红色
(4)取固体样品样品少许,溶解于水配成溶液于试管中,向其中加入足量的氯化钡溶液,直到不产生白色沉淀,然后过滤,向滤液中加氯化铜溶液,如果产生蓝色沉淀,则证明猜想三正确
【反思】CO 2 +2NaOH==Na 2 CO 3 +H 2 O1年前查看全部
- (2014•从化市一模)兴趣小组的同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验.请你与他们一起完成以下探
(2014•从化市一模)兴趣小组的同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验.请你与他们一起完成以下探究活动:
【查阅资料】Na2CO3溶液呈碱性.
【对固体猜想】猜想Ⅰ.全部是NaOH;猜想Ⅱ.全部是Na2CO3;猜想Ⅲ.Na2CO3和NaOH的混合物.
【实验和推断】兴趣小组的同学按如下方案探究:
(1)操作①除了用烧杯外,还用到的仪器是______,它在操作①的作用是______.
(2)甲同学加入的A溶液是盐酸,现象a为有气泡产生,说明氢氧化钠______(填“已经”或“没有”)变质,有气泡产生的反应的化学方程式是______.
(3)乙同学加入的A溶液是澄清石灰水,现象a有白色沉淀,现象b为无色酚酞试液变红色,则白色沉淀为______(填化学式),该实验______(填“能”或“不能”)说明样品中有氢氧化钠.
(4)丙同学加入的A是氯化钙溶液,现象a有白色沉淀产生,现象b无色酚酞不变红色,则猜想______成立. 石门同人1年前1
石门同人1年前1 -
 BuBi 共回答了13个问题
BuBi 共回答了13个问题 |采纳率92.3%解题思路:(1)固体溶解的过程中,为了加速溶解,需要玻璃棒的搅拌;
(2)甲同学加入的A溶液是盐酸,现象a为有气泡产生,说明该固体中含有碳酸钠,稀盐酸与碳酸钠反应,生成氯化钠、水和二氧化碳;
(3)钙离子与碳酸根离子结合生成白色沉淀碳酸钙,氢氧化钙和氢氧化钠都显碱性;
(4)(1)在溶解固体时,用玻璃棒不断搅拌可以加速固体溶解;
(2)加入的A溶液是盐酸,现象a为有气泡产生,则说明该固体样品中含有碳酸根离子,所以氢氧化钠已经变质.稀盐酸与碳酸钠溶液反应,有氯化钠、二氧化碳和水生成,据此书写化学反应方程式;
(3)乙同学加入的A溶液是澄清石灰水,现象a有白色沉淀,说明该固体样品中含有碳酸钠,碳酸钠与氢氧化钙反应生成白色沉淀碳酸钙(CaCO3).由于氢氧化钙和氢氧化钠都显碱性,所以若加入氢氧化钙过量时,现象b也为无色酚酞试液变红色,故不能判断样品中是否有氢氧化钠;
(4)若A是BaCl2溶液(溶液呈中性),它可以除去显碱性的碳酸钠,若现象b为无色酚酞变红色,则说明该溶液显碱性,即含有氢氧化钠.
故答案是:(1)玻璃棒; 搅拌,加快溶解;
(2)已经;Na2CO3+2HCl=2NaCl+CO2↑+H2O;
(3)CaCO3;不能;
(4)Ⅱ.点评:
本题考点: 药品是否变质的探究;碱的化学性质;盐的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 本考点考查了氢氧化钠在空气中的变质情况,还考查了化学方程式的书写.实验探究题包括实验方法和过程的探究,实验结论和实验规律的探究等.本题通过实验资料和实验分析,得到了正确的结论,属于结论性探究.同学们要具体分析,综合掌握.1年前查看全部
- 兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验.请你与他们一起完成以下探究活
 cb_net1年前1
cb_net1年前1 -
 littlechaiyi 共回答了14个问题
littlechaiyi 共回答了14个问题 |采纳率85.7%猜想三:部分NAOH部分NA2CO3
1.A为盐酸(硫酸什么的都行),说明已经变质
NA2CO3+2HCL=2NACL+CO2↑+H2O
2CACO3.,不能
3①猜想二成立
②现象,有白色沉淀产生,酚酞变红
反思①2NAOH+CO2=NA2CO3+H2O
②密封保存1年前查看全部
- 某化学兴趣小组实验后发现实验室中的气体有刺激性气味,为了探究实验室中气体的成分,需要对实验室内的气体取样研究.请你设计实
某化学兴趣小组实验后发现实验室中的气体有刺激性气味,为了探究实验室中气体的成分,需要对实验室内的气体取样研究.请你设计实验用最简单的方法取出实验室内的气体样品.
 魔芋粉销售1年前1
魔芋粉销售1年前1 -
 黑白大熊猫 共回答了11个问题
黑白大熊猫 共回答了11个问题 |采纳率90.9%解题思路:根据收集气体的方法:可以用排空气法收集,例如用针筒或塑料袋,可用排水法,例如用装满水的集气瓶.用一个大针筒,将空气排净,进入实验室,抽取气体样品即可,或用塑料袋,先将袋内气体排净,进入实验室,再将塑料袋内充满空气即可;或将一盛满水的集气瓶带入实验室,将水倒掉,再盖上毛玻璃片即可.
故答案为:用一个大针筒,将空气排净,进入实验室,抽取气体样品即可,(或用塑料袋,先将袋内气体排净,进入实验室,再将塑料袋内充满空气即可;或将一盛满水的集气瓶带入实验室,将水倒掉,再盖上毛玻璃片即可).点评:
本题考点: 常用气体的收集方法.
考点点评: 解答本题关键是要熟悉收集气体的两种方法:排水法和排空气法,并能灵活运用.1年前查看全部
- (2008•石家庄模拟)三位同学在物理自主探究实验室采用如图所示三种不同装置将同一物体匀速提升相同的高度(每个滑轮的重相
 (2008•石家庄模拟)三位同学在物理自主探究实验室采用如图所示三种不同装置将同一物体匀速提升相同的高度(每个滑轮的重相同,绳重和摩擦可以忽略).以下说法正确的是( )
(2008•石家庄模拟)三位同学在物理自主探究实验室采用如图所示三种不同装置将同一物体匀速提升相同的高度(每个滑轮的重相同,绳重和摩擦可以忽略).以下说法正确的是( )
A.有用功相同,使用甲装置做的总功比乙和丙都少,所以甲的机械效率最高
B.只要提升相同的重物,丙的机械效率总是低于乙
C.总功相同,使用丙装置做的有用功最多,所以丙的机械效率最高
D.不论提升重物重力是否相同,甲和乙的机械效率总是相同的 回首以百年1年前1
回首以百年1年前1 -
 btcnbtcn 共回答了14个问题
btcnbtcn 共回答了14个问题 |采纳率85.7%解题思路:滑轮组将同一物体匀速提升至相同的高度,在忽略绳重和摩擦的情况下,
有用功就是提升重物所做的功,总功就是拉力F所做的功,额外功就是提升动滑轮所做的功,
故W有用=G物h,W额外=G动h;根据图示确定有用功、总功与额外功等情况,然后根据效率公式答题.∵W有用=G物h,W额外=G动h,W总=W有用+W额外,
∴滑轮组的机械效率η=
W有用
W总=
G物h
(G物+G动)h=
G物
G物+G动,即η=
G物
G物+G动,
∵甲乙只有一个动滑轮,丙有两个动滑轮,因此提升相同的重物时,
甲乙的机械效率相等,都大于丙的机械效率,故AC错误,B正确;
由η=
G物
G物+G动可知,当提升重物的重力不同时,甲与乙的机械效率不同,故D错误;
故选B.点评:
本题考点: 滑轮(组)的机械效率.
考点点评: 本题是一个选择题,实质上是一个小综合题,知道忽略摩擦和绳重时,W额=G轮h、分析清楚图示情景是正确解题的关键.1年前查看全部
- 某化学实验兴趣小组为探究实验室制备Cl 2 的过程中有水蒸气和HCl挥发来,同时证明氯气的某些性质,甲同学设计了如图所示
某化学实验兴趣小组为探究实验室制备Cl 2 的过程中有水蒸气和HCl挥发来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略): 
试回答下列问题:
(1)下列方法中,可制得氯气的是______.
①MnO 2 和浓盐酸混合共热②MnO 2 、NaCl和浓硫酸混合共热③次氯酸钠和浓盐酸混合④KClO 3 和浓盐酸混合共热
⑤KMnO 4 和浓盐酸混合
(2)若用含有0.2molHCl的浓盐酸与足量MnO 2 反应制取Cl 2 ,制得的Cl 2 在标准状况下的体积总是小于1.12L的原因是______.
(3)①装置B的作用是______,现象是______.②装置C和D出现的不同现象说明的问题是______.
③装置E的作用应该是______.④写出装置F中发生反应的离子方程式______.
(4)乙同学认为甲同学的实验有缺陷,不能确认最终通入AgNO 3 溶液中的气体只有一种,为了保证实验结论的可靠性,证明最终通入AgNO 3 溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置.你认为该装置应加在______之间(填装置字母序号),装置中应加入______. 无人车1年前1
无人车1年前1 -
 longsir 共回答了16个问题
longsir 共回答了16个问题 |采纳率87.5%(1)①MnO 2 和浓盐酸混合共热②MnO 2 、NaCl和浓硫酸混合共热③次氯酸钠和浓盐酸混合④KClO 3 和浓盐酸混合共热⑤KMnO 4 和浓盐酸混和.都是实验式常用制备氯气的方法,
故答案为:①②③④⑤;
(2)浓盐酸与足量MnO 2 反应制取Cl 2 ,反应需要加热,氯化氢易挥发,反应消化氯化氢,随反应的不断进行浓盐酸的浓度逐渐变稀,稀盐酸不反应不与MnO 2 反应,
故答案为:浓盐酸的浓度随反应的不断进行逐渐变稀,变稀后将不再反应;
(3)①硫酸铜吸水生成蓝色硫酸铜晶体,检验含有水蒸气,故答案为:证明有水蒸气产生;白色固体变蓝色;
②干燥的有色布条不褪色,说明氯气不具有漂白性;湿润的有色布条褪色,氯气与水反应生成盐酸与次氯酸,盐酸不具有漂白性,所以使有色布条褪色的物质是次氯酸,故次氯酸漂白性,故答案为:氯气无漂白性,次氯酸有漂白性;
③用四氯化碳吸收氯气,防止干扰F中氯化氢的检验,故答案为:吸收氯气;
④氯化氢与硝酸银反应生成氯化银和硝酸,反应离子方程式为Ag + +Cl - =AgCl↓,故答案为:Ag + +Cl - =AgCl↓;
(4)氯气与水反应会生成盐酸,干扰F中氯化氢的检验,故在E、F之间加一装置,用碘化钾淀粉试液检验氯气是否被完全吸收,
故答案为:E与F;碘化钾淀粉试液.1年前查看全部
- (2009•鄂州)某研究性学习小组的同学为探究实验室制取氢气的方案,分别用等质量的金属A、B跟质量相同、溶质质量分数相同
 (2009•鄂州)某研究性学习小组的同学为探究实验室制取氢气的方案,分别用等质量的金属A、B跟质量相同、溶质质量分数相同的稀硫酸反应,反应生成氢气的质量与时间的关系如下图所示.分析图象得到的下列结论中,不合理的是(已知A、B在生成物中均显+2价,A、B的相对原子质量不等)( )
(2009•鄂州)某研究性学习小组的同学为探究实验室制取氢气的方案,分别用等质量的金属A、B跟质量相同、溶质质量分数相同的稀硫酸反应,反应生成氢气的质量与时间的关系如下图所示.分析图象得到的下列结论中,不合理的是(已知A、B在生成物中均显+2价,A、B的相对原子质量不等)( )
A.反应速率A>B
B.生成氢气的质量A=B
C.金属的活动性A>B
D.A,B均反应完,硫酸有剩余 水_粉_荷1年前1
水_粉_荷1年前1 -
 草君羽 共回答了19个问题
草君羽 共回答了19个问题 |采纳率100%解题思路:从图象中可以看出,氢气的最大值相等.反应速率在图象中的体现方式是直线斜率(或者直线和时间的夹角大小),直线的斜率越大,说明该反应的速率越大.从图象可以看出,A直线的斜率大于B,所以A的反应速率大于B,A的金属性大于B.金属A、B的质量相等,如果以A、B的质量为标准计算出 氢气的质量肯定不同,所以氢气的质量是以酸为标准计算出来的,因此酸完全反应.A、反应速率在图象中的体现方式是直线斜率(或者直线和时间的夹角大小),直线的斜率越大,说明该反应的速率越大.从图象可以看出,A直线的斜率大于B,所以A的反应速率大于B,故A不符合条件.
B、从图象可以看出,氢气的最大值相等,故B不符合条件.
C、反应速率越大,说明该金属的金属性越强,因为A的反应速率大于B,所以A的金属性大于B,故C不符合条件.
D、如果以A、B的质量为标准计算出氢气的质量肯定不同,所以氢气的质量是以酸为标准计算出来的,因此酸完全反应.故D符合条件.
故选D.点评:
本题考点: 金属活动性顺序及其应用;根据化学反应方程式的计算.1年前查看全部
- (2011•工业园区模拟)某兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实
(2011•工业园区模拟)某兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实
验.请你与他们一起完成以下探究活动:
对固体猜想:
猜想I:全部是Na2CO3,猜想的依据是______.
猜想Ⅱ:全部是NaOH.
猜想Ⅲ:部分是NaOH,部分是Na2CO3.
实验和推断:
(1)若现象A为有气泡产生,则加入的X溶液是______,说明氢氧化钠已经变质,有气泡产生的反应的化学方程式是______.实验步骤 实验现象 ①取少量白色固体于试管中,加水振荡后,至全部溶解 无色溶液 ②向试管的溶液中滴加适量物质X的溶液 现象A ③再向试管中滴加 几滴酚酞试液 现象B
(2)若X是Ba(OH)2溶液,现象A为有白色沉淀生成,现象B为无色酚酞试液变红,则白色沉淀为______(填化学式),该实验______(填“能”或“不能”)说明样品中有NaOH.
(3)若X是BaCl2溶液,猜想Ⅲ成立的实验现象是______,______. xm3nm1年前1
xm3nm1年前1 -
 ydxynh 共回答了23个问题
ydxynh 共回答了23个问题 |采纳率87%解题思路:猜想:氢氧化钠和空气中的二氧化钠反应生成碳酸钠和水,所以有三种情况.
实验和推断:
(1)氢氧化钠变质,就是说生成碳酸钠,碳酸钠和盐酸反应生成氯化钠和水和二氧化碳.
(2)氢氧化钡和碳酸钠反应生成碳酸钡沉淀和氢氧化钠,生成的氢氧化钠能使酚酞变红,因此无法判断原物质中是否有氢氧化钠.
(3)氯化钡和碳酸钠生成碳酸钡和氯化钠,氢氧化钠能使酚酞变红.猜想:氢氧化钠和空气中的二氧化钠反应生成碳酸钠和水.如果部分参加反应,则最后成分是碳酸钠和氢氧化钠;如果全部参加反应,则最后是碳酸钠.故答案为:NaOH与CO2反应生成.
(1)根据题目信息(氢氧化钠已经变质)可知成分中有碳酸钠.碳酸钠和盐酸生成氯化钠和水和二氧化碳.故答案为:盐酸,Na2CO3+2HCl=2NaCl+H2O+CO2↑.
(2)氢氧化钡和碳酸钠反应生成碳酸钡沉淀和氢氧化钠,生成的氢氧化钠能使酚酞变红,因此无法判断原物质中是否有氢氧化钠.故答案为:BaCO3,不能.
(3)氯化钡和碳酸钠生成碳酸钡和氯化钠,碳酸钡是沉淀,酚酞变红说明含有氢氧化钠.故答案为:现象A有白色沉淀生成,现象B酚酞变红.点评:
本题考点: 实验探究物质的组成成分以及含量;证明碳酸盐;碱的化学性质;碳酸钠、碳酸氢钠与碳酸钙.
考点点评: (2)在判断是否有氢氧化钠时,一定注意反应产物中的氢氧化钠也可以使酚酞变红,学生要留意.1年前查看全部
- 兴趣小组同学为了探究实验室中久置的氢氧化钙固体的成分,进行了有关实验.请你与他们一起完成以下探究活动:
兴趣小组同学为了探究实验室中久置的氢氧化钙固体的成分,进行了有关实验.请你与他们一起完成以下探究活动:
猜想Ⅰ.全部是Ca(OH)2;猜想Ⅱ.全部是CaCO3
猜想Ⅲ.______.
小明同学取固体样品于试管中,加少量水,振荡,静置,发现有白色沉淀出现,他认为氢氧化钙已发生变质.小红同学提出质疑,认为小明的实验不足以说明氢氧化钙已变质.其理由是______.
小雯同学设计了如下实验方案:
(1)若现象a为有气泡产生,说明沉淀A中含有的物质名称是______.
(2)若X是CO2气体,现象c无白色沉淀,则说明样品中______(填“有”或“没有”)Ca(OH)2.综合(1)和(2)的结论,得出猜想______成立.
(3)若X是Na2CO3溶液,猜想Ⅲ成立的实验现象是:现象a为有______产生,现象b为无色酚酞试液______色,现象c为______.产生现象c的反应的化学方程式为______.
若(3)反应后的废液直接倒入下水道,会污染环境.小雯同学用适量稀硫酸处理废液,但不知是否恰好完全中和.于是,小强同学设计了如下实验方案来验证:
①有同学提出质疑,认为上述实验方案不足以证明处理后的废液一定显中性,理由是:______.为此,还需要从以下选项中选择一种试剂再进行实验验证,其中可行的是______(填字母).实验步骤 实验现象 结论 取少量处理后的废液于试管中,滴入无色酚酞溶液.
若______
处理后的废液仍然显碱性若没有明显现象 处理后的废液显中性
A.石蕊溶液B.Ba(NO3)2溶液C.锌粒D.生锈的铁钉
②久置的氢氧化钙变质的化学方程式是______. wangfei08021年前1
wangfei08021年前1 -
 giant85 共回答了19个问题
giant85 共回答了19个问题 |采纳率84.2%解题思路:【对固体猜想】根据变之前后的物质的组合进行分析;
【实验】根据氢氧化钙的溶解度较小进行分析;
(1)根据酸和碳酸盐反应会生成二氧化碳气体进行分析;
(2)根据二氧化碳和氢氧化钙会生成碳酸钙沉淀进行分析;
(3)根据碳酸钙和盐酸会生成气体,氢氧化钙显碱性,氢氧化钙和碳酸钠会生成沉淀进行分析;
根据酚酞遇碱变红色进行分析;
①根据酚酞遇酸性和中性都不变色进行分析;
②根据二氧化碳和氢氧化钙会生成碳酸钙沉淀进行分析.【对固体猜想】氢氧化钙也可能是部分变质,故答案为:是Ca(OH)2和CaCO3的混合物;
【实验】氢氧化钙在水中的溶解度较小,氢氧化钙较多时,也会出现白色沉淀,故答案为:氢氧化钙微溶于水,当达到饱和状态时,也会出现白色沉淀;
【判断】(1)盐酸和碳酸钙会生成二氧化碳气体,故答案为:碳酸钙
(2)二氧化碳和氢氧化钙会生成白色的碳酸钙沉淀,故答案为:没有Ⅱ;
(3)猜想三是碳酸钙和氢氧化钙,碳酸钙和盐酸会生成二氧化碳气体,氢氧化钙会使酚酞变红色,氢氧化钙和碳酸钠会生成碳酸钙沉淀和氢氧化钠,故答案为:气泡变红产生白色沉淀Ca(OH)2+Na2CO3═CaCO3↓+2NaOH
【拓展】酚酞遇碱性溶液会变红色,
实验步骤 实验现象 结论
无色酚酞溶液变红色
【反思】①中性的溶液或酸性液体都不会使酚酞变色,故答案为:若溶液显酸性时,无色酚酞溶液也不变色;
石蕊遇酸变红色,锌和酸会生成气体,氧化铁和酸反应,溶液会变成黄色,故答案为:ACD;
②氢氧化钙和二氧化碳反应会生成碳酸钙和水,故答案为:Ca(OH)2+CO2═CaCO3↓+H2O点评:
本题考点: 酸、碱、盐的鉴别;空气中常见酸碱盐的质量或性质变化及贮存法;书写化学方程式、文字表达式、电离方程式.
考点点评: 在解此类题时,首先分析题中考查的问题,然后结合学过的知识和题中的知识进行分析解答.1年前查看全部
- (2011•广元)某研究性学习小组为了探究实验室里一瓶久置的NaOH固体是否变质.该小组同学进行了如下实验探究:
(2011•广元)某研究性学习小组为了探究实验室里一瓶久置的NaOH固体是否变质.该小组同学进行了如下实验探究:
[提出问题]
猜想Ⅰ:没变质,全部是NaOH;
猜想Ⅱ:可能部分变质,固体是NaOH和 Na2CO3的混合物;
猜想Ⅲ:可能全部变质,固体是Na2CO3.
[查阅资料]
①已知反应:BaCl2+Na2CO3=BaCO3↓+2NaCl;
②部分盐溶液在常温下的pH值如下:
[设计方案并进行实验]请你与她们一起共同完成实验,并回答所给问题;盐溶液 NaCl Na2CO3 BaCl2 pH 等于7 大于7 等于7
实验方案1:
取该样品少量于试管中,加入适量的水振荡,样品全部溶于水,向其中加入无色酚酞试液,观察到溶液变成红色.结论:样品中一定有NaOH.
实验方案2:
(1)称取上述氢氧化钠固体样品5.3g溶于50ml水配成溶液,向溶液中滴加过量氯化钡溶液,有白色沉淀产生.说明久置固体中,一定含有______(填化学式).滴加过量氯化钡溶液的目的是______.
(2)将(1)所得溶液静置,取上层清液,滴加酚酞试液,酚酞试液变红,说明久置固体中,一定含有______(填化学式).
[反思评价]小明同学认为实验方案1得出的结论不正确,其理由是______.
[实验结论]通过实验,说明上述猜想______是正确的.
[拓展]该小组同学为验证上述实验的可靠性,继续将上述白色沉淀过滤、洗净、干燥,称量得其质量为1.97g,则原样品中氢氧化钠的质量分数为______(假定试剂中无其它杂质).
[表达]久置的氢氧化钠变质的原因是______(用化学方程式表示). coolcoxixi1年前1
coolcoxixi1年前1 -
 董绅 共回答了15个问题
董绅 共回答了15个问题 |采纳率93.3%解题思路:(1)碳酸钠可以和氯化钡反应生成沉淀,而氢氧化钠不能和氯化钡反应,可以据此解答该题;
(2)由于(1)中加入的是过量的氯化钡,所以排除了碳酸钠的干扰,根据溶液呈碱性可以判断该溶液中所含物质;
【反思评价】碳酸钠溶液也呈碱性,可以据此解答;
【实验结论】根据实验的现象和结论来分析上述猜想是否正确;
【拓展】根据所得固体的质量可以求算出碳酸钠的质量,进而求算出氢氧化钠的质量;
【表达】根据氢氧化钠的性质来进行解答.(1)加入氯化钡溶液后生成不溶于水的白色物质碳酸钡,可以判断久置固体中含有碳酸钠,滴加过量BaCl2溶液,是保证所取样品中的碳酸钠完全反应;
(2)取反应后的上层清夜滴加酚酞试液,酚酞试液变红,说明溶液显碱性,即久置固体中含有NaOH;
【反思评价】碳酸钠溶液也呈碱性,其溶液也可使酚酞变红,所以不能仅仅根据酚酞变红来判断样品中一定含有NaOH;
【实验结论】由实验方案2的结论可知,原样品中含有碳酸钠和氢氧化钠,则猜想Ⅱ正确;
【拓展】由静置后的混合物过滤,将白色沉淀洗涤、干燥,称得其质量为1.97g,即碳酸钡的质量为1.97g,
设5.3g样品中碳酸钠的质量为x
Na2C03+BaCl2═BaC03↓+2NaCl
106 197
x 1.97g
[106/197=
x
1.97g]
解得:x=1.06g,所以氢氧化钠的质量为5.3g-1.06g=4.24g
[4.24g/5.3g]×100%=80%;
【表达】因氢氧化钠在空气中吸收水后能与空气中的二氧化碳反应生成碳酸钠,则久置的NaOH固体会变质,其化学方程式为:2NaOH+CO2═Na2CO3+H2O.
故答案为:(1)Na2CO3;保证所取样品中的碳酸钠完全反应;
(2)NaOH;
[反思评价]碳酸钠溶液也呈碱性,其溶液也可使酚酞变红;
[实验结论]Ⅱ;
[拓展]80%;
[表达]2NaOH+CO2═Na2CO3+H2O.点评:
本题考点: 药品是否变质的探究;碱的化学性质;盐的化学性质;书写化学方程式、文字表达式、电离方程式;根据化学反应方程式的计算.
考点点评: 本题考查了久置的NaOH固体是否变质的实验探究,学生明确实验现象与结论的关系,利用元素的守恒等来计算分析,并注意结合物质的性质来分析固体变质的原因来解答本题.1年前查看全部
- 某课外活动小组为探究实验室制取氢气的方案,分别用金属A、B跟质量相同、质量分数相同的稀硫酸反应,经实验发现:生成氢气的质
某课外活动小组为探究实验室制取氢气的方案,分别用金属A、B跟质量相同、质量分数相同的稀硫酸反应,经实验发现:生成氢气的质量与反应时间有下图所示关系.分析图象得到的以下结论中,不合理的是( ) A.反应得到氢气的质量相等 B.反应后所得溶液的质量分数A>B C.两种金属的活动顺序A>B D.稀硫酸已完全反应,两种金属可能有剩余 
 hsh91151年前1
hsh91151年前1 -
 57759000 共回答了13个问题
57759000 共回答了13个问题 |采纳率100%A、由图象可知最终金属A和金属B生成的氢气质量相等.故A合理.
B、参加反应的稀硫酸的质量和生成的稀硫酸的质量是相等的,故决定溶液质量分数的是参加反应的金属A、B的质量,而参加反应的金属A、B的质量无法确定,故不能断定溶液质量分数A>B;故不合理
C、金属的活动性越强,反应越快,所以金属的活动性:A>B.故C合理.
D、酸完全反应,金属应该足量,所以两种金属可能有剩余;故D合理.
故选B.1年前查看全部
- 兴趣小组同学为了探究实验室中久置的氢氧化钾固体的成分(氢氧化钾与氢氧化钠性质相似),进行了有关实验.请你与他们一起完成以
兴趣小组同学为了探究实验室中久置的氢氧化钾固体的成分(氢氧化钾与氢氧化钠性质相似),进行了有关实验.请你与他们一起完成以下探究活动:
【资料】
(1)K2CO3溶液与KOH溶液都呈碱性
(2)K2CO3+Ca(OH)2=CaCO3↓+2KOH
【对固体猜想】猜想Ⅰ:全部是KOH;猜想Ⅱ:全部是K2CO3;猜想Ⅲ:是KOH和K2CO3混合物.
【实验和推断】
(1)若现象a为有气泡产生,则加入的A溶液是______,说明氢氧化钾已经变质.
(2)若A是Ca(OH)2溶液,现象a有白色沉淀,现象b为无色酚酞试液变红色,则该实验______(填“能”或“不能”)说明猜想Ⅲ成立.
【反思】久置的氢氧化钾变质的原因是(用化学方程式表示)______. bjhzz1年前1
bjhzz1年前1 -
 houhuaqian 共回答了22个问题
houhuaqian 共回答了22个问题 |采纳率95.5%解题思路:(1)本题能使同学们体会到实验探究的一般过程,通过实验流程图和现象可知:若现象a为有气泡产生,则加入的A溶液是酸;
(2)根据若A是Ca(OH)2溶液,当实验现象a为产生白色沉淀;现象b为无色酚酞变红色;氢氧化钙和碳酸钾反应生成碳酸钙沉淀和氢氧化钾,只能证明碳酸钾存在,无法证明氢氧化钾存在判断.
【反思】氢氧化钾变质是因为:二氧化碳和氢氧化钾反应生成碳酸钾和水.(1)若现象a为有气泡产生,则加入的A溶液是酸;
(2)若A是Ca(OH)2溶液,当实验现象a为产生白色沉淀;现象b为无色酚酞变红色;氢氧化钙和碳酸钾反应生成碳酸钙沉淀和氢氧化钾,只能证明碳酸钾存在,无法证明氢氧化钾存在.
【反思】氢氧化钾变质是因为:二氧化碳和氢氧化钾反应生成碳酸钾和水,配平即可.
故答案为:(1)盐酸 (或稀H2SO4等酸);(2)不能;
【反思】2KOH+CO2=K2CO3+H2O.点评:
本题考点: 药品是否变质的探究;碱的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 本考点考查了氢氧化钾在空气中的变质情况,还考查了化学方程式的书写.实验探究题包括实验方法和过程的探究,实验结论和实验规律的探究等.本题通过实验资料和实验分析,得到了正确的结论,属于结论性探究.同学们要具体分析,综合掌握.1年前查看全部
- 小红同学想探究实验室中碳酸钙和盐酸制取二氧化碳后废液中溶质的成分,请你一同参与探究并回答下列问题.
小红同学想探究实验室中碳酸钙和盐酸制取二氧化碳后废液中溶质的成分,请你一同参与探究并回答下列问题.
【提出问题】废液中的溶质是什么物质?
【作出猜想】小红认为废液中溶质只有CaCl2.你认为还可能含有的溶质是______(填化学式).
【查阅资料】CaCl2溶液呈中性.
【实验与结论】
(1)请你写出碳酸钙和盐酸反应的化学方程式______.
(2)分别取少量该废液和CaCl2溶液加入到两支试管中,并向其中分别滴入无色酚酞试液做对比试验,结果两支试管中溶液均无色,于是小红认为自己的猜想是正确的.
(3)你认为小红的实验______(填“能”或“不能”)证明她的猜想,理由是______.
(4)如果要证明你的猜想是正确的,你选择______(填字母:A、石蕊试液B、氢氧化钠溶液 C、稀盐酸)来代替酚酞试液,理由是______.或加入一种固体也能证明你的猜想,发生反应的化学方程式为:______.
(5)若实验证明了你的猜想是正确的,那么废液会造成环境污染,排放时在不使用指示剂的情况下若向废液中加入过量的______,反应完成后过滤就可得到只含CaCl2一种溶质的溶液. gaolz_cn1年前1
gaolz_cn1年前1 -
 xie简简单单 共回答了18个问题
xie简简单单 共回答了18个问题 |采纳率88.9%解题思路:【作出猜想】从盐酸与碳酸钙是否恰好完全反应的角度进行分析.
【实验与结论】(1)熟记常用的化学方程式.
(3)从酸碱指示剂遇酸碱溶液的变色情况分析.
(4)要证明我的猜想正确,也就是要证明溶液中有盐酸,根据盐酸的化学性质设计实验进行检验.
(5)要得到纯净的氯化钙固体,也就是要将盐酸转化为氯化钙,盐酸与氧化钙、氢氧化钙、碳酸钙反应都能生成氯化钙.【作出猜想】若盐酸与碳酸钙恰好完全反应,溶液中的溶质是氯化钙,若盐酸过量,溶液中的溶质除了氯化钙之外还有氯化氢气体.
【实验与结论】(1)碳酸钙与盐酸反应生成氯化钙、水和二氧化碳.化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;
(3)氯化钙溶液显中性,不能使酚酞溶液变色,氯化钙与盐酸的混合溶液显酸性,也不能使酚酞溶液变色,因而酚酞溶液呈无色,两种猜想都有可能.因此不能采取滴入无色酚酞试液做对比试验的方法进行检验其猜想;
(4)盐酸溶液显酸性,能使紫色石蕊溶液变红; 而与氢氧化钠反应无明显现象;加入一种固体也能证明猜想,发生反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑
(5)要加入过量的某物质将盐酸转化为氯化钙,该物质一定不溶于水,若溶于水的话,虽然除去了盐酸,溶液中还会有剩余的该物质,那么该物质可以是碳酸钙.
故答案为:
【作出猜想】HCl;
【实验与结论】(1)CaCO3+2HCl═CaCl2+H2O+CO2↑;
(3)不能;酚酞试液遇酸性、中性溶液不显色,遇碱性溶液才显红色;
(4)A;石蕊试液遇酸性溶液显红色;CaCO3+2HCl═CaCl2+H2O+CO2↑
(5)CaCO3(或碳酸钙).点评:
本题考点: 实验探究物质的组成成分以及含量;酸的化学性质;盐的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 除杂一般有两种方法:将杂质彻底除去或将杂质转化为主物质,但所选物质不能与主物质发生反应,除去杂质的同时也不要混入其它物质.1年前查看全部
- 我市某学校化学兴趣小组为探究实验室制取氧气,把干燥、纯净的氯酸钾和二氧化锰的混合物.30g装入大试管中,加热化学方程式为
我市某学校化学兴趣小组为探究实验室制取氧气,把干燥、纯净的氯酸钾和二氧化锰的混合物.30g装入大试管中,加热化学方程式为∶2kclo3==【mno2,下面有加热符号】==2kcl+3o2↑待反应完全后,将试管冷却、称量,得到20.4g固体的物质,试计算∶ ①问剩余固体的物质是什么?
②质量各为多少? 正28经爱你1年前1
正28经爱你1年前1 -
 weiboden2006 共回答了17个问题
weiboden2006 共回答了17个问题 |采纳率94.1%生成氧气的质量为 30g-20.4g=9.6g
2KClO3==【MnO2,下面有加热符号】==2KCl+3O2↑
149 96
X 9.6g
149/x=96/9.6g
x=14.9g
剩余固体的物质是氯化钾 14.9g 二氧化锰 20.4g-14.9g=5.5g1年前查看全部
- (2011•铜仁地区)小红同学想探究实验室中碳酸钙和盐酸制取二氧化碳后废液中溶质的成分,请你一同参与探究并回答横线上的七
(2011•铜仁地区)小红同学想探究实验室中碳酸钙和盐酸制取二氧化碳后废液中溶质的成分,请你一同参与探究并回答横线上的七个问题.
【提出问题】废液中的溶质是什么物质?
【作出猜想】小红认为废液中溶质只有CaCl2.
你认为还可能含有的溶质是______(填化学式).
【查阅资料】CaCl2溶液呈中性.
【实验与结论】
(1)请你写出实验室制取二氧化碳的化学方程式______.
(2)分别取少量该废液和CaCl2溶液加入到两支试管中,并向其中分别滴入无色酚酞试液做对比试验,结果两支试管中溶液均无色,于是小红认为自己的猜想是正确的.
(3)你认为小红的实验______(填“能”或“不能”)证明她的猜想,理由是______.
(4)如果要证明你的猜想是正确的,你选择______(填字母:A、石蕊试液B、氢氧化钠溶液 C、稀盐酸 )来代替酚酞试液,理由是______.
(5)若实验证明了你的猜想是正确的,向废液中加入过量的______,反应完成后过滤就可得到只含CaCl2一种溶质的溶液. 挚爱永爱1年前1
挚爱永爱1年前1 -
 hzzhzzhzz 共回答了15个问题
hzzhzzhzz 共回答了15个问题 |采纳率93.3%解题思路:【作出猜想】从盐酸与碳酸钙是否恰好完全反应的角度进行分析.
【实验与结论】(1)熟记常用的化学方程式.
(3)从酸碱指示剂遇酸碱溶液的变色情况分析.
(4)要证明我的猜想正确,也就是要证明溶液中有盐酸,根据盐酸的化学性质设计实验进行检验.
(5)要得到纯净的氯化钙固体,也就是要将盐酸转化为氯化钙,盐酸与氧化钙、氢氧化钙、碳酸钙反应都能生成氯化钙.【作出猜想】若盐酸与碳酸钙恰好完全反应,溶液中的溶质是氯化钙,若盐酸过量,溶液中的溶质除了氯化钙之外还有氯化氢气体.
【实验与结论】(1)碳酸钙与盐酸反应生成氯化钙、水和二氧化碳.化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;
(3)氯化钙溶液显中性,不能使酚酞溶液变色,氯化钙与盐酸的混合溶液显酸性,也不能使酚酞溶液变色,因而酚酞溶液呈无色,两种猜想都有可能.因此不能采取滴入无色酚酞试液做对比试验的方法进行检验其猜想;
(4)盐酸溶液显酸性,能使紫色石蕊溶液变红; 而与氢氧化钠反应无明显现象;
(5)要加入过量的某物质将盐酸转化为氯化钙,该物质一定不溶于水,若溶于水的话,虽然除去了盐酸,溶液中还会有剩余的该物质,那么该物质可以是碳酸钙.
故答案为:
【作出猜想】HCl;
【实验与结论】(1)CaCO3+2HCl═CaCl2+H2O+CO2↑;
(3)不能;酚酞试液遇酸性、中性溶液不显色,遇碱性溶液才显红色;
(4)A;石蕊试液遇酸性溶液显红色;
(5)CaCO3(或碳酸钙).点评:
本题考点: 实验探究物质的组成成分以及含量;酸碱指示剂及其性质;酸的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 除杂一般有两种方法:将杂质彻底除去或将杂质转化为主物质,但所选物质不能与主物质发生反应,除去杂质的同时也不要混入其它物质.1年前查看全部
- (2013•川汇区模拟)兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验.请你与他们一起完成以下探究
(2013•川汇区模拟)兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验.请你与他们一起完成以下探究活动:
【对固体猜想】
猜想Ⅰ:全部是NaOH;猜想Ⅱ:全部是Na2CO3;猜想Ⅲ:是NaOH和Na2CO3混合物.
【实验和推断】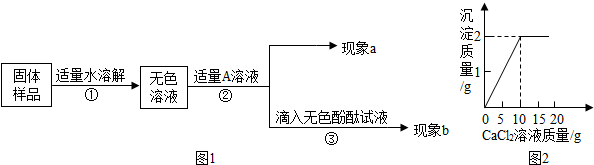
(1)若现象a为有气泡产生,则加入的A溶液是______,说明氢氧化钠已经变质,有气泡产生的反应化学方程式是______.
(2)若A是Ca(OH)2溶液,现象a有白色沉淀,现象b为无色酚酞试液变红色,则白色沉淀为______(填化学式),该实验______(选填“能”或“不能”)说明样品中有NaOH.
(3)若A是CaCl2溶液,当实验现象a为______,现象b为______,则猜想Ⅱ成立.
(4)若同学取该固体样品10g于烧杯中,加水溶解,然后逐滴滴加一定浓度的CaCl2溶液.测得生成沉淀的质量与滴入CaCl2溶液的质量,其关系如图2所示.
请根据题意计算:该样品中Na2CO3的质量分数是多少? kissmytit1年前1
kissmytit1年前1 -
 夏天的** 共回答了19个问题
夏天的** 共回答了19个问题 |采纳率78.9%解题思路:根据氢氧化钠的性质进行分析,氢氧化钠露置在空气中易与二氧化碳反应生成碳酸钠而变质,反应的程度不同,则变质的程度不同;检验碳酸盐使用的是加酸化气的方法或加入含有可溶性钙离子、钡离子的方法,要证明含有氢氧化钠,则需要除去碳酸钠再进行检验,且加入的试剂与碳酸钠反应后不能生成显碱性的物质;
变质的氢氧化钠含有碳酸钠,与氯化钙反应会生成碳酸钙沉淀,由图象知加入10g氯化钙溶液碳酸钠正好完全反应,生成碳酸钙质量是2g,从而可求碳酸钠的质量和质量分数.(1)氢氧化钠变质生成的是碳酸钠,如果加入A后产生气泡,则加入的物质是酸,可以是稀盐酸,盐酸能与碳酸钠反应生成氯化钠、水和二氧化碳,该反应的化学方程式为:Na2CO3+2HCl═2NaCl+H2O+CO2↑;
(2)氢氧化钙能与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,故白色沉淀是碳酸钙,其化学式为:CaCO3;生成的氢氧化钠能使酚酞试液变红,故不能确定原固体中是否含有氢氧化钠;
(3)若全部是碳酸钠,则加入的氯化钙能与碳酸钠反应生成碳酸钙白色沉淀和氯化钠,生成的氯化钠的水溶液呈中性,不能使酚酞试液变红,所以现象a为产生白色沉淀,现象b为酚酞不变色;
(4)解;由图可知反应生成碳酸钙质量是2g,
设样品中碳酸钠的质量为x,
Na2C03+CaCl2=CaC03↓+2NaCl
106 100
x 2g
[106/x]=[100/2g] x=2.12g
该样品中碳酸钠的质量分数=[2.12g/10g]×100%=21.2%
答:该样品中碳酸钠的质量分数是21.2%.
故答案为:
(1)稀盐酸; Na2CO3+2HCl═2NaCl+H2O+CO2↑;
(2)CaCO3;不能;
(3)有白色沉淀生成;无色酚酞试液不变色;
(4)解;由图可知反应生成碳酸钙质量是2g,
设样品中碳酸钠的质量为x,
Na2C03+CaCl2=CaC03↓+2NaCl
106 100
x 2g
[106/x]=[100/2g] x=2.12g
该样品中碳酸钠的质量分数=[2.12g/10g]×100%=21.2%
答:该样品中碳酸钠的质量分数是21.2%.点评:
本题考点: 药品是否变质的探究;酸的化学性质;碱的化学性质;盐的化学性质;根据化学反应方程式的计算.
考点点评: 本考点考查了氢氧化钠在空气中的变质情况的探究,还考查了利用图象的分析求出碳酸钠的质量分数,题目不是太难,但是综合性比较强,完成此题,可以依据氢氧化钠和碳酸钠的性质及检验方法进行.1年前查看全部
- 某化学实验活动小组的同学为了探究实验室中久置氢氧化钠固体的成分,进行了有关实验,请你参与他们进行的探究活动:
某化学实验活动小组的同学为了探究实验室中久置氢氧化钠固体的成分,进行了有关实验,请你参与他们进行的探究活动:
【猜想与假设】
猜想Ⅰ:全部是NaOH;
猜想Ⅱ:全部是Na2CO3
猜想Ⅲ:______.
【实验与探究】
(1)实验如下:
(2)为了进一步的验证猜想结果,小明同学提出了如下实验方案:继续步骤二的实验,过滤,然后向滤液中滴加无色酚酞试液,若酚酞变红,则猜想Ⅲ成立;若酚酞不变红,则猜想Ⅱ成立.实验操作步骤 实验现象 结论及解释 步骤一:取少量固体样品于试管中,加蒸馏水完全溶解,然后加入足量的稀盐酸. 实验过程中始终没有气泡产生. 则证明猜想成立. 步骤二:取少量固体样品于试管中,加蒸馏水完全溶解,然后滴加氢氧化钡溶液. 实验过程中产生
______.则证明猜想Ⅱ或Ⅲ成立,此过程中发生反应的化学方程式为______.
小华同学立即对小明同学的方案提出了质疑,通过查阅资料知道,氯化钡溶液程中性,不能使无色酚酞试液变红,但碳酸钠溶液呈______性(填“酸”或“减”)能使酚酞变红.因此,他认为该方案的操作步骤中应该改进的是______.
【反思与交流】久置固体氢氧化钠变质的原因是(用化学方程式表示)______.
【拓展与延伸】
(3)取10g已变质的氢氧化钠固体于干燥的烧杯中,并向其中加入100g一定质量分数的稀盐酸,充分反应后称得溶液的质量为107.8g,请你计算:
①没有发生变质的氢氧化钠的质量;
②盐酸溶液中溶质的质量分数. 曾经流过泪1年前1
曾经流过泪1年前1 -
 浪子云青 共回答了18个问题
浪子云青 共回答了18个问题 |采纳率88.9%解题思路:【猜想与假设】
固体可能全部是NaOH,也可能全部是Na2CO3,也可能是NaOH和Na2CO3.
【实验与探究】
(1)碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳;
碳酸钠和氢氧化钡反应生成碳酸钡沉淀和氢氧化钠;
(2)碳酸钠溶液、氢氧化钠溶液都显碱性,都能够使酚酞试液变红色;
氯化钡和碳酸钠反应生成碳酸钡沉淀和氯化钠;
氢氧化钠能够吸收空气中的二氧化碳,并且能和二氧化碳反应生成碳酸钠和水;
(3)反应前后的质量差即为反应生成二氧化碳的质量,根据二氧化碳的质量可以计算碳酸钠的质量和氯化氢的质量,进一步可以计算没有发生变质的氢氧化钠的质量和盐酸溶液中溶质的质量分数.【猜想与假设】
固体可能全部是NaOH,也可能全部是Na2CO3,也可能是NaOH和Na2CO3.
故填:NaOH和Na2CO3.
【实验与探究】
(1)取少量固体样品于试管中,加蒸馏水完全溶解,然后滴加氢氧化钡溶液,产生白色沉淀,则证明猜想Ⅱ或Ⅲ成立;
碳酸钠和氢氧化钡反应的化学方程式为:Na2CO3+Ba(OH)2═BaCO3↓+2NaOH.
故填:白色沉淀;Na2CO3+Ba(OH)2═BaCO3↓+2NaOH.
(2)碳酸钠溶液呈碱性,能使酚酞变红,因此,该方案的操作步骤中应该改进的是:取少量固体样品于试管中,加蒸馏水完全溶解,然后滴加足量的氯化钡溶液.
故填:碱;取少量固体样品于试管中,加蒸馏水完全溶解,然后滴加足量的氯化钡溶液.
【反思与交流】
氢氧化钠和二氧化碳反应的化学方程式为:2NaOH+CO2═Na2CO3+H2O.
故填:2NaOH+CO2═Na2CO3+H2O.
【拓展与延伸】
(3)①设碳酸钠的质量为x,氯化氢的质量为y,
生成二氧化碳的质量为:10g+100g-107.8g=2.2g,
Na2CO3+2HCl═2NaCl+H2O+CO2↑,
10673 44
xy 2.2g
[106/x]=[73/y]=[44/2.2g],
x=5.3g,y=3.65g,
没有发生变质的氢氧化钠的质量为:10g-5.3g=4.7g,
答:没有发生变质的氢氧化钠的质量为4.7g.
②盐酸溶液中溶质的质量分数为:[3.65g/100g]×100%=3.65%,
答:盐酸溶液中溶质的质量分数为3.65%.点评:
本题考点: 实验探究物质的组成成分以及含量;有关溶质质量分数的简单计算;碱的化学性质;盐的化学性质;根据化学反应方程式的计算.
考点点评: 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.1年前查看全部
- 兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验.请你与他们一起完成以下探究活动:
 兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验.请你与他们一起完成以下探究活动:
兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验.请你与他们一起完成以下探究活动:
[对固体猜想]
猜想Ⅰ:全部是NaOH;
猜想Ⅱ:全部是Na2CO3;
猜想Ⅲ:______混合物.
[查阅资料]
(1)氯化钙溶液呈中性.
(2)氯化钙溶液能与碳酸钠溶液反应:CaCl2+Na2CO3=CaCO3↓+2NaCl
[实验探究2]
[实验结论]猜想Ⅲ成立实验步骤 实验现象 实验结论 (1)取少量该样品配成溶液于试管中,向溶液中滴加过量的氯化钙溶液,并不断振荡. 有______生成. 说明原固体中一定有______. (2)取步骤(1)试管中的少量上层清液,滴加酚酞溶液. 溶液变______色. 说明原固体中一定有______.
[反思与评价]
(1)氢氧化钠固体露置于空气中容易变质,请写出相关反应的化学方程式:______.
(2)在上述[实验探究2]中,小明提出可用氢氧化钙溶液代替氯化钙溶液,你认为该方案______(填“可行”或“不可行”).理由______.
[理解与应用]
(1)氢氧化钠溶液容易变质,必须密封保存.实验室必须密封保存的药品还有很多,试另举一例:______.
(2)为检验其变质情况,进行了如下探究:取氢氧化钠样品10.0g于锥形瓶中,加入40.0g水,振荡形成溶液,向锥形瓶中逐滴滴加14.6%的稀盐酸,实验测得加入稀盐酸的质量与锥形瓶中物质的质量关系如图所示.
求:10.0g样品中各成分的质量 (写出计算过程) 滑铁卢之桥1年前1
滑铁卢之桥1年前1 -
 雪中圣诞 共回答了23个问题
雪中圣诞 共回答了23个问题 |采纳率87%解题思路:【对固体猜想】Ⅲ:运用氢氧化钠和二氧化碳反应生成碳酸钠及猜想I、Ⅱ解答;
【实验探究2】运用碳酸钠和氯化钙反应生成碳酸钙沉淀和氢氧化钠显碱性设计实验方案;
【反思与评价】(1)运用氢氧化钠和二氧化碳反应生成碳酸钠和水书写反应的方程式;
(2)根据氢氧化钙和碳酸钠反应产生沉淀的同时还产生氢氧化钠对氢氧化钠的检验产生干扰进行分析;
【理解与应用】(1)根据常见需要密封保存的物质回答;
(2)向变质的氢氧化钠的溶液中滴加盐酸,盐酸先与氢氧化钠反应,生成氯化钠和水,而不能产生气体,因此,随盐酸的滴加瓶内质量不断增加,如图中的第一段曲线所示;当氢氧化钠完全反应后,继续滴加的盐酸开始与碳酸钠反应,即从图乙瓶内质量为75g时始,碳酸钠与盐酸反应生成氯化钠和水,同时放出气体二氧化碳,因此随盐酸的滴加瓶内物质质量增加情况如图乙中的第二段曲线;至碳酸钠完全反应后,滴加的盐酸不发生反应,瓶内质量增加情况如图乙中第三段曲线;根据与氢氧化钠阶段反应的化学方程式及消耗盐酸的质量,可计算出参加反应的氢氧化钠的质量,碳酸钠的质量为样品与氢氧化钠的质量差.【对固体猜想】Ⅲ:氢氧化钠可能是部分变质,含有NaOH和Na2CO3;故填:是NaOH和Na2CO3;
【实验探究2】根据实验结论氢氧化钠是部分变质,含有氢氧化钠和碳酸钠,二者都显碱性,因此先加入氯化钙检验碳酸钠并除去碳酸钠,碳酸钠和氯化钙反应生成碳酸钙沉淀;剩下的氢氧化钠显碱性能够使酚酞试液变成红色;故填:白色沉淀;Na2CO3;红;NaOH;
【反思与评价】(1)氢氧化钠和二氧化碳反应生成碳酸钠和水,反应的方程式为:CO2+2NaOH═Na2CO3+H2O;故填:CO2+2NaOH═Na2CO3+H2O;
(2)因为氢氧化钙和碳酸钠反应产生沉淀的同时还产生氢氧化钠对氢氧化钠的检验产生干扰,因此该方案不可行;故填:不可行;氢氧化钙和碳酸钠反应会产生氢氧化钠;
【理解与应用】(1)因为浓盐酸具有挥发性,浓硫酸具有吸水性,因此都需要密封保存;故填:浓盐酸(或浓硫酸等);
(2)由题意和坐标分析可知,曲线第一段物质增加的质量就是与氢氧化钠反应的盐酸的质量,即75g-50g=25g
设与盐酸反应的氢氧化钠的质量为x
HCl+NaOH=NaCl+H2O
36.5 40
25g×14.6% x
[36.5/25g×14.6%]=[40/x] x=4g
因此碳酸钠的质量为:10g-4g=6g
答:10.0g样品中氢氧化钠的质量是4g,碳酸钠的质量是6g.点评:
本题考点: 药品是否变质的探究;酸碱指示剂及其性质;碱的化学性质;盐的化学性质;书写化学方程式、文字表达式、电离方程式;根据化学反应方程式的计算.
考点点评: 本题考查了氢氧化钠变质情况的探究,要注意氢氧化钠和变质的产物碳酸钠均显碱性,因此要验证氢氧化钠的存在,需要排除碳酸钠碱性的干扰;在计算氢氧化钠部分变质中物质的含量时,要依据坐标结合题意分清各段表示的意义.1年前查看全部
- 小明在探究实验室制取二氧化碳时,发现大小不一的石灰石块与稀盐酸反应,反应速率也不同.请你填写下表
小明在探究实验室制取二氧化碳时,发现大小不一的石灰石块与稀盐酸反应,反应速率也不同.请你填写下表
石灰石的形状 小块状 粉末状
反应现象
(1)实验室制取CO2应该选用哪种状态的大理石较好?理由是什么?
(2)若制的CO2去灭火,又将如何选择? tinfly1年前1
tinfly1年前1 -
 surewing 共回答了19个问题
surewing 共回答了19个问题 |采纳率84.2%1)实验室制取CO2应该选用哪种状态的大理石较好?理由是什么?
用小块状的石灰石,因为小块状的石灰石和盐酸反应速率慢,便于气体收集,便于实验操作.
(2)若制的CO2去灭火,又将如何选择?
灭火,需要瞬间制取大量的CO2,粉末状的石灰石和盐酸反应速率快,方便快速灭火.1年前查看全部
- 某化学实验活动小组的同学为了探究实验室中久置氢氧化钠固体的成分,进行了有关实验,请你参与他们进行的探究活动:
某化学实验活动小组的同学为了探究实验室中久置氢氧化钠固体的成分,进行了有关实验,请你参与他们进行的探究活动:
【猜想与假设】
猜想Ⅰ:全部是NaOH;
猜想Ⅱ:全部是Na2CO3
猜想Ⅲ:______.
【实验与探究】
(1)实验如下:
(2)为了进一步的验证猜想结果,小明同学提出了如下实验方案:继续步骤二的实验,过滤,然后向滤液中滴加无色酚酞试液,若酚酞变红,则猜想Ⅲ成立;若酚酞不变红,则猜想Ⅱ成立.实验操作步骤 实验现象 结论及解释 步骤一:取少量固体样品于试管中,加蒸馏水完全溶解,然后加入足量的稀盐酸. 实验过程中始终没有气泡产生. 则证明猜想______成立. 步骤二:取少量固体样品于试管中,加蒸馏水完全溶解,然后滴加氯化钡溶液. 实验过程中产生
______.则证明猜想Ⅱ或Ⅲ成立,此过程中发生反应的化学方程式为______.
小华同学立即对小明同学的方案提出了质疑,通过查阅资料知道,氯化钡溶液程中性,不能使无色酚酞试液变红,但碳酸钠溶液呈______性(填“酸”或“碱”)能使酚酞变红.因此,他认为该方案的操作步骤中应该改进的是______.
(3)实验小组的同学展开讨论,又提出了一个定量试验方案,通过测定产生沉淀的质量来证明猜想Ⅱ或Ⅲ成立.试验如下:准确称量m克固体样品于试管中,加热蒸馏水完全溶解,然后滴加足量氯化钡溶液,充分反映后过滤、洗涤、干燥称的沉淀的质量为n克,若猜想Ⅱ成立,则m与n的关系式为(用含m和n的等式或不等式表示,下同)______;若猜想Ⅲ成立,则m与n的关系式又为______.
【反思与交流】久置固体氢氧化钠变质的原因是(用化学方程式表示)______. 风月雪花1年前1
风月雪花1年前1 -
 寐寐我思之 共回答了13个问题
寐寐我思之 共回答了13个问题 |采纳率92.3%解题思路:【猜想与假设】氢氧化钠若变质,其产物为碳酸钠,所以可以据此结合题中的猜想完成解答;
【实验与探究】(1)碳酸钠可以和稀盐酸反应生成气体,而氢氧化钠和稀盐酸反应时没有明显现象,氯化钡溶液和碳酸钠反应生成白色沉淀,可以据此解答该题;
(2)碳酸钠溶液与氢氧化钡溶液反应生成了氢氧化钠呈碱性,可以使酚酞变红,所以为了防止反应生成的氢氧化钠干扰实验应该加入过量的氯化钡溶液,可以据此进行解答;
(3)根据氯化钡和碳酸钠溶液反应的化学方程式可以得出m和n的关系,然后根据题中的信息进行解答即可;
[反思]氢氧化钠溶液变质是由于和空气中的二氧化碳发生反应生成了碳酸钠的缘故,可以据此写出该反应的化学方程式.【猜想与假设】氢氧化钠若变质,其产物为碳酸钠,若氢氧化钠部分变质,则该固体为氢氧化钠和碳酸钠混合物;
【实验与探究】(1)碳酸钠可以和稀盐酸反应生成气体,所以若没有明显现象,则该固体中没有碳酸钠,即只有氢氧化钠,即猜想Ⅰ成立;
氯化钡溶液和碳酸钠反应生成白色沉淀碳酸钡和氯化钠,所以若观察到产生了白色沉淀,则说明在该固体中含有碳酸钠,即猜想Ⅱ或猜想Ⅲ成立;该化学方程式为:BaCl2+Na2CO3═BaCO3↓+2NaCl;
(2)通过查阅资料知道,氯化钡溶液呈中性,不能使无色酚酞试液变红,但碳酸钠溶液呈碱性,能使酚酞变红;而碳酸钠溶液与氢氧化钡溶液反应生成了氢氧化钠,可以是酚酞变红,所以为了防止碳酸钠干扰实验应该将步骤二中的氯化钡溶液改为加入过量的氯化钡溶液;
(3)假设所取的mg固体全部为碳酸钠,则:
Na2CO3+BaCl2═BaCO3↓+2NaCl
106 197
m n
[106/m]=[197/n]
即:n=[197m/106]
若猜想Ⅱ成立,即全部是碳酸钠,那么n和m的关系为:n=[197m/106];
若猜想Ⅲ成立,即所取固体为碳酸钠和氢氧化钠的混合物,所以生成的碳酸钡的质量n<[197m/106];
[反思]氢氧化钠溶液变质是由于和空气中的二氧化碳发生反应生成了碳酸钠的缘故,该反应的化学方程式为:2NaOH+CO2═Na2CO3+H2O.
故答案为:【猜想与假设】固体为氢氧化钠和碳酸钠;
【实验与探究】(1)
实验操作步骤 实验现象 结论及解释
步骤一:取少量固体样品于试管中,加蒸馏水完全溶解,然后加入足量的稀盐酸. 实验过程中始终没有气泡产生. 则证明猜想Ⅰ成立.
步骤二:取少量固体样品于试管中,加蒸馏水完全溶解,然后滴加氯化钡溶液. 实验过程中产生
白色沉淀. 则证明猜想Ⅱ或Ⅲ成立,此过程中发生反应的化学方程式为 BaCl2+Na2CO3═BaCO3↓+2NaCl.(2)碱;将步骤二中的氯化钡溶液改为加入过量的氯化钡溶液;
(3)n=[197m/106];n<[197m/106];
[[反思]2NaOH+CO2═Na2CO3+H2O.点评:
本题考点: 药品是否变质的探究;碱的化学性质;盐的化学性质.
考点点评: 在检验氢氧化钠是否是部分变质与检验是否变质是有区别的,检验变质只需用盐酸就可以了,而检验部分变质,还要检验是否有氢氧化钠,常用氯化钙溶液或是氯化钡溶液来进行检验.1年前查看全部
- 小红同学想探究实验室中碳酸钙和盐酸制取二氧化碳后废液中溶质的成分,请你一同参与探究并回答下列问题.
小红同学想探究实验室中碳酸钙和盐酸制取二氧化碳后废液中溶质的成分,请你一同参与探究并回答下列问题.
【提出问题】废液中的溶质是什么物质?
【作出猜想】小红认为废液中溶质只有CaCl2.你认为还可能含有的溶质是______(填化学式).
【查阅资料】CaCl2溶液呈中性.
【实验与结论】
(1)请你写出实验室制取二氧化碳的化学方程式______.
(2)分别取少量该废液和CaCl2溶液加入到两支试管中,并向其中分别滴入无色酚酞试液做对比试验,结果两支试管中溶液均无色,于是小红认为自己的猜想是正确的.你认为小红的实验______(填“能”或“不能”)证明她的猜想,理由是______.
(3)如果要证明你的猜想是正确的,你的方案是______
(4)若实验证明了你的猜想是正确的,向废液中加入过量的______固体后过滤,可以得到纯净的CaCl2溶液. 免贵姓邓1年前1
免贵姓邓1年前1 -
 pangxie2008 共回答了21个问题
pangxie2008 共回答了21个问题 |采纳率81%解题思路:【作出猜想】从盐酸与碳酸钙是否恰好完全反应的角度进行分析.
(1)熟记常用的化学方程式.
(2)从酸碱指示剂遇酸碱溶液的变色情况分析.
(3)要证明我的猜想正确,也就是要证明溶液中有盐酸,根据盐酸的化学性质设计实验进行检验.
(4)要得到纯净的氯化钙固体,也就是要将盐酸转化为氯化钙,而不能代入新的杂质.【作出猜想】若盐酸与碳酸钙恰好完全反应,溶液中的溶质是氯化钙,若盐酸过量,溶液中的溶质除了氯化钙之外还有氯化氢气体.故答案为:HCl;
(1)碳酸钙与盐酸反应生成氯化钙、水和二氧化碳.故答案为:CaCO3+2HCl═CaCl2+H2O+CO2↑;
(2)氯化钙溶液显中性,不能使酚酞溶液变色,氯化钙与盐酸的混合溶液显酸性,也不能使酚酞溶液变色,因而酚酞溶液呈无色,两种猜想都有可能.故答案为:不能; 酚酞在酸性条件和中性条件下均为无色;
(3)如果要证明你的猜想是正确的,你选择的试剂是石蕊试液,实验中可以看到的现象是石蕊试液变红色;故答案为:滴加紫色石蕊试液,观察是否变红色;
(4)要加入过量的某物质将盐酸转化为氯化钙,该物质一定不溶于水,若溶于水的话,虽然除去了盐酸,溶液中还会有剩余的该物质,那么该物质可以是碳酸钙;故答案为:碳酸钙.点评:
本题考点: 实验探究物质的组成成分以及含量;酸的化学性质;盐的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 化学实验现象是化学实验最突出、最鲜明的部分,也是进行分析推理得出结论的依据,掌握物质的性质和相互之间的反应关系,并有助于提高观察、实验能力.1年前查看全部
- 为了探究实验室中高锰酸钾样品的纯度,某学习小组称取该样品6.60g.加热(假设杂质不参加反应),冷却,称量剩余固体质量为
为了探究实验室中高锰酸钾样品的纯度,某学习小组称取该样品6.60g.加热(假设杂质不参加反应),冷却,称量剩余固体质量为5.96g.求:
(1)产生氧气的质量?
(2)该样品中高锰酸钾的质量分数? 批话超过文化1年前1
批话超过文化1年前1 -
 奇怪的小镇 共回答了17个问题
奇怪的小镇 共回答了17个问题 |采纳率88.2%解题思路:(1)根据质量守恒定律可知试管内质量的减少量就是生成氧气的质量;
(2)根据氧气的质量再计算高锰酸钾的质量,再除以样品的质量即可.(1)生成O2的质量=6.60g-5.96g=0.64g
(2)设高锰酸钾样品中高锰酸钾的质量为x
2KMnO4
△
.
K2MnO4+MnO2+O2↑
316 32
x 0.64g
根据:[316/x=
32
0.64g]
解得x=6.32g,所以高锰酸钾中样品的质量分数为:[6.32g/6.60g]×100%=95.8%
故答案为:(1)生成O2的质量为0.64克;(2)高锰酸钾样品的纯度为95.8%.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 解答本题的关键是根据质量守恒定律可知试管内质量的减少量就是生成氧气的质量,根据氧气的质量再计算高锰酸钾的质量即可.1年前查看全部
- 探究实验室中久置的氢氧化钠的变质程度.
探究实验室中久置的氢氧化钠的变质程度.
[探究方案]先称取13.3g氢氧化钠样品(杂质为碳酸钠),配成溶液,然后向溶液中逐滴加入质量分数为14.6%的稀盐酸,根据生成的二氧化碳的质量测定碳酸钠的质量,从而进一步确定样品中氢氧化钠的变质程度.
[解决问题]实验测得加入稀盐酸的质量与产生二氧化碳气体的质量关系如图所示.
[继续探究 ]求实验过程中与 NaOH反应所用盐酸的质量.]根据“与NaOH反应所用盐酸的质量”,对照图像,你发现什么问题? 家庭医生权威1年前1
家庭医生权威1年前1 -
 原野玫瑰 共回答了16个问题
原野玫瑰 共回答了16个问题 |采纳率93.8%NaOH+HCL=NACL+H2O
Na2CO3+2HCL=2NACL+H2O+CO2
由气体量可得NA2CO3的量,根据盐酸的总量可得氢氧化钠的量.1年前查看全部
- 研究性学习:探究实验室中久置的NaOH的变质程度
研究性学习:探究实验室中久置的NaOH的变质程度
[研究方案]先称取13.3g的NaOH样品(杂质为Na 2 CO 3 ),配成溶液,然后向溶液中逐滴加入质量分数为14.6%的稀盐酸,根据生成CO 2 的质量测定Na 2 CO 3 的质量.从而进一步确定样品中NaOH的变质程度.
(1)实验测得加入稀盐酸的质量与产生CO 2 气体的质量关系如图所示.填写下表:(计算结果保留小数点后一位)Na 2 CO 3 的质量/g 变质NaOH的质量/g NOH的变质程度 (用质量分数表示) (2)求实验过程中与NaOH反应所用盐酸的质量.
(3)根据“与NaOH反应所用盐酸的质量”,对照图象,你发现了什么问题?
 肖美燕1年前1
肖美燕1年前1 -
 hhzhuhong 共回答了20个问题
hhzhuhong 共回答了20个问题 |采纳率95%1年前查看全部
- 某研究性学习小组的同学为探究实验室制取氢气的方案,分别用等质量的金属A,B跟质量相同、溶质质量分
某研究性学习小组的同学为探究实验室制取氢气的方案,分别用等质量的金属A,B跟质量相同、溶质质量分
数相同的稀硫酸反应,反应生成氢气的质量与时间的关系如下图所示.分析图象得到的下列结论中,不合理的是(已知A,B在生成物中均显+2价)
A 相对原子质量a=b B反应结束后生成氢气的质量A=B
C 金属活动性A<B D 可能是硫酸均反映完 A B有剩余
请详细讲解D选项,搞不清酸、反应物的关系.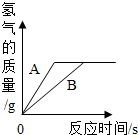
 hbin07041年前1
hbin07041年前1 -
 绿叶126 共回答了22个问题
绿叶126 共回答了22个问题 |采纳率95.5%从图上可以看到在没有反应完前,相同时间里A生成的氢气比B多,所以A比B活泼,C是错的
因为两种金属是等质量的,所以生成等质量的氢气如果生成2克,从下列方程式看如果金属全反应完,那相对原子质量是需要相等的,所以A是对的的,A+ H2SO4 = ASO4 + H2↑
B + H2SO4 = BSO4 + H2↑
由图象可知,反应结束后生成氢气的质量A=B,故B合理;
由图知,最后反应完后生成的氢气质量相等,根据质量守恒,氢气中的氢元素与硫酸中氢元素是相等的,所以肯定是硫酸反应完了,而反应等质量的硫酸,金属的相对原子质量不等,所以肯定有一种或两种同时剩余的,所以D是正确的,
不合理的选择C、
亲顺便说一下,A选项的叙述是有点问题的,没有说金属是否反应完,如果是金属反应完了那是对的,如果金属反应不完或最少有一种剩余,那A是不对的,
亲,以上都是本人自己纯手工做的,有错误,请指出.我是诚心的想帮你,若满意请请点击在下答案旁的"好评",此问题有疑问,有其他题目请另外发问,互相探讨,互相理解,请不要随意给差评,1年前查看全部
- 兴趣小组同学为了探究实验室中久置的氢氧化钙粉末的成分,进行了有关实验.请你与他们一起完成以下探究活动:
兴趣小组同学为了探究实验室中久置的氢氧化钙粉末的成分,进行了有关实验.请你与他们一起完成以下探究活动:
提出问题:这瓶氢氧化钙是否已经生成碳酸钙而变质?
进行猜想:
猜想1:氢氧化钙全部变为碳酸钙;
猜想2:氢氧化钙部分变为碳酸钙;
猜想3:氢氧化钙没有变质.
设计实验方案、进行实验:
下表是对猜想1进行实验探究的过程示例:
请你另选择一种猜想参与探究,完成下表.实 验 步 骤 实验现象 实验结论 取样,加适量水,搅拌,过滤
①取少量滤液于试管中,滴入酚酞试液
②取少量滤渣于试管中,加入盐酸①滤液不变色
②有气泡产生氢氧化钙全部
变为碳酸钙
原理与用途:实 验 步 骤 实验现象 实验结论 取样,加适量水,搅拌,过滤
①取少量滤液于试管中,滴入酚酞试液
②取少量滤渣于试管中,加入盐酸① ②
①氢氧化钙俗称______,农业上一般采用氢氧化钙改良______性土壤(选填“酸”或“碱”).
②氢氧化钙变质是由于与空气中的______发生反应的缘故,反应的化学方程式是:______,因此氢氧化钙应______保存. 风雨剑虹1年前1
风雨剑虹1年前1 -
 westgrass 共回答了19个问题
westgrass 共回答了19个问题 |采纳率78.9%解题思路:设计实验:取上述试管中的上层清液,滴加1~2滴无色酚酞试液,不变色,因此没有Ca(OH)2;往上述试管内残留的固体中加入稀盐酸,有气泡冒出,因此白色粉末中有CaCO3;由上述实验可知白色粉末的成分是:只有碳酸钙.同理可设计另一实验探究.设计实验:取上述试管中的上层清液,滴加1~2滴无色酚酞试液,不变色,因此没有Ca(OH)2;往上述试管内残留的固体中加入稀盐酸,有气泡冒出,因此白色粉末中有CaCO3;由上述实验可知白色粉末的成分是:只有碳酸钙.故答案为:Ca(OH)2微溶于水也可能不溶解而沉淀;没有Ca(OH)2;有气泡;只有CaCO3
下表是对猜想1进行实验探究的过程示例:
实 验 步 骤 实验现象 实验结论
取样,加适量水,搅拌,过滤
①取少量滤液于试管中,滴入酚酞试液
②取少量滤渣于试管中,加入盐酸 ①滤液不变色
②有气泡产生 氢氧化钙全部
变为碳酸钙根据猜想2:氢氧化钙部分变为碳酸钙;设计实验方案、进行实验:
实 验 步 骤 实验现象 实验结论
取样,加适量水,搅拌,过滤
①取少量滤液于试管中,滴入酚酞试液
②取少量滤渣于试管中,加入盐酸 溶液变为红色 氢氧化钙部分变为碳酸钙
有气泡产生原理与用途:
①氢氧化钙俗称称 熟石灰,利用中和反应,则农业上一般采用氢氧化钙改良 酸性土壤;
②氢氧化钙变质是由于与空气中的二氧化碳发生反应的缘故,反应的化学方程式是:CO2+Ca(OH)2═CaCO3↓+H2O,因此氢氧化钙应密封保存.
故答案为:
实 验 步 骤 实验现象 实验结论
取样,加适量水,搅拌,过滤
①取少量滤液于试管中,滴入酚酞试液
②取少量滤渣于试管中,加入盐酸 溶液变为红色 氢氧化钙部分变为碳酸钙
有气泡产生原理与用途:①熟石灰,酸;②CO2+Ca(OH)2═CaCO3↓+H2O,密封.点评:
本题考点: 实验探究物质的组成成分以及含量;证明碳酸盐;常见碱的特性和用途;碱的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 有关实验方案的设计和对实验方案的评价是中考的热点之一,设计实验方案时,要注意用最少的药品和最简单的方法;关于对实验设计方案的评价,要在两个方面考虑,一是方案是否可行,能否达到实验目的;二是设计的方法进行比较,那种方法更简便.1年前查看全部
- 某化学实验活动小组的同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验.请你参与他们进行的探究活动:
某化学实验活动小组的同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验.请你参与他们进行的探究活动:
【提出问题】久置氢氧化钠固体的成分是什么?
【猜想与假设】
猜想Ⅰ:全部是NaOH;猜想Ⅱ:全部是Na2CO3;猜想Ⅲ:______.
【实验与探究】
实验如下:
【反思与交流】久置的固体氢氧化钠变质的原因是(用化学方程式表示)______.实验操作步骤 实验现象 结论及解释 步骤一:取少量固体样品于试管中,加蒸馏水完全溶解,然后加入足量的稀盐酸.
实验过程中始终没有气泡产生.
则证明猜想______成立.步骤二:另取少量固体样品于试管中,加蒸馏水完全溶解,然后滴加氯化钡溶液.
实验过程中产生.
则证明猜想Ⅱ或Ⅲ成立. 黄aa化1年前1
黄aa化1年前1 -
 落英无痕36 共回答了9个问题
落英无痕36 共回答了9个问题 |采纳率88.9%解题思路:【猜想与假设】氢氧化钠若变质,其产物为碳酸钠,所以可以据此结合题中的猜想完成解答;
【实验与探究】(1)(2)碳酸钠可以和盐酸反应生成二氧化碳气体,可以据此解答该题;
【反思与交流】氢氧化钠易潮解,潮解之后会和空气的二氧化碳反应生成碳酸钠而变质,可以据此解答该题.【猜想与假设】若氢氧化钠部分变质,则该固体为氢氧化钠和碳酸钠的混合物;
【实验与探究】碳酸钠可以和稀盐酸反应生成气体,所以若没有明显现象,则该固体中没有碳酸钠,即只有氢氧化钠,即猜想Ⅰ成立;
【反思与交流】氢氧化钠易潮解,潮解之后会和空气的二氧化碳反应生成碳酸钠而变质,该反应的化学方程式为:2NaOH+CO2═Na2CO3+H2O.
故答案为:【猜想与假设】该固体为氢氧化钠和碳酸钠的混合物;
【实验与探究】Ⅰ;
【反思与交流】2NaOH+CO2═Na2CO3+H2O.点评:
本题考点: 实验探究物质的组成成分以及含量;碱的化学性质;盐的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 在检验氢氧化钠是否是部分变质与检验是否变质是有区别的,检验变质只需用盐酸就可以了,而检验部分变质,还要检验是否有氢氧化钠,常用氯化钙溶液或是氯化钡溶液来进行检验.1年前查看全部
- 某探究小组在实验室里探究实验室制取二氧化碳的原理,(仪器有石灰石、稀盐酸、稀硫酸、水、碳酸钠、碳酸钙粉末等)他们将两块石
某探究小组在实验室里探究实验室制取二氧化碳的原理,(仪器有石灰石、稀盐酸、稀硫酸、水、碳酸钠、碳酸钙粉末等)他们将两块石灰石分别放入稀盐酸和稀硫酸中发现了一个现象,稀盐酸与石灰石反应速率快,而稀硫酸与石灰石反应速率却很慢,这是为什么呢?小组成员查阅资料发现:化学反应速率和温度、反应物的接触面积、催化剂、反应物浓度四大因素有关.于是小组提出如下四大猜想,请你完成下列有关问题:
猜想:1、温度太低.
2、稀硫酸中的石灰石与稀硫酸接触面积太小.
3、水和石灰石能反应,HCl对反应有催化作用.
4、______.
小组进行实验探究如下:
首先排除猜想1,原因是______;
对于猜想2我们可以采取的验证实验是______;
若你还能对猜想3和4提出合理的验证实验,每写对一个加两分,最多奖励4分.(化学试卷总分不超过60分).
对于猜想3我们可以采取的验证实验是______;
对于猜想4我们可以采取的验证实验是______. hxf645941年前1
hxf645941年前1 -
 mo4024 共回答了17个问题
mo4024 共回答了17个问题 |采纳率94.1%对于盐酸和硫酸铜石灰石反应导致的不同速率,可以想到对反应影响的四个因素,所以要从温度、接触面积、催化剂、反应物浓度来考虑.所以第四个猜想就是:用到的硫酸的浓度偏低.
对于四个猜想的验证,有些需要验证,有些是不需要验证的,如第一个猜想问题问题,由于先前实验时温度是相同的,所以这两实验的速率与温度没有直接关系.对于后三个猜想,需要对应相同变量进行变化就可以.猜想3是验证是否为催化剂,此时可以借助催化剂的化学性质不变,若为催化剂,则反应后在石灰石剩余的情况下,溶液显酸性,所以可以加入紫色石蕊试液检验溶液是否显酸性.
故答案为:4、由于用到的硫酸的浓度偏低.
小组进行实验探究如下:
首先排除猜想1,原因是 在相同温度下完成的实验;
对于猜想2我们可以采取的验证实验是 加入颗粒相对更小的石灰石进行实验;
对于猜想3我们可以采取的验证实验是 实验完毕后滴入紫色湿润试液检验溶液是否显酸性;
对于猜想4我们可以采取的验证实验是 加入高浓度的硫酸进行实验,观察反应速度.1年前查看全部
- (2010•崇左)我市某中学化学兴趣小组为探究实验室制取氧气.把干燥、纯净的氯酸钾和二氧化锰的混合物30g装入大试管中,
(2010•崇左)我市某中学化学兴趣小组为探究实验室制取氧气.把干燥、纯净的氯酸钾和二氧化锰的混合物30g装入大试管中,加热.(化学方程式为:2KClO3
2KCl+3O2↑)待反应完全后,将试管冷却、称量,得到20.4g固体物质.MnO2 .△
试计算:
(1)完全反应后制得氧气多少克?
(2)原混合物中氯酸钾的质量分数.(计算结果用百分数表示,保留到小数点后一位数字) renxuebing1年前1
renxuebing1年前1 -
 乌云一整片 共回答了23个问题
乌云一整片 共回答了23个问题 |采纳率100%解题思路:根据质量守恒定律可知试管内物质质量的减少量就是生成的氧气的质量,根据方程式由氧气的质量,列比例式计算出参加反应的氯酸钾的质量,再除以原混合物的质量即可.(1)由于是完全反应,根据质量守恒,减少的质量就是生成的氧气的质量,即制得氧气:30g-20.4g=9.6g
(2)设氯酸钾质量为x:
2KClO3
MnO2
.
△2KCl+3O2↑
24596
x 9.6g
[245/x=
96
9.6g]
x=24.5g
原混合物中氯酸钾的质量分数为:[24.5/30g]×100%=81.7%
答:原混合物中氯酸钾的质量分数是81.7%.
故答案为:(1)9.6g;(2)81.7%.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 做本题的关键是要分析出试管内质量的减少量就是生成的氧气质量,再根据氧气质量进行进一步计算.1年前查看全部
- (2010•烟台)兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验.请你与他们一起完成以下探究活动:
(2010•烟台)兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验.请你与他们一起完成以下探究活动:
(查阅资料)Na2CO3溶液呈碱性.
(对固体猜想)
猜想Ⅰ.全部是NaOH;
猜想Ⅱ.全部是Na2CO3
猜想Ⅲ.______.(实验和推断)
(1)若现象a为有气泡产生,则加入的A溶液是______,说明氢氧化钠______(填“已经”或“没有”)变质,有气泡产生的反应的化学方程式是______.
(2)若A是Ca(OH)2溶液,现象a有白色沉淀,现象b为无色酚酞试液变红色,则白色沉淀为______(填化学式),该实验______(填“能”或“不能”)说明样品中有NaOH.
(3)若A是CaCl2溶液.①现象a有白色沉淀产生,现象b无色酚酞不变红色,则猜想______成立.
②猜想Ⅲ成立的实验现象是______.
(反思)①久置的氢氧化钠变质的原因是______(用化学方程式表示).
②保存氢氧化钠的方法是______. 天翔1年前1
天翔1年前1 -
 杏杏_nn 共回答了20个问题
杏杏_nn 共回答了20个问题 |采纳率95%解题思路:猜想III:氢氧化钠因吸收空气中的二氧化碳生成碳酸钠而变质,若全部变质则固体全部为碳酸钠,若部分变质则为氢氧化钠和碳酸钠,若未变质则固体为氢氧化钠;
(1)碳酸钠与盐酸反应生成氯化钠、水和二氧化碳;滴加稀盐酸有气体放出时,说明氢氧化钠中含有碳酸钠,已经变质;
(2)碳酸钠可与氢氧化钙反应,生成碳酸钙沉淀和氢氧化钠;向反应后的溶液中滴加无色酚酞时,生成的氢氧化钠使酚酞变红色,因此不能依此现象判断原固体物质中含氢氧化钠;
(3)碳酸钠溶液与氯化钙反应生成碳酸钙沉淀和氯化钠,反应后溶液呈中性,滴加无色酚酞不变色;若滴加酚酞后溶液变红色则说明原固体中含有氢氧化钠;
(反思)氢氧化钠能吸收空气中的水和二氧化碳而潮解、变质,因此,氢氧化钠需要密封保存.猜想Ⅲ:久置的氢氧化钠固体可能出现:不变质,固体仍为氢氧化钠;部分变质,固体为氢氧化钠和碳酸钠的混合物;全部变质,固体为碳酸钠;
故答案为:NaOH和Na2CO3混合物;
(1)向溶液中滴加稀盐酸,盐酸与碳酸钠反应,生成氯化钠、水和二氧化碳,观察到有气泡产生,说明氢氧化钠已经变质;
故答案为:HCl(或稀H2SO4等酸);已经;Na2CO3+2HCl═2NaCl+H2O+CO2↑;
(2)向溶液中滴加氢氧化钙溶液,氢氧化钙与碳酸钠反应可生成碳酸钙沉淀和氢氧化钠;由于反应可生成氢氧化钠,因此滴入酚酞变红不能说明原来溶液中含有氢氧化钠;
故答案为:CaCO3;不能;
(3)①向溶液中滴加氯化钙,氯化钙与碳酸钠反应生成碳酸钙沉淀和氯化钠;再滴入的酚酞试液不变红,说明溶液中不含氢氧化钠;可判断原固体全部为碳酸钠;故猜想II成立;
故答案为:Ⅱ;
②如果固体为氢氧化钠和碳酸钠的混合物,滴入的氯化钙与碳酸钠反应生成白色沉淀;滴入的酚酞遇氢氧化钠变成红色;
故答案为:现象a有白色沉淀产生,现象b无色酚酞变红色;
(反思)①氢氧化钠可以吸收二氧化碳,反应后生成碳酸钠和水,使氢氧化钠变质;
故答案为:CO2+2NaOH═Na2CO3+H2O;
②为避免氢氧化钠在保存过程中吸收空气中水和二氧化碳,保存时应密封保存;
故答案为:密封保存.点评:
本题考点: 药品是否变质的探究;碳酸钠、碳酸氢钠与碳酸钙;书写化学方程式、文字表达式、电离方程式.
考点点评: 氢氧化钠因吸收二氧化碳生成碳酸钠而变质,因此,在探究氢氧化钠变质情况时,需要考虑到碳酸钠溶液对氢氧化钠溶液的影响,一般地,可通过滴加氯化钙等盐把碳酸反应而除去,然后检验是否含有氢氧化钠.1年前查看全部
- 某化学实验活动小组的同学为了探究实验室中久置氢氧化钠固体的成分,进行了有关实验,请你参与他们进行的探究活动:
某化学实验活动小组的同学为了探究实验室中久置氢氧化钠固体的成分,进行了有关实验,请你参与他们进行的探究活动:
【猜想与假设】
猜想Ⅰ:全部是NaOH;
猜想Ⅱ:全部是Na2CO3
猜想Ⅲ:______.
【实验与探究】
(1)实验如下:
(2)为了进一步的验证猜想结果,小明同学提出了如下实验方案:继续步骤二的实验,过滤,然后向滤液中滴加无色酚酞试液,若酚酞变红,则猜想Ⅲ成立;若酚酞不变红,则猜想Ⅱ成立.实验操作步骤 实验现象 结论及解释 步骤一:取少量固体样品于试管中,加蒸馏水完全溶解,然后加入足量的稀盐酸. 实验过程中始终没有气泡产生. 则证明猜想______成立. 步骤二:取少量固体样品于试管中,加蒸馏水完全溶解,然后滴加氯化钡溶液. 实验过程中产生
______.则证明猜想Ⅱ或Ⅲ成立,此过程中发生反应的化学方程式为______.
小华同学立即对小明同学的方案提出了质疑,通过查阅资料知道,氯化钡溶液程中性,不能使无色酚酞试液变红,但碳酸钠溶液呈______性(填“酸”或“碱”)能使酚酞变红.因此,他认为该方案的操作步骤中应该改进的是______.
(3)实验小组的同学展开讨论,又提出了一个定量试验方案,通过测定产生沉淀的质量来证明猜想Ⅱ或Ⅲ成立.试验如下:准确称量m克固体样品于试管中,加热蒸馏水完全溶解,然后滴加足量氯化钡溶液,充分反映后过滤、洗涤、干燥称的沉淀的质量为n克,若猜想Ⅱ成立,则m与n的关系式为(用含m和n的等式或不等式表示,下同)______;若猜想Ⅲ成立,则m与n的关系式又为______.
【反思与交流】久置固体氢氧化钠变质的原因是(用化学方程式表示)______. -︻︼─一0071年前1
-︻︼─一0071年前1 -
 jantty 共回答了28个问题
jantty 共回答了28个问题 |采纳率92.9%解题思路:【猜想与假设】氢氧化钠若变质,其产物为碳酸钠,所以可以据此结合题中的猜想完成解答;
【实验与探究】(1)碳酸钠可以和稀盐酸反应生成气体,而氢氧化钠和稀盐酸反应时没有明显现象,氯化钡溶液和碳酸钠反应生成白色沉淀,可以据此解答该题;
(2)碳酸钠溶液与氢氧化钡溶液反应生成了氢氧化钠呈碱性,可以使酚酞变红,所以为了防止反应生成的氢氧化钠干扰实验应该加入过量的氯化钡溶液,可以据此进行解答;
(3)根据氯化钡和碳酸钠溶液反应的化学方程式可以得出m和n的关系,然后根据题中的信息进行解答即可;
[反思]氢氧化钠溶液变质是由于和空气中的二氧化碳发生反应生成了碳酸钠的缘故,可以据此写出该反应的化学方程式.【猜想与假设】氢氧化钠若变质,其产物为碳酸钠,若氢氧化钠部分变质,则该固体为氢氧化钠和碳酸钠混合物;
【实验与探究】(1)碳酸钠可以和稀盐酸反应生成气体,所以若没有明显现象,则该固体中没有碳酸钠,即只有氢氧化钠,即猜想Ⅰ成立;
氯化钡溶液和碳酸钠反应生成白色沉淀碳酸钡和氯化钠,所以若观察到产生了白色沉淀,则说明在该固体中含有碳酸钠,即猜想Ⅱ或猜想Ⅲ成立;该化学方程式为:BaCl2+Na2CO3═BaCO3↓+2NaCl;
(2)通过查阅资料知道,氯化钡溶液呈中性,不能使无色酚酞试液变红,但碳酸钠溶液呈碱性,能使酚酞变红;而碳酸钠溶液与氢氧化钡溶液反应生成了氢氧化钠,可以是酚酞变红,所以为了防止碳酸钠干扰实验应该将步骤二中的氯化钡溶液改为加入过量的氯化钡溶液;
(3)假设所取的mg固体全部为碳酸钠,则:
Na2CO3+BaCl2═BaCO3↓+2NaCl
106 197
m n
[106/m]=[197/n]
即:n=[197m/106]
若猜想Ⅱ成立,即全部是碳酸钠,那么n和m的关系为:n=[197m/106];
若猜想Ⅲ成立,即所取固体为碳酸钠和氢氧化钠的混合物,所以生成的碳酸钡的质量n<[197m/106];
[反思]氢氧化钠溶液变质是由于和空气中的二氧化碳发生反应生成了碳酸钠的缘故,该反应的化学方程式为:2NaOH+CO2═Na2CO3+H2O.
故答案为:【猜想与假设】固体为氢氧化钠和碳酸钠;
【实验与探究】(1)
实验操作步骤 实验现象 结论及解释
步骤一:取少量固体样品于试管中,加蒸馏水完全溶解,然后加入足量的稀盐酸. 实验过程中始终没有气泡产生. 则证明猜想Ⅰ成立.
步骤二:取少量固体样品于试管中,加蒸馏水完全溶解,然后滴加氯化钡溶液. 实验过程中产生
白色沉淀. 则证明猜想Ⅱ或Ⅲ成立,此过程中发生反应的化学方程式为 BaCl2+Na2CO3═BaCO3↓+2NaCl.(2)碱;将步骤二中的氯化钡溶液改为加入过量的氯化钡溶液;
(3)n=[197m/106];n<[197m/106];
[[反思]2NaOH+CO2═Na2CO3+H2O.点评:
本题考点: 药品是否变质的探究;碱的化学性质;盐的化学性质.
考点点评: 在检验氢氧化钠是否是部分变质与检验是否变质是有区别的,检验变质只需用盐酸就可以了,而检验部分变质,还要检验是否有氢氧化钠,常用氯化钙溶液或是氯化钡溶液来进行检验.1年前查看全部
- 为了探究实验室中久置的生石灰样品变质情况,同学们进行如下图所示的实验。下列分析和结论不正确的是
为了探究实验室中久置的生石灰样品变质情况,同学们进行如下图所示的实验。下列分析和结论不正确的是

A.该样品已完全变质 B.液体丙呈红色或无色 C.该样品中一定含有碳酸钙 D.白色固体甲可能为Ca(OH) 2 和CaCO 3 的混合物  南宫寒傲1年前1
南宫寒傲1年前1 -
 O_N_S 共回答了25个问题
O_N_S 共回答了25个问题 |采纳率92%A
1年前查看全部
- 三位同学在物理自主探究实验室采用如图所示三种不同装置将同一物体匀速提升相同的高度(每个滑轮的重相同,绳重和摩擦可以忽略)
三位同学在物理自主探究实验室采用如图所示三种不同装置将同一物体匀速提升相同的高度(每个滑轮的重相同,绳重和摩擦可以忽略).以下说法正确的是( ) A.有用功相同,使用甲装置做的总功比乙和丙都少,所以甲的机械效率最高 B.只要提升相同的重物,丙的机械效率总是低于乙 C.总功相同,使用丙装置做的有用功最多,所以丙的机械效率最高 D.不论提升重物重力是否相同,甲和乙的机械效率总是相同的 
 明华法师1年前1
明华法师1年前1 -
 pxj1024 共回答了24个问题
pxj1024 共回答了24个问题 |采纳率95.8%∵W 有用 =G 物 h,W 额外 =G 动 h,W 总 =W 有用 +W 额外 ,
∴滑轮组的机械效率η=
W 有用
W 总 =
G 物 h
(G 物 + G 动 )h =
G 物
G 物 + G 动 ,即η=
G 物
G 物 + G 动 ,
∵甲乙只有一个动滑轮,丙有两个动滑轮,因此提升相同的重物时,
甲乙的机械效率相等,都大于丙的机械效率,故AC错误,B正确;
由η=
G 物
G 物 + G 动 可知,当提升重物的重力不同时,甲与乙的机械效率不同,故D错误;
故选B.1年前查看全部
- (2014•荔湾区模拟)兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验:
(2014•荔湾区模拟)兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验:
(1)氢氧化钠固体要密封保存,原因有:
①______;②______.
【对固体猜想】
猜想一:全部是NaOH;猜想二:全部是Na2CO3;猜想三:是NaOH和Na2CO3混合物
【实验和推断】(2)为进一步确定成分,进行了以下探究:
对无色溶液进行以下实验:
③分析:小组中有同学提出质疑,认为以上实验不能证明猜想三成立,理由是:______.实验操作 实验现象 实验结论 第一步:
用试管取约2mL该溶液,滴入适量氢氧化钙溶液,振荡.
现象a:白色沉淀化学方程式:
①______,有碳酸钠并全部除尽.第二步:
静置,取上层清液于试管中滴入酚酞溶液,振荡.现象b:
②______含有NaOH,猜想三成立,是NaOH和Na2CO3混合物
④反思:把第一步中的氢氧化钙溶液换成______溶液,可达到实验目的.
(3)请利用以下提供的试剂,设计实验证明猜想一是正确的,即氢氧化钠没有变质.
提供的试剂有:酚酞溶液、稀盐酸、氢氧化钡溶液、氯化钡溶液实验操作 实验现象 实验结论 ______ ______ ______  396071821年前1
396071821年前1 -
 果冻的心 共回答了19个问题
果冻的心 共回答了19个问题 |采纳率94.7%解题思路:(1)氢氧化钠溶液变质是由于和空气中的二氧化碳发生反应生成了碳酸钠的缘故解答;
(2)
①碳酸钠溶液与氢氧化钙溶液反应生成了碳酸钙沉淀和氢氧化钠解答;
②氢氧化钠呈碱性,可以使酚酞变红解答;
③碳酸钠溶液与氢氧化钙溶液反应生成了氢氧化钠,也可以使酚酞变红;
④氯化钙溶液和碳酸钠反应生成白色沉淀碳酸钡和氯化钠解答;
(3)
碳酸钠可以和稀盐酸反应生成气体,所以若没有明显现象,则该固体中没有碳酸钠,即只有氢氧化钠,可以据此进行解答;(1)氢氧化钠固体要密封保存,原因有氢氧化钠固体易吸收空气中的水分,还和空气中的二氧化碳发生反应生成了碳酸钠而变质,故要密封保存;
(2)
①用试管取约2mL该溶液,滴入适量氢氧化钙溶液,振荡,碳酸钠溶液与氢氧化钙溶液反应生成了碳酸钙沉淀和氢氧化钠,证明有碳酸钠并全部除尽,反应化学方程式为:Na2CO3+Ca(OH)2=2NaOH+CaCO3↓;
②静置,取上层清液于试管中滴入酚酞溶液,振荡,酚酞变红,说明有氢氧化钠存在,猜想三成立,是NaOH和Na2CO3混合物;
③碳酸钠溶液与氢氧化钙溶液反应生成了氢氧化钠,也可以使酚酞变红,不能说明是原溶液中的氢氧化钠还是刚生成的氢氧化钠;
④为了排除氢氧化钙溶液与碳酸钠溶液反应生成氢氧化钠,干扰第二步氢氧化钠的检验,把第一步中的氢氧化钙溶液换成氯化钙溶液,可达到实验目的.
(3)碳酸钠可以和稀盐酸反应生成气体,所以若没有明显现象,则该固体中没有碳酸钠,即只有氢氧化钠,即猜想Ⅰ成立;
答案:
(1)
①氢氧化钠固体易潮解;
②氢氧化钠与空气中二氧化碳反应变质.
(2)
①Na2CO3+Ca(OH)2=2NaOH+CaCO3↓
②液体变红
③第一步氢氧化钙溶液与碳酸钠溶液反应生成氢氧化钠,干扰第二步氢氧化钠的检验
④氯化钙
(3)
实验操作实验现象实验结论
用试管取约2mL无色溶液滴入过量稀盐酸,振荡无明显现象固体中没有碳酸钠,即猜想一正确点评:
本题考点: 实验探究物质的组成成分以及含量;碱的化学性质;盐的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 在检验氢氧化钠是否是部分变质与检验是否变质是有区别的,检验变质只需用盐酸就可以了,而检验部分变质,还要检验是否有氢氧化钠,常用氯化钙溶液或是氯化钡溶液来进行检验.1年前查看全部
- (2006•济宁)某课外活动小组为探究实验室制取氢气的方案,分别用金属A、B跟质量相同、质量分数相同的稀硫酸反应,经实验
 (2006•济宁)某课外活动小组为探究实验室制取氢气的方案,分别用金属A、B跟质量相同、质量分数相同的稀硫酸反应,经实验发现:生成氢气的质量与反应时间有下图所示关系.分析图象得到的以下结论中,不合理的是( )
(2006•济宁)某课外活动小组为探究实验室制取氢气的方案,分别用金属A、B跟质量相同、质量分数相同的稀硫酸反应,经实验发现:生成氢气的质量与反应时间有下图所示关系.分析图象得到的以下结论中,不合理的是( )
A.反应得到氢气的质量相等
B.反应后所得溶液的质量分数A>B
C.两种金属的活动顺序A>B
D.稀硫酸已完全反应,两种金属可能有剩余 红树林_1年前1
红树林_1年前1 -
 333333ffff2 共回答了20个问题
333333ffff2 共回答了20个问题 |采纳率95%解题思路:通过图象可知金属A、B与酸反应的速率(A上升幅度较大故反应速率较快、B反应速率较慢)因金属性越强反应速率越快,由此可推出金属活动性顺序:A>B;并结合一种物质过量则另一种反应物一定完全反应,可推出金属和酸的用量问题.A、由图象可知最终金属A和金属B生成的氢气质量相等.故A合理.
B、参加反应的稀硫酸的质量和生成的氢气的质量是相等的,故决定溶液质量分数的是参加反应的金属A、B的质量,而参加反应的金属A、B的质量无法确定,故不能断定溶液质量分数A>B;故不合理
C、金属的活动性越强,反应越快,所以金属的活动性:A>B.故C合理.
D、酸完全反应,金属应该足量,所以两种金属可能有剩余;故D合理.
故选B.点评:
本题考点: 金属活动性顺序及其应用;酸的化学性质.
考点点评: 此题综合性较强,不仅需要根据图象和题意分析出直接信息,还需要根据计算得出用量问题.1年前查看全部
- 课外活动小组的同学为了探究实验室的一种黑色粉末和一瓶标签破损的无色溶液(如图)可能是什么物质,大胆猜想并设计实验进行验证
 课外活动小组的同学为了探究实验室的一种黑色粉末和一瓶标签破损的无色溶液(如图)可能是什么物质,大胆猜想并设计实验进行验证,请你参与他们的探究.
课外活动小组的同学为了探究实验室的一种黑色粉末和一瓶标签破损的无色溶液(如图)可能是什么物质,大胆猜想并设计实验进行验证,请你参与他们的探究.
【发现问题】当把黑色粉末与无色溶液混合时,立即产生气泡.
【查阅资料】初中化学实验室常见的黑色粉末有CuO.MnO2.Fe3O4.铁粉.炭粉等.
【提出假设】黑色粉末是______,无色溶液是______.(只写一种假设)
【设计实验】①向盛有少许黑色粉末的试管中加入适量试剂瓶中的无色溶液;②用试管收集气体;③检验气体(写出操作方法)______.
【实验现象】______.
【实验结论】
(1)黑色粉末与无色溶液混合时发生反应的表达式是2H2O2
2H2O+O2↑MnO2 .2H2O2;
2H2O+O2↑MnO2 .
(2)此气体是______,原假设______. qinyingying_5211年前1
qinyingying_5211年前1 -
 xdl_8341 共回答了23个问题
xdl_8341 共回答了23个问题 |采纳率91.3%解题思路:根据所学知识结合缺失标签可知:黑色粉末中有二氧化锰和铁粉能与某种无色液体(符合标签特征的有双氧水和硫酸)反应放出气体作出猜想,进而设计实验作出解答.【提出假设】所以黑色粉末是MnO2;无色溶液是过氧化氢溶液;
【设计实验】①向盛有少许黑色粉末的试管中加入适量试剂瓶中的无色溶液;②用试管收集气体;③检验气体将带火星的木条伸入试管中;
【实验现象】氧气能够支持燃烧,带火星的木条复燃;
【实验结论】①双氧水在二氧化锰的催化作用下生成水和氧气,反应的化学方程式为:2H2O2
MnO2
.
2H2O+O2↑.
②此气体是O2,原假设成立
答案:
假设一:
[提出假设]二氧化锰;双氧水
[设计实验]用带火星的木条伸入试管中
[实验现象]带火星的木条复燃
[实验结论]
①2H2O2
MnO2
.
2H2O+O2↑.
②氧气;成立点评:
本题考点: 缺失标签的药品成分的探究;实验室制取氧气的反应原理;氧气的检验和验满;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题是一道综合性试题,既考查了学生对知识的整合能力同时又考查了学生进行实验探究的能力.1年前查看全部
- 某校研究性学习小组的同学探究实验室久置的NaOH的变质程度,称取13.3g的NaOH样品(杂质为Na2CO3),配成溶液
 某校研究性学习小组的同学探究实验室久置的NaOH的变质程度,称取13.3g的NaOH样品(杂质为Na2CO3),配成溶液,然后向溶液中逐滴加入质量分数为14.6%稀盐酸,所加稀盐酸与产生的二氧化碳气体的质量关系如图.
某校研究性学习小组的同学探究实验室久置的NaOH的变质程度,称取13.3g的NaOH样品(杂质为Na2CO3),配成溶液,然后向溶液中逐滴加入质量分数为14.6%稀盐酸,所加稀盐酸与产生的二氧化碳气体的质量关系如图.
求:(1)样品中碳酸钠的质量分数.
(2)恰好完全反应时溶液中溶质的质量. 观士音菩萨1年前1
观士音菩萨1年前1 -
 2002到2006年 共回答了14个问题
2002到2006年 共回答了14个问题 |采纳率100%解题思路:(1)根据盐酸与碳酸钠反应的化学方程式和生成的二氧化碳的质量,列出比例式,就可计算出该样品中Na2CO3的质量;再根据Na2CO3的质量分数的计算方法即可求得样品中Na2CO3的质量分数;
(2)根据碳酸钠的质量可以求得样品中氢氧化钠的质量,再根据氢氧化钠的质量可以求得反应产生的氯化钠的质量;则完全反应后溶质的质量为碳酸钠与盐酸反应生成的氯化钠的质量加氢氧化钠与盐酸反应生成氯化钠的质量;(1)由图象可知:完全反应后生成的二氧化碳的质量是2.2g;设13.3g样品中碳酸钠的质量是x,产生氯化钠的质量为y;Na2CO3+2HCl═2NaCl+H2O+CO2↑106 11...
点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 在碱和盐的混合溶液中滴加盐酸时,盐酸首先与碱反应,然后再跟盐反应,所以在氢氧化钠和碳酸钠的混合物中滴加盐酸,一开始没有二氧化碳产生.1年前查看全部
- 某兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,
某兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,
进行了有关实验.请你与他们一起完成以下探究活动:
【对固体猜想】
猜想I:全部是Na2CO3,猜想的依据是______;
猜想Ⅱ:全部是NaOH猜想Ⅲ部分是NaOH,部分是Na2CO3.
【实验和推断】
(1)若现象A为有气泡产生,则加入的X溶液是______,说明氢氧化钠已经变质,有气泡产生的反应的化学方程式是______.实验步骤 实验现象 ①取少量白色固体于试管中,加水振荡后,至全部溶解. 无色溶液 ②向试管的溶液中滴加适量物质X的溶液 现象A ③再向试管中滴加几滴酚酞试液. 现象B
(2)若X是Ca(OH)2溶液,现象A有白色沉淀,现象B为无色酚酞试液变红色,则白色沉淀为______(填化学式),该实验______ (填“能”或“不能”)说明样品中有NaOH. 香榭里舍1年前1
香榭里舍1年前1 -
 粉色qq 共回答了16个问题
粉色qq 共回答了16个问题 |采纳率100%解题思路:猜想:氢氧化钠和空气中的二氧化钠反应生成碳酸钠和水,所以有三种情况.
实验和推断:
(1)氢氧化钠变质,就是说生成碳酸钠,碳酸钠和盐酸反应生成氯化钠和水和二氧化碳.
(2)氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,生成的氢氧化钠能使酚酞变红,因此无法判断原物质中是否有氢氧化钠.猜想:氢氧化钠和空气中的二氧化钠反应生成碳酸钠和水.如果部分参加反应,则最后成分是碳酸钠和氢氧化钠;如果全部参加反应,则最后是碳酸钠.故答案为:NaOH与CO2反应生成.
(1)根据题目信息(氢氧化钠已经变质)可知成分中有碳酸钠.碳酸钠和盐酸生成氯化钠和水和二氧化碳.故答案为:盐酸,Na2CO3+2HCl═2NaCl+H2O+CO2↑.
(2)氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,生成的氢氧化钠能使酚酞变红,因此无法判断原物质中是否有氢氧化钠.故答案为:CaCO3;不能.
故答案为:
猜想I:NaOH与CO2反应生成;(1)盐酸,Na2CO3+2HCl═2NaCl+H2O+CO2↑;(2)CaCO3;不能.点评:
本题考点: 药品是否变质的探究;碱的化学性质;盐的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: (2)在判断是否有氢氧化钠时,一定注意反应产物中的氢氧化钠也可以使酚酞变红,学生要留意.1年前查看全部
- 某兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验.请你与他们一起完成以下探究活动:对固体猜想:
某兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验.请你与他们一起完成以下探究活动:对固体猜想:
(1)猜想I:全部是Na 2 CO 3 ,猜想的依据是 _________ ;
猜想Ⅱ:全部是NaOH
猜想Ⅲ:部分是NaOH,部分是Na 2 CO 3 .试验和推断:
(2)若现象A为有气泡产生,则加入的X溶液是 _________ ,说明氢氧化钠已经变质,有气泡产生的反应的化学方程式是 _________ .
(3)若X是Ca(OH) 2 溶液,现象A有白色沉淀,现象B为无色酚酞试液变红色,则白色沉淀为 _________ (填化学式),该实验 _________ (填“能”或“不能”)说明样品中有NaOH.
(4)若X是CaCl 2 溶液,猜想Ⅲ成立的实验现象是 _________ 、 _________ . VOLVO大姐1年前1
VOLVO大姐1年前1 -
 天开 共回答了9个问题
天开 共回答了9个问题 |采纳率88.9%猜想I:CO 2 +2NaOH=Na 2 CO 3 +H 2 O(或空气中的CO 2 与NaOH反应生成Na 2 CO 3 )
(1)稀盐酸(或稀硫酸等酸);Na 2 CO 3 +2HCl=2NaCl+H 2 O+CO 2 ↑(与所选的酸对应,合理均可)
(2)CaCO 3 ;不能
(3)现象A有白色沉淀产生;现象B为无色酚酞变红色1年前查看全部
- 某探究小组在实验室里探究实验室制取二氧化碳的原理,(仪器有石灰石、稀盐酸、稀硫酸、水、碳酸钠、碳酸钙粉末等)他们将两块石
某探究小组在实验室里探究实验室制取二氧化碳的原理,(仪器有石灰石、稀盐酸、稀硫酸、水、碳酸钠、碳酸钙粉末等)他们将两块石灰石分别放入稀盐酸和稀硫酸中发现了一个现象,稀盐酸与石灰石反应速率快,而稀硫酸与石灰石反应速率却很慢,这是为什么呢?小组成员查阅资料发现:化学反应速率和温度、反应物的接触面积、催化剂、反应物浓度四大因素有关.于是小组提出如下四大猜想,请你完成下列有关问题:
猜想:1、温度太低.
2、稀硫酸中的石灰石与稀硫酸接触面积太小.
3、水和石灰石能反应,HCl对反应有催化作用.
4、______.
小组进行实验探究如下:
首先排除猜想1,原因是______;
对于猜想2我们可以采取的验证实验是______;
若你还能对猜想3和4提出合理的验证实验,每写对一个加两分,最多奖励4分.(化学试卷总分不超过60分).
对于猜想3我们可以采取的验证实验是______;
对于猜想4我们可以采取的验证实验是______. 我没运气1年前1
我没运气1年前1 -
 baicai3310 共回答了16个问题
baicai3310 共回答了16个问题 |采纳率87.5%解题思路:对于实验速率的影响,一般要考虑的因素就是温度和接触面积以及催化剂、反应物浓度等.对于改变反应也是从这几个角度进行出发的.而对于探究给定实验的速率影响,需要设计对应的控制变量来实现对问题的解决.对于盐酸和硫酸铜石灰石反应导致的不同速率,可以想到对反应影响的四个因素,所以要从温度、接触面积、催化剂、反应物浓度来考虑.所以第四个猜想就是:用到的硫酸的浓度偏低.
对于四个猜想的验证,有些需要验证,有些是不需要验证的,如第一个猜想问题问题,由于先前实验时温度是相同的,所以这两实验的速率与温度没有直接关系.对于后三个猜想,需要对应相同变量进行变化就可以.猜想3是验证是否为催化剂,此时可以借助催化剂的化学性质不变,若为催化剂,则反应后在石灰石剩余的情况下,溶液显酸性,所以可以加入紫色石蕊试液检验溶液是否显酸性.
故答案为:4、由于用到的硫酸的浓度偏低.
小组进行实验探究如下:
首先排除猜想1,原因是 在相同温度下完成的实验;
对于猜想2我们可以采取的验证实验是 加入颗粒相对更小的石灰石进行实验;
对于猜想3我们可以采取的验证实验是 实验完毕后滴入紫色石蕊试液检验溶液是否显酸性;
对于猜想4我们可以采取的验证实验是 加入高浓度的硫酸进行实验,观察反应速度.点评:
本题考点: 影响化学反应速率的因素探究;猜想与事实验证.
考点点评: 反应速率的影响或者是催化剂的探究,其实就是变量控制的过程,这个过程中要让所要验证变量之外的量保持不变,只改变其一,这样结论才有对比意义,结论也才能达到印证的目的1年前查看全部
大家在问
- 1能不能帮我找几个初中数学典型例题,难一点的?
- 2在三角形abc中 ∠ACB=60度 ∠BAC=75度 AD⊥BC BE⊥AC ∠CHD=
- 3look at the students( )games in the playground now.是用 are pl
- 4某信号兵用红、黄、蓝3面旗从上到下挂在竖直的旗杆上表示信号.每一次可以任挂1面、2面、3面,并且不同的顺序、不同的位置表
- 5我国有文字可考的历史,始于商朝.后人们要想知道商朝之前的史实,最科学的方法是( )
- 6英译汉-They hadThey had a good time last Sunday.-----------They
- 71米的三分之一是[ ]米,3米的四分之一是[ ]米?
- 8读下面的句子,将你联想到的词语写下来
- 9用 阳光 花朵 分别造一个句子
- 10描写春节热闹场面的古诗
- 11---Excuse me. Where is your teachers’ office?
- 12一头牛被一条长3m的绳子拴在草地上,它能吃到草的最大面积是多少平方米?(绳子结头长度忽略不计)
- 13现有1.金刚石2.氢气3.海水4.铁5.二氧化碳6.石灰水7.空气8水9.酒精10.氧化铜
- 14弟子问老师:“您能谈谈人类的奇怪之处吗?” 老师答道:“他们急于成长,然后又哀叹失去的童年;他们以健康换取金钱,不久后又
- 15Their group seems to have greater players.





