粗盐提纯实验中产率偏低的原因有?(未用玻璃棒引流也会导致产率偏低吗?)
 纳瓦谢里采夫2022-10-04 11:39:540条回答
纳瓦谢里采夫2022-10-04 11:39:540条回答
已提交,审核后显示!提交回复
共0条回复
相关推荐
- 在粗盐提纯实验,过滤和蒸发能使那些杂质从混合物中分离?
在粗盐提纯实验,过滤和蒸发能使那些杂质从混合物中分离?
我们只做了溶解,过滤和蒸发,但没有加入其它化学物质,请问提纯後幼盐有甚麼杂质 tiger21st1年前1
tiger21st1年前1 -
 妹妹毁了洋娃娃 共回答了23个问题
妹妹毁了洋娃娃 共回答了23个问题 |采纳率87%不溶性杂质如泥沙等可以用溶解、过滤的方法除去,然后蒸发水分得到较纯净的精盐.而可溶性杂质如Ca2+,Mg2+,SO42- 等无法分离1年前查看全部
- (2013•尤溪县质检) (1)如图1是粗盐提纯中蒸发操作,其中玻璃棒的作用是防止______,造成液滴飞溅.
 (2013•尤溪县质检) (1)如图1是粗盐提纯中蒸发操作,其中玻璃棒的作用是防止______,造成液滴飞溅.
(2013•尤溪县质检) (1)如图1是粗盐提纯中蒸发操作,其中玻璃棒的作用是防止______,造成液滴飞溅.
(2)取下热的蒸发皿需要用到下列______(填序号)仪器.
A.镊子 B.坩埚钳 C.玻璃棒
(3)配制 100g 质量分数为 6%的氯化钠溶液,需要氯化钠的质量为______g.配制完成后,将该溶液装瓶并贴上标签(如图2).标签包含两项内容,请将标签另一项内容补充完整. apple08129021年前1
apple08129021年前1 -
 d94535ec8a127767 共回答了15个问题
d94535ec8a127767 共回答了15个问题 |采纳率86.7%解题思路:(1)玻璃棒的用途有搅拌、引流、转移物质等;
(2)坩埚钳可以用来夹持蒸发皿;
(3)根据溶液质量、溶液质量分数可以计算溶质质量.(1)蒸发过程中,用玻璃棒不断搅拌的目的是:防止液体受热不均,造成液滴飞溅.
故填:受热不均.
(2)热的蒸发皿可以用坩埚钳夹持.
故填:B.
(3)配制100g质量分数为6%的氯化钠溶液,需要氯化钠的质量为:
100g×6%=6g.
故填:6.
标签另一项内容应该是溶液的质量和溶液中溶质的质量分数,溶液质量是100g,质量分数是6%.
标签如图中所示:
点评:
本题考点: 氯化钠与粗盐提纯;一定溶质质量分数的溶液的配制;蒸发与蒸馏操作.
考点点评: 本题比较简单,只要熟记教材内容即可顺利解答.1年前查看全部
- 粗盐提纯中,杂质有氯化钙和氯化镁,应该先除哪个?为什么?
粗盐提纯中,杂质有氯化钙和氯化镁,应该先除哪个?为什么?
怎么什么说法都有啊? seetiezx1年前3
seetiezx1年前3 -
 binbin8520 共回答了20个问题
binbin8520 共回答了20个问题 |采纳率95%先除镁,再除钙,这是纯碱厂生产盐水精制的顺序;
工业上使用石灰乳除镁,氢氧化镁的溶度积是1.8×10∧-11,而氢氧化钙的是5.5×10∧-6,氢氧化镁被除去时钙离子没有被除去,经沉降后,再向溶液中通入二氧化碳除钙;
实验室里你可以先用氢氧化钠除镁,再用碳酸钠除钙;
在化学试验中由于被允许的误差范围是±0.2%,因此,当溶液中某种离子的含量低于1×10∧-6时就认为这种离子被除净了.1年前查看全部
- 粗盐提纯中实际的顺序,方案最好的?1.Bacl2-NaoH-Na2Co3-Hcl 2.Bacl2-Na2Co3-NaoH
粗盐提纯中实际的顺序,方案最好的?1.Bacl2-NaoH-Na2Co3-Hcl 2.Bacl2-Na2Co3-NaoH-Hcl 3.Bacl2-Hcl-Na2C
 lsa4lck5m1年前1
lsa4lck5m1年前1 -
 duyu1979526 共回答了19个问题
duyu1979526 共回答了19个问题 |采纳率94.7%选2,HCL肯定在最后,可以最后蒸出,Naco3应在后面可以将ba+全部出去1年前查看全部
- 粗盐提纯有几个步骤?
 天男海北1年前1
天男海北1年前1 -
 冷雨纷飞 共回答了15个问题
冷雨纷飞 共回答了15个问题 |采纳率100%这是我以前看到一个人回答的,似乎对你有用,引用过来的,他的账号在底下……呵呵
一、实验目的
1.掌握溶解、过滤、蒸发等实验的操作技能.
2.理解过滤法分离混合物的化学原理.
3.体会过滤的原理在生活生产等社会实际中的应用.
二、实验仪器和药品
药品:粗盐,水
器材:托盘天平,量筒,烧杯,玻璃棒,药匙,漏斗,铁架台(带铁圈),蒸发皿,酒精灯,坩埚钳,胶头滴管,
滤纸,剪刀,火柴,纸片
三、实验原理
粗盐中含有泥沙等不溶性杂质,以及可溶性杂质如: 等.不溶性杂质可以用溶解、过滤的方法
除去,然后蒸发水分得到较纯净的精盐.
四、实验操作
1.溶解
用托盘天平称取5克粗盐(精确到0.1克).用量筒量取10毫升水倒入烧杯里.用药匙取一匙粗盐加入水中,观察发生的现象.用玻璃棒搅拌,并观察发生的现象(玻璃棒的搅拌对粗盐的溶解起什么作用?).接着再加入粗盐,边加边用玻璃棒搅拌,一直加到粗盐不再溶解时为止.观察溶液是否浑浊.
在天平上称量剩下的粗盐,计算在10毫升水中大约溶解了多少克粗盐.
2.过滤
按照化学实验基本操作6所述方法进行过滤.仔细观察滤纸上的剩余物及滤液的颜色.滤液仍浑浊时,应该再过滤一次.
如果经两次过滤滤液仍浑浊,则应检查实验装置并分析原因,例如,滤纸破损,过滤时漏斗里的液面高于滤纸边缘,仪器不
干净等.找出原因后,要重新操作.
3.蒸发
把得到的澄清滤液倒入蒸发皿.把蒸发皿放在铁架台的铁圈上,用酒精灯加热(图20).同时用玻璃棒不断搅拌滤液.
等到蒸发皿中出现较多量固体时,停止加热.利用蒸发皿的余热使滤液蒸干.
4.用玻璃棒把固体转移到纸上,称量后,回收到教师指定的容器.比较提纯前后食盐的状态并计算精盐的产率.
五、实验总结
过滤操作中的问题探析
过滤是最常用的分离液体和固体的实验操作.现行的初中化学教材中仅粗浅地介绍了过滤的操作要点,而实际操作过程中,往往会遇到许多细节性的问题.笔者结合教学实际,就过滤操作中经常遇到的问题谈一下自已的解决办法,仅供参考.
(一)、怎样选择漏斗和滤纸?
漏斗的大小主要取决于要过滤的沉淀的量或析出固体的量,而不是看液体的体积.沉淀量或固体量较多,则所选用的漏斗就大,反之亦然.漏斗的圆锥角应为60°.管径粗细适宜,太粗难以保持水柱,太细则水流速度慢,过滤需要的时间过长.管径末端应稍微倾斜.滤纸的选择依据所做的实验来定.滤纸分定性滤纸和定量滤纸.定性滤纸在过滤操作中主要用于研究物质的物理性质和化学性质;定量滤纸主要用于物质的定量分析.在中学实验中,过滤操作常用于定性实验,所以大多用定性滤纸.选好的滤纸放入漏斗后,纸的边缘要比漏斗边缘低5毫米左右为宜.
(二)、怎样组装过滤器?
首先,将选好的滤纸对折两次,第二次对折要与第一次对折的折缝不完全重合.当这样的滤纸放入漏斗(顶角60°)中,其尖角与漏斗壁间有一定的间隙,但其上部却能完好贴在漏斗壁上.这样装成的过滤器比所有表面都贴在漏斗上的过滤器的过滤速度更快.对折时,不要把滤纸顶角的折缝压得过扁,以免削弱尖端的强度.然后剪去三层纸那边的两层的小角,以便在湿润后,滤纸的上部能紧密地贴在漏斗壁上.
其次,将叠好的滤纸放入合适的漏斗中,用洗瓶的水湿润滤纸,用手指把滤纸上部1/3处轻轻压紧在漏斗壁上.把水注入漏斗时,漏斗颈应充满水,或用手指堵住漏斗颈末端,使其充水至漏斗顶角稍上部为止.漏斗颈保持有连续的水柱,会产生向下的引力,加速了过滤过程.
(三)、怎样正确地进行过滤?
在过滤时,玻璃棒与盛有过滤液的烧杯嘴部相对着;玻璃棒末端和漏斗中滤纸的三层部分相接近,但不能触及滤纸;要保持垂直(笔者认为玻璃棒斜立易导致过滤液外溢);漏斗的颈部尖端紧靠接收滤液烧杯嘴部的内壁.每次转移的液体不可超过滤纸高度的三分之二,防止滤液不通过滤纸而由壁间流出.对于残留在烧杯里的液体和固体物质应该用溶剂或蒸馏水按少量多次的原则进行润冲,将洗液全部转移到漏斗中进行过滤.
(四)、怎样正确洗涤沉淀物?
如果需要洗涤沉淀物,则应立即进行洗涤,否则沉淀物在滤纸上放置过久会开裂或结块,不易润洗.可用原溶剂、蒸馏水或其它适当的洗涤剂进行润洗.换一个洁净的空烧杯以代替原来接受滤液的烧杯,这样可以避免因沉淀穿透滤纸而要重新过滤大体积的液体.每次洗液用量以能浸没所收集的沉淀物为宜.洗涤时,用少量洗液小心沿四周从上而下冲洗,将沉淀冲到漏斗底部,不可使液体流速过猛,否则会使沉淀冲出过滤器.也不可用玻璃棒搅拌漏斗内的物质,以免划破滤纸,前功尽弃.一般洗2到3次左右,可基本洗净
(五)、怎样检验沉淀物是否洗净?
可根据沉淀物上可能检出的杂质类别,在最后一次洗出液中加入适宜的试剂,来检验洗涤程度.如过滤Na2SO4、BaCl2两溶液恰好完全反应后的混合物时,要检验沉淀物是否洗净,应选择AgNO3溶液.若在最后一次洗出液中加入AgNO3溶液无沉淀(AgCl)生成,则说明沉淀已洗净.
(六)、过滤时,滤液过多而超出滤纸边缘或滤纸被划破怎么办?
可用少量原溶剂冲洗漏斗和滤纸2到3次,原滤液连同洗液重新进行过滤.
(七)、分离沉淀和液体是否必需用过滤操作?
否.当分离的沉淀量很少时,可盛物于离心试管内,用离心机进行常温下沉淀分离.用吸管吸取沉淀上清液.根据需要可进行洗涤后再离心分离.只有当沉淀量较多时,才适宜用过滤法分离
(八)、过滤操作是否还有其他方式?
有.要使过滤速度快,且方便洗涤,可用布氏漏斗进行减压抽滤,这使得过滤和洗涤费时少,而且便于洗涤;当过滤需要在一定温度下进行时应选用保温漏斗进行过滤1年前查看全部
- 粗盐提纯实验中,将粗盐研细,的目的是?
 steven90001年前2
steven90001年前2 -
 1234xjl 共回答了22个问题
1234xjl 共回答了22个问题 |采纳率90.9%因为影响物质溶解速率的因素有:溶剂的性质,溶质的性质,温度,搅拌,固体颗粒的大小,所以在这里就是使固体颗粒变小,加快食盐的溶解速率,1年前查看全部
- 王璐同学在进行“粗盐提纯”实验时,发现最后得到的食盐晶体的质量比加入的粗盐的质量少很多,试帮她分析一原因?
 梦小痕1年前4
梦小痕1年前4 -
 miranda_yao 共回答了16个问题
miranda_yao 共回答了16个问题 |采纳率93.8%解题思路:根据粗盐提纯实验操作过程溶解,过滤,蒸发过程中可能造成得到粗盐的质量少的原因:晶体会受热飞溅出蒸发皿,加热时局部受热溶液飞溅出蒸发皿进行分析解答本题.根据实验操作过程,造成最后得到的食盐晶体的质量比加入的粗盐的质量少很多最主要原因可能是:加热时间太长,食盐晶体形成后继续加热,晶体会受热飞溅出蒸发皿;应该加热至有较多固体析出是即停止加热,利用余热使剩余水分蒸发掉;
另外,加热时应用玻璃棒不断搅拌,防止局部过热使固体飞溅,造成损失.点评:
本题考点: 氯化钠与粗盐提纯.
考点点评: 本题考查学生对粗盐提纯实验操作过程的操作可能造成的失误进行分析解题的能力.1年前查看全部
- 粗盐提纯中为了是滤渣不混入滤液该注意哪6个方面啊?
粗盐提纯中为了是滤渣不混入滤液该注意哪6个方面啊?
快啊.. luo34001年前1
luo34001年前1 -
 vickie1979 共回答了16个问题
vickie1979 共回答了16个问题 |采纳率93.8%一贴、二低、三靠
一贴:滤纸要紧贴漏斗壁,二低:1是滤纸的边缘要稍低于漏斗的边缘;2是在整个过滤过程中还要始终注意到滤液的液面要低于滤纸的边缘.
三靠:1是待过滤的液体倒入漏斗中时,盛有待过滤液体的烧杯的烧杯嘴要靠在倾斜的玻璃棒上(玻璃棒引流);2是指玻璃棒下端要靠在三层滤纸一边(三层滤纸一边比一层滤纸那边厚,三层滤纸那边不易被弄破);3是指漏斗的颈部要紧靠接收滤液的接受器的内壁.1年前查看全部
- 关于粗盐提纯的一个问题将含有少量可溶性杂质的氯化钠溶液溶解蒸发.问为什么用少量水洗涤结晶物能除去其中少量的可溶性杂质?如
关于粗盐提纯的一个问题
将含有少量可溶性杂质的氯化钠溶液溶解蒸发.
问为什么用少量水洗涤结晶物能除去其中少量的可溶性杂质?
如果洗涤,那有可能把大部分氯化钠都洗掉了.杂质还是没有洗清. 天天汉1年前2
天天汉1年前2 -
 树风8838 共回答了14个问题
树风8838 共回答了14个问题 |采纳率92.9%用饱和食盐水,因为食盐水饱和了,就不能溶解食盐了,能溶解其他杂质(可溶的,不可溶的,过滤)所以,就可得到氯化钠了!
针对:【如果洗涤,那有可能把大部分氯化钠都洗掉了.杂质还是没有洗清.】 可以加大饱和食盐水的量,并且杂质不可能有很多的!1年前查看全部
- 2008年4月我市进行九年级化学实验考查.某校化学小组在考查时抽到的题目是:①粗盐提纯②淀粉与葡萄糖的检验③二氧化碳的制
2008年4月我市进行九年级化学实验考查.某校化学小组在考查时抽到的题目是:①粗盐提纯②淀粉与葡萄糖的检验③二氧化碳的制取、收集和验满④氧气的制取、收集和验满.考试的方法是由考生抽签确定考题,凯凯同学抽签后被监考老师引导至准备了下列仪器和药品的实验台前(图1) 
请回答:(1)指出上图中仪器的名称:a______b______;
(2)由实验台上提供的仪器和药品,你认为小凯抽到的是第______个考题,其反应的化学方程式为______;
(3)以下是凯凯完成该实验主要操作过程的示意图.按评分标准,每项操作正确得1分,满分5分,实验完毕后小凯得了3分.请找出他失分的操作并说明原因:______、______
(4)仅用上述仪器(药品另选),也能制取另一种常见气体,化学方程式为______;若增加______ (填一种玻璃仪器名称)还能组装成高锰酸钾制氧气的发生装置. 当爱情经过的时候1年前1
当爱情经过的时候1年前1 -
 martin_polo 共回答了20个问题
martin_polo 共回答了20个问题 |采纳率95%(1)常见的仪器名称、用途应当掌握,a的名称为铁架台,b是镊子;
(2)根据二氧化碳的实验室制法和提供的仪器、药品、实验的操作可以推测出小凯抽到的是二氧化碳的制取、收集和验满;制取二氧化碳的化学反应式是:CaCO 3 +2HCl═CaCl 2 +CO 2 ↑+H 2 0;
(3)小凯的操作中出现了两个错误:取液时瓶塞未倒放、验满时不能把燃着的火柴伸入集气瓶内;
(4)实验室用过氧化氢制氧气为固体且反应不需加热的装置,反应原理为2H 2 O 2
Mn O 2
.
2H 2 O+O 2 ↑;
用高锰酸钾制氧气需要用给固体加热的装置,所以还需补充酒精灯.
故答案为:
(1)a铁架台;b镊子;
(2)3;CaCO 3 +2HCl═CaCl 2 +CO 2 ↑+H 2 0;
(3)操作Ⅱ存在错误,瓶塞应倒放;操作Ⅳ存在错误,火柴应放在集气瓶口验满;
(4)2H 2 O 2
Mn O 2
.
2H 2 O+O 2 ↑; 酒精灯.1年前查看全部
- 蒸发时哪些操作会导致晶体损失做粗盐提纯的实验.蒸发后晶体有损失的原因.求详解.
 fzucjf1年前1
fzucjf1年前1 -
 士不得老 共回答了19个问题
士不得老 共回答了19个问题 |采纳率94.7%冲料、飞溅会导致晶体减少1年前查看全部
- 2008年4月我市进行九年级化学实验考查.某校化学小组在考查时抽到的题目是:①粗盐提纯②淀粉与葡萄糖的检验③二氧化碳的制
2008年4月我市进行九年级化学实验考查.某校化学小组在考查时抽到的题目是:①粗盐提纯②淀粉与葡萄糖的检验③二氧化碳的制取、收集和验满④氧气的制取、收集和验满.考试的方法是由考生抽签确定考题,凯凯同学抽签后被监考老师引导至准备了下列仪器和药品的实验台前(图1)

请回答:(1)指出上图中仪器的名称:a______b______;
(2)由实验台上提供的仪器和药品,你认为小凯抽到的是第______个考题,其反应的化学方程式为______;
(3)以下是凯凯完成该实验主要操作过程的示意图.按评分标准,每项操作正确得1分,满分5分,实验完毕后小凯得了3分.请找出他失分的操作并说明原因:______、______
(4)仅用上述仪器(药品另选),也能制取另一种常见气体,化学方程式为2H2O2
2H2O+O2↑MnO2 .2H2O2;若增加______ (填一种玻璃仪器名称)还能组装成高锰酸钾制氧气的发生装置.
2H2O+O2↑MnO2 . 天边飞来一只燕1年前1
天边飞来一只燕1年前1 -
 judy_ni0102 共回答了16个问题
judy_ni0102 共回答了16个问题 |采纳率87.5%解题思路:根据题目中提供的仪器、药品、实验的操作,结合二氧化碳的实验室制法可以推测出小凯抽到的是二氧化碳的制取、收集和验满;结合实验基本操作可以看到小凯的操作中出现了两个错误:取液时瓶塞未倒放、验满时不能把燃着的火柴伸人集气瓶内;二氧化碳的发生装置为固液混合不加热的装置,所以根据过氧化氢为液体、二氧化锰为固体且反应不需加热,得到还可以用过氧化氢和二氧化锰制取氧气,反应原理为2H2O2
2H2O+O2↑;用高锰酸钾制氧气需要用到加热,所以还需补充的仪器为酒精灯.MnO2 .(1)常见的仪器名称、用途应当掌握,a的名称为铁架台,b是镊子;
(2)根据二氧化碳的实验室制法和提供的仪器、药品、实验的操作可以推测出小凯抽到的是二氧化碳的制取、收集和验满;制取二氧化碳的化学反应式是:CaCO3+2HCl═CaCl2+CO2↑+H20;
(3)小凯的操作中出现了两个错误:取液时瓶塞未倒放、验满时不能把燃着的火柴伸入集气瓶内;
(4)实验室用过氧化氢制氧气为固体且反应不需加热的装置,反应原理为2H2O2
MnO2
.
2H2O+O2↑;
用高锰酸钾制氧气需要用给固体加热的装置,所以还需补充酒精灯.
故答案为:
(1)a铁架台;b镊子;
(2)3;CaCO3+2HCl═CaCl2+CO2↑+H20;
(3)操作Ⅱ存在错误,瓶塞应倒放;操作Ⅳ存在错误,火柴应放在集气瓶口验满;
(4)2H2O2
MnO2
.
2H2O+O2↑; 酒精灯.点评:
本题考点: 实验操作注意事项的探究;常用仪器的名称和选用;二氧化碳的实验室制法.
考点点评: 初中化学对于气体的实验室制法主要从药品、反应原理、发生装置、收集装置、检验、验满、及实验操作、注意事项等方面进行比较、归纳,进而总结实验室制取气体的一般思路和方法.1年前查看全部
- 在粗盐提纯中加入盐酸为什么要在过滤之后?
 无心之过1年前1
无心之过1年前1 -
 xk8239784 共回答了16个问题
xk8239784 共回答了16个问题 |采纳率100%粗盐提纯,1加入过量氯化钡,2加入过量氢氧化钠,3加入过量碳酸钠,过滤,4加入适量盐酸.
过滤前溶液中有氢氧化镁,硫酸钡,碳酸钙沉淀,若过滤前加盐酸,盐酸与他们反应生成氯化镁、氯化钡、氯化钙,这些都易溶于水,等于没提纯1年前查看全部
- 粗盐提纯实验中溶解粗盐搅拌时应注意
 蛇眼冥神1年前2
蛇眼冥神1年前2 -
 贾正磊 共回答了18个问题
贾正磊 共回答了18个问题 |采纳率100%一般是顺时针搅拌,而非圆形搅拌动作的 要求,需注意不要让玻璃棒碰击烧杯内壁,以防打破烧杯液体外流.1年前查看全部
- 粗盐提纯实验为何取15ml水为宜?
粗盐提纯实验为何取15ml水为宜?
试卷上的题目啊,(听说要分情况讨论,) 342188376a1年前1
342188376a1年前1 -
 孙麒越 共回答了22个问题
孙麒越 共回答了22个问题 |采纳率95.5%太多:蒸发时间过长 太少:溶解得不彻底1年前查看全部
- 粗盐提纯(用饱和的氯化钠溶液冲洗,除去氯化镁及氯化钙)的原理?
 fgrtfd1221年前1
fgrtfd1221年前1 -
 灏心灏意 共回答了24个问题
灏心灏意 共回答了24个问题 |采纳率79.2%因为氯化钠的饱和溶液中,氯化钠已经达到饱和状态,而其他物质,像氯化镁,氯化钙等还未达到饱和状态.1年前查看全部
- 粗盐提纯中的化学方程式是怎么样配的?有什么方法?
 diabetes1年前1
diabetes1年前1 -
 kingland2008 共回答了20个问题
kingland2008 共回答了20个问题 |采纳率95%初中的粗盐提纯实验不涉及化学变化,所以是没有化学方程式的.具体步骤是溶解-过滤-结晶.1年前查看全部
- 粗盐提纯中加入试剂碳酸钠会不会与氯化镁反应?
 69716281年前2
69716281年前2 -
 七月的清风朗月 共回答了23个问题
七月的清风朗月 共回答了23个问题 |采纳率87%实际上是发生反应的,因为会生成碳酸镁,是微溶物,大量后按不溶物沉淀处理.1年前查看全部
- 粗盐提纯中,选择的除杂试剂不能用KOH代替NaOH,理由是
 帮亲弄ID1年前2
帮亲弄ID1年前2 -
 低调平静 共回答了18个问题
低调平静 共回答了18个问题 |采纳率94.4%Na0H可以加Hcl变成水和所需的Nac|,而K0H反应还生成不需要的杂质Kc|1年前查看全部
- 粗盐提纯中为什么要溶解
 感觉时刻1年前3
感觉时刻1年前3 -
 益均 共回答了24个问题
益均 共回答了24个问题 |采纳率95.8%很简单,是为了除去粗盐中的不溶解性的杂质啊,溶解是提纯的第一步1年前查看全部
- 在粗盐提纯实验中每步实验都用到的是
 丁克宝贝1年前1
丁克宝贝1年前1 -
 刀客COMMAND 共回答了14个问题
刀客COMMAND 共回答了14个问题 |采纳率92.9%A玻璃棒1年前查看全部
- 在粗盐提纯实验中,每步都要用到的的是 ------
 croce1年前1
croce1年前1 -
 moeklim 共回答了14个问题
moeklim 共回答了14个问题 |采纳率100%玻璃棒
溶解 用来加速溶解
过滤 用来引流
蒸发 防止局部过热1年前查看全部
- 在粗盐提纯中,每步都需要用到的仪器是什么
 vmho1年前4
vmho1年前4 -
 trinity 共回答了25个问题
trinity 共回答了25个问题 |采纳率80%玻璃棒1年前查看全部
- 在粗盐提纯实验中为什么要将硫酸钡沉淀除去后再加碳酸钠
 happy_ever_after1年前3
happy_ever_after1年前3 -
 nut_li 共回答了14个问题
nut_li 共回答了14个问题 |采纳率85.7%可以不除去,就直接加入碳酸钠.1年前查看全部
- 粗盐提纯中,为什么第一步是加氯化钡溶液,去掉硫酸根离子?不可以先去掉钙离子或镁离子吗?
 Love宝er1年前1
Love宝er1年前1 -
 shijinyao 共回答了28个问题
shijinyao 共回答了28个问题 |采纳率85.7%三种试剂中氯化钡中钡是杂质,据试剂过量原则,会引入更多钡杂质,因此要先加它除去硫酸根,以便多余的钡用后面的试剂除去,再加NaOH除镁,最后加过量碳酸纳除Ba和Ca,再加盐酸到恰无气体,则已中和,碳酸根与酸产气指示反应终点,因此最后加1年前查看全部
- 蒸发结晶的例子有哪些?除了海水晒盐还有什么?粗盐提纯是什么例子?和粗盐提纯相似的有什么?要日常生活中的实例
 龙之吻5201年前2
龙之吻5201年前2 -
 尚东方 共回答了20个问题
尚东方 共回答了20个问题 |采纳率85%蒸发的还有:硫酸铜,三硝基甲苯……氯酸盐,硝酸盐,都是可以蒸发的,但是碳酸盐一般是不行的因为它不稳定蒸发易分解1年前查看全部
- 粗盐提纯中加入试剂碳酸钠与氯化镁反应生成的碳酸镁微溶,会不会阻碍反应的继续发生?
 raulwdox1年前2
raulwdox1年前2 -
 fuyu1007 共回答了22个问题
fuyu1007 共回答了22个问题 |采纳率95.5%多了碳酸镁就会变成沉淀
微溶的镁离子在遇到后来加的氢氧化钠后变成氢氧化镁沉淀1年前查看全部
- 粗盐提纯实验中,怎样去掉可溶性杂质?
 lb1c1年前1
lb1c1年前1 -
 huai800 共回答了18个问题
huai800 共回答了18个问题 |采纳率94.4%粗盐中,可溶性杂质多为氯化镁,氯化钙等,会吸收空气中的水分而潮解.
除去杂质,应用饱和的食盐水反复冲洗粗盐,直到固体质量不再减少为止,过滤,得粗盐,
因为氯化钠的饱和溶液中,氯化钠已经达到饱和状态,而其他物质,像氯化镁,氯化钙等还未达到饱和状态.1年前查看全部
- 粗盐提纯检验硫酸根离子,先加入盐酸酸化,再加硝酸钡行吗.先加硝酸,再加氯化钡行吗?
 经济动物1年前1
经济动物1年前1 -
 长_发_飘_飘 共回答了19个问题
长_发_飘_飘 共回答了19个问题 |采纳率100%只能先加入盐酸,排除碳酸根离子、亚硫酸根离子及银离子干扰;然后应该加入氯化钡.
加入硝酸钡会使亚硫酸及离子氧化为硫酸根,干扰检验.
先加硝酸再加氯化钡不好,干扰离子亚硫酸根离子及银离子不能排除.1年前查看全部
- 粗盐提纯实验完后用不用清洗蒸发皿?
 小虫wpj1年前3
小虫wpj1年前3 -
 zhongyi998 共回答了14个问题
zhongyi998 共回答了14个问题 |采纳率92.9%用玻璃棒转移后需要清洗且需干燥,防止影响下一次的实验1年前查看全部
- 粗盐提纯中除难溶性杂质的主要步骤有哪些
 bl10081年前1
bl10081年前1 -
 lclclc09663 共回答了18个问题
lclclc09663 共回答了18个问题 |采纳率100%过滤1年前查看全部
- 粗盐提纯为什么不先过滤再加碳酸钠溶液?
 lily16351年前2
lily16351年前2 -
 艾v楠 共回答了17个问题
艾v楠 共回答了17个问题 |采纳率94.1%加碳酸钠溶液是为了除去钙离子(与碳酸根离子形成碳酸钙沉淀)经过滤除去,以免有少量在氯化钠结晶时进入产品.1年前查看全部
- 用什么方法判断粗盐提纯实验中盐酸加得适量
 鲜鱼翻身1年前1
鲜鱼翻身1年前1 -
 462056465 共回答了20个问题
462056465 共回答了20个问题 |采纳率95%取一小部分样品,加入紫色石蕊试液,变红则过量,类似的方法很多,LZ自己再想想吧1年前查看全部
- 粗盐提纯实验中.先用盐酸调PH值再过滤有什么影响?
粗盐提纯实验中.先用盐酸调PH值再过滤有什么影响?
原因 会与什么溶解 什么与什么溶解~我也 知道 会 wfwang1年前2
wfwang1年前2 -
 lovens123 共回答了20个问题
lovens123 共回答了20个问题 |采纳率95%用盐酸酸化则会使沉淀中的BaCO3溶解,产生可溶性的BaCl2,而Ba2+是有剧毒的离子,所以应先过滤再酸化.1年前查看全部
- 过量的BaCl2试剂在粗盐提纯中为什么会有多余的Ba离子而不是Cl离子呢
 azai131年前4
azai131年前4 -
 海肚风 共回答了18个问题
海肚风 共回答了18个问题 |采纳率83.3%因为粗盐溶液中需要留下的成分是NaCl
Na+ Cl-都不算杂质1年前查看全部
- 关于粗盐提纯实验一道实验题:在粗盐提纯的三个步骤中,都要使用到的玻璃仪器是( )【我觉得是烧杯】该仪器在步骤中的作用分别
关于粗盐提纯实验
一道实验题:在粗盐提纯的三个步骤中,都要使用到的玻璃仪器是( )【我觉得是烧杯】
该仪器在步骤中的作用分别是( )( )( )
PS:【实验】蒸发过程中有液体飞溅出来,可能的原因是( )
明天要交的作业...please passerby0011年前1
passerby0011年前1 -
 狄墨龙 共回答了14个问题
狄墨龙 共回答了14个问题 |采纳率92.9%1 玻璃棒
2 加快溶解 引流 加热的时候搅拌以达到受热均匀的目的
3 受热不均匀1年前查看全部
- 高中新课改化学粗盐提纯的七个步骤?
高中新课改化学粗盐提纯的七个步骤?
麻烦也写一下每个步骤除去和引入的杂质和涉及的离子方程式!谢谢!在线等!急! wxgh655009791年前2
wxgh655009791年前2 -
 海腚aa 共回答了17个问题
海腚aa 共回答了17个问题 |采纳率76.5%1.溶解
2.过滤(不溶性杂质)
3.滴加氯化钡(除硫酸根离子)SO42-+Ba2+=BASO4
4.滴加氢氧化钠 (除镁离子)Mg2++2OH-=Mg(OH)2
5.加碳酸钠(除过量的氯化钡)Ba2+CO32-=BaCO3
6.滴加稀盐酸(除过量的碳酸钠、氢氧化钠)其中沉淀也要过滤
7.蒸发
如果说一定是七步那只有这么说了1年前查看全部
- 粗盐提纯中溶解这一步为什么先加水,再加盐,而不是先加盐,后加水
 kjwwf1年前1
kjwwf1年前1 -
 ohyea_photo 共回答了19个问题
ohyea_photo 共回答了19个问题 |采纳率94.7%没有这个规矩把1年前查看全部
- 这是一道关于粗盐提纯的题溶解后,粗盐因逐渐溶解而减少,食盐水呈现﹙ ﹚ 过滤后,液体通过过滤,滤纸上有不少不溶物滤液﹙
这是一道关于粗盐提纯的题
溶解后,粗盐因逐渐溶解而减少,食盐水呈现﹙ ﹚
过滤后,液体通过过滤,滤纸上有不少不溶物滤液﹙ ﹚
水分不断蒸发,逐渐有﹙ ﹚析出 非琐1年前1
非琐1年前1 -
 Johny_R 共回答了8个问题
Johny_R 共回答了8个问题 |采纳率100%混浊
清澈
晶体1年前查看全部
- 写出粗盐提纯的步骤及每步中玻璃棒的作用
写出粗盐提纯的步骤及每步中玻璃棒的作用
如题,在线等 女人不笑1年前3
女人不笑1年前3 -
 不可置信 共回答了15个问题
不可置信 共回答了15个问题 |采纳率100%1.用托盘天平称取5克粗盐(精确到0.1克).用量筒量取10毫升水倒入烧杯里.用药匙取一匙粗盐加入水中,观察发生的现象.用玻璃棒搅拌,并观察发生的现象.接着再加入粗盐,边加边用玻璃棒搅拌,一直加到粗盐不再溶解时为止.观察溶液是否浑浊.在天平上称量剩下的粗盐,计算在10毫升水中大约溶解了多少克粗盐.
2.过滤:按照化学实验基本操作6所述方法进行过滤.仔细观察滤纸上的剩余物及滤液的颜色.滤液仍浑浊时,应该再过滤一次.如果经两次过滤滤液仍浑浊,则应检查实验装置并分析原因,例如,滤纸破损,过滤时漏斗里的液面高于滤纸边缘,仪器不干净等.找出原因后,要重新操作.
3.蒸发:把得到的澄清滤液倒入蒸发皿.把蒸发皿放在铁架台的铁圈上,用酒精灯加热(图20).同时用玻璃棒不断搅拌滤液.等到蒸发皿中出现较多量固体时,停止加热.利用蒸发皿的余热使滤液蒸干.
4.用玻璃棒把固体转移到纸上,称量后,回收到教师指定的容器.比较提纯前后食盐的状态并计算精盐的产率.
玻璃棒:
1、玻璃棒的搅拌
2、引流
3、搅拌
4、转移固体1年前查看全部
- 某兴趣小组进行粗盐提纯并配制NaCl溶液,请回答下列问题:
某兴趣小组进行粗盐提纯并配制NaCl溶液,请回答下列问题:
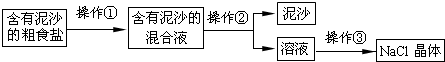
(1)操作①②③都要用到得一种玻璃仪器是______;
(2)操作②中需要将圆形滤纸折叠处理,下列图示中不该出现的情形是______(填序号).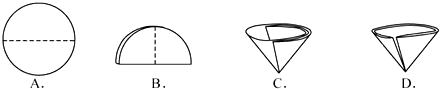
(3)操作③中,当蒸发皿中______时,停止加热.
(4)实验结束后称量获得的精盐,并计算精盐的产率,发现产率较低,其可能原因是______(填序号).
A.过滤时滤纸有破损B.蒸发时有固体溅出
C.溶解含有泥沙的粗食盐时,加入的水量不足D.蒸发后,所得精盐很潮湿
(5)用上述实验所得NaCl晶体配制50g 10%NaCl溶液,称量时正确的操作是______(填序号).
A.先放砝码,后放药品 B.先放药品,后放砝码
(6)若最后配得的溶液质量分数大于10%,则可能的原因是______(填序号).
A.用量筒量取水时俯视读数B.配制溶液时烧杯用少量蒸馏水润洗
C.氯化钠未完全溶解就将溶液转移至试剂瓶中D.砝码缺损. wxfsgu1081年前1
wxfsgu1081年前1 -
 website 共回答了21个问题
website 共回答了21个问题 |采纳率90.5%解题思路:(1)根据粗盐提纯的步骤进行分析解答.
(2)根据图示中的滤纸的折叠方法进行分析判断.
(3)根据蒸发操作的注意事项进行分析解答.
(4)根据精盐制得率=[精盐的质量/粗盐的质量]×100%进行分析解答.
(5)根据用托盘天平称量一定量的药品的方法进行分析判断.
(6)导致最后配得的溶液质量分数大于10%的原因可能是:称量溶质称多了、量取水时量少了(量水时俯视读数)等.(1)操作①为:粗盐溶解;操作②含有泥沙的混合液经过过滤,得较纯净的氯化钠溶液;操作③蒸发滤液,得氯化钠晶体;三步操作都要用到得一种玻璃仪器是玻璃棒.
(2)A、B、C 是滤纸的正确的折叠方法,D中的滤纸,接口处出现缝隙,液体会直接的进入下面的烧杯,故不应该出现.
(3)进行蒸发操作时,待蒸发皿中出现较多的固体时,应停止加热.
(4)A、过滤时滤纸有破损,会造成泥沙进入滤液中,蒸发后精盐的质量比正常值偏大,则精盐制得率较高,不符合题意;
B、蒸发时有固体溅出,精盐质量减少,则精盐制得率较低,符合题意;
C、溶解含有泥沙的粗食盐时,加入的水量不足,会导致造成滤液中食盐的量减少,精盐质量减少,则精盐制得率较低,符合题意;
D、蒸发后,所得精盐很潮湿,含有部分水分,造成精盐质量增加,则精盐制得率较高,不符合题意.
故选BC.
(5)用托盘天平称量一定质量的药品时,应先放砝码,后放药品,直至天平平衡.
(6)A、用量筒量取水时俯视读数,读数偏大,但实际量取到的水偏小,溶质不变,溶剂偏小,溶质质量分数偏大.
B、配制溶液的烧杯用少量蒸馏水润洗会使所取水质量增加,溶质不变,溶剂偏大,导致溶质质量分数偏小.
C、氯化钠未完全溶解就将溶液转移至试剂瓶中,会导致最后所得溶液中溶质的质量偏小,溶剂不变,最后配得的溶液质量分数偏小.
D、砝码缺损,会导致所量取的溶质的质量偏小,溶剂不变,导致溶质质量分数偏小.
故答案为:(1)玻璃棒;(2)D;(3)出现较多的固体;(4)BC;(5)A;(6)A.点评:
本题考点: 物质除杂或净化的探究;一定溶质质量分数的溶液的配制.
考点点评: 本题难度不是很大,但综合性较强,掌握粗盐提纯实验的有关注意事项、影响溶质质量分数大小的因素等是正确解答本题的关键.1年前查看全部
- 粗盐提纯为什么用氯化钡除硫酸根而不能用氯化钙
 咏珊1年前2
咏珊1年前2 -
 zsl_zsl112233 共回答了27个问题
zsl_zsl112233 共回答了27个问题 |采纳率92.6%氯化钡和硫酸根形成硫酸钡难溶物可以过滤除去,氯化钙与硫酸根形成的硫酸钙微溶不能完全除去硫酸根1年前查看全部
- 下图是粗盐提纯实验的部分操作,请回答相关问题。
下图是粗盐提纯实验的部分操作,请回答相关问题。
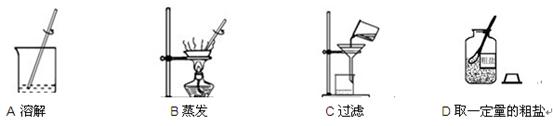
(1)上图所示操作中,有错误的是 (填字母)。
(2)粗盐提纯的正确操作顺序为 (填字母)。
(3)操作B中,玻璃棒的作用是 。
(4)步骤D中称取10.0g粗盐,将该粗盐逐渐加入盛有10mL水的烧杯中,边加边用玻璃棒搅拌,直到粗盐不再溶解为止,称得剩余粗盐为2.0g,最终得到NaCl晶体6.4g,该实验精盐的产率是 ;
(5)若制得的精盐的产率偏高,则可能的原因是 (填字母) 。A.过滤时滤纸有破损 B.蒸发时有固体溅出 C.溶解含有泥沙的粗食盐时,加入的水量不足 D.最终所得精盐比较潮湿  原地打转转1年前1
原地打转转1年前1 -
 zhangbin6123 共回答了24个问题
zhangbin6123 共回答了24个问题 |采纳率83.3%C,DACB,使受热均匀,防止液滴飞溅 80﹪ AD
1年前查看全部
- 粗盐提纯中加入过量的碳酸钠的目的
 黄五1年前1
黄五1年前1 -
 洗闷锤靴 共回答了16个问题
洗闷锤靴 共回答了16个问题 |采纳率93.8%去除可溶性杂质氯化钙,回答正确给好评,1年前查看全部
- 粗盐提纯中为什么要先加盐酸酸将溶液酸化
 觉得自己傻1年前2
觉得自己傻1年前2 -
 缘法今生 共回答了15个问题
缘法今生 共回答了15个问题 |采纳率80%粗盐中含有Mg2+、Ca2+、SO42-
加入过量BaCl2(去除硫酸根离子)
加入过量NaOH(去除镁离子)
加入过量Na2CO3(去除钙离子)
过滤后往滤液中加入过量HCl除去NaOH,Na2CO31年前查看全部
- 在粗盐提纯实验中,滤纸的作用如题
 toyotadisco1年前1
toyotadisco1年前1 -
 zjfkey 共回答了18个问题
zjfkey 共回答了18个问题 |采纳率94.4%过滤1年前查看全部
- 已知20摄氏度时,NaCl的溶解度为40g/100g水,试通过计算说明粗盐提纯实验中,要溶解10g粗盐,需要量取水的
已知20摄氏度时,NaCl的溶解度为40g/100g水,试通过计算说明粗盐提纯实验中,要溶解10g粗盐,需要量取水的
求需要量取水的体积为多少毫升时较为适宜 答案为30ml xsxiaopai1年前2
xsxiaopai1年前2 -
 chase4_1 共回答了14个问题
chase4_1 共回答了14个问题 |采纳率92.9%已知20摄氏度时,NaCl的溶解度为40g/100g水
即:100g(水)---------40g(氯化钠)
x 10g
100g/40g=x/10g
x=25g(25ml)1年前查看全部
- ★粗盐提纯★实验报告★名称 目的(?) 器材 现象(真奇怪 这个有吗) 结论(?)问题与讨论(问题为“提纯后的粗盐就是纯
★粗盐提纯★实验报告★
名称 目的(?) 器材 现象(真奇怪 这个有吗) 结论(?)问题与讨论(问题为“提纯后的粗盐就是纯净的NaCl吗 还有什么成分 如何除杂质”)
关键是 目的 现象 结论 jason99581年前2
jason99581年前2 -
 早z在wi 共回答了22个问题
早z在wi 共回答了22个问题 |采纳率95.5%一、实验目的
1.掌握溶解、过滤、蒸发等实验的操作技能.
2.理解过滤法分离混合物的化学原理.
3.体会过滤的原理在生活生产等社会实际中的应用.
二、实验仪器和药品
药品:粗盐,水
器材:托盘天平,量筒,烧杯,玻璃棒,药匙,漏斗,铁架台(带铁圈),蒸发皿,酒精灯,坩埚钳,胶头滴管,
滤纸,剪刀,火柴,纸片
三、实验原理
粗盐中含有泥沙等不溶性杂质,以及可溶性杂质如: 等.不溶性杂质可以用溶解、过滤的方法
除去,然后蒸发水分得到较纯净的精盐.
四、实验操作
1.溶解
用托盘天平称取5克粗盐(精确到0.1克).用量筒量取10毫升水倒入烧杯里.用药匙取一匙粗盐加入水中,观察发生的现象.用玻璃棒搅拌,并观察发生的现象(玻璃棒的搅拌对粗盐的溶解起什么作用?).接着再加入粗盐,边加边用玻璃棒搅拌,一直加到粗盐不再溶解时为止.观察溶液是否浑浊.
在天平上称量剩下的粗盐,计算在10毫升水中大约溶解了多少克粗盐.
2.过滤
按照化学实验基本操作6所述方法进行过滤.仔细观察滤纸上的剩余物及滤液的颜色.滤液仍浑浊时,应该再过滤一次.
如果经两次过滤滤液仍浑浊,则应检查实验装置并分析原因,例如,滤纸破损,过滤时漏斗里的液面高于滤纸边缘,仪器不
干净等.找出原因后,要重新操作.
3.蒸发
把得到的澄清滤液倒入蒸发皿.把蒸发皿放在铁架台的铁圈上,用酒精灯加热(图20).同时用玻璃棒不断搅拌滤液.
等到蒸发皿中出现较多量固体时,停止加热.利用蒸发皿的余热使滤液蒸干.
4.用玻璃棒把固体转移到纸上,称量后,回收到教师指定的容器.比较提纯前后食盐的状态并计算精盐的产率.
五、实验总结
过滤操作中的问题探析
过滤是最常用的分离液体和固体的实验操作.现行的初中化学教材中仅粗浅地介绍了过滤的操作要点,而实际操作过程中,往往会遇到许多细节性的问题.笔者结合教学实际,就过滤操作中经常遇到的问题谈一下自已的解决办法,仅供参考.
(一)、怎样选择漏斗和滤纸?
漏斗的大小主要取决于要过滤的沉淀的量或析出固体的量,而不是看液体的体积.沉淀量或固体量较多,则所选用的漏斗就大,反之亦然.漏斗的圆锥角应为60°.管径粗细适宜,太粗难以保持水柱,太细则水流速度慢,过滤需要的时间过长.管径末端应稍微倾斜.滤纸的选择依据所做的实验来定.滤纸分定性滤纸和定量滤纸.定性滤纸在过滤操作中主要用于研究物质的物理性质和化学性质;定量滤纸主要用于物质的定量分析.在中学实验中,过滤操作常用于定性实验,所以大多用定性滤纸.选好的滤纸放入漏斗后,纸的边缘要比漏斗边缘低5毫米左右为宜.
(二)、怎样组装过滤器?
首先,将选好的滤纸对折两次,第二次对折要与第一次对折的折缝不完全重合.当这样的滤纸放入漏斗(顶角60°)中,其尖角与漏斗壁间有一定的间隙,但其上部却能完好贴在漏斗壁上.这样装成的过滤器比所有表面都贴在漏斗上的过滤器的过滤速度更快.对折时,不要把滤纸顶角的折缝压得过扁,以免削弱尖端的强度.然后剪去三层纸那边的两层的小角,以便在湿润后,滤纸的上部能紧密地贴在漏斗壁上.
其次,将叠好的滤纸放入合适的漏斗中,用洗瓶的水湿润滤纸,用手指把滤纸上部1/3处轻轻压紧在漏斗壁上.把水注入漏斗时,漏斗颈应充满水,或用手指堵住漏斗颈末端,使其充水至漏斗顶角稍上部为止.漏斗颈保持有连续的水柱,会产生向下的引力,加速了过滤过程.
(三)、怎样正确地进行过滤?
在过滤时,玻璃棒与盛有过滤液的烧杯嘴部相对着;玻璃棒末端和漏斗中滤纸的三层部分相接近,但不能触及滤纸;要保持垂直(笔者认为玻璃棒斜立易导致过滤液外溢);漏斗的颈部尖端紧靠接收滤液烧杯嘴部的内壁.每次转移的液体不可超过滤纸高度的三分之二,防止滤液不通过滤纸而由壁间流出.对于残留在烧杯里的液体和固体物质应该用溶剂或蒸馏水按少量多次的原则进行润冲,将洗液全部转移到漏斗中进行过滤.
(四)、怎样正确洗涤沉淀物?
如果需要洗涤沉淀物,则应立即进行洗涤,否则沉淀物在滤纸上放置过久会开裂或结块,不易润洗.可用原溶剂、蒸馏水或其它适当的洗涤剂进行润洗.换一个洁净的空烧杯以代替原来接受滤液的烧杯,这样可以避免因沉淀穿透滤纸而要重新过滤大体积的液体.每次洗液用量以能浸没所收集的沉淀物为宜.洗涤时,用少量洗液小心沿四周从上而下冲洗,将沉淀冲到漏斗底部,不可使液体流速过猛,否则会使沉淀冲出过滤器.也不可用玻璃棒搅拌漏斗内的物质,以免划破滤纸,前功尽弃.一般洗2到3次左右,可基本洗净
(五)、怎样检验沉淀物是否洗净?
可根据沉淀物上可能检出的杂质类别,在最后一次洗出液中加入适宜的试剂,来检验洗涤程度.如过滤Na2SO4、BaCl2两溶液恰好完全反应后的混合物时,要检验沉淀物是否洗净,应选择AgNO3溶液.若在最后一次洗出液中加入AgNO3溶液无沉淀(AgCl)生成,则说明沉淀已洗净.
(六)、过滤时,滤液过多而超出滤纸边缘或滤纸被划破怎么办?
可用少量原溶剂冲洗漏斗和滤纸2到3次,原滤液连同洗液重新进行过滤.
(七)、分离沉淀和液体是否必需用过滤操作?
否.当分离的沉淀量很少时,可盛物于离心试管内,用离心机进行常温下沉淀分离.用吸管吸取沉淀上清液.根据需要可进行洗涤后再离心分离.只有当沉淀量较多时,才适宜用过滤法分离
(八)、过滤操作是否还有其他方式?
有.要使过滤速度快,且方便洗涤,可用布氏漏斗进行减压抽滤,这使得过滤和洗涤费时少,而且便于洗涤;当过滤需要在一定温度下进行时应选用保温漏斗进行过滤.1年前查看全部
- 粗盐提纯中除去可溶性杂质是根据什么除去的?比如氯化镁 硫酸钠..急!
 kean2001cn1年前2
kean2001cn1年前2 -
 五子希 共回答了18个问题
五子希 共回答了18个问题 |采纳率88.9%根据物质溶解性.生成溶解性小的物质而除去.
氯化镁——加氢氧化钠,生成氢氧化镁沉淀
硫酸钠——加氯化钡,生成硫酸钡沉淀1年前查看全部
大家在问
- 1一次数学小测试共有25道选择题,评分标准如下:答对一题得4分;答错一题扣1分;不答得0分.已知小明不答的题比搭错的题多2
- 2在1000m长跑考试中,大梦的成绩是3分20秒,它的平均速度是——m/s,起跑150m所用的时间为25s,
- 3甲从高处自由落下的同时,乙在蹦床上竖直跳起,两人同时落到蹦床,乙看甲怎么运动
- 4甲从高处自由落下的同时,乙在蹦床上竖直跳起,两人同时落到蹦床,乙看甲一直朝下运动对吗?
- 5CAD做图中已知三个条件 请求画出此圆
- 6幼儿园大班开放半日活动的评语怎么写
- 7幼儿园大班第一学期期末评语怎么写
- 8农作物主要包括 作物 作物 作物和 等种类
- 9如果一个长方体的每条棱长各增加了它的2分之1,这个长方体的体积比原来增加了百分之几?
- 10随机变量x的分布函数fx求常数ab和落在的概率
- 11过去式的造句公式是什么?quarrel怎么变过去式?
- 12what is miss gao's favourite _______?she is always in pi
- 13英语快乐寒假(寒假能力自测)(百家出版社)
- 14关于土建造价工程试题的问题!求轴线间的砖工程量(GZ:240mm*240mm)3.6+4.8-.24*4-0.03*6既
- 1512分之7×14分之3 = 4分之3 -0.5= 5.2÷0.26= 4分之1×4÷4分之1×4=
