在400℃、101kPa时,3L某烃A在mL氧气中完全燃烧,燃烧后测得气体体积为
 昏迷中2022-10-04 11:39:541条回答
昏迷中2022-10-04 11:39:541条回答(m+6)L(气体体积均在同温同压下测定),则:
(1)烃A应满足的条件是?
(2)当m=21时,烃A可能的分子式有?
(3)若烃A在常温下为气态物质,求m的取值范围.

已提交,审核后显示!提交回复
共1条回复
 xn_hld 共回答了17个问题
xn_hld 共回答了17个问题 |采纳率94.1%- 注意400度,生成的H2O是气体
设烃为CxHy
CxHy + (x+y/4)O2 = xCO2 + y/2H2O----体积增加
1---------(x+y/4)--------------------(x+y/2-1-x-y/4)
3---------m过量-----------------------------3
解得,y=8
(1)烃A应满足的条件是?----H原子数是8
(2)当m=21时,烃A可能的分子式有?
此时要保证O2还是过量的
同时,由于H原子数是8,则C原子数最小为3,否则不能结合那么多的H
m/(x+y/4) > 3
21/(x+y/4) >3
即,x < 5
可能分子式是,C3H8、C4H8
(3)若烃A在常温下为气态物质,求m的取值范围.
保证,x < 5
即,x最小为3,最大为4
代入,即,m/(x+y/4) > 3
得到,m大于等于18 - 1年前
相关推荐
- 某物质是铼(Re)的氯化物,为深棕色或黑色晶体,熔点为220℃,它可由CCl4和Re207在封闭管中子400℃反应而成
某物质是铼(Re)的氯化物,为深棕色或黑色晶体,熔点为220℃,它可由CCl4和Re207在封闭管中子400℃反应而成
某物质是铼(Re)的氯化物,为深棕色或黑色晶体,熔点为220℃,它可由CCl4和Re207在封闭管中子400℃反应而成。在晶态时,用x射线测得其结构为A的二聚体,则该二聚体的空间结构,和形成的原因! tintin31661年前2
tintin31661年前2 -
 zyw1205 共回答了15个问题
zyw1205 共回答了15个问题 |采纳率73.3%ReCl5 ,有两个氯桥键,构型是两个正八面体共用一条边,形成的原因应该是缺电子,再具体的就想不起来了.1年前查看全部
- 12.在蒸发皿中加热蒸干并灼烧(低于400℃)下列物质的溶液,可以得到该固体的是________
12.在蒸发皿中加热蒸干并灼烧(低于400℃)下列物质的溶液,可以得到该固体的是________
①氯化铝 ②碳酸氢钠 ③硫酸镁 ④高锰酸钾 ⑤偏铝酸钠
⑥氯化镁 ⑦硝酸钠 ⑧氯化铵 ⑨碳酸氢钙 xx季风1年前3
xx季风1年前3 -
 偏爱注zz23 共回答了28个问题
偏爱注zz23 共回答了28个问题 |采纳率89.3%1 水解 先为 氢氧化铝和氯化氢 最后氯化氢挥发掉 氢氧化铝变为氧化铝
2碳酸氢钙受热变为碳酸钙
3可以 因为硫酸不易挥发 又可以溶强氧化铝 最后还是硫酸铝
4高锰酸易变性
5可以 先水解为氢氧化纳 和氢氧化铝 但 氢氧化铝过量可以容氢氧化铝
6同1
7 硝酸易挥发 所以 应该 也许不得 硝酸钠
8 两者都易挥发
9同2 最后为 氧化钙
这都是从微观方面1年前查看全部
- 初二物理题,急需,拜托!将质量为2kg的铁块从10℃加热到400℃,铁块的质量___________将质量为1.5kg的
初二物理题,急需,拜托!
将质量为2kg的铁块从10℃加热到400℃,铁块的质量___________
将质量为1.5kg的金块锻打成0.01mm厚的金箔后,它的质量___________
将质量为5kg的冰融化成水后,它的质量___________
用托盘天平称物体质量时,当把一直最小的砝码加入右盘时嫌多,取出这只最小的砝码时又嫌少,这时应该通过________使天平平衡,然后测出物体质量. hlkm1年前2
hlkm1年前2 -
 youzc2001 共回答了15个问题
youzc2001 共回答了15个问题 |采纳率80%不变/不变/不变/游码1年前查看全部
- 分析45钢正火、淬火、淬火+400℃回火的组织与性能的差别
 mas19801年前1
mas19801年前1 -
 shuk 共回答了23个问题
shuk 共回答了23个问题 |采纳率87%正火组织:铁素体+珠光体,韧性较好,硬度HB170-187,
淬火组织:板条马氏体,韧性极低,硬度HB516-615
400度回火:屈氏体,韧性中等,弹性好,硬度HB319-4101年前查看全部
- 一块金属的质量是500g,温度从400℃降到50℃,共放出1.5×10的五次方J的热量,求此金属的比热容.
 yyyouthpeople1年前1
yyyouthpeople1年前1 -
 思乐冰livia 共回答了18个问题
思乐冰livia 共回答了18个问题 |采纳率83.3%Q=cmΔT
则c=Q/(mΔT)=1.5*10^5/(0.5*350)=857J/kg℃1年前查看全部
- 氯元素的常见化合价有-1,0,+1,+3,+4,+5,+7.①KClO3是一种强氧化剂,常温下较稳定,在400℃以上则
氯元素的常见化合价有-1,0,+1,+3,+4,+5,+7.①KClO3是一种强氧化剂,常温下较稳定,在400℃以上则
 氯元素的常见化合价有-1,0,+1,+3,+4,+5,+7.
氯元素的常见化合价有-1,0,+1,+3,+4,+5,+7.
①KClO3是一种强氧化剂,常温下较稳定,在400℃以上则分解并放出氧气.其分解分为两步进行:加热到356℃以上时分解为甲和乙,而几乎不放出氧气.当温度在400℃以上时,乙分解为甲和丙.其中甲是一种含氯的化合物.
②已知化合物丁由丙物质组成元素和氯元素组成,是一种红黄色有强烈刺激性臭味的气体,标准状况下密度约为3.01g?L-1.
(1)甲的电子式为______.试比较KClO3与乙的稳定性______(用化学式表示).
(2)实验室可以用KClO3和浓盐酸制备氯气,反应的方程式为______.
(3)工业上KClO3和乙均由电解和复分解两步反应制得,其生产流程如图所示,电解热的NaCl溶液时,产生的Cl2与NaOH反应生成NaClO3和NaCl,NaCl继续参与电极反应,最终实现向NaClO3的转化.写出该电解池中发生的总反应方程式______.当温度低于80℃时,会有部分NaClO生成.若电解消耗了117gNaCl时,电路中转移的电子为10.4mol,则NaClO3的产率为______.(产率=[生成物的实际产量/理论产量]×100%)
(4)写出电解NaClO3生成戊时的阳极反应式______.
(5)NaClO3还可用于丁的生产:将NaClO3溶液用H2SO4酸化后,通入SO2气体制得.试写出发生的离子反应方程式______.
 zhifeng11331年前1
zhifeng11331年前1 -
 zfc96315 共回答了18个问题
zfc96315 共回答了18个问题 |采纳率94.4%(1)氯化钾为离子化合物,是由钾离子与氯离子通过离子键形成,电子式为:;根据题意氯酸钾在高温下分解生成氯化钾和高氯酸可知,高氯酸钾稳定性强于氯酸钾,即:KClO3<KClO4,故答案为:;KClO3<KClO...1年前查看全部
- 用溶胶-凝胶法制备二氧化钛,在400℃下焙烧4小时,为什么会容易碳化生成的晶体成黑色,不甚感激
 想看看1年前4
想看看1年前4 -
 马路撞车 共回答了18个问题
马路撞车 共回答了18个问题 |采纳率100%焙烧是分解在形成凝胶时的杂质 使产物中的杂质少些 二氧化钛在400度还不至于碳化 但为什么变黑 因为你的具体操作不是很明确1年前查看全部
- 火油从800℃冷却到400℃时间的意义是什么?
 风速1年前1
风速1年前1 -
 天天elegance 共回答了15个问题
天天elegance 共回答了15个问题 |采纳率93.3%淬火油从800℃冷却到400℃时间的长短,直接反映淬火油在奥氏体不稳定区的冷却能力,淬火油特性温度高,800℃冷却到400℃的时间短,可以避免零件向珠光体组织转变,从而获得所需要的马氏体组织和下贝氏体组织.使零件具有高硬度、高疲劳强度、高耐磨性.1年前查看全部
- 在蒸发皿中加热蒸干再加热(低于400℃)下列物质的溶液,可以得到该物质固体的是( ) A.氯化铝 B.碳酸氢钠
在蒸发皿中加热蒸干再加热(低于400℃)下列物质的溶液,可以得到该物质固体的是( )
A.氯化铝 B.碳酸氢钠 C.硫酸亚铁 D.硫酸镁  000079971年前1
000079971年前1 -
 我是打牛的 共回答了16个问题
我是打牛的 共回答了16个问题 |采纳率100%D
1年前查看全部
- 机械加工问题.1.现有三块形状、尺寸完全相同的钢试样,经过850℃加热保温后在水中冷却,然后分别再放入200℃、400℃
机械加工问题.
1.现有三块形状、尺寸完全相同的钢试样,经过850℃加热保温后在水中冷却,然后分别再放入200℃、400℃、600℃的炉中重新加热保温,经过相同的时间后取出冷至室温.问:(1)三块试样进行了什么热处理操作?(2)比较三块试样的硬度高低.
2.现有三块形状、尺寸完全相同的40Cr钢试样,经过860℃加热保温后取出,分别放入下列介质中冷却:a.炉中,b.空气中,c.水中.指出这三种热处理工艺的名称,并比较最终三块试样的硬度高低. 绿色笔丁1年前1
绿色笔丁1年前1 -
 luojian909 共回答了15个问题
luojian909 共回答了15个问题 |采纳率86.7%1(1)低温回火,中温回火,高温回火.(2)硬度1>2>3
2(1)退火,正火,淬火.(2)硬度11年前查看全部
- 在400℃、101kPa时,NO2(g)+CO(g)=NO(g)+CO2(g)反应过程的能量变化如图所示.下列说法不正确
在400℃、101kPa时,NO2(g)+CO(g)=NO(g)+CO2(g)反应过程的能量变化如图所示.下列说法不正确的是( )
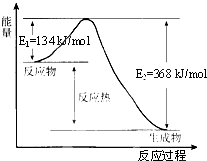 A. 该反应是放热反应
A. 该反应是放热反应
B. 该反应的反应热△H=-234 kJ/mol
C. 加入催化剂,使该反应的活化能降低,反应速率加快,同时使该反应的反应热数值减小
D. 由图可推出:NO(g)+CO2(g)
NO2(g)+CO(g)△H=+234 kJ/mol100℃ .101kPa  lcy19816291年前1
lcy19816291年前1 -
 come23 共回答了19个问题
come23 共回答了19个问题 |采纳率89.5%解题思路:A、由图象可知,该反应是一个能量降低的反应,即放热反应;
B、反应的焓变=拆化学键吸收能量-形成化学键放出能量;
C、加入催化剂,使该反应的活化能降低,同等程度的改变正逆反应的活化能;
D、热化学方程式反写时,反应热数值不变,符号相反.A、由图象可知,该反应是一个能量降低的反应,即放热反应,故A正确;
B、反应的焓变△H=E1-E2=134KJ/mol-368KJ/mol=-234kJ/mol,故B正确;
C、加入催化剂,使该反应的活化能降低,同等程度的改变正逆反应的活化能,所以反应热的值不变,故C错误;
D、热化学方程式反写时,反应热数值不变,符号相反,所以NO(g)+CO2(g)
100℃
.
101kPaNO2(g)+CO(g)△H=+234 kJ/mol,故D正确.
故选C.点评:
本题考点: 化学能与热能的相互转化.
考点点评: 本题考查了反应热、活化能、催化剂对活化能的影响等,难度中等,注意催化剂对反应热无影响.1年前查看全部
- 在400℃,1.01×10 5 Pa时,将SO 2 和14molO 2 压入一个装有催化剂的V升密闭反应器中
在400℃,1.01×10 5 Pa时,将SO 2 和14molO 2 压入一个装有催化剂的V升密闭反应器中,发生2SO 2 +O 2 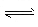 2SO 3 的反应,并且在10min后达到平衡时,测得容器内有2molSO 2 和12molO 2 :
2SO 3 的反应,并且在10min后达到平衡时,测得容器内有2molSO 2 和12molO 2 :
(1)SO 2 的起始浓度为_______,SO 3 (气)的平衡浓度为_________;
(2)SO 2 的转化率为________,O 2 的平均反应速率为________;
(3)平衡时SO 3 (气)占总体积的百分数为__________,此时体系压强为反应起始时体系压强的________倍;
(4)达平衡后再加入2molSO 2 、12molO 2 和4molSO 3 (气),此时正反应速率将_______,逆反应速率将_______,平衡_______移动。 蚊子乱飞1年前1
蚊子乱飞1年前1 -
 4485485 共回答了12个问题
4485485 共回答了12个问题 |采纳率91.7%(1)6/Vmol·L -1 ;4/Vmol·L -1
(2)66.67% ;0.2/Vmol·L -1 ·min -1
(3)22.22% ;0.9倍
(4)增大;增大;向右(或正反应方向)1年前查看全部
- 400℃水蒸气的密度是多少?压力为1000Pa左右~是不是温度高,压力对密度的影响很小了?
 酷11年前1
酷11年前1 -
 黛菲菲 共回答了19个问题
黛菲菲 共回答了19个问题 |采纳率94.7%400℃水蒸气,绝对压力为1000Pa,密度0.032193 (kg/m3),
400℃水蒸气,相对压力为1000Pa(绝对压力102325Pa),密度0.32980 (kg/m3),
温度高,压力对密度的影响不小,正因为温度高,水蒸气更接近于理想气体,理想气体的密度和压力正相关.1年前查看全部
- 将直径为10毫米,黑度为0.9的球体放进内壁温度为400℃的大型真空烘箱中,若球的温度保持80摄氏度,则炉壁对球体的辐射
将直径为10毫米,黑度为0.9的球体放进内壁温度为400℃的大型真空烘箱中,若球的温度保持80摄氏度,则炉壁对球体的辐射热流量是多少
 laog16861年前1
laog16861年前1 -
 顶级ee222 共回答了20个问题
顶级ee222 共回答了20个问题 |采纳率95%φ=εσA(T14次方-T24次方)
ε为黑度
σ为斯忒藩玻尔兹曼常数5.67*10-8次方
面积就是球面积
温度用热力学温度.1年前查看全部
- 请问热动的朋友们有没有20℃的过热蒸汽,400℃的水,为什么?
 zz带砺1年前1
zz带砺1年前1 -
 狐狼紫香 共回答了19个问题
狐狼紫香 共回答了19个问题 |采纳率94.7%400℃的水没有吧,水不是到了375度就成临界状态了吗?超过375度就变成气了,所以没有400℃的水.
水的沸点跟压力有关,当压力低的时候是可以在20度以下达到饱和蒸汽的,在这基础上继续加热就可得过热蒸汽了,所以,这个可以有.1年前查看全部
- 在蒸发皿中加热蒸干并灼烧(低于400℃)下列物质的溶液,可以得到该物质固体的是( )
在蒸发皿中加热蒸干并灼烧(低于400℃)下列物质的溶液,可以得到该物质固体的是( )
A. 氯化铝
B. 碳酸钠
C. 碳酸氢钠
D. 高锰酸钾 rswhm1631年前2
rswhm1631年前2 -
 flora_meiyu 共回答了22个问题
flora_meiyu 共回答了22个问题 |采纳率81.8%解题思路:加热蒸干并灼烧的过程中,要注意考虑盐的水解平衡的移动、物质的氧化、物质的分解等情况,
A.氯化铝易水解,加热HCl挥发,水解彻底进行得到氢氧化铝,灼烧氢氧化铝分解;
B.碳酸钠水解得到碳酸氢钠与氢氧化钠,但氢氧化钠难挥发,最终有生成碳酸钠;
C.NaHCO3在加热条件下易分解;
D.高锰酸钾加热易分解.A.AlCl3因为能水解生成Al(OH)3和HCl,加热HCl挥发,水解彻底进行,生成Al(OH)3沉淀,灼烧Al(OH)3得Al2O3,故A错误;
B.碳酸钠在溶液在加热时水解得到碳酸氢钠与氢氧化钠,但氢氧化钠难挥发,最后得到的固体为Na2CO3,故B正确;
C.NaHCO3在加热条件下易分解生成碳酸钠、二氧化碳和水,故C错误;
D.KMnO4受热易分解锰酸钾、二氧化锰与氧气,故D错误;
故选B.点评:
本题考点: 盐类水解的应用.
考点点评: 本题综合考查物质的性质,主要对水解等知识考查,题目难度不大,注意相关物质的性质的掌握.1年前查看全部
- 16ml由NO与NH3组成的混合气体在催化剂作用下于400℃左右可发生反应,6NO+4NH3==5N2+6H2O(气)
16ml由NO与NH3组成的混合气体在催化剂作用下于400℃左右可发生反应,6NO+4NH3==5N2+6H2O(气)
达到化学平衡时在相同条件下气体体积变为17.5ml,则原混合气体中NO与NH3的物质的量之比有四种情况:①5:3 ②3:2 ③4:3 ④9:7 正确的有? kokoooo1年前1
kokoooo1年前1 -
 兽包传说 共回答了13个问题
兽包传说 共回答了13个问题 |采纳率84.6%6NO+4NH3==5N2+6H2O
6 4 体积增加5+6-6-4=1
X Y 17.5-16=1.5
X=9ml
Y=6ml
剩余气体=16-9-6=1ml,若剩余气体为NH3,则NH3的体积为=6+1=7ml,NO体积为9ml,体积比=物质的量比=9:7;若剩余气体为NO,则NH3的体积为6ml,NO体积=9+1=10ml,体积比=物质的量比=10:6=5:3.
选1和4.1年前查看全部
- 在蒸发发皿中加热蒸干并灼烧(低于400℃)下列的溶液,可以得到该物质的固体是( )
在蒸发发皿中加热蒸干并灼烧(低于400℃)下列的溶液,可以得到该物质的固体是( )
A.氯化镁溶液
B.硫酸亚铁溶液
C.碳酸氢钠溶液
D.硫酸铝溶液 人生的路漫漫1年前1
人生的路漫漫1年前1 -
 我来了来了 共回答了17个问题
我来了来了 共回答了17个问题 |采纳率94.1%解题思路:在蒸发发皿中加热蒸干并灼烧(低于400℃)下列的溶液,可以得到该物质的固体,则该物质在蒸发时没有发生水解生成其它物质,没有被氧化或者发生分解等反应,以此解答该题.A.加热氯化镁溶液,水解生成氢氧化镁和盐酸,盐酸易挥发,灼烧可得到氧化镁,故A错误;
B.加入硫酸亚铁溶液,易被空气中氧气氧化生成硫酸铁,故B错误;
C.加热碳酸氢钠溶液,碳酸氢钠分解生成碳酸钠,故C错误;
D.加入硫酸铝溶液,虽然氯离子水解生成氢氧化铝,但硫酸难挥发,最终仍为硫酸铝,故D正确.
故选D.点评:
本题考点: 盐类水解的应用.
考点点评: 本题考查盐类水解原理和应用,为高考高频考点,侧重于学生对化学基本反应原理和应用的考查,难度不大,注意把握盐类水解的原理和规律.1年前查看全部
- 用Cl2生产某些含氯有机物时会产生副产物HCl.利用反应A:4HCl+O2 CuO/CuCl2 .400℃2Cl2+2H
用Cl2生产某些含氯有机物时会产生副产物HCl.利用反应A:4HCl+O2 CuO/CuCl2 .400℃2Cl2+2H2O,可实现氯
用Cl2生产某些含氯有机物时会产生副产物HCl.利用反应A:4HCl+O2
2Cl2+2H2O,可实现氯的循环利用.CuO/CuCl2 .400℃
已知:Ⅰ.反应A中,4mol HCl被氧化,放出115.6kJ的热量.
Ⅱ.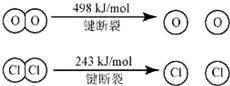
则断开1mol H-O键与断开1mol H-Cl键所需能量相差约为( )
A.16kJ
B.24kJ
C.32kJ
D.48kJ
 留恋291年前1
留恋291年前1 -
 ii的孔子 共回答了15个问题
ii的孔子 共回答了15个问题 |采纳率93.3%E(H-O)、E(HCl)分别表示H-O键能、H-Cl键能,
反应A中,4mol HCl被氧化,放出115.6kJ的热量,反应热△H=反应物总键能-生成物的总键能,故:
4×E(H-Cl)+498kJ/mol-[2×243kJ/mol+4×E(H-O)]=-115.6kJ/mol,
整理得,4E(H-Cl)-4E(H-O)=-127.6kJ/mol,即E(H-O)-E(HCl)=31.9kJ/mol,
故断开1mol H-O键与断开1mol H-Cl键所需能量相差约为31.9kJ/mol×1mol=31.9kJ≈32kJ,
故选C.1年前查看全部
- 一氧化氮 是大气污染物之一.目前有一种治理方法是在 400℃左右、有催化剂存在的情况下用氨把一氧 化氮还原为氮气和水.请
一氧化氮 是大气污染物之一.目前有一种治理方法是在 400℃左右、有催化剂存在的情况下用氨把一氧 化氮还原为氮气和水.请写出该反应的化学方 程式_______.该反应中,生成1.4mol还原产物时,转移电子的物质的量为_____.
 yangrenchuan011年前1
yangrenchuan011年前1 -
 ranranwxda 共回答了19个问题
ranranwxda 共回答了19个问题 |采纳率100%四个氨气+六个一氧化氮=五个氮气+六个水
1mol还原产物转移4mol电子,1.4mol还原产物转移5.6mol电子1年前查看全部
- 在400℃时,将一定量的SO2和14molO2压入一个盛有催化剂的10L密闭容器中进行反应,2SO2+O2可逆箭头2SO
在400℃时,将一定量的SO2和14molO2压入一个盛有催化剂的10L密闭容器中进行反应,2SO2+O2可逆箭头2SO3,已知2min后容器中剩余2molSO2和12molO2,计算:
(1)生成SO3物质的量是________________.
(2)SO2的起始浓度是________________.
(3)2min内SO2和SO3的反应速率.. 薰衣草包1年前1
薰衣草包1年前1 -
 kk牛仔裤 共回答了22个问题
kk牛仔裤 共回答了22个问题 |采纳率81.8%不是很简单吗 你大概没学过 可逆反应这章吧
1 4mol 因为 o2 反应减少了2mol 所以 so3就增加了4mol 这个和方程式的比例系数有关
2 因为 o2减少了2mol 所以 so2 应该减少4mol 理由同上 所以为6mol 因为体积是10L 所以 浓度是 0.6mol/L
3 反应速度 so2 和 so3 一样的 就是减少量 或者 增加量 除以时间 再除以体积 所以就可以直接 减少或增加的 浓度 除以时间
所以为0.2mol/(L*s)1年前查看全部
- 1.在一定体积的容器中,加入1.5 mol 氙气和7.5 mol 氟气,于400℃和2633 kPa 压强下加热数小时,
1.在一定体积的容器中,加入1.5 mol 氙气和7.5 mol 氟气,于400℃和2633 kPa 压强下加热数小时,然后迅速冷却至25℃,容器内除得到一种无色晶体外,还余下4.5 mol氟气.则所得无色晶体产物中,氙与氟的原子个数比是
A.1:2 B.1:3 C.1:4 D.1:6
2.M(NO3)2热分解化学方程式为:2M(NO3)2△====2MO+4NO2↑+O2↑,加热29.6 g M(NO3)2使其完全分解,在标准状况下收集11200 mL的气体,那么M的摩尔质量是
A.64g/mol B.24g/mol C.65g/mol D.40g/mol
3.实验测得乙烯(C2H4)与氧气混和气体的密度是氢气14.5倍,可知其中乙烯的质量百分比为
(A)25.0% (B)27.6% (C)72.4% (D)75.0% 布入流1年前4
布入流1年前4 -
 要匿名 共回答了14个问题
要匿名 共回答了14个问题 |采纳率100%1,C,氙气为单原子气体,氟气为双原子气体,反应后剩余4.5mol氟气,那么反应了3mol氟气以及1.5mol氙气,对应原子个数比为3*2*NA:1.5*NA=4:1,故选c
2,B,2M(NO3)2△====2MO+4NO2↑+O2↑,
2mol 5mol(气体的)
x 11.2/22.4=0.5
x=0.2mol 0.2mol的物质质量为29.6,就有0.2(m+124)=29.6
m=24g/mol
3,D,混合气体密度是氢气的14.5倍,M(混合)/M(氢气)=14.5,M(混合)=29g/mol,
设乙烯的质量分数为x,氧气(1-x)
28*x+32*(1-x)=29
解出x=0.75
仔细看参考书和课本,加油哈1年前查看全部
- 一道化学计算题,望有详解400℃恒温条件下将NO和O2注入真空容器,反应开始瞬间,NO和O2的分压分别是100和286k
一道化学计算题,望有详解
400℃恒温条件下将NO和O2注入真空容器,反应开始瞬间,NO和O2的分压分别是100和286kPa,反应NO+O2→2NO2达平衡时,体系中NO2的分压是79.2 kPa,则该反应在400℃的平衡常数是?
5.88 uuhebby1年前2
uuhebby1年前2 -
 伊淇儿 共回答了25个问题
伊淇儿 共回答了25个问题 |采纳率92%由pV=nRT变形得n/V=p/RT计算出NO和O2的起始浓度与NO2的平衡浓度,再用“三段式”求出NO和O2的平衡浓度,最后用平衡常数计算公式即可求出
当p,V,n,T的单位分别采用Pa(帕斯卡),m3(立方米),mol,K时,R的数值为8.314.
自己算看看1年前查看全部
- 在400℃、101kPa,将SO2和14mol O2装入一个有催化剂的5L密闭容器中,发生了2SO2(g)+O
在400℃、101kPa,将SO2和14mol O2装入一个有催化剂的5L密闭容器中,发生了2SO2(g)+O2(g)⇌2SO3(g)的反应,10min时达到平衡时,测得容器内有2mol SO2和12mol O2.则:
(1)SO2的起始浓度为______.
(2)平衡时体系中有______mol SO3.
(3)从开始反应至达到平衡状态用O2表示的平均反应速率为______.
(4)平衡体系中含SO3的体积分数为______.
(5)以上反应体系达到平衡后,如要使平衡向正反应方向移动,可以采取措施为:______,______.(任写两条) ln97311年前1
ln97311年前1 -
 悠然见男衫 共回答了16个问题
悠然见男衫 共回答了16个问题 |采纳率81.3%解题思路:依据化学平衡三段式列式计算
(1)根据c=[n/V]计算;
(2)依据三段式计算得到;
(3)依据V=[△c/△t]计算;
(4)利用平衡时三氧化硫物质的量除以平衡气体总物质的量计算;
(5)反应是气体体积减少的放热反应,结合平衡移动原理分析;列出三段式计算
2SO2(g)+O2(g)⇌2SO3(g)
起始量(mol)6 14 0
变化量(mol)4 2 4
平衡量(mol) 2 124
(1)SO2的起始浓度=[6mol/5L]=1.2mol/L;
故答案为:1.2mol/L;
(2)平衡时体系中有4mol三氧化硫生成;
故答案为:4;
(3)从开始反应至达到平衡状态用O2表示的平均反应速率=
2mol
5L
10min=0.04mol/L•min;
故答案为:0.04mol/L•min;
(4)平衡体系中含SO3的体积分数=[4mol/2mol+12mol+4mol]×100%=22.2%;
故答案为:22.2%;
(5)体系达到平衡后,反应是气体体积减少的放热反应,如要使平衡向正反应方向移动,可以降低温度,增大压强,加入氧气等;
故答案为:降低温度,增大压强,加入氧气等;点评:
本题考点: 化学平衡的计算;化学平衡的影响因素.
考点点评: 本题考查了化学平衡的计算方法和概念计算应用,主要是浓度计算、体积分数、影响平衡的因素判断,掌握基础是关键,题目较简单.1年前查看全部
- 在蒸发发皿中加热蒸干并灼烧(低于400℃)下列的溶液,可以得到该物质的固体是 A.氯化镁溶液 B.硫酸铵溶液 C.碳酸氢
在蒸发发皿中加热蒸干并灼烧(低于400℃)下列的溶液,可以得到该物质的固体是
A.氯化镁溶液 B.硫酸铵溶液 C.碳酸氢钠溶液 D.硫酸铝溶液  sqvumdct1年前1
sqvumdct1年前1 -
 uu月0816 共回答了21个问题
uu月0816 共回答了21个问题 |采纳率85.7%D
1年前查看全部
- 红外测温枪超量程会怎样?普通的红外线测温枪量程假设是-50℃~330℃,如果把激光小红点指向400℃以上的酒精灯会发生什
红外测温枪超量程会怎样?
普通的红外线测温枪量程假设是-50℃~330℃,如果把激光小红点指向400℃以上的酒精灯会发生什么? 诺言与谎言1年前1
诺言与谎言1年前1 -
 ma19781018 共回答了18个问题
ma19781018 共回答了18个问题 |采纳率83.3%显示不知道什么东西的温度,因为这种红外测温仪(-50℃~330℃),测不了火焰的温度,不知道测的是什么温度,如果指向400℃物体,比如钢板,会显示超量程符号,每种符号不一定一样1年前查看全部
- 在线等化学题6分)NO、NO2是大气污染物之一,目前有一种治理方法是在400℃左右,有催化剂存在条件下,用NH3将NO或
在线等化学题
6分)NO、NO2是大气污染物之一,目前有一种治理方法是在400℃左右,有催化剂存在条件下,用NH3将NO或NO2还原为N2和H2O,请写出NH3在上述条件下分别将NO、NO2还原成N2和H2O的化学方程式:
_________________________________、____________________________________.
设某硝酸工业排放出的尾气中,只含NO和NO2且NO2和NO体积之比为3:1,现用氨还原法处理,上述尾气1体积需消耗相同状况下氨气_____________体积.
第二步7/6怎么来的
 夕阳童年梦1年前1
夕阳童年梦1年前1 -
 wen115 共回答了21个问题
wen115 共回答了21个问题 |采纳率81%4NH3+6NO=5N2+6H2O 8NH3+6NO2+7N2+12H2O
4 6 8 6
x 1/4 y 3/4
由以上得x=1/6 Y=1 x+y=7/61年前查看全部
- 在400℃、101kPa时,NO2(g)+CO(g)=NO(g)+CO2(g)反应过程的能量变化如图所示.下列说法不正确
 在400℃、101kPa时,NO2(g)+CO(g)=NO(g)+CO2(g)反应过程的能量变化如图所示.下列说法不正确的是( )
在400℃、101kPa时,NO2(g)+CO(g)=NO(g)+CO2(g)反应过程的能量变化如图所示.下列说法不正确的是( )
A.该反应是放热反应
B.该反应的反应热△H=-234 kJ/mol
C.加入催化剂,使该反应的活化能降低,反应速率加快,同时使该反应的反应热数值减小
D.由图可推出:NO(g)+CO2(g)
NO2(g)+CO(g)△H=+234 kJ/mol100℃ .101kPa  1205538111年前1
1205538111年前1 -
 海南星云oo 共回答了19个问题
海南星云oo 共回答了19个问题 |采纳率89.5%解题思路:A、由图象可知,该反应是一个能量降低的反应,即放热反应;
B、反应的焓变=拆化学键吸收能量-形成化学键放出能量;
C、加入催化剂,使该反应的活化能降低,同等程度的改变正逆反应的活化能;
D、热化学方程式反写时,反应热数值不变,符号相反.A、由图象可知,该反应是一个能量降低的反应,即放热反应,故A正确;
B、反应的焓变△H=E1-E2=134KJ/mol-368KJ/mol=-234kJ/mol,故B正确;
C、加入催化剂,使该反应的活化能降低,同等程度的改变正逆反应的活化能,所以反应热的值不变,故C错误;
D、热化学方程式反写时,反应热数值不变,符号相反,所以NO(g)+CO2(g)
100℃
.
101kPaNO2(g)+CO(g)△H=+234 kJ/mol,故D正确.
故选C.点评:
本题考点: 化学能与热能的相互转化.
考点点评: 本题考查了反应热、活化能、催化剂对活化能的影响等,难度中等,注意催化剂对反应热无影响.1年前查看全部
- 写出下列有关化学方程式:(1)NO是大气污染物之一,目前有一种治理方法是在400℃左右、有催化剂存在的条件下,用氨气把N
写出下列有关化学方程式:
(1)no是大气污染物之一,目前有一种治理方法是在400℃左右、有催化剂存在的条件下,用氨气把no还原为氮气和水:4nh3+6no
5n2+6h2o催化剂 .400℃ 4nh3+6no.
5n2+6h2o催化剂 .400℃
(2)***使用的燃料主要是煤炭和石油,产生的so2遇到雨水成为酸雨.目前有一种较有效的方法,即用直升飞机喷洒碳酸钙粉末,脱硫效果可达85%,碳酸钙与so2及空气中的氧气反应生成硫酸钙和二氧化碳,写出化学方程式______.
(3)市售打火机里装的不是汽油,而是液体丁烷(c4h10),丁烷在空气中燃烧后产生二氧化碳和水蒸气,写出丁烷完全燃烧的化学方程式2c4h10+13o2
8co2+10h2o点燃 .2c4h10+13o2.
8co2+10h2o点燃 .
(4)将镁条点燃后,伸入到装有二氧化碳的集气瓶中,发现镁条仍能继续燃烧,生成了白色的氧化镁和黑色的碳粉.co2+2mg
2mgo+c点燃 .co2+2mg.
2mgo+c点燃 . 五月的风111年前1
五月的风111年前1 -
 O古风O 共回答了16个问题
O古风O 共回答了16个问题 |采纳率93.8%解题思路:根据反应物、生成物、反应条件及其质量守恒定律可以书写反应的化学方程式.(1)一定条件下,氨气和一氧化氮反应的化学方程式为:4NH3+6NO
催化剂
.
400℃5N2+6H2O.
故填:4NH3+6NO
催化剂
.
400℃5N2+6H2O.
(2)碳酸钙、二氧化硫和氧气反应的化学方程式为:2CaCO3+2SO2+O2=2CaSO4+2CO2.
故填:2CaCO3+2SO2+O2=2CaSO4+2CO2.
(3)丁烷燃烧的化学方程式为:2C4H10+13O2
点燃
.
8CO2+10H2O.
故填:2C4H10+13O2
点燃
.
8CO2+10H2O.
(4)点燃条件下二氧化碳和镁反应的化学方程式为:CO2+2Mg
点燃
.
2MgO+C.
故填:CO2+2Mg
点燃
.
2MgO+C.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 书写化学方程式要注意四步:一是反应物和生成物的化学式要正确;二是要遵循质量守恒定律,即配平;三是要有必要的条件;四是看是否需要“↑”或“↓”.1年前查看全部
- 400℃时,在催化剂存在的条件下,用氨气(NH3)可将有毒气体NO还原为N2和H2O,该反应的化学方程式为?各
400℃时,在催化剂存在的条件下,用氨气(NH3)可将有毒气体NO还原为N2和H2O,该反应的化学方程式为?各
物质的质量比为? qwerty210001年前2
qwerty210001年前2 -
 dsrlegp 共回答了20个问题
dsrlegp 共回答了20个问题 |采纳率85%4NH3 + 6NO = 5N2 + 6H2O
4:6:5:61年前查看全部
- 在蒸发皿中加热蒸干并灼烧(低于400℃)下列物质的溶液,可以得到该物质固体的是( )
在蒸发皿中加热蒸干并灼烧(低于400℃)下列物质的溶液,可以得到该物质固体的是( )
A. 氯化铁
B. 亚硫酸钠
C. 硫酸镁
D. 碳酸氢铵 玟汝1年前3
玟汝1年前3 -
 星轨嘉儿 共回答了20个问题
星轨嘉儿 共回答了20个问题 |采纳率75%解题思路:A.氯化铁易水解且氯化氢易挥发;
B.亚硫酸钠易被氧化;
C.硫酸镁易水解但硫酸没有挥发性;
D.碳酸氢铵易分解.A.氯化铁水解生成氢氧化铁和氯化氢,加热过程中促进氯化氢挥发,从而促进氯化铁水解,最后蒸干时得到氢氧化铁固体,灼烧时氢氧化铁固体分解生成氧化铁,所以最后得到的固体是氧化铁,故A错误;
B.亚硫酸钠不稳定,易被氧化生成硫酸钠,所以最后蒸干灼烧得到的固体是硫酸钠,故B错误;
C.加热虽然促进硫酸镁水解,但硫酸没有挥发性,且灼烧时硫酸镁不分解,所以最终得到的固体是硫酸镁,故C正确;
D.碳酸氢铵不稳定,在加热条件下,易分解生成氨气、二氧化碳和水,蒸干灼烧得不到固体,故D错误;
故选C.点评:
本题考点: 盐类水解的应用;含硫物质的性质及综合应用.
考点点评: 本题以盐类水解为载体考查了物质的性质,明确物质的性质是解本题关键,根据物质的稳定性、水解特点等来分析解答,难度不大.1年前查看全部
- 在400℃左右,有催化剂存在的条件下,用氨气(NH3)可将有毒气体NO还原为N2和H2O,试写出反应的化学方程式:4NH
在400℃左右,有催化剂存在的条件下,用氨气(NH3)可将有毒气体NO还原为N2和H2O,试写出反应的化学方程式:4NH3+6NO
5N2+6H2O催化剂 .400℃ 4NH3+6NO.
5N2+6H2O催化剂 .400℃  gaoming611年前1
gaoming611年前1 -
 红颜祸害 共回答了21个问题
红颜祸害 共回答了21个问题 |采纳率81%解题思路:根据反应物、生成物、反应条件写出化学反应方程式.由于在400℃左右,在催化剂存在的条件下,用氨气可将有毒气体NO还原为N2和H2O,反应的化学方程式为:4NH3+6NO
催化剂
.
400℃5N2+6H2O.
故答案为:4NH3+6NO
催化剂
.
400℃5N2+6H2O;点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 主要考查了化学方程式的书写,根据质量守恒定律进行正确解答即可.1年前查看全部
- 在400℃时,将一定量的SO 2 和14mol O 2 压入一个盛有催化剂的10L密闭容器中进行反应:2SO
在400℃时,将一定量的SO 2 和14mol O 2 压入一个盛有催化剂的10L密闭容器中进行反应:2SO 2 +O 2 
2SO 3 ,已知2min后,容器中剩余2mol SO 2 和12mol O 2 ,则:
(1)生成了______mol SO 3 ,SO 2 的起始物质的量浓度是______.
(2)2min内平均反应速率:v(SO 2 )是______mol/(L•min),v(SO 3 )是______mol/(L•min). xjzangel1年前1
xjzangel1年前1 -
 梦琪Q_Q 共回答了22个问题
梦琪Q_Q 共回答了22个问题 |采纳率90.9%1年前查看全部
- 在密闭容器中盛有HI气体,在400℃时建立如下平衡:2HI(g)⇌H2 (g)+I2 (g);△H>
在密闭容器中盛有HI气体,在400℃时建立如下平衡:2HI(g)⇌H2 (g)+I2 (g);△H>0,改变下列条件,请填空:(填写变化情况)
(1)将温度升至480℃,混合气体的颜色______,(加深,变浅、不变)HI的分解率______,(增大、减小、不变),化学平衡向______移动,平衡常数______(增大、减小、不变),混合气体的总质量______(增大、减小、不变);
(2)若将密闭容器的体积压缩了[1/4],平衡常数______(增大、减小、不变) 云往风飞1年前1
云往风飞1年前1 -
 liuxinghudiew 共回答了23个问题
liuxinghudiew 共回答了23个问题 |采纳率87%解题思路:(1)化学平衡是气体体积不变的吸热反应,升高温度平衡向正向进行,依据平衡移动方向分析碘化氢分解率,混合气体质量守恒,平衡常数随温度变化;
(2)平衡常数随温度变化,不随浓度变化.(1)在400℃时建立如下平衡:2HI(g)⇌H2 (g)+I2 (g);△H>0,反应是气体体积不变的吸热反应,将温度升至480℃,平衡向吸热反应进行,平衡正向进行,碘单质浓度增大,颜色变深,碘化氢分解率增大,平衡常数不变,反应前后都是气体,混合气体质量不变,
故答案为:变深;增大;向正反应方向;增大;不变;
(2)若将密闭容器的体积压缩了[1/4],压强增大,平衡常数不变,故答案为:不变.点评:
本题考点: 化学平衡的影响因素.
考点点评: 本题考查了化学平衡影响因素的分析判断,主要是平衡常数的分析应用,注意平衡常数随温度变化,掌握基础是关键,题目较简单.1年前查看全部
- (2012•佳木斯)一氧化氮是大气污染物之一.目前,有一种治理的方法:在400℃左右,有催化剂存在的情况下,用氨气和一氧
(2012•佳木斯)一氧化氮是大气污染物之一.目前,有一种治理的方法:在400℃左右,有催化剂存在的情况下,用氨气和一氧化氮反应生成氮气和水,请写出该反应的化学方程式4NH3+6NO
5N2+6H2O催化剂 .400℃ 4NH3+6NO.
5N2+6H2O催化剂 .400℃  尾巴好长的耗子1年前1
尾巴好长的耗子1年前1 -
 haomulin 共回答了20个问题
haomulin 共回答了20个问题 |采纳率80%解题思路:根据书写化学方程式的步骤:(1)写:根据事实写反应物和生成物的化学式,中间用短横线相连;(2)配:配平化学方程式,并检验;(3)等:将短横线改写成“=”;(4)标:标明反应发生条件以及生成物状态;(5)查:检查化学式是否正确,进行分析解答本题.根据书写化学方程式的步骤,写出反应方程式,
故答案为:4NH3+6NO
催化剂
.
400℃5N2+6H2O.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查学生根据书写化学方程式的步骤书写方程式的能力,并应用到解题当中.1年前查看全部
- 大约在400℃,在催化剂的作用下,一氧化氮与氨气反应生成氮气和水,写出反应的方程式:
 baojlo1年前2
baojlo1年前2 -
 大二男生 共回答了17个问题
大二男生 共回答了17个问题 |采纳率88.2%6NO+4NH3=5N2+6H2O1年前查看全部
- 在蒸发皿中加热蒸干并灼烧(低于400℃)下列物质的溶液,可以得到该物质固体的是 A.氯化铁 B.亚硫酸钠 C.硫酸镁 D
在蒸发皿中加热蒸干并灼烧(低于400℃)下列物质的溶液,可以得到该物质固体的是
A.氯化铁 B.亚硫酸钠 C.硫酸镁 D.碳酸氢铵  espdazzle1年前1
espdazzle1年前1 -
 gentlewjr 共回答了25个问题
gentlewjr 共回答了25个问题 |采纳率80%C
A错,氯化铁中铁离子水解,蒸发时得到的固体物质为氢氧化铁;B错,亚硫酸钠易被氧气氧化为硫酸钠,在蒸发过程中所得到的固体为硫酸钠;C正确;D错,碳酸氢铵易分解,最后得不到固体;1年前查看全部
- 醋酸钠和氢气在400℃条下件反应生成
 听你说谎1年前1
听你说谎1年前1 -
 黯黯生天际 共回答了17个问题
黯黯生天际 共回答了17个问题 |采纳率100%CH3COONA+2H2=CH3CH2ONA+H2O1年前查看全部
- 一密闭容器中,400℃时存在一个化学平衡.反应进行至2min、4min时,分别只改变了某一条件,容器中四种物质的物质的量
一密闭容器中,400℃时存在一个化学平衡.反应进行至2min、4min时,分别只改变了某一条件,容器中四种物质的物质的量n (mol)随时间t (min)变化如图,下列说法不正确的( ) A.平衡涉及反应为4NH 3 +5O 2 
4NO+6H 2 OB.0至3分钟气体的平均分子量在逐步减小 C.第4至5分钟平衡在右移,NH 3 的转化率提高 D.2min、4min时改变条件可能为降温、加入O 2 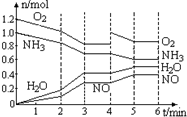
 boschoolbo1年前1
boschoolbo1年前1 -
 sdzmud 共回答了20个问题
sdzmud 共回答了20个问题 |采纳率80%A、从图中看出反应开始时O 2 为1.2mol,NH 3 为1.0mol,并随时间逐渐减少,开始时NO和H 2 O的物质的量都为0,
且随时间不断增多,所以反应是以NH 3 和O 2 为反应物开始生成NO和H 2 O的,且前2min内,NH 3 减少了0.12mol,O 2 减
少了0.15mol,NO和H 2 O的物质的量分别增加了0.12mol和0.18mol,化学反应计量数之比为:4:5:4:6,所以
平衡涉及反应为4NH 3 +5O 2
4NO+6H 2 O,故A对;
B、0至3分钟,NH 3 和O 2 的物质的量不断减少,NO和H 2 O的物质的量不断增多,平衡向正反应方向进行,混合气体中
分子个数增多,但是总质量不变,因此平均相对分子质量减小,故B对;
C、第4至5分钟,NH 3 的物质的量在减少,但第4分钟时O 2 的物质的量却增加,说明第4分钟时向容器中加入了O 2 ,
因此,平衡向右移,NH 3 的转化率提高,故C对;
D、由图看出2min后,NH 3 和O 2 的减少速度与NO和H 2 O的增多速度都在增大,说明反应速率增大,2min时改变的
条件不可能是降温,4min时,O 2 的物质的量增加,NH 3 的物质的量减少,说明第4分钟时向容器中加入了O 2 ,故D错.
故选:D.1年前查看全部
- 在火炉中加热到400℃质量为100克铁块放入质量为50克,初温为20℃的水中,水温最高能升多少摄氏度?
 cxo1231年前3
cxo1231年前3 -
 shoudao1 共回答了14个问题
shoudao1 共回答了14个问题 |采纳率100%答案:
解析:
设热平衡后,水的温度为t,根据热平衡方程,Q吸=Q放
即:c水m水(t-20)=c铁m铁(400-t)
代入质量与比热容,得:
4200×0.05×(t-20)=460×0.1×(400-t)
解出:t≈88.28℃
回答的是正确的,给他个采纳吧.1年前查看全部
- 已知在400℃时,N2(g)+3H2(g)=2NH3(g) △H<0,该反应的平衡常数K1=0.5,回答下面问题
已知在400℃时,N2(g)+3H2(g)=2NH3(g) △H<0,该反应的平衡常数K1=0.5,回答下面问题
(1)相同温度下2NH3(g)=N2(g)+3H2(g)的平衡常数K2
(2)400℃,在0.5L的反应容器中进行合成氮反应,一段时间后,测得N2.H2.NH3的物质的量分别为2MOL,1MOL,2MOL,则此时N2的反应速率V正 V逆(大于,小于,等于) chaoji011年前1
chaoji011年前1 -
 我爱你love 共回答了18个问题
我爱你love 共回答了18个问题 |采纳率83.3%1.K2=2
2NH3(g)=N2(g)+3H2(g)是所给方程式的逆反应,正逆反应的平衡常数乘积是1,所以K2=1/K1=1/0.5=2
2.v正=v逆
N2、H2、NH3的物质的量浓度分别是2/0.5=4mol/L、1/0.5=2mol/L、2/0.5=4mol/L
浓度商=c(NH3)^2/c(N2)*c(H2)^3=4^2/4*2^3=0.5=K1,说明反应已经达到了化学平衡状态,所以v正=v逆.1年前查看全部
- 在蒸发皿中加热蒸干并灼烧(低于400℃)下列物质的溶液,可以得到该物质固体的是( )
在蒸发皿中加热蒸干并灼烧(低于400℃)下列物质的溶液,可以得到该物质固体的是( )
A. 氯化铝
B. 碳酸钠
C. 碳酸氢钠
D. 高锰酸钾 dd吟唱的神曲1年前2
dd吟唱的神曲1年前2 -
 凌霄云 共回答了20个问题
凌霄云 共回答了20个问题 |采纳率80%解题思路:加热蒸干并灼烧的过程中,要注意考虑盐的水解平衡的移动、物质的氧化、物质的分解等情况,
A.氯化铝易水解,加热HCl挥发,水解彻底进行得到氢氧化铝,灼烧氢氧化铝分解;
B.碳酸钠水解得到碳酸氢钠与氢氧化钠,但氢氧化钠难挥发,最终有生成碳酸钠;
C.NaHCO3在加热条件下易分解;
D.高锰酸钾加热易分解.A.AlCl3因为能水解生成Al(OH)3和HCl,加热HCl挥发,水解彻底进行,生成Al(OH)3沉淀,灼烧Al(OH)3得Al2O3,故A错误;B.碳酸钠在溶液在加热时水解得到碳酸氢钠与氢氧化钠,但氢氧化钠难挥发,最后得到的固体为...
点评:
本题考点: 盐类水解的应用.
考点点评: 本题综合考查物质的性质,主要对水解等知识考查,题目难度不大,注意相关物质的性质的掌握.1年前查看全部
- 在400℃时,将SO2和14molO2压入一个盛有催化剂的VL密闭容器中进行反应(2S2+O2⇌2SO3),2分钟时容器
在400℃时,将SO2和14molO2压入一个盛有催化剂的VL密闭容器中进行反应(2S2+O2⇌2SO3),2分钟时容器中剩下2molSO2和12molO2.则:
(1)2分钟内生成的SO3的物质的量是______,SO2起始的物质的量是______.
(2)2分钟内以SO2浓度变化表示的平均反应速率是[2/V]mol/L•min;[2/V]mol/L•min;. ivewaken1年前1
ivewaken1年前1 -
 zhengraohui 共回答了19个问题
zhengraohui 共回答了19个问题 |采纳率94.7%解题思路:依据化学平衡三段式列式计算,设二氧化硫起始量为x,生成三氧化硫物质的量为y
2SO2+O2⇌2SO3
起始量(mol) x 14 0
变化量(mol) y 0.5y y
平衡量(mol) 2 12 y
14-0.5y=12
y=4
x-y=2
x=6
(1)依据上述计算得到;
(2)反应速率v=[△c/△t]计算;依据化学平衡三段式列式计算,设二氧化硫起始量为x,生成三氧化硫物质的量为y
2SO2+O2⇌2SO3
起始量(mol) x 14 0
变化量(mol) y 0.5y y
平衡量(mol) 2 12 y
14-0.5y=12
y=4
x-y=2
x=6
(1)2分钟内生成的SO3的物质的量是4mol,SO2起始的物质的量是6mol;
故答案为:4,6;
(2)2分钟内以SO2浓度变化表示的平均反应速率=
△n
V
△t=
4mol
VL
2min=[2/V]mol/L•min;
故答案为:[2/V]mol/L•min;点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查了化学平衡影响因素分析计算,掌握基础是关键,题目较简单.1年前查看全部
- 常温和400℃以上 管内径300—500mm渐变 可以实现内径测量,并体现加热之后温度引起的变形能测量吗?
 minzhu20061年前1
minzhu20061年前1 -
 squirrel_37 共回答了18个问题
squirrel_37 共回答了18个问题 |采纳率94.4%ZM10X激光幕帘直径测量仪1年前查看全部
- 在蒸发皿中加热蒸干并灼烧(低于400℃)下列物质的溶液,可以得到该物质固体的是( ) A.
在蒸发皿中加热蒸干并灼烧(低于400℃)下列物质的溶液,可以得到该物质固体的是( ) A.
在蒸发皿中加热蒸干并灼烧(低于400℃)下列物质的溶液,可以得到该物质固体的是( ) A.氯化铝 B.碳酸氢钠 C.硫酸镁 D.高锰酸钾 【选择哪一项?为什么?】 我与深圳无缘吗1年前1
我与深圳无缘吗1年前1 -
 偶是披着狼皮的羊 共回答了19个问题
偶是披着狼皮的羊 共回答了19个问题 |采纳率89.5%选D.A会有Al2O3,B是Na2CO3,C会有MgO .D难以分解.1年前查看全部
大家在问
- 1CuO+ HNO3= Cu(NO3)2+ H2O 配平
- 2一台电动机,其电阻为1Ω,加在它两端的电压是220V,正常工作时通过它的电流是15A,正常工作0.5h,求:
- 3某项工程,甲工程队单独完成任务要40天,现乙工程队先做30天后,甲乙两队合作20天恰好完成任务,乙工程队单独做要多少天才
- 4一道中级财务会计题.某商场采用售价金额核算法对库存商品进行核算.
- 5按要求把下面的字写在横线上!厨 烁 揍 履 遂 伸 敏 挠 诺 撒 葬 饮 炙 羚 锦 圣 塑 荆读翘舌音的字:读平舌音
- 6wei什么?地球上最早出现的生物代谢类型是厌养异养型
- 7下列说法中正确的是( )A. 我们观察到的太阳光谱是明线光谱B. 红光和紫光从水中射向空气时,紫光发生全反射的临界角比
- 8阳光收集在瓶子里,瓶子便有了温暖;阳光收集在心里,内心便有了爱。如果经常收集阳光,我们的内心也便有了阳光的普照,滋润着爱
- 9第一次作文怎么写???求速解
- 10The more you care for someone,the less you understand her.这句
- 11已知,关于X的方程X的平方+(M-1)X-1=0 设方程的两个实数根分别为X1,X2,当X1的绝对值=4倍的X2的绝对值
- 12将△ABC沿着AD对折,顶点C恰好落在边AB上的点E处,若已知AE=18cm,BE=4cm试求线段BD与CD的长度之比(
- 13桌子上有一把钥匙,英语怎么写
- 14已知点A在单位圆上,且x轴正半轴绕原点逆时针旋转到过A点时所转的最小正角为θ,则向量O→A的坐标为( )
- 15英语翻译如上
