CO2和NaHSO3会反应吗?除CO2里的SO2用什么呢?化学实验使用的导管是橡胶的吗?图上很多导管都像是玻璃的.
 yjdc10132022-10-04 11:39:541条回答
yjdc10132022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 红颜遇清风 共回答了19个问题
红颜遇清风 共回答了19个问题 |采纳率84.2%- 不会`根据强酸制弱酸
CO2+H2O=H2CO3实际上是H2CO3和NaHSO3反应
但H2SO3酸性比H2CO3强,所以不反应
用NaHCO3
2NaHCO3+SO2=Na2SO3+H2O↑+CO2↑
有橡胶有玻璃的,根据实验要求配备 - 1年前
相关推荐
- 有机化学题A和B是羰基的有机化合物,相对分子质量为72.A和B都能与饱和NaHSO3作用生成白色沉淀.A可发生银镜反应,
有机化学题
A和B是羰基的有机化合物,相对分子质量为72.A和B都能与饱和NaHSO3作用生成白色沉淀.A可发生银镜反应,B则不能,B能发生碘仿反应,A则不能.写出A和B的结构式和名称. 起舞弄清影011年前1
起舞弄清影011年前1 -
 折翅鹰 共回答了17个问题
折翅鹰 共回答了17个问题 |采纳率100%去下羰基的28的分子量,还有44,则为C3H8,说明分子式是C4H8O,A能发生银镜反应,说明是醛,则为丁醛;B能发生碘仿反应,则为甲基酮,是2-丁酮.关于和亚硫酸氢钠反应,是告诉分子中和羰基相连的碳没有支链,没有位阻.1年前查看全部
- 同体积同浓度的na2so3和nahso3混合,溶液中so3与hso3的浓度大小比较
同体积同浓度的na2so3和nahso3混合,溶液中so3与hso3的浓度大小比较
原因 nishannan1年前1
nishannan1年前1 -
 s7515677 共回答了17个问题
s7515677 共回答了17个问题 |采纳率100%亚硫酸根在亚硫酸钠中的浓度大于亚硫酸氢钠中的浓度
亚硫酸氢根在亚硫酸氢钠中的浓度大于亚硫酸钠中的浓度.
即使两个弱离子会水解,并且后者的亚硫酸氢根会电离.
但是弱离子的电离与水解是微弱的,所以还是根据原来电解质的电解所得结果为主要.
希望采纳.1年前查看全部
- 为什NaHSO3中离子浓度由大到小为Na+ HSO3- SO3 2- H2SO3 NaHCO3
为什NaHSO3中离子浓度由大到小为Na+ HSO3- SO3 2- H2SO3 NaHCO3
为什NaHSO3中离子浓度由大到小为Na+ HSO3- SO3 2- H2SO3
NaHCO3中却是Na+ HCO3- H2CO3 CO3 2- geometrie1年前3
geometrie1年前3 -
 呼和浩特部落 共回答了15个问题
呼和浩特部落 共回答了15个问题 |采纳率93.3%HSO3-电离大于水解,其液呈酸性,HCO3-水解大于电离呈碱性,所以前者H2SO3多于SO32-,后者则恰好相反1年前查看全部
- Na2co3 nahco3 nahso3 nh4cl电荷守恒物料守恒质子守恒离子浓度关系
 zhaobo77881年前1
zhaobo77881年前1 -
 忽略忽略再忽略 共回答了14个问题
忽略忽略再忽略 共回答了14个问题 |采纳率100%Na2CO3
电荷守恒,cNa+ +cH+=2cCO32-+cHCO3-+cOH-
物料守恒,2cCO32-+2cHCO3-+2cH2CO3=cNa+
质子守恒,cH+ +cH2CO3=cOH-+cCO32-
NaHCO3
电荷守恒,cNa+ +cH+=2cCO32-,+cHCO3-+cOH-
物料守恒,cNa+=cHCO3-+cCO32-+cH2CO3
质子守恒,cH++cH2CO3=cCO32-+cOH-
NaHSO3与NaHCO3几乎完全一样,就不书写了
NH4Cl,电荷守恒,
cCl-+cOH-=cNH4+ +cH+
物料守恒,cNH4+ +cNH3.H2O=cCl-
质子守恒,cH+ =cNH3.H2O+cOH-
质子守恒,即电荷守恒与物料守恒式子的相减可得1年前查看全部
- NaHS,NaHSO4,NaHSO3,NaSO4,比较pH
 kajv1年前4
kajv1年前4 -
 虚籽疋 共回答了15个问题
虚籽疋 共回答了15个问题 |采纳率73.3%NaHS>NaHSO3>NaSO4> NaHSO4
由于纯在水解 氢硫酸的酸性比亚硫酸酸性弱 水解后溶液现实碱性更强 所以NaHS>NaHSO3
NaSO4溶液是中性 强酸强碱盐
NaHSO4
可以直接电离出氢离子 显示酸性1年前查看全部
- 向KIO3溶液中 滴加NaHSO3溶液的离子方程式
 斩月兮1年前1
斩月兮1年前1 -
 horsesky 共回答了16个问题
horsesky 共回答了16个问题 |采纳率93.8%当NaHSO3加入KIO3溶液中后,就发生反应:IO3-+3 HSO3 - = I- +3 SO4 2- + 3H+,由于是KIO3过量且溶液呈酸性,这时,IO3-和与I-发生氧化还原反应:IO3- + 5I- + 6H+ = 3 I2 + 3H2O.将两个反应方程式加和得:2 IO3- +5 HSO...1年前查看全部
- NaHSO3粉末加入HNO3溶液反应
 记忆的幸福1年前1
记忆的幸福1年前1 -
 丝妮雅岛服 共回答了22个问题
丝妮雅岛服 共回答了22个问题 |采纳率68.2%加入稀HNO3溶液:
NaHSO3+HNO3(稀)===SO2+H20+NaNO3
加入浓HNO3溶液:
生成Na2SO4、H2O、NO21年前查看全部
- NaHCO3+SO2==NaHSO3+CO2 生成的CO2有没有气体符号?
 pinly61920011年前1
pinly61920011年前1 -
 卖蒸馍地 共回答了15个问题
卖蒸馍地 共回答了15个问题 |采纳率93.3%没有,因为反应物SO2是气体,生成物中有气体就不必加气体符号了.1年前查看全部
- 0.01mol/L H2SO3与浓度均为0.01mol/L的 H2SO3 和NaHSO3的混合溶液H+浓度哪个大?
0.01mol/L H2SO3与浓度均为0.01mol/L的 H2SO3 和NaHSO3的混合溶液H+浓度哪个大?
0.01mol/L H2SO3的H+浓度与0.01mol/L的 H2SO3 和NaHSO3的混合溶液H+浓度哪个大?
1.混合溶液中H2SO3、NaHSO3浓度均为0.01mol/L
2.请教sd61961如何解释?能具体计算出结果吗?
3.由于HSO3-电离的程度大于水解的程度,NaHSO3最终显酸性。
4. iedwawx1年前5
iedwawx1年前5 -
 zchangjing 共回答了19个问题
zchangjing 共回答了19个问题 |采纳率84.2%你的NaHSO3的浓度也是0.01mol/L吗,如果这样就是H2SO3中的H+浓度大,NaHSO3的HSO3-抑制了H2SO3的电离,毕竟HSO3-的电离小的多1年前查看全部
- SO3和NaHSO3反应 到底是生成Na2SO4还是NaHSO4?我看到网上有人说是前者 但做题的时候 有一题问的是 二
SO3和NaHSO3反应 到底是生成Na2SO4还是NaHSO4?我看到网上有人说是前者 但做题的时候 有一题问的是 二氧化硫三氧化硫通过 盛有亚硫酸氢钠的洗气瓶 放这个洗气瓶的目的是什么 吸收三氧化硫放出等量的二氧化硫 不是生成硫酸钠的吗?
 快递深蓝1年前1
快递深蓝1年前1 -
 龙龙五 共回答了15个问题
龙龙五 共回答了15个问题 |采纳率93.3%SO3少量+2NAHSO3=NA2SO4+2SO2+H2O SO3过量+NAHSO3=NAHSO4+SO21年前查看全部
- 1.如何判断酸式盐酸碱性?NaHSO3是酸性的吗?为什么?
1.如何判断酸式盐酸碱性?NaHSO3是酸性的吗?为什么?
2.强碱溶液中 偏铝酸根与碳酸根可以共存吗?为什么?
3.等体积 0.01mol/LNaOH与0.02mol/LHAc混合,离子浓度大小排序?HAc排哪里?...这个溶液是酸性的还是碱性的?怎么判断?..这种混合物离子浓度排序有什么技巧吗?总是搞不清
..还是没解释清楚 等体积 0.01mol/LNaOH与0.02mol/LHAc混合,显酸性碱性?怎么看? lzt8211141年前1
lzt8211141年前1 -
 路北2号 共回答了12个问题
路北2号 共回答了12个问题 |采纳率75%1、具体方法是比较酸式酸根离子的电离常数和水解常数,前者大就显酸性,后者大就显碱性;亚硫酸氢根离子的电离常数>水解常数,所以亚硫酸氢钠溶液显酸性.
2、可以,因为它们之间不反应,与氢氧根离子也不反应.
3、混合以后是醋酸钠和醋酸的等浓度混合溶液,显酸性,因为此时,醋酸的电离强于醋酸根离子的水解【注意,与1不同.具体方法是比较醋酸的电离常数和醋酸根离子的水解常数.】离子浓度排序是这样想的:首先根据溶液显酸性,确定氢离子浓度大于氢氧根离子浓度,再根据电中性,确定醋酸根离子浓度大于钠离子浓度,醋酸分子浓度是这样考虑的:因为溶液显酸性,可以只考虑醋酸的电离,忽略醋酸根离子的水解,在它们不电离、不水解时,它们是等浓度,【也与钠离子等浓度】,发生电离当然就会变小,所以它比醋酸根离子浓度小,也比钠离子浓度小,当然比氢离子浓度大【因为氢离子可以看作是醋酸电离生成的,而电离了的比起剩下的毕竟小得多.】这样一来,离子浓度排序结果是:醋酸根离子浓度>钠离子浓度>醋酸分子浓度>氢离子浓度>氢氧根离子浓度.1年前查看全部
- 如何证明混合物中有NaHSO3和Na2SO3
 mianmian_5221年前2
mianmian_5221年前2 -
 youisfree 共回答了22个问题
youisfree 共回答了22个问题 |采纳率90.9%配成溶液之后加Ca2+看是否有沉淀生成,有的话就有Na2SO31年前查看全部
- 跪求SO2通入Na2SO3 NaHSO3的反应方程式
 zhhx1011年前3
zhhx1011年前3 -
 yzfqh 共回答了13个问题
yzfqh 共回答了13个问题 |采纳率100%H2O+SO2+Na2SO3=2NaHSO31年前查看全部
- 关于电离和水解除了NaHSO3的电离大于水解外还有什么物质电离大于水解?(高中阶段)
 李走走1年前1
李走走1年前1 -
 檬工厂 共回答了23个问题
檬工厂 共回答了23个问题 |采纳率78.3%HSO3负离子组成的一类,HSO4负离子组成的一类,H2PO4负离子组成的一类都是的!
简单点说,就是
两个以上H离子的中强酸或者强酸电离出的负离子与金属阳离子组成的可溶性化合物,其电离都大于水解.
KHSO3、KHSO4、KH2PO4等都是!1年前查看全部
- Na2O2和NaHSO3反应的化学方程式
 cdtv1301年前1
cdtv1301年前1 -
 江小夕 共回答了17个问题
江小夕 共回答了17个问题 |采纳率94.1%当n(Na2O2)/n(NaHSO3)=1/1反应为:Na2O2+NaHSO3=Na2SO4+NaOH.当其n(Na2O2)/n(NaHSO3)=1/2反应为:Na2O2+2NaHSO3=Na2SO4+Na2SO3+H2O1年前查看全部
- Na2SO3与NaHSO3反应的方程式?(在一定条件下反应要产生气泡的方程式)
 含瑛雅兰1年前1
含瑛雅兰1年前1 -
 tianluo 共回答了20个问题
tianluo 共回答了20个问题 |采纳率85%Na2SO3与NaHSO3不反应
Na2CO3与NaHSO3反应,生成CO2,Na2CO3+2NaHSO3=CO2+2Na2SO3+H2O1年前查看全部
- NaHSO3在氯水中先与H离子反应还是先与Cl2反应?为什么?
 蓝色的理想1年前1
蓝色的理想1年前1 -
 我孤单不kk 共回答了12个问题
我孤单不kk 共回答了12个问题 |采纳率91.7%NaHSO3 + CI2 + H2O == NaHSO4 + 2HCI
是和次氯酸反应,被次氯酸氧化,S从+4到+6.1年前查看全部
- 再加一个⑤组,a.S b.SO2 c.H2SO3 d.NaHSO3
再加一个⑤组,a.S b.SO2 c.H2SO3 d.NaHSO3
请写清每步是什么与什么反应;某步不能反应的原因是什么.
4,5
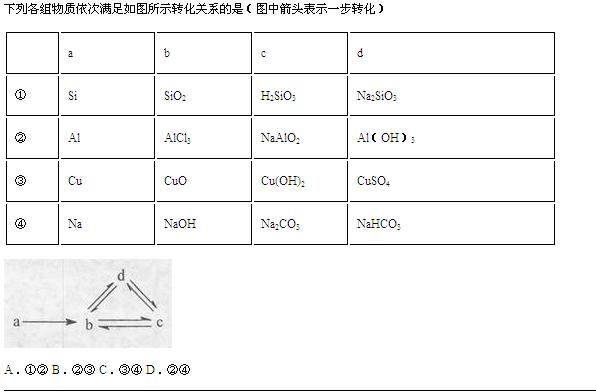
 富丽图1年前3
富丽图1年前3 -
 yun0011 共回答了18个问题
yun0011 共回答了18个问题 |采纳率94.4%1、因为SiO2要想转变为H2SiO3,只能与水反应,但是SiO2不溶于水,所以不行.
2、反应的化学方程式为:
2Al+3Cl2=点燃=2AlCl3
AlCl3+4NaOH=NaAlO2+2H2O+3NaCl
NaAlO2+4HCl=NaCl+AlCl3+2H2O
AlCl3+3NaOH=Al(OH)3↓+3NaCl
Al(OH)3↓+3HCl=AlCl3+3H2O
Al(OH)3+NaOH=NaAlO2+2H2O
NaAlO2+2H2O+CO2=Al(OH)3↓+NaHCO3
3、CuO不能转化为Cu(OH)2因为氧化铜不与水反应,
4、2Na+2H2O=2NaOH+H2↑
2NaOH + CO2 = Na2CO3 + H2O
Ca(OH)2 + Na2CO3 = CaCO3↓+ 2NaOH
Na2CO3+H2O+CO2=2NaHCO3
2NaHCO3=△=Na2CO3+H2O+CO2↑
NaOH + CO2 = NaHCO3
NaHCO3 +NaOH=Na2CO3+H2O
5、 S + O2=点燃= SO2
SO2+H2O=H2SO3
H2SO3=△=SO2↑+H2O
H2SO3 +NaOH=NaHSO3+H2O
2NaHSO3+H2SO4=Na2SO4+2SO2↑+2H2O
NaOH +SO2=NaHSO3
NaHSO3+HCl=NaCl+SO2↑+H2O1年前查看全部
- 化学H2SO3怎么转化为NaHSO3
 爱乐园1年前4
爱乐园1年前4 -
 forint 共回答了27个问题
forint 共回答了27个问题 |采纳率88.9%直接向氢氧化钠溶液里通过量的SO2,但是要防止氧化,可以考虑使用氮气为保护气.1年前查看全部
- 一道大一难度有机推断题.有一化合物A,分子是为C6H12O,可以与羟氨反应,但不与NaHSO3发生加成反应.A催化加氢的
一道大一难度有机推断题.
有一化合物A,分子是为C6H12O,可以与羟氨反应,但不与NaHSO3发生加成反应.A催化加氢的B,分子是为C6H14O,B与浓硫酸加热得C,分子式C6H12.C与臭氧反应后用Zn+H2O处理,得到两个化合物D和E,分子式皆为C3H6O,D可使H2CrO4变绿,E不能.推断A B C D E的结构简式. rennyann1年前2
rennyann1年前2 -
 blackwill1 共回答了20个问题
blackwill1 共回答了20个问题 |采纳率90%A (CH3)2CHCOCH2Ch3
B (CH3)2CHCH(OH)CH2Ch3
C (CH3)2C=CHCH2Ch3
D CH3CH2CHO
E (CH3)2C=O
A与羟氨是生成亚胺,A羰基位组太大不与NaHSO3加成.
H2CrO4不会氧化酮,能把醛氧化成羧酸1年前查看全部
- Na2SO3+SO2+H2O为什么会生成NaHSO3啊?
Na2SO3+SO2+H2O为什么会生成NaHSO3啊?
原理. 卡萁鱼1年前1
卡萁鱼1年前1 -
 凤栖梧 共回答了15个问题
凤栖梧 共回答了15个问题 |采纳率86.7%强酸制弱酸原理
SO2+H2O=H2SO3 是一个酸,NaHSO3可以看作是一个酸,(因为可以电离H离子)酸性比H2SO3弱.
就跟Na2CO3+CO2+H2O=HaCO3的道理一样1年前查看全部
- nahso3和什么气体反应生成na2so4
 adhust1年前2
adhust1年前2 -
 CRESPO_戈多 共回答了21个问题
CRESPO_戈多 共回答了21个问题 |采纳率95.2%这里NaHSO3被氧化,因此需要通入一些氧化性气体,如Cl2
2NaHSO4+2Cl2+2H2O=Na2SO4+H2SO4+4HCl
离子方程式【这个比较可靠,因为溶液中都是离子,最好不写出确定的物质】:
(HSO3 -)+Cl2+H2O=3(H +)+(SO4 2-)+2(Cl -)1年前查看全部
- Na2SO3和什么怎么反应生成NaHSO3?
 zxds1年前1
zxds1年前1 -
 小猪19851986 共回答了21个问题
小猪19851986 共回答了21个问题 |采纳率90.5%Na2SO3+SO2+H2O=2NaHSO31年前查看全部
- NAHSO3溶液加热蒸干得到什么物质
 雨-寒1年前3
雨-寒1年前3 -
 明珑 共回答了18个问题
明珑 共回答了18个问题 |采纳率83.3%Na2SO4
因为2NaHSO3=△=Na2SO3+H2O+SO2 ↑
而生成的Na2SO3在蒸干过程中逐渐被空气中的O2氧化成Na2SO41年前查看全部
- NaHSO3与Ba(NO3)2的反应方程式怎么写?
 王小是1年前1
王小是1年前1 -
 静默凌枫 共回答了14个问题
静默凌枫 共回答了14个问题 |采纳率92.9%2NaHSO3+2Ba(NO3)2=BaSO4+2NaNO3+2NO2+H2O+BaSO31年前查看全部
- NaHSO3溶液各离子浓度大小
 风如此之大1年前4
风如此之大1年前4 -
 loria1 共回答了23个问题
loria1 共回答了23个问题 |采纳率95.7%NaHSO3在水中因为HSO3-水解,溶液呈碱性.
因为NaHSO3是一种强酸弱碱盐,所以其水溶液会因为
HSO3- +H2O=H2SO3+OH-
即HSO3- 水解生成弱酸(难电离出H+),致使溶液中的氢离子减少,而水的离子积不变,所以氢氧根离子增加,溶液呈碱性.
离子浓度大小由大到小:Na+>HSO3->OH->H+1年前查看全部
- NAHSO3和什么气体反应生成NAHSO4
 flyljw1年前2
flyljw1年前2 -
 珠珠zjy 共回答了21个问题
珠珠zjy 共回答了21个问题 |采纳率85.7%2NaHSO3+Cl2+H2O=2NaHSO4+2HCL1年前查看全部
- 吸收SO2用NaHSO3还是Na2SO3/
 我不管1231年前1
我不管1231年前1 -
 yesong841 共回答了18个问题
yesong841 共回答了18个问题 |采纳率94.4%NaHSO31年前查看全部
- 铜与浓硫酸反应产生的白雾是什么?为什么用NaHSO3可以吸收?
 tea1101年前3
tea1101年前3 -
 kiss_shunji 共回答了22个问题
kiss_shunji 共回答了22个问题 |采纳率95.5%铜和浓硫酸会被氧化,生成硫酸铜,二氧化硫和水.白雾应该是二氧化硫和水出来生成的.至于为什么亚硫酸钠可以吸收.我不清楚,我认为这俩东西不能反映= =因为S氧化态一样...没有氧化还原趋势= =1年前查看全部
- NaHSO3怎样生成Na2SO3
 darrenma1年前2
darrenma1年前2 -
 白色星期天 共回答了12个问题
白色星期天 共回答了12个问题 |采纳率100%加入氢氧化钠 NAHSO3+NAOH=NA2SO3+H2O1年前查看全部
- NaHSO3+SO3生成什么
 夏芥1年前2
夏芥1年前2 -
 一试深浅999 共回答了18个问题
一试深浅999 共回答了18个问题 |采纳率88.9%在水溶液中:2NaHSO3+SO3+H2O=Na2SO4+2H2O+2SO2
如果三氧化硫过量,Na2SO4+H2O+SO3=2NaHSO41年前查看全部
- NaHSO3+SO3=?
 宁海沐雨1年前1
宁海沐雨1年前1 -
 guozhou126 共回答了16个问题
guozhou126 共回答了16个问题 |采纳率87.5%SO3+H2O+2NaHSO3=Na2SO4+2SO2+2H2O1年前查看全部
- NaHSO3与Ba(NO3)2反应有沉淀吗
NaHSO3与Ba(NO3)2反应有沉淀吗
能给个准确点的答案吗? xihuan_mm1年前1
xihuan_mm1年前1 -
 mmyy369 共回答了10个问题
mmyy369 共回答了10个问题 |采纳率100%有
HSO3可以电离出少量的H+
而NO3-在酸性环境中就相当于存在硝酸,可以表现出强氧化性,从而将SO32-氧化为SO42-
而SO42-与BA2+相遇,就会得到白色沉淀1年前查看全部
- NaHSO3和NaHCO3溶液的混合方程式
 waswj321年前1
waswj321年前1 -
 绿竹猗猗76 共回答了17个问题
绿竹猗猗76 共回答了17个问题 |采纳率88.2%NaHSO3+NaHCO3=Na2CO3+H2O+SO21年前查看全部
- NAHSO3和NAHCO3的中性混合溶液中,
NAHSO3和NAHCO3的中性混合溶液中,
B.常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:
c(Na+)>c(Cl—)>c(CH3COOH)
到底为什么错? 严雨光1年前2
严雨光1年前2 -
 553647695 共回答了14个问题
553647695 共回答了14个问题 |采纳率85.7%根据电荷守恒,c(Na+)+c(H+)=c(OH—)+c(Cl—)+c(CH3COO—),溶液呈中性c(H+)=c(OH—),所以c(Na+)=c(Cl—)+c(CH3COO—),故c(Na+)>c(Cl—);CH3COONa+HCl=NaCl+CH3COOH,两溶液混合后溶液中的溶质是NaCl,反应生成的CH3COOH与未反应完的CH3COONa,NaCl溶液为中性,CH3COOH=CH3COO—+H+,CH3COO—+H2O=CH3COOH+OH—,溶液为中性,CH3COOH的电离程度等于CH3COONa的水解程度,所以c(Cl—)=c(CH3COOH)1年前查看全部
- 练习:KClO3和NaHSO3间的反应生成Cl-和SO42-离子的速度岁时间的增加先增大后减小,已知反应速率随c(H+)
练习:KClO3和NaHSO3间的反应生成Cl-和SO42-离子的速度岁时间的增加先增大后减小,已知反应速率随c(H+)的增加而加快,试说明 (1)为什么反应开始时,反应速率增大?(2)反应后期速率降低的主要原因是什么?
为什么ClO3根与氢离子结合才能体现ClO3的强氧化性? logosjy1年前1
logosjy1年前1 -
 周-TEX 共回答了16个问题
周-TEX 共回答了16个问题 |采纳率87.5%H+和ClO3-生成HClO3,HClO3是比3强酸酸性还强的强酸,酸体现氧化性.
反应开始时NaHSO3产生H+,H+和ClO3-结合产生强氧化性的HClO3氧化SO32-成SO42-所以反应速率增大.
反应是可逆反应c(SO42-)增大反应速率降低,反应物浓度下降反应速率降低.
我是高3的~这样的题我正在做1年前查看全部
- NaHSO3温度增加PH怎么变HSO3-水解电离都增加,那PH变小还是变大
 w181ng1年前2
w181ng1年前2 -
 追梦rr路 共回答了22个问题
追梦rr路 共回答了22个问题 |采纳率95.5%NaHSO3是电离大于水解,楼上不懂不要乱讲.
既然电离程度较大,那么受温度影响也较大,因此pH要降低.1年前查看全部
- 请问:亚硫酸和NaoH生成NaHSo3为什么是中和反应?不是应该还有水生成的吗?
 lichong05331年前4
lichong05331年前4 -
 lotus_ke 共回答了18个问题
lotus_ke 共回答了18个问题 |采纳率83.3%酸与碱反应就叫中和反应!一般都会有水和盐式根产生
用离子方程式比较好理(H+) + (HSO3-) + ( Na+) + ( oH)- == H20+NaHSO3
如果你学了分子结构式,就会明白为什么的了1年前查看全部
- 怎样除掉CO2中的SO2,除杂剂为什么是NAHSO3不是NAHCO3?
 zcd12341年前1
zcd12341年前1 -
 天使的眼泪jojo 共回答了19个问题
天使的眼泪jojo 共回答了19个问题 |采纳率84.2%除杂剂是NaHCO3;将气体通入饱和NaHCO3溶液中.用饱和NaHCO3溶液除CO2中SO2时,SO2+H2O=H2SO3,H2SO3+2NaHCO3=Na2SO3+H2O+CO2↑,这样不仅利用抑制作用减少了CO2溶解,而且通过化学反应增加了CO2的总量.1年前查看全部
- Na2SO3怎么变成NaHSO3,请写出化学方程式
 gy7423vg1年前2
gy7423vg1年前2 -
 yidongsell 共回答了21个问题
yidongsell 共回答了21个问题 |采纳率90.5%溶液中通入二氧化硫气体,即可
Na2SO3 +SO2+H2O==2NaHSO3
这与碳酸钠如何变成碳酸氢钠是一个原理
希望可以帮到你1年前查看全部
- NaHSO3怎么写物料守恒等式前面的计量数怎么判断的把怎么判断前面的计量数说明白一下
 Alessio1年前1
Alessio1年前1 -
 宾白商务 共回答了16个问题
宾白商务 共回答了16个问题 |采纳率93.8%c(Na+)=c(SO3 2-)+c(HSO3 -)+c(H2SO3)
钠跟硫是一比一的,亚硫酸氢根水解.电离,把硫离子所有可能存在形式全写出来就可以了1年前查看全部
- 求NaHSO3被Br2氧化的化学方程式,
 odyseyxing1年前2
odyseyxing1年前2 -
 ieekroul 共回答了19个问题
ieekroul 共回答了19个问题 |采纳率94.7%2NaHSO3+2Br2+2H2O=Na2SO4+2HBr+H2SO41年前查看全部
- 自然界存在NaIO3,可利用NaIO3与NaHSO3溶液来制取单质碘.反应分两步进行:IO3-+3HSO3-═I-+3S
自然界存在NaIO3,可利用NaIO3与NaHSO3溶液来制取单质碘.反应分两步进行:IO3-+3HSO3-═I-+3SO42-+3H+;IO3-+5I-+6H+═3I2+3H2O.下列说法错误的是( )
A.NaIO3是氧化剂,HSO3-是还原剂
B.生产中可得到副产物H2SO4和Na2SO4
C.I2既是氧化产物又是还原产物
D.HSO3-的还原性比I-弱 今天好热啊1年前1
今天好热啊1年前1 -
 njsf 共回答了20个问题
njsf 共回答了20个问题 |采纳率100%解题思路:在IO3-+3HSO3-═I-+3SO42-+3H+中碘元素的化合价变化为+5价变为-1价,S元素的化合价由+4价变为+6价;IO3-+5I-+6H+═3I2+3H2O中碘元素的化合价由+5价、-1价变为0价,在氧化还原反应中得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂,氧化剂对应的产物是还原产物,还原剂对应的产物是氧化产物,同一自发的氧化还原反应中,还原剂的还原性大于还原产物的还原性.A.在IO3-+3HSO3-═I-+3SO42-+3H+中碘元素的化合价变化为+5价变为-1价,S元素的化合价由+4价变为+6价,所以NaIO3是氧化剂,HSO3-是还原剂,故A正确;
B.该反应中不仅有氧化还原反应,还同时生成可溶性的硫酸和硫酸钠,故B正确;
C.IO3-+5I-+6H+═3I2+3H2O中碘元素的化合价由+5价、-1价变为0价,所以碘既是氧化产物又是还原产物,故C正确;
D.IO3-+3HSO3-═I-+3SO42-+3H+中还原剂是HSO3-,还原产物是I-,同一自发的氧化还原反应中,还原剂的还原性大于还原产物的还原性,所以HSO3-的还原性比I-强,故D错误;
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,明确元素化合价是解本题关键,会根据化合价判断氧化剂、还原剂,难度不大.1年前查看全部
- SO2和NaOH反应时,产物是Na2SO3还是NaHSO3?
 cuizhe30301年前1
cuizhe30301年前1 -
 13875268239 共回答了24个问题
13875268239 共回答了24个问题 |采纳率87.5%当氢氧化钠过量,产物为Na2SO3
当二氧化硫过量,产物为NaHSO3
当二氧化硫介于两者之间,产物两者都有1年前查看全部
- SO2与NaOH溶液的反应问题SO2+2NaOH=Na2SO3+H2OSO2+NaOH=NaHSO3若将标况下0.02m
SO2与NaOH溶液的反应问题
SO2+2NaOH=Na2SO3+H2O
SO2+NaOH=NaHSO3
若将标况下0.02moL的SO2通入100mL 0.3mL/L的NaOH 溶液中
则会发生哪些反应?
得到的产物又分别是哪些?并分别求出其物质的量 半夜三点半1年前1
半夜三点半1年前1 -
 sz星罗棋布 共回答了18个问题
sz星罗棋布 共回答了18个问题 |采纳率100%由题可知 2SO2+3NaOH=Na2SO3+H2O+NaHSO3
0.02 0.03
所以得到的产物又分别是Na2SO3,NaHSO3
;0.01molNa2SO3,0.01molNaHSO31年前查看全部
- NaHSO4+Ca(HCO3)2= NaHSO3+NaHSO4= HAC(醋酸)+Ba(OH)2=
NaHSO4+Ca(HCO3)2= NaHSO3+NaHSO4= HAC(醋酸)+Ba(OH)2=
顺便帮我总结一下写方程式反应物的规律!
急用!
NaHSO4+Ca(HCO3)2=?
NaHSO3+NaHSO4=?
HAC(醋酸)+Ba(OH)2=?
帮我总结一下写方程式反应物的规律! 哈药六厂11年前1
哈药六厂11年前1 -
 蓝色轩冰 共回答了25个问题
蓝色轩冰 共回答了25个问题 |采纳率96%2NaHSO4+Ca(HCO3)2=Na2SO4+CaSO4+2H2O+2C02↑
NaHSO3+NaHSO4=Na2SO4+H2O+SO2↑
HAC(醋酸)+Ba(OH)2=Ba(AC)2+2H20
先多背点方程,然后找规律,因为同一类型离子方程是一样的1年前查看全部
- 已知NaHS、MgSO4、NaHSO3组成的混合物中,硫元素的质量为a%,则混合物中氧元素的质量分数是( )
已知NaHS、MgSO4、NaHSO3组成的混合物中,硫元素的质量为a%,则混合物中氧元素的质量分数是( )
A. a%
B. 2a%
C. (100-1.75a)%
D. (1-0.75a)% ibm5021年前1
ibm5021年前1 -
 tblz07dgy2_8fd 共回答了18个问题
tblz07dgy2_8fd 共回答了18个问题 |采纳率83.3%解题思路:若把混合物看成1,混合物中氧元素的质量分数=1-混合物中硫元素的质量分数-镁元素的质量分数-钠元素的质量分数-氢元素的质量分数;由于Na和H的相对原子质量的和等于Mg的相对原子质量,抛开元素仅从数字的角度来看,“NaH”与Mg相等,所以可以从质量角度将“NaH”视为一个与Mg等效的整体A(即将“NaH”和Mg都换用“A”来表示,可看作其相对原子质量为24).那么,这样处理后混合物就相当于是由AS、ASO4、ASO3组成的了,混合物中氧元素的质量分数=1-混合物中硫元素的质量分数-A元素的质量分数;而此时的混合物中A、S原子个数比为1:1,二者的质量比为24:32;利用硫元素的质量分数可求得A的质量分数,从而计算出混合物中氧元素质量分数.由于Na和H的相对原子质量和等于Mg的相对原子质量,所以可以从质量角度将“NaH”视为一个与Mg等效的整体A(即将“NaH”和Mg都换用“A”来表示,其相对原子质量可作24).
根据A、S质量比为24:32以及硫的质量分数为a%,设A的质量分数为x,则有24:32=x:a%,解之得,混合物中A的质量分数为
3
4a%,
氧的质量分数为1-a%-
3
4a%=1-1.75a%=(100-1.75a)%;
故选C.点评:
本题考点: 元素的质量分数计算;元素质量比的计算.
考点点评: 根据物质组成元素的特点,利用数学的技巧处理复杂的化学计算,是解决此类问题所需要的能力.1年前查看全部
- NaOH+SO2=NaHSO3反应如何产生
 悟生也有涯1年前2
悟生也有涯1年前2 -
 jiyide 共回答了16个问题
jiyide 共回答了16个问题 |采纳率100%SO2过量的总反应式就是这个.
SO2+2NaOH=Na2SO3+H2O
Na2SO3+SO2+H2O=2NaHSO3
两者合并得到NaOH+SO2=NaHSO31年前查看全部
- 已知由NaHS、MgSO4、NaHSO3组成的混合物,硫元素的质量分为a%,则混合物中氧元素的质量分数为( )
已知由NaHS、MgSO4、NaHSO3组成的混合物,硫元素的质量分为a%,则混合物中氧元素的质量分数为( )
A. a%
B. 2a%
C. 1-1.75a%
D. 1-0.75a% 417670531年前1
417670531年前1 -
 甲会员 共回答了17个问题
甲会员 共回答了17个问题 |采纳率94.1%解题思路:NaHS、NaHSO3中“NaH”的总相对原子质量为24,与1个Mg原子的相对原子质量相等,所以可以从质量角度将“NaH”视为一个与Mg等效的整体A(即将“NaH”和Mg都换用“A”来表示,可看作其相对原子质量为24).那么,这样处理后混合物就相当于是由AS、ASO4、ASO3组成的了,而此时的混合物中A、S原子个数比为1:1,二者的质量比为24:32;利用硫元素的质量分数可求得A的质量分数,混合物中氧元素的质量分数=1-混合物中硫元素的质量分数-A元素的质量分数.由于Na和H的相对原子质量和等于Mg的相对原子质量,所以可以从质量角度将“NaH”视为一个与Mg等效的整体A(即将“NaH”和Mg都换用“A”来表示,其相对原子质量可作24),
混合物就相当于是由AS、ASO4、ASO3组成,而此时的混合物中A、S原子个数比为1:1,二者的质量比为24:32=3:4,由于w(S)=a%,故w(A)=[3/4]×a=0.75a%,
氧元素的质量分数=1-a%-0.75a%=1-1.75a%.
故选:C.点评:
本题考点: 元素质量分数的计算.
考点点评: 本题考查质量分数的有关计算,根据物质组成元素的特点,利用数学的技巧进行换元计算,是解决此类问题所需要的能力,难度中等.1年前查看全部
大家在问
- 1服务优良的公交车从中心广场通往城区的各个地方.把这句翻译成英语
- 2It's a Sunday morning.There( )a lot of people in the park.So
- 3is,hoe,your,old,city,)连成句子
- 4—Where is Jack? I haven’t seen him for a long time.
- 5翻译You use simply to emphasize what you are saying.
- 6骆驼和鸽子,同样没有剑拔弩张的样子,它们的眼睛都含着羞怯的光.
- 7图书馆买来300本故事书,比科技书的5分之2多50本,科技书多少本
- 8五二班全体同学的身高情况如下138 143 148 148 150 150 165165 157 157 148 148
- 9丁烷(化学式为C4H10)燃烧时火苗高且亮,即使在白天,200m以外也能清晰可见.下列关于丁烷的叙述不正确的是( )
- 10云层的高度受哪些因素影响?
- 11将下列人物与其称号相连接。1.武圣 ①孟轲2.亚圣 ②陆羽3.茶圣 ③吴道子4.画圣 ④关羽5.
- 12已知a,b互为相反数,c,d互为倒数,求a的(二次方减b的二次方)除以(a的二次方加b的二次方)减cd的平方根,得值.
- 135个5中间符号填什么等于19?
- 14Let's sit down over there and watch the kid ______ a kite.
- 15小明站在地上:1采用什么办法,能迅速地使地面所受压强立即增大到两倍
