在盐湖附近的人们吸管“夏天晒盐,冬天捞碱”.请你解释原因:“夏天晒盐”:“冬天捞碱”:
 花瓣大人2022-10-04 11:39:543条回答
花瓣大人2022-10-04 11:39:543条回答······································

已提交,审核后显示!提交回复
共3条回复
 xy123xyxy 共回答了18个问题
xy123xyxy 共回答了18个问题 |采纳率83.3%- 盐(NaCl)溶解度受温度变化影响较小,要提取,只能把水蒸干结晶.而碱(实际上是Na2SO4/CaSO4),溶解度随温度下降显著降低,冬天很易达到饱和,所以用“捞”的方法即可.
- 1年前
 爱小雪99 共回答了111个问题
爱小雪99 共回答了111个问题 |采纳率- 饱和浓度与温度有关
- 1年前
 烧火煮饭 共回答了2个问题
烧火煮饭 共回答了2个问题 |采纳率- 这是关于初中化学中酸碱盐方面的知识。其实这 跟溶解度方面的知识有关,1。蒸发溶剂2。冷却 热饱和溶液 其实前者无论对于溶解度受温度影响 大的还是小的物质来说都是有效的,那么我们可 以抛开溶解度对分析这道题的束缚来考虑。所以 ,由于蒸发溶剂,会有大量的氯化钠和一些碳酸 钠析出,只不过,析出的氯化钠多与碳酸钠罢了 ,在实际生活中并没有那么多一成不变,很绝对 的事情,所以不必过于叫真2。冬天,则是运用 ...
- 1年前
相关推荐
- 一道数学题目沿湖一周的路长为1920米,甲乙两人在盐湖的路上竞走,两人同时同地出发,反方向行走,甲比乙走的快,12分钟后
一道数学题目
沿湖一周的路长为1920米,甲乙两人在盐湖的路上竞走,两人同时同地出发,反方向行走,甲比乙走的快,12分钟后两人相遇,如果两人每分钟都多走16千米,则相遇地点与前次相差20米.
1.求两人原来的行走速度
2.如果甲乙两人各以原速度同地同时出发,同向而走,则甲在何处第二次追上乙? 云步风歌1年前2
云步风歌1年前2 -
 llll09176 共回答了16个问题
llll09176 共回答了16个问题 |采纳率75%你是不是写错了,"如果两人每分钟都多走 16千米 ",
如果是16米
1.甲每分钟90米,乙每分钟70米
(x+16)*10+20=12x
x=90
1920=(90+乙的速度)*12
2.192分钟后在 起点处,第二次追上乙,
如果是16千米没意义!1年前查看全部
- 生活在盐湖附近的人们习惯“夏天晒盐,冬天捞碱”.请你解释原因:
生活在盐湖附近的人们习惯“夏天晒盐,冬天捞碱”.请你解释原因:
“夏天晒盐” .
“冬天捞碱” . yehao561年前3
yehao561年前3 -
 大头麻雀11 共回答了16个问题
大头麻雀11 共回答了16个问题 |采纳率100%夏天晒盐是将水蒸发后析出得到氯化钠.
而冬天则是由于温度降低导致碳酸钠在水中的溶解度急剧减小而自动析出.1年前查看全部
- 柴达木盆地的四大盐湖分别是?茶卡盐湖为啥是最小的一个了?其他三个分别是?
 love2731年前2
love2731年前2 -
 把墙撞倒 共回答了18个问题
把墙撞倒 共回答了18个问题 |采纳率88.9%1茶卡盐湖、察尔汗盐湖、马海盐湖、昆特依盐湖
2地理位置决定
3重复第一问1年前查看全部
- (2013•南宁三模)I.某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制
(2013•南宁三模)I.某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制取较纯净的氯化钾晶体及液溴,他们设计了如图1流程:
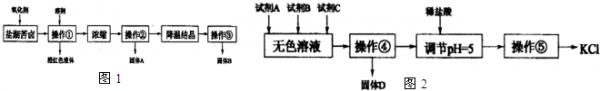
请根据以上流程,回答以下问题:
(1)操作①的名称为萃取、分液萃取、分液,溶剂可以选择:ACAC.A.四氯化碳B.乙醇C.苯D.己烯
(2)操作②要趁热过滤,所得固体A为MgSO4MgSO4(用化学式表示),操作③所得固体B为KClKCl.(用化学式表示)
Ⅱ.某同学提出一种新方案,对上述操作①后无色溶液进行除杂提纯,其方案如图2.
(3)无色溶液中先加试剂A(KOH),再加试剂B(BaCl2)最后加试剂C,若C为常见的盐,则试剂C为K2CO3K2CO3(用化学式表示),固体D的主要成分为Mg(OH)2、BaSO4、BaCO3Mg(OH)2、BaSO4、BaCO3(用化学式表示).
(4)用盐酸调节溶液pH=5的过程中,涉及的离子方程式有,:H++OH-═H2O和2H++CO32-=H2O+CO2↑2H++CO32-=H2O+CO2↑. 三渡1年前1
三渡1年前1 -
 qyh2 共回答了15个问题
qyh2 共回答了15个问题 |采纳率86.7%I.(1)图1流程操作为在盐湖苦卤的浓缩液中加入氧化剂应为氯气,可生成溴,通过萃取、分液的方法分离,利用碘易溶于有机溶剂的性质来进行提取,选择能提取碘的试剂除了对I2有强的溶解能力处,还必须难溶于水,否则不能进行分液分离,符合条件的有四氯化碳、苯,
故答案为:萃取、分液;AC;
(2)硫酸镁在高温下溶解度较小,氯化钾在高温时溶解度大,采用趁热过滤,能除去不溶性杂质硫酸镁,防止氯化钾冷去后析出,然后降温结晶可得氯化钾,
故答案为:MgSO4;KCl;
Ⅱ.(3)操作①后无色溶液含有K+、Mg2+、SO42-、Cl-以及实验的目的是制取较纯净的氯化钾晶体,需先用氢氧化钾除去Mg2+;再用氯化钡除去SO42-,最后再用碳酸钾除去过量的氯化钡,得到的沉淀为氢氧化镁、硫酸钡和碳酸钡,
故答案为:K2CO3;Mg(OH)2、BaSO4、BaCO3;
(3)溶液中含有过量的氢氧根离子、碳酸根离子,所以用盐酸除去过量的氢氧根离子、碳酸根离子,反应的相关离子方程式为H++OH-═H2O、2H++CO32-=H2O+CO2↑,
故答案为:2H++CO32-=H2O+CO2↑.1年前查看全部
- (2011•青岛模拟)某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制取较
(2011•青岛模拟)某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制取较纯净的氯化钾晶体及液溴,他们设计了如下流程:
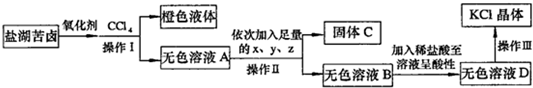
回答以下问题:
(1)操作Ⅰ的名称:______;要从橙色液体中分离出溴,所采取的操作需要的主要玻璃仪器除酒精灯和温度计外,还需要______;
(2)试剂z的化学式为______;检验SO42-已除尽的方法是______;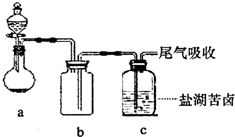
(3)写出操作Ⅲ的具体操作步骤______;
(4)某同学用如右图所示的实验装置制取氧化剂并将其通入盐湖苦卤中,装置b在实验中的作用是______
;若把上述装置中的a、b作为气体的发生、收集装置,装置c可任意改进,则根据下列提供的药品,用这套装置还可以制取的气体是______;若用上述装置中的a、b制取并收集NO,应将装置b如何改进______.
①制NH3:浓氨水和碱石灰 ②制SO2:Cu片和浓硫酸
③制NO:Cu片和稀硝酸 ④制O2:MnO2和双氧水. 帮你做多1年前1
帮你做多1年前1 -
 kec616 共回答了23个问题
kec616 共回答了23个问题 |采纳率95.7%解题思路:(1)操作Ⅰ为互不相溶的液体的分离,应为萃取分液,从橙色液体中分离出溴,应为蒸馏操作,以此判断所需要的仪器;
(2)除去溶液中的Mg2+、SO42-,应分别加入过量的BaCl2、KOH、K2CO3,检验SO42-已除尽,应加入BaCl2溶液,观察是否有沉淀生成;
(3)操作Ⅲ为蒸发操作,从操作要点分析;
(4)制备气体时要防止液体倒吸;根据反应装置不要加热的特点以及气体的收集方法判断还可制备的气体,根据NO的性质选择收集方法.(1)氧化剂应为氯气,通入氯气发生:Cl2+2Br-=2Cl-+Br2,加入CCl4,溴易溶于CCl4,溶液分层,用萃取、分液的方法分离;由于溴和CCl4的沸点不同,可用蒸馏的方法分离,蒸馏时用到的仪器有酒精灯、温度计、蒸馏烧瓶、冷凝管、牛角管、锥形瓶等,
故答案为:萃取、分液;蒸馏烧瓶、冷凝管、牛角管、锥形瓶;
(2)除去溶液中的Mg2+、SO42-,应分别加入过量的BaCl2、KOH、K2CO3,类似于粗盐的提纯,加入过量BaCl2可除去SO42-,
加入过量KOH溶液可除去Mg2+,最后加入K2CO3可除去BaCl2,检验SO42-已除尽的方法是取无色溶液D,加入BaCl2溶液,若没有白色沉淀,则SO42-已除尽,
故答案为:K2CO3;取无色溶液D,加入BaCl2溶液,若没有白色沉淀,则SO42-已除尽;
(3)操作Ⅲ为蒸发操作,,蒸发时将溶液倒入蒸发皿中并置于三脚架上;加热并用玻璃棒不断搅拌蒸发皿中的液体,直到出现较多晶体时,停止加热,注意不能直接蒸干,
故答案为:将溶液倒入蒸发皿中并置于三脚架上;加热并用玻璃棒不断搅拌蒸发皿中的液体,直到出现较多晶体时,停止加热;
(4)制备气体时要防止液体倒吸,b的作用为安全瓶,起到防止倒吸作用,由装置图可知,制备气体时不需要加热,并且生成的气体用向下排空气法收集,气体的密度比空气的小,只有氨气符合;NO只能用排水法收集,则b中应装满水.
故答案为:安全瓶;①;将b中装满水.点评:
本题考点: 氯、溴、碘及其化合物的综合应用;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查较为综合,涉及物质的制备和分离、物质的检验、蒸发以及气体的制备、收集等问题,本题难度中等,学习中注意相关基础知识的积累.1年前查看全部
- 我国北方某盐湖生产的纯碱(Na2CO3)产品中常含有少量的氯化钠.为测该产品中碳酸钠的质量分数,现称取6克样品放在烧杯中
 我国北方某盐湖生产的纯碱(Na2CO3)产品中常含有少量的氯化钠.为测该产品中碳酸钠的质量分数,现称取6克样品放在烧杯中并滴加稀盐酸.当盐酸滴加至36.5克时,烧杯内溶液的总质量为40.3克,产生的气体质量与滴入稀盐酸的质量关系如下图所示.计算:
我国北方某盐湖生产的纯碱(Na2CO3)产品中常含有少量的氯化钠.为测该产品中碳酸钠的质量分数,现称取6克样品放在烧杯中并滴加稀盐酸.当盐酸滴加至36.5克时,烧杯内溶液的总质量为40.3克,产生的气体质量与滴入稀盐酸的质量关系如下图所示.计算:
(1)试样中碳酸钠的质量分数
(2)所用稀盐酸中溶质的质量分数. sxcjp1年前1
sxcjp1年前1 -
 宕瓴 共回答了10个问题
宕瓴 共回答了10个问题 |采纳率100%解题思路:根据图中信息判断生成二氧化碳的质量,根据化学方程式可以计算碳酸钠的质量分数以及所用盐酸的溶质质量分数.其中加入36.5克稀盐酸时,反应已经结束.再加入稀盐酸时,反应不再进行.产生二氧化碳气体的质量为:2.2g.
(1)设纯碱试样中碳酸钠的质量为x,36.5g稀盐酸中溶质质量为y.
Na2CO3+2HCl=2NaCl+H2O+CO2↑
1067344
xy 2.2g
[106/44=
x
2.2g]
x=5.3g
[73/44=
y
2.2g]
y=3.65g
试样中碳酸钠的质量分数为:
5.3g
6g×100%≈88.3%
(2)所用盐酸的溶质质量分数=
3.65g
36.5g×100%=10%
答案:
(1)试样中碳酸钠的质量分数为88.3%
(2)所用盐酸的溶质质量分数10%点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 本题主要考查了视图问题和根据化学方程式进行相关方面计算的内容.1年前查看全部
- 生活在盐湖附近的人们习惯“夏天晒盐,冬天捞碱”.请你解释原因.
 雅越如水1年前2
雅越如水1年前2 -
 串味的爱情气息 共回答了13个问题
串味的爱情气息 共回答了13个问题 |采纳率100%盐(NaCl)溶解度受温度变化影响较小,要提取,只能把水蒸干结晶.而碱(实际上是Na2SO4/CaSO4),溶解度随温度下降显著降低,冬天很易达到饱和,所以用“捞”的方法即可.1年前查看全部
- .我国北方地区有一些盐湖,当地农民采用冬天挥碱(Na2CO3),夏天晒盐( NaCl)的作法,得到纯碱和食盐,
 0095331年前1
0095331年前1 -
 zhaoyishan003 共回答了16个问题
zhaoyishan003 共回答了16个问题 |采纳率93.8%冬天挥碱:由于蒸发溶剂,会有大量的氯化钠和一些碳酸钠析出,Na2CO3的溶解度在温度低的情况下(冬天)较小,所以析出的物质大部分是碳酸钠.
夏天晒盐:由于冷却热饱和溶液,碳酸钠溶解度受温度影响较大,而氯化钠受温度影响不大,所以析出的物质大部分是碳酸钠.
因此冬天挥碱(Na2CO3),夏天晒盐( NaCl)1年前查看全部
- (2013•南宁三模)I.某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制
(2013•南宁三模)I.某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制取较纯净的氯化钾晶体及液溴,他们设计了如图1流程:
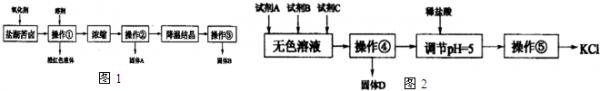
请根据以上流程,回答以下问题:
(1)操作①的名称为______,溶剂可以选择:______.A.四氯化碳B.乙醇C.苯D.己烯
(2)操作②要趁热过滤,所得固体A为______(用化学式表示),操作③所得固体B为______.(用化学式表示)
Ⅱ.某同学提出一种新方案,对上述操作①后无色溶液进行除杂提纯,其方案如图2.
(3)无色溶液中先加试剂A(KOH),再加试剂B(BaCl2)最后加试剂C,若C为常见的盐,则试剂C为______(用化学式表示),固体D的主要成分为______(用化学式表示).
(4)用盐酸调节溶液pH=5的过程中,涉及的离子方程式有,:H++OH-═H2O和______. 掌外1年前1
掌外1年前1 -
 蚂蚁伐大树 共回答了23个问题
蚂蚁伐大树 共回答了23个问题 |采纳率91.3%解题思路:I.图1流程操作为在盐湖苦卤的浓缩液中加入氧化剂应为氯气,可生成溴,通过萃取、分液的方法分离,浓缩后得到硫酸镁和氯化钾的混合液,经重结晶可得硫酸镁,过滤得到氯化钾溶液,经降温结晶,过滤可得到氯化钾;
Ⅱ.对上述操作①后无色溶液含有K+、Mg2+、SO42-、Cl-等离子,无色溶液中先加试剂A(KOH),以除去Mg2+,再加试剂B(BaCl2)以除去SO42-,最后加试剂K2CO3,可除去过量的钡离子,过滤可得到Mg(OH)2、BaSO4沉淀以及少量BaCO3沉淀,然后加入盐酸可除去过量的氢氧化钾和碳酸钾,经蒸发、浓缩、冷却结晶可得到氯化钾.I.(1)图1流程操作为在盐湖苦卤的浓缩液中加入氧化剂应为氯气,可生成溴,通过萃取、分液的方法分离,利用碘易溶于有机溶剂的性质来进行提取,选择能提取碘的试剂除了对I2有强的溶解能力处,还必须难溶于水,否则不能进行分液分离,符合条件的有四氯化碳、苯,
故答案为:萃取、分液;AC;
(2)硫酸镁在高温下溶解度较小,氯化钾在高温时溶解度大,采用趁热过滤,能除去不溶性杂质硫酸镁,防止氯化钾冷去后析出,然后降温结晶可得氯化钾,
故答案为:MgSO4;KCl;
Ⅱ.(3)操作①后无色溶液含有K+、Mg2+、SO42-、Cl-以及实验的目的是制取较纯净的氯化钾晶体,需先用氢氧化钾除去Mg2+;再用氯化钡除去SO42-,最后再用碳酸钾除去过量的氯化钡,得到的沉淀为氢氧化镁、硫酸钡和碳酸钡,
故答案为:K2CO3;Mg(OH)2、BaSO4、BaCO3;
(3)溶液中含有过量的氢氧根离子、碳酸根离子,所以用盐酸除去过量的氢氧根离子、碳酸根离子,反应的相关离子方程式为H++OH-═H2O、2H++CO32-=H2O+CO2↑,
故答案为:2H++CO32-=H2O+CO2↑.点评:
本题考点: 氯、溴、碘及其化合物的综合应用;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题综合考查物质的制备、分离和提纯的实验设计和评价,侧重于学生的分析能力和实验能力的考查,为高考常见题型和高频考点,注意把握物质的分离、提纯原理,根据实验流程解答该题,答题时要注意审题,把握实验的目的和原理.1年前查看全部
- 英语翻译帮我翻译一下:地球表面的最低点是死海.那里的水面平均低于海平面约400米.死海是一个内陆盐湖,位于以色列和约旦之
英语翻译
帮我翻译一下:
地球表面的最低点是死海.那里的水面平均低于海平面约400米.死海是一个内陆盐湖,位于以色列和约旦之间的约旦谷地.西岸为犹太山地,东岸为外约旦高原.约旦河从北注入.死海长80公里,宽处为18公里,表面积约1020平方公里,最深处400米.死海位于约旦-死海地沟的最低部,是东非大裂谷的北部延续部分.这是一块下沉的地壳,夹在两个平行的地质断层崖之间.死海位于沙漠中,降雨极少且不规则.利桑半岛年降雨量为65毫米.冬季气候温暖,夏季炎热.湖水年蒸发量平均为1400毫米,因此湖面往往形成浓雾.湖面水位有季节性变化,在30至60厘米之间.死海水含盐量极高,且越到湖底越高.最深处有湖水已经化石化(一般海水含盐量为千分之35,而死海的含盐量在千分之230至250左右.表层水中的的盐分每公升达227至275克,深层水中达327克.).由于盐水浓度高,游泳者极易浮起.湖中除细菌外没有其他动植物.涨潮时从约旦河或其他小河中游来的鱼立即死亡.岸边植物也主要是适应盐碱地的盐生植物.死海是很大的盐储藏地.死海湖岸荒芜,固定居民点很少,偶见小片耕地和疗养地等.
(注:要英文的)! utkjhsdk1年前2
utkjhsdk1年前2 -
 雪桃 共回答了10个问题
雪桃 共回答了10个问题 |采纳率90%The Earth surface of a little bit lowest is Dead Sea.The yonder surface is average low is about 400 meters in the sea level.BE an inland salt lake Dead Sea, locate Israel and Jordan it the Jordan valley of.The west coast is a Judean mountainous country, east coast is the outside Jordan plateau.Jordan the river infuses into from the north.Grow 80 kilometers Dead Sea, the breadth is 18 kilometers, the surface accumulates about 1020 square kilometers, the most deep place is 400 meters.Locate Jordan Dead Sea-Dead Sea the lowest department of the ditch is the north in the not- big 裂 valley of the east to continue part.This is the earth crust that a cake of descends to sink, clipping in two parallel geologies to break of the layer precipice.Locate Dead Sea in the desert, rain rarely and anomaly.The benefit mulberry peninsula year rainfall is 65.The weather is warm in winter, blazing hot in summer.The lake water the year evaporate quantity average is 1400 millimeter, so the lake noodles usually becomes heavy mist.Noodles water level in lake contain the seasonal variety between 30-60 the 厘 rices.Dead Sea the water salinity is very high, and arrives the lake bottom more more high.The deep place has the lake water already fossilization(the general sea water salinity is 35/1000, but Dead Sea of the salinity is about 230-250/1000.Surface layer aquatic salt the each liter reach to 227-275 grams, reaching to 327 grams in the deep water.).Because density in brine is high, the swimmer floats easiest.In the lake in addition to germ have no other move a plant.Rise tide swim from the Jordan the river or other brooks of the fish dies immediately.The near the bank plant also mainly is the salt that adapts the salt such soil to living a plant.It is a very big salt to store ground Dead Sea.Dead Sea the lake shore is shabby, fixing residents to order seldom, see the crumb farmland accidentally with recuperate a ground of etc..1年前查看全部
- (2008•梅州)我国北方有许多盐湖,湖水中溶有大量的Na2CO3和NaCl,那里的人们冬天捞碱(Na2CO3),夏天晒
 (2008•梅州)我国北方有许多盐湖,湖水中溶有大量的Na2CO3和NaCl,那里的人们冬天捞碱(Na2CO3),夏天晒盐(NaCl).Na2CO3和NaCl的溶解度曲线如下图所示,据图回答下列问题:
(2008•梅州)我国北方有许多盐湖,湖水中溶有大量的Na2CO3和NaCl,那里的人们冬天捞碱(Na2CO3),夏天晒盐(NaCl).Na2CO3和NaCl的溶解度曲线如下图所示,据图回答下列问题:
(1)t1℃时,溶解度较大的物质是______.
(2)等质量Na2CO3、NaCl饱和溶液分别从t2℃降温到t1℃,析出晶体较多的是______.
(3)冬天捞碱的原因是由于Na2CO3的溶解度随温度降低而______(填“增大”、“减小”或“不变”).
(4)夏天晒盐是利用______(填序号)的方法,使NaCl晶体析出.
①升高温度,使NaCl溶解度增大 ②风吹日晒.使溶剂蒸发. bestping1年前1
bestping1年前1 -
 goldmon 共回答了16个问题
goldmon 共回答了16个问题 |采纳率100%解题思路:根据固体物质的溶解度曲线可以:①比较不同的物质在同一温度下的溶解度的大小,②判断物质的溶解度随温度变化的变化情况,从而判断等质量的饱和溶液降温时析出的晶体的多少,或判断通过降温还是蒸发溶剂的方法使溶质从溶液中结晶析出等.(1)由两物质的溶解度曲线不难看出,在t1℃时,氯化钠的溶解度大于碳酸钠的溶解度,故答案为:NaCl
(2)由于氯化钠和碳酸钠的溶解度都随温度的升高而增大,但碳酸钠的溶解度受温度的影响较大,因此把等质量Na2CO3、NaCl饱和溶液分别从t2℃降温到t1℃,析出晶体较多的是碳酸钠,故答案为:碳酸钠
(3)冬天捞碱说明温度降低时,该物质的溶解度减小,故答案为:减小
(4)由于氯化钠的溶解度受温度的影响很小,因此若想使氯化钠从溶液中结晶析出,主要采取蒸发溶剂的方法,故答案为:②点评:
本题考点: 固体溶解度曲线及其作用;结晶的原理、方法及其应用;晶体和结晶的概念与现象.
考点点评: 本题难度不是很大,主要考查了根据固体物质的溶解度曲线解决相关的问题,加强学生对固体溶解度的理解.1年前查看全部
- 已知一盐湖中生活着各种细菌和嗜盐古菌,请设计方案从中快速分离培养分解蛋白质的嗜盐古菌.
 在小爱1年前1
在小爱1年前1 -
 fisher1112 共回答了16个问题
fisher1112 共回答了16个问题 |采纳率93.8%具体的你自己写写吧,我只给你基本思路
首先要把其他细菌去除,方法是向取来的水样品种中加入适量的盐,(记得要保证充足的营养)然后得到嗜盐古菌
第二步,不给这些细菌提供营养,只是加一些蛋白质,最后能存活下来的细菌便是分解蛋白质的嗜盐古菌1年前查看全部
- (2009•道外区一模)在内蒙古盐湖中含有的溶质主要是Na2CO3和NaCl,其溶解度曲线如图所示,据此下列说法不正确的
(2009•道外区一模)在内蒙古盐湖中含有的溶质主要是Na2CO3和NaCl,其溶解度曲线如图所示,据此下列说法不正确的是( )

A.Na2CO3和NaCl是易溶性物质
B.夏天时(30℃),水分蒸发.析出的晶体是NaCl
C.冬天时析出的Na2CO3•10H2O中一定不含有NaCl
D.NaCl溶饵度曲线受温度的影响变化不大 wangbox1年前1
wangbox1年前1 -
 liujie766 共回答了22个问题
liujie766 共回答了22个问题 |采纳率86.4%A、因为室温(20℃)时,溶解度大于10克的属于易溶物质,由图可知,Na2CO3和NaCl是易溶性物质,说法正确,故A正确;
B、夏天时(30℃),水分蒸发.不易形成碳酸钠的饱和溶液,所以析出的晶体是NaCl,说法正确,故B正确;
C、冬天温度低,碳酸钠溶解度小易析出,但是氯化钠也会随着碳酸钠析出一小部分;冬天时析出的Na2CO3•10H2O中一定不含有NaCl,说法错误,仍含有一定的氯化钠,故C错误;
D、NaCl溶解度曲线受温度的影响变化不大,说法正确,故D正确.
故选C.1年前查看全部
- (2010•延庆县二模)我国北方某盐湖生产的纯碱(Na2CO3)产品中常含有少量的氯化钠(其它杂质忽略不计).为测定该产
 (2010•延庆县二模)我国北方某盐湖生产的纯碱(Na2CO3)产品中常含有少量的氯化钠(其它杂质忽略不计).为测定该产品中碳酸钠的质量分数,现称取6g试样放在烧杯中并滴入稀盐酸.当盐酸滴加至36.5g时,烧杯内溶液的总质量为40.3g,(假设产生的气体全部逸出),产生气体的质量与滴入稀盐酸的质量关系如图所示.试计算:
(2010•延庆县二模)我国北方某盐湖生产的纯碱(Na2CO3)产品中常含有少量的氯化钠(其它杂质忽略不计).为测定该产品中碳酸钠的质量分数,现称取6g试样放在烧杯中并滴入稀盐酸.当盐酸滴加至36.5g时,烧杯内溶液的总质量为40.3g,(假设产生的气体全部逸出),产生气体的质量与滴入稀盐酸的质量关系如图所示.试计算:
(1)A点产生气体的质量m=______.
(2)试样中碳酸钠的质量分数(结果精确至0.1%).
(3)B点时,烧杯内溶液中的溶质是______(写出化学式). CD-sky1年前1
CD-sky1年前1 -
 liuxiaoning1 共回答了15个问题
liuxiaoning1 共回答了15个问题 |采纳率80%解题思路:(1)根据产生气体的质量与滴入稀盐酸的质量关系图,A点时碳酸钠与盐酸恰好完全反应,之后再加稀盐酸为过量不再发生反应,因此,根据质量守恒定律,利用最终烧杯内溶液总质量与反应前所加各物质总质量的差值,可求得放出二氧化碳质量;
(2)根据反应的化学方程式,由恰好完全反应放出二氧化碳的质量,可计算样品中所含有碳酸钠的质量,该质量与样品质量比可计算试样中碳酸钠的质量分数;
(3)至A点恰好完全反应后,所加稀盐酸过量就不再发生反应,因此,至B点时因盐酸过量,所得溶液为氯化钠和稀盐酸的混合溶液.(1)根据质量守恒定律,A点产生气体的质量=36.5g+6g-40.3g=2.2g;
故答案为:2.2g;
(2)设样品中碳酸钠的质量为x
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
x 2.2g
[106/x]=[44/2.2g] x=5.3g
试样中碳酸钠的质量分数=[5.3g/6g]×100%=88.3%
答:试样中碳酸钠的质量分数为88.3%;
(3)B点时所加稀盐酸过量,所得溶液为氯化钠与稀盐酸的混合溶液,其中溶质为NaCl、HCl;
故答案为:NaCl、HCl.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 分析表示反应规律的曲线时,曲线的折点即图中A点为恰好完全反应,此后所加稀盐酸过量,不再发生反应.1年前查看全部
- 通过晾晒海水或煮盐井水、盐湖水等方法,均可得到含有较多杂质的粗盐,这种方法属于_______变化(填“物理”或“化学”)
通过晾晒海水或煮盐井水、盐湖水等方法,均可得到含有较多杂质的粗盐,这种方法属于_______变化(填“物理”或“化学”).现有少量含泥沙的粗盐.经过①______、②过滤、③______等操作可得到初步提纯,再通过化学方法获得精盐.某同学想用得到的3克精盐和20mL蒸馏水配制氯化钠溶液,请你参与完成下列问题:
(1)称量精盐:称量时氯化钠应放在______(填“左”或“右”)盘.
(2)溶解:用量筒来量取所需的水(水的密度为1g/cm3),量筒的规格是______(从下列中选用:10mL、25mL、50mL).量取液体时,量筒必须放平,视线与液体的______保持水平.以上三步操作均要用到______(填仪器名称),其作用分别是______,______,______.
(3)操作②时该同学发现滤液仍浑浊,可能原因之一是:______
(4)反思:若量取蒸馏水时该生是仰视读数,你认为他实际量取水的量会______(填“偏大”、“偏小”或“无影响”). jessicashen18181年前1
jessicashen18181年前1 -
 jingke12345 共回答了16个问题
jingke12345 共回答了16个问题 |采纳率81.3%解题思路:根据物理变化与化学变化的特点和区别,主要看这些变化过程是否有新的物质产生;根据粗盐提纯的过程解答即可;
(1)根据“左物右码”的原则分析;
(2)根据尽量减少误差分析选用的量筒;用量筒量取液体时,视线与凹液面的最低处保存水平;溶解、过滤、蒸发都要用到玻璃棒;
(3)接滤液的烧杯不干净、滤纸破损、液面高于滤纸边缘等都会造成滤液浑浊;
(4)仰视读量筒内液体体积,读数比实际液体体积小;俯视读数液体体积比实际偏大.有新的物质产生的变化是化学变化,没有新的物质产生的变化是物理变化.晾晒海水或煮盐井水、盐湖水只是蒸发掉其中的水分,并没有生成新的物质,故属于物理变化;粗盐提纯的过程为:溶解、过滤、蒸发.
(1)称量精盐:称量时氯化钠应放在左盘;
(2)量取20mL蒸馏水要用25mL的量筒;量取液体时,量筒必须放平,视线与液体的凹液面的最低处保持水平;溶解中玻璃棒的作用是搅拌,可以加速溶解;过滤中玻璃棒的作用是引流,为防止液体直接倒入而冲破滤纸,在向漏斗内倒入液体时,应使液体沿玻璃棒慢慢流入,这一作用简称为“引流”;
蒸发时用到玻璃棒,作用是搅拌,目的是使液体受热均匀,防止局部过热,引起液体飞溅;
(3)接滤液的烧杯不干净、滤纸破损、液面高于滤纸边缘等都会造成滤液浑浊;
(4)仰视读量筒内液体体积,读数比实际液体体积小;俯视读数液体体积比实际偏大;所以仰视结果量取水的实际体积偏大.
故答案为:物理;溶解;蒸发.
(1)左.
(2)25mL;凹液面的最低处;玻璃棒;搅拌;引流;搅拌.
(3)滤纸破损.
(4)偏大.点评:
本题考点: 氯化钠与粗盐提纯;实验数据处理或者误差分析的探究;混合物的分离方法;过滤的原理、方法及其应用.
考点点评: 了解物理变化和化学变化的区别;粗盐提纯的步骤方法;量筒的使用.量筒的使用是中考热之一,量筒操作错误时会出现“俯大仰小”,即俯视读数,数值比实际体积大,反之,则小.1年前查看全部
- 通过晾晒海水或煮盐井水、盐湖水等方法,均可得到含有较多杂质的粗盐,这种方法属于_______变化(填“物理”或“化学”)
通过晾晒海水或煮盐井水、盐湖水等方法,均可得到含有较多杂质的粗盐,这种方法属于_______变化(填“物理”或“化学”).现有少量含泥沙的粗盐.经过①______、②过滤、③______等操作可得到初步提纯,再通过化学方法获得精盐.某同学想用得到的3克精盐和20mL蒸馏水配制氯化钠溶液,请你参与完成下列问题:
(1)称量精盐:称量时氯化钠应放在______(填“左”或“右”)盘.
(2)溶用量筒来量取所需的水(水的密度为1g/cm 3 ),量筒的规格是______(从下列中选用:10mL、25mL、50mL).量取液体时,量筒必须放平,视线与液体的______保持水平.以上三步操作均要用到______(填仪器名称),其作用分别是______,______,______.
(3)操作②时该同学发现滤液仍浑浊,可能原因之一是:______
(4)反思:若量取蒸馏水时该生是仰视读数,你认为他实际量取水的量会______(填“偏大”、“偏小”或“无影响”). arthur2861年前1
arthur2861年前1 -
 丫米 共回答了12个问题
丫米 共回答了12个问题 |采纳率66.7%有新的物质产生的变化是化学变化,没有新的物质产生的变化是物理变化.晾晒海水或煮盐井水、盐湖水只是蒸发掉其中的水分,并没有生成新的物质,故属于物理变化;粗盐提纯的过程为:溶解、过滤、蒸发.
(1)称量精盐:称量时氯化钠应放在左盘;
(2)量取20mL蒸馏水要用25mL的量筒;量取液体时,量筒必须放平,视线与液体的凹液面的最低处保持水平;溶解、过滤、蒸发都要用到玻璃棒,作用分别是搅拌、引流、搅拌;
(3)接滤液的烧杯不干净、滤纸破损、液面高于滤纸边缘等都会造成滤液浑浊;
(4)仰视读量筒内液体体积,读数比实际液体体积小;俯视读数液体体积比实际偏大;所以仰视结果量取水的实际体积偏大.
故答案为:物理;溶解;蒸发.
(1)左.
(2)25mL;凹液面的最低处;玻璃棒;搅拌;引流;搅拌.
(3)滤纸破损.
(4)偏大.1年前查看全部
- (2005•内蒙古)内蒙古某盐湖生产的口碱中含有碳酸钠,另外还含有氯化钠和硫酸钠.请你通过化学实验证明口碱溶液中确实含有
(2005•内蒙古)内蒙古某盐湖生产的口碱中含有碳酸钠,另外还含有氯化钠和硫酸钠.请你通过化学实验证明口碱溶液中确实含有Cl-和SO42-
实验步骤 实验现象 实验目的 (1)取少量口碱溶液放入试管中,加入过量的______ ______ ______ (2)______ ______ ______ (3)______ ______ ______  ai菊花1年前1
ai菊花1年前1 -
 stefayzi 共回答了15个问题
stefayzi 共回答了15个问题 |采纳率73.3%解题思路:根据检验氯离子和硫酸根离子的方法,可以知道必须先排除碳酸根离子的干扰,在这里为了防止干扰实验结论,在去除碳酸根离子时不能选择盐酸和硫酸,可以据此作答.检验氯离子常用硝酸银溶液,检验硫酸根离子常用氯化钡或是硝酸钡溶液,而硫酸根离子能够和氯离子产生微溶物,所以为了防止干扰实验,我们应该先检验硫酸根离子,如果用氯化钡则会引入氯离子,故用硝酸钡溶液来检验,然后再加硝酸银来检验氯离子,由于碳酸根能够和硝酸银和硝酸钡反应生成沉淀,故必须先用过量的硝酸来酸化溶液,除去碳酸根离子.
故答案为:
实验步骤 实验现象 实验目的
(1)取少量口碱溶液放入试管中,加入过量的稀硝酸 产生大量的气泡 除去碳酸根离子,防止干扰实验现象和结论
(2)向(1)所得溶液中加入过量的硝酸钡溶液 产生白色沉淀 验证硫酸根离子的存在
(3)将(2)所得溶液过滤,然后向滤液中加入适量的硝酸银溶液 产生白色沉淀 验证氯离子的存在点评:
本题考点: 证明盐酸和可溶性盐酸盐;化学实验方案设计与评价;证明硫酸和可溶性硫酸盐.
考点点评: 熟练掌握碳酸根离子、氯离子和硫酸根离子的检验方法,在检验氯离子和硫酸根离子时为了防止碳酸根离子的干扰,必须先用硝酸对溶液进行酸化.1年前查看全部
- (2009•道外区一模)在内蒙古盐湖中含有的溶质主要是Na2CO3和NaCl,其溶解度曲线如图所示,据此下列说法不正确的
(2009•道外区一模)在内蒙古盐湖中含有的溶质主要是Na2CO3和NaCl,其溶解度曲线如图所示,据此下列说法不正确的是( )

A.Na2CO3和NaCl是易溶性物质
B.夏天时(30℃),水分蒸发.析出的晶体是NaCl
C.冬天时析出的Na2CO3•10H2O中一定不含有NaCl
D.NaCl溶饵度曲线受温度的影响变化不大 o远在天边o1年前1
o远在天边o1年前1 -
 liuyuliang68 共回答了19个问题
liuyuliang68 共回答了19个问题 |采纳率94.7%A、因为室温(20℃)时,溶解度大于10克的属于易溶物质,由图可知,Na2CO3和NaCl是易溶性物质,说法正确,故A正确;
B、夏天时(30℃),水分蒸发.不易形成碳酸钠的饱和溶液,所以析出的晶体是NaCl,说法正确,故B正确;
C、冬天温度低,碳酸钠溶解度小易析出,但是氯化钠也会随着碳酸钠析出一小部分;冬天时析出的Na2CO3•10H2O中一定不含有NaCl,说法错误,仍含有一定的氯化钠,故C错误;
D、NaCl溶解度曲线受温度的影响变化不大,说法正确,故D正确.
故选C.1年前查看全部
- (2007•山西)我国北方有许多盐湖,湖水中溶有大量的碳酸钠和氯化钠,那里的农民冬天捞碱(碳酸钠),夏天晒盐(氯化钠).
 (2007•山西)我国北方有许多盐湖,湖水中溶有大量的碳酸钠和氯化钠,那里的农民冬天捞碱(碳酸钠),夏天晒盐(氯化钠).
(2007•山西)我国北方有许多盐湖,湖水中溶有大量的碳酸钠和氯化钠,那里的农民冬天捞碱(碳酸钠),夏天晒盐(氯化钠).
(1)右图是碳酸钠和氯化钠在不同温度下的溶解度曲线,其中表示碳酸钠溶解度曲线的是______
(2)从湖水中得到的碳酸钠中常含有少量的氯化钠,可以用的方法得到较纯净的碳酸钠______.
(3)20℃时,两物质的溶解度大小关系为A______B. smsjx1年前1
smsjx1年前1 -
 wxcwxcxjl1 共回答了15个问题
wxcwxcxjl1 共回答了15个问题 |采纳率86.7%解题思路:(1)根据溶解度受温度影响较大时采取降温结晶获得晶体、受温度影响不大时采取蒸发结晶,由获得氯化钠与碳酸钠的方法,判断两物质溶解度与温度的关系判断溶解度曲线;
(2)根据两物质溶解度曲线,判断两物质的溶解度随着温度的变化而变化的情况,选择分离混合物的方法;
(3)根据溶解度曲线可以比较相同温度时(或一定温度范围内)不同物质溶解度的大小,利用图示的曲线,比较20℃时两物质的溶解度大小.(1)根据冬天捞碱(碳酸钠)夏天晒盐(氯化钠)可知,碳酸钠的溶解度受温度影响较大,因此,曲线②表示碳酸钠溶解度曲线;(2)由于氯化钠的溶解度受温度影响不大,而碳酸钠的溶解度受温度影响较大,因此,从碳酸钠...
点评:
本题考点: 固体溶解度曲线及其作用;结晶的原理、方法及其应用.
考点点评: 根据溶解度曲线,可以看出物质的溶解度随着温度的变化而变化的情况,可以比较在一定温度范围内的物质的溶解度大小,可以判断某温度下物质的溶解度.1年前查看全部
- 现有一块北方盐湖结晶出的白色晶体
现有一块北方盐湖结晶出的白色晶体
可能含有碳酸钠,硫酸钠,氯化钠中的一种或几种.为了证明其成分,加入试剂的正确顺序是:1.加水溶解2.假如足量的硝酸钡溶液.3.加入足量的硝酸.4.加入硝酸银溶液.
答案1324.
我觉得1423好像..
为什么按他的那个顺序... Bacchus781年前4
Bacchus781年前4 -
 tiger_008 共回答了20个问题
tiger_008 共回答了20个问题 |采纳率95%1.加水溶解
----制成溶液
3.加入足量的硝酸
----有气体生成证明有碳酸钠
2.假如足量的硝酸钡溶液.
----有沉淀 生成证明有硫酸钠
4.加入硝酸银溶液.
---有沉淀 生成证明有氯化钠
注意:
----加硫酸钡或硝酸银之前先加硝酸,排除碳酸根离子,故第3在第24之前.
----硝酸银可以和氯化钠反应生成沉淀,也可和硫酸钠反应生成硫酸银沉淀,硫酸银微溶于水,故在加硝酸银之前先加硝酸钡检验出硫酸钠,故第2必须在第4之前.1年前查看全部
- 二 火车行驶在盐湖上(27分)①乘坐在青藏铁路的列车上,可以亲身体验火车在辽阔的盐湖上驰骋的乐趣.②青藏铁路西宁至格尔木
二 火车行驶在盐湖上(27分)
①乘坐在青藏铁路的列车上,可以亲身体验火车在辽阔的盐湖上驰骋的乐趣.
②青藏铁路西宁至格尔木段铁路线上,有32公里的铁路是以盐层作为路基,直接建在察尔汗盐湖上的,这在世界上极为罕见,是典型的盐湖铁路.
③察尔汗盐湖位于青海省都兰县、格尔木市等地的境内,是世界上最大的陆地盐湖.它东西长168公里,南北宽20~40公里,总面积约5856平方公里,储盐量达500多亿吨,被人们称为“盐湖之王”.这个内陆湖名义上被称为“湖”,但实际上却没有***的湖水,而是一层厚约80厘米的褐色硬壳层,硬壳层下面又是厚达10~20米的盐层或卤水.据测定,此硬壳层能承受每平方米43吨重的压力.
④早在1869年美国修建的太平洋铁路,也曾将路基筑在美国犹他州境内的一个大盐湖上.但这种盐湖铁路早期却没有路基,仅仅以木制栈桥搭建通过盐湖.然而,木桥经不住盐水的腐蚀,铁路运营五十余年后,改用卵石填筑了路基.
⑤而青藏铁路的盐湖铁路是直接修建在盐湖之上的,其工程难度极大.筑路人员( )要克服高寒缺氧、饮用水缺乏等恶劣条件,( )要解决工程施工之中的种种困难.首先要填补盐层下的溶洞.在铁路所经之处的盐湖层下寻找有无溶洞存在,如发现溶洞,则使用机械将盐层揭开,填进卵石或片石,再填铺碎石,构筑成深达数十米的铁路路基的基层.同时要修好渗水的路基,在有地下水渗透的路基一侧,要打进若干根排水管,将卤水引到远处蒸发,防止形成新的溶洞.还要增加路基密实度.在盐层特别坚硬的地方,也要钻眼放炮,崩开盐壳,然后用机械压碎,再浇上卤水,使之溶解蒸发后硬化,从而增加路基的密实度.
⑥这(断、段)盐湖铁路,自1984年通车以来,从(末、未)发生任何(事、是)故.据专家推(测、侧),百年内,这里的气候和盐湖的情况不会有很大变化,因此铁路仍可畅通无阻.
6、读第⑤段:(2)筑路人员在盐湖上建筑铁路要解决哪些困难?填表:
要解决施工中的困难:1.2.3. N年恋一次1年前1
N年恋一次1年前1 -
 dsaadsa 共回答了25个问题
dsaadsa 共回答了25个问题 |采纳率96%克服高寒缺氧、饮用水缺乏
要解决工程施工之中的种种困难.首先要填补盐层下的溶洞 、修好渗水的路基 增加路基密实度1年前查看全部
- (2013•道外区一模)为了测定盐湖析出的一定量Na2CO3中NaCl的质量,向10.9gNa2CO3(含少量NaCl)
(2013•道外区一模)为了测定盐湖析出的一定量Na2CO3中NaCl的质量,向10.9gNa2CO3(含少量NaCl)的混合物中滴加14.6%的稀盐酸至恰好完全反应时,并收集气体4.4g,回答下列问题:
(1)写出题中发生反应的化学方程式______;
(2)根据已知条件列出求解Na2CO3质量(x)的比例式[106/x=
=44 4.4g]或[44/106
=4.4g x] [106/x
=44 4.4g]或[44/106 4.4g x];
(3)10.9g样品中含NaCl的质量为______g;
(4)反应后向所得溶液中加入23.5g水,则其中溶质质量分数为______.赞
风花雪飘月 幼苗
共回答了14个问题采纳率:92.9% 举报
解题思路:(1)碳酸钠与盐酸反应放出二氧化碳而氯化钠不与盐酸反应,根据方程式书写原则写出化学方程式
(2)根据反应的化学方程式,由生成二氧化碳的质量可列出计算样品中碳酸钠的质量,
(3)由(2)中比例式可求出碳酸钠质量,用总质量减去碳酸钠质量即为氯化钠质量.
(2)反应后所得溶液为氯化钠溶液,其中氯化钠由原样品中氯化钠和反应生成氯化钠两部分所组成;由生成二氧化碳质量可计算出生成的氯化钠的质量,样品质量与碳酸钠质量差则为样品中氯化钠的质量,两部分氯化钠的质量和与所得溶液的质量比可计算反应后所得溶液的溶质质量分数,其中反应后所得溶液质量可利用质量守恒定律计算求得.(1)碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,化学方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑
(2)设样品中碳酸钠的质量为x,生成氯化钠的质量为y,消耗HCl的质量为z
Na2CO3+2HCl═2NaCl+H2O+CO2↑
10673 117 44
x z y4.4g
[106/x=
44
4.4g] [117/y=
44
4.4g] [73/z=
44
4.4g]
X=10.6g y=11.7g z=7.3g
反应掉的盐酸的质量=[7.3g/14.6%]=50g
(3)样品中氯化钠质量为10.9g-10.6g=1=0.3g
(4)反应后的溶液中溶质氯化钠质量=0.3g+11.7g=12g
反应后的溶液中溶液的质量=10.9g+50g+23.5g-4.4g=80g
反应后溶液的溶质质量分数[12g/80g]×100%=15%
故答案为:(1)Na2CO3+2HCl═2NaCl+H2O+CO2↑ (2)[106/x=
44
4.4g]或[44/106=
4.4g
x];(3)0.3g;(4)15%点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 根据化学方程式可以表示反应中各物质的质量比,由反应中任意物质的质量可计算出反应中其它物质的质量.1年前
2可能相似的问题-
1年前1个回答
-
1年前1个回答
你能帮帮他们吗
Copyright © 2022 YULUCN.COM - 雨露学习互助 - 17 q. 0.083 s. - webmaster@yulucn.com VVVVVVKK1年前1
VVVVVVKK1年前1 -
-
 风花雪飘月 共回答了14个问题
风花雪飘月 共回答了14个问题 |采纳率92.9%解题思路:(1)碳酸钠与盐酸反应放出二氧化碳而氯化钠不与盐酸反应,根据方程式书写原则写出化学方程式
(2)根据反应的化学方程式,由生成二氧化碳的质量可列出计算样品中碳酸钠的质量,
(3)由(2)中比例式可求出碳酸钠质量,用总质量减去碳酸钠质量即为氯化钠质量.
(2)反应后所得溶液为氯化钠溶液,其中氯化钠由原样品中氯化钠和反应生成氯化钠两部分所组成;由生成二氧化碳质量可计算出生成的氯化钠的质量,样品质量与碳酸钠质量差则为样品中氯化钠的质量,两部分氯化钠的质量和与所得溶液的质量比可计算反应后所得溶液的溶质质量分数,其中反应后所得溶液质量可利用质量守恒定律计算求得.(1)碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,化学方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑
(2)设样品中碳酸钠的质量为x,生成氯化钠的质量为y,消耗HCl的质量为z
Na2CO3+2HCl═2NaCl+H2O+CO2↑
10673 117 44
x z y4.4g
[106/x=
44
4.4g] [117/y=
44
4.4g] [73/z=
44
4.4g]
X=10.6g y=11.7g z=7.3g
反应掉的盐酸的质量=[7.3g/14.6%]=50g
(3)样品中氯化钠质量为10.9g-10.6g=1=0.3g
(4)反应后的溶液中溶质氯化钠质量=0.3g+11.7g=12g
反应后的溶液中溶液的质量=10.9g+50g+23.5g-4.4g=80g
反应后溶液的溶质质量分数[12g/80g]×100%=15%
故答案为:(1)Na2CO3+2HCl═2NaCl+H2O+CO2↑ (2)[106/x=
44
4.4g]或[44/106=
4.4g
x];(3)0.3g;(4)15%点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 根据化学方程式可以表示反应中各物质的质量比,由反应中任意物质的质量可计算出反应中其它物质的质量.1年前查看全部
- 为什么气候干旱会引起盐湖面积扩大
 轩新1年前1
轩新1年前1 -
 zhangbo800429 共回答了17个问题
zhangbo800429 共回答了17个问题 |采纳率94.1%气候干旱,湖水蒸发大于补给,盐类就会析出结晶,同时水体变浅,湖面萎缩,从而使盐湖面积扩大.(盐湖指的是盐,不是水)1年前查看全部
- 我国面积最大的咸湖是?面积最大的盐湖是?
 whw_pl1年前1
whw_pl1年前1 -
 石晓玲 共回答了21个问题
石晓玲 共回答了21个问题 |采纳率95.2%面积最大的咸湖是青海湖 面积最大的盐湖是察尔汗盐湖,也是世界上最大的盐湖.
希望采纳1年前查看全部
- 请回答下面的问题①乘坐在青藏铁路的列车上,可以亲身体验火车在辽阔的盐湖上驰骋的乐趣.②青藏铁路西宁至格尔木段铁路线上,有
请回答下面的问题
①乘坐在青藏铁路的列车上,可以亲身体验火车在辽阔的盐湖上驰骋的乐趣.
②青藏铁路西宁至格尔木段铁路线上,有32公里的铁路是以盐层作为路基,直接建在察尔汗盐湖上的,这在世界上极为罕见,是典型的盐湖铁路.
③察尔汗盐湖位于青海省都兰县、格尔木市等地的境内,是世界上最大的陆地盐湖.它东西长168公里,南北宽20~40公里,总面积约5856平方公里,储盐量达500多亿吨,被人们称为“盐湖之王”.这个内陆湖名义上被称为“湖”,但实际上却没有***的湖水,而是一层厚约80厘米的褐色硬壳层,硬壳层下面又是厚达10~20米的盐层或卤水.据测定,此硬壳层能承受每平方米43吨重的压力.
④早在1869年美国修建的太平洋铁路,也曾将路基筑在美国犹他州境内的一个大盐湖上.但这种盐湖铁路早期却没有路基,仅仅以木制栈桥搭建通过盐湖.然而,木桥经不住盐水的腐蚀,铁路运营五十余年后,改用卵石填筑了路基.
⑤而青藏铁路的盐湖铁路是直接修建在盐湖之上的,其工程难度极大.筑路人员除了要克服高寒缺氧、饮用水极其困难等恶劣条件外,还必须实施三项工程措施.一是要在铁路所经之处的盐湖层下寻找有无溶洞存在;如发现溶洞,则使用机械将盐层揭开,填进卵石或片石,再填铺碎石,构筑成深达数十米的铁路路基的基层.二是在有地下水渗透的路基一侧,要打进若干根排水管,将卤水引到远处蒸发,防止形成新的溶洞.三是在盐层特别坚硬的地方,也要钻眼放炮,崩开盐壳,然后用机械压碎,再浇上卤水,使之溶解蒸发后硬化,从而增加路基的密实度.
⑥这段盐湖铁路,自1984年通车以来,从未发生任何事故.据专家推测,百年内,这里的气候和盐湖的情况不会有很大变化,因此铁路仍可畅通无阻.
1、第②段讲铁路是直接建在盐湖上的,这在世界上极为罕见.“极为罕见”可改为“绝无仅有”吗?为什么?(要求:用文中例子说明理由)
2、在文中找出下列词语的反义词.
柔软( ) 阻塞( ) 没入人海1年前1
没入人海1年前1 -
 果冻爽317 共回答了25个问题
果冻爽317 共回答了25个问题 |采纳率96%1 这种盐湖铁路在世界上虽然少但是也有先例,所以,不能用绝无仅有.而极为罕见,虽然罕见,但是也可看见.
柔软 ﹙ 硬化﹚ 阻塞﹙畅通﹚1年前查看全部
- 在我国青海湖地区有一种说法:冬天捞碱,夏天晒盐.这里的碱是指Na2CO3,盐是指NaCl.人们从盐湖中捞得的Na2CO3
在我国青海湖地区有一种说法:冬天捞碱,夏天晒盐.这里的碱是指Na2CO3,盐是指NaCl.人们从盐湖中捞得的Na2CO3会含有少量的NaCl.
某研究性学习小组称取含NaCl的Na2CO3固体25.0g,将其配制成溶液,再向其中逐滴加入足量的7.3%的稀盐酸,使气体完全放出,共收集到8.8g CO2气体.
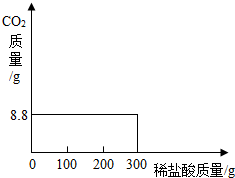
(1)计算原固体中Na2CO3的质量分数和消耗盐酸的总质量.
(2)下表为研究性学习小组向上述所配制的混合液中分三次逐滴加盐酸后,所记录的部分数据.
经查阅资料知:Na2CO3+HCl=NaCl+NaHCO3 (1)NaHCO3+HCl=NaCl+H2O+CO2↑(2)
已知:反应(1)完全后,反应(2)才开始.
①请完成表格中未填的部分.
②根据表中数据在坐标系中画出CO2质量(纵坐标)与所加入盐酸质量(横坐标)的关系图.实验次序 每次产生的CO2的质量(g) 第一次先逐滴加盐酸100g ______ 第二次再逐滴加盐酸100g 8.8 第三次再逐滴加盐酸100g 0  李子的庄周1年前1
李子的庄周1年前1 -
 王天日 共回答了16个问题
王天日 共回答了16个问题 |采纳率87.5%解题思路:(1)利用碳酸钠与盐酸反应生成氯化钠、水和二氧化碳的化学方程式,由放出二氧化碳的质量计算反应中消耗碳酸钠及HCl的质量,完成该问题的计算;
(2)结合资料中所给出的反应信息,由碳酸的质量计算反应(1)所需要盐酸的质量,判断此时反应是否产生气体二氧化碳;由碳酸氢钠的质量计算反应(2)需要盐酸的质量及放出二氧化碳的质量,并判断此时的反应情况,以进一步推断第三次加入盐酸时可能出现的变化情况.(1)设原固体中Na2CO3的质量为x,消耗稀盐酸的质量为yNa2CO3+2HCl=2NaCl+CO2↑+H2O 1067344xy×7.3...
点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 解答本题的两个小问题时应区别对待,前一个小问题利用基础的碳酸钠与盐酸反应知识解答,后一个小问题才需要利用资料信息分析反应,两个问题不可混为一谈.1年前查看全部
- (2013•奉贤区二模)我国北方某盐湖生产的纯碱(Na2CO3)产品中常含有少量的氯化钠(其它杂质忽略不计).为测定该产
 (2013•奉贤区二模)我国北方某盐湖生产的纯碱(Na2CO3)产品中常含有少量的氯化钠(其它杂质忽略不计).为测定该产品中碳酸钠的质量分数,现称取6g试样配成溶液,向其中逐滴加入CaCl2溶液,产生沉淀物质的量与所加CaCl2的物质量关系如图所示.
(2013•奉贤区二模)我国北方某盐湖生产的纯碱(Na2CO3)产品中常含有少量的氯化钠(其它杂质忽略不计).为测定该产品中碳酸钠的质量分数,现称取6g试样配成溶液,向其中逐滴加入CaCl2溶液,产生沉淀物质的量与所加CaCl2的物质量关系如图所示.
试回答:
(1)试样中碳酸钠的质量分数(结果精确至0.1%).(要求写出计算过程)
(2)B点时,溶液中的溶质是______(写出化学式). soccers1年前1
soccers1年前1 -
 lrdztoc 共回答了14个问题
lrdztoc 共回答了14个问题 |采纳率100%解题思路:(1)根据图象分析出沉淀碳酸钙的质量后根据化学方程式计算出样品中碳酸钠的物质的量,然后求出碳酸钠的质量再比上试样的质量即可求解.
(2)根据A点碳酸钠全部参加反应,B时加入的氯化钙没有碳酸钠和氯化钙反应,所以此时溶液中的溶质包括氯化钠和氯化钙分析.(1)设6克试样中含碳酸钠的物质的量为x
Na2CO3+CaCl2=CaCO3↓+2NaCl
1 1
x 0.05mol
[1/x]=[1/0.05mol]
X=0.05mol
Na2CO3%=[0.05mol×106g/mol/6g]×100%=88.3%
答:试样中碳酸钠的质量分数为88.3%.
(2)NaCl和CaCl2点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题是借助于数学模型,利用图表的方式来分析和解决化学计算中的有关问题,要求学生有较强的识图能力和数据分析能力.1年前查看全部
- (2006•云南)结晶是分离可溶性固体混合物的一种常用方法.我国北方有许多盐湖,湖水中溶有大量的碳酸钠和氯化钠,那里的农
 (2006•云南)结晶是分离可溶性固体混合物的一种常用方法.我国北方有许多盐湖,湖水中溶有大量的碳酸钠和氯化钠,那里的农民冬天捞“碱”(碳酸钠),夏天晒盐(氯化钠).请你判断图中能反映碳酸钠溶解度变化的曲线是( )
(2006•云南)结晶是分离可溶性固体混合物的一种常用方法.我国北方有许多盐湖,湖水中溶有大量的碳酸钠和氯化钠,那里的农民冬天捞“碱”(碳酸钠),夏天晒盐(氯化钠).请你判断图中能反映碳酸钠溶解度变化的曲线是( )
A.a
B.b
C.c
D.无法判断 绿柳小筑1年前1
绿柳小筑1年前1 -
 renteryou 共回答了13个问题
renteryou 共回答了13个问题 |采纳率100%解题思路:根据冬天捞碱原因是冬天温度降低,物质的溶解度必须减小,能够析出晶体,才能捞到碱.由于冬天温度低,物质的溶解度减小,达到饱和后温度再降低,溶解度继续减小,有部分溶质就不会再溶解在溶液中,而结晶析出,这时我们就能将其捞出来,由此可以判断该物质的溶解度必须随温度的升高而增大,随温度的降低而减小,并且受温度的影响必须很大,才能做到冬天捞碱.所以碳酸钠的溶解度受温度影响较大.
故选A.点评:
本题考点: 固体溶解度曲线及其作用;结晶的原理、方法及其应用.
考点点评: 解答本题的关键是要分析出冬天能捞碱说明在冬天该物质的溶解度减小的幅度必须大,才能析出晶体.1年前查看全部
- 冬季天气寒冷,从盐湖中析出的物质主要是氯化钠氯化钾原因是什么
 isxse_19_go58_c81年前1
isxse_19_go58_c81年前1 -
 黄湘鄂 共回答了25个问题
黄湘鄂 共回答了25个问题 |采纳率96%因为温度低的话,氯化钠氯化钾的溶解度变小,所以会析出1年前查看全部
- 请运用所学的化学知识解释:(1)在我国北方地区的某些小盐湖,冬天湖底常有纯碱晶体析出,而夏天则常有食盐晶体析出.是什么缘
请运用所学的化学知识解释:
(1)在我国北方地区的某些小盐湖,冬天湖底常有纯碱晶体析出,而夏天则常有食盐晶体析出.是什么缘故?请解释之.
(2)夏天的鱼池中,经常看见鱼浮上水面,而冬天则很少看到浮在水面的活鱼.这又是什么道理呢?请加以说明. 小蜜柚1年前1
小蜜柚1年前1 -
 坏脾气小哀 共回答了12个问题
坏脾气小哀 共回答了12个问题 |采纳率83.3%解题思路:(1)盐湖中溶有大量的Na2CO3和NaCl,Na2CO3的溶解度受温度影响较大,NaCl的溶解度受温度影响较小,据此进行分析解答.
(2)鱼儿生长需要水中的氧气,利用气体的溶解度随温度的升高而降低,随着压强的增大而增大,结合事实进行分析解答.(1)因盐湖中溶有大量的Na2CO3和NaCl,Na2CO3的溶解度受温度影响较大,冬天气温较低,Na2CO3的溶解度较小,易形成饱和溶液及析出晶体;NaCl的溶解度受温度影响较小,夏天气温较高,水分易蒸发,故易形成NaCl饱和溶液及析出 NaCl晶体.故在我国北方地区的某些小盐湖,冬天湖底常有纯碱晶体析出,而夏天则常有食盐晶体析出.
(2)夏天的鱼池中,经常看见鱼浮上水面,而冬天则很少看到浮在水面的活鱼,是因为鱼儿生长需要水中的氧气,夏天气温较高时氧气的溶解度较小,水中氧气不足,故鱼儿便浮上含氧气相对较多的水面;冬天气温较低,氧气的溶解度较大,水中氧气较充足,放鱼儿不必浮上水面就能得到所需的氧气而正常生长.
故答案为:(1)盐湖中溶有大量的Na2CO3和NaCl,Na2CO3的溶解度受温度影响较大,冬天气温较低,Na2CO3的溶解度较小,易形成饱和溶液及析出晶体;NaCl的溶解度受温度影响较小,夏天气温较高,水分易蒸发,故易形成NaCl饱和溶液及析出 NaCl晶体;
(2)鱼儿生长需要水中的氧气,夏天气温较高时氧气的溶解度较小,水中氧气不足,故鱼儿便浮上含氧气相对较多的水面;冬天气温较低,氧气的溶解度较大,水中氧气较充足,放鱼儿不必浮上水面就能得到所需的氧气而正常生长.点评:
本题考点: 结晶的原理、方法及其应用;气体溶解度的影响因素.
考点点评: 本题难度不大,掌握结晶的原理、气体溶解度的两个影响因素并能灵活运用是正确解答本题的关键.1年前查看全部
- 地理题,推测盐湖分布地区的自然环境影响
 哈皮fase1年前1
哈皮fase1年前1 -
 小王子0901 共回答了22个问题
小王子0901 共回答了22个问题 |采纳率81.8%盐湖分布地区应该气候比较干旱,降水量少,蒸发量大;河流较少,向盐湖注入的水量少;植被较少.1年前查看全部
- 我国北方某盐湖生产的纯碱(Na2CO3)产品中常含有少量的氯化钠(其它杂质忽略不计).为测定该产品中碳酸钠的质量分数,现
 我国北方某盐湖生产的纯碱(Na2CO3)产品中常含有少量的氯化钠(其它杂质忽略不计).为测定该产品中碳酸钠的质量分数,现称取6g试样放在烧杯中并滴入稀盐酸,当盐酸滴加至36.5g时,烧杯内溶液的总质量为40.3g(假设产生的气体全部逸出).产生气体的质量与滴入稀盐酸的质量关系如图所示,试计算:
我国北方某盐湖生产的纯碱(Na2CO3)产品中常含有少量的氯化钠(其它杂质忽略不计).为测定该产品中碳酸钠的质量分数,现称取6g试样放在烧杯中并滴入稀盐酸,当盐酸滴加至36.5g时,烧杯内溶液的总质量为40.3g(假设产生的气体全部逸出).产生气体的质量与滴入稀盐酸的质量关系如图所示,试计算:
(1)A点产生气体的质量m=______.
(2)样品中碳酸钠的质量分数(结果精确至0.1%)? roisky1年前1
roisky1年前1 -
 自己的犒劳吧 共回答了18个问题
自己的犒劳吧 共回答了18个问题 |采纳率94.4%解题思路:据图可以看出,当消耗盐酸溶液36.5g时碳酸钠全部参加反应,据此可以求出生成的二氧化碳的质量和需要的碳酸钠的质量,据此解答即可.(1)根据质量守恒定律,化学反应前后物质的总质量不变,故生成的二氧化碳的质量为:6g+36.5g-40.3g=2.2g,故填:2.2;
(2)设生成2.2g二氧化碳需要碳酸钠的质量为x
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 2.2g
[106/x=
44
2.2g] x=5.3g
碳酸钠的质量分数为:
5.3g
6g×100%≈88.3%
答:样品中碳酸钠的质量分数为88.3%.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题考查了根据化学方程式的计算,完成此题,可以依据图示、题干提供的信息结合反应的化学方程式进行.1年前查看全部
- 盐湖沼泽 这个四字词语的意思是什么?
盐湖沼泽 这个四字词语的意思是什么?
fghy
 杀虫剂061年前1
杀虫剂061年前1 -
 danmei 共回答了19个问题
danmei 共回答了19个问题 |采纳率84.2%盐湖是咸水湖的一种,干旱地区含盐度(以氯化物为主)很高的湖泊。
沼泽是指地表过湿或有薄层常年或季节性积水,土壤水分几达饱和,生长有喜湿性和喜水性沼生植物的地段。
盐湖沼泽形容地质恶劣、不宜人居的地方。1年前查看全部
- 化学题,请详细解答,谢谢!用海水晒盐或用井水、盐湖水煮盐,得到的粗盐中含有较多的杂质。如不溶性的泥沙,可溶性的CaCl2
化学题,请详细解答,谢谢!
用海水晒盐或用井水、盐湖水煮盐,得到的粗盐中含有较多的杂质。如不溶性的泥沙,可溶性的CaCl2 、MgCl2 以及一些硫酸盐等。(1)粗盐提纯:溶解、过滤、蒸发实验操作中,所用到的玻璃仪器有____________________。(2)检验:提纯后的粗盐中仍含有可溶性的CaCl2 、MgCl2 以及一些硫酸盐。将提纯后的盐配成溶液,检验该溶液中SO42― 离子时,你的操作是_______________________________。(3)除杂:除去溶液中CaCl2、MgCl2 以及一些硫酸盐,需要考虑加入的试剂、试剂的先后顺序及试剂的用量等问题,在你考虑的方案中,最后一步加入的试剂是_____________,判断加入这种试剂结束时的实验现象是_________________________________________。
 baibaideye1年前1
baibaideye1年前1 -
 yuyi1999 共回答了29个问题
yuyi1999 共回答了29个问题 |采纳率89.7%答案应该是D 因为D将生成硫酸钡沉淀,这种沉淀是既不溶于水,也不溶于酸的,虽然答案中有硝酸也会有沉淀,所以答案应该选择D A答案有盐酸,生成碳酸钡沉淀会溶解. B答案有硫酸,镁或者置换出的铁会与酸反应而溶解. C有硝酸,即使生成氢氧化铜也会溶解. 记住:初中阶段只有氯化银和硫酸钡不既不溶于水也不溶于酸的,所以它们两个常常会是考点....1年前查看全部
- 我国北方某盐湖生产的纯碱(Na 2 CO 3 )产品中常含有少量的氯化钠(其他杂质忽略不计)。为测定该产品中碳酸钠的质量
我国北方某盐湖生产的纯碱(Na 2 CO 3 )产品中常含有少量的氯化钠(其他杂质忽略不计)。为测定该产品中碳酸钠的质量分数,现称取6g试样放在烧杯中并滴入稀盐酸。当盐酸滴加至36.5g时,烧杯内溶液的总质量为40.3g(假设产生的气体全部逸出),产生气体的质量与滴入稀盐酸的质量关系如下图所示。试计算: 
(1)A点产生气体的质量m=______。
(2)试样中碳酸钠的质量分数(结果精确至0.1%)。
(3)B点时,烧杯内溶液中的溶质是____(写出化学式)。 aoyunyyy281361年前1
aoyunyyy281361年前1 -
 63zba 共回答了22个问题
63zba 共回答了22个问题 |采纳率90.9%(1)2.2g
(2)设纯碱试样中碳酸钠的质量为x。
Na 2 CO 3 +2HCl==2NaCl+H 2 O+CO 2 ↑
106 44
x 2.2g
106/44=x/2.2g
x=5.3g
试样中碳酸钠的质量分数为:5.3g/6g×100%≈83. 3%
(3)NaCl、HCl1年前查看全部
- (2009•道外区一模)在内蒙古盐湖中含有的溶质主要是Na2CO3和NaCl,其溶解度曲线如图所示,据此下列说法不正确的
(2009•道外区一模)在内蒙古盐湖中含有的溶质主要是Na2CO3和NaCl,其溶解度曲线如图所示,据此下列说法不正确的是( )

A.Na2CO3和NaCl是易溶性物质
B.夏天时(30℃),水分蒸发.析出的晶体是NaCl
C.冬天时析出的Na2CO3•10H2O中一定不含有NaCl
D.NaCl溶饵度曲线受温度的影响变化不大 ymwawa1年前1
ymwawa1年前1 -
 小硕68 共回答了18个问题
小硕68 共回答了18个问题 |采纳率88.9%A、因为室温(20℃)时,溶解度大于10克的属于易溶物质,由图可知,Na2CO3和NaCl是易溶性物质,说法正确,故A正确;
B、夏天时(30℃),水分蒸发.不易形成碳酸钠的饱和溶液,所以析出的晶体是NaCl,说法正确,故B正确;
C、冬天温度低,碳酸钠溶解度小易析出,但是氯化钠也会随着碳酸钠析出一小部分;冬天时析出的Na2CO3•10H2O中一定不含有NaCl,说法错误,仍含有一定的氯化钠,故C错误;
D、NaCl溶解度曲线受温度的影响变化不大,说法正确,故D正确.
故选C.1年前查看全部
- 下列关于湿地的叙述,正确的是A.湿地就是过湿的土地 B.盐湖、盐沼是湿地 C.天然湖泊、河流是湿地,而人工水库不是湿地
下列关于湿地的叙述,正确的是
A.湿地就是过湿的土地 B.盐湖、盐沼是湿地 C.天然湖泊、河流是湿地,而人工水库不是湿地 D.青藏高原上的湿地具有防风固沙、保持水土的作用 andyzjx1年前1
andyzjx1年前1 -
 Californiasunny 共回答了17个问题
Californiasunny 共回答了17个问题 |采纳率88.2%答案B 解析:本题主要考查学生对湿地的理解.A项说法太片面;湿地包括淡水或咸水,天然或人工的,故盐湖、盐沼是湿地,B项正确;天然湖泊、河流是湿地,人工水库也是湿地,C项错误;青藏高原湿地对涵养水源、调节全球气候变化有极其重要的作用,故D项错.查看原帖1年前查看全部
- 下列关于湿地的叙述,正确的是A.湿地就是过湿的土地B.盐湖、盐沼是湿地C.天然湖泊、河流是湿地,而人工水库不是湿地D.青
下列关于湿地的叙述,正确的是
A.湿地就是过湿的土地
B.盐湖、盐沼是湿地
C.天然湖泊、河流是湿地,而人工水库不是湿地
D.青藏高原上的湿地具有防风固沙、保持水土的作用 chenlingling631年前1
chenlingling631年前1 -
 lup24 共回答了20个问题
lup24 共回答了20个问题 |采纳率95%答案B
解析:本题主要考查学生对湿地的理解.A项说法太片面;湿地包括淡水或咸水,天然或人工的,故盐湖、盐沼是湿地,B项正确;天然湖泊、河流是湿地,人工水库也是湿地,C项错误;青藏高原湿地对涵养水源、调节全球气候变化有极其重要的作用,故D项错.1年前查看全部
- 通过晾晒海水或煮盐井水、盐湖水等,可以蒸发除去水分得到粗盐。粗盐中含有难溶性杂质(泥沙等)和多种可溶性杂质(氯化镁、氯化
通过晾晒海水或煮盐井水、盐湖水等,可以蒸发除去水分得到粗盐。粗盐中含有难溶性杂质(泥沙等)和多种可溶性杂质(氯化镁、氯化钙等)。
[提出问题]如何才能将粗盐中难溶性杂质和可溶性杂质(氯化镁、氯化钙)除去,从而获得较纯的食盐晶体?
[资料准备]
[实验方案]某同学为了提纯粗盐,设计了如下实验方案并进行实验。20℃时,一些物质的溶解度 OH - CO 3 2- Na + 溶 溶 Ca 2+ 微 不 Mg 2+ 不 微 
[交流与表达]
(1)实验步骤①和②的目的是 ;实验步骤③和④的目的是 。
(2)实验操作X的名称是 ,该操作中要用到的玻璃仪器有烧杯、玻璃棒和 。
(3)实验步骤③的主要目的是 (用化学方程式回答);判断氢氧化钠溶液已过量的方法是 。
(4)实验步骤④中生成的沉淀D是 。
(5)实验步骤⑤用蒸发溶剂的方法而不用降低溶液温度的方法获取食盐晶体,原因是 ;在蒸发食盐溶液的过程中要使用玻璃棒,作用是 。
[反思与评价]
(6)有同学认为只需要用氢氧化钠溶液和碳酸钠溶液中任意一种试剂就能将两种可溶性杂质出去,你认为这种方法 (选填“可行”或“不可行”),理由是 。
(7)有同学认为原实验方案不完善,做出这种评价的依据是 。
[实验方案设计]
(8)为了完善原实验发难,你设计的实验是 (仅写出补充部分的实验操作和现象) 银妆1年前1
银妆1年前1 -
 naugar 共回答了17个问题
naugar 共回答了17个问题 |采纳率100%(1)除去粗盐中的难溶性杂质(1分)
除去粗盐中的易溶性杂质CaCl 2 、MgCl 2 (1分)
(2)过滤(1分)漏斗(1分)
(3)MgCl 2 +2NaOH====Mg(OH) 2 ↓+2NaCl(1分) 不再继续产生沉淀
(4)碳酸钙(或CaCO 3 )(1分)
(5)氯化钠的溶解度收温度影响较小(1分)
搅拌溶液,避免因局部过热,造成液滴飞溅(1分)
(6)不可行(1分) MgCO 3 、Ca(OH) 2 均为微溶物,只用任意一种试剂就会有一种杂质生成微溶物而不能全部除去(1分)
(7)在除去MgCl 2 和CaCl 2 的同时,又引入了新的杂质NaOH和Na 2 CO 3 (或在除去Ca 2+ 和Mg 2+ 的同时又引入了新的杂质离子OH — 和CO 3 2 — )(1分)
(8)向溶液C中逐滴加入稀盐酸至不再产生气泡为止(1分)
(1)浑浊液体经操作X分成了固体和液体,即操作X应该是将固体和液体进行分离的方法。所以操作X为过滤。过滤除去的是不溶于水的固体,因此实验步骤①和②是将粗盐中的不溶于水的固体除去。
粗盐中含有不溶性杂质和可溶性杂质(氯化镁、氯化钙)。实验步骤①1年前查看全部
- (2009•道外区一模)在内蒙古盐湖中含有的溶质主要是Na2CO3和NaCl,其溶解度曲线如图所示,据此下列说法不正确的
(2009•道外区一模)在内蒙古盐湖中含有的溶质主要是Na2CO3和NaCl,其溶解度曲线如图所示,据此下列说法不正确的是( )

A.Na2CO3和NaCl是易溶性物质
B.夏天时(30℃),水分蒸发.析出的晶体是NaCl
C.冬天时析出的Na2CO3•10H2O中一定不含有NaCl
D.NaCl溶饵度曲线受温度的影响变化不大 zhouwenjunors1年前1
zhouwenjunors1年前1 -
 猫儿HOHO 共回答了21个问题
猫儿HOHO 共回答了21个问题 |采纳率85.7%解题思路:由溶解度曲线可知,碳酸钠的溶解度受温度影响较大,而氯化钠的溶解度受温度的影响不大,所以“夏晒盐,冬捞碱”,这里的“碱”,指纯碱碳酸钠.A、因为室温(20℃)时,溶解度大于10克的属于易溶物质,由图可知,Na2CO3和NaCl是易溶性物质,说法正确,故A正确;
B、夏天时(30℃),水分蒸发.不易形成碳酸钠的饱和溶液,所以析出的晶体是NaCl,说法正确,故B正确;
C、冬天温度低,碳酸钠溶解度小易析出,但是氯化钠也会随着碳酸钠析出一小部分;冬天时析出的Na2CO3•10H2O中一定不含有NaCl,说法错误,仍含有一定的氯化钠,故C错误;
D、NaCl溶解度曲线受温度的影响变化不大,说法正确,故D正确.
故选C.点评:
本题考点: 固体溶解度曲线及其作用.
考点点评: 溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度;同一温度下,不同溶质的溶解度;温度对不同物质的溶解度影响不同.1年前查看全部
- 神话般的盐湖阅读理解答案
 lin-linan1年前1
lin-linan1年前1 -
 小帆也能远航 共回答了15个问题
小帆也能远航 共回答了15个问题 |采纳率93.3%1、这篇课文从地点、形成和作用这三个方面介绍了盐湖.
2、雪水一路上带来许多矿物质,水到湖里不能向外流,蒸发量又大,年复一年,这样就把淡水湖变成了盐湖.(用“------”画出写盐湖形成原因的句子)
3、答:抒发了作者对盐湖的喜爱、肯定的思想感情.1年前查看全部
- 我国北方许多盐湖溶有氯化钠和碳酸钠在这里有夏天捞盐冬天捞碱
 sbfv02271年前1
sbfv02271年前1 -
 刘老铁 共回答了13个问题
刘老铁 共回答了13个问题 |采纳率92.3%盐(NaCl)溶解度受温度变化影响较小,要提取,只能把水蒸干结晶.而碱(实际上是Na2SO4/CaSO4),溶解度随温度下降显著降低,冬天很易达到饱和,所以用“捞”的方法即可.1年前查看全部
- 盐湖中盐水变成盐(成品)属于什么变化
盐湖中盐水变成盐(成品)属于什么变化
同题 3det41年前3
3det41年前3 -
 uvud0 共回答了14个问题
uvud0 共回答了14个问题 |采纳率100%物理变化.结晶1年前查看全部
- (2006•兰州)在我国青海湖地区有一种说法,冬天捞碱,夏天晒盐.这里的碱是指Na2CO3,盐是指NaCl.人们从盐湖中
(2006•兰州)在我国青海湖地区有一种说法,冬天捞碱,夏天晒盐.这里的碱是指Na2CO3,盐是指NaCl.人们从盐湖中捞得的碱会含有少量的NaCl.某研究性学习小组称取含NaCl的Na2CO3,固体25.0g,将其配制成溶液,再向其中逐滴加入足量的溶质质量分数为7.3%的稀盐酸,使气体完全放出,共收集到8.8g二氧化碳气体.试计算:
(1)原固体中Na2CO3,的质量分数;
(2)反应中消耗的盐酸的总质量. 紫雨如风S1年前0
紫雨如风S1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 通过晾晒海水或煮盐井水、盐湖水等,可以蒸发除去水分得到粗盐.粗盐中含有难溶性杂质(泥沙等)和多种可溶性杂质(氯化镁、氯化
通过晾晒海水或煮盐井水、盐湖水等,可以蒸发除去水分得到粗盐.粗盐中含有难溶性杂质(泥沙等)和多种可溶性杂质(氯化镁、氯化钙等).
[提出问题]如何才能将粗盐中难溶性杂质和可溶性杂质(氯化镁、氯化钙)除去,从而获得较纯的食盐晶体?
[资料准备]
[实验方案]某同学为了提纯粗盐,设计了如下实验方案并进行实验.20℃时,一些物质的溶解度 OH - CO 3 2- Na + 溶 溶 Ca 2+ 微 不 Mg 2+ 不 微 
[交流与表达]
(1)实验步骤①和②的目的是______;实验步骤③和④的目的是______.
(2)实验操作X的名称是______,该操作中要用到的玻璃仪器有烧杯、玻璃棒和______.
(3)实验步骤③的主要目的是______(用化学方程式回答);判断氢氧化钠溶液已过量的方法是______.
(4)实验步骤④中生成的沉淀D是______.
(5)实验步骤⑤用蒸发溶剂的方法而不用降低溶液温度的方法获取食盐晶体,原因是______;在蒸发食盐溶液的过程中要使用玻璃棒,作用是______.
[反思与评价]
(6)有同学认为只需要用氢氧化钠溶液和碳酸钠溶液中任意一种试剂就能将两种可溶性杂质出去,你认为这种方法______(选填“可行”或“不可行”),理由是______.
(7)有同学认为原实验方案不完善,做出这种评价的依据是______.
[实验方案设计]
(8)为了完善原实验方案,你设计的实验是______(仅写出补充部分的实验操作和现象) 原野ee1年前1
原野ee1年前1 -
 海底的老鹰 共回答了24个问题
海底的老鹰 共回答了24个问题 |采纳率70.8%(1)通过溶解、过滤可以把粗盐中不溶性杂质除去.
故填:除去粗盐中的难溶性杂质.
通过步骤③和④,可以除去粗盐中的易溶性杂质CaCl 2 、MgCl 2 .
故填:除去粗盐中的易溶性杂质CaCl 2 、MgCl 2 .
(2)实验操作X的名称是过滤,该操作中要用到的玻璃仪器有烧杯、玻璃棒和漏斗.
故填:过滤;漏斗.
(3)实验步骤③的主要目的是除去氯化镁,氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,反应的化学方程式为:MgCl 2 +2NaOH═Mg(OH) 2 ↓+2NaCl.
故填:MgCl 2 +2NaOH═Mg(OH) 2 ↓+2NaCl.
判断氢氧化钠溶液已过量的方法是:取样品少许,加入试管中,滴加酚酞试液,溶液变红色.
故填:取样品少许,加入试管中,滴加酚酞试液,溶液变红色.
(4)实验步骤④中生成的沉淀D是碳酸钙.
故填:碳酸钙.
(5)实验步骤⑤用蒸发溶剂的方法而不用降低溶液温度的方法获取食盐晶体,原因是氯化钠的溶解度受温度影响较小.
故填:氯化钠的溶解度受温度影响较小.
在蒸发食盐溶液的过程中要使用玻璃棒,作用是搅拌溶液,避免因局部过热,造成液滴飞溅.
故填:搅拌溶液,避免因局部过热,造成液滴飞溅.
(6)这种方法不可行,因为MgCO 3 、Ca(OH) 2 均为微溶物,只用任意一种试剂就会有一种杂质生成微溶物而不能全部除去.
故填:不可行;MgCO 3 、Ca(OH) 2 均为微溶物,只用任意一种试剂就会有一种杂质生成微溶物而不能全部除去.
(7)做出这种评价的依据是:在除去MgCl 2 和CaCl 2 的同时,又引入了新的杂质NaOH和Na 2 CO 3 .
故填:在除去MgCl 2 和CaCl 2 的同时,又引入了新的杂质NaOH和Na 2 CO 3 .
(8)设计的实验是:向溶液C中逐滴加入稀盐酸至不再产生气泡,滴加酚酞试液时溶液不变色.
故填:向溶液C中逐滴加入稀盐酸至不再产生气泡,滴加酚酞试液时溶液不变色.1年前查看全部
- 山西的盐湖里开采的盐有哪些形状越快越好!
 屈兰1年前1
屈兰1年前1 -
 gawr 共回答了17个问题
gawr 共回答了17个问题 |采纳率100%形状:盐类形状十分奇特,有的象璀璨夺目的珍珠,有的象盛开的花朵,有的象水晶,有的角宝石,因此才有珍珠盐、玻璃盐、钟乳盐、珊瑚盐、水晶盐、雪花盐、蘑菇盐等许多美丽动人的名称.
颜色:白色、黄色、绿色等1年前查看全部
- 硫酸镁溶液为什么盐湖中的硫酸镁在盐湖温度降至10摄氏度是都没有析出,而氯化钠则析出?
 云-云1年前1
云-云1年前1 -
 a暗香盈袖a 共回答了12个问题
a暗香盈袖a 共回答了12个问题 |采纳率100%溶解度是随温度的降低而减小的.所以NACL析出.
常温时,硫酸镁的溶解度是54 g.
结晶过程可以看作溶解的反过程,结晶浓度可以认为是饱和浓度,即溶解度
硫酸镁的溶解度(g/100g水):0度25.5,10度30.4,20度35.1,25度37.4,30度39.7,40度44.7,50度50.4,60度54.8,超过70度下降
20摄氏度36g 温度升高溶解度提高 到65度时溶解度最大为54g
所以在65度时重结晶最好1年前查看全部
大家在问
- 1英语翻译今天我去了世博会.那里非常好玩,世博园区内共有154个展馆.我去游玩了美国馆,美国馆的创始人是罗杰斯.美国馆共有
- 2细胞遇糖水变形吗?遇盐水呢?失水皱缩还是吸水膨胀?
- 3小王和小李分别使用装置甲和装置乙作为实验室里二氧化碳气体的发生装置(铁架台、铁夹已略去).回答有关问题:
- 4若分式方程[x−1/x−4=mx−4]有增根,则m的值为m=______.
- 5(2013•江油市模拟)甲、乙、丙三人合资成立公司,且同时订立合同:盈利按个人出资的比例分配(出资情况如表).2006年
- 6有一个圆锥,它的侧面展开图为一个半圆,母线长OA=5厘米,在圆锥底面的A点有一只蚂蚁他想吃到.
- 7earth land soil的区别
- 819961997*1997-19961996*1996的简算方法 需要过程 谢谢
- 9·Li Lei is the youngest member in our club.改成相同或相近的句子.
- 10某校六年级共有110人,参加语文、英语、数学三科活动小组,每人至少参加一组.已知参加语文小组的有52人,只参加语文小组的
- 11由四舍五入法得到的近似数0.05010的有效数字的个数有____
- 12一个装水的瓶向瓶中倒3杯水共重550克.倒9杯水重850克.如倒20 杯水共重多少克
- 13修一条路,没有修的是已经修好的2/3.把( )看成单位“1”,相等关系是( )
- 14下列物质既能与盐酸反应,有能与氢氧化钠溶液反应的是
- 151.Only when students _____ willing to learn can they be acti



