脱氢醋(乙)酸钠、丙酸钠的防腐原理是什么?
 zkn02022-10-04 11:39:541条回答
zkn02022-10-04 11:39:541条回答其结构所具有的什么性质使得它们能够防腐呢?

已提交,审核后显示!提交回复
共1条回复
 生活所迫555 共回答了12个问题
生活所迫555 共回答了12个问题 |采纳率91.7%- 我觉得是它们的结构中羰基的O原子与金属原子配位结合,在金属表面形成一层稳定的隔离膜,组织空气中的氧气与金属反应,产生生锈的现象.
- 1年前
相关推荐
- 酯化反应规律:有机酸酸脱羟基醇脱氢,无机酸中醇脱羟基酸脱氢
酯化反应规律:有机酸酸脱羟基醇脱氢,无机酸中醇脱羟基酸脱氢
能否简述其中原因,满足高中生的好奇心,通俗易懂. gxd50321年前1
gxd50321年前1 -
 人生沸腾 共回答了22个问题
人生沸腾 共回答了22个问题 |采纳率90.9%有机中酸的羧基可以分解为羰基连羟基,这样碳氧键极性增大,易断裂,而醇中可以分解为烃基连羟基,碳氧键极性相对较小,羟基的氧氢键极性大,易断裂 无极中酸的氢离子完全电离,提供氢,醇只能提供羟基1年前查看全部
- 9.调节三羧酸循环运转最主要的酶是( ) A.琥珀酸脱氢酶 B.丙酮酸脱氢酶 C.柠檬酸合成酶 D.苹果酸脱氢
 淡水雲1年前1
淡水雲1年前1 -
 majiaba 共回答了16个问题
majiaba 共回答了16个问题 |采纳率81.3%选 C
三羧酸循环的3个关键酶是:柠檬酸合酶、异柠檬酸脱氢酶、α-酮戊二酸脱氢酶
所以,只能选C
——————
关键酶:调节催化反应的限速酶,对整个反应都具有关键的调控作用.
代谢途径中决定反应的速度和方向的酶,称为关键酶.
它有三个特点:
1、它催化的反应速度最慢,所以又称限速酶.其活性决定代谢的总速度.
2、它常常催化单向反应,其活性能决定代谢的方向.
3、它常常受多种效应剂的调节.1年前查看全部
- 乙苯脱氢生成苯乙烯的反应是什么反应?(从分子数)
乙苯脱氢生成苯乙烯的反应是什么反应?(从分子数)
就是增大还是减小的 abc30651年前1
abc30651年前1 -
 念念lr 共回答了17个问题
念念lr 共回答了17个问题 |采纳率82.4%分子数增加的反应1年前查看全部
- 判断题 1.在有机反应中,脱氢称为氧化,加氢称为还原( )
 kavinming1年前3
kavinming1年前3 -
 美丽饕餮 共回答了20个问题
美丽饕餮 共回答了20个问题 |采纳率100%1.对2.对3.错,油酸不是4.错,甲胺>氨>苯胺5.错,蔗糖是非还原性二糖,果糖是一种还原性单糖1年前查看全部
- (2012•南通模拟)钛白粉(主要成分是TiO2),广泛用于油漆、塑料、造纸等行业,还可用作乙醇脱水、脱氢的催化剂.下图
(2012•南通模拟)钛白粉(主要成分是TiO2),广泛用于油漆、塑料、造纸等行业,还可用作乙醇脱水、脱氢的催化剂.下图是以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料生产钛白粉并获得副产品FeSO4•7H2O的工艺流程图.

(1)钛铁矿与硫酸发生反应①的化学方程式为______;在TiOSO4和FeSO4溶液中加入Fe的目的是______.
(2)溶液Ⅱ中TiOSO4在加热条件下发生水解反应②的离子方程式为______;可回收利用的物质是______.
(3)为测定溶液Ⅱ中TiOSO4的含量,首先取待测钛液10mL用水稀释至100mL,加过量铝粉,充分振荡,使其完全反应:3TiO2++Al+6H+=3Ti3++Al3++3H2O.过滤后,取出滤液20.00mL,向其中滴加2~3滴KSCN溶液作指示剂,用______(填一种玻璃仪器的名称)滴加0.1000mol•L-1 FeCl3溶液,当溶液出现红色达到滴定终点,用去了30.00mL FeC13溶液.待测钛液中TiOSO4的物质的量浓度是______. dzcrk1年前1
dzcrk1年前1 -
 秋叶之路 共回答了22个问题
秋叶之路 共回答了22个问题 |采纳率81.8%解题思路:(1)根据反应物和生成物写出化学方程式;Fe2+具有较强的还原性;
(2)根据反应物和生成物及质量和电荷守恒定律写出化学方程式,根据产物确定可回收利用的物质;
(3)准确滴加氯化铁溶液可使用酸式滴定管;根据元素守恒计算待测钛液中TiOSO4的物质的量;(1)反应物有FeTiO3,H2SO4;生成物有:TiOSO4和FeSO4,化学方程式为FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O;Fe2+具有较强的还原性,加入Fe可防止Fe2+被氧化,
故答案为:FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O;防止Fe2+被氧化,以获得纯净的副产品FeSO4•7H2O;
(2)TiOSO4与水反应生成H2TiO3,离子方程式为TiO2++2H2O=H2TiO3↓+2H+;反应生成硫酸,硫酸可回收利用,
故答案为:TiO2++2H2O=H2TiO3↓+2H+;H2SO4;
(3)准确滴加氯化铁溶液可使用滴定管,氯化铁有较强的氧化性,应用酸式滴定管;
设滤液Ti3+的物质的量为X.
Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
1 1
X 0.1000mol•L-1×0.03L
解得X=0.1000mol•L-1×0.03L=0.003mol
则待测钛液中TiOSO4的物质的量=0.003mol×5=0.015mol
根据C=[n/V]=[0.015mol/0.01L]=1.50 mol•L-1
故答案为:酸式滴定管;1.50 mol•L-1;点评:
本题考点: 常见金属元素的单质及其化合物的综合应用;物质分离和提纯的方法和基本操作综合应用;中和滴定.
考点点评: 本题考查常见金属元素的单质及其化合物的综合应用,难度适中,注意根据元素守恒和C=[n/V]解题.1年前查看全部
- 三羧酸循环中的琥珀酸脱氢变为延胡索酸是否就是呼吸链中复合体Ⅱ的第一步反应?
 west3341年前1
west3341年前1 -
 sango2 共回答了19个问题
sango2 共回答了19个问题 |采纳率84.2%我认为是的1年前查看全部
- 硬脂酸跟软脂酸的B氧化有什么区别?是不是都是先脱氢再加水在脱氢硫解?
 cfztc5181年前2
cfztc5181年前2 -
 深圳公交全球最牛 共回答了17个问题
深圳公交全球最牛 共回答了17个问题 |采纳率100%脂肪酸β-氧化,经脱氢、水化、再脱氢、硫解四步反应,产生乙酰CoA和比原来脂酰辅酶A少两个碳原子的脂酰CoA.新生成的脂酰辅酶A再经上述四个反应,最终全部转化为乙酰CoA.乙酰CoA再进入三羧酸循环(TCA循环),最后形成二氧化碳和水.
软脂酸是16碳酸,8个二碳单元,7轮β-氧化后最后一个二碳单元产生.β-氧化之前软脂酸需要激活,消耗一个ATP的两个高能键,减去2ATP.一轮β-氧化产生5个ATP,每个二碳单元进入三羧酸循环生成12个ATP.这样的话,7轮β-氧化产生的ATP数目为:5×7=35,八个二碳单元产生的ATP数目:12×8=96.96+35﹣2=129.1年前查看全部
- C2H5OH+O2---CH3CHO+H2O是从相邻的C和O原子上脱氢的消去反应吗?
 haoyunlai1年前6
haoyunlai1年前6 -
 aihansong 共回答了19个问题
aihansong 共回答了19个问题 |采纳率94.7%不是,是羟基氢和阿尔法-氢(就是与与羟基相连的碳相连的碳,或者说是与羟基相隔1个碳氧键、1个碳碳键和一个碳氢键的氢)参加氧化反应.如果没有阿尔法氢,则这个反应不能进行1年前查看全部
- (2011•闵行区二模)工业生产苯乙烯是利用乙苯的脱氢反应:
(2011•闵行区二模)工业生产苯乙烯是利用乙苯的脱氢反应:

针对上述反应,在其它条件不变时,下列说法正确的是( )
A.在保持体积一定的条件下,充入较多的乙苯,可以提高乙苯的转化率
B.在保持压强一定的条件下,充入稀有气体,有利于提高苯乙烯的产率
C.在保持其它条件一定的情况下,降低温度,可以提高乙苯的转化率
D.仅从平衡移动的角度分析,工业生产苯乙烯选择恒压条件优于恒容条件 jiangxsyt1年前1
jiangxsyt1年前1 -
 Fan Zi Xuan 共回答了16个问题
Fan Zi Xuan 共回答了16个问题 |采纳率100%解题思路:A、增大乙苯浓度,增大了反应的压强,平衡向着逆向移动;
B、压强一定,充入稀有气体,各组分的浓度减小;
C、根据反应是吸热反应进行判断;
D、根据压强对该反应的影响进行分析.A、在保持体积一定的条件下,充入较多的乙苯,反应体系的压强增大,平衡向着逆向移动,乙苯的转化率降低,故A错误;
B、保持压强一定的条件下,充入稀有气体,相当于减小了各组分的浓度,生成物浓度减小的程度大,平衡向着正向移动,苯乙烯的产量增加,故B正确;
C、该反应是吸热反应,降低温度,平衡向着放热的逆向移动,乙苯的转化率降低,故C错误;
D、该反应是体积增大的反应,恒容体系中,随着反应的进行,体系的压强增大,平衡向着逆向移动,不利于苯乙烯的生成,故恒压条件优于恒容条件,故D正确;
故选BD.点评:
本题考点: 化学平衡的调控作用.
考点点评: 本题考查了化学平衡的调控,注意分析反应的特点,吸热反应还是放热反应、反应两边气体体积增大还是减小,根据平衡移动原理进行分析即可,本题难度中等.1年前查看全部
- 乙苯脱氢制苯乙烯加什么 有机化学书上说乙苯脱氢制苯乙烯,那加什么脱氢?氧气?
 baiweioy1年前2
baiweioy1年前2 -
 莫道人生 共回答了18个问题
莫道人生 共回答了18个问题 |采纳率100%你去参看百度文库【乙苯脱氢制苯乙烯】.
加氧化铁系催化剂.1年前查看全部
- 一道化学题! 甲醇脱氢可制取甲醛CH3OH(g)HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示
一道化学题! 甲醇脱氢可制取甲醛CH3OH(g)HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示

 关于B选项 甲醇转换率升高 不应该是V正>V逆 么? 求详解!
关于B选项 甲醇转换率升高 不应该是V正>V逆 么? 求详解!
是不是 它正在平衡? 所以V逆>V正? sudeidei1年前1
sudeidei1年前1 -
 地之缝 共回答了19个问题
地之缝 共回答了19个问题 |采纳率78.9%那条曲线表示反应平衡时甲醇的转化率,而Y在曲线上方,说明此时未达到平衡,反应要向逆反应进行,所以v逆大于v正1年前查看全部
- (2011•闵行区二模)工业生产苯乙烯是利用乙苯的脱氢反应:
(2011•闵行区二模)工业生产苯乙烯是利用乙苯的脱氢反应:

针对上述反应,在其它条件不变时,下列说法正确的是( )
A.在保持体积一定的条件下,充入较多的乙苯,可以提高乙苯的转化率
B.在保持压强一定的条件下,充入稀有气体,有利于提高苯乙烯的产率
C.在保持其它条件一定的情况下,降低温度,可以提高乙苯的转化率
D.仅从平衡移动的角度分析,工业生产苯乙烯选择恒压条件优于恒容条件 阧岭_1年前1
阧岭_1年前1 -
 左飞飞右飞飞 共回答了19个问题
左飞飞右飞飞 共回答了19个问题 |采纳率89.5%A、在保持体积一定的条件下,充入较多的乙苯,反应体系的压强增大,平衡向着逆向移动,乙苯的转化率降低,故A错误;
B、保持压强一定的条件下,充入稀有气体,相当于减小了各组分的浓度,生成物浓度减小的程度大,平衡向着正向移动,苯乙烯的产量增加,故B正确;
C、该反应是吸热反应,降低温度,平衡向着放热的逆向移动,乙苯的转化率降低,故C错误;
D、该反应是体积增大的反应,恒容体系中,随着反应的进行,体系的压强增大,平衡向着逆向移动,不利于苯乙烯的生成,故恒压条件优于恒容条件,故D正确;
故选BD.1年前查看全部
- 生物竞赛细胞呼吸部分概念问题1.细胞呼吸中脱氢,是不是还原性氢?还原性氢是不是氢离子?2.为什么脱氢和加氧是氧化?3.“
生物竞赛细胞呼吸部分概念问题
1.细胞呼吸中脱氢,是不是还原性氢?还原性氢是不是氢离子?
2.为什么脱氢和加氧是氧化?
3.“NADH是NAD+的还原形式”是什么意思?
还有高分奉送.
谢谢rety_balance的回答.
还想问问,加氧加的是氧气.那么这个化合物怎么写呢?会带负电荷吗? wskddit1年前1
wskddit1年前1 -
 ruby580232 共回答了21个问题
ruby580232 共回答了21个问题 |采纳率90.5%1.细胞呼吸中脱氢,是不是还原性氢?是的
还原性氢是不是氢离子?不是,是NADH,这是一种化合物,具有强还原性
2.为什么脱氢和加氧是氧化?从化学的角度来看,因为都会失电子阿(不知道你学了这部分内容没有,可以看看高一化学书)
3.“NADH是NAD+的还原形式”是什么意思?NAD+和NADP+都可以夺取其他物质的H,形成NADH和NADPH(后者主要在光合作用中携带H),这两种物质具有强还原性,所以就说是还原形式,但是如果从化学的角度来说,其实已经是不同的物质了.1年前查看全部
- 乙醇和硝酸的反应中断键位置如何老师说是硝酸脱氢,醇脱羟基,结合成水.但这好像违背了酯化反应的规律,
 金州海边1年前1
金州海边1年前1 -
 暗香盈袖:) 共回答了19个问题
暗香盈袖:) 共回答了19个问题 |采纳率84.2%无机含氧酸与醇可以发生酯化反应,断键方式与有机酸与醇反应不同.
前者是酸脱氢醇脱羟基生成脂类,后者是醇脱羟基酸脱氢生成脂类.
乙醇和硝酸的反应归为硝化反应更加恰当.
CH3CH2-OH + H+NO3- → CH3CH2-ONO2 + H2O1年前查看全部
- 为什么酯化反应中浓硫酸有吸水的作用?吸水性不是指原先有水,后来没水吗?酯化反应是脱羟基脱氢,应该脱水啊
 万物有本性1年前3
万物有本性1年前3 -
 wkk332036 共回答了12个问题
wkk332036 共回答了12个问题 |采纳率100%浓硫酸脱水一般指从一个有机分子中脱出水来,如浓硫酸与乙醇在170℃时生成乙烯的反应,表现了浓硫酸的脱水性.酯化反应是一个可逆反应,所以浓硫酸的作用是催化和吸水,吸水导致平衡右移,有利于酯化的进行.
从一个分子中脱水表现浓硫酸的脱水性,从两个分子中脱水表现浓硫酸的吸水性.1年前查看全部
- 为什么乳酸和碳酸钠反应两个羧基均脱氢,而乳酸和钠反应只有一个羧基脱氢?
 iwangcai1年前5
iwangcai1年前5 -
 最后的咖啡夜2007 共回答了21个问题
最后的咖啡夜2007 共回答了21个问题 |采纳率100%楼上的老师补充的很正确
首先 不是2个羧基 是1个羟基和1个羧基
其次是乳酸和纳反应脱2个氢 和碳酸钠是脱1个
这里涉及到羟基和羧基的亲核能力不一样大 碳酸钠和钠的亲电能力不一样大
说的就深了啊 不是高一解释的了的1年前查看全部
- 关于甲基原子共面单对于甲基来说最多可能几个原子共面?是单纯的甲烷脱氢吗?
 jiabaoyu1年前4
jiabaoyu1年前4 -
 冰山焰 共回答了14个问题
冰山焰 共回答了14个问题 |采纳率78.6%1年前查看全部
- 20.已知:(1)醇类物质在催化剂存在条件下可发生类似于乙醇的脱氢氧化.(2)羰基()与两个烃基相连构成的化合物叫酮(如
20.已知:(1)醇类物质在催化剂存在条件下可发生类似于乙醇的脱氢氧化.(2)羰基()与两个烃基相连构成的化合物叫酮(如丙酮);而分别与烃基和氢相连构成的化合物叫醛(如乙醛CH3CHO).下列醇被氧化时,不可能得到醛类化合物的是 ( )
A.(CH3)3COH B.CH3CHOHCH3
C.CH3CH2CH2OH D.(CH3)3CCH2OH 西南风飞弹1年前3
西南风飞弹1年前3 -
 sfgfsd 共回答了21个问题
sfgfsd 共回答了21个问题 |采纳率90.5%答案:AB
1.-OH所连的碳上有3个H时,如甲醇,可被氧化成醛.
2.-OH所连的碳上有2个H时,可被氧化成醛.如乙醇被氧化成乙醛.
3..-OH所连的碳上有1个H时,可被氧化成酮.如2-丙醇被氧化成丙酮.
4..-OH所连的碳上有无H时,不能被催化氧化.如2-甲基-2-丙醇.1年前查看全部
- 生物氧化中大多数底物脱氢需要哪一种辅酶?NAD+,Cytc,CoQ,FAD,FMN中的哪种呢
 阎阎1年前1
阎阎1年前1 -
 xushuangxi 共回答了20个问题
xushuangxi 共回答了20个问题 |采纳率90%NAD+1年前查看全部
- 琥珀酸脱氢生成延胡索酸 脱下的一对氢通过呼吸链传递 若KCN存在时生成多少摩尔ATP 为什么?
琥珀酸脱氢生成延胡索酸 脱下的一对氢通过呼吸链传递 若KCN存在时生成多少摩尔ATP 为什么?
有的答案是1摩尔 有的是没有ATP 究竟哪个正确啊 我觉得是1摩尔 如果没有ATP生成 其中原理是什么啊? yhy198201年前2
yhy198201年前2 -
 生活是首歌 共回答了20个问题
生活是首歌 共回答了20个问题 |采纳率95%题目中给出KCN是不是想要暗示利用KCN对呼吸酶的抑制作用来解题呢?
“KCN使细胞色素及细胞色素氧化酶失去传递电子的作用 ”
KCN破坏了电子传递链.我认为是这种原因导致了没有ATP生成.1年前查看全部
- 不是说二硫键的形成要脱氢么是以什么形式脱下来的脱下来的是什么东西
 绿色草坪1年前3
绿色草坪1年前3 -
 心动痕迹 共回答了16个问题
心动痕迹 共回答了16个问题 |采纳率93.8%二硫键的形成确实要脱氢,其中的氢是以失电子变成氢离子脱下来的,脱下来的是两个氢离子,不是氢气.1年前查看全部
- 关于酯化反应键的断裂问题?请问 酯化反应中,(例如)乙醇脱氢,乙酸脱羟,是什么力是它们两个结合起来而脱离原来的乙醇和乙酸
关于酯化反应键的断裂问题?
请问 酯化反应中,(例如)乙醇脱氢,乙酸脱羟,是什么力是它们两个结合起来而脱离原来的乙醇和乙酸.
还有,为什么会脱离,乙醇和乙酸分子中不都是共价键吗?是很强的键啊 为什么会断呢?
课本里只讲了它们会反应生成乙酸乙酯,但我不知道为什么 ping855671年前2
ping855671年前2 -
 ly4382 共回答了23个问题
ly4382 共回答了23个问题 |采纳率91.3%1年前查看全部
- 甲醇脱氢可制取甲醛CH3OH(g)⇌HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如图所示.下列有关说法正确
甲醇脱氢可制取甲醛CH3OH(g)⇌HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如图所示.下列有关说法正确的是( )

A.脱氢反应的△H<0
B.600K时,Y点甲醇的υ(正)<υ(逆)
C.从Y点到Z点可通过增大压强
D.在t1K时,该反应的平衡常数为8.1mol•L-1 rcxzxq1年前1
rcxzxq1年前1 -
 狗山 共回答了22个问题
狗山 共回答了22个问题 |采纳率95.5%解题思路:A、甲醇脱氢反应为吸热反应还是放热反应由温度对平衡移动的影响确定;
B、60K时Y点甲醇转化率大于X点甲醇平衡转化率;
C、增大压强,平衡向逆反应方向移动,甲醇转化率减小;
D、由于初始浓度不知,因此对于此反应而言无法求算化学平衡常数.A、由图可知,温度越高甲醇平衡转化率越大,说明升高温度化学平衡正向移动,因此甲醇脱氢反应为吸热反应即△H>0,故A错误;
B、600K时Y点甲醇转化率大于X点甲醇平衡转化率,说明反应逆向进行即:υ(正)<υ(逆),故B正确;
C、由图可知Y点和Z点甲醇转化率相等,若增大压强,平衡向逆反应方向移动,甲醇转化率减小,则甲醇的转化率将小于Z点甲醇转化率,故C错误;
D、由于不知道初始浓度,只有转化率这一条件计算不出平衡浓度,因此无法计算平衡常数,故D错误.
故选:B.点评:
本题考点: 转化率随温度、压强的变化曲线.
考点点评: 本题考查化学平衡影响因素、化学平衡常数及其计算等,从图中提取有用信息的能力尤为关键,难度中等,注意基础知识理解掌握.1年前查看全部
- 脱氢乙酸钠与氯化钙会发生化学反应吗?反应后的物质是不是脱氢乙酸钙?其对人体是否有害?
 SaintH1年前0
SaintH1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2012•合肥三模)工业生产苯乙烯是利用乙苯的脱氢反应:
(2012•合肥三模)工业生产苯乙烯是利用乙苯的脱氢反应:

达到平衡后改变反应条件,下列图中曲线变化不正确的是( )
A.
B.
C.
D.
 与我行1年前1
与我行1年前1 -
 zyz015 共回答了20个问题
zyz015 共回答了20个问题 |采纳率95%解题思路:该反应正方向是气体体积增大的方向,正反应为吸热反应;根据温度、压强对平衡的影响分析.A、该反应的正方向为吸热反应,升温平衡向着正方向移动,乙苯的转化率升高,故A正确;
B、该反应的正方向为吸热反应,升温平衡向着正向移动,平衡常数增大,故B错误;
C、增大压强,正反应速率增大,故C正确;
D、该反应是体积增大的反应,增大压强,平衡向着逆方向移动,苯乙烯的转化率减小,故D正确;
故选B.点评:
本题考点: 转化率随温度、压强的变化曲线;化学平衡常数的含义.
考点点评: 本题考查了化学平衡的调控,注意分析反应的特点,吸热反应还是放热反应、反应两边气体体积增大还是减小,根据平衡移动原理进行分析即可,本题难度中等.1年前查看全部
- 醇类的催化脱氢 催化氧化是为一个概念?
 海纳百川_aaa1年前1
海纳百川_aaa1年前1 -
 轩0079 共回答了28个问题
轩0079 共回答了28个问题 |采纳率92.9%不是一个概念;有机化学中的氧化反应是这么定义的.氧化反应:有机物中加氧或去氢的反应叫氧化反应.可见:醇类的催化脱氢属于氧化反应.但醇类的催化氧化还会包括醇类的加氧反应,产生醇——→醛之间的“中间体”(高中化学不学).1年前查看全部
- 关于酸脱羟基醇脱氢在高中阶段,是不是所有酯化反应都是这个道理?那么除去乙醇中的乙酸,加足量生石灰,就成了酸脱氢,就不按这
关于酸脱羟基醇脱氢
在高中阶段,是不是所有酯化反应都是这个道理?那么除去乙醇中的乙酸,加足量生石灰,就成了酸脱氢,就不按这个方法了是不是?这算不算取代? 宇星子1年前1
宇星子1年前1 -
 qujiao 共回答了18个问题
qujiao 共回答了18个问题 |采纳率88.9%加了生石灰是生成了醋酸钙,属于酸碱的中和,不是酯化反应,但属于取代反应,另外,楼上的人错了,大学阶段,叔醇服从醇脱羟基酸脱氢.1年前查看全部
- EMP和TCA途径脱氢步骤反应式并讨论生物意义
EMP和TCA途径脱氢步骤反应式并讨论生物意义
关键是生物意义 哈达姆1年前1
哈达姆1年前1 -
 五元码 共回答了18个问题
五元码 共回答了18个问题 |采纳率94.4%你是本科生吧,这个生化里都有,糖酵解就是将葡萄糖水解为丙酮酸,并释放出少量的能量和NADPH.而这一步生成的丙酮酸和NADPH就是下一步TCA的原料,这一步会产生大量的能量.至于你说的脱氢的步骤,就是在每一次生成NADPH的时候脱得.通过时有机物氧化,并产生能量.至于具体每一步的建议你看看生化书.1年前查看全部
- 三羧酸循环中的主要氧化脱氢反应及其氢受体
 儋耳人1年前1
儋耳人1年前1 -
 鹦鹉初啼 共回答了24个问题
鹦鹉初啼 共回答了24个问题 |采纳率83.3%三羧酸循环的四次脱氢,其中三对氢原子以NAD+为受氢体,一对以FAD为受氢体
三对氢原子以NAD+为受氢体:
由异柠檬酸脱氢酶催化柠檬酸氧化脱羧生成α酮戊二酸反应
由α-酮戊二酸脱氢酶复合体催化α-酮戊二酸氧化脱羧生成琥珀酰CoA反应
由苹果酸脱氢酶催化苹果酸脱氢生成草酰乙酸反应
一对以FAD为受氢体:
由琥珀酸脱氢酶催化琥珀酸脱氢生成延胡索酸反应1年前查看全部
- 一个有趣的有机化学问题烷烃能否直接脱氢生成烯烃呢?如果能需要什么条件如果不能是否是因为烷烃比烯烃稳定,反应的吉布斯自由能
一个有趣的有机化学问题
烷烃能否直接脱氢生成烯烃呢?
如果能需要什么条件
如果不能是否是因为烷烃比烯烃稳定,反应的吉布斯自由能为正? 鲜果沙冰1年前4
鲜果沙冰1年前4 -
 古丽娜依 共回答了21个问题
古丽娜依 共回答了21个问题 |采纳率100%首先纠正一下,不是烷烃比烯烃稳定,而是两个碳氢sigma键比一个碳碳pi键键能高得多.反应的确Delta G大于〇,但是,G只是反应自发过程的判据,而不是所有反应的判据,G大于〇的反应是可以发生的,只不过得给于体系能量.
楼上说的是对的,烷烃的高热下的热裂解,是可以形成烯烃的.1年前查看全部
- (2015•韶关一模)化工工业中常用乙苯脱氢的方法制备苯乙烯.已知某温度下:
 (2015•韶关一模)化工工业中常用乙苯脱氢的方法制备苯乙烯.已知某温度下:
(2015•韶关一模)化工工业中常用乙苯脱氢的方法制备苯乙烯.已知某温度下:
反应①:CO2(g)+H2(g)⇌CO(g)+H2O(g),△H=+41.2kJ/mol;
反应②: (g)⇌
(g)⇌ (g)+H2(g),△H=+117.6kJ/mol.
(g)+H2(g),△H=+117.6kJ/mol.
①、②的化学反应平衡常数分别为K1、K2.
(1)请写出二氧化碳氧化乙苯制备苯乙烯的热化学反应方程式______.该反应的化学平衡常数K=______(用K1、K2表示).
(2)恒温恒容条件下,反应①达到平衡后,t1时刻通入少量CO2.请画出t1之后的正逆反应曲线,并作出标注.
(3)已知某温度下,Ag2SO4饱和溶液中c(Ag+)=0.04mol/L,则该温度下Ksp(Ag2SO4)=______.(保留两位有效数字)
(4)电解法制备高铁酸钠(Na2FeO4),总反应式为:Fe+2H2O+2OH-═FeO42-+3H2↑,电解质溶液选用NaOH溶液.该电解池阳极材料是______(写化学式);阳极的电极反应式为______. 徐超仔1年前1
徐超仔1年前1 -
 winsam2007 共回答了10个问题
winsam2007 共回答了10个问题 |采纳率90%解题思路:(1)根据盖斯定律,结合已知方程式计算反应热,然后写热化学方程式;方程式相加时,总平衡常数等于分方程的平衡常数之积;
(2)恒温恒容条件下,反应①达到平衡后;t1时刻通入少量CO2,则正反应速率瞬间增大,逆反应速率逐渐增大;
(3)根据Ksp(Ag2SO4)=c2(Ag+)c(SO42-)求算;
(4)根据电解方程可知Fe失电子作阳极,碱性条件下,Fe失电子生成FeO42-.(1)已知反应①:CO2(g)+H2(g)→CO(g)+H2O(g)△H=+41.2kJ/mol;
反应②: (g)→
(g)→ (g)+H2(g)△H=+117.6kJ/mol;
(g)+H2(g)△H=+117.6kJ/mol;
根据盖斯定律:①+②,得 CO2(g)+ +CO(g)+H2O(g) △H=+41.2+117.6=+158.8kJ/mol,
+CO(g)+H2O(g) △H=+41.2+117.6=+158.8kJ/mol,
反应①与②相加得总方程,则总方程的平衡常数等于分方程的平衡常数之积,即K=K1•K2,
故答案为:CO2(g)+ +CO(g)+H2O(g) △H=+158.8 kJ/mol;K1•K2;
+CO(g)+H2O(g) △H=+158.8 kJ/mol;K1•K2;
(2)恒温恒容条件下,反应①达到平衡后;t1时刻通入少量CO2,则正反应速率瞬间增大,逆反应速率逐渐增大,其t1之后的正逆反应曲线为: ,故答案为:
,故答案为: ;
;
(3)Ag2SO4的饱和溶液中,c(Ag+)=4×10-2mol/L,则c(SO42-)=2×10-2mol/L,则Ksp(Ag2SO4)=c2(Ag+)•c(SO42-)=2×10-2×(4×10-2)2=3.2×10-5,
故答案为:3.2×10-5;
(4)已知电解法制备高铁酸钠(Na2FeO4),总反应式为:Fe+2H2O+2OH-═FeO42-+3H2,可知Fe失电子作阳极,碱性条件下,Fe失电子生成FeO42-,其阳极的电极方程式为:Fe-6e+8OH-=FeO42-+4H2O,
故答案为:Fe;Fe-6e+8OH-=FeO42-+4H2O.点评:
本题考点: 化学平衡常数的含义;难溶电解质的溶解平衡及沉淀转化的本质;电解原理.
考点点评: 本题考查了热化学方程式的书写、平衡常数K的应用、Ksp的计算、电解原理的应用等,题目涉及的知识点较多,题目难度中等,侧重于考查学生对基础知识的综合应用能力.1年前查看全部
- 发生在人体内环境中的是?1:神经递质与受体结合2:葡萄糖脱氢分解产生丙酮酸3:事物中的蛋白质经消化被分解成氨基酸4:一道
发生在人体内环境中的是?
1:神经递质与受体结合
2:葡萄糖脱氢分解产生丙酮酸
3:事物中的蛋白质经消化被分解成氨基酸
4:一道细胞合成胰岛素 db19831年前7
db19831年前7 -
 清朝旅馆 共回答了24个问题
清朝旅馆 共回答了24个问题 |采纳率87.5%人体内环境包括:血浆,淋巴,组织液.
1.神经递质与受体结合,这个情况是神经递质由突触小泡与突触前膜结合发出到突触间隙中,然后再与突触后膜上的受体结合;这整个过程都发生在两个细胞之间,而两个细胞之间则恰恰是组织液,属于内环境.
2.葡萄糖脱氢分解产生丙酮酸(注:这个过程可以认为是细胞有氧呼吸第一步,也可以认为是无氧呼吸),这个过程发生在细胞中,但是并不属于内环境.
3.食物中的蛋白质经消化被分解成氨基酸,这一过程应该发生在胃腔吧,明显也不是内环境.
4.胰岛细胞合成胰岛素,胰岛素的实质是蛋白质,而蛋白质的合成是发生在细胞里的核糖体中,所以自然也不是内环境.
最后答案就只可能是 1 了.1年前查看全部
- 葡萄糖可在细胞质基质中脱氢后形成2分子丙酮酸.这句话有什么问题.
葡萄糖可在细胞质基质中脱氢后形成2分子丙酮酸.这句话有什么问题.
如题. jeremy471年前3
jeremy471年前3 -
 sadfghjaekrth 共回答了19个问题
sadfghjaekrth 共回答了19个问题 |采纳率78.9%没什么大问题,非要说有问题的话,大概在于“脱氢”两个字
葡萄糖经历了磷酸化、变构、裂解、脱氢、去磷酸化、脱水等等一系列的反应,才生成两分子丙酮酸,所以,脱氢只是其中一个过程,不能概括整个过程.1年前查看全部
- 甲醛是一种重要的化工产品,可利用甲醇脱氢制备,反应式如下:
甲醛是一种重要的化工产品,可利用甲醇脱氢制备,反应式如下:
CH 3 OH(g) CH 2 O(g) + H 2 (g)
CH 2 O(g) + H 2 (g) =" 84.2" kJ·mol -1 ⑴
=" 84.2" kJ·mol -1 ⑴
向体系中通入空气,通过以下反应提供反应(1) 所需热量:
H 2 (g) + 1/2O 2 (g)=H 2 O(g) =" –241.8" kJ·mol -1 (2)
=" –241.8" kJ·mol -1 (2)
要使反应温度维持在700℃,计算进料中甲醇与空气的摩尔数之比。已知空气中氧气的体积分数为0.20。 asd23881年前1
asd23881年前1 -
 dkw110 共回答了20个问题
dkw110 共回答了20个问题 |采纳率90%要使反应维持在一定温度并持续进行,应保证反应(2)放出的热量恰好被反应(1) 全部利用,因此:
甲醇与氧气的摩尔比为: n (CH 3 OH): n (O 2 ) =" (2" × 241.8) / 84.2 =" 5.74"
甲醇与空气的摩尔比为: n (CH 3 OH) : n (空气) =" 5.74" / 5 = 1.1
要使反应维持在一定温度持续进行,应保证反应(2)放出的热量恰好被反应(1) 全部利用。因此甲醇与氧气的物质的量之比为(2 ´ 241.8) / 84.2 = 5.74(注意保留三位有效数字),根据氧气的体积分数0.20,可求得甲醇与空气的物质的量之比。
此题需注意计算过程中有效数字的保留:乘除运算中,以有效数字最少的保留有效数字;加减运算中以小数点位数最少的保留有效数字;常数不计算有效数字等。1年前查看全部
- 14.三羧酸循环有 次脱氢,其中 的辅酶是FAD.
 okjiut1年前1
okjiut1年前1 -
 725433040 共回答了20个问题
725433040 共回答了20个问题 |采纳率95%三羧酸循环有4次脱氢,其中1次(琥珀酸脱氢为苹果酸)的辅酶是FAD1年前查看全部
- 甲醛是一种重要的化工产品,可以利用甲醇脱氢制备,反应式如下:
甲醛是一种重要的化工产品,可以利用甲醇脱氢制备,反应式如下:
①CH 3 OH(g) CH 2 O(g)+H 2 (g) ΔH 1 ="+84.2" kJ·mol -1
CH 2 O(g)+H 2 (g) ΔH 1 ="+84.2" kJ·mol -1
向反应体系中通入氧气,通过反应②2H 2 (g)+O 2 (g) 2H 2 O(g) ΔH 2 ="-483.6" kJ·mol -1 提供反应①所需热量,要使反应温度维持在700 ℃,则进料中甲醇与氧气的物质的量之比约为( )
2H 2 O(g) ΔH 2 ="-483.6" kJ·mol -1 提供反应①所需热量,要使反应温度维持在700 ℃,则进料中甲醇与氧气的物质的量之比约为( )A.5.74∶1 B.11.48∶1 C.1∶1 D.2∶1  zhan__1年前1
zhan__1年前1 -
 sunnyjesse2001 共回答了17个问题
sunnyjesse2001 共回答了17个问题 |采纳率100%1年前查看全部
- 英语翻译摘要本设计的任务是6000t/a环己酮蒸馏脱氢工段的工艺设计。环己酮是重要化工原料,是制造尼龙、己内酰胺和己二酸
英语翻译
摘要
本设计的任务是6000t/a环己酮蒸馏脱氢工段的工艺设计。
环己酮是重要化工原料,是制造尼龙、己内酰胺和己二酸的主要中间体,也是重要的工业溶剂。
本文介绍了环己酮的性质、用途、***外生产概况、生产方案论证以及生产工艺流程;对环己酮车间蒸馏脱氢工段中的轻一塔、环己酮精馏塔、环己醇精馏塔和脱氢反应器进行了物料衡算和热量衡算;对环己醇精馏塔及其附属设备和脱氢反应器进行了设备选型和计算;列出了设备一览表、产品的技术经济定额和安全生产的原则;翻译了相关的外文文献;应用autocad2010绘制了该工段物料流程图、带控制点的工艺流程图、平立面布置图。 ucross181年前1
ucross181年前1 -
 游在江南 共回答了13个问题
游在江南 共回答了13个问题 |采纳率84.6%Abstract
The mission designing that originally is that 6000 t/a are encircled by self own's process design of ketone distillation dehydro section of construction project.Being encircled by self own's ketone is important industrial chemicals ,is to make nylon ,self own lactam and the main adilic acid centre body ,be also important industry menstruum.Be encircled by self own's ketone character ,use ,be produced a general situation at home and abroad ,be produced project approachment and be produced a process flow that the main body of a book has been introduced; The reactor has carried out the material accounting and the quantity of heat accounting on to be encircled by one light tower in self own's ketone workshop distillation dehydro section of construction project ,to be encircled by self own's ketone rectifying tower ,to be encircled by self own's alcohol rectifying tower and be dehydrogenated; The equipment having been in progress to ring self own's alcohol rectifying tower and their subsidiary equipment and dehydro reactor chooses a type and secretly schemes against; Have listed the equipment schedule ,product technical economy quota and the safety at work principle; Have translated the pertinent foreign language document; Arrangement plan applying AutoCAD2010 having drawn that section of construction project material flow chart ,taking control point process flowsheet ,tie to stand on face.1年前查看全部
- 工业上采用乙苯与CO2脱氢生产重要化工原料苯乙烯
工业上采用乙苯与CO2脱氢生产重要化工原料苯乙烯
 (g)+CO2(g)⇌
(g)+CO2(g)⇌ (g)+CO(g)+H2O(g)△H=-166kJ•mol-1
(g)+CO(g)+H2O(g)△H=-166kJ•mol-1
(1)①乙苯与CO2反应的平衡常数表达式为:K=c(C6H5CH=CH2)•c(CO)•c(H2O) c(C6H5CH2CH3)•c(CO2) .c(C6H5CH=CH2)•c(CO)•c(H2O) c(C6H5CH2CH3)•c(CO2)
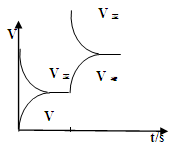
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是______(填代号).
(2)在3L密闭容器内,乙苯与CO2的反应在三种不同的条件下进行实验,乙苯、CO2的起始浓度分别为1.0mol•L-1和3.0mol•L-1,其中实验Ⅰ在T1℃,0.3MPa,而实验Ⅱ、Ⅲ分别改变了实验其他条件;乙苯的浓度随时间的变化如图1所示.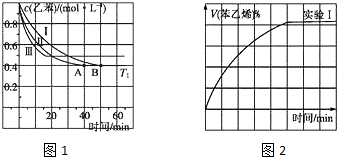
①实验Ⅰ乙苯在0~50min时的反应速率为______.
②实验Ⅱ可能改变的条件是______.
③图2是实验Ⅰ中苯乙烯体积分数V%随时间t的变化曲线,请在图2中补画实验Ⅲ中苯乙烯体积分数V%随时间t的变化曲线.
(3)若实验Ⅰ中将乙苯的起始浓度改为1.2mol•L-1,其他条件不变,乙苯的转化率将______(填“增大”“减小”或“不变”),计算此时平衡常数为______. grapejojo1年前1
grapejojo1年前1 -
 颓废老狗 共回答了22个问题
颓废老狗 共回答了22个问题 |采纳率86.4%解题思路:(1)①平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,结合方程式分析;
②a、到达平衡后正、逆速率相等,不再变化;
b、到达平衡后,温度为定值,平衡常数不变,结合反应热判断随反应进行容器内温度变化,判断温度对化学平衡常数的影响;
c、t1时刻后二氧化碳、NO的物质的量发生变化,最后不再变化;
d、到达平衡后各组分的含量不发生变化;
(2)①根据图I中乙苯的浓度变化,求出反应速率;
②根据图I中实验Ⅱ改变条件平衡不移动,反应速率增大;
③图1可知曲线Ⅲ乙苯的物质的量浓度较大,所以苯乙烯的体积分数就小,而且Ⅲ达平衡时间短,然后作图;
(3)根据加入乙苯引起的浓度增大量与平衡移动引起的浓度减小量的相对关系分析;温度不变平衡常数不变.(1)①乙苯与CO2反应的平衡常数表达式为:K=
c(C6H5CH=CH2)•c(CO)•c(H2O)
c(C6H5CH2CH3)•c(CO2),故答案为:
c(C6H5CH=CH2)•c(CO)•c(H2O)
c(C6H5CH2CH3)•c(CO2);
②A、到达平衡后正、逆速率相等,不再变化,t1时刻V正最大,之后随反应进行速率发生变化,未到达平衡,故A错误;
B、该反应正反应为放热反应,随反应进行温度升高,化学平衡常数减小,到达平衡后,温度为定值,达最高,平衡常数不变,为最小,图象与实际符合,故B正确,
C、t1时刻后二氧化碳、NO的物质的量发生变化,t1时刻未到达平衡状态,故C错误;
D、NO的质量分数为定值,t1时刻处于平衡状态,故D正确;
故答案为:BD;
(2)①根据图I中可知,0-50min时乙苯的浓度变化为1.0mol/L-0.4mol/L=0.6mol/L,
则其反应速率为[△c/t]=[0.6mol/L/50min]=0.012mol/(L•min);
故答案为:0.012mol/(L•min);
②根据图I中实验Ⅱ改变条件平衡不移动,而反应速率增大,所以改变的条件是加催化剂,
故答案为:加催化剂;
③图1可知曲线Ⅲ乙苯的物质的量浓度较大,所以苯乙烯的体积分数就小,而且Ⅲ达平衡时间短,然后作为: ,故答案为:
,故答案为: ;
;
(3)若实验I中将乙苯的起始浓度改为1.2mol/L,其他条件不变,平衡正移,由于二氧化碳的初始浓度没变,平衡移动引起的乙苯的浓度的减小量小于加入的乙苯引起的浓度增加量,所以乙苯的转化率减小;
由 (g)+CO2(g)⇌
(g)+CO2(g)⇌ (g)+CO(g)+H2O(g)
(g)+CO(g)+H2O(g)
初起量:1.0 3.0 0 0 0
变化量:0.6 0.6 0.6 0.6 0.6
平衡量:0.4 2.4 0.6 0.6 0.6
所以平衡常数为:K=[0.6×0.6×0.6/0.4×2.4]=0.225,
故答案为:减小;0.225.点评:
本题考点: 化学平衡常数的含义;化学平衡的影响因素;产物的百分含量随浓度、时间的变化曲线;化学平衡的计算.
考点点评: 本题综合性较大,涉及化学平衡状态的判断、化学平衡常数、化学平衡影响因素、反应速率的计算等,题目涉及的内容较多,侧重于考查学生对知识点的综合应用能力,题目难度中等.1年前查看全部
- 丙酮酸进入线粒体后发生几次脱羧几次脱氢?
 蒸汽朋克1年前2
蒸汽朋克1年前2 -
 smile呵 共回答了11个问题
smile呵 共回答了11个问题 |采纳率90.9%丙酮酸进入线粒体后生成生成乙酰辅酶A,有一次脱氢.
乙酰辅酶A参加三羧酸循环四次脱氢.
共5次.1年前查看全部
- 葡萄糖的苷羟基和其它醇或胺缩合生成苷的时候是脱氢还是脱去整个苷羟基?
 wangziwen131年前1
wangziwen131年前1 -
 sunxuelin 共回答了15个问题
sunxuelin 共回答了15个问题 |采纳率86.7%此反应作为亲核取代反应,是由醇或胺的孤对电子进攻羟基相连的碳,故为苷羟基整个脱去.1年前查看全部
- 酯化反应中醇脱氢是因为羟基中氧直接连在碳上亲核力大形成新键,难道酸中羟基不是直接连在碳...
酯化反应中醇脱氢是因为羟基中氧直接连在碳上亲核力大形成新键,难道酸中羟基不是直接连在碳...
酯化反应中醇脱氢是因为羟基中氧直接连在碳上亲核力大形成新键,难道酸中羟基不是直接连在碳上的吗?好象也是啊 为什么酸上羟基中的氧与碳的亲核力就没有醇羟基中氧与碳的亲核力大而整个羟基都脱掉了呢 没钱的小uu1年前1
没钱的小uu1年前1 -
 彩色oo糖 共回答了24个问题
彩色oo糖 共回答了24个问题 |采纳率91.7%醇中羟基连接的是烷基,烷基是给电子基团,可以增大羟基氧上面电子云的密度,使得其亲核能力加强;而在羧酸的羧基中,羟基的旁边连接着一个羰基,而羰基是强吸电子基团,会使羟基氧上的电子云密度大大降低,使得其几乎没有亲核性了.因此我们一般把羧基做为一个整体来看待,不把它拆成羰基和羟基的组合.1年前查看全部
- 酯化反应乙酸乙醇断键部位 规律酯化反应中 乙酸中羧基脱羟基 乙醇中羟基脱氢 总结规律
 秋影ying1年前2
秋影ying1年前2 -
 明月沉江春雾晓 共回答了13个问题
明月沉江春雾晓 共回答了13个问题 |采纳率92.3%确实是酸脱羟基醇脱氢 ,但这是一般情况,在存在重氧和超重氧时,可能会出现醇脱羟基酸脱氢,因为只产生正常水分子1年前查看全部
- (16分)化工工业中常用乙苯脱氢的方法制备苯乙烯。
(16分)化工工业中常用乙苯脱氢的方法制备苯乙烯。
(1)已知某温度下:
反应①:CO 2 (g) +H 2 (g) →CO (g) + H 2 O (g) ,ΔH= +41.2 kJ/mol
反应②: (g)→
(g)→ (g)+H 2 (g),ΔH=" +117.6" kJ/mol
(g)+H 2 (g),ΔH=" +117.6" kJ/mol
②的化学反应平衡常数分别为K 1 、K 2 。
请写出二氧化碳氧化乙苯制备苯乙烯的热化学反应方程式 。该反应的化学平衡常数K= (用K 1 、K 2 表示)。
(2)对于反应①,恒温恒容条件下,向密闭容器中加入2molCO 2 和2molH 2 , 当反应达到平衡后,以下说法正确的是 。
(3)温恒容条件下,反应①达到平衡后;t 1 时刻通入少量CO 2 ; 请在下图中画出t 1 之后的正逆反应曲线,并作出标注。A.因为该反应是吸热反应,所以升高温度,正反应速率增大,逆反应速率减小; B.若继续加入1molCO 2 、1mol H 2 ,平衡向正反应方向移动; C.若继续通入1mol CO 2 则平衡向正反应方向移动,CO 2 的转化率增大; D.压缩体积,平衡不移动,反应物和产物的浓度都不变; 
(4)已知某温度下, Ag 2 SO 4 (M=312g/mol)的溶解度为0.624g/100g H 2 O,该温度下K sp (Ag2SO4) = ;(两位有效数字)
(5)电解法制备高铁酸钠(Na 2 FeO 4 ),总反应式为:Fe+2H 2 O+2OH - = FeO 4 2- +3H 2 ,电解质溶液选用NaOH溶液。该电解池阳极材料是 (写化学式) ;阳极的电极反应式为: 。 baggioshixiao1年前1
baggioshixiao1年前1 -
 jjwwbbww 共回答了21个问题
jjwwbbww 共回答了21个问题 |采纳率85.7%1年前查看全部
- 请问脱氢酸醋酸钠分子式是什么?最好能有它的分子结构式
 jgdq051年前1
jgdq051年前1 -
 呆鹅7401 共回答了18个问题
呆鹅7401 共回答了18个问题 |采纳率100%也叫氧化醋酸钠
CH2-Oh-COONa
H O
| //
H-C-C
|
OH ONa1年前查看全部
- 乙酸转化成乙醛乙酸可以转化成乙醛吗?乙醛氧化得到乙酸,那么乙酸能不能脱氢得到乙醛?条件呢?
 ttcyf1年前4
ttcyf1年前4 -
 刘世良 共回答了11个问题
刘世良 共回答了11个问题 |采纳率72.7%乙酸极难还原,LiAlH4通常会完全还原生成乙醇
CH3COCl可以控制还原得到乙醛1年前查看全部
- (2013•茂名一模)工业上采用乙苯与CO2脱氢生产重要化工原料苯乙烯
(2013•茂名一模)工业上采用乙苯与CO2脱氢生产重要化工原料苯乙烯

其中乙苯在CO2气氛中的反应可分两步进行
(1)上述乙苯与CO2反应的反应热△H为______
(2)①乙苯与CO2反应的平衡常数表达式为:K=c(C6H5CH=CH2)•c(CO)•c(H2O) c(C6H5CH2CH3)c(CO2) c(C6H5CH=CH2)•c(CO)•c(H2O) c(C6H5CH2CH3)c(CO2)
②乙苯与CO2在固定体积的容器中反应下列叙述不能说明已达到平衡状态的是______
a.体系的密度不再改变b.体系的压强不再改变c.c(CO2)=c(CO)
d.消耗1molCO2同时生成1molH2Oe.CO2的体积分数保持不变
(3)在3L密闭容器内,乙苯与CO2的反应在三种不同的条件下进行实验,乙苯、CO2的起始浓度分别为
1.0mol/L和3.0mol/L,其中实验I在T1℃,0.3MPa,而实验II、III分别改变了实验其他条件;乙苯的浓度随时间的变化如图I所示.
①实验I乙苯在0-50min时的反应速率为______
②实验Ⅱ可能改变条件的是______
③图II是实验I中苯乙烯体积分数V%随时间t的变化曲线,请在图II中补画实验Ⅲ中苯乙烯体积分数V%随时间t的变化曲线.
(4)若实验I中将乙苯的起始浓度改为1.2mol/L,其他条件不变,乙苯的转化率将______(填“增大”、“减小”或“不变”),计算此时平衡常数为______. 孤星入命1年前1
孤星入命1年前1 -
 renyi26 共回答了15个问题
renyi26 共回答了15个问题 |采纳率93.3%解题思路:(1)根据盖斯定律结合热化学方程式分析;
(2)①平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,结合方程式分析;
②根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆速率之比等于化学计量数之比(不同物质),各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化;
(3)①根据图I中乙苯的浓度变化,求出反应速率;
②根据图I中实验Ⅱ改变条件平衡不移动,反应速率增大;
③实验Ⅲ中改变条件,由图I可知乙苯的浓度增大,平衡逆移,所以苯乙烯体积分数V%随时间t增大而减小;
(4)根据加入乙苯引起的浓度增大量与平衡移动引起的浓度减小量的相对关系分析;若实验I中将乙苯的起始浓度改为1.2mol/L,其他条件不变,因为温度不变,则K不变,根据图I中数据求出K的值.(1)方程A+方程B得到:
 ,所以该反应的反应热为:△H=△H1+△H2=-125-41=-166KJ/mol,
,所以该反应的反应热为:△H=△H1+△H2=-125-41=-166KJ/mol,
故答案为:-166KJ/mol;
(2)①乙苯与CO2反应的平衡常数表达式为:K=
c(C6H5CH=CH2)•c(CO)•c(H2O)
c(C6H5CH2CH3)c(CO2),故答案为:
c(C6H5CH=CH2)•c(CO)•c(H2O)
c(C6H5CH2CH3)c(CO2);
②a.反应前后体积不变,质量守恒,所以体系的密度始终不变,故不能用密度判断平衡,故a错误;
b.反应前后气体的体积不等,所以体系的压强改变,当压强不再变化即是平衡状态,故b正确;
c.c(CO2)与c(CO)的浓度是否相等,与反应的起始量和转化率有关,所以当c(CO2)=c(CO)时,不能说明已经达到平衡状态,故c错误;
d.消耗1molCO2为正速率,同时生成1molH2O也是正速率,都是正速率,二者始终相等,不能说明已经达到平衡状态,故d错误;
e.随着反应的进行CO2的体积分数逐渐减小,当CO2的体积分数保持不变,即是平衡状态,故e正确;
所以不能说明已达到平衡状态的是acd,故答案为:acd;
(3)①根据图I中可知,0-50min时乙苯的浓度变化为1.0mol/L-0.4mol/L=0.6mol/L,则其反应速率为[△c/t]=[0.6mol/L/50min]=0.012mol/(L•min);
故答案为:0.012mol/(L•min);
②根据图I中实验Ⅱ改变条件平衡不移动,而反应速率增大,所以改变的条件是加催化剂,故答案为:加催化剂;
③实验Ⅲ中改变条件,由图I可知乙苯的浓度增大,平衡逆移,所以苯乙烯体积分数V%随时间t增大而减小,其图形为: ;
;
故答案为: ;
;
(4)若实验I中将乙苯的起始浓度改为1.2mol/L,其他条件不变,平衡正移,由于二氧化碳的初始浓度没变,平衡移动引起的乙苯的浓度的减小量小于加入的乙苯引起的浓度增加量,所以乙苯的转化率减小;
根据图I中实验1可知,0-50min时乙苯的浓度变化为1.0mol/L-0.4mol/L=0.6mol/L
C6H5CH2CH3 +CO2 ⇌C6H5CH=CH2 +CO+H2O
起始浓度(mol/L):1.0 3.0 0 0 0
反应浓度(mol/L):0.6 0.6 0.6 0.6 0.6
平衡浓度(mol/L):0.4 2.4 0.6 0.6 0.6
则K=[0.6×0.6×0.6/0.4×2.4]=0.225,
故答案为:减小;0.225.点评:
本题考点: 化学平衡状态的判断;化学平衡的计算.
考点点评: 本题综合性较大,涉及化学平衡状态的判断、化学平衡常数、化学平衡影响因素、反应速率的计算等,注意(4)中平衡常数的计算依据图I中的实验1分析计算,题目难度较大.1年前查看全部
- 蛋白质分子量=氨基酸总分子量—脱水总分子量(—脱氢总原子量)=na—18(n—m);
 小芭果1年前1
小芭果1年前1 -
 秋雨梧桐888 共回答了14个问题
秋雨梧桐888 共回答了14个问题 |采纳率92.9%是水的相对分子质量1年前查看全部
大家在问
- 1设函数f(x)=[1/x],g(x)=ax2+bx(a,b∈R,a≠0),若y=f(x)的图象与y=g(x)的图象有且仅
- 2"垂手可得"中哪个字错了?垂手可得中哪个字错了啊?
- 3熔断器的作用是什么?
- 41/2,1/3,5/6、( ),12/6,( ).找规律?请写出它变化的规律是怎么样的
- 5文明礼仪伴我成长被 作文
- 6动物是人类的好朋友,请根据下图回答问题
- 7看一看的英文怎么写
- 81、x²+x-12、3x²-x-23、x²-(根号5)x+1
- 9已知1+2i是关于x的方程2x²+px+q=0的一个根,求实数p q的值.
- 10(2008•贵港)毛毛同学利用课外活动研究浮力的大小与哪些因素有关,她的实验过程是:在弹簧测力计的下端挂一石块,分别把石
- 11将CH4与Cl2在一密闭容器中混合,然后放在光亮的地方放置一段时间后,容器中可能存在的气体有( )
- 12一道简单的定语从句题目Helen was much kinder to her youngest child than
- 13怎么写奖状2位服务员拾金不昧,获得单位颁发的特别贡献的奖状,请问应当怎么写?
- 14英语翻译你知道美国人最爱吃什么吗?我还是最喜欢中国菜 它不仅多种多样 色泽鲜美而且还有营养 让我们永远吃不腻 那也是家的
- 15当你最好的朋友出卖你时,你怎么办?