在合成塔中合成氨要在高温、高压和有催化剂的条件下进行!
 ann1005035332022-10-04 11:39:541条回答
ann1005035332022-10-04 11:39:541条回答请问 各反应条件的作用?
温度(500°) 有什么作用?
压强(5*10~7Pa)有什么作用?
催化剂(铁触媒)呢?

已提交,审核后显示!提交回复
共1条回复
 离天 共回答了18个问题
离天 共回答了18个问题 |采纳率94.4%- 合成氨是放热反应,温度为500度,可以在较短的时间内使反应到平衡,温度过高会使产率降低,高压强可以加快反应,并且提高产率.但是过高的压强会使生产设备负担加大.催化剂可以加快反应速度,使反应很快达到平衡
- 1年前
相关推荐
- 改变可逆反应速率的方法合成塔中,下列方法中,不能加快合成氨反应速率的是A 向合成塔中充入更多的N2和H2 B 降低反应所
改变可逆反应速率的方法
合成塔中,下列方法中,不能加快合成氨反应速率的是
A 向合成塔中充入更多的N2和H2 B 降低反应所需的温度 C 加入催化剂.
A算不算对压强的增加? 仙女蚊子1年前1
仙女蚊子1年前1 -
 ruroru 共回答了21个问题
ruroru 共回答了21个问题 |采纳率90.5%选 B
A、正确.最直接的就是增加了反应物浓度,因为反应塔的体积是一定的,N2、H2越多,浓度就越大.你认为增大了压强也可以,因为N2、H2物质的量增加,体积不变,压强肯定增加.
B、错误.降低温度,速率减慢.
C、正确.催化剂可以加快反应速率1年前查看全部
- 28.(6分)在合成氨时,将l00mol氮气和300mol氢气混合后通过合成塔中的催化剂,一 定条件下达到平衡时,若
28.(6分)在合成氨时,将l00mol氮气和300mol氢气混合后通过合成塔中的催化剂,一 定条件下达到平衡时,若
28.(6分)在合成氨时,将l00mol氮气和300mol氢气混合后通过合成塔中的催化剂,一
定条件下达到平衡时,若测得混合气体中氨气的含量为25%.求平衡混合气体中N2的体积分数和H2的转化率各为多少?
请说出具体思路与步骤 千依百顺1年前1
千依百顺1年前1 -
 czf0754 共回答了23个问题
czf0754 共回答了23个问题 |采纳率91.3%设N2反应掉Xmol,
则反应后N2=(100-x)mol H2=(300-3x)mol NH3=2x mol
2x:(100-x+300-3x)=25:75=1:3
x=40mol 反应后共(100-x+300-3x+2x)=320mol
所以平衡中N2=40/320=12.5% H2转化率=3x/300=120/300=40%1年前查看全部
- 合成氨的反应问题:某厂在中,测得合成塔入口处气体N2;H2;NH3的体积比为6;18;1,出口处气体体积比为9;27;8
合成氨的反应问题:
某厂在中,测得合成塔入口处气体N2;H2;NH3的体积比为6;18;1,出口处气体体积比为9;27;8,则N2的转化率为多少?
 xujingtong1年前1
xujingtong1年前1 -
 灰天使雨沙 共回答了15个问题
灰天使雨沙 共回答了15个问题 |采纳率93.3%设入口处N2、H2、NH3的体积分别为6L、18L、1L,设N2转化率为x.
N2(g)+3H2(g) 2NH3(g)
1 3 2
6x 18x 12x
故(6-6x )∶(18-18x)∶(1+12x)=9∶27∶8
解得:x=25%.1年前查看全部
- 将一定量N2和H2(体积1:3)的混合气体通入合成塔后,达到平衡时,NH3体积分数为16%
将一定量N2和H2(体积1:3)的混合气体通入合成塔后,达到平衡时,NH3体积分数为16%
求平衡混合气体中N2的体积分数和H2转化率
 cbjnq1年前1
cbjnq1年前1 -
 hunterxxx 共回答了23个问题
hunterxxx 共回答了23个问题 |采纳率91.3%0.32除以1.16
设N2是a H2是3a 反应量是x 列式子求x1年前查看全部
- 氨在国民经济中占有重要地位。(1)工业合成氨时,合成塔中每产生1 mol NH 3 ,放出46.1 kJ的热量。① 工业
氨在国民经济中占有重要地位。
(1)工业合成氨时,合成塔中每产生1 mol NH 3 ,放出46.1 kJ的热量。
① 工业合成氨的热化学方程式是 。
② 已知:
N 2 (g) 2N (g)
2N (g)
H 2 (g) 2H (g)
2H (g)
则断开1 mol N-H键所需的能量是_______kJ。
(2)下表是当反应器中按n(N 2 ):n(H 2 )=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH 3 的物质的量分数随压强的变化曲线。
① 曲线a对应的温度是 。
② 关于工业合成氨的反应,下列叙述正确的是 (填字母)。
A. 及时分离出NH 3 可以提高H 2 的平衡转化率
B. 加催化剂能加快反应速率且提高H 2 的平衡转化率
C. 上图中M、N、Q点平衡常数K的大小关系是K(M)=" K(Q)" >K(N)
③ M点对应的H 2 转化率是 。 (3)氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。电池的总反应为:
(3)氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。电池的总反应为:
4NH 3 (g) + 3O 2 (g) = 2N 2 (g) + 6H 2 O(g)。
则该燃料电池的负极反应式是 。 fififriend1年前1
fififriend1年前1 -
 朱知山 共回答了20个问题
朱知山 共回答了20个问题 |采纳率90%1年前查看全部
- (2013•孝感二模)工业上在合成塔中采用下列反应合成甲醇:CO(g)+2H2(g)⇌CH3OH(g)△H=QkJ/mo
 (2013•孝感二模)工业上在合成塔中采用下列反应合成甲醇:CO(g)+2H2(g)⇌CH3OH(g)△H=QkJ/mol
(2013•孝感二模)工业上在合成塔中采用下列反应合成甲醇:CO(g)+2H2(g)⇌CH3OH(g)△H=QkJ/mol
(1)判断该可逆反应达到平衡状态的标志是(填字母序号)______.
a、生成CH3OH的速率与消耗CO的速率相等
b、混合气体的密度不变
c、混合气体的平均相对分子质量不变
d、CH3OH、CO、H2的浓度都不再发生变化
(2)如表所列数据是该可逆反应在不同温度下的化学平衡常数(K)
①由表中数据判断Q______0(填“>”、“<”或“=”)温度 250℃ 300℃ 350℃ K 2.041 0.270 0.012
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应后,达到平衡测得c(CO)=0.2mol•L-1,此时对应的温度为______;CO的转化率为______.
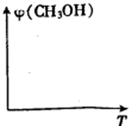
(3)请在图中画出压强不同,平衡时甲醇的体积分数(φ)随温度(T)变化的两条曲线(在曲线上标出P1、P2、,且p1<P2)
(4)要提高CO的转化率,可以采取的措施是______(填字母序号).
a、升温b、加入催化剂c、增加CO的浓度 d、通入H2加压账 e、通人惰性气体加压f、电离出甲醇
(5)已知一定条件下,CO与H2在催化剂的作用下生成5mol CH3OH时,能量的变化为454kJ.在该条件下,向容积相同的3个密闭容器中,按照甲、乙、丙三种不同的投料方式加人反应物,测得反应达到平衡时的有关数据如下:
下列说法正确的是______(填字母序号).容器 甲 乙 丙 反应物投入量 1mol CO 2mol H2 1mol CH3OH 2mol CH3OH 平
衡
时
数
据CH3OH的浓度(mol•L-1) c1 c2 c3 反应吸收或放出的能量(KJ) a b c 体系压强(Pa) P1 P2 P3 反应物转化率 α1 α2 α3
A、2c1>c3 B、a+b<90.8 C、2P2<P3D、α1+α3<1. biofxz1年前1
biofxz1年前1 -
 annzimber 共回答了29个问题
annzimber 共回答了29个问题 |采纳率96.6%解题思路:(1)a、CH3OH的生成速率与CO的消耗速率都表示正反应速率;
b、都为气体,容器的体积不变,混合气体的总质量不变,密度自始至终为定值;
c、混合气体的总质量不变,随反应进行,混合气体的总的物质的量减小,即平均相对分子质量减小,最后为定值;
d、可逆反应得到平衡,反应混合物的浓度、含量为定值;
(2)①由表中数据可知,温度越高,平衡常数越小,说明升高温度平衡向逆反应移动,升高温度平衡向吸热反应移动;
②计算平衡时CO的物质的量,n开始(CO)-n平衡(CO)=n转化(CO),利用转化率定义计算CO的转化率;
计算该温度下的平衡常数,对比表中数据判断温度;
(3)根据外界条件对化学平衡的影响,主要受温度和压强的影响可以作出图;
(4)要提高CO的转化率,平衡应向正反应移动,据此结合选项分析判断.注意若只增大CO浓度,平衡向正反应移动,CO的转化率降低;
(5)甲和乙为等效平衡,丙的起始物质的量为甲乙的双倍,根据压强对平衡的影响可以判断.(1)a、CH3OH的生成速率与CO的消耗速率都表示正反应速率,自始至终反应速率都按1:1进行,不能说明到达平衡,故a错误;b、都为气体,容器的体积不变,混合气体的总质量不变,密度自始至终为定值,不能说明可逆反应...
点评:
本题考点: 等效平衡;化学平衡的影响因素;化学平衡状态的判断;产物的百分含量随浓度、时间的变化曲线.
考点点评: 本题考查平衡状态判断、平衡移动、平衡常数、热化学方程式、化学平衡图象等,是化学反应速率与化学平衡的综合题目,难度不大,注重基础知识的考查.1年前查看全部
- (2012•闸北区一模)合成氨工业中原料气(H2、CO的混合气)在进入合成塔前常用醋酸亚铜氨溶液来吸收原料气中的CO:C
(2012•闸北区一模)合成氨工业中原料气(H2、CO的混合气)在进入合成塔前常用醋酸亚铜氨溶液来吸收原料气中的CO:Cu(NH3)2Ac(溶液)+CO(g)⇌Cu(NH3)2Ac•CO(溶液)+Q kJ(Q>0),吸收CO后的溶液经过适当处理又可以重新生成醋酸亚铜氨.
(1)写出该反应的平衡常数表达式K=c[Cu(NH3)2Ac•CO] c[Cu(NH3)2Ac]×c(CO) ;升高温度K值将______(选填“增大”“减小”“不变”).c[Cu(NH3)2Ac•CO] c[Cu(NH3)2Ac]×c(CO)
(2)必须除去原料气中CO的原因是______,欲充分吸收CO,适宜的条件是______(选填序号)
a.升高温度b.增大压强c.增大醋酸亚铜氨溶液浓度
吸收CO时,溶液中Cu(NH3)2Ac和Cu(NH3)2Ac•CO的浓度(mol/L)变化情况如下:
(3)前30min Cu(NH3)2Ac的平均反应速率为______;0min 30min 45min 60min 90min Cu(NH3)2Ac 2.0 1.2 0.9 0.9 1.8 Cu(NH3)2Ac•CO 0 a 1.1 1.1 0.2
(4)60min时改变的条件可能是______. silence91年前1
silence91年前1 -
 kimchel 共回答了28个问题
kimchel 共回答了28个问题 |采纳率82.1%解题思路:(1)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写;
该反应正反应是放热反应,升高温度平衡向逆反应方向移动,平衡常数减小;
(2)CO会导致催化剂中毒;根据平衡移动分析吸收CO的条件;
(3)计算Cu(NH3)2Ac浓度变化量,再根据v=[△c/△t]计算;
(4)由表中数据可知,45min时到达平衡,60min到90min,Cu(NH3)2Ac浓度增大0.9mol/L,Cu(NH3)2Ac•CO浓度减小0.9mol/L,等于化学计量数之比,且速率比0-30min快,应是改变条件平衡向逆反应方向移动,且加快反应速率,据此解答.(1)Cu(NH3)2Ac(溶液)+CO(g)⇌Cu(NH3)2Ac•CO(溶液)平衡常数表达式k=
c[Cu(NH3)2Ac•CO]
c[Cu(NH3)2Ac]×c(CO),该反应正反应是放热反应,升高温度平衡向逆反应方向移动,平衡常数减小,
故答案为:
c[Cu(NH3)2Ac•CO]
c[Cu(NH3)2Ac]×c(CO);减小;
(2)CO会导致催化剂中毒,必须除去原料气中CO,防止催化剂中毒;
a.该反应正反应为放热反应,升高温度向逆反应方向移动,不利于CO吸收,故a错误;
b.正反应为气体体积减小的反应,增大压强平衡向正反应方向移动,有利于CO吸收,故b正确;
c.增大醋酸亚铜氨溶液浓度,平衡向正反应方向移动,有利于CO吸收,故c正确;
故答案为:防止催化剂中毒;bc;
(3)由表中数据可知,前30min内Cu(NH3)2Ac浓度变化为2mol/L-1.2mol/L=0.8mol/L,故Cu(NH3)2Ac的平均反应速率为[0.8mol/L/30min]=0.027 mol/(L•min),
故答案为:0.027 mol/(L•min);
比较计算Cu(NH3)2Ac•CO浓度变化,再根据v=[△c/△t]计算;
(4)由表中数据可知,45min时到达平衡,60min到90min,Cu(NH3)2Ac浓度增大0.9mol/L,Cu(NH3)2Ac•CO浓度减小0.9mol/L,等于化学计量数之比,且速率比0-30min快,应是改变条件平衡向逆反应方向移动,且加快反应速率,正反应是体积减小的反应,不可能是增大压强,正反应是放热反应,故可能是升高温度,
故答案为:升高温度.点评:
本题考点: 化学平衡常数的含义;反应速率的定量表示方法;化学平衡的影响因素.
考点点评: 本题考查化学平衡常数的书写、化学平衡影响因素、反应速率的计算与影响因素等,难度中等,(4)为易错点,学生容易只考虑浓度变化,忽略速率问题导致错误.1年前查看全部
- 氨在国民经济中占有重要地位.(1)合成氨工业中,合成塔中每产生2mol NH3,放出92.2kJ热量.①工业合
氨在国民经济中占有重要地位.
(1)合成氨工业中,合成塔中每产生2mol NH3,放出92.2kJ热量.
①工业合成氨的热化学方程式是______.
②若起始时向一体积为4L的密闭容器内放入1mol N2和3mol H2,达平衡后体系放出的热量Q______92.2kJ (填“>”、“<”或“=”).若已知在该条件下平衡时N2的转化率为20%,则反应放出的热量为Q1 kJ,则Q1的数值为______;该温度下,该反应的化学平衡常数为______.(保留小数点后两位)
③已知:
试根据热化学方程式计算1mol N-H键断裂吸收的能量约等于______kJ.
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行合成氨反应:
N2(g)+3H2(g)⇌2NH3(g)其化学平衡常数K与温度t的关系如下表:
请完成下列问题.t/℃ 200 300 400 K K1 K2 0.5
①试比较K1.K2的大小,K1_______ K2(填写“>”.“=”或“<”).
②下列各项能作为判断该反应达到化学平衡状态的依据是_______(填序号字母):
a.容器内N2、H2、NH3的浓度之比为1:3:2b.v(N2)正=3v(H2)逆
c.容器内压强保持不变d.混合气体的密度保持不变
③在400℃时,当测得N2、H2和NH3的物质的量分别为2mol、1mol、2mol时,则此时该反应的v(N2)正_______ v(N2)逆(填写“>”.“=”或“<”),反应______达到平衡(填“是”或“否”). 海口泰华酒店1年前1
海口泰华酒店1年前1 -
 diqiganyong 共回答了18个问题
diqiganyong 共回答了18个问题 |采纳率77.8%解题思路:(1)①依据热化学方程式的书写方法分析书写;
②反应是可逆反应不能进行彻底,根据三行式计算K;
③依据反应焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量计算得到;
(2)①对于放热反应,温度升高,K减小;
②根据化学平衡状态的特征:正逆反应速率相等、各组分别浓度不变等来回答;
③化学平衡常数,正反应平衡常数和你反应的平衡常数互为倒数,根据浓度熵和平衡常数的关系来确定平衡的移动方向.(1)①合成塔中每生成2mol NH3,放出92.2kJ热量,依据热化学方程式写出,标注物质聚集状态和对应反应放出的热量写出热化学方程式为:N2(g)+3H2(g)=2NH3(g)△H=-92.2kJ/mol
故答案为:N2(g)+3H2(g)=2NH3(g)△H=-92.2kJ/mol;
②反应是可逆反应不能进行彻底,该温度下合成塔中放入1mol N2和3mol H2,生成的氨气小于1mol,故达平衡后放出的热量小于92.2 kJ;
N2(g)+3H2(g)=2NH3(g)△H=-92.2kJ/mol;
初始浓度:0.25 0.75 0
变化浓度:0.050.15 0.1 4.61kJ
平衡浓度:0.2 0.6 0.1
K=
0.12
0.2×0.63≈0.23,
故答案为:<;4.61;0.23;
③3H2+N2⇌2NH3,反应焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量=3×436+945.8-6×N-H键键能=-92.2,N-H键键能=391KJ;
故答案为:391;
(2)①该反应正反应是放热反应,升高温度,平衡向逆反应方向移动,生成物浓度减小,反应物浓度增大,所以K1>K2,故答案为:>;
②N2(g)+3H2(g)⇌2NH3(g)△H<0,反应是气体体积减小的放热反应,则
a、容器内各物质的浓度之比等于计量数之比,不能证明正逆反应速率相等,故a错误;
b、不同物质的正逆反应速率之比等于其计量数之比是平衡状态,3υ(N2)(正)=υ(H2)(逆)是平衡状态,故b错误;
c、容器内压强不变,气体的物质的量不变,该反应达平衡状态,故c正确;
d、如果是在密闭容器中反应,质量不变,体积不变,密度始终不变,故d错误;
故答案为:c;
③400℃时,得N2、H2和NH3的物质的量分别为2mol、1mol、2mol时,NH3和N2.H2的物质的量浓度分别为:4mol/L、4mol/L、2mol/L,400℃时,浓度商Qc=
42
4×23=0.5=K,说明达到了平衡状态,因此有v(N2)正=v(N2)逆,故答案为:=;是.点评:
本题考点: 热化学方程式;有关反应热的计算;化学平衡的影响因素.
考点点评: 本题考查反应热的计算、化学平衡常数及影响因素、意义,反应速率计算等,题目难度中等,注意化学平衡常数大小说明反应进行程度,与反应难易无关、与反应速率无关.1年前查看全部
- 高中化学中有哪些反应用到合成塔,吸收塔?它们的作用是什么
 tracywang1111年前1
tracywang1111年前1 -
 3886732 共回答了18个问题
3886732 共回答了18个问题 |采纳率100%工业合成氨中氨气的合成在合成塔中进行.
工业制硫酸、工业制硝酸中最后一步在吸收塔中进行,制硫酸是用98%的硫酸吸收三氧化硫得发烟硫酸,制硝酸是用水吸收二氧化氮得到硝酸.
它们的作用顾名思义工业上物质的合成在合成塔,物质被吸收在吸收塔.1年前查看全部
- 差量法总压强为 3.0×107 Pa 时,N2、H2 混合气体(体积之比为 1∶3)通入合成塔中
差量法总压强为 3.0×107 Pa 时,N2、H2 混合气体(体积之比为 1∶3)通入合成塔中
总压强为 3.0×107 Pa 时,N2、H2 混合气体(体积之比为 1∶3)通入合成塔中,反应达平衡时,压强降为 2.5×107 Pa,则平衡时混合气体中 NH3 的体积分数为( )
假设通入的N2的量为n,则通入的H2的量为3n,若反应了xmolN2,则:
N2 + 3H2 ⇋ 2NH3 Δn=-2
x 3x 2x -2x
根据题意V,T不变,由理想气体状态方程得:
反应前:P1V=n1RT n1=n+3n=4n
反应后:P2V=n2RT n2=n1+Δn= 4n-2x
两式相除得:n1/n2=P1/P2,即4n/(4n-2x)=3.0×107 /2.5×107 =1.2,所以n=3x
平衡时混合气体中 NH3 的体积分数=v(NH3)/V(总)=n(NH3)/n2=2x/(4n-2x)=2x/(12x-2x)=20%
为什么n2=n1+Δn= 4n-2x 海外文摘1年前1
海外文摘1年前1 -
 吉鸿之原来如此 共回答了13个问题
吉鸿之原来如此 共回答了13个问题 |采纳率100%首先注意下n和x的区别哈 一个是通入的量 一个是反应的量(因为是工业生产 通入的肯定都是过量的)
然后就是你的这个问题 其实很简单啊 设反应了xmol ,则根据方程式 反应后 气体比原来通入的少了2xmol,通入的是4n,所以反应后就是4n-2x mol 啊
这样解释懂了么?不懂欢迎追问~1年前查看全部
- 关于化学反应平衡的题总压强为3.0×10七次方Pa时,氮氢混合气体(体积比为1:3)通入合成塔,反应达到平衡时,压强降为
关于化学反应平衡的题
总压强为3.0×10七次方Pa时,氮氢混合气体(体积比为1:3)通入合成塔,反应达到平衡时,压强降为2.5×10七次方Pa,则平衡时混合气体中氨的体积分数为( )
A.35% B.30% C.25% D.20% 辣不刺喉1年前1
辣不刺喉1年前1 -
 glay705 共回答了19个问题
glay705 共回答了19个问题 |采纳率94.7%D.
N2+3H2==2NH3.
所以由上方程式可得,反应发生总气体体积会缩小一半.
有压强关系可得:反应前后总体积之比为6:5
由此可推知:有三分之一的气体反应,体积减少六分之一.
所以平衡时生成物体积分数为五分之一.
因为这是反应平衡的题,所以反应不是完全进行,有一个平衡度.1年前查看全部
- 工业制氯化氢时,合成塔的燃烧器内,中心管道中通入的气体是
 董鄂-珊瑚1年前1
董鄂-珊瑚1年前1 -
 江湖游子 共回答了17个问题
江湖游子 共回答了17个问题 |采纳率88.2%工业:氯碱工业:2NaCl+2H2O==通电==2NaOH+H2↑+Cl2↑
H2+Cl2==点燃==2HCl
中心管道通入的气体:H2+Cl21年前查看全部
- 氨在国民经济中占有重要地位.(1)合成氨工业中,合成塔中每生成2mol NH3,放出92.2kJ热量.①工业合
氨在国民经济中占有重要地位.
(1)合成氨工业中,合成塔中每生成2mol NH3,放出92.2kJ热量.
①工业合成氨的热化学方程式是______.
②若起始时向容器内放入2mol N2 和6mol H2,达平衡后放出的热量为Q,则Q______(填“>”、“<”或“=”)184.4kJ.
③已知:(如图1所示)
1mol N-H键断裂吸收的能量约等于______kJ.
(2)工业生产尿素的原理是以NH3 和CO2 为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3(g)+CO2(g)⇌CO(NH2)2(l)+H20(l),该反应的平衡常数和温度的关系如表所示:
①△H______(填“>”、“<”或“=”)0.T/℃ 165 175 185 195 K 111.9 74.1 50.6 34.8
②在一定温度和压强下,若原料气中的NH3 和CO2 的物质的量之比(氨碳比)
=x,碳比(x)与CO2 平衡转化率(α)的关系如图2所示.α 随着x增大而增大的原因是______.n(NH3) n(CO2)
③图2中的B点处,NH3的平衡转化率为______. cyy35001831年前1
cyy35001831年前1 -
 银色夜空 共回答了16个问题
银色夜空 共回答了16个问题 |采纳率87.5%解题思路:(1)①依据热化学方程式的书写方法分析书写;
②反应是可逆反应不能进行彻底
③依据反应焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量计算得到;
(2)①依据平衡常数随温度变化分析判断反应吸热放热;
②增大反应物浓度,平衡正向进行;
③依据x含义和图象数据分析结合化学方程式换算氨气转化率;(1)①合成塔中每生成2mol NH3,放出92.2kJ热量,依据热化学方程式写出,标注物质聚集状态和对应反应放出的热量写出热化学方程式为:N2(g)+3H2(g)=2NH3(g)△H=-92.2kJ/mol
故答案为:N2(g)+3H2(g)=2NH3(g)△H=-92.2kJ/mol
②反应是可逆反应不能进行彻底,该温度下合成塔中放入2mol N2和6mol H2,达平衡后放出的热量小于184.4 kJ;
故答案为:<;
③3H2+N2⇌2NH3,反应焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量=3×436+945.8-6×N-H键键能=-92.2,N-H键键能=391KJ;
故答案为:391;
(2)①平衡常数随温度升高减小,说明正反应为放热反应,△H<0,故答案为:<;
②2NH3 (g)+CO2 (g)⇌CO(NH2)2 (l)+H2O (l),图象分析判断,增大氨气浓度平衡正向进行,转化率增大,故答案为:c(NH3)增大,平衡正向移动;
③B点处x=4,原料气中的NH3和CO2的物质的量之比为4,二氧化碳转化率为64%,假设氨气为4mol,二氧化碳为1mol,则反应的二氧化碳为0.64mol,
依据化学方程式2NH3(g)+CO2(g)⇌CO(NH2)2(l)+H2O(l)反应的氨气为1.28mol,
NH3的平衡转化率=[1.28mol/4mol]×100%=32%;
故答案为:32%;点评:
本题考点: 热化学方程式;化学能与热能的相互转化;化学平衡的影响因素;化学平衡的计算.
考点点评: 本题考查了化学能与热能关系分析判断,焓变计算应用,热化学方程式书写,注意可逆反应的判断,题目难度中等1年前查看全部
- 氨在国民经济中占有重要地位.(1)合成氨工业中,合成塔中每产生2mol NH3,放出92.2kJ热量.①工业合
氨在国民经济中占有重要地位.
(1)合成氨工业中,合成塔中每产生2mol NH3,放出92.2kJ热量.
①工业合成氨的热化学方程式是______.
②若起始时向容器内放入2mol N2和6mol H2,达平衡后放出的热量为Q,则Q(填“>”、“<”或“=”)______184.4kJ.
③已知: 1mol N-H键断裂吸收的能量约等于______ kJ.
1mol N-H键断裂吸收的能量约等于______ kJ.
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3(g)+CO2(g)⇌CO(NH2)2(l)+H2O(l),该反应的平衡常数和温度关系如表:
①焓变△H(填“>”、“<”或“=”)______0.T/℃ 165 175 185 195 K 111.9 74.1 50.6 34.8
(3)已知:
①N2(g)+O2(g)═2NO(g)△H1=+180kJ•mol-1
②N2(g)+3H2(g)⇌2NH3(g)△H2=-92.4kJ•mol-1
③2H2(g)+O2(g)═2H2O(g)△H3=-483.6kJ•mol-1
氨的催化氧化反应的热化学方程式为______. s8833-331年前1
s8833-331年前1 -
 梦想十月 共回答了19个问题
梦想十月 共回答了19个问题 |采纳率94.7%解题思路:(1)①依据热化学方程式的书写方法分析书写;
②反应是可逆反应不能进行彻底;
③依据反应焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量计算得到;
(2)依据平衡常数随温度变化分析判断反应吸热放热;
(3)依据热化学方程式和盖斯定律计算得到所需热化学方程式.(1)①合成塔中每生成2mol NH3,放出92.2kJ热量,依据热化学方程式写出,标注物质聚集状态和对应反应放出的热量写出热化学方程式为:N2(g)+3H2(g)=2NH3(g)△H=-92.2kJ/mol
故答案为:N2(g)+3H2(g)=2NH3(g)△H=-92.2kJ/mol;
②反应是可逆反应不能进行彻底,该温度下合成塔中放入2mol N2和6mol H2,生成的氨气小于2mol,故达平衡后放出的热量小于184.4 kJ;
故答案为:<;
③3H2+N2⇌2NH3,反应焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量=3×436+945.8-6×N-H键键能=-92.2,N-H键键能=391KJ;
故答案为:391;
(2)平衡常数随温度升高减小,说明正反应为放热反应,△H<0,故答案为:<;
(3)已知:
①N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
②N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ/mol
③2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol
由盖斯定律③×3-②×2+①×2得到热化学方程式:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905.0 kJ/mol,
故答案为:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905.0 kJ/mol.点评:
本题考点: 反应热和焓变;热化学方程式.
考点点评: 本题考查了化学能与热能关系分析判断、盖斯定律、温度对化学平衡常数的影响、热化学方程式书写,题目难度中等.1年前查看全部
- 氮气及含氮的化合物在国民经济中占有重要地位。合成氨工业中,合成塔中每产生2 mol NH 3 ,放出92.4 kJ热量。
氮气及含氮的化合物在国民经济中占有重要地位。合成氨工业中,合成塔中每产生2 mol NH 3 ,放出92.4 kJ热量。
(1)若起始时向容器内放入2 mol N 2 和6 mol H 2 ,达平衡后放出的热量为Q,则Q_____184.8kJ(填“>”、“<”或“=”) 。 一定条件下,在密闭恒容的容器中,能表示反应达到化学平衡状态的是____________。
a.3v 逆 (N 2 )=v 正 (H 2 ) b.2v 正 (H 2 )= v 正 (NH 3 )
c.混合气体密度保持不变 d.c(N 2 ):c(H 2 ):c(NH 3 )=1:3:2
工业生产尿素的原理是以NH 3 和CO 2 为原料合成尿素[CO(NH 2 ) 2 ],反应的化学方程式为2NH 3 (g)+ CO 2 (g) CO(NH 2 ) 2 (l) + H 2 O (l)。
CO(NH 2 ) 2 (l) + H 2 O (l)。
(2)在一定温度和压强下,若原料气中的NH 3 和CO 2 的物质的量之比(氨碳比) ,右图是氨碳比(x)与CO 2 平衡转化率(α)的关系。α随着x增大而增大的原因是___________。
,右图是氨碳比(x)与CO 2 平衡转化率(α)的关系。α随着x增大而增大的原因是___________。
(3)图中的B点处,NH 3 的平衡转化率为_______。
已知:3Cl 2 +2NH 3 →N 2 +6HCl――① 3Cl 2 +8NH 3 →N 2 +6NH 4 Cl――②
(4)完成并配平下列氧化还原反应方程式,再标出电子转移的方向和数目:
12Cl 2 +15NH 3 → ――③
(5)反应③中的还原剂是 ,还原产物是 。
(6)若按③反应后产生气体9.408L(标准状况),则被氧化的气体的物质的量是 mol。 an_la1年前1
an_la1年前1 -
 xiaozhulaile 共回答了12个问题
xiaozhulaile 共回答了12个问题 |采纳率66.7%1年前查看全部
- (2013•上海模拟)合成气经压缩升温后进入10m3的甲醇合成塔中,在催化剂的作用下进行甲醇合成,主要反应是:
(2013•上海模拟)合成气经压缩升温后进入10m3的甲醇合成塔中,在催化剂的作用下进行甲醇合成,主要反应是:
2H2(g)+CO(g)⇌CH3OH(g)+181.6kJ.
已知:某温度下(设温度为T1℃)此反应的平衡常数为160.
(1)此温度下,在密闭容器中加入一定量的CO和H2,反应到某时刻测得各组分的浓度如下表:
比较此时正、逆反应速率的大小:v正______v逆 (填“>”、“<”或“=”);若加入与上述同样多的CO和H2,在T2℃条件下反应,10min后达平衡时c(H2)=0.4mol/L,则该时间内反应速率v(CH3OH)=______ mol/(L•min);物质 H2 CO CH3OH 浓度/(mol/L) 0.2 0.1 0.4
(2)在一定条件的密闭恒容的容器中,下列式子或文字描述能表示上述反应达到化学平衡状态的是______(选填序号);
a.2v逆(CO)=v正(H2) b.c(CO):c(H2):c(CH3OH)=1:2:1
c.混合气体的平均式量保持不变d.混合气体的密度保持不变
(3)上述反应达到平衡后,下列说法正确的是______(选填序号);
a.其他条件不变,增大压强,平衡常数K<160
b.其他条件不变,温度升高,平衡常数K会减小
c.其他条件不变,若同比例地增加CO和H2的量平衡不会发生移动
d.其他条件不变,增大甲醇的物质的量,正反应速率也会随之逐渐增大
(4)寻找合适的催化剂来改善上述合成甲醇的条件一直是研究课题.现分别对X、Y、Z三种催化剂进行如下实验(其他条件均相同):
①X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂并简述理由:______. 黄-蓉1年前1
黄-蓉1年前1 -
 kk的猫爪 共回答了28个问题
kk的猫爪 共回答了28个问题 |采纳率92.9%解题思路:(1)计算此时的浓度商Qc,与平衡常数比较,判断反应进行的方向,据此解答;依据图表数据计算起始量,结合三段式列式计算,根据甲氢气的浓度变化计算甲醇的浓度变化量,再根据v=[△c/△t]计算v(CH3OH);
(2)依据反应特征和平衡标志分析,正逆反应速率相同,各组分含量保持不变分析;
(3)a.其他条件不变,增大压强,平衡常数不变;
b.其他条件不变,温度升高,反应是放热反应,平衡逆向进行,平衡常数K会减小;
c.其他条件不变,若同比例地增加CO和H2的量,相当于增大压强,平衡正向进行;
d.其他条件不变,增大甲醇的物质的量,平衡逆向进行,正逆反应速率也会随之逐渐增大;
(4)该反应正反应为放热反应,应选择催化活性高、速度快、反应温度较低;(1)由表中数据可知,10min时氢气的浓度为0.2mol/L、CO的浓度为0.1mol/L、甲醇的浓度为0.4mol/L,则此时的浓度商Qc=[0.4
0.22×0.1=100,小于平衡常数160,故反应向正反应方向进行,故V正>V逆,依据图表计算起始量;
2H2(g)+CO(g)⇌CH3OH(g)
起始量(mol/L) 1 0.5 0
变化量(mol/L) 0.80.4 0.4
T4时(mol/L) 0.2 0.1 0.4
若加入CO、H2后,在T5℃反应10min达到平衡,c(H2)=0.4mol•L-1,由表中数据可知,l0min内氢气的浓度变化量为0.6mol/L,故甲醇的浓度变化量为0.3mol/L,故v(CH3OH)=
0.3mol/L/10min]=0.03mol/(L•min),
故答案为:>;0.03;
(2)2H2(g)+CO(g)⇌CH3OH(g)+181.6kJ,反应是气体体积减小的放热反应
a.反应速率之比等于化学方程式计量数之比,2v逆(CO)=v正(H2),说明一氧化碳正逆反应速率相同,说明反应达到平衡状态,故a正确;
b.c(CO):c(H2):c(CH3OH)=1:2:1,只能说明浓度比等于反应比,和起始量变化量有关,不能说明反应达到平衡,故b错误;
c.反应前后气体物质的量减小,质量不变,混合气体的平均式量保持不变,说明反应达到平衡状态,故c正确;
d.反应前后气体质量和体积不变,混合气体的密度始终保持不变,不能说明反应达到平衡状态,故d错误;
故答案为:a c;
(3)a.其他条件不变,增大压强,平衡常数不变,故a错误;
b.其他条件不变,温度升高,反应是放热反应,平衡逆向进行,平衡常数K会减小,故b正确;
c.其他条件不变,若同比例地增加CO和H2的量,相当于增大压强,平衡正向进行,故c错误;
d.其他条件不变,增大甲醇的物质的量,增大生成物浓度,平衡逆向进行,正逆反应速率也会随之逐渐增大,故d正确;
故答案为:b d;
(4)该反应正反应为放热反应,应选择催化活性高、速度快、反应温度较低,故选择Z,
故答案为:Z;催化活性高、速度快、反应温度较低:点评:
本题考点: 化学平衡的影响因素;反应速率的定量表示方法;化学平衡状态的判断.
考点点评: 本题考查化学平衡常数、化学平衡影响因素、反应速率计算、反应中能量变化等,难度中等,注意理解掌握平衡常数和平衡标志的理解应用.1年前查看全部
- 氨在国民经济中占有重要地位.(1)合成氨工业中,合成塔中每生成2mol NH 3 ,放出92.2kJ热量.①工
氨在国民经济中占有重要地位.
(1)合成氨工业中,合成塔中每生成2mol NH 3 ,放出92.2kJ热量.
①工业合成氨的热化学方程式是______.
②若起始时向容器内放入2mol N 2 和6mol H 2 ,达平衡后放出的热量为Q,则Q______(填“>”、“<”或“=”)184.4kJ.
③已知:(如图1所示)
1mol N-H键断裂吸收的能量约等于______kJ.
(2)工业生产尿素的原理是以NH 3 和CO 2 为原料合成尿素[CO(NH 2 ) 2 ],反应的化学方程式为2NH 3 (g)+CO 2 (g)⇌CO(NH 2 ) 2 (l)+H 2 0(l),该反应的平衡常数和温度的关系如表所示:
①△H______(填“>”、“<”或“=”)0.T/℃ 165 175 185 195 K 111.9 74.1 50.6 34.8
②在一定温度和压强下,若原料气中的NH 3 和CO 2 的物质的量之比(氨碳比)
=x ,碳比(x)与CO 2 平衡转化率(α)的关系如图2所示.α 随着x增大而增大的原因是______.n(N H 3 ) n(C O 2 )
③图2中的B点处,NH 3 的平衡转化率为______. destroysun1年前1
destroysun1年前1 -
 姑苏ee 共回答了19个问题
姑苏ee 共回答了19个问题 |采纳率89.5%(1)①合成塔中每生成2mol NH 3 ,放出92.2kJ热量,依据热化学方程式写出,标注物质聚集状态和对应反应放出的热量写出热化学方程式为:N 2 (g)+3H 2 (g)=2NH 3 (g)△H=-92.2kJ/mol
故答案为:N 2 (g)+3H 2 (g)=2NH 3 (g)△H=-92.2kJ/mol
②反应是可逆反应不能进行彻底,该温度下合成塔中放入2mol N 2 和6mol H 2 ,达平衡后放出的热量小于184.4 kJ;
故答案为:<;
③3H 2 +N 2 ⇌2NH 3 ,反应焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量=3×436+945.8-6×N-H键键能=-92.2,N-H键键能=391KJ;
故答案为:391;
(2)①平衡常数随温度升高减小,说明正反应为放热反应,△H<0,故答案为:<;
②2NH 3 (g)+CO 2 (g)⇌CO(NH 2 ) 2 (l)+H 2 O (l),图象分析判断,增大氨气浓度平衡正向进行,转化率增大,故答案为:c(NH 3 )增大,平衡正向移动;
③B点处x=4,原料气中的NH 3 和CO 2 的物质的量之比为4,二氧化碳转化率为64%,假设氨气为4mol,二氧化碳为1mol,则反应的二氧化碳为0.64mol,
依据化学方程式2NH 3 (g)+CO 2 (g)⇌CO(NH 2 ) 2 (l)+H 2 O(l)反应的氨气为1.28mol,
NH 3 的平衡转化率=
1.28mol
4mol ×100%=32%;
故答案为:32%;1年前查看全部
- 氨在国民经济中占有重要地位.(1)工业合成氨时,合成塔中每产生1mol NH3,放出46.1kJ的热量.①工业
氨在国民经济中占有重要地位.

(1)工业合成氨时,合成塔中每产生1mol NH3,放出46.1kJ的热量.①工业合成氨的热化学方程式是______.②已知:N2(g)
2N(g) H2(g)436.0kJ•mol−1
2H(g)则断开1mol N-H键所需的能量是______kJ.945.8kJ•mol−1
(2)如图1是当反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线.①曲线a对应的温度是______.②关于工业合成氨的反应,下列叙述正确的是______(填字母).A.及时分离出NH3可以提高H2的平衡转化率 B.加催化剂能加快反应速率且提高H2的平衡转化率 C.上图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N)
③M点对应的H2转化率是______.
(3)氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料,如图2.电池的总反应为:4NH3(g)+3O2(g)═2N2(g)+6H2O(g).则该燃料电池的负极反应式是______. 半透明vv1年前1
半透明vv1年前1 -
 孟令辉 共回答了22个问题
孟令辉 共回答了22个问题 |采纳率90.9%解题思路:(1)①先求出此反应的焓变,根据热化学方程式的书写规则再写出热化学方程式;
②根据反应热等于反应物的总键能减去生成物的总键能计算;
(2)①依据反应是放热反应,温度升高,平衡逆向进行,氨气的含量减小;
②依据化学平衡影响因素的分析,普华永道原理的应用判断选项;
③M点氨气的物质的量为60%,剩余40%,按照反应物反应比1:3,投料剩余氢气30%,依据化学方程式计算可知反应的氢气90%.依据转化率概念计算;
(3)依据氧化还原反应元素化合价变化分析判断,电池中负极上是氨气失电子生成氮气的反应;(1)①反应物总能量大于生成物总能量,应为放热反应,生成1mol氨气放出46.1kJ热量,则反应的热化学方程式为N2(g)+3H2(g)⇌2NH3(g)△H=-92.2kJ/mol;
故答案为:N2(g)+3H2(g)⇌2NH3(g)△H=-92.2kJ/mol;
②反应热等于反应物的总键能减去生成物的总键能,设N-H的键能为x,则945.8+3×436-6x=-92.2,x=391;
故答案为:391;
(2)①合成氨的反应为放热反应,反应温度越高,越不利于反应的进行,曲线a的氨气的物质的量分数最高,其反应温度对应相对最低,所以a曲线对应温度为200°C;
故答案为:200°C;
②A.及时分离出NH3,可以使平衡正向进行,可以提高H2的平衡转化率,故A正确;
B.加催化剂能加快反应速率,但不能提高H2的平衡转化率,故B错误;
C.平衡常数与温度有关,与其他条件无关,同一温度下的平衡常数相同,反应是放热反应,温度越高平衡常数越小,上图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N),故C正确;
故答案为:AC.
③在M点氨气的物质的量为60%,剩余40%,因为反应器中按n(N2):n(H2)=1:3投料,故剩余氢气物质的量为30%,因为N2(g)+3H2(g)⇌2NH3(g),即发生反应的氢气物质的量90%,所以M点对应氢气的转化率=[90/90+30]×100%=75%;
故答案为:75%;
(3)原电池中负极失电子,氨气中氮元素化合价升高,发生氧化反应,该燃料电池的负极电极反应为:2NH3-6e-+6OH-=N2+6H2O;
故答案为:2NH3-6e-+6OH-=N2+6H2O;点评:
本题考点: 热化学方程式;常见化学电源的种类及其工作原理;化学平衡的影响因素.
考点点评: 本题考查了热化学方程式和盖斯定律的分析应用,化学反应能量变化,平衡常数的影响因素分析,原电池原理的理解和电极反应的书写方法,题目难度中等.1年前查看全部
- 氨在国民经济中占有重要地位.(1)合成氨工业中,合成塔中每产生2mol NH3,放出92.2kJ热量.工业合成
 氨在国民经济中占有重要地位.
氨在国民经济中占有重要地位.
(1)合成氨工业中,合成塔中每产生2mol NH3,放出92.2kJ热量.工业合成氨的热化学方程式是N2(g)+3H2(g)⇌2NH3(g)△H=-92.2 kJ•mol-1N2(g)+3H2(g)⇌2NH3(g)△H=-92.2 kJ•mol-1.
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3(g)+CO2(g)⇌CO(NH2)2(l)+H2O(l),该反应的平衡常数和温度关系如下:
①△H(填“>”、“<”或“=”)______0.T/℃ 165 175 185 195 K 111.9 74.1 50.6 34.8
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)
═x,如图所示是氨碳比(x)与CO2平衡转化率(α%)的关系.α随着x增大而增大的原因是______.n(NH3) n(CO2)
③图中的B点处,NH3的平衡转化率为______. along0211年前1
along0211年前1 -
 忧郁小调 共回答了12个问题
忧郁小调 共回答了12个问题 |采纳率91.7%解题思路:(1)根据热化学方程式的意义和书写方法来回答判断;
(2)①依据平衡常数随温度变化分析判断反应吸热放热;
②增大反应物浓度,平衡正向进行;
③依据x含义和图象数据分析结合化学方程式换算氨气转化率.(1)合成塔中每产生2mol NH3,放出92.2kJ热量,即N2(g)+3H2(g)⇌2NH3(g)△H=-92.2 kJ•mol-1,故答案为:N2(g)+3H2(g)⇌2NH3(g)△H=-92.2 kJ•mol-1;
(2)①平衡常数随温度升高减小,说明正反应为放热反应,△H<0,故答案为:<;
②2NH3 (g)+CO2 (g)⇌CO(NH2)2 (l)+H2O (l),图象分析判断,增大氨气浓度平衡正向进行,二氧化碳转化率增大,
故答案为:NH3的量增大,平衡正向移动,则增大CO2的转化率;
③B点处x=4,原料气中的NH3和CO2的物质的量之比为4,二氧化碳转化率为64%,假设氨气为4mol,二氧化碳为1mol,则反应的二氧化碳为0.64mol,
依据化学方程式2NH3(g)+CO2(g)⇌CO(NH2)2(l)+H2O(l)反应的氨气为1.28mol,
NH3的平衡转化率=[1.28mol/4mol]×100%=32%,
故答案为:32%.点评:
本题考点: 转化率随温度、压强的变化曲线;化学平衡建立的过程.
考点点评: 本题考查了化学能与热能关系分析判断,热化学方程式书写,化学平衡移动原理,题目难度中等.1年前查看全部
- 接触法制硫酸中没有涉及的设备是()A沸腾炉B合成塔C吸收塔D接触室
 黎明的黎1年前1
黎明的黎1年前1 -
 ff患 共回答了24个问题
ff患 共回答了24个问题 |采纳率87.5%接触法制硫酸的主要过程分为3步:
造气:原料(黄铁矿等)经处理后进行煅烧氧化,生成SO2.此反应在沸腾炉中进行.
氧化:SO2和O2经催化氧化生成SO3.此反应在接触室进行.
吸收:SO3用浓硫酸吸收,然后稀释得到产品.此过程在吸收室进行.
因此选B,没有涉及合成塔1年前查看全部
- 将一定量的氮气和氢气(体积比1:3)的混合气体充入合成塔,反应达到平衡后,氨气的体积分数为16% ,则平衡混合气体中氮气
将一定量的氮气和氢气(体积比1:3)的混合气体充入合成塔,反应达到平衡后,氨气的体积分数为16% ,则平衡混合气体中氮气的体积分数为多少?
氢气的转化率为多少? 20060614CN1年前1
20060614CN1年前1 -
 断点-pig 共回答了16个问题
断点-pig 共回答了16个问题 |采纳率75%氮气的体积分数为21%
氢气的转化率为24/871年前查看全部
- 氨的合成中算氢气的转化率.在一定温度和压强下,将氢气和氮气按3:1(体积比)混合后进入合成塔,反应达到平衡时,平衡混合气
氨的合成中算氢气的转化率.
在一定温度和压强下,将氢气和氮气按3:1(体积比)混合后进入合成塔,反应达到平衡时,平衡混合气中氨气的体积分数为15%,此时氨气的转化率为多少?
0.75,错!
要具体过程! wangshengdi20051年前1
wangshengdi20051年前1 -
 wcndr 共回答了18个问题
wcndr 共回答了18个问题 |采纳率88.9%设反应掉了N2有x,则生成氨气2x,氢气反映了3x.有等式
2x÷((3-3x)+(1-x)+2x)=15% x=3/13,即生成氨气3/13(与原来一体积的体积比).所以氢气生成氨气的转化率为:
(3-3*3/13)÷3=10/13
氮气生成氨气的转化率为:
(1-3/13)÷1=10/131年前查看全部
- 在合成氨时,将1体积氮气和3体积H2混合后通过合成塔中的催化剂,若从塔中导出的混合气体中,氨气的体积分数为12%,求N2
在合成氨时,将1体积氮气和3体积H2混合后通过合成塔中的催化剂,若从塔中导出的混合气体中,氨气的体积分数为12%,求N2和H2的体积分数各为多少.
 yuanju2161年前1
yuanju2161年前1 -
 liaoyujian 共回答了16个问题
liaoyujian 共回答了16个问题 |采纳率100%解题思路:反应后混合气体为N2、H2、NH3,合成氨中N2、H2按体积比1:3反应,而二者化学计量数之比为1:3,故反应后混合气体中N2、H2的体积之比为1:3,根据NH3的体积分数计算反应后混合气体中N2、H2的总体积分数,进而计算N2和H2的体积分数.发生反应:N2+3H2
催化剂
.
高温高压2NH3,反应后混合气体为N2、H2、NH3,合成氨中N2、H2按体积比1:3反应,而二者化学计量数之比为1:3,故反应后混合气体中N2、H2的体积之比为1:3,
NH3的体积分数为12%,则反应后混合气体中N2、H2的总体积分数为1-12%=88%,
反应后混合气体中N2的体积分数为88%×[1/4]=22%,H2的体积分数为88%-22%=66%,
答:反应后N2的体积分数为22%,H2的体积分数为66%.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查化学方程式计算,难度不大,注意充分利用方程式判断反应后氮气与氢气的体积之比.1年前查看全部
- 将一体机氮气和三体积氢气混合后通过合成塔中的催化剂,若从塔中导出的混合气体中,氨气的体积分数为12%,
将一体机氮气和三体积氢气混合后通过合成塔中的催化剂,若从塔中导出的混合气体中,氨气的体积分数为12%,
若从塔中导出的混合气体中,氨气的体积分数为12%,求氮气和氢气的体积分数各为多少? 1108aj1年前1
1108aj1年前1 -
 石门浮生 共回答了17个问题
石门浮生 共回答了17个问题 |采纳率100%一体机氮气和三体积氢气设氮气为a则氢气为3a
N2 + 3H2 === 2NH3
起: a 3a 0
变: x 3x 2x
终: a-x 3a-3x 2x
2x/(a-x + 3a-3x +2x) =12%
x=0.27a
氮气体积分数: (a-0.27a)/(a-0.27a+3a-3*0.27a+2*0.27a)=21%
氢气的体积分数:(3a-0.27a*3)/(a-0.27a+3a-3*0.27a+2*0.27a)=63%1年前查看全部
- 合成氨时,把1体积N2和3体积H2混合后,通过合成塔,若合成塔排出气体中氨占体积的15%
合成氨时,把1体积N2和3体积H2混合后,通过合成塔,若合成塔排出气体中氨占体积的15%
求H2所占的体积分数及N2的平衡转化率(体积均在同温同压下测定.) loter1年前1
loter1年前1 -
 juanna1029 共回答了14个问题
juanna1029 共回答了14个问题 |采纳率100%H2所占的体积分数63.8%,N2的平衡转化率是26%
N2 +3H22NH3
化学计量数 1 3 2
起始 1 3 0
变化 x 3x 2x
平衡 1-x 3-3x 2x
平衡时气体体积是 1-x+3-3x+2x=4-2x
2x/(4-2x)=15%
x=0.26
H2所占的体积分数是(3-3x)/(4-2x)=(3-0.26*3)/(4-0.26*2)=63.8%
N2的平衡转化率是0.26/1*100%=26%1年前查看全部
- 合成氨工业对国民经济和社会发展具有重要的意义. 合成塔中发生反应为:N2(g)+3H2(g)⇌2NH3(g)△
 合成氨工业对国民经济和社会发展具有重要的意义. 合成塔中发生反应为:N2(g)+3H2(g)⇌2NH3(g)△H<0
合成氨工业对国民经济和社会发展具有重要的意义. 合成塔中发生反应为:N2(g)+3H2(g)⇌2NH3(g)△H<0
(1)工业生产时,制取氢气的一个反应为:CO(g)+H2O(g)⇌CO2(g)+H2(g)△H>0
①t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol•L-1.该温度下此反应的平衡常数K=______.
②保持温度不变,向上述平衡体系中再加入0.1mol CO,当反应重新建立平衡时,水蒸气的总转化率
α(H2O)______.
(2)下表为不同温度下合成氨反应的平衡常数.由表可推知T1______573K(填“>”、“<”或“=”).
(3)673K,30MPa下n(NH3) 和n(H2) 随时间变化的关系如下图所示依据上图,下列有关叙述正确的是(填写序号)______.T/K T1 573 T2 K 1.00×107 2.45×105 1.88×103
A.c点表示n(NH3)和n (H2)相等
B.c点表示NH3生成速率与NH3分解速率相同
C.e点和d点时反应的平衡常数相同
D.c点时正反应速率大于逆反应速率
(4)用NO2溶于水制硝酸:3NO2+H2O⇌2HNO3+NO.从生产流程看,吸收塔中需要补充空气,其原因用化学平衡移动的理论进行解释是______. fangfang99771年前1
fangfang99771年前1 -
 湖底草生长 共回答了14个问题
湖底草生长 共回答了14个问题 |采纳率92.9%解题思路:(1)①利用三段式计算出平衡时各物质的量的平衡浓度,代入平衡常数表达式计算.
②保持温度不变,平衡常数不变.向上述平衡体系中再加入0.1mol CO,可以等效为开始加入0.3molCO,0.3molH2O,
令参加反应的水的物质的量为xmol,利用三段式用x表示出各物质的浓度变化量、平衡时各物质的平衡浓度,代入平衡常数计算x值,再利用转化率定义计算.
(2)合成氨正反应是放热反应,升高温度平衡逆反应进行,平衡常数减小,即温度越高平衡常数越小.
(3)A.由图可知c点n(NH3)和n (H2)相等.
B.由图可知c点后氨气物质的量增大,氢气的物质的量减小,c点未处于平衡状态,平衡向正反应进行.
C.平衡常数只受温度影响,温度相同,平衡常数相同.
D.由图可知c点后氨气物质的量增大,氢气的物质的量减小,c点未处于平衡状态,平衡向正反应进行.
(4)充入空气,NO转化为NO2,降低NO的浓度,增大NO2的浓度,平衡向正反应移动,有利于提高原料利用率.(1)①对于可逆反应:CO(g)+H2O(g)
 CO2(g)+H2(g)
CO2(g)+H2(g)
起始物质的量浓度(mol/L)0.20.3 0 0
转化物质的量浓度(mol/L)0.120.120.120.12
平衡物质的量浓度(mol/L)0.080.180.12 0.12
所以该温度下此反应的平衡常数K=[0.12×0.12/0.08×0.18]=1.
故答案为:1.
②保持温度不变,平衡常数不变,向上述平衡体系中再加入0.1mol CO,可以等效为开始加入0.3molCO,0.3molH2O,
对于可逆反应:CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
起始物质的量浓度(mol/L)0.30.3 0 0
转化物质的量浓度(mol/L)x x x x
平衡物质的量浓度(mol/L)0.3-x 0.3-x x x
所以[x•x
(0.3−x)•(0.3−x)=1,解得x=1.5
所以当反应重新建立平衡时,水蒸气的总转化率α(H2O)=
1.5mol/0.3mol]×100%=50%.
故答案为:50%
(2)合成氨正反应是放热反应,升高温度平衡逆反应进行,平衡常数减小,即温度越高平衡常数越小.由表中数据可知
T1 时平衡常数大于573K时平衡常数,故T1<573K.
故答案为:<.
(3)A.由图可知c点n(NH3)和n (H2)相等,故A正确;
B.由图可知c点后氨气物质的量增大,氢气的物质的量减小,c点未处于平衡状态,平衡向正反应进行,c点表示NH3生成速率大于NH3分解速率,故B错误;
C.温度相同,平衡常数相同,e点和d点时反应的平衡常数相同,故C正确;
D.由图可知c点后氨气物质的量增大,氢气的物质的量减小,c点未处于平衡状态,平衡向正反应进行,c点时正反应速率大于逆反应速率,故D正确.
故选:ACD.
(4)充入空气,NO转化为NO2,降低NO的浓度,增大NO2的浓度,平衡向正反应移动,有利于提高原料利用率.
故答案为:充入空气,NO转化为NO2,降低NO的浓度,增大NO2的浓度,平衡向正反应移动,有利于提高原料利用率.点评:
本题考点: 物质的量或浓度随时间的变化曲线;化学平衡建立的过程;化学平衡的影响因素.
考点点评: 考查平衡常数的计算运用及影响因素、平衡移动等,难度中等,注意平衡常数的计算及三段式解题法的运用.1年前查看全部
- 11.16-3/通入合成塔的 N2、H2混合气体密度为0.38g/l (标准状况),反应后从合成塔出来的混合气体的平均相
11.16-3/通入合成塔的 N2、H2混合气体密度为0.38g/l (标准状况),反应后从合成塔出来的混合气体的平均相对分子质量为9.4,求:
①反应前N2和H2的体积比 (1:3)
②反应后N2的平均转化率 (19.1%)
③反应后压强与反应前压强的比值 (0.904:5)
我做不出来~
用什么思路作? nn园1年前1
nn园1年前1 -
 判老电民 共回答了21个问题
判老电民 共回答了21个问题 |采纳率85.7%1.
十字交叉法
0.38g/l
分子量= 8.512
28.6.5
.8.5.
2.19.5
6.512/19.488=1:3
2.
反应后从合成塔出来的混合气体的平均相对分子质量为9.4
设N2转化了X
原来为N2=1,H2=3
反应后:4-2x
(4/4-2x)*8.5=9.4
x=19.1%
3.
4-2x/4=0.9045:11年前查看全部
- 在某合成氨厂的反应中,测得合成塔入口气体N2,H2,NH3的体积比为16:8:1,出口处气体N2,H2,NH3的体积比为
在某合成氨厂的反应中,测得合成塔入口气体N2,H2,NH3的体积比为16:8:1,出口处气体N2,H2,NH3的体积比为
9:27:8,则氮的转化率为( )
设开始N2,H2,NH3的体积为16L,8L,1L
结束时为9x,27x,8x
N2+3H2==2NH3
起 6 18 1
末 9x 27x 8x
转化 6-9x 18-27x 1+8x
所以(6-9x):(1+8x)=1:2
x=11/26
转化率(6-9*11/26)/6=36.5%
答案是25%,我知道正确的怎么做,但为什么我这样做不对? 土土hot1年前2
土土hot1年前2 -
 如风如花如雪如月 共回答了11个问题
如风如花如雪如月 共回答了11个问题 |采纳率90.9%氨气本身有1L,反应后为8X,其中包含起始量.则转化为8x-1,而不是8x+11年前查看全部
- 甲醇合成塔氢碳比如何调节如何对甲醇合成塔进气的氢碳比进行调节
 星星的承诺1年前4
星星的承诺1年前4 -
 evanxue1979 共回答了21个问题
evanxue1979 共回答了21个问题 |采纳率81%主要是靠净化来调节,转化炉加入的蒸汽的多少,可改变合成新鲜气中二氧化碳的含量,蒸汽多则二氧化碳多1年前查看全部
- (2014•山东模拟)合成氨工业对国民经济和社会发展具有重要的意义. 合成塔中发生反应为:
 (2014•山东模拟)合成氨工业对国民经济和社会发展具有重要的意义. 合成塔中发生反应为:
(2014•山东模拟)合成氨工业对国民经济和社会发展具有重要的意义. 合成塔中发生反应为:
N2(g)+3H2(g)⇌2NH3(g)△H<0
(1)工业生产时,制取氢气的一个反应为:CO(g)+H2O(g)⇌CO2(g)+H2(g)△H>0
①t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol•L-1.该温度下此反应的平衡常数K=______.
②保持温度不变,向上述平衡体系中再加入0.1mol CO,当反应重新建立平衡时,水蒸气的总转化率α (H2O)______.
(2)下表为不同温度下合成氨反应的平衡常数.由表可推知T1______573K(填“>”、“<”或“=”).
(3)673K,30MPa下n(NH3) 和n(H2) 随时间变化的关系如图所示依据上图,下列有关叙述正确的是(填写序号)______.T/K T1 573 T2 K 1.00×107 2.45×105 1.88×103
A.c点表示n(NH3)和n (H2)相等
B.c点表示NH3生成速率与NH3分解速率相同
C.e点和d点时反应的平衡常数相同
D.c点时正反应速率大于逆反应速率
(4)用NO2溶于水制硝酸:3NO2+H2O⇌2HNO3+NO.从生产流程看,吸收塔中需要补充空气,其原因用化学平衡移动的理论进行解释是______.
(5)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气.目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ•mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ•mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:______. 5523495361年前1
5523495361年前1 -
 oo酒落醉枫影oo 共回答了15个问题
oo酒落醉枫影oo 共回答了15个问题 |采纳率93.3%解题思路:(1)①利用三段式计算出平衡时各物质的量的平衡浓度,代入平衡常数表达式计算.
②保持温度不变,平衡常数不变.向上述平衡体系中再加入0.1mol CO,可以等效为开始加入0.3molCO,0.3molH2O,
令参加反应的水的物质的量为xmol,利用三段式用x表示出各物质的浓度变化量、平衡时各物质的平衡浓度,代入平衡常数计算x值,再利用转化率定义计算.
(2)合成氨正反应是放热反应,升高温度平衡逆反应进行,平衡常数减小,即温度越高平衡常数越小.
(3)A.由图可知c点n(NH3)和n (H2)相等.
B.由图可知c点后氨气物质的量增大,氢气的物质的量减小,c点未处于平衡状态,平衡向正反应进行.
C.平衡常数只受温度影响,温度相同,平衡常数相同.
D.由图可知c点后氨气物质的量增大,氢气的物质的量减小,c点未处于平衡状态,平衡向正反应进行.
(4)充入空气,NO转化为NO2,降低NO的浓度,增大NO2的浓度,平衡向正反应移动,有利于提高原料利用率.
(5)根据盖斯定律利用热化学方程式加减构造目标热化学方程式.(1)①对于可逆反应:CO(g)+H2O(g)
 CO2(g)+H2(g)
CO2(g)+H2(g)
起始物质的量浓度(mol/L)0.20.3 0 0
转化物质的量浓度(mol/L)0.120.120.120.12
平衡物质的量浓度(mol/L)0.080.180.12 0.12
所以该温度下此反应的平衡常数K=[0.12×0.12/0.08×0.18]=1.
故答案为:1.
②保持温度不变,平衡常数不变,向上述平衡体系中再加入0.1mol CO,可以等效为开始加入0.3molCO,0.3molH2O,
对于可逆反应:CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
起始物质的量浓度(mol/L)0.30.3 0 0
转化物质的量浓度(mol/L)x x x x
平衡物质的量浓度(mol/L)0.3-x 0.3-x x x
所以[x•x
(0.3−x)•(0.3−x)=1,解得x=1.5
所以当反应重新建立平衡时,水蒸气的总转化率α(H2O)=
1.5mol/0.3mol]×100%=50%.
故答案为:50%
(2)合成氨正反应是放热反应,升高温度平衡逆反应进行,平衡常数减小,即温度越高平衡常数越小.由表中数据可知
T1 时平衡常数大于573K时平衡常数,故T1<573K.
故答案为:<.
(3)A.由图可知c点n(NH3)和n (H2)相等,故A正确;
B.由图可知c点后氨气物质的量增大,氢气的物质的量减小,c点未处于平衡状态,平衡向正反应进行,c点表示NH3生成速率大于NH3分解速率,故B错误;
C.温度相同,平衡常数相同,e点和d点时反应的平衡常数相同,故C正确;
D.由图可知c点后氨气物质的量增大,氢气的物质的量减小,c点未处于平衡状态,平衡向正反应进行,c点时正反应速率大于逆反应速率,故D正确.
故选:ACD.
(4)充入空气,NO转化为NO2,降低NO的浓度,增大NO2的浓度,平衡向正反应移动,有利于提高原料利用率.
故答案为:充入空气,NO转化为NO2,降低NO的浓度,增大NO2的浓度,平衡向正反应移动,有利于提高原料利用率.
(5)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ•mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ•mol-1
由盖斯定律可知:①+②得:CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-1734kJ/mol
即CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867kJ/mol.
故答案为:CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867kJ/mol.点评:
本题考点: 化学平衡的计算;用盖斯定律进行有关反应热的计算;化学平衡的调控作用;物质的量或浓度随时间的变化曲线.
考点点评: 考查平衡常数的计算运用及影响因素、平衡移动、热化学方程式等,难度中等,注意平衡常数的计算及三段式解题法的运用.1年前查看全部
- (2014•九江二模)氮气及含氮的化合物在国民经济中占有重要地位.合成氨工业中,合成塔中每产生2mol NH3
 (2014•九江二模)氮气及含氮的化合物在国民经济中占有重要地位.合成氨工业中,合成塔中每产生2mol NH3,放出92.4kJ热量.
(2014•九江二模)氮气及含氮的化合物在国民经济中占有重要地位.合成氨工业中,合成塔中每产生2mol NH3,放出92.4kJ热量.
(1).若起始时向容器内放入2mol N2和6mol H2,达平衡后放出的热量为Q,则Q______184.8kJ(填“>”、“<”或“=”).一定条件下,在密闭恒容的容器中,能表示反应达到化学平衡状态的是______.
a.3v逆(N2)=v正(H2) b.2v正(H2)=v正(NH3)
c.混合气体密度保持不变 d.c(N2):c(H2):c(NH3)=1:3:2
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3(g)+CO2(g⇌CO(NH2)2(l)+H2O (l).
(2)在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)
=X,如图是氨碳比(x)与CO2平衡转化率(α)的关系.α随着x增大而增大的原因是______.n(NH3) n(CO2)
(3)如图的B点处,NH3的平衡转化率为______.
(4)已知:3Cl2+2NH3→N2+6HCl①3Cl2+8NH3→N2+6NH4Cl②完成并配平下列氧化还原反应方程式:12Cl2+15NH3→______③ divv1年前1
divv1年前1 -
 sansan119 共回答了15个问题
sansan119 共回答了15个问题 |采纳率100%解题思路:(1)可逆反应的特点:反应不能进行到底;化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化;
(2)增大一种反应物的浓度,平衡正向移动,另一种反应物的转化率增大;
(3)依据x含义和图象数据分析结合化学方程式换算氨气转化率;
(4)根据化合价升降总数相等进行配平.(1)2mol N2和6mol H2完全转化生成4mol氨气,放出184.8kJ热量,由于是可逆反应,故放出的热量Q<184.8kJ;
a.3v逆(N2)=v正(H2),反应速率之比等于化学计量数之比,故v逆=v正,故a正确;
b.2v正(H2)=v正(NH3),反应速率之比化学计量数之比不等,故b错误;
c.密度=[总质量/体积],总质量不变,体积也不变,故混合气体密度保持不变不能作为判断是否达到化学平衡状态的依据,故c错误;
d.各物质的浓度之比取决于物质的起始物质的量和转化率,故c(N2):c(H2):c(NH3)=1:3:2不能作为判断是否达到平衡状态的依据,故d错误,
故答案为:<;a;
(2)c(NH3)增大,平衡正向移动,所以CO2的转化率增大,
故答案为:c(NH3)增大,平衡正向移动,所以CO2的转化率增大;
(3)2NH3~CO2
设起始时CO2为2amol,氨气为2amol×4=8amol,则平衡时CO2为2amol×0.5=amol,转化的CO2为2amol-amol=amol,转化的氨气为amol×2=2amol,故氨气的转化率为
2amol
8amol×100%=25%,
故答案为:25%;
(4)3Cl2+2NH3→N2+6HCl①
3Cl2+8NH3→N2+6NH4Cl②
12Cl2+15NH3→,Cl由0价降低为-1价,共降低24,N由-3价升高为0价,共升高24,故有8个氨气被氧化生成氮气,7个氨气未被氧化,故产物为4N2+7NH4Cl+17HCl,
故答案为:12Cl2+15NH3=4N2+7NH4Cl+17HCl.点评:
本题考点: 化学平衡状态的判断;有关反应热的计算;化学平衡的计算.
考点点评: 本题考查化学平衡的标志判断、化学平衡的影响因素、转化率的计算以及氧化还原反应的配平,综合性较强,难度较大.1年前查看全部
- 工业上用于制造水泥的主要设备是 A.炼铁高炉 B.制硫酸的沸腾炉 C.水泥回转窑 D.氨的合成塔
 zjs56751年前1
zjs56751年前1 -
 chastiser 共回答了27个问题
chastiser 共回答了27个问题 |采纳率88.9%C
水泥的原料为石英、石灰石和纯碱。在水泥回转窑中反应。1年前查看全部
- (2014•四川模拟)某火电厂的脱硫尾气通入饱和K2CO3溶液吸收池后,经分解池制得纯净的CO2,再在合成塔与H2反应生
(2014•四川模拟)某火电厂的脱硫尾气通入饱和K2CO3溶液吸收池后,经分解池制得纯净的CO2,再在合成塔与H2反应生成甲醇.其工艺艺流程示意图如下:
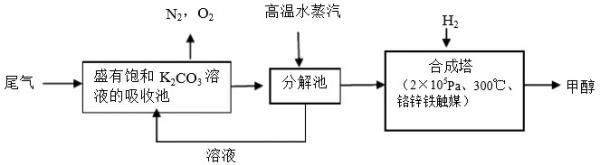
(1)吸收池中饱和K2CO3溶液吸收CO2的离子方程式是______.
(2)流程示意图中循环使用的物质是______.
(3)300℃时,合成塔中的反应为CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),在密闭条件下,下列示意图能说明反应进行到t1时刻时达到平衡状态的是______(填字母序号)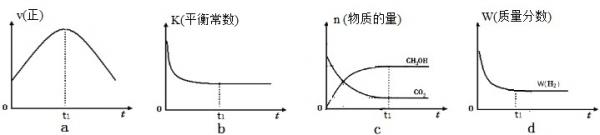
(4)利用合成塔中失活后的铬锌触媒可制得含有Cl-和CrO42-的溶液,其浓度均为0.01mol/L,向该溶液中逐滴加入0.01mol/L的AgNO3溶液时,首先产生沉淀的阴离子是______(已知:Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12)
(5)合成塔中失活的铬锌触媒可用于制备锌锰电池.在碱性条件下,该电池的总反应为:
Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s),该电池正极的电极反应式是______.若用电池电解(惰性电极)足量的Mg(NO3)2和NaCl的混合溶液,电解过程中阴极的现象是______. 新月婉清1年前1
新月婉清1年前1 -
 云落风起 共回答了17个问题
云落风起 共回答了17个问题 |采纳率100%解题思路:由流程图可知,火电厂的脱硫尾气的主要成份是二氧化碳,在吸收池中充分反应生成碳酸氢钾,生成的碳酸氢钾由分解池分解后所得溶液是碳酸钾可通入吸收池再利用,合成塔内反应是氢气与二氧化碳反应生成甲醇和水,由此分析解题.(1)二氧化碳和碳酸钾反应生成碳酸氢钾,离子方程式为CO2+CO32-+H2O=2HCO3-,故答案为:CO2+CO32-+H2O=2HCO3-.
(2)碳酸氢钾在分解池中分解产生碳酸钾在吸收池中可重复利用,故答案为:碳酸钾;
(3)平衡状态是指外界一定各组份的浓度、物质的量、质量分数、速率不再随时间的改变而改变的动态平衡状态,
a、t1时刻正反应速率最大,不是变,故a不选;
b、温度不变,平衡常数不变,故b不选;
c、t1时刻,各物质的量不再随时间的变化而变化,故选c;
d、t1时刻,氢气的体积分数不再随时间的改而改变,故选d;
故答案为:c、d;
(4)析出沉淀时,AgCl溶液中c(Ag+)=
Ksp(AgCl)
c(Cl−)=
1.56×10−10
0.01=1.56×10-8mol/L,Ag2CrO4溶液中c2(Ag+)=Ksp(Ag2CrO4)/c(CrO42-)=
9.0×10−12
0.01,则c(Ag+)为3×10-5mol/L,c(Ag+)越小,则越先生成沉淀,故答案为:Cl-;
(5)正极发生还原反应,得电子化合价降低,二氧化锰中的锰元素由+4价变成+3价,故正极是二氧化锰发生还原反应,电极反应式为:2MnO2+2e-+H2O=2OH-+Mn2O3,若用电池电解(惰性电极)足量的Mg(NO3)2和NaCl的混合溶液,阴极是氢离子放电,电极反应方程式为2H2O+2e-=H2↑+2OH-,氢氧根离子与镁离子结合在难溶氢氧化镁沉淀,故答案为:2MnO2+2e-+H2O=2OH-+Mn2O3;有无色气体和白色沉淀产生.点评:
本题考点: 离子方程式的书写;常见化学电源的种类及其工作原理;化学平衡状态的判断;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 此题通过研究二氧化碳对环境的影响考察对二氧化碳的了解.根据题中的条件对化学方程式的推理及应用,根据化学方程式进行数据的求解都是考查的重点.溶解平衡问题,题目难度中等,注意根据溶解度判断生成沉淀的先后顺序,对于组成不相似的物质,不能直接根据溶度积判断.1年前查看全部
- (2013•河西区一模)已知:①某温度下,合成氨工业合成塔中每产生2molNH3,放出92.2kJ热量;
(2013•河西区一模)已知:①某温度下,合成氨工业合成塔中每产生2molNH3,放出92.2kJ热量;

下列相关叙述正确的是( )
A.加入高效催化剂可提高氨气的产率
B.断裂1mol N-H键吸收的能量约等于391 kJ
C.该工业合成氨热化学方程N2(g)+3H2(g)⇌2NH3(g)△H=-92.2kJ
D.该温度下合成塔中放入2mol N2和6mol H2,达平衡后放出的热量为184.4 kJ abb5141年前1
abb5141年前1 -
 壹痕沙 共回答了25个问题
壹痕沙 共回答了25个问题 |采纳率84%解题思路:A、催化剂改变反应速率,不能改变平衡;
B、依据反应焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量计算得到;
C、焓变单位为KJ/mol;
D、反应是可逆反应不能进行彻底.A、加入高效催化剂改变反应速率不改变化学平衡,不能提高氨气的产率,故A错误;
B、3H2+N2⇌2NH3,反应焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量=3×436+945.8-6×N-H键键能=-92.2,N-H键键能=391KJ;故B正确;
C、该工业合成氨热化学方程N2(g)+3H2(g)⇌2NH3(g)△H=-92.2kJ/mol,故C错误;
D、反应是可逆反应不能进行彻底,该温度下合成塔中放入2mol N2和6mol H2,达平衡后放出的热量小于184.4 kJ,故D错误;
故选B.点评:
本题考点: 化学能与热能的相互转化.
考点点评: 本题考查了化学能与热能关系分析判断,焓变计算应用,热化学方程式书写,注意可逆反应的判断,题目难度中等.1年前查看全部
- 氮气及含氮的化合物在国民经济中占有重要地位。合成氨工业中,合成塔中每产生2 mol NH 3 ,放出92.4 kJ热
氮气及含氮的化合物在国民经济中占有重要地位。合成氨工业中,合成塔中每产生2 mol NH 3 ,放出92.4 kJ热氮气及含氮的化合物在国民经济中占有重要地位。合成氨工业中,合成塔中每产生2 mol NH 3 ,放出92.4 kJ热量。
(1)若起始时向容器内放入2 mol N 2 和6 mol H 2 ,达平衡后放出的热量为Q,则Q_____184.8kJ(填“>”、“<”或“=”) 。 一定条件下,在密闭恒容的容器中,能表示反应达到化学平衡状态的是____________。
a.3v 逆 (N 2 )=v 正 (H 2 ) b.2v 正 (H 2 )= v 正 (NH 3 )
c.混合气体密度保持不变 d.c(N 2 ):c(H 2 ):c(NH 3 )=1:3:2
工业生产尿素的原理是以NH 3 和CO 2 为原料合成尿素[CO(NH 2 ) 2 ],反应的化学方程式为2NH 3 (g)+ CO 2 (g) CO(NH 2 ) 2 (l) + H 2 O (l)。
CO(NH 2 ) 2 (l) + H 2 O (l)。
(2)在一定温度和压强下,若原料气中的NH 3 和CO 2 的物质的量之比(氨碳比) ,右图是氨碳比(x)与CO 2 平衡转化率(α)的关系。α随着x增大而增大的原因是___________。
,右图是氨碳比(x)与CO 2 平衡转化率(α)的关系。α随着x增大而增大的原因是___________。
(3)图中的B点处,NH 3 的平衡转化率为_______。
已知:3Cl 2 +2NH 3 →N 2 +6HCl――① 3Cl 2 +8NH 3 →N 2 +6NH 4 Cl――②
(4)完成并配平下列氧化还原反应方程式,再标出电子转移的方向和数目:
12Cl 2 +15NH 3 → ――③
(5)反应③中的还原剂是 ,还原产物是 。
(6)若按③反应后产生气体9.408L(标准状况),则被氧化的气体的物质的量是 mol。
 szsybr1年前1
szsybr1年前1 -
 洛qing城 共回答了12个问题
洛qing城 共回答了12个问题 |采纳率91.7%(1)< a (共2分,各1分)
(2)c(NH 3 )增大,平衡正向移动,所以CO 2 的转化率增大(1分)
(3)25% (2分)
(4)12Cl 2 +15NH 3 → 4 N 2 + 7 NH 4 Cl + 17 HCl
(5)NH 3 (1分) NH 4 Cl 和HCl(各0.5分,共1分)
(6)0.16(2分)
试题分析:(1)由于合成氨的反应是可逆反应,若起始时向容器内放入2 mol N 2 和6 mol H 2 ,达平衡后不可能有4mol氨气生成,故放出的热量为Q<184.8kJ。 一定条件下,在密闭恒容的容器中,能表示反应达到化学平衡状态的是 a.3v 逆 (N 2 )=v 正 (H 2 ) 相当于同一物质的正逆反应相等,正确;
(2)根据方程式,c(NH 3 )增大,平衡正向移动,所以CO 2 的转化率增大。
(3)图中的B点处,x=4,原料气中的NH 3 和CO 2 的物质的量之比为4,二氧化碳转化率为50%,假设氨气为4mol,二氧化碳为1mol,则反应的二氧化碳为0.5mol,依据化学方程式2NH 3 (g)+CO 2 (g)?CO(NH 2 ) 2 (l)+H 2 O(l)反应的氨气为1mol,NH 3 的平衡转化率=1/4×100%=25%;故答案为:25%;
(4)运用氧化还原反应原理书写为2Cl 2 +15NH3=" 4" N 2 + 7 NH 4 Cl + 17 HCl ,转移电子数为24e。
(5)反应③中的还原剂是NH 3 ,还原产物是NH 4 Cl 和HCl。34.生成气体9.408L(标准状况),可求得其中氮气占了4/21,则被氧化的气体的物质的量就为氮气的8倍,即为0.16 mol。1年前查看全部
- 合成氨工业中,采用氮气和氢气1:2.8的物质的量之比进入合成塔.从合成塔出来的混合气体中,氨气占体积的15%.若采用相同
合成氨工业中,采用氮气和氢气1:2.8的物质的量之比进入合成塔.从合成塔出来的混合气体中,氨气占体积的15%.若采用相同温度、压强,若初始时氮气与氢气的物质的量的比为1:3,则平衡时氨气的体积分数_______15%(填“大于”、“小于”或“等于”)
 floyd76211年前1
floyd76211年前1 -
 qxy1222 共回答了22个问题
qxy1222 共回答了22个问题 |采纳率95.5%氨气的氮氢元素比为1:3,若初始物质量比为1:3的就是平衡时转化率最高的比例,所以氨气的体积分数应该是大于原来的.选 大于.1年前查看全部
- 在合成氨时,将1体积氮气和3体积H2混合后通过合成塔中的催化剂,若从塔中导出的混合气体中,氨气的体积分数为12%,求N2
在合成氨时,将1体积氮气和3体积H2混合后通过合成塔中的催化剂,若从塔中导出的混合气体中,氨气的体积分数为12%,求N2和H2的体积分数各为多少.
 冰封王子1年前1
冰封王子1年前1 -
 莎莎5570 共回答了24个问题
莎莎5570 共回答了24个问题 |采纳率100%解题思路:反应后混合气体为N2、H2、NH3,合成氨中N2、H2按体积比1:3反应,而二者化学计量数之比为1:3,故反应后混合气体中N2、H2的体积之比为1:3,根据NH3的体积分数计算反应后混合气体中N2、H2的总体积分数,进而计算N2和H2的体积分数.发生反应:N2+3H2
催化剂
.
高温高压2NH3,反应后混合气体为N2、H2、NH3,合成氨中N2、H2按体积比1:3反应,而二者化学计量数之比为1:3,故反应后混合气体中N2、H2的体积之比为1:3,
NH3的体积分数为12%,则反应后混合气体中N2、H2的总体积分数为1-12%=88%,
反应后混合气体中N2的体积分数为88%×[1/4]=22%,H2的体积分数为88%-22%=66%,
答:反应后N2的体积分数为22%,H2的体积分数为66%.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查化学方程式计算,难度不大,注意充分利用方程式判断反应后氮气与氢气的体积之比.1年前查看全部
- 在某合成氨厂,测得合成塔中氮气氢气氨气的体积比为6:18:1出口体中氮气氢气氨气的比为9:27:8则氢气的转化率为几(
在某合成氨厂,测得合成塔中氮气氢气氨气的体积比为6:18:1出口体中氮气氢气氨气的比为9:27:8则氢气的转化率为几( )
A 75% B 50% C 25% D 20% 无心匪类1年前1
无心匪类1年前1 -
 最美是你 共回答了16个问题
最美是你 共回答了16个问题 |采纳率87.5%这是一道关于转化率的计算题.设入口处气体的体积各为6L,18L,1L,设反应了的体积为X,
初始体积(L) 6 18 1
转化体积(L) X 3X 2X
平衡体积(L) 6-X 18-3X 1+2X
X=1.5L 氮气的转化率=1.5L/6L×100%=25% 答案 C1年前查看全部
- 在合成氨时,将1体积氮气和3体积H2混合后通过合成塔中的催化剂,若从塔中导出的混合气体中,氨气的体积分数为12%,求N2
在合成氨时,将1体积氮气和3体积H2混合后通过合成塔中的催化剂,若从塔中导出的混合气体中,氨气的体积分数为12%,求N2和H2的体积分数各为多少.
 金HUA1年前1
金HUA1年前1 -
 deardennis 共回答了14个问题
deardennis 共回答了14个问题 |采纳率92.9%解题思路:反应后混合气体为N2、H2、NH3,合成氨中N2、H2按体积比1:3反应,而二者化学计量数之比为1:3,故反应后混合气体中N2、H2的体积之比为1:3,根据NH3的体积分数计算反应后混合气体中N2、H2的总体积分数,进而计算N2和H2的体积分数.发生反应:N2+3H2
催化剂
.
高温高压2NH3,反应后混合气体为N2、H2、NH3,合成氨中N2、H2按体积比1:3反应,而二者化学计量数之比为1:3,故反应后混合气体中N2、H2的体积之比为1:3,
NH3的体积分数为12%,则反应后混合气体中N2、H2的总体积分数为1-12%=88%,
反应后混合气体中N2的体积分数为88%×[1/4]=22%,H2的体积分数为88%-22%=66%,
答:反应后N2的体积分数为22%,H2的体积分数为66%.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查化学方程式计算,难度不大,注意充分利用方程式判断反应后氮气与氢气的体积之比.1年前查看全部
- 氨在国民经济中占有重要地位。(1)合成氨工业中,合成塔中每产生2molNH 3 ,放出92.2 kJ热量。①工业合成氨的
氨在国民经济中占有重要地位。
(1)合成氨工业中,合成塔中每产生2molNH 3 ,放出92.2 kJ热量。
①工业合成氨的热化学方程式是 。
②若起始时向容器内放入2molN 2 和6molH 2 ,达平衡后放出的热量为Q,则Q(填“>”、“<”或“=”)_______184.4 kJ。
③已知:
1molN-H键断裂吸收的能量约等于 kJ。
(2)工业生产尿素的原理是以NH 3 和CO 2 为原料合成尿素[CO(NH 2 ) 2 ],反应的化学方程式为2NH 3 (g)+CO 2 (g) CO(NH 2 ) 2 (l)+H 2 O(l),该反应的平衡常数和温度关系如下:
CO(NH 2 ) 2 (l)+H 2 O(l),该反应的平衡常数和温度关系如下:T / ℃ 165 175 185 195 K 111.9 74.1 50.6 34.8
①焓变ΔH(填“>”、“<”或“=”)_______0。
(3)已知:
①N 2 (g)+O 2 (g)=2NO(g) ΔH 1 =+180 kJ·mol -1
②N 2 (g)+3H 2 (g) 2NH 3 (g) ΔH 2 =-92.4 kJ·mol -1
2NH 3 (g) ΔH 2 =-92.4 kJ·mol -1
③2H 2 (g)+O 2 (g)=2H 2 O(g) ΔH 3 =-483.6 kJ·mol -1
氨的催化氧化反应的热化学方程式为 fengsheng1年前1
fengsheng1年前1 -
 alexseo 共回答了17个问题
alexseo 共回答了17个问题 |采纳率82.4%1年前查看全部
- 1.合成氨时把1体积N2和3体积H2混合后,通过合成塔,若合成塔排出的混合气体中氨占体积的15%,求H2所占的体积分数及
1.合成氨时把1体积N2和3体积H2混合后,通过合成塔,若合成塔排出的混合气体中氨占体积的15%,求H2所占的体积分数及N2的平衡转化率(体积均在同温同压下测定)(答案:63.74% 26.1%)
2.常温下于一密闭容器中充入NO2,当反应2NO2(g)(双箭头)N2O4(g)达到平衡后,测知有80%的NO2转化为N2O4,则平衡时混合气体的平均相对分子质量约为多少?76.7) 独自躲在墙角dd1年前1
独自躲在墙角dd1年前1 -
 wuya0000 共回答了18个问题
wuya0000 共回答了18个问题 |采纳率88.9%H2%=(1-15%)*3/4 ;
N2 + 3H2 ===== 2NH3
1.3.
x.3x.2x
2x/(4-2x)=15%
a(N2)=x
M=(14+32)/0.61年前查看全部
- 有科学家提出回收利用CO2的构想:把空气吹入碳酸钾溶液,从溶液中提取出CO2,又在合成塔使之变为燃料甲醇(CH3OH).
有科学家提出回收利用CO2的构想:把空气吹入碳酸钾溶液,从溶液中提取出CO2,又在合成塔使之变为燃料甲醇(CH3OH).该技术流程如下:
N2、O2 H2
|( 这里箭头是向下的) |(这里箭头是向下的)
空气——吸收池————分解池——合成塔——甲醇(横杠代表向右的箭头
(吸收池中盛有饱和的K2CO3溶液,合成塔内的反应条件为300℃、200kPa和催化剂.)
1)合成塔中发生反应的化学方程式 2)请在图中标出可循环利用的物质名称和循环方向 3)若空气不经吸收池和分解池而直接通入合成塔,你认为可行吗?原因.
4)请计算生产4.8t甲醇,可回收空气中CO2的质量是多少? zlx_7212221年前0
zlx_7212221年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 化学反应的限度:合成氨对反应N2+3H2≒2NH3,将N2和H2以体积比为1:3通入合成塔,当反应达到平衡后,氨的体积分
化学反应的限度:合成氨
对反应N2+3H2≒2NH3,将N2和H2以体积比为1:3通入合成塔,当反应达到平衡后,氨的体积分数为16%,则平衡混合气体中N2的体积分数为多少?H2的转化率为多少.这个题的思路是什么,要设未知数吗?是不是体积比就是物质的量之比? 昏睡de小笨鸟1年前1
昏睡de小笨鸟1年前1 -
 亚洲称霸郑秀文 共回答了17个问题
亚洲称霸郑秀文 共回答了17个问题 |采纳率100%NH3 0.16
反应了的N2 0.08
原来是0.25
现在0.25-0.08=0.17
H2反应了0.24
原来是0.75
转化率0.24/0.75=0.32
同温同压时,气体物质的量的比等于体积的比
这个题应为投放的反应物的物质的量与系数相等,不存在过量问题,按照系数之比计算就可以了1年前查看全部
- (他0上0•茂名二模)在一定条件下,合成塔中氮气和氢气的起始浓度分别为amo8•8-上和下
(他0上0•茂名二模)在一定条件下,合成塔中氮气和氢气的起始浓度分别为amo8•8-上和下mo8•8-上,反应为:a他+你1他→他a1你,氨气的浓度随时间变化如图上所示.

(上)反应到5mia时,氢气反应速率______.
(他)在上0mia时采取的措施是______,A的平衡常数为上他 (α-他)(下-他)你 ,点A的平衡常数K______(填“<”、“>”或“=”)下点的平衡常数.上他 (α-他)(下-他)你
(你)若合成塔内生成上7g氨气放出我5.5kJ热量,在图他坐标上画出该合成氨反应过程中能量随时间的变化示意图.
(我)-50°C时,液氨存在如下电离:他a1你⇌a1我++a1-他,k=他×上0-他,液氨的电离达到平衡时,各微粒的浓度大小关系为______,加入a1我C8固体,K______他×上0-上他(填“<”、“>”或“=”) lwlyuan1年前1
lwlyuan1年前1 -
 desfbnh 共回答了15个问题
desfbnh 共回答了15个问题 |采纳率86.7%解题思路:(1)由反应速率为单位时间内浓度的变化量来计算氨气的反应速率,再利用反应速率之比等于化学计量数之比计算氢气的反应速率;
(2)由图可知10min时氨气的浓度瞬间减小,平衡常数为生成物浓度幂之比与反应物浓度幂之比的比,温度不变,则化学平衡K不变;
(3)生成17g氨气放出46.6kJ热量,即生成1molNH3放出热量46.6kJ,反应物的能量高,生成物的能量低;
(4)电离的程度不大,由电离方程式可知,c(NH+4)=c(NH-2),温度不变,电离平衡常数不变.(4)a人in时氨气的浓度为4人ol/L,则氨气的反应速率为[4人ol/L/a人in]=0.四人ol•L-4•人in-4,
由反应速率之比等于化学计量数之比可知,氢气的反应速率为0.四人ol•L-4•人in-4×[3/4]=4.4人ol•L-4•人in-4,
故答案为:4.4人ol•L-4•人in-4;
(4)由图可知40人in时氨气的浓度瞬间减小,则采取的措施为移去部分氨气,
由N4+3H4→4NH3,
开始a b 0
转化4 6 4
平衡a-4 b-6 4
则K=
46
(α-4)(b-6)3,
因A和B点的温度相对,则化学平衡常数K相等,故答案为:移去部分氨气;
46
(α-4)(b-6)3;=;
(3)由题意可知生成4人olNH3放出热量46.6k四,反应物的能量高,生成物的能量低,如图 ,
,
故答案为: ;
;
(4)因电离的程度不r,由电离方程式可知,c(NH+4)=c(NH-4),则c(NH3)>c(NH+4)=c(NH-4),又温度不变,电离平衡常数K不变,
故答案为:c(NH3)>c(NH+4)=c(NH-4);=.点评:
本题考点: 物质的量或浓度随时间的变化曲线;化学平衡常数的含义;化学平衡的影响因素;化学平衡的计算.
考点点评: 本题考查化学反应速率、化学平衡移动、平衡常数、电离等知识,明确图象及图象的分析是解答本题的关键,难度较大.1年前查看全部
- 工业上在合成塔中采用下列反应合成甲醇:
 工业上在合成塔中采用下列反应合成甲醇:
工业上在合成塔中采用下列反应合成甲醇:
CO(g)+2H2(g)⇌CH3OH(g)△H=Q kJ/mol
(1)判断该可逆反应达到平衡状态的标志是(填字母序号)______.
a、生成CH3OH的速率与消耗CO的速率相等b、混合气体的密度不变
c、CH3OH、CO、H2的浓度都不再发生变化d、混合气体的平均相对分子质量不变
(2)下表所列数据是该可逆反应在不同温度下的化学平衡常数(K)
①由表中数据判断Q______0(填“>”、“<”或“=”),该反应在______(填“较高”或“较低”)温度下有利于自发进行.温度 250℃ 300℃ 350℃ K 2.041 0.270 0.012
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应后,达到平衡测得c(CO)=0.2mol/L,此时对应的温度为_______;CO的转化率为______.
(3)请在图中画出压强不同,平衡时甲醇的体积分数(φ)随温度(T)变化的两条曲线(在曲线上标出P1、P2、,且p1<P2)
(4)要提高CO的转化率且提高反应速率,可以采取的措施是______(填字母序号).
a、升温b、加入催化剂c、增加CO的浓度 d、通入H2加压e、通人惰性气体加压f.、分离出甲醇
(5)已知一定条件下,CO与H2在催化剂的作用下生成5molCH3OH时,能量的变化为454kJ.在该条件下,向容积相同的3个密闭容器中,按照甲、乙、丙三种不同的投料方式加人反应物,测得反应达到平衡时的有关数据如下:
下列说法正确的是______(填字母序号).容器 甲 乙 丙 反应物投入量 1molCO
2molH21molCH3OH 2molCH3OH 平衡
时数
据CH3OH的浓度(mol•L-1) c1 c2 c3 反应吸收或放出的能量(KJ) a b c 体系压强(Pa) P1 P2 P3 反应物转化率 α1 α2 α3
A、2c1>c3B、a+b<90.8C、2P2<P3D、α1+α3<1. 7sv61年前1
7sv61年前1 -
 yue_jia 共回答了18个问题
yue_jia 共回答了18个问题 |采纳率83.3%解题思路:(1)化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断,得出正确结论;
(2)①依据平衡常数随温度变化分析,结合平衡移动原理分析热量变化;
②依据化学平衡的三段式列式计算,依据转化率概念计算得到;根据浓度计算出平衡常数,再判断温度;
(3)增大压强,平衡正向移动;甲醇的体积分数(φ)增大;升高温度,平衡逆向移动,甲醇的体积分数(φ)减小,依此作图;
(4)a.升温,反应速率加快,平衡逆向移动,CO的转化率减小;
b.加入催化剂,反应速率加快,平衡不移动,CO的转化率不变;
c.增加CO的浓度,反应速率加快,平衡正向移动,但CO的转化率减小;
d.通入H2加压,反应速率加快,平衡正向移动,CO的转化率增大;
e.通人惰性气体加压,反应速率不变,平衡不移动,CO的转化率不变;
f.分离出甲醇,反应速率减慢,平衡正向移动,CO的转化率增大;
(5)A.甲、丙相比较,把甲等效为开始加入1molCH3OH,丙中甲醇的物质的量为甲的2倍,压强增大,对于反应CH3OH(g)⇌CO(g)+2H2(g),平衡向生成甲醇的方向移动;
B.由题目可知生成1molCH3OH的能量变化为[454/5]=90.8kJ,甲、乙平衡状态相同,令平衡时甲醇为nmol,计算反应热数值,据此判断;
C.比较乙、丙可知,丙中甲醇的物质的量为乙的2倍,压强增大,对于反应CH3OH(g)⇌CO(g)+2H2(g),平衡向生成甲醇的方向移动;
D.甲、乙处于相同的平衡状态,则α1+α2=1,由C的分析可知α2>α3,据此判断.(1)CO(g)+2H2(g)⇌CH3OH(g)
a.生成CH3OH是正反应,消耗CO也是正反应,故a错误;
b.密度=[总质量/体积],总质量一定,体积一定,故混合气体的密度不变不能说明反应达平衡状态,故b错误;
c.达到化学平衡状态时,各物质的浓度不再发生变化,故CH3OH、CO、H2的浓度都不再发生变化能说明反应达平衡状态,故c正确;
d.平均相对分子质量=[总质量/总物质的量],总质量一定,总物质的量会变,故混合气体的平均相对分子质量不变能说明反应达平衡状态,故d正确;
故答案为:cd;
(2)①依据图表数据可知,随温度升高,平衡常数减小,说明平衡逆向进行,逆向是吸热反应,正向放热反应,故Q<0;
故答案为:<;
△G=△H-T△S,△H<0,△S<0,故低温有利于自发进行,
故答案为:<;低温;
②c(CO)=0.2mol/L,物质的量为0.4mol;
CO (g)+2H2 (g)⇌CH3OH (g)
起始量(mol) 2 6 0
变化量(mol) 1.6 3.21.6
平衡量(mol) 0.4 2.8 1.6
c(CO)=[0.4/2]=0.2mol/L,c(H2)=[2.8/2]=1.4mol/L,c(CH3OH )=[1.6/2]=0.8mol/L,
此时的平衡常数为:K=[1.6/0.2×1.4×1.4]≈2.041,所以温度为250℃,
CO的转化率=[1.6/2]×100%=80%,
故答案为:250℃;80%;
(3)增大压强,平衡正向移动;甲醇的体积分数(φ)增大;升高温度,平衡逆向移动,甲醇的体积分数(φ)减小,
故答案为: ;
;
(4)a.升温,反应速率加快,平衡逆向移动,CO的转化率减小,故a错误;
b.加入催化剂,反应速率加快,平衡不移动,CO的转化率不变,故b错误;
c.增加CO的浓度,反应速率加快,平衡正向移动,但CO的转化率减小,故c错误;
d.通入H2加压,反应速率加快,平衡正向移动,CO的转化率增大,故d正确;
e.通人惰性气体加压,反应速率不变,平衡不移动,CO的转化率不变,故e错误;
f.分离出甲醇,反应速率减慢,平衡正向移动,CO的转化率增大,故f错误;
故答案为:d;
(5)A.甲、丙相比较,把甲等效为开始加入1molCH3OH,丙中甲醇的物质的量为甲的2倍,压强增大,对于反应CH3OH(g)⇌CO(g)+2H2(g),平衡向生成甲醇的方向移动,故2c1<c3,故A错误;
B.由题目可知生成1molCH3OH的能量变化为[454/5]=90.8kJ,甲、乙平衡状态相同,令平衡时甲醇为nmol,对于甲容器,a=90.8n,等于乙容器b=90.8(1-n),故a+b=90.8,故B错误;
C.比较乙、丙可知,丙中甲醇的物质的量为乙的2倍,压强增大,对于反应CH3OH(g)⇌CO(g)+2H2(g),平衡向生成甲醇的方向移动,故2p2>p3,故C错误;
D.甲、乙处于相同的平衡状态,则α1+α2=1,由C的分析可知α2>α3,所以a1+a3<1,故D正确,
故答案为:D.点评:
本题考点: 等效平衡;化学平衡的影响因素;化学平衡状态的判断.
考点点评: 本题考查平衡状态的判断、化学平衡的计算、平衡常数的计算等,综合性较强,难度中等,题量超大.1年前查看全部
- 5.24-化学1/ 20.在氮气、氢气合成氨的合成塔中,进入的N2和H2体积比为1:3,
5.24-化学1/ 20.在氮气、氢气合成氨的合成塔中,进入的N2和H2体积比为1:3,
塔中起始压强为1.67* 10^7 Pa ,又知从塔中出来的气体中,NH3占25%(体积分数).求:
(1)合成塔中出来的混合气体中,N2和H2的体积分数.
(2)反应达到平衡时,合成塔中混合气体的总压强.
我第一题做出来1:3,第二题3.24*10^7 Pa .感觉不对. 星月681年前1
星月681年前1 -
 藏一手80 共回答了26个问题
藏一手80 共回答了26个问题 |采纳率88.5%第一个问题:
N2+3H2=2NH3
开始时,1:3:0
反映了,X:3X,生成了2X
剩余1-X:3-3X:2X
最后2X占了25%
所以列方程:2X/(4-2X)=0.25
解得X=0.4
则N2体积分数=(1-0.4)/(4-2*0.4)=18.75%
H2的体积分数=(3-1.2)/(4-2*0.4)=56.25%
(验算,0.25+0.1875+0.5625=1,答案正确)
第二个问题:
压强和气体在容器中物质的量有关
1.67*10^7/x=(1+3)/(0.6+1.8+0.8)
解得x=1.336*10^61年前查看全部
大家在问
- 1刘翔在2004年打破了一项世界记录用英语怎么说?
- 2I don't like stories…have unhappy ending.
- 3急需一篇以“我爱我家”为话题的短文 要真情实感 我还要上讲台念呢!
- 4看图,回答22-23题:22.看图回答,A点的经纬度正确的是( )23.下列选项正确的是( )A.A点位于B点的西北
- 5看下图写英语单词(每题1分,共10分)
- 6刘禹锡 浪淘沙九曲黄河万里沙,浪淘风簸自天涯.如今直上银河去,同到牵牛织女家
- 7高考题,在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知N
- 8有理数计算~解方程~整式的加减计算题各200道
- 9【甲】潭中鱼可百许头,皆若空游无所依。日光下澈,影布石上。佁然不动,俶尔远逝,往来翕忽。似与游者相乐。
- 10研究光电效应的实验装置如图,现在电流表有示数,则下列说法中正确的是( )
- 11在同时存在匀强电场合匀强磁场的空间中取正交坐标系Oxyz(z轴正方向竖直向上),如图所示。已知电场方向沿z轴正方向,场强
- 12"This picture is not the same size as that one."的同义句
- 13一次函数两函数图像相垂直,两函数K的关系
- 14ahousewithtwofloors意思
- 15在口里填上适当的数.40+5>40+口:68-60>10口:56—囗=29+20:40+囗=26+30


