在铜锌电解池中,(电解质溶液为硫酸铜溶液,阳极为锌片,阴极为铜片),
 青帮小老大2022-10-04 11:39:543条回答
青帮小老大2022-10-04 11:39:543条回答在铜锌电解池中(电解质溶液为硫酸铜溶液,阳极为锌片,阴极为铜片),
1.为什么锌片会自己自动失去电子,然后锌原子变成锌离子?硫酸铜溶液为什么不和锌片直接发生氧化还原反应,即锌原子直接把电子转移给铜离子?
2.锌离子出来后为什么不会趋向阴极(铜片),然后又得到电子变成锌原子,形成单质锌?
打错了 是原电池 不是电解池

已提交,审核后显示!提交回复
共3条回复
 凤翅镏金 共回答了12个问题
凤翅镏金 共回答了12个问题 |采纳率100%- 电解池问题 (请耐心看完)
1电解池由阴极 阳极 电解液体构成 已经形成了闭合的回路 所以回有电子的流动 通常是活泼的金属失电子
因为锌是做负极 负极失电子 阳极得电子(怎样判断阴阳级?通常 相对活泼的金属是做阴极的 锌比铜活泼所以 锌是负)
硫酸铜可以和锌片反应的 因为锌比铜活泼 可以置换铜 不知道你为什么说不能反应
2 这就要看溶液里有什么离子了上述溶液里正离子有氢离子与锌离子 这也涉及了离子的放电顺序 氢离子 》锌离子
也就是说 氢离子的氧化性强于锌离子 氢离子比锌离子先得到电子 所以不会析出单质锌 只会析出氢气
够详细了吧 - 1年前
 LIA-网感 共回答了8个问题
LIA-网感 共回答了8个问题 |采纳率- 肯定是电池的氧化性比铜离子大得多因此它(锌)先把电子给电池。
电子又从负极出来可是铜没有氧化性因此电子只能到溶液中,而溶液中只有锌离子(当然不考虑水解),因此锌离子只能又变成锌单质了。 - 1年前
 开钩机上太空 共回答了11个问题
开钩机上太空 共回答了11个问题 |采纳率- 因为水的导电性不如金属的好啊
金属中存在金属阳离子和大量的自由电子
自由电子定向移动就形成了电流
水中导电的是水电解形成的氢离子和氢氧根
相比下数量,还是金属的多……
因为锌的金属活动性比铜强
就是锌要比铜活泼
金属活动性顺序:钾钙钠镁铝 锌铁锡铅氢 铜汞银铂金
高中用到的……
通常情况下,只有排在前面的金属单质才能置换出后面... - 1年前
相关推荐
- 关于电解质,原电池,电解池1.原电池,电解质有什么要求,为什么电解质的阳离子所代表的元素不能比负极金属活泼(有盐桥的那种
关于电解质,原电池,电解池
1.原电池,电解质有什么要求,为什么电解质的阳离子所代表的元素不能比负极金属活泼(有盐桥的那种)?
2.电解池中的电解质有什么要求,
3.电解池连接负极的金属为什么不会与电解质反应
4.为什么溶液呈电中性时才能放电,原电池中才有电流
(回答时请标序号逐个解答,
对于问题2,我还想知道为什么 宝鸡921年前1
宝鸡921年前1 -
 骂你不是我的错 共回答了19个问题
骂你不是我的错 共回答了19个问题 |采纳率84.2%1.要求是反应会自发进行,电解质的阳离子所代表的元素不能比负极金属活泼的原因也是反应自发进行(置换反应强的把弱的置换出来,这个知道的吧)
2.能让电子在电解质中自由移动,这是化学反应的实质
3.因为电池负极放出电子,电子是负的,保护了负极的金属,使其不会因为失去电子二变成离子(这也是一些金属防腐蚀的原理)
4.似乎不是吧 酸碱都是可以的啊 酸的话 反应还要快类1年前查看全部
- 怎么解有关原电池和电解池的题呀?
 雷达测控1年前1
雷达测控1年前1 -
 接近神的阿吉 共回答了16个问题
接近神的阿吉 共回答了16个问题 |采纳率93.8%你只要记住原电池的总是 负极为活泼的金属 失电子(为氧化反应) 正极总是 不活泼的金属(相对与负极来说意思是比负极不活泼)负极得到电子 (还原反应)
★原电池中,较活泼的一般是负极,较不活泼的一般是正极,但这里的活泼和不活泼是相对于电解质溶液而言的.比如:铁的金属性比铜活泼,但是如果电解溶液是浓硫酸的话,铁会钝化,这时候铜就是负极了.负极放电,通过外路流入正极.这里的“放电”是指电子流出,与电流的方向相反(这你肯定知道的吧,虽然很简单的原理,但是至关重要!).失电子发生氧化反应,得电子发生还原反应(这你也是很清楚的吧~)
★原电池的书写技巧:⑴先确定正负极
⑵若负极反应生成的阳离子与电解质溶液中的阴离子不共存,则电解质溶液中的阴离子应写入负极反应式.
这里氢氧燃料电池的反应式尤其重要.
若正极反应物是氧气,电解质溶液为中性或碱性,H2O必须写入正极的反应式中,O2生成OH-(吸氧腐蚀);若电解质溶液为酸性,则H+必须写入正极反应式中,O2生成H2O(析氢腐蚀).
★电解池的正负判断简单,与正极相连的为阳极,与负极相连的为阴极.
★电解池反应式书写技巧;这个很容易的,只要记得阴阳离子的放电顺序即可.1年前查看全部
- 电解池与原电池对于这个问题我也是一知半解,不能确定电极反应式,主要问题在于对电极反应的物质判断不够明确,也还请老师指点迷
电解池与原电池
对于这个问题我也是一知半解,不能确定电极反应式,主要问题在于对电极反应的物质判断不够明确,也还请老师指点迷津 望淮溪1年前2
望淮溪1年前2 -
 aifeidexuan121 共回答了24个问题
aifeidexuan121 共回答了24个问题 |采纳率83.3%你的老师肯定会跟你讲放电顺序,记住这个顺序,在写电极式最需要注意的就是溶液自身酸碱性1年前查看全部
- 下列关于原电池和电解池的叙述正确的是
下列关于原电池和电解池的叙述正确的是
A 电解池中,阳离子向阴极移动
B 原电池中,阳离子向负极移动
C 原电池失去电子的电极为正极
D 电解池中,与电源负极相连电极为阳极
PS:阳(阴)极正(负)极 什么区别啊 bear461年前2
bear461年前2 -
 郭静_nn 共回答了13个问题
郭静_nn 共回答了13个问题 |采纳率100%正确的是:A、电解池中,阳离子向阴极移动
1、对于原电池而言,有负极正极之分
正极:得到电子的极,发生得电子的反应
负极:失去电子的极,发生失电子的反应
2、对电解池而言,有阴阳极之分
阳极:与外电源的正极相连,阴离子移向的极
阴极:与外电源的负极相连,阳离子移向的极
3、B不对,原电池中,阴离子在负极失去电子,阳离子在正极得到电子;C不对,得电子的极为正极;D不对,与电源负极相连的是阴极.1年前查看全部
- 在物理公式q=it中,在电解池中的问题
在物理公式q=it中,在电解池中的问题
已知在溶液中阳离子完全放电的时间以及电流,那么乘积得出的电荷量是正负离子绝对值之和还是转移的电子数.什么时候是正负离子绝对值之和,什么时候是转移的电子数 EileenCafe1年前2
EileenCafe1年前2 -
 马路qq007 共回答了15个问题
马路qq007 共回答了15个问题 |采纳率86.7%这个公式得出的是转移的电子数.任何一个溶液都满足电荷守恒,也就是说正负离子之和等于0.1年前查看全部
- 电解池中阳极为什么失电子发生氧化反应,阳极不是和电池正极相连吗?那么电子是从阴极移到阳极啊.
电解池中阳极为什么失电子发生氧化反应,阳极不是和电池正极相连吗?那么电子是从阴极移到阳极啊.
所以阴极是失电子发生氧化反应才对吧、 ivwsit1年前1
ivwsit1年前1 -
 小叶子2008 共回答了22个问题
小叶子2008 共回答了22个问题 |采纳率77.3%额,你把正负极与阴阳极弄混了...你想,电池的负极是给出电子的,那么电解时与负极相连的阴极附近的溶液就会得到电子,不就是还原反应嘛...1年前查看全部
- 金属通过形成电解池而腐蚀属于金属腐蚀吗?
 zhangchi20061年前2
zhangchi20061年前2 -
 是谁在扔砖头 共回答了22个问题
是谁在扔砖头 共回答了22个问题 |采纳率95.5%电腐蚀(包括原电池和电解池)电子通过导线转移,速度快,且电解池两端有外加电压,促进了电子的迁移和反应的进行.
属于金属腐蚀1年前查看全部
- 电解池中能不能有气体参加反应
 f1u2c3keva1年前1
f1u2c3keva1年前1 -
 ice_mint 共回答了17个问题
ice_mint 共回答了17个问题 |采纳率100%可以生成气体,但反应物中却真的没有见过用气体的.
若是电池,倒是常用标准气压下氢气和1mol/l的氢离子作为标准电极.1年前查看全部
- 某一电解池,如果在1秒内共有5×10^18个二价正离子和1×10^19个一价负离子通过某一横截面,则通过这个截面的电流强
某一电解池,如果在1秒内共有5×10^18个二价正离子和1×10^19个一价负离子通过某一横截面,则通过这个截面的电流强度是( )
 tiki为乐1年前2
tiki为乐1年前2 -
 tq0bv95 共回答了23个问题
tq0bv95 共回答了23个问题 |采纳率82.6%I=Q/T,其中Q=【5×10^18×2+1×10^19】×e,《e是每个电子的电量,我忘了》.
一楼的,两种电荷的方向当然是相反,因是电解池.1年前查看全部
- 在原电池和电解池中,1molCl-和Cl2得失电子数必为2mol,
 华秀431年前1
华秀431年前1 -
 dachou007 共回答了18个问题
dachou007 共回答了18个问题 |采纳率83.3%不对,1molCl-失电子数应是1mol (这是指生成Cl2而言的,会生成0.5molCl2),1molCl2得电子数才是2mol
倒是 2molCl-和1molCl2得失电子数必为2mol 这还说得过去1年前查看全部
- 铜置换锌的电解池怎样设计?是不是阳极:Cu-2e-=Cu2+阴极:Zn2++2e-=Zn总反应:Cu+ZnSO4=CuS
铜置换锌的电解池怎样设计?
是不是
阳极:Cu-2e-=Cu2+
阴极:Zn2++2e-=Zn
总反应:Cu+ZnSO4=CuSO4+Zn 错了请指出 柏拉园广场1年前3
柏拉园广场1年前3 -
 sy2888 共回答了16个问题
sy2888 共回答了16个问题 |采纳率93.8%楼主电子式错了 楼主问的有些怪 直接电解硫酸锌就可以了(电极用石磨)你要非要用铜当电极 那也是 先氢得电子 得完后才轮到锌离子 ) 毕竟锌活泼性远大于铜1年前查看全部
- 1.有一硝酸盐晶体M(NO3)x·nH2O.将12.1g该晶体溶于水配制成100mLM(NO3)x溶液,并将其置于电解池
1.有一硝酸盐晶体M(NO3)x·nH2O.将12.1g该晶体溶于水配制成100mLM(NO3)x溶液,并将其置于电解池中,用惰性电极电解,当有0.1mol电子通过电极时,溶液中的金属阳离子全部析出,且阴极质量增加了3.2g,若电解后溶液的体积不变,密度为1.032g/cm3.(1)晶体方程式(Cu(NO3)2·3H2O)(2)反应后溶液的物质的量浓度和溶质的质量分数(1mol/L、6.1%)(3)电解后的pH(pH=0) 2.准确称取6g铝土矿(含氧化铝、氧化铁、二氧化硅)样品,放入盛100mL硫酸的烧杯中,充分反应后过滤,向滤液中加入10mol/L的氢氧化钠溶液,则产生的沉淀(g)与所加氢氧化钠溶液的体积(mL)的关系如图.(1)硫酸的物质的量浓度(1.75mol/L)(2)若b=2.75mL,则铝土矿中各组成成分的质量分数是(氧化铝85%氧化铁10%二氧化硅5%)
 xiehuina00001年前1
xiehuina00001年前1 -
 陨石的守望 共回答了21个问题
陨石的守望 共回答了21个问题 |采纳率100%这样想
(1)3.2g为金属M,得到电子0.1mol
列等式:3.2/M*x=0.1→M=32x,因为x要为正整数,而且化合价也要对得上,所以x=2,M=64,为Cu
化学式:Cu(NO3)2·3H2O
(2)Cu的化合价下降,这里只有O的化合价能够上升,生成O2
电解硝酸铜溶液:
Cu2+ + 2e=Cu
2OH- - 2e=2H++O2
Cu2+ + 2OH-=Cu+2H+ + O2↑
所以N的物质的量没有动,也就是12.1/242*2=0.1 mol
物质的量浓度=0.1/0.1=1mol/L
质量分数=0.1*63÷(1.032*100)=0.061
(3)有0.1mol电子得失,那么有0.05molOH-得到电子,也就是有0.05H+生成
接下来就是计算PH值啦1年前查看全部
- 为什么电解池阳极发生氧化反应
 我的日子好好过1年前1
我的日子好好过1年前1 -
 薛侣班 共回答了18个问题
薛侣班 共回答了18个问题 |采纳率100%电解池中,电流是从阳极流向负极,而电子的流动方向是与电流方向相反的,所以是从负极到正极,也就是说,正极得到电子,负极失去电子,所以电极失去电子,化合价升高,发生氧化反应,属于还原剂,顺便给你个口诀,很适用:阳养阴还(阳极氧化,阴极还原),高失氧(化合价升高失电子氧化反应)被氧化还原剂,低得还(化合价降低得电子还原反应)被还原氧化剂.1年前查看全部
- 电解池和原电池问题为什么点解硫酸实质是水电解?硫酸不是也电离H+离子吗?还有原电池中,用中性点解质,Fe和石墨做电极,F
电解池和原电池问题
为什么点解硫酸实质是水电解?硫酸不是也电离H+离子吗?
还有原电池中,用中性点解质,Fe和石墨做电极,Fe与O2反应,这时,为什么Fe会氧化成2+而不是3+?氧气不是有强氧化性吗? ll博客91年前3
ll博客91年前3 -
 yushoujun 共回答了21个问题
yushoujun 共回答了21个问题 |采纳率90.5%电解池中,电解的实质是阴阳离子电解硫酸时,你得明确此时溶液中的阳离子只有氢离子,不存在活泼性的先后,而阴离子有硫酸根和氢氧根(水中的),就存在氧化的先后问题了,是先氧化硫酸根还是氢氧根了.根据活泼性可知(这个活泼性是需要背下来的,氢氧根活泼性大于酸根离子,比如硫酸根,磷酸根,碳酸根等,并且活泼性大的先反应),氢氧根先被氧化,也就是说在阳极,氢氧根被氧化,在阴极,氢离子被还原,就相当于电解水了.
至于Fe和石墨做电极,Fe与O2反应,这时,为什么Fe会氧化成2+而不是3+,是因为一般情况下铁只能失电子成二价,Fe只会氧化成2+ 在空气中Fe2+会变成三价,也就是说在溶液中的反应,只能氧化到正二价,不容易到正三价.1年前查看全部
- 原电池如果作为电解池的电源,电子流动方向怎么不一致
原电池如果作为电解池的电源,电子流动方向怎么不一致
如果原电池作为电解池的电源的话 那么它们的电子流动方向应该是一致的,但是看辅导书上的对电解池(上图)和原电池(下图)的电子流动示意图 ,电解池的电子是正极到负极的,原电池的
电子是负极到正极,这是怎么回事?还有原电池有内外电路的说法,它的内外是相对什么说的?


还有下图中的课本上的铜锌原电池,实验印证发生了Zn还原CuSO4反应,铜离子在另一个烧杯中,没和Zn直接接触,它是怎么到另一个有Zn棒的烧杯中的呢?

 红笺紫函1年前2
红笺紫函1年前2 -
 我爱灌水 共回答了22个问题
我爱灌水 共回答了22个问题 |采纳率77.3%姐姐请你看清楚一点,电解池电子从电源负极出来,经过阴极到达溶液,再到阳极,经过电源正极回到电源.原电池的电子也是从负极出来,到外电路,再到正极回电源.有什麽区别?
原电池的内电路是电解质加两极这一部份,外电路就是除了内电路以外的部份
那是原电池原理,你不用管那麼多1年前查看全部
- 怎样判断,电解池和原电池?是原电池能自发进行氧化还原反应,电解池不能?
 yjqqqqyv1年前2
yjqqqqyv1年前2 -
 sally_17 共回答了13个问题
sally_17 共回答了13个问题 |采纳率69.2%没错,还可以从装置中用没用电源,电极材料是不是一活一钝,是不是燃料电池等来判断1年前查看全部
- 电化学中电解池部分的化学方程式该怎么写?(阴阳两极分开写)
电化学中电解池部分的化学方程式该怎么写?(阴阳两极分开写)
电解质不同时,方程式中有时有OH根,有时是别的酸根等等。看的话能看懂,让我根据题目写, landonge1年前3
landonge1年前3 -
 岸边蝴碟 共回答了23个问题
岸边蝴碟 共回答了23个问题 |采纳率95.7%电解池的电极反应符合异性相吸的原理,阳极连着电源的正极带正电性,所以能吸引溶液中的阴离子到电极上反应,而阴极连着电源的负极带负电性,能吸引溶液中的阳离子到电极上反应.参加电极反应的离子有一定的顺序:阳离子一般以金属活动性顺序表为基准,排在H+后面的金属阳离子先得电子,如果是活泼金属的阳离子则轮到水电离出来的H+先得电子;阴离子看组成,如果是简单阴离子如 Cl-、Br-、S2-等,那么就是它们先失电子,如果酸根阴离子是硫酸根离子、碳酸根离子、硝酸根离子这些复杂原子团时,那么就轮到水电离出来的OH-先失电子了
如: 电解NaCl溶液:阳离子是H+在阴极得电子,阴离子就是Cl-在阳极失电子;
电解Na2SO4溶液:阳离子是H+在阴极得电子,阴离子就是OH-在阳极失电子;
电解CuSO4溶液:阳离子是Cu2+在阴极得电子,阴离子就是OH-在阳极失电子;
电解CuCl2溶液:阳离子是Cu2+在阴极得电子,阴离子就是Cl-在阳极失电子;1年前查看全部
- 下列叙述正确的是( )A.在原电池的负极和电解池的阴极上都发生氧化反应B.用惰性电极电解Na2SO4溶液,阴阳两极产物
下列叙述正确的是( )
A.在原电池的负极和电解池的阴极上都发生氧化反应
B.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2
C.用惰性电极电解饱和NaCl溶液,若有1mol电子转移,则生成1mol NaOH
D.原电池中,活泼金属只能作负极 jiaopi1681年前1
jiaopi1681年前1 -
 才云hh 共回答了17个问题
才云hh 共回答了17个问题 |采纳率82.4%解题思路:A.电解池的阴极发生还原反应;
B.用惰性电极电解Na2SO4溶液,阴阳两极产物分别为H2和O2;
C.用惰性电极电解饱和NaCl溶液,发生2NaCl+2H2O
2NaOH+H2↑+Cl2↑;电解 .
D.原电池中,活泼金属也可作正极,应是较强的金属为负极.A.原电池的负极发生氧化反应,电解池的阴极发生还原反应,故A错误;
B.用惰性电极电解Na2SO4溶液,阴阳两极产物分别为H2和O2,阴阳两极产物的物质的量之比为2:1,故B错误;
C.用惰性电极电解饱和NaCl溶液,发生2NaCl+2H2O
电解
.
2NaOH+H2↑+Cl2↑,若有1mol电子转移,则生成1mol NaOH,故C正确;
D.Mg、Al碱性原电池中,Mg为正极,Al为负极,故D错误.
故选C.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查原电池和电解池的工作原理,为高考常见题型,注意把握工作原理以及电极方程式的书写,易错点为D,注意能举出反例,题目难度中等.1年前查看全部
- 硫酸和氯化钠在电解池中电解为什么先电解硫酸中的氢离子而不电解水中的氢离子?
硫酸和氯化钠在电解池中电解为什么先电解硫酸中的氢离子而不电解水中的氢离子?
只电解硫酸的话为什么电解的又是水中的氢离子,两者有什么不同,请用最易懂的话说,我是一名高中生,
是硫酸和氯化钠一起在溶液中 yunitongzai1年前2
yunitongzai1年前2 -
 zhboy1314 共回答了20个问题
zhboy1314 共回答了20个问题 |采纳率95%因为硫酸中氢的浓度高,所以就先电解硫酸中的氢离子
随着反应的进行,硫酸中氢的浓度为0
就开始电解水的啦
不是还有一个阴离子的放电顺序么1年前查看全部
- 如下图所示甲、乙为相互串联的两电解池.试回答:
如下图所示甲、乙为相互串联的两电解池.试回答:
乙池中Fe极电极反应式为___________ 为什么说下
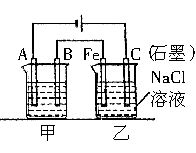
 呐呐大人1年前1
呐呐大人1年前1 -
 e2453606b60e20a3 共回答了16个问题
e2453606b60e20a3 共回答了16个问题 |采纳率81.3%NaCl溶液在通电的情况下会生成NaOH,Cl2,H2,在通电的情况下是发生电解水的反应,然后OH-和二价亚铁离子反应,还会和空气中的氧气发生反应.
FE+水——氢氧化亚铁+氢气
氢氧化亚铁+氧气——氢氧化铁
其中在电解过程中产生的亚铁离子会和氢氧化钠中的OH-发生反应1年前查看全部
- 急!电解池中硫酸电极反应方程式两端电极都是C
 雾中迷茫1年前1
雾中迷茫1年前1 -
 myanfen 共回答了12个问题
myanfen 共回答了12个问题 |采纳率91.7%好像是:负极:2H+ + 2e- =H2
正极:4OH- - 4 e-= 2H2O + O21年前查看全部
- 电解池反应正负极通式和总反应的化学方程式
 SaRaPhim1年前2
SaRaPhim1年前2 -
 jwjsrh 共回答了13个问题
jwjsrh 共回答了13个问题 |采纳率84.6%普通的锌锰干电池的电极反应式和总反应式如下:
正极:2NH4+ + 2e- + 2MnO2 = 2NH3 + Mn2O3 + H2O
(包括极区反应H2+2MnO2=Mn2O3+H2O,教材此处已在试用版的基础上得到修正)
负极:Zn - 2e- = Zn2+
该电池总反应式为(狭义):
Zn + 2NH4+ + 2MnO2 = Zn2+ + 2NH3 + Mn2O3 + H2O(一般常用此式表示)
若还包括两极各自产物Zn2+和NH3在溶液中的络合反应{ Zn2+ + 4NH3 = [Zn(NH3)4]2+},则该电池反应的总反应式(广义)即为:
2Zn + 4NH4+ + 4MnO2 = Zn2+ +[Zn(NH3)4]2+ + 2Mn2O3 +2 H2O.1年前查看全部
- 电解池原电池1Lk2SO4 CuSO4 的混合溶液中 【SO4】=2mol/L 用石墨做电极电解此溶液 通电一段时间后
电解池原电池
1Lk2SO4 CuSO4 的混合溶液中 【SO4】=2mol/L 用石墨做电极电解此溶液 通电一段时间后 两级均收集到22.4L气体 则原溶液 【K+】为
阴阳极各发生什么反应 ouyang_hz1年前2
ouyang_hz1年前2 -
 jereny 共回答了11个问题
jereny 共回答了11个问题 |采纳率100%阳极:2H2O-4e- == 4H+ +O2
阴极:Cu2+ +2e- == Cu 2H+ +2e- ==H2
c(K+)= 2mol/L1年前查看全部
- 原电池怎样做电解池的电源啊,电子不是只能从导线流过吗,这我有点不懂,谢谢老师回答
 冷月兰1年前1
冷月兰1年前1 -
 123茶 共回答了11个问题
123茶 共回答了11个问题 |采纳率100%把原电池和电解池串联起来呀
比如以铜锌原电池为电源,点解硫酸铜溶液
导线链接铜电极和电解池的一个电极,锌电极链接电解池的另一电极1年前查看全部
- 原电池和电解池中,如果某极有沉淀生成,电极质量是增加还是减小
 lmiyd1年前1
lmiyd1年前1 -
 MP4专卖 共回答了17个问题
MP4专卖 共回答了17个问题 |采纳率82.4%如果有沉淀生成,说明电极中的金属溶解生成离子进入溶液,与电解质溶液中的离子反应生成了沉淀,则电极质量减小.如果是电镀,即在阴极金属离子得电子还原为金属,则阴极电极的质量增大.1年前查看全部
- 电解池如何判断正负,与原电池的区别 ,如何写反应式
 bx23971年前1
bx23971年前1 -
 jieli_72 共回答了16个问题
jieli_72 共回答了16个问题 |采纳率93.8%解析:
★原电池中,较活泼的一般是负极,较不活泼的一般是正极,但这里的活泼和不活泼是相对于电解质溶液而言的.比如:铁的金属性比铜活泼,但是如果电解溶液是浓硫酸的话,铁会钝化,这时候铜就是负极了.负极放电,通过外路流入正极.这里的“放电”是指电子流出,与电流的方向相反(这你肯定知道的吧,虽然很简单的原理,但是至关重要!).失电子发生氧化反应,得电子发生还原反应(这你也是很清楚的吧~)
★原电池的书写技巧:⑴先确定正负极
⑵若负极反应生成的阳离子与电解质溶液中的阴离子不共存,则电解质溶液中的阴离子应写入负极反应式.
这里氢氧燃料电池的反应式尤其重要.
若正极反应物是氧气,电解质溶液为中性或碱性,H2O必须写入正极的反应式中,O2生成OH-(吸氧腐蚀);若电解质溶液为酸性,则H+必须写入正极反应式中,O2生成H2O(析氢腐蚀).
★电解池的正负判断简单,与正极相连的为阳极,与负极相连的为阴极.
★电解池反应式书写技巧;这个很容易的,只要记得阴阳离子的放电顺序即可.
好累啊~~
这些都是我高考的法宝,我老师很关注电化学的,我也学的很用心的,所以高考考到这些我一点都不怕的.
看在我一个字一个字打出来的份上,把分给我吧!~~Т Т
-1年前查看全部
- 原电池的正极和电解池的阳极反应本质是否相同?为什么?
 金ww1年前1
金ww1年前1 -
 nicolaou 共回答了14个问题
nicolaou 共回答了14个问题 |采纳率78.6%不.原电池正极上的物质得电子,化合价降低,是还原反应;而电解池的阳极和电源的正极相连,化合价升高,是氧化反应.这就是本质区别.1年前查看全部
- 原电池电解质溶液中阴阳离子怎么移动?与电解池中一样吗?
 laovers1年前1
laovers1年前1 -
 tomcat999 共回答了15个问题
tomcat999 共回答了15个问题 |采纳率100%有 都是阳离子向电子堆积的地方搞点电子回来,我称她“放电”
在原电池里面,电子堆积在正极,所以阳离子跑到正极去
在电解槽中,电子在阴极,所以阳离子跑到阴极去
这样说应该还是清楚吧.1年前查看全部
- 求电解池原电池中的有关电子转移的问题
求电解池原电池中的有关电子转移的问题
这些是化学《化学反应原理》这本里面的知识点……可是我总是做不熟练,不是很会分析这类的问题…所以…求这类问题咯…
如
“有三个烧杯,分别盛有氯化铜、氯化钾和硝酸银三种溶液,均以铂作为电极,将他们串联在一起一段时间,侧得电极增重综合2.8克,这时产生的有色气体与物色气体量之比是多少?”
这样的问题,就是在解题过程中要运用到电子转移、得失电子守恒的这类型…要题目、答案和详细的讲解(详解是最重要的!)…总共要20题,有多的当然更好……
然后劳烦大家跟我讲解下做这类问题的关键点……提前谢谢了, 拾海者1年前1
拾海者1年前1 -
 如果415 共回答了16个问题
如果415 共回答了16个问题 |采纳率81.3%用惰性电极电解500毫升1mol/L含硫酸铜的氯化钠溶液,当两极都生成11.2L(标况下)气体时,求硫酸铜溶液的物质的量浓度?(忽略反应过程当中的体积变化)
方程式是
2CuSO4+2H2O 电解== 2Cu + O2↑ + 2H2SO4
2NaCl+2H2O 电解== 2NaOH+H2↑+Cl2↑
首先,因为电解液是硫酸铜和氯化钠的混合溶液,所以阳极首先电解出的是氯气Cl2再是氧气,阴极首先电解出的是金属铜Cu再是氢气 .因为氯化钠溶液量浓度是1mol/L,且体积是500ml,所以氯化钠物质的量是0.5×1=0.5mol.
由题可知在标况下两极产生11.2L的气体,那么两极也就产生了0.5mol的气体,可以知道在阳极区先开始产生的是氯气,因为氯离子物质的量为0.5mol,显然阳极产生的气体不会全部是氯气,因为产生0.5mol氯气需要1mol的氯离子.所以可知在阳极还产生了另一种气体那就是氧气.且氯离子是被电解完了的,所以只能产生0.25mol氯气且失去0.5mol的电子,所以剩下0.25mol气体就是氧气了(因为只有氯离子电解完了才可以产生氧气),又可知产生1mol氧气需要失去4mol电子,所以产生0.25mol氧气就失去了1mol电子,这样阳极就总共失去了1.5mol电子.
根据电子守恒可知阴极得到1.5mol电子,由于阴极产生了0.5mol气体(可以肯定这是氢气)可知产生1mol氢气需得到2mol电子,那么产生0.5mol氢气就得到了1mol电子,那么还剩下0.5mol电子由铜离子得到成为单质铜,因为氢气是铜离子电解完后才能产生的,所以可知电解后溶液里已经不存在铜离子,又知1mol铜离子得到2mol电子成为铜单质,那么0.5mol电子就被0.25mol铜离子全部得到了,所以总共有0.25mol铜离子.
根据公式可以得到硫酸铜的量浓度为0.25÷0.5=0.5mol/L1年前查看全部
- 在原电池和电解池的电极上所发生的反应,同属氧化反应或同属还原反应的是( )
在原电池和电解池的电极上所发生的反应,同属氧化反应或同属还原反应的是( )
①原电池正极和电解池阳极所发生的反应
②原电池正极和电解池阴极所发生的反应
③原电池负极和电解池阳极所发生的反应
④原电池负极和电解池阴极所发生的反应.
A. ①②
B. ①④
C. ②③
D. ③④ realstone_lr1年前3
realstone_lr1年前3 -
 silingsan 共回答了16个问题
silingsan 共回答了16个问题 |采纳率87.5%解题思路:得电子化合价降低的反应物发生还原反应,失电子化合价升高的反应物发生氧化反应,据此分析解答.得电子化合价降低的反应物发生还原反应,失电子化合价升高的反应物发生氧化反应,原电池负极和电解池阳极上失电子发生氧化反应、原电池正极好电解池阴极上得电子发生还原反应,故选B.
点评:
本题考点: 氧化还原反应.
考点点评: 本题考查了氧化还原反应,根据得失电子确定反应类型,知道原电池和电解池各个电极上发生的反应,题目难度不大.1年前查看全部
- 电解池中两极为铁和碳棒,电解液可以为纯水吗?
电解池中两极为铁和碳棒,电解液可以为纯水吗?
如果可以,那么生成的沉淀是在两极之间的溶液中生成还是在电极上生成? hxy12121年前3
hxy12121年前3 -
 aa一族 共回答了20个问题
aa一族 共回答了20个问题 |采纳率90%纯水是极弱电解质,理论上是可以,如果你有耐心等上几天到几个月的话````因为铁被氧化,进入溶液,所以电导率会随反应进程而逐渐增大,还是可行的.如果惰性电极电解纯水的话,几百年都有可能.
生成的沉淀在两极之间.1年前查看全部
- 原电池与电解池的区别最好是全部希望能有原电池与电解池的特点都讲一下 请稍微简略一点
 fish5205801年前1
fish5205801年前1 -
 libel 共回答了17个问题
libel 共回答了17个问题 |采纳率94.1%电解池与原电池有什么区别?(正负极、阴阳极;氧化反应、还原反应;电荷移动规律)`(1)能量转化形式:(2)电极材料名称:(3) 电极反应:(4) 反应的异同点:氧化还原反应(自发与非自发) 板书 酸碱盐溶液的电解规律 酸碱盐 电极反应式 电解反应式 PH变化 (A)硫酸溶液 阳:阴:减小 (B)盐酸 阳:阴:增大 (C)氢氧化钠 阳:阴:增大 (D)硫酸钠 阳:阴:不变 (E)氯化钠 阳:阴:增大 (F)硫酸铜 阳:阴:减小 (G)氯化铜 阳:阴:----- 从以上表可以看出,用惰性电极电解酸、碱、盐的水溶液时,其基本规律是:1. 电解无氧酸或无氧酸的中等或不活泼金属盐溶液时,相当与溶质本身被分解.如(B)、(F)、(G).2. 电解强碱、含氧酸或含氧酸的强碱盐溶液,相当与电解水.如(A)、(C)、(D).3. 电解不活泼金属或中等活泼金属的含氧酸盐溶液,生成金属、含氧酸和氧气.如:(F).4. 电解活泼金属的无氧酸盐溶液,生成氢气、碱和金属单质.如(E).PH值的变化:(1) 析氢吸氧(2) (一)阴极出氢气,阳极不出氧气(二)阴极不出氢气,阳极出氧气(三)阴极出氢气,阳极出氧气,电解水.板书 二.电解原理的应用(一) 电解饱和食盐水 (-) (+) 阴极(Fe) 阳极(C)NaCl === Na+ + Cl-H2O=== H+ + OH-阳极:Cl- 、OH-阴极:Na+、H+放电能力:Cl->OH-;H+>Na+阳极:2Cl- -2e === Cl2(氧化反应)阴极:2H+ + 2e == H2(还原反应)现象:两极均产生气体,阳极气体有刺激性气味,能使淀粉碘化钾试纸变蓝,两极滴加酚酞,发现阴极区酚酞变红.阴极:由于氢气的产生而破坏了阴极区水的电离平衡,使氢氧根离子浓度增大,生成氢氧化钠,所以滴加酚酞显红色.板书 总反应方程式:2NaCl + 2H2O === 2NaOH + H2 + Cl2 (阴极区)(阴极)(阳极) 简介 设备:立式隔膜电解槽 阳极:金属钛或石墨 阴极:铁丝网(附在一层石棉绒)阳极室 阴极室隔膜作用:氢氯混合易爆炸、氯气与碱发生反应.氢氧化钠、氯化钠的分离:加热蒸发,析出氯化钠晶体(重结晶)流程:溶盐、精制、电解、提纯.板书 (二)铝的冶炼 介绍 铝是地壳含量最多的金属元素,又是用途很广的金属,但是由于他是较活泼的金属,自然界没有单质铝存在,很难制取他.用钠还原氧化铝,成本很高,不能大量生产,1886年,青年科学家霍尔发明了用电解法制铝以后,才大量生产铝.板书 基本原料:铝土矿(Al2O3)纯氧化铝 熔点:2045 难熔化助熔剂:Na3AlF6电解槽:长方形,外面是钢壳.内村耐火砖 碳作槽池(阴极)、两个碳快作阳极.阴极:4Al3+ + 12e === 4Al阳极:6O2- - 12e ==== 3O2总反应方程式:2Al2O3=== 4Al + 3O2C + O2 === CO2液态铝的密度大于熔融冰晶石-氧化铝的密度,沉于槽底,定期取出.板书 (三)电镀:应用电解的原理在某些金属表面镀上一层其他金属或合金的过程.目的:使金属增强抗腐蚀的能力,增加美观和表面硬度.实验 (-) (+) 阳极:Zn -2e === Zn2+ Fe Zn阴极:Zn2+ + 2e === Zn ZnCl2 ZnCl2 电镀的结果:阳极的锌不断溶解,阴极的锌不断析出,且减少和增加锌的质量相等.电解质溶液氯化锌的浓度不变.阴极:待镀物件阳极:镀层金属电解质:镀层金属盐特点:阳极本身也参加了电极反应(失电子溶解) 介绍 铜的精炼.练习 用石墨作电极电解硫酸铜溶液(体积为1L、1mol/L)当电路通过0.5mol电子时,溶液中铜离子浓度为 ,氢离子浓度为 ;然后将电源反接,又通过1mol电子,溶液中铜离子浓度为 、硫酸根离子浓度为 、氢离子浓度为 .(1年前查看全部
- 电解池中如果是活性阳极,阴阳两极的点解反应式怎么写
 ok6111年前1
ok6111年前1 -
 xiaozhu841017 共回答了9个问题
xiaozhu841017 共回答了9个问题 |采纳率100%阴极原来怎么写就怎么写,阳极就只写活泼金属失去电子价态升高.
例如铜电解精炼的原理如下:
阳极反应:Cu — 2e = Cu2+阴极反应:Cu2+ + 2e = Cu1年前查看全部
- 电解池中,电子是由负极经外电路流向正极,还是有电解质溶液流向负极?电流是由经过外电路还是电解质溶液
 天职也1年前1
天职也1年前1 -
 qepwq133 共回答了22个问题
qepwq133 共回答了22个问题 |采纳率86.4%一个电路中,导电的质子,带正电荷的就跟电流方向相同,带负电的就跟电流方向相反,这个是由电流的定义决定的.
所以电路回路中,有电子参与导电的部分,电子流动方向是跟电流相反的.
整个回路都有电流,包括外电路跟电解质溶液.外电路中,电子从电源负极流出,到达电解质溶液,由电解质溶液的导电离子参与导电(正离子与电流方向相同,流向负极;负离子与电流方向相反,流向正极),最后从导电溶液出来的电子流向电源正极.1年前查看全部
- 如何判断电解池中物质的得失电子的产物
 loy9901年前3
loy9901年前3 -
 瘦羊博士 共回答了15个问题
瘦羊博士 共回答了15个问题 |采纳率86.7%电解池里浮只羊,原电池里两只羊
即电解池中负极为氧化反应 ,原电池中阳极为氧化反应
再由升失氧,降得还
即氧化反应失电子,还原反应得电子
多做一些习题就可以掌握1年前查看全部
- 电解池中OH根放电形成什么?怎样反应?H离子我懂,只是OH根生成氧气步骤不怎么明白
 QQ07211年前2
QQ07211年前2 -
 liupps 共回答了23个问题
liupps 共回答了23个问题 |采纳率91.3%OH-,是阴离子,所以只能向阳极动,阳极发生的是氧化反应,即失去电子,电子是负的,即OH-会失去负电荷,被氧化,化合价会升高
H已经是+1价,不能再升高了
所以只能是O从-2价升高,所以产物有O2
每生成1个O2,化合价升高2*2=4,即要失去4个e-,所以就是4个OH-失去4个e-
4OH- - 4e- = O2 + H2O1年前查看全部
- 高中化学(电解)刚刚看到这句话:电子流向是,电子由电解池的阳极流出,流回直流电源的正极.由直流电源负极流出流到电解池的阴
高中化学(电解)
刚刚看到这句话:电子流向是,电子由电解池的阳极流出,流回直流电源的正极.由直流电源负极流出流到电解池的阴极.
那老师上课说的 电子的流向从负极到正极
电子流向到底从哪到哪啊
 9522191年前1
9522191年前1 -
 wuqinghui1984 共回答了18个问题
wuqinghui1984 共回答了18个问题 |采纳率88.9%电解池外接电源的正极,是电解池中的阳极;外接的负极,是电解池中的阴极.
在电解池的外部,电子由正极流向负极.
在电解池的内部,阴离子带着电子从阴极流向阳极;阳离子带着正电荷从阳极流向阴极.
你一定把老师的的话听错了.因为在电解池内部没有负极和正极只有阴极和阳极.老师也不可能说电解池中“ 电子的流向从负极到正极”,因为电解池中是离子的转移,或称流动也可以,不是电子的流动.1年前查看全部
- 电解精炼铜时,电解池每转移一摩尔电子,阳极溶解的铜原子为0.5NA
电解精炼铜时,电解池每转移一摩尔电子,阳极溶解的铜原子为0.5NA
这句话为什么不对 本日蛋塔1年前2
本日蛋塔1年前2 -
 疯掉算了 共回答了15个问题
疯掉算了 共回答了15个问题 |采纳率100%既然是精炼说明这个铜里面有其它的杂质,比如Fe,这样溶解的铜原子就少于0.5NA了1年前查看全部
- 电解熔融碳酸盐的产物麻烦问下 电解熔融态的碳酸盐生成什么?阴极是什么 阳极是什么 记住 是 电解池 而非原电池 还有 电
电解熔融碳酸盐的产物
麻烦问下 电解熔融态的碳酸盐生成什么?
阴极是什么 阳极是什么
记住 是 电解池 而非原电池
还有 电子是怎么移动的?
烦劳诸位 stakistaki1年前1
stakistaki1年前1 -
 writer71529 共回答了19个问题
writer71529 共回答了19个问题 |采纳率84.2%产物 相应的阳离子金属 一氧化碳和氧气 阴极 与电源负极相连 阳极与电源正极连接 电子由负极向正极 移动1年前查看全部
- 右图表示一个电解池,电解液ɑ是足量的饱和NaCl溶液,X、Y都是石墨电极,实验开始前,在两边各滴入几滴酚酞试液,则:
 右图表示一个电解池,电解液ɑ是足量的饱和NaCl溶液,X、Y都是石墨电极,实验开始前,在两边各滴入几滴酚酞试液,则:
右图表示一个电解池,电解液ɑ是足量的饱和NaCl溶液,X、Y都是石墨电极,实验开始前,在两边各滴入几滴酚酞试液,则:
(1)X电极上的电极反应式为______,在X极附近观察到的现象是______.
(2)Y电极上的电极反应式为______,若在X电极处收集到标准状况下的气体224mL,则Y电极处生成物的质量为______ g. mcpbv1年前1
mcpbv1年前1 -
 安徽rr 共回答了19个问题
安徽rr 共回答了19个问题 |采纳率94.7%解题思路:(1)依据装置图可知X为电解池阴极,溶液中氢离子得到电子发生还原反应生成氢气,破坏了水的电离平衡,溶液中氢氧根离子浓度增大;
(2)Y电极和电源正极连接是电解池的阳极,溶液中氯离子失电子发生氧化反应失电子生成氯气;依据X电极生成的氢气物质的量计算Y电极生成的氯气;(1)装置图可知X连接电源负极,为电解池阴极,溶液中氢离子得到电子发生还原反应生成氢气,电极反应为:2H++2e-=H2↑,破坏了水的电离平衡,溶液中氢氧根离子浓度增大,酚酞变红色;
故答案为:2H++2e-=H2↑,生成无色气体,X电极附近溶液变红;
(2)Y电极和电源正极连接是电解池的阳极,溶液中氯离子失电子发生氧化反应失电子生成氯气,Y电极上的电极反应式为2Cl--2e-=Cl2↑,若在X电极处收集到标准状况下的气体224mL是氢气,物质的量为0.01mol,依据电子守恒计算得到氯气为0.01mol,生成氯气质量=0.01mol×71g/mol=0.71g;
故答案为:2Cl--2e-=Cl2↑,0.71g;点评:
本题考点: 电解原理.
考点点评: 本题考查电解原理的应用,主要是电极判断,电极反应应用,题目较简单.1年前查看全部
- 电解池的阳离子得电子能力其中Al3+<H+(水中)<Zn2+<.<H+(酸性)<.如果是硫酸溶液 那么H+先于Zn2+得
电解池的阳离子得电子能力
其中Al3+<H+(水中)<Zn2+<.<H+(酸性)<.
如果是硫酸溶液 那么H+先于Zn2+得电子 如果是水溶液 Zn2+先于H+得电子
那如果是ZnSO4这样的盐溶液呢? yxcmcu1年前3
yxcmcu1年前3 -
 虎纠仁 共回答了25个问题
虎纠仁 共回答了25个问题 |采纳率88%ZnSO4这样的盐溶液就是水溶液了,所以Zn2+先于H+得电子1年前查看全部
- 已知电解池总方程式1已知总方程式写阴阳极,需要知道电解质是酸性还是碱性吗?2为什么电解饱和食盐水我根据总方程式写不出阴极
已知电解池总方程式
1已知总方程式写阴阳极,需要知道电解质是酸性还是碱性吗?2为什么电解饱和食盐水我根据总方程式写不出阴极方程式,因为水拆不了.3冷却结晶和蒸发结晶怎么区分 csallen5001年前2
csallen5001年前2 -
 lcxcyj 共回答了16个问题
lcxcyj 共回答了16个问题 |采纳率87.5%1.高中阶段,我们这边是不要求电解质是酸性还是碱性对电极方程式的影响的,但是大学或者竞赛里就一定要求,或者题目中给出.
而且,知道了总方程式,一般都能根据反应物推出电解质的酸碱性的.
2.电解饱和食盐水:
2NaCl+2H2O==(电解)==2NaOH+Cl2+H2
离子方程式:2H2O+2H2+Cl- ====2OH-+ Cl2+H2
阳极被氧化:Cl- —— Cl2
配平:2Cl-====Cl2+2e-
阴极被还原:H2O——H2+OH-
配平:2H2O+2e-====H2+2OH-
3.冷却结晶一般是跟在加热浓缩之后,也就是“冷却热饱和溶液法”,结晶出来的一般是漂亮的晶体,而且是在溶液中就析出晶体的
蒸发结晶是加热至溶剂全部挥发,出来的一般是粉末,像高中、初中常见的提取粗盐实验中,在坩埚中把粗盐溶液蒸发完全.1年前查看全部
- 电解池阴阳极怎么分
 johnliu1231年前1
johnliu1231年前1 -
 梦中的芙蓉 共回答了17个问题
梦中的芙蓉 共回答了17个问题 |采纳率94.1%原电池中活泼金属做负极,发生氧化反应.相应的不活泼金属或非金属做正极,发生还原反应. 电解池的阴阳极正好和原电池相反,阴极对应正极,即发生还原反应,而阳极对应负极,发生氧化反应.1年前查看全部
- 高中化学电解池中的阴阳离子真的定向移动吗?,就拿nacl说,na+在溶液中移动吗?水电离出的h+在阴极放点后,剩下的oh
高中化学
电解池中的阴阳离子真的定向移动吗?,就拿nacl说,na+在溶液中移动吗?水电离出的h+在阴极放点后,剩下的oh—会移动吗?如果移动,什么时候移动?,怎么移动,(解答时多讲讲离子移动方面的事) 纳兰若儿1年前2
纳兰若儿1年前2 -
 lagostine 共回答了19个问题
lagostine 共回答了19个问题 |采纳率94.7%电解池中的阴阳离子在外加直流电源的电场力的作用下发生定向移动,比如电解NaCl溶液,Na+在溶液中定向移动到阴极,水在阴极放电后剩下的OH-也会定向移动到阳极.当电路形成闭合回路时,就会发生移动.1年前查看全部
- 某电解池内盛有Cu(NO3)2溶液,插入两根电极,接通直流电源后,欲达到如下要求:阳极质量不变;a阳极质量不变,b阴极质
某电解池内盛有Cu(NO3)2溶液,插入两根电极,接通直流电源后,欲达到如下要求:阳极质量不变;a阳极质量不变,b阴极质量增加;c电解液pH减小,则应选用的电极是( )
①阴阳两极都用石墨
②铜作阳极铁作阴极
③铁作阳极铜作阴极
④铂作阳极铜作阴极.
A.①③
B.①②
C.③④
D.①④ 纪海1年前1
纪海1年前1 -
 忧游uu 共回答了16个问题
忧游uu 共回答了16个问题 |采纳率81.3%解题思路:依据电解原理分析,电极若是惰性电极,溶液中的阴离子在阳极失电子发生氧化反应,若阳极是活性电极,则电极本身是单质发生氧化反应,电极质量减小;阴极是溶液中阳离子得到电子发生还原反应;欲达到如下要求:a阳极质量不变 b阴极质量增加 c电解液pH减小,是惰性电极做阳极,电解质溶液中铜离子得到电子在阴极析出,阳极是溶液中氢氧根离子放电生成氧气,溶液中氢离子浓度增大,pH减小.依据电解原理分析,电极若是惰性电极,溶液中的阴离子在阳极失电子发生氧化反应,若阳极是活性电极,则电极本身是单质发生氧化反应,电极质量减小;阴极是溶液中阳离子得到电子发生还原反应;欲达到如下要求:a阳极质量不变 b阴极质量增加 c电解液pH减小,是惰性电极做阳极,电解质溶液中铜离子得到电子在阴极析出,阳极是溶液中氢氧根离子放电生成氧气,溶液中氢离子浓度增大,pH减小,
①阴阳两极都用石墨电极,电解反应为2CuSO4+2H2O
通电
.
2Cu+O2↑+2H2SO4,符合要求条件,故①符合;
②铜作阳极,铁作阴极,阳极是活性电极铜失电子质量减小,不符合题干条件,故②不符合;
③铁作阳极,铜作阴极,阳极是活性电极铁失电子质量减小,不符合题干条件,故③不符合;
④铂作阳极,铜作阴极,阳极是惰性电极,电解反应为2CuSO4+2H2O
通电
.
2Cu+O2↑+2H2SO4,符合要求条件,故④符合;
故选:D.点评:
本题考点: 电解原理.
考点点评: 本题考查了电解原理的分析判断,主要是阳极材料的分析应用,掌握基础是关键,题目难度中等.1年前查看全部
- 在电解池中,阳极的电极材料一定发生氧化反应,这句话对吗,如果错错在
 小猪笨笨mei1年前2
小猪笨笨mei1年前2 -
 金贝子 共回答了22个问题
金贝子 共回答了22个问题 |采纳率95.5%不一定,惰性电极就不会发生氧化反应,比如石墨(C单质),金,铂.别的都会发生氧化反应.
题目的表述太绝对了,所以是错的1年前查看全部
- 一个有关原电池和电解池的问题如何根据离子方程式来判断是电解池还是原电池.例如Cu+2H+=Cu2+ +H2,是电解池还是
一个有关原电池和电解池的问题
如何根据离子方程式来判断是电解池还是原电池.
例如Cu+2H+=Cu2+ +H2,是电解池还是原电池? huangpulaohua1年前4
huangpulaohua1年前4 -
 蒸发空气 共回答了17个问题
蒸发空气 共回答了17个问题 |采纳率82.4%电解池.
原电池中发生的反应一定都是自发的,而Cu不能和H+自发进行反应,所以一定要通过电解才能进行.1年前查看全部
- Y电解池中阳离子为什么向阴极移动
 Lallie1年前3
Lallie1年前3 -
 limeflowers 共回答了20个问题
limeflowers 共回答了20个问题 |采纳率90%电解池中电流由正极流向负极,电子是由负极流向正极.
阴极发生还原反应,物质化合价降低,所以阴极与负极相连,阴极得到电子,而电解池中阳离子会被还原,所以向阴极移动,阳离子得电子一般生成单质.1年前查看全部
- 电解池的离子放电请解释一下什么是离子放电?怎么放 谁放电 举个例子
 西夏的梦1年前3
西夏的梦1年前3 -
 csodifupaosufd 共回答了20个问题
csodifupaosufd 共回答了20个问题 |采纳率95%离子得失电子:阴离子失电子、阳离子得电子,使离子所带电荷数降低.1年前查看全部
大家在问
- 1把含盐15%的盐水800克稀释成含盐5%的盐水,要加水多少克?
- 2虽在农与工肆之人,有能则举之 成语
- 3下列各离子组中,可以在水溶液中大量共存的是?
- 4九年级物理所有物体在对外做功时,它的内能都会减小,这种说法正确吗
- 5近义词 颂歌颂歌(近)高唱(反)
- 6小数化为最简整数比的方法快,快,快,十万火急
- 74分之1乘以X乘以5分之3等于30分之17
- 8Sue is 15 years old.I'm15 years old,too.(用the same合并句子)
- 9三角形重心坐标公式怎么推是坐标公式、不是怎么推重心就是说给你三角形三个角的坐标、为什么重心的坐标就是重心横坐标=(X+P
- 10不知道怎样背英语单词音标总掌握不好,
- 11(2007•益阳)下列关于Fl本发展经济的有利条件,叙述错误的是( )
- 12next the girl to them who's 连词成句,加汉意
- 139共10个数 每3个数一组,共多少个组合?
- 14怎么证明:正切的反三角函数 arctgx 与对积分1/(1+t*t)dt从0积到x呢?,如图
- 15请用0.1.2.3.4.5.6.7.8.9组成加减乘法,每个就可以用一次.
