“烂版液”是制印刷锌板时,用稀硝酸腐蚀锌板后得到的“废液”(含有少量的Cl - 、Fe 3 + ),某化学兴趣小组拟用“
 小猪xx2022-10-04 11:39:541条回答
小猪xx2022-10-04 11:39:541条回答| “烂版液”是制印刷锌板时,用稀硝酸腐蚀锌板后得到的“废液”(含有少量的Cl - 、Fe 3 + ),某化学兴趣小组拟用“烂版液”制取Zn(NO 3 ) 2 ·6H 2 O的过程如下:  已知:Zn(NO 3 ) 2 ·6H 2 O是一种无色晶体,水溶液呈酸性,Zn(NO 3 ) 2 能与碱反应,得到的产物具有两性。 (1)“烂版液”中溶质的主要成分是________(填化学式),若稀硝酸腐蚀锌板产生的气体为N 2 O,写出稀硝酸腐蚀锌板反应的主要化学方程式_____________________________。 (2)在操作①中保持pH=8的目的是____________________________。 (3)沉淀Ⅰ的主要成分是_______________________________________。 (4)操作③中加热、煮沸的目的是________________________________; 此步骤操作的理论依据是____________________________________。 (5)操作④保持pH=2的目的是__________________________________; 此步骤操作中所用的主要仪器是________________________________。 |

已提交,审核后显示!提交回复
共1条回复
 sailormo 共回答了16个问题
sailormo 共回答了16个问题 |采纳率87.5%- (1)Zn(NO 3 ) 2
4Zn+10HNO 3 ===4Zn(NO 3 ) 2 +N 2 O↑+5H 2 O
(2)防止生成的Zn(OH) 2 沉淀被溶解
(3)Zn(OH) 2 和Fe(OH) 3
(4)促使Fe 3 + 完全水解 温度越高,水解程度越大
(5)抑制Zn 2 + 水解为Zn(OH) 2
蒸发皿、酒精灯、铁架台、玻璃棒
略 - 1年前
相关推荐
- “烂版液”是制印刷锌板时,用稀硝酸腐蚀锌板后得到的“废液”(含有少量的Cl-、Fe3+),某化学兴趣小组拟用“烂版液”制
“烂版液”是制印刷锌板时,用稀硝酸腐蚀锌板后得到的“废液”(含有少量的Cl-、Fe3+),某化学兴趣小组拟用“烂版液”制取Zn(NO3)2•6H2O的过程如下:
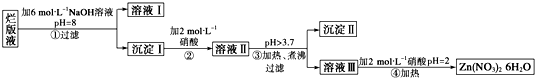
已知:Zn(NO3)2•6H2O是一种无色晶体,水溶液呈酸性,Zn(NO3)2能与碱反应,得到的产物具有两性.
(1)“烂版液”中溶质的主要成分是______(填化学式).
(2)若稀硝酸腐蚀锌板产生的气体为N2O,写出稀硝酸腐蚀锌板反应的主要化学方程式______.
(3)在操作①中保持pH=8的目的是______.
(4)沉淀Ⅰ的主要成分是______.
(5)操作③中加热、煮沸的目的是______;此步骤操作的理论依据是______.
(6)操作④保持pH=2的目的是______;此步骤操作中所用的主要仪器是______. 迷失的lcy1年前1
迷失的lcy1年前1 -
 回风令 共回答了15个问题
回风令 共回答了15个问题 |采纳率86.7%解题思路:“烂板液”中含有大量的锌离子、氢离子、硝酸根离子和少量的Cl-、Fe3+,加入氢氧化钠调节溶液的PH=8使铁离子、锌离子完全沉淀,然后在沉淀Ⅰ中加硝酸溶解,溶液Ⅱ中含有大量锌离子、氢离子、硝酸根离子和少量的铁离子,调节溶液的PH使铁离子沉淀,溶液Ⅲ是硝酸锌溶液,在酸性条件下加热浓缩蒸发结晶,得到Zn(NO3)2•6H2O是一种无色晶体.
(1)烂板液”中溶质的主要成分是Zn(NO3)2;
(2)此时硝酸很稀,硝酸中的氮被还原+1价为N2O,Zn被氧化为Zn(NO3)2;
(3)使锌离子完全转化为氢氧化锌,pH不大,如果pH加大氢氧化锌两性又溶解;
(4)Zn2+、Fe3+完全沉淀生成相应的氢氧化物;
(5)热煮沸促使Fe3+完全水解;
(6)锌离子易水解生成氢氧化锌,操作④包括蒸发浓缩,冷却结晶,过滤.“烂板液”中含有大量的锌离子、氢离子、硝酸根离子和少量的Cl-、Fe3+,加入氢氧化钠调节溶液的PH=8使铁离子、锌离子完全沉淀,然后在沉淀Ⅰ中加硝酸溶解,溶液Ⅱ中含有大量锌离子、氢离子、硝酸根离子和少量的铁离子,调节溶液的PH使铁离子沉淀,溶液Ⅲ是硝酸锌溶液,在酸性条件下加热浓缩蒸发结晶,得到Zn(NO3)2•6H2O是一种无色晶体.
(1)烂板液”中溶质的主要成分是Zn(NO3)2,故答案为:Zn(NO3)2;
(2)此时硝酸很稀,硝酸中的氮被还原+1价,硝酸中的氮被还原+1价为N2O,Zn被氧化为Zn(NO3)2,发生的化学反应为4Zn+10HNO3=4Zn(NO3)2+N2O↑+5H2O;
故答案为:4Zn+10HNO3=4Zn(NO3)2+N2O↑+5H2O;
(3)使锌离子完全转化为氢氧化锌,PH不大,如果PH加大氢氧化锌两性又溶解,故答案为:防止生成的Zn(OH)2溶解;
(4)Zn2+、Fe3+完全沉淀生成相应的氢氧化物,故答案为:Fe(OH)3和Zn(OH)2;
(5)热煮沸促使Fe3+完全水解,原理是温度越高,水解程度越大,故答案为:促进Fe3+完全水解;水解反应吸热,温度高,水解程度大;
(6)锌离子易水解生成氢氧化锌,酸性条件下可抑制锌离子的水解,则操作④保持pH=2的目的是抑制Zn2+水解为Zn(OH)2;操作④包括蒸发浓缩,冷却结晶,过滤,所用的主要仪器有蒸发皿、酒精灯、铁架台、玻璃棒,
故答案为:抑制Zn2+水解为Zn(OH)2;蒸发皿、酒精灯、铁架台、玻璃棒.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查了物质的分离提纯实验操作,涉及氢氧化锌的两性、过滤的仪器、沉淀的生成、盐类的水解等,难度中等,注意锌离子易水解生成氢氧化锌,酸性条件下可抑制锌离子的水解.1年前查看全部
大家在问
- 1计算机的IP地址共分为A、B、C、D、E五类,如何区别他们?最好能举实例说明,
- 2电热水壶由于使用方便、效率高,巳成为家庭常用的电器之一.如表是某电热水壶的铭牌.在标准大气压下,使用该电热水壶要将lL&
- 3作文我的家乡开封二年级
- 4用cosα表示sin^4α
- 5我国南方地区和北方地区在自然、人文等方面存在差异。某同学对两者进行了比较,但填写的内容有限。请你将未填的内容补充完整。
- 6你还有多少作业要做?How much homework do you have left to do?这里的left应放
- 79分之7乘7分之3表示的意义是?
- 8设函数fx=向量a*向量b,其中向量a=(m,cos2x),向量b=(1+sin2x,1),x∈R且fx的图像经过点(π
- 9初三化学评价手册第二章第十五页第九题!
- 10I don't know what to do it.中的to do做什么成分?
- 11坩埚钳如何使用夹取坩埚时,是用它的尖端还是用当中圆的部位啊?如果用尖端,圆的部位是干什么的类?
- 12用分式方程解答!急急急!!!甲乙两地相距300千米,新高速公路开通后,在甲乙两地之间行驶的长途客车平均车速比原来提高百分
- 13九(下)数学相似练习(2)相似三角形的判定①答案
- 14能源、环境与人类的生活和社会发展密切相关.
- 15等腰三角形的周长为2+2倍根号3,底边上的高为1.求底角的SIN值和等腰三角形的面积
