kmno4+h2c2o4+h2so4等于?
 mandy7262022-10-04 11:39:541条回答
mandy7262022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 shenxhrg 共回答了19个问题
shenxhrg 共回答了19个问题 |采纳率94.7%- 2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10Co2+8H2O
- 1年前
相关推荐
- 草酸(H2C2O4)主要用于生产抗菌素和冰片等药物以及提炼稀有金属的溶剂、染料还原剂、鞣革剂等.已知25℃时,草酸Ka1
草酸(H2C2O4)主要用于生产抗菌素和冰片等药物以及提炼稀有金属的溶剂、染料还原剂、鞣革剂等.已知25℃时,草酸Ka1=5.9×10-2,Ka2=6.4×10-5;碳酸(H2CO3)的电离平衡常数为Ka1=4.2×10-7,Ka2=5.6×10-11.
NH3•H2O:Kb=1.8×10−5.
(1)在盛有3ml 0.1mol•L-1Na2CO3溶液的试管中,逐滴加入0.1mol•L-1H2C2O4溶液,并不断振荡,请写出初始阶段发生反应的离子方程式:______;0.1mol•L-1的H2C2O4溶液加水稀释过程中,下列表达式的值变大的是______.
A.
B.c(H+) c(OH−)
C.c(H+) c(H2C2O4)
D.c(C2
)O 2−4c(HC2
)O −4c2(H+)•c(C2
)O 2−4c(H2C2O4)
(2)25℃时,在10mL0.2mol•L-1H2C2O4溶液中加入10mL 0.2mol•L-1NaOH溶液时,所得溶液pH<7,其原因是:______.下列说法正确的是______
A.10mL0.1mol•l-1H2C2O4溶液中加入VmL0.1mol•L-1NH3•H2O溶液,所得溶液pH=7,则V>20mL
B.等物质的量浓度的NaHC2O4、Na2C2O4、Na2CO3溶液的pH大小顺序为:Na2CO3>Na2C2O4>NaHC2O4
C.NaHC2O4溶液中各离子浓度大小顺序:c(Na+)>c(HC2O4)>c(H+)>c(OH−)>c(C2O42−)
D.等物质的量浓度的Na2C2O4和NaHCO3混合液中,c(CO32−)+c(HCO3−)=c(C2O42−)+c(HC2O4−)
(3)当在浓度均为0.1mol•L-1的Na2CO3和NaHCO3混合溶液中加入少量的酸或碱,结果发现该溶液的pH变化不大,其原因是______.据此可判断浓度均为0.1mol•L-1的下列混合溶液中,不能抵抗外加少量酸或碱对溶液pH影响的是______.
A.H2C2O4、NaHC2O4 B.NH4Cl、NaCl C.NaHSO3、Na2SO3 D.Na2S2O3、KNO3
(4)已知CaCO3、CaC2O4的溶度积常数(25℃)分别为5.0×10-9、2.5×10-9,向0.3mol•L-1Na2C2O4溶液中加入过量CaCO3固体后,溶液中的c(CO32−)=______.
(5)设计实验方案证明在水中存在着电离平衡______. iabird1年前1
iabird1年前1 -
 wxsp002 共回答了15个问题
wxsp002 共回答了15个问题 |采纳率100%解题思路:(1)草酸和碳酸钠反应生成草酸钠和碳酸氢钠;加水稀释草酸促进草酸电离,但溶液中氢离子浓度减小,氢氧根离子浓度增大;
(2)草酸和碳酸钠的物质的量相等,二者反应生成草酸一氢钠,溶液呈酸性,说明草酸氢根离子电离程度大于水解程度,结合物料守恒和电荷守恒解答;
(3)该溶液为缓冲溶液;
(4)C2O42-沉淀完全时,令CO32- 的浓度为a mol/L,由碳酸钙溶度积计算溶液中c(Ca 2+ ),进而表示出溶液中C2O42-的浓度的变化量,平衡时C2O42-的浓度,由草酸钙溶度积列方程计算;
(5)用pH计测量溶液的pH判断.(1)根据电离平衡常数知,酸性强弱顺序是:草酸>草酸氢根离子>碳酸>碳酸氢根离子,所以草酸和碳酸钠反应生成草酸钠和碳酸氢钠,离子方程式为:H2C2O4+2CO32-=C2O42-+2HCO3-;加水稀释草酸促进草酸电离,但溶液中氢离子浓度减小,氢氧根离子浓度增大,
A.氢氧根离子浓度增大,氢原子浓度减小,则氢离子浓度与氢氧根离子浓度之比减小,故错误;
B.加水稀释促进草酸电离,则氢离子个数增大,草酸分子个数减小,所以氢离子浓度与草酸分子浓度之比增大,故正确;
C.加水稀释促进草酸根离子电离,草酸根离子个数增大,草酸氢根离子个数减小,所以草酸根离子浓度与草酸氢根离子浓度之比增大,故正确;
D.温度不变,草酸的电离平衡常数不变,故错误;
故答案为:H2C2O4+2CO32-=C2O42-+2HCO3-;BC;
(2)草酸和碳酸钠的物质的量相等,二者反应生成草酸一氢钠,溶液呈酸性,说明草酸氢根离子电离程度大于水解程度,
A.10mL0.1mol•l-1H2C2O4溶液中加入VmL0.1mol•L-1NH3•H2O溶液,所得溶液pH=7,草酸铵溶液呈酸性,要使溶液呈中性,一水合氨的物质的量应该稍微过量,所以V>20mL,故正确;
B.等物质的量浓度的NaHC2O4、Na2C2O4、Na2CO3溶液中,酸根离子水解程度:碳酸根离子>碳酸氢根离子>草酸氢根离子,酸根离子水解程度越大溶液的PH越大,所以这三种溶液的pH大小顺序为:Na2CO3>Na2C2O4>NaHC2O4,故正确;
C.草酸氢钠溶液中草酸氢根离子电离程度大于水解程度,溶液呈酸性,水还电离出氢离子,导致氢离子浓度大于草酸根离子浓度,溶液中氢氧根离子浓度最小,故错误;
D.等物质的量浓度的Na2C2O4和NaHCO3混合液中,根据物料守恒得c(H2CO3)+c(CO32- )+c(HCO3-)=c(C2O42- )+c(HC2O4-)+c(H2C2O4),故错误;
故答案为:草酸氢根离子电离程度大于水解程度;AB;
(3)当在浓度均为0.1mol•L-1的Na2CO3和NaHCO3混合溶液中加入少量的酸或碱时,酸抑制碳酸氢根离子电离,氢氧根离子抑制碳酸根离子水解,溶液溶液pH变化不大;
A.H2C2O4、NaHC2O4中草酸能和碱反应、草酸氢钠能和碱反应,所以能抵抗外加少量酸或碱对溶液pH影响,故错误;
B.NH4Cl、NaCl中氯化铵能和酸但不能和碱反应,所以不能抵抗外加少量酸或碱对溶液pH影响,故正确;
C.NaHSO3、Na2SO3中能和酸或碱反应,所以能抵抗外加少量酸或碱对溶液pH影响,故错误;
D.Na2S2O3、KNO3和酸反应但不和碱反应,所以不能抵抗外加少量酸或碱对溶液pH影响,故正确;
故答案为:当加入少量酸时,氢离子和碳酸根离子反应生成碳酸氢根离子,使得增加的氢离子减少,当加入少量碱时,氢氧根离子和碳酸氢根离子作用生成碳酸根离子,使得增加的氢氧根离子减少,因而加入少量的酸或碱对溶液的pH影响不大;BD;
(4)C2O42-沉淀完全时,令CO32- 的浓度为a mol/L,由碳酸钙溶度积可知,溶液中c(Ca 2+ )=
5×10−9
amol/L,故C2O42-的浓度的变化量=(a-
5×10−9
a)mol/L,平衡时C2O42-的浓度=0.3mol/L-(a-
5×10−9
a)mol/L,由草酸钙溶度积可知:[0.3-(a-
5×10−9
a)]×
5×10−9
a=2.5×10-9,溶液中碳酸根浓度远大于钙离子浓度,可以近似为(0.3-a)×
5×10−9
a=2.5×10-9,解得a=0.2,
故答案为:0.2mol/L;
(5)如果草酸氢根离子完全电离,则溶液的pH=1,用pH计测量0.10mol/L草酸氢钠溶液的pH大于1小于7,则证明HC2O4-在水中存在着电离平衡,故答案为:用pH计测量0.10mol/L草酸氢钠溶液的pH大于1小于7.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算;影响盐类水解程度的主要因素;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查了弱电解质的电离、难溶物的溶解平衡等知识点,根据电离平衡常数确定酸的酸性强弱,酸性越强的酸其酸根离子水解程度越小,再结合溶度积常数进行计算,难度中等.1年前查看全部
- (2009•南通二模)草酸(H2C2O4)是二元弱酸,KHC2O4溶液呈酸性.向100mL0.2mol/L的草酸溶液中加
(2009•南通二模)草酸(H2C2O4)是二元弱酸,KHC2O4溶液呈酸性.向100mL0.2mol/L的草酸溶液中加入1.68 g KOH固体,若溶液体积不变,则对所得溶液中各粒子浓度之间的关系描述错误的是( )
A.c(C2O42-)+c(HC2O4-)+c(OH-)=c(K+)+c(H+)
B.c(C2O42-)+c(HC2O4-)+c(H2C2O4)=0.2mol/L
C.c(C2O42-)<c(HC2O4-)<c(H2C2O4)
D.c(H+)<c(HC2O4-)<c(C2O42-)<c(K+) 偶爱阿酷卡1年前1
偶爱阿酷卡1年前1 -
 a1kk 共回答了15个问题
a1kk 共回答了15个问题 |采纳率100%解题思路:向100mL0.2mol/L的草酸溶液中加入1.68 g KOH固体,n(H2C2O4)=0.02mol,n(KOH)=[1.68g/56g/mol]=0.03mol,则二者反应生成0.01molK2C2O4、0.01molKHC2O4,由KHC2O4溶液呈酸性,则混合溶液显酸性,电离大于水解,结合物料守恒及电荷守恒解答.向100mL0.2mol/L的草酸溶液中加入1.68 g KOH固体,n(H2C2O4)=0.02mol,n(KOH)=[1.68g/56g/mol]=0.03mol,则二者反应生成0.01molK2C2O4、0.01molKHC2O4,
A.由电荷守恒可知,存在2c(C2O42-)+c(HC2O4-)+c(OH-)=c(K+)+c(H+),故A错误;
B.由草酸根中C原子守恒,可知物料守恒式为c(C2O42-)+c(HC2O4-)+c(H2C2O4)=0.2mol/L,故B正确;
C.混合溶液显酸性,电离大于水解,则c(H2C2O4)<c(HC2O4-)<c(C2O42-),故C错误;
D.溶液中有0.01molK2C2O4、0.01molKHC2O4,电离大于水解,溶液显酸性,则c(H+)<c(HC2O4-)<c(C2O42-)<c(K+),故D正确;
故选AC.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查离子浓度大小的比较及酸碱混合计算,把握混合后溶液中溶质及量的关系为解答的关键,注意电荷守恒及物料守恒的应用,题目难度中等.1年前查看全部
- (2012•丹徒区三模)已知草酸(H2C2O4)在浓硫酸的催化作用下,加热能分解产生三种化合物B、C、D,它们与其它物质
(2012•丹徒区三模)已知草酸(H2C2O4)在浓硫酸的催化作用下,加热能分解产生三种化合物B、C、D,它们与其它物质间的转化关系如下图所示,其中E是由两种元素组成的化合物,其相对分子质量为160,X、Y、Z均为单质.试解答下列问题:

(1)写出有关物质的化学式:C______;E______;Y______.
(2)写出有关反应的化学方程式:
反应①H2C2O4
CO↑+CO2↑+H2O浓H2SO4 .△ H2C2O4;反应③
CO↑+CO2↑+H2O浓H2SO4 .△ Fe2O3+3CO
2Fe+3CO2高温 .Fe2O3+3CO.
2Fe+3CO2高温 .
(3)说出单质Y的用途______(一条即可).
(4)反应④是Z和______(填试剂的名称)的反应. qufan20051年前1
qufan20051年前1 -
 一个世纪的旅行 共回答了21个问题
一个世纪的旅行 共回答了21个问题 |采纳率81%(1)根据质量守恒定律可知BCD物质中的元素从H、C、O三种元素中选,由于B能分解得到X和Y两种单质,可知B是水,水电解能生成氢气和氧气,所以X和Y应该是氢气和氧气中选,再根据Z单质通过反应能生成浅绿色溶液和X,说明Z是铁,X是氢气,所以Y是氧气;由于D中不能含有铁元素,所以E中是铁的化合物,且根据E是由两种元素组成的化合物,其相对分子质量为160,所以E是氧化铁,所以D具有还原性,且D是化合物,三大还原剂有:氢气、一氧化碳、碳,所以D是一氧化碳,一氧化碳与氧化铁反应生成铁和二氧化碳,所以C是二氧化碳;
(2)反应①的反应物是H2C2O4,生成物是CO、CO2、H2O,已经平了,把短线改成等号,CO和CO2后面标上上升符号,反应条件是浓硫酸催化和加热写在等号的上边和下边;反应③的反应物是一氧化碳和氧化铁,生成物是铁和二氧化碳,用观察法配平,高温写在等号的上边;
(3)氧气的作用是支持燃烧和供给呼吸;
(4)反应④是铁与酸反应生成亚铁盐和氢气,这里的酸可以是盐酸或硫酸.
故答案为:(1)CO2; Fe2O3;O2
(2)①H2C2O4
浓H2SO4
.
△CO↑+CO2↑+H2O
③Fe2O3+3CO
高温
.
2Fe+3CO2
(3)供呼吸(其它合理解答也可)
(4)盐酸或硫酸1年前查看全部
- 0.1680gH2C2O4 2H2O恰好与24.65mL浓度为0.1045mol/L的NaOH标准溶液反应,求H2C2O
0.1680gH2C2O4 2H2O恰好与24.65mL浓度为0.1045mol/L的NaOH标准溶液反应,求H2C2O4 2H2O的纯度.
 花舞双飞1年前1
花舞双飞1年前1 -
 siqian888 共回答了26个问题
siqian888 共回答了26个问题 |采纳率84.6%H2C2O4 2H2O的纯度%={24.65×0.1045×126.07}/(2×168.0)=96.65%1年前查看全部
- 向0.10草酸溶液中滴加NaOH溶液使pH = 7.0,溶液中(H2C2O4,) 浓度最大.(已知H2C2O4的,
向0.10草酸溶液中滴加NaOH溶液使pH = 7.0,溶液中(H2C2O4,) 浓度最大.(已知H2C2O4的,
Ka1=0.059 Ka2=0.000064
为什么是草酸根的浓度最大? suntinsquare1年前1
suntinsquare1年前1 -
 静水yy 共回答了16个问题
静水yy 共回答了16个问题 |采纳率100%草酸溶液滴加氢氧化钠溶液,当PH=7时,溶液为草酸氢钠和草酸钠溶液,两者关系如下:
PH=PKa2-lg[HA-]/[A2-]
7=4.2-lg[HA-]/[A2-]
lg[HA-]/[A2-]=-2.8
[HA-]/[A2-]=0.001585/1
计算可以得知,草酸钠的浓度是草酸氢钠浓度的1/0.001585=631倍.
草酸钠全部电离,电离后的草酸根只有部分水解,所以草酸根的浓度最大.1年前查看全部
- 实验室用下图装置制取纯净、干燥的CO,然后用CO还原CuO并检验气体产物.已知草酸(H2C2O4)在浓硫酸存在并加热的条
实验室用下图装置制取纯净、干燥的CO,然后用CO还原CuO并检验气体产物.已知草酸(H2C2O4)在浓硫酸存在并加热的条件下,可分解生成一氧化碳、二氧化碳和水.
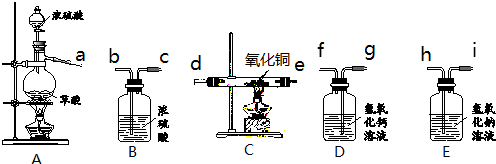
(1)写出A、C中有关反应的化学方程式.
(2)装置D、E的作用分别是什么?
(3)要达到实验目的,装置中导管接口从左到右的连接顺序为:a接______、______接______、______接______、______接______.
(4)从环保角度考虑,还需对以上装置进行改进,请简述改进措施.
(5)要制得6.4g铜,理论上至少需要20%的草酸溶液的质量是多少? 88度1年前1
88度1年前1 -
 wsw1300 共回答了20个问题
wsw1300 共回答了20个问题 |采纳率90%解题思路:(1)A中是草酸在催化剂浓硫酸和加热的条件下发生的分解反应;C中是一氧化碳在高温下还原氧化铜;
(2)二氧化碳与氢氧化钙反应生成碳酸钙沉淀;氢氧化钠溶液吸收二氧化碳;
(3)根据氢氧化钠溶液能吸收二氧化碳,用排液体收集气体的方法填空;
(4)一氧化碳有毒,不能直接排放到空气直接;
(5)根据化学反应方程式中的已知物质的质量来求未知物质的质量.(1)A是实验室用草酸(H2C2O4)和浓硫酸加热制取一氧化碳的气体发生装置,反应的化学方程式是:H2C2O4
浓H2SO4
.
△H2O+CO2↑+CO↑.
C是实验室里用一氧化碳还原氧化铜的装置,其反应方程式为:CuO+CO
高温
.
Cu+CO2;
(2)装置D中盛有氢氧化钙溶液,二氧化碳能使澄清的石灰水变浑浊;E中盛有氢氧化钠溶液,吸收混合气体中的二氧化碳;
即:D的作用是检验二氧化碳;E的作用是除去一氧化碳中的二氧化碳.
(3)此实验是利用草酸分解产生的一氧化碳来还原氧化铜.一氧化碳在通入装置C前需要进行除杂:二氧化碳被氢氧化钠吸收,浓硫酸除去水蒸气;一氧化碳还原氧化铜后产生的二氧化碳气体利用氢氧化钙进行检验.
故答案是:h、i接b、c接d(或e)、e(或d)接f.
(4)该装置中缺少了尾气处理装置.将尾气点燃或进行收集等,防止一氧化碳污染空气.
(5)设理论上至少需要20%的草酸溶液的质量为x.
H2C2O4~CO~Cu
9064
x×20%6.4 g
[90/64=
x×20%
6.4g]
x=45 g
答:理论上至少需要20%的草酸溶液的质量是45g.点评:
本题考点: 碳、一氧化碳、氢气还原氧化铜实验;常见气体的检验与除杂方法;书写化学方程式、文字表达式、电离方程式;根据化学反应方程式的计算.
考点点评: 本题考查一氧化碳还原氧化铁的实验装置及相关问题,属于课本基本实验的延伸,难度不大,容易出错的是(2)装置的连接,注意吸收二氧化碳用氢氧化钠,检验二氧化碳用澄清石灰水,以及气体从溶液中出来时带来水蒸气.1年前查看全部
- 加热H2C2O4 晶体时试管口为何向上?
 水--云--间1年前1
水--云--间1年前1 -
 冰雪梦儿 共回答了15个问题
冰雪梦儿 共回答了15个问题 |采纳率93.3%因为草酸熔点只有一百多度,火焰加热会使其熔化为液态,试管口向下显然就流出来了.
这正式草酸加热不同于其它固体加热的原因1年前查看全部
- 无机化学:将63.0g草酸晶体(H2C2O4·2H2O)溶于水,使之成为体积为1.00L,密度为1.02g/cm3的草酸
无机化学:将63.0g草酸晶体(H2C2O4·2H2O)溶于水,使之成为体积为1.00L,密度为1.02g/cm3的草酸溶液,求水的总质量(不要忘记草酸晶体中的水)
 暗夜的横生1年前1
暗夜的横生1年前1 -
 阿雪 共回答了20个问题
阿雪 共回答了20个问题 |采纳率85%草酸的质量=63.0*90.04/126.07=45.0g
水的质量=1000*1.02-45.0=975g1年前查看全部
- 将物质的量相等的KHC2O4和H2C2O4溶于水配成溶液:2C(K+)=C(HC2O4-)+C(H2C2O4)+C(C2
将物质的量相等的KHC2O4和H2C2O4溶于水配成溶液:2C(K+)=C(HC2O4-)+C(H2C2O4)+C(C2O4-) 这个等式是怎么推
将物质的量相等的KHC2O4和H2C2O4溶于水配成溶液:2C(K+)=C(HC2O4-)+C(H2C2O4)+C(C2O4-)
这个等式是怎么推出来的? walkmann1年前1
walkmann1年前1 -
 laidongping 共回答了24个问题
laidongping 共回答了24个问题 |采纳率91.7%物料守恒,KHC2O4 H2C2O4等摩尔,先不考虑电离和水解,K+的两倍等于HC2O4- 和 H2C2O4物质的量的和,再考虑HC2O4- H2C2O4电离为C2O4 2-1年前查看全部
- 标定碱标准溶液时,邻苯二甲酸氢钾( KHC8H4O4 , M=204.32g*mol)和二水草酸( H2C2O4'H2O
标定碱标准溶液时,邻苯二甲酸氢钾( KHC8H4O4 , M=204.32g*mol)和二水草酸( H2C2O4'H2O , M=126.07g*mol
都可以作为基准物质,你认为选择哪一种好,为什么?
可以再具体点 可以加方程式吗 那样我比较容易理解 萧萧52013141年前2
萧萧52013141年前2 -
 bossji55 共回答了20个问题
bossji55 共回答了20个问题 |采纳率65%邻苯二甲酸氢钾
基准物质的标准中有一条,就是在其他条件一样的情况下,分子量越大越好,这样称量的相对误差较小.1年前查看全部
- 已知在酸性条件下,KMNO4可将H2C2O4氧化为CO2,本身被还原成MN2+,求1MOL KMNO4能氧化多少MOL
已知在酸性条件下,KMNO4可将H2C2O4氧化为CO2,本身被还原成MN2+,求1MOL KMNO4能氧化多少MOL H2C2O4?
 Fredy131年前1
Fredy131年前1 -
 不是那个燕妮 共回答了18个问题
不是那个燕妮 共回答了18个问题 |采纳率88.9%H2C2O4中C为+3价,变成2个CO2需要失去2*e-.而MnO4-中Mn为+7,变成+2要得到5e-.所以能够氧化的物质的量为2.5mol.1年前查看全部
- (2013•辽宁一模)已知:乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,157℃时开始分解.
(2013•辽宁一模)已知:乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,157℃时开始分解.
(1)探究草酸的酸性
25℃H2C2O4K1=5.4×10-2,K2=5.4×10-5;H2CO3K1=4.5×10-7,K2=4.7×10-11
下列化学方程式可能正确的是______.
A.H2C2O4+CO32-=HCO3-+HC2O4-B.HC2O4-+CO32-=HCO3-+C2O42-
C.2C2O42-+CO2+H2O=2HC2O4-+CO32-D.H2C2O4+CO32-+=C2O42-+H2O+CO2↑
(2)探究草酸分解产物
①实验中观察到B中CuSO4粉末变蓝,C中澄清石灰水变浑浊,D的作用:______,证明有CO气体生成的现象是:______.
②写出H2C2O4分解的化学方程式:H2C2O4
CO2↑+CO↑+H2O↑△ .H2C2O4.
CO2↑+CO↑+H2O↑△ .
(3)探究催化剂对化学反应速率的影响
在甲、乙两支试管中各加入4mL 0.0lmol/LKMnO4酸性溶液和2mL0.1moL/L H2C2O4溶液,再向乙试管中加入一粒黄豆大的MnSO4固体,摇匀.填写下表:
(4)用酸性KmnO4溶液滴定Na2C2O4,求算Na2C2O4的纯度反应现象 ______ 实验结论 ______ 试管中发生反应的离子方程式 ______
实验步骤:准确称取2.0g Na2C2O4固体,配成100mL溶液,取出20.00mL于锥形瓶中.再向瓶中加入足量稀H2SO4,用0.0160mol/L酸性高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液25.00mL.
①高锰酸钾溶液应装在______滴定管中.(填“酸式”或“碱式”)
②滴定至终点时的实验现象是:______.
③Na2C2O4的纯度是:______. 铃音991年前1
铃音991年前1 -
 2226183ying 共回答了19个问题
2226183ying 共回答了19个问题 |采纳率100%解题思路:(1)电离常数越大其酸性越强,根据强酸制取弱酸判断;
(2)①氢氧化钠是碱能吸收酸性氧化物;一氧化碳具有还原性,二氧化碳能使澄清石灰水变浑浊;
②根据反应物、生成物和反应条件写出反应方程式;
(3)高锰酸钾具有氧化性,能氧化还原性物质,硫酸锰具有催化作用,加快反应速率;
(4)①酸式滴定管能量取酸性溶液;
②滴定终点时,溶液褪色;
③根据高锰酸钾计算草酸钠的纯度.(1)根据电离常数知酸性强弱顺序是:H2C2O4>HC2O4->H2CO3>HCO3-,根据强酸制取弱酸知草酸和碳酸根离子反应生成草酸根离子和二氧化碳,草酸氢根离子和碳酸根离子反应生成碳酸氢根离子和草酸根离子,故选BD;
(2)①氢氧化钠是强碱能吸收酸性氧化物二氧化碳,一氧化碳具有还原性,能还原黑色的氧化铜生成红色的铜,同时自身被氧化生成二氧化碳,二氧化碳使澄清的石灰水变浑浊,所以看到的现象是:F中黑色CuO变成光亮的红色,G中澄清石灰水变浑浊,
故答案为:吸收CO2气体;F中黑色CuO变成光亮的红色,G中澄清石灰水变浑浊;
②该反应中反应物是草酸,生成物是水、二氧化碳和一氧化碳,反应条件是加热,所以该反应方程式为H2C2O4
△
.
CO2↑+CO↑+H2O↑,
故答案为:H2C2O4
△
.
CO2↑+CO↑+H2O↑;
(3)看到的现象是两支试管中紫色KMnO4溶液均褪色,乙试管中溶液褪色较快;
通过对比实验知,硫酸锰是该反应的催化剂,加入催化剂能加快反应速率;
该反应中高锰酸根离子被还原生成锰离子,草酸被氧化生成二氧化碳,离子反应方程式为:2MnO4-+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O,
故答案为:两支试管中紫色KMnO4溶液均褪色,乙试管中溶液褪色较快;MnSO4(Mn2+)是此反应的催化剂,加入催化剂可以使化学反应速率加快;
2MnO4-+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O;
(4)①高锰酸钾溶液呈酸性,应该用酸式滴定管量取,故答案为:酸式;
②当入最后一滴KMnO4,高锰酸钾溶液过量,溶液由无色变为紫色,故答案为:滴入最后一滴KMnO4,溶液由无色变为紫色(紫红色);
③设草酸钠的质量分数为x,
2MnO4-+5C2O42-+16H+=10CO2↑+2Mn2++8H2O
2 5
0.0160mol/L×0.025L ( [2.0x/134×
1
5])mol
x=[0.016×0.025×5×5×134/2×2.0]×100%=33.5%,
答:草酸钠的质量分数为33.5%.点评:
本题考点: 弱电解质在水溶液中的电离平衡;探究物质的组成或测量物质的含量;性质实验方案的设计.
考点点评: 本题考查弱电解质的电离、探究物质的组成及含量的测定等知识点,计算量较大,会根据实验现象确定物质的组成,难度中等.1年前查看全部
- 将用稀硫酸酸化的高锰酸钾溶液滴入足量草酸(H2C2O4)溶液的试管
将用稀硫酸酸化的高锰酸钾溶液滴入足量草酸(H2C2O4)溶液的试管
第19题(4)
像这种没学过的化学方程式如何书写???怎么知道草酸与酸化的高锰酸钾如何反应?
 130760933241年前1
130760933241年前1 -
 yxy1166 共回答了22个问题
yxy1166 共回答了22个问题 |采纳率86.4%酸性高锰酸钾溶液褪色,产生无色气体。
2MnO4- + 5H2C2O4 + 6H+ = 2Mn2+ + 10CO2 + 8H2O1年前查看全部
- 医学上将高锰酸钾(硫酸酸化)溶液和草酸(H2C2O4)溶液的反应用于测定血钙的含量.回答下列问题:
医学上将高锰酸钾(硫酸酸化)溶液和草酸(H2C2O4)溶液的反应用于测定血钙的含量.回答下列问题:
(1)该反应中的还原剂是______.
(2)写出该反应的化学方程式______.
(3)反应转移了0.4mol电子,则参加反应的H2SO4物质的量为______.
(4)测定血钙的含量的方法是:取2mL血液用蒸馏水稀释后,向其中加入足量草酸铵晶体[化学式为(NH4)2C2O4],反应生成CaC2O4沉淀,将沉淀用稀硫酸溶解得到H2C2O4后,再用KMnO4溶液滴定.
①稀硫酸溶解CaC2O4沉淀的化学方程式是______.
②用KMnO4溶液滴定H2C2O4时,判断滴定终点的方法是______.
③若消耗了1.0×10-4mol/L 的KMnO4溶液20.00mL,则100mL该血液中含钙______克. microlabjune1年前1
microlabjune1年前1 -
 林一茶 共回答了16个问题
林一茶 共回答了16个问题 |采纳率93.8%解题思路:(1)高锰酸钾具有强氧化性,在硫酸条件下将H2C2O4氧化为CO2,自身被还原为MnSO4,反应中草酸是还原剂.
(2)高锰酸钾,在硫酸条件下与H2C2O4反应生成硫酸钾、硫酸锰、CO2、水.
(3)在反应中Mn由+7价被还原到+2价,由方程式可知转移10 mol电子时消耗3molH2SO4,据此计算.
(4)①利用强酸制备弱酸,稀硫酸与CaC2O4沉淀反应生成硫酸钙与草酸.
②高锰酸钾溶液本身有颜色,为紫色,在开始滴入草酸中时被还原,颜色消失,当达到滴定终点时,加入最后一滴高锰酸钾溶液颜色不褪去,溶液应该是由无色变为浅紫色.
③利用有关反应的方程式可以得出关系式:5Ca2+~2KMnO4,据此计算.(1)高锰酸钾具有强氧化性,在硫酸条件下将H2C2O4氧化为CO2,自身被还原为MnSO4,反应中草酸是还原剂.
故答案为:H2C2O4.
(2)高锰酸钾,在硫酸条件下与H2C2O4反应生成硫酸钾、硫酸锰、CO2、水,反应方程式为2KMnO4+5H2C2O4+3H2SO4═2MnSO4+K2SO4+10CO2↑+8H2O.
故答案为:2KMnO4+5H2C2O4+3H2SO4═2MnSO4+K2SO4+10CO2↑+8H2O.
(3)在反应中Mn由+7价被还原到+2价,由方程式2KMnO4+5H2C2O4+3H2SO4═2MnSO4+K2SO4+10CO2↑+8H2O可知,2molKMnO4反应转移电子为2mol×(7-2)=10mol,转移10 mol电子时消耗3molH2SO4,所以应转移了0.4 mol电子时,参加反应的H2SO4的物质的量为3mol×[0.4mol/10mol]=0.12 mol.
故答案为:0.12mol.
(4)①稀硫酸与CaC2O4沉淀反应生成硫酸钙与草酸,反应方程式为CaC2O4+H2SO4═CaSO4+H2C2O4.
故答案为:CaC2O4+H2SO4═CaSO4+H2C2O4.
②高锰酸钾溶液本身有颜色,为紫色,在开始滴入草酸中时被还原,颜色消失,当达到滴定终点时,加入最后一滴高锰酸钾溶液颜色不褪去,溶液由无色变为浅紫色,并保持30s不消失.
故答案为:溶液由无色变为浅紫色,并保持30s不消失.
③由CaC2O4+H2SO4═CaSO4+H2C2O4、2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O可以得出关系式:5Ca2+~2KMnO4,所以n(Ca2+)=2.5n(KMnO4)=1.0×10-4mol/L×0.02L×2.5,所以可计算出100 mL该血液中含钙的质量为:1.0×10-4mol/L×0.02L×2.5×40g/mol×[100mL/2mL]=0.01g.
故答案为:0.01.点评:
本题考点: 探究物质的组成或测量物质的含量;氧化还原反应;中和滴定.
考点点评: 考查化学方程式书写、氧化还原反应、滴定应用、化学计算等,难度中等,是对所需知识的综合运用,需要学生具有扎实的基础知识与分析问题、解决问题的能力.1年前查看全部
- 取血清5毫升,稀释至25毫升,量取10毫升加入H2C2O4适量使Ca离子沉淀为CaC2O4,将CaC2O4溶于硫酸中,
取血清5毫升,稀释至25毫升,量取10毫升加入H2C2O4适量使Ca离子沉淀为CaC2O4,将CaC2O4溶于硫酸中,
再用高锰酸钾标准溶液0.001700mol\L滴定,终点时用去1.2ml,求血样中Ca离子的含量(mg100ml),(Mca40.08) faxuejia1年前1
faxuejia1年前1 -
 bageda 共回答了21个问题
bageda 共回答了21个问题 |采纳率85.7%好吧,这个得慢慢算,听好咯!
5C204- + 2MnO4- + 16H+ =10CO2 +2Mn2+ +8H20
计算出C204-的含量为 0.001700*2.5=0.004250mmol
然后溶液中钙离子的含量就是草酸根的含量 0.004250mmol.
其次,我们可以推断出,稀释后血清中钙离子含量 0.004250*2.5=0.01063mmol(注意有效数字)
然后计算出血清中钙离子浓度(有些跳步,应该可以自己解决)
0.01063mmol/25mL *5 =0.002016mol/L,换算得到0.0002016mol/100mL,最后得到答案
8.504mg/100mL.
我也不知道答案对不对.1年前查看全部
- H2C2O4和H2SO3的PH的大小
 _caqu46ee_v481a1年前6
_caqu46ee_v481a1年前6 -
 nightwolf36 共回答了13个问题
nightwolf36 共回答了13个问题 |采纳率92.3%H2SO3的Ka1=1.4*10^-2
草酸的Ka1=5.9×10^-2
所以草酸酸性强.1年前查看全部
- 已知草酸(H2C2O4)固体与浓硫酸共热发生化学反应:H2C2O4 浓硫酸 .△CO2↑+CO↑+H
已知草酸(H2C2O4)固体与浓硫酸共热发生化学反应:H2C2O4
CO2↑+CO↑+H2O.某化学兴趣小组同学设计如图1实验装置,用于制取纯净干燥的CO气体来还原氧化铁.请根据题目要求回答下列问题:(已知CO2+2NaOH=Na2CO3+H2O)浓硫酸 .△ 
(1)实验开始时,应首先点燃______处的酒精灯(填装置序号).
(2)装置C中浓硫酸的作用是______.
(3)D装置玻璃管中观察的现象是______,反应的化学方程式为Fe2O3+3CO
2Fe+3CO2高温 .Fe2O3+3CO.
2Fe+3CO2高温 .
(4)E处能够观察到澄清石灰水变浑浊,发生反应的化学方程式为_______.
(5)其实H2也能还原氧化铁.氢气作为最清洁的能源,越来越受到人们的关注.请写出氢气燃烧的化学方程式2H2+O2
2H2O点燃 .2H2+O2;实验室常用锌和稀硫酸制取氢气,图2的发生装置哪一个最好?______(填装置序号).
2H2O点燃 . 生瓜蛋1年前1
生瓜蛋1年前1 -
 安慰受伤的心灵 共回答了19个问题
安慰受伤的心灵 共回答了19个问题 |采纳率84.2%解题思路:(1)一氧化碳还原氧化铁首先要通一氧化碳排尽管内空气,防止加热发生爆炸,所以要先点燃A处酒精灯,制取一氧化碳;
(2)根据浓硫酸的吸水性来分析;
(3)一氧化碳可与红色的氧化铁反应生成黑色的铁粉,同时生成二氧化碳,据此分析解答;
(4)二氧化碳使澄清石灰水变浑浊;
(5)氢气燃烧生成水;比较仪器的不同点来进行分析.(1)为了防止发生爆炸,点燃或加热可燃性气体都必须验纯,故应利用生成的一氧化碳排净装置内的空气,应该先点燃A处的酒精灯;
(2)浓硫酸具有吸水性,可以除去一氧化碳中混有的水蒸气;
(3)装置D中一氧化碳和氧化铁反应生成铁和二氧化碳,故玻璃管中观察的现象是 红色粉末逐渐变为黑色,反应的方程式为:Fe2O3+3CO
高温
.
2Fe+3CO2;
(4)二氧化碳和澄清石灰水反应生成碳酸钙沉淀和水,反应方程式是:CO2+Ca(OH)2=CaCO3↓+H2O;
(5)氢气在点燃的条件下与氧气反应生成水;装置D滴加液体的仪器是注射器,可以使滴加的液体随加随停,控制反应的速率.
故答案为:(1)A;(2)除去一氧化碳中混有的水蒸气;(3)红色粉末逐渐变为黑色;Fe2O3+3CO
高温
.
2Fe+3CO2;(4)CO2+Ca(OH)2=CaCO3↓+H2O;
(5)2H2+O2
点燃
.
2H2O;D.点评:
本题考点: 一氧化碳还原氧化铁;常见气体的检验与除杂方法;气体的净化(除杂);氢气的制取和检验;书写化学方程式、文字表达式、电离方程式;氢气的化学性质与燃烧实验.
考点点评: 本题考查了炼铁的原理、实验现象、尾气处理以及应用.要注意有毒气体不能随意排放,可燃性气体在加热或点燃前的验纯,以及净化气体的方法.1年前查看全部
- 将H2C2O4加入到0.10mol/lNa2CO3溶液中,使总浓度为0.020mol/l,求该溶液的pH
将H2C2O4加入到0.10mol/lNa2CO3溶液中,使总浓度为0.020mol/l,求该溶液的pH
H2C2O4的pKa1=1.20,pKa2=4.2;H2CO3的pKa1=6.40,pKa2=10.20 米悠1年前1
米悠1年前1 -
 红酒醉人 共回答了13个问题
红酒醉人 共回答了13个问题 |采纳率92.3%因为相对于H2CO3而言,H2C2O4的Ka1和Ka2均较大,其酸性较强,所以,加到Na2CO3中后发生如下反应:2CO3^2-+H2C2O4==2HCO3+C2O4 所以[HCO3-]==2[C2O4^2-]=0.04mol/L,[CO3^2-]=0.10-0.040=0.060mol/L 此时构成了HCO3-=O3^2-缓冲体系
[H+]=Ka2*{[HCO3-]/[CO3^2-]}=10^-10.20X{0.040/0.060}=10^-10.38 pH=10.381年前查看全部
- (2012•泸州)已知草酸(H2C2O4)固体与浓硫酸供热发生化学反应:H2C2O4 浓硫酸 .△C
(2012•泸州)已知草酸(H2C2O4)固体与浓硫酸供热发生化学反应:H2C2O4
CO2↑+CO↑+H2O.某化学兴趣小组同学设计如下实验装置,用于制取纯净干燥的CO气体来还原氧化铁.请根据题目要求回答下列问题:浓硫酸 .△ 
(1)实验开始时,应首先点燃______处的酒精灯(填装置序号).
(2)装置B中NaOH的作用是______;C中所盛的液体是______.
(3)D装置玻璃管中观察的现象是______,反应的方程式为Fe2O3+3CO
2Fe+3CO2高温 .Fe2O3+3CO
2Fe+3CO2高温 .
(4)从E装置出来的尾气要进行处理,是因为尾气中含有______. 张馨19791年前1
张馨19791年前1 -
 重庆小易 共回答了19个问题
重庆小易 共回答了19个问题 |采纳率84.2%解题思路:本题是在原有一氧化碳还原氧化铁的实验基础上增加了制取纯净的一氧化碳的实验,由题中信息,草酸分解后得到的一氧化碳中混有二氧化碳和水蒸气,因此要预先除掉二氧化碳.氢氧化钠与二氧化碳反应消耗二氧化碳,浓硫酸具有吸水性除去水分.产生的二氧化碳使澄清石灰水变浑浊,过程中可能一氧化碳过多,必须对尾气进行处理.(1)为了防止发生爆炸,点燃或加热可燃性气体都必须验纯,故应利用生成的一氧化碳排净装置内的空气,应该先点燃A处的酒精灯.
(2)因为要制取纯净干燥的一氧化碳,B装置内是氢氧化钠能吸收产生的二氧化碳,C装置则是干燥一氧化碳的装置,可用浓硫酸来吸收水分.
(3)装置D中一氧化碳和氧化铁反应生成铁和二氧化碳,故玻璃管中观察的现象是 红色粉末逐渐变为黑色,反应的方程式为:Fe2O3+3CO
高温
.
2Fe+3CO2;
(4)一氧化碳有毒,过程中可能一氧化碳过多,必须对尾气进行处理.
故答案为:(1)A.
(2)除去二氧化碳;浓硫酸.
(3)红色粉末逐渐变为黑色,Fe2O3+3CO
高温
.
2Fe+3CO2
(4)CO.点评:
本题考点: 常见气体的检验与除杂方法;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查了炼铁的原理、实验现象、尾气处理以及应用.要注意有毒气体不能随意排放,可燃性气体在加热或点燃前的验纯,以及净化气体的方法.1年前查看全部
- 实验测得0.01mol/L的KMnO4的硫酸溶液和0.1mol/L的H2C2O4溶液等体积混合后,反应速率υ[mol/(
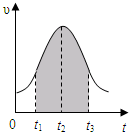 实验测得0.01mol/L的KMnO4的硫酸溶液和0.1mol/L的H2C2O4溶液等体积混合后,反应速率υ[mol/(L•s)]与反应时间t(s)的关系如图所示.该反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
实验测得0.01mol/L的KMnO4的硫酸溶液和0.1mol/L的H2C2O4溶液等体积混合后,反应速率υ[mol/(L•s)]与反应时间t(s)的关系如图所示.该反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
回答如下问题:
(1)0→t2时间段内反应速率增大的原因是:______
(2)t2→t时间段内反应速率减小的原因是:______,
(3)图中阴影部分“面积”表示t1→t3时间里______.
A.Mn2+物质的量浓度的增大B.Mn2+物质的量的增加
C.SO42-物质的量浓度D.MnO4-物质的量浓度的减小. luozhen3691年前1
luozhen3691年前1 -
 aiwoderenwobuai 共回答了26个问题
aiwoderenwobuai 共回答了26个问题 |采纳率80.8%解题思路:(1)根据温度对化学反应速率的影响判断;
(2)根据浓度对化学反应速率的影响判断;
(3)根据v=[△c/△t],推倒得v×△t=△C判断.(1)该反应是放热反应,温度越高,反应速率越快,所以温度是改变反应速率的主要原因,
故答案为:反应放热,温度升高,反应速率加快;
(2)随着反应的进行,反应物的浓度降低,浓度越低,反应速率越小,所以浓度的改变是反应速率变化的主要原因,
故答案为:反应物浓度降低,导致反应速率降低;
(3)根据v=[△c/△t],推倒得v×△t=△C,所以阴影面积表示反应物浓度的减少或生成物浓度的增加,
故选AD.点评:
本题考点: 化学平衡的影响因素.
考点点评: 本题考查了影响化学反应速率的因素,侧重考查学生分析问题、分析图象、解决问题的能力.1年前查看全部
- (2009•聊城)草酸(H2C2O4)加热能分解.化学兴趣小组的同学对草酸受热分解的产物作如下探究:草酸分解得到的气体产
(2009•聊城)草酸(H2C2O4)加热能分解.化学兴趣小组的同学对草酸受热分解的产物作如下探究:草酸分解得到的气体产物:
A.只有CO2B.只有COC.既有CO2,也有CO
【查阅资料】CO遇到浸有磷钼酸溶液的氯化钯黄色试纸,立即变蓝;而CO2遇该试纸不变色
【设计方案】该兴趣小组的同学在老师的指导下,设计下图所示实验(夹持试管装置省略),通过观察下列装置中的实验现象,验证猜想.
【实验探究】请你帮助他们完成实验报告:
【讨论与反思】(1)装置B中浓硫酸的质量增加,说明草酸的分解产物还有______.实验步骤 实验现象 实验结论及化学方程式 点燃酒精灯加热,观
察装置C、装置D中的现象
装置C中______;
装置D中______.
草酸分解的气体产物为CO2和CO.装置D
中反应的化学方程式为______
.
(2)根据实验结论,从环保角度考虑,实验装置中存在的不足是______,正确的处理方法是______. waiting9111年前1
waiting9111年前1 -
 lyhaq992 共回答了16个问题
lyhaq992 共回答了16个问题 |采纳率100%解题思路:【实验探究】根据实验结论的各个物质的特性推导实验现象,
【讨论和反思】(1)根据浓硫酸的吸水性进行分析,
(2)根据一氧化碳的毒性进行分析.【实验探究】实验结论中得出气体产物中有二氧化碳和一氧化碳,CO遇到浸有磷钼酸溶液的氯化钯黄色试纸,立即变蓝,二氧化碳能使澄清石灰水变浑浊,故答案为:试纸变蓝,澄清石灰水变浑浊,Ca(OH)2+CO2=CaCO3↓+H2O,
【讨论与反思】(1)浓硫酸的质量增加说明吸收了水分,故答案为:水,
(2)一氧化碳有毒性,直接的排入空气中,会污染空气,需要尾气处理,故答案为:缺少尾气处理装置,将尾气收集到气囊中(或将尾气点燃).点评:
本题考点: 常见气体的检验与除杂方法;二氧化碳的化学性质;一氧化碳的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要考查了利用物质的性质选择适当的除杂质和检验的方法.1年前查看全部
- KMnO4与FeSO4和H2C2O4的反应式是?
 wangbaoyi1年前1
wangbaoyi1年前1 -
 美丽心海 共回答了14个问题
美丽心海 共回答了14个问题 |采纳率92.9%2KMnO4 + 10FeSO4 + 8H2SO4 = K2SO4 + 2MnSO4 + 5Fe2(SO4)3 + 8H2O
2KMnO4+5H2C2O4+3H2SO4=K2SO4+2Mnso4+10CO2↑+8H2O
这两个反应里都要用硫酸酸化的高锰酸钾溶液,酸化后的高锰酸钾溶液氧化性很强,可以和以上物质反应1年前查看全部
- .关于配平问题如何配平以下化学方程式KMmO4 + H2C2O4 + H2SO4 箭头 K2SO4 + MnSO4 +
.关于配平问题
如何配平以下化学方程式
KMmO4 + H2C2O4 + H2SO4 箭头 K2SO4 + MnSO4 + CO2(气体箭头) + H2O
帮忙写出配平具体过程..C有+3价的吗 好象没有哦我这个地方想不通 wfkwujie1年前1
wfkwujie1年前1 -
 catlee 共回答了22个问题
catlee 共回答了22个问题 |采纳率95.5%2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
根据得失电子总数相等,H2C2O4中C的+3价升到CO2的+4价,每个H2C2O4失去2个电子;根据KMnO4中Mn的+7价降到+2价,每个KMnO4得到5个电子,所以就在KMnO4前配2,H2C2O4前配5.
然后根据C的守恒在CO2前配10,根据Mn的守恒在MnSO4前配2,根据K的守恒在K2SO4前配1,根据硫酸根的守恒在H2SO4前配3,最后再根据H的守恒在H2O前配8.1年前查看全部
- H2C2O4+KMnO4+H2SO4生成CO2+K2SO4+MnSO4+H2
H2C2O4+KMnO4+H2SO4生成CO2+K2SO4+MnSO4+H2
H2C2O4+KMnO4+H2SO4生成CO2+K2SO4+MnSO4+H2O sunny-vivian1年前0
sunny-vivian1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 草酸(化学式:H2C2O4)在浓硫酸催化下加热分解为A、B、C三种初中常见的氧化物.其中C为一种常见的无色透明液体,A、
 草酸(化学式:H2C2O4)在浓硫酸催化下加热分解为A、B、C三种初中常见的氧化物.其中C为一种常见的无色透明液体,A、B两物质的组成元素相同.各物质之间的关系如图所示(反应条件省略):
草酸(化学式:H2C2O4)在浓硫酸催化下加热分解为A、B、C三种初中常见的氧化物.其中C为一种常见的无色透明液体,A、B两物质的组成元素相同.各物质之间的关系如图所示(反应条件省略):
(1)写出草酸在浓硫酸催化作用下加热的化学方程式H2C2O4
CO↑+CO2↑+H2OH2C2O4浓H2SO4 . △
CO↑+CO2↑+H2O;浓H2SO4 . △
推断并用化学式表示D物质H2CO3H2CO3
(2)从草酸反应产生气体中得到纯净的B物质,首先要除去混合物中A物质,请用化学方程式表示能除去A物质的反应CuO+CO
Cu+CO2CuO+CO△ .
Cu+CO2.△ .
(3)A、B两种物质所含的元素相同,而它们的化学性质不同.请举一例说明A、B两物质性质差异一氧化碳能燃烧,二氧化碳不能燃烧一氧化碳能燃烧,二氧化碳不能燃烧;两物质性质差异最根本的原因是分子构成不同分子构成不同. m5138311年前1
m5138311年前1 -
 guojihong88 共回答了29个问题
guojihong88 共回答了29个问题 |采纳率93.1%解题思路:此题为框图式物质推断题,完成此类题目,关键是找准解题突破口,根据叙述的关键,以及物质的性质和物质之间的反应,做出判断,C为一种常见的无色透明液体,则C为水,A、B两物质的组成元素相同,则A和B可能为一氧化碳或二氧化碳,A能与氧气反应生成B,则B为二氧化碳,A为一氧化碳,二氧化碳和水反应生成的D为碳酸,代入框图,推断合理.(1)C为一种常见的无色透明液体,则C为水,A、B两物质的组成元素相同,则A和B可能为一氧化碳或二氧化碳,A能与氧气反应生成B,则B为二氧化碳,A为一氧化碳,草酸分解生成的一氧化碳、二氧化碳和水,所以本题答案为:H2C2O4
浓H2SO4
.
△CO↑+CO2↑+H2O;
(2)二氧化碳和水反应生成的D为碳酸,所以本题答案为:H2CO3;
(3)要除去二氧化碳中混有的一氧化碳,可以使一氧化碳与氧化铜反应,所以本题答案为:CuO+CO
△
.
Cu+CO2;
(4)一氧化碳和二氧化碳的分子构成不同,因而性质不同,比如一氧化碳能燃烧,而二氧化碳不能燃烧,所以本题答案为:一氧化碳能燃烧,二氧化碳不能燃烧,分子构成不同.点评:
本题考点: 物质的鉴别、推断;书写化学方程式、文字表达式、电离方程式.1年前查看全部
- 某校化学学习小组为了探究草酸(H2C2O4)的化学性质,设计了如下实验:
某校化学学习小组为了探究草酸(H2C2O4)的化学性质,设计了如下实验:
Ⅰ.小组成员在做草酸溶液与酸性高锰酸钾溶液反应实验时发现,溶液褪色先慢后快.
(1)上述H2C2O4溶液与酸性KMnO4溶液反应的离子方程为______.
(2)为了探究此反应速率由小变大的原因,甲同学做了如下实验(表中“一”表示未加入该试剂).
甲同学由此能够得出结论:实验
编号反应温度
(利用水浴加热)稀硫酸
溶液MnSO4固体 0.10mol/L
KMnO4溶液褪色
时间1 750℃ ---- --- 1mL 1OOs 2 750℃ 10滴 ---- 1mL 40s 3 750℃ 10滴 加入少许 1mL 3s
Ⅱ.乙同学查资料得知“菠菜中富含可溶性草酸盐和碳酸盐”,决定用实验验证这一事实并检测草酸盐含量.进一步查阅资料得知,草酸(H2C2O4)是酸性强于醋酸的二元弱酸,对应的钙盐(CaC2O4)不溶于醋酸,能溶于强酸.
(1)他将菠菜研磨成汁、热水浸泡、过滤得到溶液,调节溶液呈弱碱性,加入足量的CaCl2溶液,产生白色沉淀,过滤、洗涤沉淀备用,对生成的沉淀进行探究.
①提出合理假设:
假设1:只存在CaCO3;
假设2:既存在CaCO3,也存在CaC2O4;
假设3:______.
②基于假设2,设计实验方案,进行实验.请写出实验步骤以及预期现象和结论.
限选实验试剂:1mol•L-1 H2SO4、1mol•L-1 HCl、0.1mol•L-1 NaOH、1mol•L-1 CaCl2、0.01mol•L-1 KMnO4、澄清石灰水.
(2)欲准确测定菠菜中草酸盐含量,回答有关问题:实验步骤 预期现象和结论 步骤1:______ ______ 步骤2:______ ______
①操作:取m g菠菜样品,将其中草酸盐转化为 CaC2O4 沉淀分离出来,用盐酸溶解后,溶液转入100mL容量瓶中加水配制成100mL溶液.每次移取25.00mL该溶液,用0.0100mol•L-1KMnO4标准溶液滴定,滴定实验重复操作2-3次.平均消耗标准溶液V mL.
②计算:菠菜中草酸盐(以C2O42-计)的质量分数为
×100%0.0100×10−3×5×100×88×V 2×25.00×m .(只列式不计算,已知:C2O42-的摩尔质量为88g•mol-1)
×100%0.0100×10−3×5×100×88×V 2×25.00×m
③讨论:用标准KMnO4溶液直接滴定菠菜研磨、浸泡、过滤得到的溶液结果可能偏高,原因是______. 杨__子1年前1
杨__子1年前1 -
 红玫瑰还是白玫瑰 共回答了17个问题
红玫瑰还是白玫瑰 共回答了17个问题 |采纳率94.1%解题思路:Ⅰ、(1)高锰酸钾溶液具有氧化性能氧化草酸为二氧化碳,依据原子守恒和电荷守恒配平书写离子方程式;
(2)分析图表数据,随着草酸溶液与高锰酸钾溶液反应的进行,生成了Mn2+,Mn2+作为该反应的催化剂,加入少许硫酸锰可加快化学反应速率;
Ⅱ、(1)①依据假设和成分分析判断;
②利用盐酸和碳酸钙反应生成二氧化碳气体能使澄清石灰水变浑浊验证碳酸钙的存在,加入的酸溶解生成的草酸和高锰酸钾溶液反应使溶液褪色来设计实验进行验证草酸钙的存在;
(2)②依据化学反应的离子方程式定量关系计算;
③高锰酸钾具有强氧化性,菠菜中可能含有奇谈还原性物质.I.(1)高锰酸钾溶液具有氧化性能氧化草酸为二氧化碳,依据原子守恒和电荷守恒配平书写离子方程式为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O,
故答案为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O;
(2)图表中高锰酸钾溶液加热褪色时间较长,加入稀硫酸褪色时间缩短说明生成的锰离子对分解起了催化作用,加入少许硫酸锰速率增大较快,反应需要的时间缩短,
故答案为:随着草酸溶液与高锰酸钾溶液反应的进行,生成了Mn2+,Mn2+作为该反应的催化剂,可加快化学反应速率;
II.(1)①依据假设1、假设2可知假设3为只存在草酸钙,故答案为:只存在CaC2O4;
②假设2:既存在CaCO3,也存在CaC2O4,设计实验方案,进行实验先检验碳酸钙的存在,再利用加入的酸溶解生成的草酸和高锰酸钾溶液反应使溶液褪色来设计实验进行验证,取少量沉淀于试管中,加入足量1 mol•L-1 HCl,将产生的气体通入澄清石灰水中,澄清石灰水变浑浊,说明菠菜中含有碳酸盐,向步骤1得到的溶液中滴加几滴0.01 mol•L-1 KMnO4溶液紫红色褪去,说明菠菜中含有草酸盐,
故答案为:
取少量沉淀于试管中,加入足量1 mol•L-1 HCl,将产生的气体通入澄清石灰水中 澄清石灰水变浑浊,说明菠菜中含有碳酸盐
向步骤1得到的溶液中滴加几滴0.01 mol•L-1 KMnO4 溶液紫红色褪去,说明菠菜中含有草酸盐(2)②取m g菠菜样品,将其中草酸盐转化为 CaC2O4 沉淀分离出来,用盐酸溶解后,溶液转入100mL容量瓶中加水配制成100mL溶液.每次移取25.00mL该溶液,用0.0100mol•L-1KMnO4标准溶液滴定,滴定实验重复操作2-3次.平均消耗标准溶液V mL,依据反应的离子方程式计算草酸物质的量为x:
5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O
5 2
x 0.0100mol/L×v×10-3L
故答案为:
0.0100×10−3×5×100×88×V
2×25.00×m×100%;
③用标准KMnO4溶液直接滴定菠菜研磨、浸泡、过滤得到的溶液中可能含有其他还原性物质会消耗高锰酸钾,导致结果可能偏高,
故答案为:菠菜中还含有其他还原性物质,能与KMnO4反应.点评:
本题考点: 性质实验方案的设计;化学实验方案的评价.
考点点评: 本题考查了物质性质的实验设计和实验分析判断,定量测定实验的设计和计算应用,掌握实验基础和物质性质是解题关键,题目难度中等.1年前查看全部
- 为什么草酸分子式顺序颠倒一般有机物的分子式按碳——氢——氧——氟——硫顺序排列,但为什么草酸分子式是H2C2O4?急——
为什么草酸分子式顺序颠倒
一般有机物的分子式按碳——氢——氧——氟——硫顺序排列,但为什么草酸分子式是H2C2O4?急———— 芦屋1年前3
芦屋1年前3 -
 性zz大师 共回答了22个问题
性zz大师 共回答了22个问题 |采纳率81.8%这个问题好理解,草酸实际是有机酸,结构简式为HOOC-COOH,也就是乙二酸,在无机化学中为了保持一致,把它写成H2C2O4.这正如醋酸,也就是乙酸,在有机部分我们都写成CH3COOH,但在无机化学,我们通常写成HAc.1年前查看全部
- H2SO4+KMnO4+H2C2O4-K2SO4+MnSO4+CO2+H20
H2SO4+KMnO4+H2C2O4-K2SO4+MnSO4+CO2+H20
请详细告诉我氧化还原反应的配平方法,并告诉我这个化学方程式中的还原剂 氧化剂 还原产物 氧化产物 分别是什么 7m8k1年前1
7m8k1年前1 -
 恐龙的传人 共回答了14个问题
恐龙的传人 共回答了14个问题 |采纳率92.9%仔细说一下这个方程式吧,
1、首先找出前后化合价发生改变的元素.一般O、H、K化合物中都是不变价(除非是Na2O2等),而S前后都在SO4中,为+6价.
2、易得Mn从+7价变到+2价,化合价下降5价,即得5个电子,发生还原反应,故KMnO4为氧化剂,反应产物MnSO4为还原产物(还原反应的产物);同理C从+3价变到+4价,失1个电子,发生氧化反应,H2C2O4为还原剂,CO2为氧化产物
3、氧化还原配平:Mn得5电子,C失1电子.为使得失电子守恒,故需要5个C提供Mn所需电子,但H2C2O4中C必为偶数,则取最小公倍数10,在H2C2O4前加2,CO2前加10,KMnO4前加2,MnSO4前加2
4、基本配平:根据原子守恒得最终系数为3,2,5;1,2,10,81年前查看全部
- 2 KMnO4 + 3 H2C2O4 + 5 H2SO4 == K2SO4 + 2 MnSO4 + 10 CO2 + 8
2 KMnO4 + 3 H2C2O4 + 5 H2SO4 == K2SO4 + 2 MnSO4 + 10 CO2 + 8 H20的离子方程式
 二月十三1年前1
二月十三1年前1 -
 竖尾巴的猫 共回答了11个问题
竖尾巴的猫 共回答了11个问题 |采纳率90.9%化学方程式写错了,应该是
2 KMnO4 + 5H2C2O4 + 3H2SO4 == K2SO4 + 2 MnSO4 + 10 CO2 + 8 H2O
离子方程式是:
2MnO4- + 5H2C2O4 + 6H+ = 2Mn2+ + 10CO2 + 8H2O1年前查看全部
- H2C2O4这个化学式怎么读?(数字是下标)
H2C2O4这个化学式怎么读?(数字是下标)
还有Na2S4O6怎么读? 苟朋1年前6
苟朋1年前6 -
 xinallan 共回答了19个问题
xinallan 共回答了19个问题 |采纳率100%H2C2O4读作草酸,或者乙二酸.
Na2S4O6读作连四硫酸钠 .1年前查看全部
- 用粉笔和草酸制取硫酸的问题CaSO4+H2C2O4=H2SO4+CaC2O4但是粉笔内还有碳酸钙,现有2种想法.1.不管
用粉笔和草酸制取硫酸的问题
CaSO4+H2C2O4=H2SO4+CaC2O4
但是粉笔内还有碳酸钙,现有2种想法.
1.不管它,反正反应出的都是草酸钙
2.除去碳酸钙,只留下硫酸钙反应.
若选方法2,该怎么提纯硫酸钙?而硫酸和草酸钙好像也是可以反应的,该怎么避免这点?
我还有亚硫酸,能不能使亚硫酸和碳酸钙反应生成亚硫酸钙,再让亚硫酸钙氧化成硫酸钙?若能,反应速率能有多少? Miriambb1年前1
Miriambb1年前1 -
 nj20070401 共回答了17个问题
nj20070401 共回答了17个问题 |采纳率100%鼓励你的思考和想法.勤于与实际结合的思考是学习化学的好方法.
不过你这个反应是不能发生的.因为硫酸是强酸.你的反应是用弱酸制强酸,不能发生.倒过来是可以的.
关于补充,你究竟是要得到硫酸还是硫酸钙?如果要硫酸,你直接用亚硫酸密封放在太阳下暴晒几天就成稀硫酸了.1年前查看全部
- 一定体积KMnO4的溶液恰好能氧化一定质量的KHC2O4'H2C2O4'2H2O.若用0.1的NaOH溶液中和相同质量的
一定体积KMnO4的溶液恰好能氧化一定质量的KHC2O4'H2C2O4'2H2O.若用0.1的NaOH溶液中和相同质量的KHC2O4'H2C2O4'2H2O,所需NaOH溶液的体积恰好为KMnO4溶液的3倍,也KMnO4溶液的浓度为
看不懂,能不能详细点 布拉沃1年前2
布拉沃1年前2 -
 guanweiweibb 共回答了28个问题
guanweiweibb 共回答了28个问题 |采纳率92.9%NaOH与KHC2O4'H2C2O4'2H2O是酸碱反应,3:1;
KMnO4与KHC2O4'H2C2O4'2H2O是氧化还原反应,4:5;1年前查看全部
- H2CO3[碳酸],HAC[醋酸],H2C2O4[草酸]的酸性排序
H2CO3[碳酸],HAC[醋酸],H2C2O4[草酸]的酸性排序
这几个物质之间的置换顺序是啥? 江南茶叶1年前1
江南茶叶1年前1 -
 yunxiang777 共回答了14个问题
yunxiang777 共回答了14个问题 |采纳率85.7%草酸>醋酸>碳酸,这同时也是置换顺序,强酸制弱酸的顺序1年前查看全部
- 化学式KSCN、H2C2O4怎么读?
 wcxz1年前1
wcxz1年前1 -
 海棠一叶 共回答了15个问题
海棠一叶 共回答了15个问题 |采纳率93.3%硫氰化钾,无水草酸1年前查看全部
- 0.1mol/L的H2C2O4与0.1mol/L的NaOH等体积混合,溶液PH=a ,a和7的关系.请点拨一下,
 mzche1年前2
mzche1年前2 -
 arealcarl 共回答了17个问题
arealcarl 共回答了17个问题 |采纳率94.1%生成物草酸氢钠.
NaHC2O4
记住:草酸氢根是电离大于水解的酸式盐,所以电离出的H+大于水解产生的OH-,所以溶液显酸性.
a1年前查看全部
- H2C2O4 ,H3BO3 ,HCN 的化学名称与俗称分别是什么?
 shaodongok1年前1
shaodongok1年前1 -
 aabbcc43 共回答了18个问题
aabbcc43 共回答了18个问题 |采纳率88.9%草酸,硼酸,氰化氢1年前查看全部
- 0.1mol/L的H2C2O4溶液与0.1mol/L的NaOH溶液等体积混合,溶液的pH=a(溶液的体积等于混合前体积和
0.1mol/L的H2C2O4溶液与0.1mol/L的NaOH溶液等体积混合,溶液的pH=a(溶液的体积等于混合前体积和),则c(HC2O4-)+2c(C2O4-)=?(用含a的代数式表示)
05+10^(-a)-10^(a-14),请问怎么得来的?0. hui12581年前3
hui12581年前3 -
 缘分使我们相识 共回答了19个问题
缘分使我们相识 共回答了19个问题 |采纳率94.7%两种溶液等体积混合,浓度减半,也就是0.05了
考虑化学反应,反应结果是只剩NaHC2O4
草酸氢钠电离式写出来,10^(-a)就是电离氢离子的浓度,再衡算一下就出来了1年前查看全部
- (2010•惠州模拟)ClO2是一种常用的预防“禽流感”的消毒剂,可通过以下反应制得(未配平):KClO3+H2C2O4
(2010•惠州模拟)ClO2是一种常用的预防“禽流感”的消毒剂,可通过以下反应制得(未配平):KClO3+H2C2O4+H2SO4→ClO2↑+K2SO4+CO2↑+H2O
下列说法正确的是( )
A.H2SO4做氧化剂
B.ClO2是氧化产物
C.H2C2O4被氧化
D.每消耗lmolKClO3就有2mol电子转移 我是cc我怕你1年前1
我是cc我怕你1年前1 -
 leaf2413 共回答了22个问题
leaf2413 共回答了22个问题 |采纳率90.9%解题思路:反应2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O 中,Cl元素的化合价由+5降低为+4价,C元素的化合价由+3升高到+4价,以此来解答.A、因反应中,H2SO4中元素化合价均未变,所以硫酸既不是氧化剂又不是还原剂,故A错误;
B、Cl元素的化合价降低,被还原,对应的产物为还原产物,即ClO2是还原产物,故B错误;
C、因C元素的化合价由+3升高到+4价,则H2C2O4在反应中作还原剂,被氧化,故C正确;
D、Cl元素的化合价由+5降低为+4价,1molKClO3参加反应转移的电子为1mol×(5-4)=1mol,故D错误;
故选C.点评:
本题考点: 氧化还原反应;氧化还原反应的电子转移数目计算.
考点点评: 本题考查氧化还原反应,明确反应中元素的化合价变化是解答本题的关键,注意H2C2O4中C元素化合价的判断是学生的易错点.1年前查看全部
- 将等物质的量的KHC2O4和H2C2O4溶于水配成溶液 该溶液 物料守恒怎么写
 niuzong20081年前2
niuzong20081年前2 -
 xiaonanqueen 共回答了28个问题
xiaonanqueen 共回答了28个问题 |采纳率85.7%等物质的量混合,草酸的存在形式有三种 HC2O4-、H2C2O4、C2O42-
他们的总浓度是 K+浓度的2倍.
所以物料守恒:
2 c(K+) = c(HC2O4-) + c(H2C2O4) + c(C2O42-)1年前查看全部
- 欲配制Ph=4.19的缓冲溶液,需要H2C2O4与NaOH固体的物质的量之比是多少?(已知H2C2O4的Ka1=5.90
欲配制Ph=4.19的缓冲溶液,需要H2C2O4与NaOH固体的物质的量之比是多少?(已知H2C2O4的Ka1=5.90×10∧-2,Ka2=6.46×10∧-5)《求详细解答过程》
 weichangxin2061年前1
weichangxin2061年前1 -
 冰雨若寒 共回答了15个问题
冰雨若寒 共回答了15个问题 |采纳率93.3%3:21年前查看全部
- 一道初中天原杯竞赛题草酸(H2C2O4)受热分解的产物是(?).
 红月雪光1年前1
红月雪光1年前1 -
 实力是底气 共回答了18个问题
实力是底气 共回答了18个问题 |采纳率88.9%HOOCCOOH(加热,浓H2SO4)=H2O+CO2(g)+CO(g)(实验室制CO)
也可用HCOOH(加热,浓H2SO4)=H2O+CO2(g)1年前查看全部
- (2010•江苏二模)草酸(H2C2O4)是一种重要的化工原料.已知常温下0.01mol•L-1的H2C2O4、KHC2
(2010•江苏二模)草酸(H2C2O4)是一种重要的化工原料.已知常温下0.01mol•L-1的H2C2O4、KHC2O4、K2C2O4溶液的pH如下表所示.
(1)在其它条件不变时,下列措施能使KHC2O4溶液中c(K+):c(HC2O4-)接近1:1的是______(填字母).H2C2O4 KHC2O4 K2C2O4 pH 2.0 3.1 8.1
A.加入适量的H2C2O4 B.加入适量的KHC2O4
C.加入适量的Na2C2O4D.升高溶液的温度
(2)取一定质量H2C2O4•2H2O和KHC2O4的混合物,加水溶解,配成250mL溶液,取两份此溶液各25mL,向第一份溶液中先加入几滴酚酞试液,再滴加0.25mol•L-1 NaOH溶液至20.00mL时,溶液由无色变为浅红色;向第二份溶液中滴加适量3mol•L-1 H2SO4溶液酸化后,用0.10mol•L-1 KMnO4溶液滴定,当消耗KMnO4溶液16.00mL时,溶液由无色变为浅紫红色.请回答下列问题:
①完成离子方程式:5C2O42-+2Mn04-+16H+═10______+2Mn2++8H2O.
②原混合物中H2C2O4•2H2O和KHC2O4的物质的量之比为______.
(3)某实验小组用如图所示的装置探究FeC2O4•2H2O在隔绝空气条件下受热分解的产物.当36D0g FeC2O4•2H2O充分反应后,残留固体质量为13.6g,浓硫酸增重7.2g,碱石灰增重11.0g.求残留固体的成分和物质的量.(已知FeC2O4•2H2O的相对分子质量为180;设反应产生的气体被充分吸收) 路_渐行渐远1年前1
路_渐行渐远1年前1 -
 sqhkjy 共回答了16个问题
sqhkjy 共回答了16个问题 |采纳率87.5%解题思路:(1)依据KHC2O4溶液显酸性可知,溶液中电离大于水解,选择抑制电离的试剂;
A、H2C2O4 分步电离显酸性,可以抑制HC2O4-离子的电离;
B、加入KHC2O4仍然离子浓度是大于1:1;
C、加入适量的Na2C2O4,可以抑制 HC2O4-离子的电离;
D、升温促进电离;
(2)①依据电子守恒、电荷守恒和原子守恒配平写出;
②依据原子守恒和化学方程式计算得到;
(3)最后被点燃的为一氧化碳气体,浓硫酸增重7.2g为水,碱石灰增重11.0g为二氧化碳气体.依据反应生成的物质在过程中的质量分别计算得到;(1)图表分析,KHC2O4溶液显酸性可知,溶液中电离大于水解,选择抑制HC2O4-离子电离的试剂;
A、H2C2O4 分步电离显酸性,可以抑制HC2O4-离子的电离,KHC2O4溶液中c(K+):c(HC2O4-)接近1:1;故A符合;
B、加入KHC2O4仍然离子浓度是大于1:1;故B不符合;
C、加入适量的Na2C2O4,可以抑制 HC2O4-离子的电离,KHC2O4溶液中c(K+):c(HC2O4-)接近1:1;故C符合;
D、升温促进电离,KHC2O4溶液中c(K+):c(HC2O4-)大于1:1;故D不符合;
故答案为:AC;
(2)①依据原子守恒得到为CO2;故答案为:CO2;
②25mL中,设xmol H2C2O4•2H2O ymol KHC2O4根据滴定的,可以得出:2x+y=0.25×0.02
根据氧化还原的,可以得出:x+y=0.1×0.016×2.5,x=0.001,y=0.003mol,所以原混合物中H2C2O4•2H2O和KHC2O4的物质的量之比为1:3;故答案为:1:3;
(3)被点燃的气体为CO,质量为m(CO)=36.0 g-13.6 g-7.2 g-11.0 g=4.2 g;
又FeC2O4•2H2O为0.2 mol,n(H2O)=7.2 g÷18 g/mol=0.4 mol,
n(CO2)=11.0 g÷44 g/mol=0.25 mol,n(CO)=4.2 g÷28 g/mol=0.15 mol,
所以,残留固体中所含元素及物质的量为n(Fe)=0.2 mol,n(O)=0.15 mol,
则残留固体为Fe和FeO的混合物,其中Fe为0.05 mol,FeO为0.15 mol;
故答案为:Fe为0.05 mol,FeO为0.15 mol;点评:
本题考点: 影响盐类水解程度的主要因素;氧化还原反应方程式的配平.
考点点评: 本题考查了盐类水解和弱电解质电离的相对大小比较,平衡移动方向的判断,氧化还原反应离子方程式的配平方法,实验过程的计算应用,题目难度中等.1年前查看全部
- 水中碳酸氢根离子Hco3主要以CaH2co3的形式存在,那在水中加入草酸H2C2O4后除了形成草酸钙CaC2o4还有?
水中碳酸氢根离子Hco3主要以CaH2co3的形式存在,那在水中加入草酸H2C2O4后除了形成草酸钙CaC2o4还有?
草酸去除水中钙离子后,Hco3缓冲物质是否跟着消失了?草酸与碳酸氢钙CaH2co3的反应的方程式是什么? 我是一只海鸥1年前2
我是一只海鸥1年前2 -
 顺手一枪 共回答了15个问题
顺手一枪 共回答了15个问题 |采纳率100%H2C2O4+Ca(HCO3)2=CaC2O4+2H2O+2CO2;
在这个反应方程中,Hco3缓冲物质反应消失了,但是水中的Hco3缓冲物质是不可能完全 被除去的.1年前查看全部
- KMnO4 + H2C2O4 + H2SO4—— K2SO4 + MnSO4 + CO2 + H2O 问:为什么以C2为
KMnO4 + H2C2O4 + H2SO4—— K2SO4 + MnSO4 + CO2 + H2O 问:为什么以C2为变化单位?本人觉得知道点但是有点迷惑的感觉
 wangdayun1年前1
wangdayun1年前1 -
 情定今夜 共回答了17个问题
情定今夜 共回答了17个问题 |采纳率76.5%因为 n(H2C2O4) = n(C2)
2KMnO4 + 5H2C2O4 + 3H2SO4 = K2SO4 + 2MnSO4 + 10CO2 + 8H2O1年前查看全部
- 固体草酸(H2C2O4)受热分解生成碳的氧化物和水,写出该反应的化学方程式
 q7bt1年前2
q7bt1年前2 -
 晓莜 共回答了21个问题
晓莜 共回答了21个问题 |采纳率90.5%H2C2O4=加热=H2O+CO2↑+CO↑1年前查看全部
- (2008•镇江)草酸晶体(H2C2O4•2H2O)熔点较低,加热会熔化、气化和分解.草酸(H2C2O4)受热会分解,它
(2008•镇江)草酸晶体(H2C2O4•2H2O)熔点较低,加热会熔化、气化和分解.草酸(H2C2O4)受热会分解,它与氢氧化钙的反应为:H2C2O4+Ca(OH)2=CaC2O4↓(白色)+2H2O.
甲、乙两同学对草酸受热分解的产物作如下探究:
(1)猜想与假设:第一种:草酸分解生成CO2和H2;第二种:草酸分解生成CO2、CO和H2O;
第三种:草酸分解:H2C2O4→CO2↑+H2O(未配平);
有同学从理论上就可判断第三种假设不成立,老师也认为这一判断是正确的,该同学判断的理论依据是______.
(2)设计与实验:
甲、乙两同学分别设计了下图所示的A、B两套实验装置(图中铁架台略去).
①甲同学按A装置实验,观察到澄清石灰水变浑浊,认为此现象是由草酸晶体受热分解产生的CO2所导致,此判断______(填“严密”或“不严密”).
②乙同学的B装置图方框内的仪器未画完整,请你帮他画完整(直接画在图上或答题卡上).
乙同学按B装置实验,看到无水硫酸铜由白变蓝,洗气瓶中溶液变浑浊.在尖嘴管口点燃剩余气体,火焰上方罩一个______烧杯,有白色固体生成,证明产物中有______;换一个干、冷烧杯罩在火焰上方,内壁无现象,证明产物中无H2.
(3)结论与思考:
①草酸受热分解的化学方程式为:H2C2O4
CO2↑+CO↑+H2O(2分);加热 ..H2C2O4.
CO2↑+CO↑+H2O(2分);加热 ..
②若省略B装置方框内的仪器,整套装置也能证明产物中有CO2(假设每步都反应完全),方法是:______. ujdf21年前1
ujdf21年前1 -
 zpp402423 共回答了12个问题
zpp402423 共回答了12个问题 |采纳率100%解题思路:猜想生成物首先考虑元素化合价反应前后肯定有升高的也又降低的,再根据图中设计的实验和二氧化碳的性质解决其它题目.(共8分)
(1)酸受热分解若只生成二氧化碳和水,氢氧元素化合价不变,而碳元素化合价升高,所以反应后应有化合价降低的元素,所以(1)答案:(1)无法进行配平、配不平或不符合质量守恒定律或只有化合价的升高,无化合价的降低(1分).
(2)烧杯敞口放置在空气中空气中也有二氧化碳,时间长了烧杯内的澄清石灰水也会变浑浊,故答案:①不严密(1分)注意洗气瓶要长进短出,进气的导管要浸没液体中,出气导管只要刚刚露出橡皮塞.故答案②如右下图(长管不伸入液面下不给分,不作美观要求)(1分)
因为无水硫酸铜由白变蓝,洗气瓶中溶液变浑浊,所以草酸受热分解肯定生成二氧化碳和水,但都被吸收.到最后点燃的是一氧化碳,燃烧生成二氧化碳.故答案:内壁附有澄清石灰水(其它合理答案均给分)(1分)CO(1分)
(3)根据实验现象和前面的分析知草酸受热分解生成二氧化碳、一氧化碳、水.故答案:①H2C2O4
△
.
CO2↑+CO↑+H2O(2分);
二氧化碳能和碱石灰中的氢氧化钠反应,虽没现象但干燥管因吸收它质量增加.故答案:②称量实验前后盛有碱石灰的干燥管的质量(意思相近的表述均给分)(1分)点评:
本题考点: 实验探究物质的性质或变化规律;化学实验方案设计与评价;化学方程式的配平;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题是实验探究题,综合考查到了质量守恒定律、物质的性质、化学用语相关知识.1年前查看全部
- 高锰酸钾的硫酸溶液和H2C2O4溶液反应的化学方程式
 yuru551年前1
yuru551年前1 -
 sadfgjaewghrth 共回答了23个问题
sadfgjaewghrth 共回答了23个问题 |采纳率82.6%2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O1年前查看全部
- 称取软锰矿试样0.5000g,加入0.7500gH2C2O4·2H2O及稀硫酸,加热至反应完全.过量的草酸用30.00m
称取软锰矿试样0.5000g,加入0.7500gH2C2O4·2H2O及稀硫酸,加热至反应完全.过量的草酸用30.00mL0.02000mol/L的KMnO4溶液滴定至终点,求软锰矿的氧化能力(以已知)(8分)
 c1dt1ybg1年前1
c1dt1ybg1年前1 -
 youbear 共回答了24个问题
youbear 共回答了24个问题 |采纳率91.7%哦,擅长领域还是化学的呢?!
5H2C2O4.2H2O :2KMnO4
5*126.07 2
X 30/1000*0.02 X = 5*126.07*0.02/2/1000 = 0.1891g
MnO2 :H2C2O4.2H2O
86.94 126.07
Y 0.1891 Y = 86.94*0.1891/126.07 = 0.1304g
……1年前查看全部
- H2C2O4是一种二元弱酸,NaHC2O4溶液显酸性.现测得某溶液中存在的离子有C2O42-、
H2C2O4是一种二元弱酸,NaHC2O4溶液显酸性.现测得某溶液中存在的离子有C2O42-、
HC2O4-、OH-、Na+、H+.下列判断正确的是
A.该溶液的溶质只能是Na2C2O4或NaHC2O4或两者的混合物
B.该溶液可能显酸性、碱性或中性
C.溶液中一定存在c(Na+) >c(HC2O4-)
D.溶液中一定存在c(H+) -c(OH-) >c(HC2O4- ) - c(Na+) 路人孤寂1年前1
路人孤寂1年前1 -
 血雨降尘 共回答了20个问题
血雨降尘 共回答了20个问题 |采纳率90%A,错,可以是H2C2O4和Na2C2O4或H2C2O4和NaHC2O4的混合物
B,对,这几种物质,单独或按不同的比例组合,就能使溶液显酸性、碱性或中性
C,错,若是H2C2O4和Na2C2O4或H2C2O4和NaHC2O4的混合物,此式就不成立
D,对,按电荷守恒: c(H+) +c(Na+)= c(OH-) +c(HC2O4- )+2c(C2O42-)
所以:c(H+) -c(OH-) = c(HC2O4- )+2c(C2O42-)-c(Na+)
等式的右边减去2c(C2O42-),等号就可以换成的>
即:c(H+) -c(OH-) >c(HC2O4- ) - c(Na+)1年前查看全部
大家在问
- 1已知椭圆C的中心在原点 焦点在y轴上 焦距为2倍根号3 且过点M*(-根号13/4,根号3/2)
- 2幸福是什么 (很值一读的小学课文) 幸福是什么 (很值一读的小学课文)
- 3已知:a(a-1)-(a的平方-b)=—4,求代数式ab-2分之a的平方+b的平方的值、
- 4Jim's mother often writing stories.(改错)
- 5填单词 Take some medicine and have a good __________________?
- 6一个长方形的周长是70厘米,长比宽多5厘米,现在要同时减少长和宽,减少以后的长方形面积是原来长方形面积的一半.如果长减少
- 7英语单选题求助the rich man has decided to ___ everything he has to
- 8植物和照片的英文
- 9优秀的举重运动员能在2秒内将1500牛的杠铃举到2米高的地方,他的功率至少达到了?
- 10基因型为AaBbCcDd和AABbCcDd的向日葵杂交,按自由组合定律,后代中基因为AABBCcdd的个体所占的比例为(
- 11小车A和小木块B(可看成是质点)的质量分别是mA=15.0kg,mB=5.0kg,车的长度L=4.0m.B位于A的最左端
- 121.(2x-1)(4x²+2x+1))
- 131XX生活中处处都有美,只要你有一双发现美的眼睛,有一颗感悟美的心灵.3心——(江西《让
- 14I`ve left someone to look agter the apartment while the men
- 15she is happy to have_______friends
