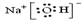保险粉在水中的分解速度很快吗?我配制的溶液放了一天好象连二亚硫酸钠就分解完了,
 ceciliatse2022-10-04 11:39:544条回答
ceciliatse2022-10-04 11:39:544条回答
已提交,审核后显示!提交回复
共4条回复
 冰雨传说 共回答了20个问题
冰雨传说 共回答了20个问题 |采纳率85%- 连二亚硫酸钠的溶液还算稳定,只能保存1天似乎不太可能.这东西必须密封保存在阴凉处,并且尽量不要接触金属离子,有条件的话保存在塑料瓶里面吧,可以避免玻璃中含有的痕量金属离子催化分解反应
- 1年前
 yuan8261 共回答了21个问题
yuan8261 共回答了21个问题 |采纳率81%- 那玩意很容易被氧气氧化
- 1年前
 463131 共回答了1个问题
463131 共回答了1个问题 |采纳率- 保险粉遇水或过热(超过90度)都会剧烈分解并产生大量的热。一烧杯的保险粉里面加入少量水(约20毫升)约五分钟之后保险粉能燃烧起来。配制一烧杯水溶液在搅拌的同时连二亚硫酸钠就会完全分解。
- 1年前
 zjjz008 共回答了1个问题
zjjz008 共回答了1个问题 |采纳率- OK
- 1年前
相关推荐
- 盐酸普鲁卡因合成实验中:盐酸普鲁卡因成盐时为何要加入保险粉?酯化反应中,为何加入二甲苯做溶剂?还原反应结束,为什么要加入
盐酸普鲁卡因合成实验中:
盐酸普鲁卡因成盐时为何要加入保险粉?
酯化反应中,为何加入二甲苯做溶剂?
还原反应结束,为什么要加入硫化钠? 哭泣的蓝gg1年前1
哭泣的蓝gg1年前1 -
 853999 共回答了20个问题
853999 共回答了20个问题 |采纳率90%1、保险粉为强还原剂,可防止芳胺基氧化,同时可除去有色杂质,以保证产品色泽洁白,若用量过多,则成品含硫量不合格.
2、用惰性溶剂(二甲苯)与聚酯化反应生成水的共沸而将水带出.
3、沉淀反应液中的铁盐1年前查看全部
- 保险粉废水是什么?有些什么成分?
 群星陨落1年前1
群星陨落1年前1 -
 yjq715 共回答了20个问题
yjq715 共回答了20个问题 |采纳率90%保险粉废水是含保险粉的废水保险粉是硫代硫酸钠1年前查看全部
- 什么是保险粉
 梦想人鱼1年前2
梦想人鱼1年前2 -
 fweferffd 共回答了21个问题
fweferffd 共回答了21个问题 |采纳率76.2%连二亚硫酸钠,也称为保险品,是一种白色砂状结晶或淡黄色粉末化学用品,熔点300℃(分解) ,引燃温度 250 ℃,不溶于乙醇,溶于氢氧化钠溶液,遇水发生强烈反应并燃烧.1年前查看全部
- (2014•重庆二模)硫代硫酸钠(Na2S2O3)俗称保险粉,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等.实验室可
(2014•重庆二模)硫代硫酸钠(Na2S2O3)俗称保险粉,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等.实验室可通过如下反应制取:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2.
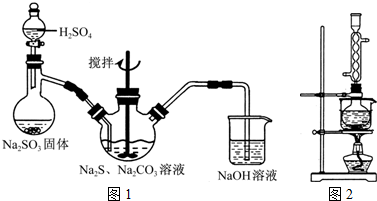
(1)用图1所示装置制取Na2S2O3,其中NaOH溶液的作用是______.如将分液漏斗中的H2SO4改成浓盐酸,则三颈烧瓶内除Na2S2O3生成外,还有______(填化学式)杂质生成.
(2)为测定所得保险粉样品中Na2S2O3•5H2O的质量分数,可用标准碘溶液进行滴定,反应方程式为2Na2S2O3+I2═2NaI+Na2S4O6.
①利用KIO3、KI和HCl可配制标准碘溶液.写出配制时所发生反应的离子方程式:______.
②准确称取一定质量的Na2S2O3•5H2O样品于锥形瓶中,加水溶解,并滴加______作指示剂,用所配制的标准碘溶液滴定.滴定时所用的玻璃仪器除锥形瓶外,还有______.
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3•5H2O的质量分数的测量结果______(填“偏高”“偏低”或“不变”).
(3)本实验对Na2S的纯度要求较高,利用图2所示的装置可将工业级的Na2S提纯.已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精.提纯步骤依次为:
①将已称量好的工业Na2S放入圆底烧瓶中,并加入一定质量的酒精和少量水;
②按图2所示装配所需仪器,向冷凝管中通入冷却水,水浴加热;
③待______时,停止加热,将烧瓶取下;
④______;
⑤______;
⑥将所得固体洗涤、干燥,得到Na2S•9H2O晶体. apimh1年前1
apimh1年前1 -
 关心生活 共回答了21个问题
关心生活 共回答了21个问题 |采纳率81%解题思路:(1)制备过程中需要制备二氧化硫进行反应生成硫代硫酸钠,二氧化硫是污染性气体不能排放空气中,需要用氢氧化钠溶液吸收;若换成盐酸除了反应生成硫代硫酸钠外还有氯化钠;
(2)①KIO3、KI和HCl可配制标准碘溶液,利用KIO3、KI在酸溶液中发生的氧化还原反应生成单质碘;
②用配制的碘溶液滴定硫代硫酸钠,利用碘单质遇碘单质变蓝指示反应终点;碘溶液具有氧化性,应选用酸式滴定管;
③局部变色就停止滴定,消耗标准溶液少,测定结果偏低;
(3)③依据Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精,根据提纯硫化钠晶体的实验步骤和方法分析判断的;
④温度增大硫化钠在酒精中溶解度增大,热溶液过滤得到滤液;
⑤热的滤液冷却结晶过滤得到晶体.(1)装置中氢氧化钠是吸收尾气的主要作用,因为原料气二氧化硫是污染性气体不能排放到空气中,以防止污染空气;换做 盐酸进行反应产物中 除了硫代硫酸盐外还有氯化钠,
故答案为:吸收二氧化硫等尾气,防止污染空气;NaCl;
(2))①KIO3、KI和HCl可配制标准碘溶液,利用KIO3、KI在酸溶液中发生的氧化还原反应生成单质碘,反应的离子方程式为:IO3-+5I-+6H+=3I2+3H2O,
故答案为:IO3-+5I-+6H+=3I2+3H2O;
②用配制的碘溶液滴定硫代硫酸钠,利用碘单质遇碘单质变蓝指示反应终点;碘溶液具有氧化性,应选用酸式滴定管,
故答案为:淀粉溶液;酸式滴定管;
③滴定时振荡不充分,刚看到溶液局部变色就停止滴定,消耗标准溶液体积减小,则会使样品中Na2S2O3•5H2O的质量分数的测量偏低;
故答案为:偏低;
(3)由提纯硫化钠的实验步骤和操作过程可知,
③依据Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精,根据提纯硫化钠晶体的实验步骤和方法可知,但烧瓶中固体不再减少,说明硫化钠全部溶解于酒精中,不溶的杂质沉淀过滤除去,故答案为:烧瓶中固体不再减少;
④温度增大硫化钠在酒精中溶解度增大,热溶液过滤得到滤液中主要是硫化钠的酒精溶液,故答案为:趁热过滤;
⑤热的滤液通过冷却、结晶、过滤得到晶体,故答案为:将所得滤液冷却结晶,过滤得到硫化钠结晶水合物.点评:
本题考点: 制备实验方案的设计.
考点点评: 本题考查了物质制备实验方案的设计和制备过程分析应用,主要是实验基本操作的应用,掌握基础,注意积累是解题关键,题目难度中等.1年前查看全部
- 如何使用保险粉褪去真丝面料的颜色?是否需要加入其他化学试剂?温度、浓度、时间等该如何掌握?
如何使用保险粉褪去真丝面料的颜色?是否需要加入其他化学试剂?温度、浓度、时间等该如何掌握?
如题. 开心凌儿1年前1
开心凌儿1年前1 -
 但我却是 共回答了21个问题
但我却是 共回答了21个问题 |采纳率95.2%保险粉(低亚硫酸钠):属于强还原漂白剂.在碱性溶液内对面料有剥色和漂白作用,主要用于白色丝、毛织物的漂白和脱色.
保险粉是什么样的助剂?怎样正确使用?保险粉又名快粉,化学名称为低亚硫酸钠或连二亚硫酸钠.它是强还原剂,呈白色流动性细纱状,性质活泼,遇到水能够自燃,属于危险品.它极易受潮而失去使用价值.
由于保险粉以纤维的损伤相对于氧化剂而言要小得多,所以称做“保险粉”.它可以用于各种纤维的纺织品而不至于造成伤害.但是保险粉对除还原染料以为的大多数染料有破坏作用.所以一般情况下只能在白色纺织品使用.保险粉主要用于剥除衣物上的色迹,亦可使一些陈旧性的灰黄色衣物的色泽更新.具体用法:使用10~15倍90℃热水,加入25~40克保险粉/每件衣物,然后投入衣物并且迅速翻动拎洗,3分钟之内反应就可以基本结束.上述的操作的要点是:⑴使用时要把保险粉放入热水中搅匀,不要用热水冲化保险粉.(先放水后放保险粉) ⑵注意翻动衣物时使其尽量没入水中.⑶动作应该迅速.
多注意观察(随时)还原程度等的变化.
保险粉(棉扒白)对活性染料、直接染料的扒色:
一、主要有3种现象:
A、扒色后织物为白色.B、扒色后织物为原色的浅色.C、扒色后织物为其它色的浅色.
二、一般扒色时的用量(以 1 kg布为准)
保险粉:40—60g
纯 碱:PH值 10—10.5
温 度:98—100℃浴比1:15
时 间:20—30分钟
扒色后的水洗过程:冷洗→酸洗(PH值4左右)→冷洗二次→静置2小时以上,冷洗一次,80℃左右热洗一次,冷洗2次,待染色.
三、扒色后的作用
⒈棉纤维可以将深色改为浅色,方法是扒色,再水洗后再染可需的颜色.
⒉染色中出现色花,扒色后要从新染色进行补救.
一般情况下不要扒色,最好根据原来的颜色进行改色,或加色,可以节约成本,减少不必要的浪费.
色的三要素:颜色有三种主要特性(即色的三要素),就是色相、亮度和深度.
⑴色相指比较明确地表示出某种颜色的色别的名称,如红、黄、蓝等.
⑵亮度也称鲜艳度,是指光泽的明、暗、强、弱的程度.
⑶深度一般是指颜色的浓淡(深浅).1年前查看全部
- 焦亚硫酸钠 亚硫酸钠 亚硫酸氢钠 保险粉 哪个的还原性最强,顺序是!
 zhangjianf20051年前4
zhangjianf20051年前4 -
 小鸟飞刀 共回答了17个问题
小鸟飞刀 共回答了17个问题 |采纳率82.4%保险粉最强
之后应该是亚硫酸氢钠,亚硫酸钠,焦亚硫酸钠1年前查看全部
- 甲醇的实验室制法有个地方不理解将甲酸和溶于甲醇和水混合溶剂的NaOH溶液混合,再通入SO2气体,就得到保险粉.化学式如下
甲醇的实验室制法有个地方不理解
将甲酸和溶于甲醇和水混合溶剂的NaOH溶液混合,再通入SO2气体,就得到保险粉.
化学式如下: HCOONa + 2SO2 + NaOH== Na2S2O4 + CO2 +H2O
甲醇作溶剂,其中生成物与反应物均可溶于甲醇,可以降低保险粉在水中的溶解度,因“水加入甲醇之后会降低极性,而保险粉极性很强,可从溶剂中析出,从而起到从反应体系方便分离的目的”
水极性那么大,水加入甲醇之后怎么会降低极性呢? 分头头1年前1
分头头1年前1 -
 翠花宝贝 共回答了11个问题
翠花宝贝 共回答了11个问题 |采纳率90.9%甲醇是弱极性分子,与水互溶并行成氢键后使保险粉用极性氧.氢原子接触的机会变小了,从而析出.1年前查看全部
- 保险粉做什么用的?
 缀网劳猪1年前3
缀网劳猪1年前3 -
 笑翻了跟头 共回答了11个问题
笑翻了跟头 共回答了11个问题 |采纳率90.9%连二亚硫酸钠,也称为保险粉,是一种白色砂状结晶或淡黄色粉末化学用品,熔点300℃(分解) ,引燃温度 250 ℃,不溶于乙醇,溶于氢氧化钠溶液,遇水发生强烈反应并燃烧.
保险粉广泛用于纺织工业的还原性染色、还原清洗、印花和脱色及用作丝、毛、尼龙等物织的漂白,由于它不含重金属,经漂白后的织物色泽鲜艳,不易退色.在各种物质方面,保险粉还可用于食品漂白,诸如明胶、蔗糖、蜜等,肥皂、动(植)物油、竹器、瓷土的漂白等.保险粉还可应用于有机合成,如染料、药品的生产里作还原剂或漂白剂,它是最适合木浆造纸的漂白剂.[1年前查看全部
- 在染整还原洗的时候水加少了保险粉飞溅出来了!灰色裤子变成粉红色的了!这是什么反应?
 bugbaby1年前1
bugbaby1年前1 -
 jinghongzhaoying 共回答了17个问题
jinghongzhaoying 共回答了17个问题 |采纳率82.4%保险粉对还原染料等具有还原、褪色的作用.
不能肯定你的灰色裤子是用的什么染料,但肯定是发生了反应,导致染料褪色.
可以用低浓度的氧化剂,如含有过氧化碳(俗名:氧净)的洗衣粉溶液浸泡,有助于恢复颜色.但不一定能完全复原.1年前查看全部
- (2014•泉州模拟)保险粉(Na2S2O4)有极强的还原性,遇水或在潮湿空气中会分解发热,甚至引起燃烧,但在碱性环境下
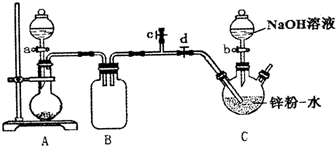 (2014•泉州模拟)保险粉(Na2S2O4)有极强的还原性,遇水或在潮湿空气中会分解发热,甚至引起燃烧,但在碱性环境下较稳定.某实验小组利用如图装置制取保险粉,并验证其还原性.在35~45℃下,将SO2气体通入锌粉-水悬浮液中,生成ZnS2O4;待反应完全后,冷却至室温,向三颈烧瓶中加入18%的NaOH溶液,生成Na2S2O4和Zn(OH)2;经一系列操作获得无水Na2S2O4样品.
(2014•泉州模拟)保险粉(Na2S2O4)有极强的还原性,遇水或在潮湿空气中会分解发热,甚至引起燃烧,但在碱性环境下较稳定.某实验小组利用如图装置制取保险粉,并验证其还原性.在35~45℃下,将SO2气体通入锌粉-水悬浮液中,生成ZnS2O4;待反应完全后,冷却至室温,向三颈烧瓶中加入18%的NaOH溶液,生成Na2S2O4和Zn(OH)2;经一系列操作获得无水Na2S2O4样品.
(1)实验室用A装置制备SO2气体,选用的最佳试剂是______
A.Na2SO3和盐酸 B.Na2SO3和硫酸 C.Na2SO3和硝酸 D.Cu和浓硫酸
(2)实验开始应先关闭止水夹d、打开c一段时间,其原因是______
(3)C装置中的反应需控制温度35~45℃,方法是______
(4)SO2流速过快会导致C中反应温度过高,控制SO2流速的操作是______
(5)生成Na2S2O4的化学方程式为______
(6)配制保险粉浓溶液的操作是______
(7)该装置存在的明显缺陷是______. 蝴蝶信笺1年前1
蝴蝶信笺1年前1 -
 月饼大王 共回答了21个问题
月饼大王 共回答了21个问题 |采纳率90.5%解题思路:(1)据装置是否要加热、酸是否有挥发和是否有强氧化性来判断;
(2)装置中有氧气会干扰后面的实验;
(3)加热时采用水浴;
(4)控制硫酸的滴入速度;
(5)合成保险粉的反应物为ZnS2O4和NaOH,结合质量守恒书写方程式;
(6)配制保险粉注意与水大量放热,让产生的热量及时散失,要及时搅拌.
(7)装置的设计要符合环保.(1)因为盐酸有挥发性,制得的气体不纯,而混有HCl气体;硝酸有强氧化性,Na2SO3有较强的还原性,二者反应不生成SO2;Cu和浓硫酸反应要加热,而图A中没有,故答案为:B;
(2)装置中有氧气会氧化锌,所以原因为:排除装置中的氧气,故答案为:排除装置中的氧气;
(3)水浴能使容器受热均匀,故答案为:水浴加热;
(4)控制硫酸的滴入速度,让产生的热量及时散失,做法就是缓慢旋转活塞a,故答案为:缓慢旋转活塞a,控制硫酸的滴入速度;
(5)合成保险粉的反应物为ZnS2O4和NaOH,生成Na2S2O4和Zn(OH)2,反应的方程式为ZnS2O4+2NaOH=Na2S2O4+Zn(OH)2↓,
故答案为:ZnS2O4+2NaOH=Na2S2O4+Zn(OH)2↓;
(6)配制保险粉注意与水大量放热,让产生的热量及时散失,要及时搅拌,故答案为:往一定量的水中边缓慢加入保险粉并搅拌;
(7)装置的设计要符合环保,有尾气SO2气体放出,污染环境,故答案为:无尾气吸收装置.点评:
本题考点: 性质实验方案的设计.
考点点评: 解答本题的关键是要掌握各种物质的性质,只有掌握了物质的性质才能对物质的性质和储存方法做出正确的判断.1年前查看全部
- 求保险粉加碱在剥分散染料的作用我对保险粉的理解是还原性,在碱性条件下加热到85度起作用,加碱只是调节PH值.而今天有人告
求保险粉加碱在剥分散染料的作用
我对保险粉的理解是还原性,在碱性条件下加热到85度起作用,加碱只是调节PH值.而今天有人告诉我保险粉剥红光,片碱剥黄光.到底哪个才是正确的, 空即食色1年前1
空即食色1年前1 -
 美星68 共回答了14个问题
美星68 共回答了14个问题 |采纳率92.9%保险粉是一种强还原剂,很多染料的母体结构中都含有偶氮不饱和双键,而这种不饱和双键就是染料的发色基团.保险粉能破坏掉这种共轭性的不饱和双键,使染料褪色.但是分散染料绝大多数都不是这种结构,而是蒽醌共轭结构,保...1年前查看全部
- 硫代硫酸钠(Na2S2O3)俗称保险粉,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等.实验室可通过如下反应制取:2N
硫代硫酸钠(Na2S2O3)俗称保险粉,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等.实验室可通过如下反应制取:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2.
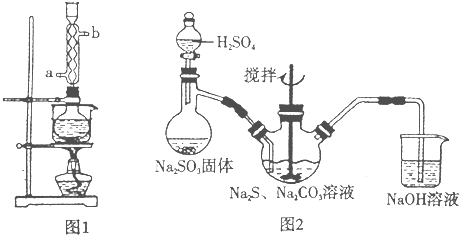
(1)本实验对Na2S的纯度要求较高,利用图1所示的装置可将工业级的Na2S提纯.已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精.提纯步骤依次为:
①将已称量好的工业Na2S放入圆底烧瓶中,并加入一定质量的酒精和少量水;
②按图1所示装配所需仪器,向冷凝管的______处(填a或b)通入冷却水,同时水浴加热;
③待烧瓶中固体不再减少时,停止加热,将烧瓶取下;
④______;
⑤______;
⑥将所得固体洗涤、干燥,得到Na2S•9H2O晶体.
(2)用图2所示装置制取Na2S2O3,其中NaOH溶液的作用是______.如将分液漏斗中的H2SO4改成浓盐酸,则三颈烧瓶内除Na2S2O3生成外,还有可能出现浑浊,写出该反应的化学方程式______.
(3)为测定所得保险粉样品中Na2S2O3•5H2O的质量分数,可用标准碘溶液进行滴定,反应方程式为2Na2S2O3+I2=2NaI+Na2S4O6.
①利用KIO3、KI和HCl可配制标准碘溶液.写出配制时所发生反应的离子方程式:______.
②准确称取一定质量的Na2S2O3•5H2O样品于锥形瓶中,加水溶解,并滴加______作指示剂,用所配制的标准碘溶液滴定.滴定时所用的玻璃仪器除锥形瓶外,还有______.
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3•5H2O的质量分数的测量结果______(填“偏高”“偏低”或“不变”). xmcxcoc1年前1
xmcxcoc1年前1 -
 caolingyun 共回答了18个问题
caolingyun 共回答了18个问题 |采纳率83.3%解题思路:(1)②为充分冷却,应使冷水充满冷凝管;
④温度增大硫化钠在酒精中溶解度增大,热溶液过滤得到滤液;
⑤热的滤液冷却结晶过滤得到晶体;
(2)制备过程中需要制备二氧化硫进行反应生成硫代硫酸钠,二氧化硫是污染性气体不能排放空气中,需要用氢氧化钠溶液吸收;若换成盐酸除了反应生成硫代硫酸钠外还有氯化钠;
(3)①KIO3、KI和HCl可配制标准碘溶液,利用KIO3、KI在酸溶液中发生的氧化还原反应生成单质碘;
②用配制的碘溶液滴定硫代硫酸钠,利用碘单质遇碘单质变蓝指示反应终点;碘溶液具有氧化性,应选用酸式滴定管;
③刚看到溶液局部变色就停止滴定,可能还没有达到滴定终点.(1)②为充分冷却,应使冷水充满冷凝管,则应向冷凝管的a处通入水,故答案为:a;
④温度增大硫化钠在酒精中溶解度增大,热溶液过滤得到滤液中主要是硫化钠的酒精溶液,故答案为:趁热过滤;
⑤热的滤液通过冷却、结晶、过滤得到晶体,故答案为:冷却结晶,过滤;
(2)装置中氢氧化钠是吸收尾气的主要作用,因为原料气二氧化硫是污染性气体不能排放到空气中,以防止污染空气;换做盐酸进行反应产物中除了硫代硫酸盐外,在酸性条件下发生反应生成单质硫和氯化钠,反应的方程式为4HCl+2Na2S+SO2=4NaCl+3S↓+2H2O,
故答案为:吸收SO2等有害气体,防止污染空气;4HCl+2Na2S+SO2=4NaCl+3S↓+2H2O;
(3)①KIO3、KI和HCl可配制标准碘溶液,利用KIO3、KI在酸溶液中发生的氧化还原反应生成单质碘,反应的离子方程式为:IO3-+5I-+6H+=3I2+3H2O,
故答案为:IO3-+5I-+6H+=3I2+3H2O;
②用配制的碘溶液滴定硫代硫酸钠,利用碘单质遇碘单质变蓝指示反应终点;碘溶液具有氧化性,应选用酸式滴定管,
故答案为:淀粉溶液;酸式滴定管;
③刚看到溶液局部变色就停止滴定,可能还没有达到滴定终点,消耗的碘少,则浓度偏低,故答案为:偏低.点评:
本题考点: 制备实验方案的设计;含硫物质的性质及综合应用.
考点点评: 本题考查了物质制备实验方案的设计和制备过程分析应用,主要是实验基本操作的应用,掌握基础,侧重于学生的分析能力、实验能力的考查,为高考常见题型和高频考点,注意把握物质的性质以及实验原理的探究,题目难度中等.1年前查看全部
- 保险粉是用在什么地方的?
 bbaxx1年前1
bbaxx1年前1 -
 lilykeky 共回答了13个问题
lilykeky 共回答了13个问题 |采纳率92.3%保险粉广泛用于纺织工业的还原性染色、还原清洗、印花和脱色及用作丝、毛、尼龙等物织的漂白,由于它不含重金属,经漂白后的织物色泽鲜艳,不易退色.在各种物质方面,保险粉还可用于食品漂白,诸如明胶、蔗糖、蜜等,肥皂、动(植)物油、竹器、瓷土的漂白等.保险粉还可应用于有机合成,如染料、药品的生产里作还原剂或漂白剂,它是最适合木浆造纸的漂白剂.而且在水处理和控制污染方面可将许多重金属离子如Pb2+,Bi3+等还原为金属,还可用于保存食物水果等.
但是由于保险粉存在的诸多危险性,它的很多用途倾向于用更加安全,易于储存与运输的二氧化硫脲替代1年前查看全部
- (2012•龙岩)4月13日,佛山下一场暴雨,引发一辆大货车着火.调查表明,该车装了大量的保险粉(化学式为Na2S2O4
(2012•龙岩)4月13日,佛山下一场暴雨,引发一辆大货车着火.调查表明,该车装了大量的保险粉(化学式为na2s2o4),保险粉与水接触剧烈反应而引发了燃烧.事故现场,***紧急调来沙土,覆盖在保险粉上,火被扑灭.请结合信息回答:
(1)na2s2o4中硫元素的化合价为______.
(2)保险粉与水反应属于______反应(填“放热”或“吸热”).
(3)沙土覆盖能灭火的主要原因是______.
(4)保险粉是重要的化工产品,制取反应的化学方程式为:hcoona+2so2+naoh=na2s2o4+co2+x
①x代表一种物质,其化学式为______.
②制得的保险粉该如何保存?答:______. xsl80921年前1
xsl80921年前1 -
 1分56秒 共回答了19个问题
1分56秒 共回答了19个问题 |采纳率73.7%解题思路:(1)根据化合物中正负化合价的代数和为零的原则分析;
(2)根据题目中的信息“保险粉与水接触剧烈反应而引发了燃烧”分析;
(3)根据灭火的原理:清除可燃物或使可燃物与其他物品隔离、隔绝氧气或空气、使温度降到可燃物的着火点以下,解答本题;
(4)①根据质量守恒定律的微观解释:化学反应前后原子的种类和数目不变.可知在化学反应方程式中,反应物和生成物中所含的原子的种类和数目相同,进行分析;②根据保险粉的性质分析判断.(1)Na2S2O4中Na是+1价,O是-2价,根据化合物中正负化合价的代数和为零的原则,则Na2S2O4中S的化合价为+3价;
(2)根据题目中的信息“保险粉与水接触剧烈反应而引发了燃烧”可知,此反应是放热反应;
(3)根据灭火的原理,沙土覆盖能灭火的主要原因是隔绝氧气;
(4)①根据质量守恒定律和化学方程式HCOONa+2SO2+NaOH=Na2S2O4+CO2+X可得,X的化学式含有钠原子的个数为:1+1-2=0,含有硫原子的个数为:2-2=0,含有氧原子的个数为:2+2x2+1-4-2=1,含有碳原子的个数为1-1=0,含有氢原子的个数为1+1-0=2.故可判断X的化学式为H2O;②根据题目中的信息“保险粉与水接触剧烈反应而引发了燃烧”可知,保险粉应密封、干燥保存.
故答案为:(1)+3;(2)放热;(3)隔绝氧气;(4)①H2O;②密封、干燥保存点评:
本题考点: 有关元素化合价的计算;化学性质与物理性质的差别及应用;物质发生化学变化时的能量变化;质量守恒定律及其应用;灭火的原理和方法.
考点点评: 本题主要考查学生从题目中获取信息的能力以及根据获得的信息结合所学化学知识解决问题的能力,题目中用到的化学知识有根据质量守恒定律推断化学式、根据化合物中化合价原则推断某元素的化合价、灭火的原理、物质的保存等,难度不大.1年前查看全部
- (2012•佛山)连二亚硫酸钠(Na2S2O4),也称保险粉,广泛用于纺织工业,属于一级遇湿易燃物品.下列有关连二亚硫酸
(2012•佛山)连二亚硫酸钠(Na2S2O4),也称保险粉,广泛用于纺织工业,属于一级遇湿易燃物品.下列有关连二亚硫酸钠的认识正确的是( )
A.连二亚硫酸钠是一种盐,硫元素化合价为+6价
B.连二亚硫酸钠与水能剧烈反应,化学性质很活泼
C.连二亚硫酸钠称为“保险粉”,化学性质很稳定
D.连二亚硫酸钠是一种毫无用处的有害物质 johnsonkang1年前1
johnsonkang1年前1 -
 上岸鱼 共回答了15个问题
上岸鱼 共回答了15个问题 |采纳率86.7%解题思路:A、根据盐的含义以及化合物中化合价的代数和为0进行解答;
B、根据连二亚硫酸钠与水能剧烈反应其化学性质很活泼进行解答;
C、根据连二亚硫酸钠的化学性质很活泼进行解答;
D、根据连二亚硫酸钠用于纺织工业的漂白剂、脱色剂进行解答.A、连二亚硫酸钠是一种盐,硫元素化合价为+3价,故A错误;
B、连二亚硫酸钠与水能剧烈反应其化学性质很活泼,故B正确;
C、连二亚硫酸钠虽称为“保险粉”,但连二亚硫酸钠的化学性质很活泼,故C错误;
D、连二亚硫酸钠用于纺织工业的漂白剂、脱色剂,而不是毫无用处的有害物质,故D错误.
故选:B.点评:
本题考点: 常见的氧化物、酸、碱和盐的判别;有关元素化合价的计算;化学性质与物理性质的差别及应用.
考点点评: 解答本题的关键是要掌握各种物质的性质,只有掌握了物质的性质才能对物质的性质和储存方法做出正确的判断.1年前查看全部
- (14分)连二亚硫酸钠(Na 2 S 2 O 4 )俗称保险粉,是一种强还原剂,广泛用于纺织工业。
(14分)连二亚硫酸钠(Na 2 S 2 O 4 )俗称保险粉,是一种强还原剂,广泛用于纺织工业。
其制备过程如下:
①把甲酸(HCOOH)和足量的NaOH溶液混合;
②用Na 2 SO 3 固体和某酸反应制备SO 2 气体;
③在一定温度下,将足量的SO 2 气体通入①的溶液中,即有保险粉生成,同时生成一种气体。
(1)写出NaOH的电子式
(2)制备SO 2 时所选用的酸,你认为下列最适宜选用的是
(3)制备保险粉的化学方程式可表示为A.浓盐酸 B.质量分数为70%的H 2 SO 4 C.稀硝酸 D.质量分数为10%的稀硫酸
(4)保险粉可以用于除去废水中的重铬酸根离子(Cr 2 O 7 2- 被转化为Cr 3+ ),这是目前除去酸性废水中铬离子的有效方法之一,则每消耗0.1mol保险粉,理论上可以除去Cr 2 O 7 2- 的物质的量为 mol。
(5)保险粉不稳定,容易分解生成甲、 乙、 丙三种化合物。若将甲、乙两种物质分别配成溶液,在甲溶液中加入稀硫酸,则有淡黄色沉淀和气体丙产生;乙溶液中加入BaCl 2 溶液和稀盐酸,有气体丙产生,但无白色沉淀。在甲溶液中加入稀硫酸后所发生反应的离子方程式为 保险粉分解的化学方程式为
(6)保险粉在空气中容易吸收氧气而发生氧化。其方程式为:
①2Na 2 S 2 O 4 +O 2 +H 2 O=4NaHSO 3 或 ②2Na 2 S 2 O 4 +O 2 +H 2 O=4NaHSO 3 +NaHSO 4
请设计实验证明氧化时发生的是②的反应。 让爱随风colorful1年前1
让爱随风colorful1年前1 -
 蔡斐然 共回答了15个问题
蔡斐然 共回答了15个问题 |采纳率93.3%1年前查看全部
- 保险粉是几类危险品
 kezhen43341年前4
kezhen43341年前4 -
 shannylam 共回答了22个问题
shannylam 共回答了22个问题 |采纳率90.9%属于一级遇湿易燃物品,遇水后发生化学反应,反应剧烈,产生可燃气体硫化氢和二氧化硫,并放出大量的热.1年前查看全部
- (14分)硫代硫酸钠(Na 2 S 2 O 3 )俗称保险粉,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等。实验室可
(14分)硫代硫酸钠(Na 2 S 2 O 3 )俗称保险粉,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等。实验室可通过如下反应制取:2Na 2 S+Na 2 CO 3 +4SO 2 =3Na 2 S 2 O 3 +CO 2 。

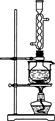
图1图2
(1)用图1所示装置制取Na 2 S 2 O 3 ,其中NaOH溶液的作用是_____________________。
如将分液漏斗中的H 2 SO 4 改成浓盐酸,则三颈烧瓶内除Na 2 S 2 O 3 生成外,还有
(填化学式)杂质生成。
(2)为测定所得保险粉样品中Na 2 S 2 O 3 ·5H 2 O的质量分数,可用标准碘溶液进行滴定,
该反应的化学方程式为:2Na 2 S 2 O 3 +I 2 = 2NaI+Na 2 S 4 O 6
①利用KIO 3 、KI和HCl作原料可配制标准碘溶液。写出配制时所发生反应的离子方程式 。
②准确称取一定质量的Na 2 S 2 O 3 ·5H 2 O样品于锥形瓶中,加水溶解,并滴加______作指示剂,用所配制的标准碘溶液滴定。滴定时所用的玻璃仪器除锥形瓶外,还有 。
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na 2 S 2 O 3 ·5H 2 O的质量分数的测量结果___________(填“偏高”“偏低”或“不变”)。
(3)本实验对Na 2 S的纯度要求较高,利用图2所示的装置可将工业级的Na 2 S提纯。已知Na 2 S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精。
提纯步骤依次为:
①将已称量好的工业级Na 2 S放入圆底烧瓶中,并加入一定质量的酒精和少量水;
②按图2所示装配所需仪器,向冷凝管中通入冷却水,水浴加热;
③待 时,停止加热,将烧瓶取下;
④ __________________________;
⑤ __________________________;
⑥将所得固体洗涤、干燥,即可得到Na 2 S·9H 2 O晶体。 奘淼潇潇1年前1
奘淼潇潇1年前1 -
 云中羽衣孑 共回答了12个问题
云中羽衣孑 共回答了12个问题 |采纳率100%(14分)(1)吸收二氧化硫等尾气,防止污染空气 (2分) NaCl(2分)
(2)①IO 3 - +5I - +6 H + =3I 2 + 3H 2 O(2分)
②淀粉溶液 (2分) 酸式滴定管(2分)
③偏低(1分)
(3)③烧瓶中固体不再减少(1分)
④趁热过滤(1分)
⑤将所得滤液冷却结晶,过滤(1分)
1年前查看全部
- 保险粉和氯水的反映方程式是什么?、急用
 slhz5211年前1
slhz5211年前1 -
 jchun 共回答了17个问题
jchun 共回答了17个问题 |采纳率88.2%Na2S2O4 + 3Cl2 +4H2O =Na2SO4 + 6HCl +H2SO41年前查看全部
- 什么是保险粉?0.4-0.5之间的保险粉有什么作用?
 afrajiang1年前1
afrajiang1年前1 -
 bgbzx 共回答了23个问题
bgbzx 共回答了23个问题 |采纳率95.7%保险粉又名快粉,学名是连二亚硫酸钠.是强还原剂,性质活泼,遇到水能够自燃,属于危险品.非常容易受潮变质.一定要密封保存.
由于保险粉对于衣物县份的损伤对于氧化剂而言要小的很多,所以叫做“保险粉”它可以用于各种纤维的纺织品二不至于造成伤害.但是保险粉对于除了还原染料以外的大多数燃料有破坏作用.所以一般情况下只能用于白色纺织物.
保险粉主要用于剥除衣物上的色迹,亦可以使一些陈旧性的灰黄色衣物的色泽更新.还可以用来中和被次氯酸钠或者高锰酸钾漂黄了的白色织物1年前查看全部
- 什么是保险粉?//帮下忙
 isabella01391年前2
isabella01391年前2 -
 junsen168 共回答了15个问题
junsen168 共回答了15个问题 |采纳率80%连二亚硫酸钠,也称为“保险粉”.它是一种白色砂状结晶或淡黄色粉末化学用品,熔点300℃(分解) ,引燃温度 250 ℃,不溶于乙醇,溶于氢氧化钠溶液,遇水发生强烈反应并燃烧.
保险粉广泛用于纺织工业的还原性染色、还原清洗、印花和脱色及用作丝、毛、尼龙等物织的漂白,由于它不含重金属,经漂白后的织物色泽鲜艳,不易退色.在各种物质方面,保险粉还可用于食品漂白,诸如明胶、蔗糖、蜜等,肥皂、动(植)物油、竹器、瓷土的漂白等.保险粉还可应用于有机合成,如染料、药品的生产里作还原剂或漂白剂,它是最适合木浆造纸的漂白剂.1年前查看全部
- Na2S2O4.2H2O(保险粉)跟NaOH反应的方程式怎么写?11
 浪子在淘沙1年前1
浪子在淘沙1年前1 -
 cecelxq 共回答了15个问题
cecelxq 共回答了15个问题 |采纳率93.3%Na2S2O4.2H2O(保险粉)可以溶于NaOH溶液,并没有提及会反应.
因为Na2S2O4.2H2O(保险粉)还原性极强,不很稳定,在加热灯条件下,会与NaOH反应,发生自身氧化还原,
生成Na2S+ Na2SO3 +H2O1年前查看全部
- "A药品用量为5%"是什么意思该反应是固液反应.书本说道"A药品用量为5%",那究竟指用A药品用量是多少?例如:"保险粉
"A药品用量为5%"是什么意思
该反应是固液反应.书本说道"A药品用量为5%",那究竟指用A药品用量是多少?例如:"保险粉用量2%,草酸用量2%" ed19831年前2
ed19831年前2 -
 莱纳斯有心 共回答了18个问题
莱纳斯有心 共回答了18个问题 |采纳率100%按照这个说法,应该是各种药品的质量之和为总质量,按质量分数计算.
固液反应,体积不好计算,只能是质量分数了~
就像楼上说的一样.
如果是液体和液体反应,那就可能是体积了.1年前查看全部
- 连二亚硫酸钠(保险粉)与碳酸钠反应的产物是什么?方程式是怎样?
连二亚硫酸钠(保险粉)与碳酸钠反应的产物是什么?方程式是怎样?
对了,反应的条件是在水中,在水中时,保险粉分解为硫酸氢钠和亚硫酸氢钠
如果在一密闭的一升的容器中,想将二氧化碳的浓度提高到5%,大概需要两种物质各加多少? w3024669s1年前1
w3024669s1年前1 -
 lldrong 共回答了20个问题
lldrong 共回答了20个问题 |采纳率95%保险粉(连二亚硫酸钠,Na2S2O4)具有还原性,其中S化合价为+3,在水中与O2发生氧化还原反应,生成亚硫酸氢钠(NaHSO3),其中S化合价为+4和硫酸氢钠(NaHSO4),其中S化合价为+6,反应如下:
O2+H2O+Na2S2O4=NaHSO3+NaHSO4
NaHSO3和NaHSO4为酸式盐具有酸性,可与Na2CO3发生如下反应:
NaHSO4+NaHSO3+Na2CO3=Na2SO3+Na2SO4+H2O+CO2
综合上述两个反应如下:
O2+Na2S2O4+Na2CO3=Na2SO3+Na2SO4+CO2
根据以上反应方程式可知:两种反应物与生成CO2的mol比为1:1:1,根据容器体积和CO2的含量可以得到CO2的mol数,也就是应分别加入两种物质的mol数,由此得到两种物质的质量.1年前查看全部
- 硫代硫酸钠(Na 2 S 2 O 3 )俗称保险粉,可用作定影剂,也可用于纸浆漂白、脱氯剂等。
硫代硫酸钠(Na 2 S 2 O 3 )俗称保险粉,可用作定影剂,也可用于纸浆漂白、脱氯剂等。
Na 2 S 2 O 3 易溶于水,不溶于乙醇,常温下溶液中析出晶体通常为Na 2 S 2 O·5H 2 O。实验室制备保险粉的装置如下图所示。涉及的总化学方程式如下: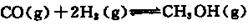

(1)检查虚线框内装置气密性的方法是 。
(2)反应前仪器a中加入的药品为 ,仪器c中加入的药品为 。
(3)仪器b的名称是 。
(4)在制备过程中,持续通人气体时,观察到B装置中先有大量浅黄色沉淀析出,反应一段时间,沉淀逐渐减少;待浅黄色沉淀消失时反应完成,停止加热。反应的离子方程式为 。
(5)反应完成后,为了从混合溶液中获取产品,操作如下:
操作②为 。
(6)为了测产品的纯度,称取8.000 g粗产品,配制成250 mL溶液,用移液管移取25.00 mL于锥形瓶中,再用0.05000 mol·L -l 的碘标准溶液进行滴定(2S 2 O 3 2- +I 2 =S 4 O 6 2- +2I - ),
平行3次实验,平均消耗碘标准溶液的体积为30.00mL。
①测得产品的纯度为 。
②关于上述实验的有关操作,以下表述正确的是 。(填编号)A.用碱式滴定管盛装碘标准溶液 B.用移液管移取25.00mL溶液于锥形瓶中,移液管的尖嘴和锥形瓶内壁要接触 C.如果滴定终点没有控制好,碘标准溶液滴加过量,则必须重新进行滴定 D.滴定过程中若剧烈摇动锥形瓶(溶液不外溅),则所测得的纯度将会偏高  bailinghua1年前1
bailinghua1年前1 -
 新重庆遮阳扇 共回答了20个问题
新重庆遮阳扇 共回答了20个问题 |采纳率95%(1)关闭蒸馏烧瓶右端活塞,往分液漏斗中加水,打开分液漏斗的活塞,水开始下滴,一段时间后,如果水不再下滴,表明气密性良好。反之则气密性不好。
(2)Na 2 SO 3 固体 NaOH溶液(或KMnO 4 溶液等)
(3)三颈烧瓶
(4)S 2 O 3 2- +SO 2 +H 2 O=S↓+2HSO 3 2-
(5)蒸发浓缩、冷却结晶
(6)①93.00% ②B
1年前查看全部
大家在问
- 1基因突变与染色体变异他们的区别只是一个不能在显微镜在观察到而另一个可以吗?不过不是请详解,
- 2直接写出得数(近似值符号的是估算题)
- 3宋代书法家米芾\"芾\"字怎么读
- 4我国南方盛产柑橘,北方盛产苹果,影响其分布最主要的因素是( )
- 5哥哥姐姐们,还有20天中考啦.我们满分70分我只能得40分左右,而我算了一下我模拟考的成绩和重点高中的分数线只有20分左
- 6下面的题对吗?对的打“√”,错的打“×”,并改正过来
- 7狠下决心,改掉以前的毛病(写一个成语)
- 8在方程①4(x-1)(x+2)=3,②x^2+y^2=1,③5x^2-3x=0,④2x^2+x+1=o,⑤1/((x^2
- 9已知二次函数f(x)=ax2+bx+c满足f(0)=-2,且方程f(x)=0的两根为x0和-1,其中x0>2.
- 10下列离子方程式的书写正确的是( )
- 11宾语从句选择题,并且标出"主语''和''从句"
- 12填入横线处的短句,排序正确的一组是 [ ] 在生命的旅程中,能拥有那
- 13光阴的阅读答案谁也无法描绘出他的面目,但世界上能处处听到他的脚步。 当旭日驱散夜的残幕时,当夕阳被朦胧的地平线吞噬时,他
- 14persistence of embryologic remnants是什么意思
- 15between my idcard and the is computer notebook 怎么组成一句话?