硫酸亚铁晶体(FeSO4•7H2O)在医药上作补血剂.某课外研究小组测定该补血剂中铁元素的含量,实验步骤如下:
 冰冻柚子2022-10-04 11:39:541条回答
冰冻柚子2022-10-04 11:39:541条回答
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加______,该过程的现象为:______.
(2)步骤②加入过量H2O2的目的:______.
(3)步骤③中反应的离子方程式:______.
(4)步骤④中一系列处理的操作步骤:过滤、______、灼烧、______、称量.
(5)若实验无损耗,则每片补血剂含铁元素的质量______g.
(6)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定.(5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管外,还需______.
②上述实验中的KMnO4溶液需要酸化,用于酸化的酸是______.
a.稀硝酸b.稀硫酸c.稀盐酸d.浓硝酸
③滴定到终点时的颜色为______色.

已提交,审核后显示!提交回复
共1条回复
 红蓝蜡笔 共回答了16个问题
红蓝蜡笔 共回答了16个问题 |采纳率87.5%- 解题思路:(1)Fe3+遇KSCN溶液显红色,该现象用于检验Fe3+存在,可以加入氧化剂将Fe2+氧化为Fe3+.检验Fe2+可以先滴加KSCN溶液,溶液不变色,再滴加氯水或双氧水,溶液变为血红色,说明含有Fe2+;
(2)由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量.步骤②加入过量H2O2的是将Fe2+氧化为Fe3+;
(3)步骤③是将Fe3+转化为氢氧化铁沉淀,试剂X可以是氢氧化钠或氨水等;
(4)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量;
(5)根据氧化铁的质量计算铁元素的质量.注意ag氧化铁含有的铁元素质量为10片含有的铁元素质量;
(6)①精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管,250mL容量瓶;
②KMnO4溶液需要酸化,用于酸化的酸不能具有强氧化性氧化Fe2+,不能具有强还原性被高锰酸钾氧化,否则会影响高锰酸钾溶液的体积;
③高锰酸钾为紫色,当滴定到终点时,Fe2+被完全氧化,加入的最后一滴高锰酸钾不反应,溶液的颜色为紫色.(1)Fe3+遇KSCN溶液显红色,该现象用于检验Fe3+存在,可以加入氧化剂将Fe2+氧化为Fe3+.检验Fe2+可以先滴加KSCN溶液,溶液不变色,再滴加氯水或双氧水,溶液变为血红色,说明含有Fe2+,故答案为:氯水或双氧水;溶液由浅绿色变成血红色;
(2)由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量.步骤②加入过量H2O2的是将Fe2+氧化为Fe3+,故答案为:将Fe2+全部氧化成Fe3+;
(3)步骤③是将Fe3+转化为氢氧化铁沉淀,试剂X可以是氢氧化钠或氨水等,反应离子方程式为Fe3++3OH-=Fe(OH)3↓(或Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+ ),
故答案为:Fe3++3OH-=Fe(OH)3↓(或Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+ );
(4)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量,
故答案为:洗涤;冷却;
(5)最后氧化铁为ag,氧化铁含有铁元素的质量为[112/160]×ag=0.7ag,故每片补血剂含铁元素的质量为[0.7ag/10]=0.07ag,故答案为:0.07a;
(6)①精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管,250mL容量瓶,故答案为:250mL容量瓶;
②稀硝酸、浓硝酸具有强氧化性,含有氧化Fe2+,高锰酸钾可以氧化HCl为氯气,故选硫酸酸化,故选:b;
③高锰酸钾为紫色,当滴定到终点时,Fe2+被完全氧化,加入的最后一滴高锰酸钾不反应,溶液的颜色为紫色,故答案为:紫.点评:
本题考点: 探究物质的组成或测量物质的含量;二价Fe离子和三价Fe离子的检验.
考点点评: 本题考查学生对实验原理与实验操作的理解、物质分离提纯、元素化合物性质、化学计算等、氧化还原滴定应用,难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力. - 1年前
相关推荐
- 某科学兴趣小组的同学从实验室收集到一桶含有FeSO4,CuSO4的废液,他们想从中回收金属铜和硫酸亚铁晶体
某科学兴趣小组的同学从实验室收集到一桶含有FeSO4,CuSO4的废液,他们想从中回收金属铜和硫酸亚铁晶体
设计了如下的实验方案,结合实验方案回答下列问题:(注:操作a,b皆为过滤,最后的晶体为硫酸亚铁晶体)
(1)选择金属X的关键?(应根据怎样的线索选择) 西西Triang1年前1
西西Triang1年前1 -
 nesowei 共回答了17个问题
nesowei 共回答了17个问题 |采纳率94.1%因为在第一步后得到的是金属混合物,而我们要求是得到铜,所以很明显的能判断出第一步中过量X就是一种比铜活泼的金属单质.因为最后要得到硫酸亚铁,所以滤液一中肯定是硫酸亚铁溶液,所以X是铁,第二题中,在滤液一和二中有硫酸亚铁和硫酸,硫酸亚铁是固体,硫酸是液体,固体物质形成溶液后要结晶,一般的方法就是蒸发溶剂就能得到,当有大量固体析出时,过滤就行了,1年前查看全部
- 硫酸亚铁溶液制硫酸亚铁晶体可以加什么溶液?
 zoe551年前1
zoe551年前1 -
 cfkc5r 共回答了20个问题
cfkc5r 共回答了20个问题 |采纳率95%硫酸亚铁不能直接蒸干结晶,亚铁离子会氧化水解的!
在相对高的温度下溶解硫酸亚铁,人后冷冻结晶,得到硫酸亚铁晶体!1年前查看全部
- 硫酸亚铁晶体(FeSO 4 ·7H 2 O)在医药上作补血剂。为测定补血剂中铁元素的含量,某化学兴趣小组设计了两套实验方
硫酸亚铁晶体(FeSO 4 ·7H 2 O)在医药上作补血剂。为测定补血剂中铁元素的含量,某化学兴趣小组设计了两套实验方案:
方案一:滴定法用酸性KMnO 4 溶液测定铁元素的含量。反应原理:5Fe 2+ +MnO 4 - +8H + =5Fe 3+ +Mn 2+ +4H 2 O
(1)实验前,首先要精确配制一定物质的量浓度的KMnO 4 溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需__________(填仪器名称)。
(2)上述实验中KMnO 4 溶液需要酸化,用于酸化的酸是_________。
A.稀硝酸 B.稀盐酸 C.稀硫酸 D.浓硝酸
(3)某同学没计的下列滴定方式中,最合理的是___________(夹持部分略去)(填字母序号)。
方案二:重量法操作流程如下 
(4)步骤②中除用H 2 O 2 外还可以使用的物质是______________。
(5)步骤②是否可以省略:________,理由是_______________________。
(6)步骤④中一系列操作依次是:过滤、洗涤、___、冷却、称量。
(7)假设实验无损耗,则每片补血剂含铁元素的质量为___g(用含a的代数式表示)。 神代_魅1年前1
神代_魅1年前1 -
 糖果女孩 共回答了29个问题
糖果女孩 共回答了29个问题 |采纳率100%(1)250mL容量瓶
(2)C
(3)B
(4)氯水(或其他合理的氧化剂)
(5)不可以;因为Fe 2+ 与碱反应后在空气中加热不能得到纯净的Fe 2 O 3 ,故无法准确计算Fe的含量
(6)灼烧
(7)0.07a1年前查看全部
- 硫酸亚铁晶体(FeSO4•7H2O)俗称绿矾,加热至高温会分解产生水、金属氧化物和非金属氧化物.某化学兴趣小组的同学对绿
硫酸亚铁晶体(FeSO4•7H2O)俗称绿矾,加热至高温会分解产生水、金属氧化物和非金属氧化物.某化学兴趣小组的同学对绿矾分解产生的非金属氧化物作如下探究:
(1)猜想与假设:
猜想1:非金属氧化物为SO2
猜想2:非金属氧化物SO3
猜想3:非金属氧化物SO2、SO3
(2)设计与实验:
同学们设计了如图所示的实验装置(图中铁架台略去)
按上述装置进行实验,同学们观察到如下现象:装置B中硫酸铜粉末变蓝;绿矾完全分解后装置A中固体呈红棕色,将其放入足量稀盐酸,固体全部溶解,得到黄色溶液;C中溶液褪色.
①由以上实验现象,可否认上述猜想中的______(填数字编号);
②小明同学从理论上分析得出:绿矾分解还生成另一物质SO3.请你说出他这样判断的理论依据是______;
③小明同学打算向装置D中滴入紫色石蕊试液以证明反应产生了SO3,小红认为此法不能达到实验目的,小红这样判断的理由是______;
④小红同学认为,在C、D之间连接图虚线方框内的装置,就可利用小明的方法证明反应产生了SO3.虚线方框内的仪器未画完整,请你帮她画完整并在装置图下的方框中注明药品的名称(气流方向:左→右).
(3)结论与思考:
①利用小红的改进装置进行实验时,当观察到______后(填虚线方框装置中的现象),再在D中加入______(填试剂名称),若产生气泡,也可证明反应产生了SO3;②FeSO4高温加热分解的化学方程式为:2FeSO4
Fe2O3+SO2↑+SO3↑高温 .2FeSO4.
Fe2O3+SO2↑+SO3↑高温 . 10b40111年前1
10b40111年前1 -
 681222 共回答了16个问题
681222 共回答了16个问题 |采纳率68.8%解题思路:(2)①无水硫酸铜白色粉末遇水变蓝,二氧化硫能使高锰酸钾溶液褪色;②运用质量守恒定律,硫酸亚铁晶体加热会失去结晶水,高温会继续分解产生金属氧化物和非金属氧化物,三氧化二铁是红棕色固体,能和稀盐酸反应生成可溶性的黄色物质来解答此题;③SO2溶于水能够生成亚硫酸,亚硫酸可使紫色石蕊变红;④运用SO3能与水反应生成硫酸及硫酸根离子的特性来解答此题;(3)①运用硫酸的特性来解答;②据质量守恒定律,反应物、生成反应条件可写出方程式.(2)①据无水硫酸铜白色粉末遇水变蓝,二氧化硫能使高锰酸钾溶液褪色,可否认猜想中的2;②根据质量守恒定律,化学反应前后元素原子的种类个数不变,因每两个FeSO4分解生成1个Fe2O3后剩余S、O原子个数比为2:5不等...
点评:
本题考点: 实验探究物质的性质或变化规律;常见气体的检验与除杂方法;盐的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 题考查了物质存在和性质的实验探究方法和实验设计判断,氧化还原反应和盐类水解的分析应用是解题关键.1年前查看全部
- (2012•泰安)某兴趣小组的同学从实验室收集到一桶含有FeSO4、CuSO4的废液,他们想从中回收金属铜和硫酸亚铁晶体
(2012•泰安)某兴趣小组的同学从实验室收集到一桶含有FeSO4、CuSO4的废液,他们想从中回收金属铜和硫酸亚铁晶体,设计了如下实验方案.结合实验方案回答下列问题:

(1)步骤①中,金属X是铁(或Fe)铁(或Fe),该反应的化学方程式为Fe+CuSO4=Cu+FeSO4Fe+CuSO4=Cu+FeSO4;
(2)步骤②中,加入过量稀硫酸的目的是除去铜中的铁除去铜中的铁;
(3)从滤液中获得硫酸亚铁晶体采用的方法是蒸发蒸发. 含羞草101年前1
含羞草101年前1 -
 一个人的红尘 共回答了19个问题
一个人的红尘 共回答了19个问题 |采纳率78.9%(1)由题意可知,由于需要将铜离子转化为铜单质,而溶液还必须为硫酸亚铁,即不能引入新的杂质,所以可以加入铁将铜离子转化为铜单质.该反应的化学方程式为:Fe+CuSO4 ═FeSO4 +Cu;
(2)步骤②中,加入过量稀硫酸的目的是 除去铜中的铁;
(3)从滤液中获得硫酸亚铁晶体采用的方法是蒸发.
故答为:(1)铁,Fe+CuSO4 ═FeSO4 +Cu;(2)除去铜中的铁;(3)蒸发.1年前查看全部
- (2012•杭州)某化学兴趣小组通过如下实验由废铁屑制备硫酸亚铁晶体(FeSO4•7H2O):
(2012•杭州)某化学兴趣小组通过如下实验由废铁屑制备硫酸亚铁晶体(FeSO4•7H2O):
①在洗涤过的废铁屑中加入适量稀硫酸,反应结束后过滤.
②将滤液转入到密闭容器中,静置、冷却析出硫酸亚铁晶体.
③待结晶完毕后,滤出晶体,用少量低温的水洗涤晶体3次.
请回答下列问题:
(1)在步骤①过滤时,所需用到的玻璃仪器中,除了漏斗、烧杯外,还需______.
(2)写出步骤①中发生反应的化学反应方程式______.
(3)步骤③中洗涤晶体用的水必须少量且低温,其原因是______.
(4)为了判断步骤③中晶体表面吸附的硫酸是否洗净,有人向第3次洗涤液中滴加硝酸钡溶液和稀硝酸,得到白色沉淀,以此证明该晶体并未洗净.该结论是否可靠?为什么?
______. xiaoxueno11年前1
xiaoxueno11年前1 -
 zct7 共回答了24个问题
zct7 共回答了24个问题 |采纳率91.7%解题思路:(1)根据过滤操作选择仪器;
(2)根据反应物、生成物及质量守恒定律写出化学方程式;
(3)根据硫酸亚铁易溶于水分析;
(4)根据FeSO4•7H2O晶体易溶于水,洗涤液中也有SO42-,都和钡离子产生不溶于稀硝酸的硫酸钡沉淀进行分析;解;(1)过滤所需要的仪器有烧杯、漏斗和玻璃棒,故填:玻璃棒;
(2)铁和硫酸反应生成硫酸亚铁和氢气,反应化学方程式为:Fe+H2SO4=FeSO4+H2↑
(3)因为硫酸亚铁易溶于水,洗涤晶体用的水必须少量且低温是减小其溶解度,故填:FeSO4易溶于水,低温减小FeSO4的溶解度;
(4)因为FeSO4•7H2O晶体易溶于水,洗涤液中也有SO42-,都和钡离子产生不溶于稀硝酸的硫酸钡沉淀,故填:不可靠,因为FeSO4•7H2O晶体易溶于水,洗涤液中也有SO42-,都能和钡离子产生不溶于稀硝酸的白色沉淀;点评:
本题考点: 物质的相互转化和制备;酸、碱、盐的鉴别.
考点点评: 本题是一道实验探究题,能较好的考查学生分析和解决问题的能力,考查了常见金属的性质以及某些盐的性质,解答时要依据题干提供信息,结合相关知识细心分析解答.1年前查看全部
- 实验:将硫酸亚铁晶体(FeSO4•7H2O)加入如图(1)中所示的干燥试管A里,隔绝空气加强热充分反应后,试管A中得残留
实验:将硫酸亚铁晶体(FeSO4•7H2O)加入如图(1)中所示的干燥试管A里,隔绝空气加强热充分反应后,试管A中得残留固体甲,在试管B内得到无色液体乙.取出甲放在图(2)中的石英管C的中部,连接好其他部分的仪器后,开启旋塞K,逐滴滴加乙醇使C管左部石棉绒(一种纤维状硅酸盐材料,很稳定,不燃烧)浸润吸足,关闭K,然后加热,几分钟左右(加热过程中还可以较快地开启、关闭旋塞K来补充乙醇并使之通入石棉绒里),可观察到甲的颜色由红棕色逐渐变为黑色.反应停止后,取试管E中的液体0.5mL逐滴加入到含新配制的银氨溶液的试管F中,振荡后,把试管放在水浴中温热,不久会观看到试管内壁上附着一层光亮如镜的金属银.

回答下列问题:
(1)写出如图(1)所示的干燥试管A中发生反应的化学方程式:2(FeSO4•7H2O)
Fe2O3+SO2↑+SO3+14H2O△ .2(FeSO4•7H2O);
Fe2O3+SO2↑+SO3+14H2O△ .
(2)根据反应原理请你评价图(1)实验装置的主要缺点是:______;
(3)简述如何检验图(2)所示装置气密性:______;
(4)试管C中反应的化学方程式为:3CH3CH2OH+Fe2O3
2Fe+3CH3CHO+3H2O△ 3CH3CH2OH+Fe2O3;
2Fe+3CH3CHO+3H2O△
(5)试管D的作用是:______;
(6)写出F试管中反应的化学方程式:CH3CHO+2Ag(NH3)2OH
CH3COONH4+2Ag↓+3NH3+H2O△ CH3CHO+2Ag(NH3)2OH.
CH3COONH4+2Ag↓+3NH3+H2O△  沐子1年前1
沐子1年前1 -
 欧克 共回答了31个问题
欧克 共回答了31个问题 |采纳率96.8%解题思路:(1)将硫酸亚铁晶体(FeSO4•7H2O)加入如图(1)中所示的干燥试管A里,隔绝空气加强热充分反应后,试管A中得残留固体甲,图2装置中加热,甲的颜色由红棕色逐渐变为黑色,判断甲为Fe2O3;说明硫酸亚铁晶体受热分解是发生了氧化还原反应,硫元素化合价降低,铁元素化合价升高,结合氧化还原反应电子守恒分析生成产物有二氧化硫,结合化学方程式配平写出;
(2)图1装置分解产物中生成了二氧化硫污染气体,但缺少尾气处理装置;
(3)依据装置气密性检查方法进行回答,主要是利用压强关系判断气密性变化;
(4)依据乙醇的催化氧化反应原理推断为氧化铁和乙醇反应生成乙醛;
(5)装置D是安全装置,可以起到防倒吸的作用;
(6)F试管中反应为乙醛被银氨溶液氧化的化学方程式.(1)将硫酸亚铁晶体(FeSO4•7H2O)加入如图(1)中所示的干燥试管A里,隔绝空气加强热充分反应后,试管A中得残留固体甲,图2装置中加热,甲的颜色由红棕色逐渐变为黑色,判断甲为Fe2O3;说明硫酸亚铁晶体受热分解是发生了氧化还原反应,硫元素化合价降低,铁元素化合价升高,结合氧化还原反应电子守恒分析生成产物有二氧化硫,依据原子守恒和电子守恒配平书写出的化学方程式为:2(FeSO4•7H2O)
△
.
Fe2O3+SO2↑+SO3+14H2O,
故答案为:2(FeSO4•7H2O)
△
.
Fe2O3+SO2↑+SO3+14H2O;
(2)硫酸亚铁分解生成的产物含污染性气体二氧化硫,不能排放到大气中,所以装置的缺点为:SO2为大气污染物,缺少尾气处理装置,
故答案为:SO2为大气污染物,缺少尾气处理装置;
(3)装置2是需要乙醇气化和氧化铁反应,生成气体乙醛,收集验证,有气体的装置中 需要检查装置气密性,主要是利用装置中的压强关系分析,检查方法为:关闭活塞K,将E的导气管插入水中,微热C管,E中有气泡产生,停止加热后,E管出现一段水柱,说明装置不漏气,
故答案为:关闭活塞K,将E的导气管插入水中,微热C管,E中有气泡产生,停止加热后,E管出现一段水柱,说明装置不漏气;
(4)试管C中反应是乙醇气化和氧化铁的反应生成铁、乙醛和水,反应的化学方程式为:3CH3CH2OH+Fe2O3
△
2Fe+3CH3CHO+3H2O,故答案为:3CH3CH2OH+Fe2O3
△
2Fe+3CH3CHO+3H2O;
(5)装置D是安全装置,防止液体倒吸,故答案为:防止倒吸;
(6)试管E中的液体0.5mL逐滴加入到含新配制的银氨溶液的试管F中,振荡后,把试管放在水浴中温热,不久会观看到试管内壁上附着一层光亮如镜的金属银.证明生成了乙醛,乙醛和银氨溶液反应出现银镜反应现象,反应的化学方程式为:CH3CHO+2Ag(NH3)2OH
△
CH3COONH4+2Ag↓+3NH3+H2O,
故答案为:CH3CHO+2Ag(NH3)2OH
△
CH3COONH4+2Ag↓+3NH3+H2O.点评:
本题考点: 无机物的推断;探究物质的组成或测量物质的含量.
考点点评: 本题考查了物质转化关系的应用,物质性质的应用,实验装置分析和实验基本操作的应用,主要是硫酸亚铁分解产物的判断,产物的性质验证,产物的催化作用,乙醇的催化氧化反应,乙醛的氧化反应,银镜反应等性质的综合应用,题目难度中等.1年前查看全部
- (14分)某课外学习小组为探究硫酸亚铁晶体(FeSO 4 ·7H 2 O)制备及影响因素,进行如下实验。
(14分)某课外学习小组为探究硫酸亚铁晶体(FeSO 4 ·7H 2 O)制备及影响因素,进行如下实验。
Ⅰ制取硫酸亚铁溶液
称取一定量铁屑,放入烧瓶中,加入25 mL 3 mol·L -1 硫酸,用酒精灯加热。
(1)加热一段时间后,发现烧瓶中溶液变黄并产生能使品红溶液褪色的气体。产生该现象的原因是
(用化学方程式表示)。
(2)制备过程中,铁需过量的原因是 。
Ⅱ实验改进
该小组同学发现以上实验不完善,查阅资料后,对实验做如下
改进:①反应前通入氮气;②水浴加热,控制温度50~60℃;
③实验中适当补充硫酸调节pH=2;④增加尾气吸收装置。改进装置如图(夹持和加热装置略去)。
(3)实验中采用水浴加热,除了便于控制温度外,还有的优点是 。
(4)调节pH=2目的是 。
(5)下列装置适合尾气吸收的是 (填序号)。
Ⅲ 晶体纯度测定
(6)烧瓶中的溶液经处理得硫酸亚铁晶体。准确称取晶体 0.5000 g置于锥形瓶中,加入10 mL 3mol·L - 1 硫酸溶液和15 mL新煮沸过的蒸馏水进行溶解,立即用0.02000mol·L - 1 高锰酸钾标准溶液滴定,消耗标准溶液体积的平均值为16.90 mL。(已知:5Fe 2 + +MnO 4 - +8H + =5Fe 3 + +Mn 2 + +4H 2 O)
①高锰酸钾标准溶液应盛装在 滴定管(填“酸式”或“碱式”)。
②获得硫酸亚铁晶体的纯度为 。 我爱美丽家园1年前1
我爱美丽家园1年前1 -
 zxy850813 共回答了14个问题
zxy850813 共回答了14个问题 |采纳率92.9%(1)2Fe+6H 2 SO 4 (浓) △ Fe 2 (SO 4 ) 3 +3SO 2 ↑+6H 2 O(其他合理答案给分)(3分)
(2)防止Fe 2 + 被氧化(2分) (3)均匀受热(2分) (4)抑制Fe 2 + 的水解(2分)
(5)BC(2分) (6)①酸式(1分) ②93.96%(2分)
1年前查看全部
- 硫酸亚铁晶体 (FeSO4•7H2O)的摩尔质量为______,
硫酸亚铁晶体 (FeSO4•7H2O)的摩尔质量为______,
1mol硫酸亚铁晶体分子中含______mol氧原子、______个铁原子. 东坡肘子西边雨1年前1
东坡肘子西边雨1年前1 -
 何伟ww 共回答了14个问题
何伟ww 共回答了14个问题 |采纳率100%解题思路:摩尔质量以g/mol作单位,数值上等于其相对分子质量或相对原子质量,据此解答.
根据N=nNA,结合分子构成来计算原子个数.FeSO4•7H2O的相对分子质量为:56+32+16×4+7×(2+16)=278,则酸亚铁晶体 (FeSO4•7H2O)的摩尔质量为278g/mol,
n(0)=11n(FeSO4•7H2O)=11×1mol=11mol;
n(Fe)=n(FeSO4•7H2O)=1×1mol=1mol;
N=nNA=1mol×6.02×1023/mol=1.0×1023,
故答案为:278g/mol;11;1.0×1023.点评:
本题考点: 有关化学式的计算和推断.
考点点评: 本题考查了摩尔质量,难度不大,旨在考查学生对基础知识的掌握,加强基础知识的积累.1年前查看全部
- 某贫血患者,经检验共需补充1.4g铁元素,在服用的药物中相当于硫酸亚铁晶体(FeSO 4 •7H 2 O)多少克?
 太白惊心1年前1
太白惊心1年前1 -
 啊-冰-儿 共回答了26个问题
啊-冰-儿 共回答了26个问题 |采纳率96.2%设补充1.4g铁元素相当于药物硫酸亚铁晶体(FeSO 4 •7H 2 O)x克
1.4g=x×
56
56+96+7×18 ×100%
解答 x=6.95g
答:补充1.4g铁元素相当于服用药物硫酸亚铁晶体(FeSO 4 •7H 2 O)6.95 g.1年前查看全部
- (2014•秦淮区二模)医学上经常用硫酸亚铁糖衣片给贫血患者补铁.某兴趣小组的同学对糖衣片中硫酸亚铁晶体(FeSO4•x
(2014•秦淮区二模)医学上经常用硫酸亚铁糖衣片给贫血患者补铁.某兴趣小组的同学对糖衣片中硫酸亚铁晶体(FeSO4•xH2O)的组成进行了探究.
【查阅资料】
(1)白色的无水硫酸铜粉末遇水会变成蓝色的硫酸铜晶体.
(2)硫酸亚铁晶体加热先失去结晶水,高温继续分解产生一种金属氧化物和两种非金属氧化物.
(3)能使高锰酸钾溶液褪色的气体有二氧化硫、乙烯(C2H4)等.
(4)亚铁离子遇具有氧化性的物质易被氧化成铁离子.
【进行实验】
该兴趣小组同学称取ag硫酸亚铁晶体(FeSO4•xH2O)样品按图1装置高温加热,使其完全分解,并对所得产物进行分析,利用SDTQ600热分析仪对硫酸亚铁晶体热分解获得相关数据,绘制成图2所示关系图.
【数据分析】
(1)图1装置B中无水硫酸铜粉末变蓝,质量增加12.6g,说明产物中有(填化学式,下同)______;装置C中高锰酸钾溶液褪色,说明产物中还有______;
(2)T4℃时,硫酸亚铁晶体经完全分解后装置A中固体呈红色,放入足量稀盐酸,固体全部溶解,得到黄色溶液,则装置A中红色固体是______;
(3)兴趣小组的同学从理论上分析硫酸亚铁分解还生成另一物质SO3,写出FeSO4分解的化学方程式2FeSO4
Fe2O3+SO2↑+SO3↑高温 .2FeSO4;
Fe2O3+SO2↑+SO3↑高温 .
(4)请根据上述实验及图2中有关数据计算FeSO4•xH2O中的x.(写出计算过程)2FeSO4•xH2O
Fe2O3+SO2↑+SO3↑+2xH2O高温 .
16036x
8g12.6g
160/36x=8g/12.6g
x=72FeSO4•xH2O
Fe2O3+SO2↑+SO3↑+2xH2O高温 .
16036x
8g12.6g
160/36x=8g/12.6g
x=7
【交流讨论】
(1)反应完全后仍要持续通入氮气,否则测出的x值会(填“偏大”“偏小”或“不变”)______;
(2)硫酸亚铁糖衣片的糖衣除了用于包装药物外,还可能具有的作用是______. 我拿青春献祖oo1年前1
我拿青春献祖oo1年前1 -
 无需多言 共回答了16个问题
无需多言 共回答了16个问题 |采纳率100%解题思路:【数据分析】(1)有无水硫酸铜粉末变蓝,说明产物中有水;二氧化硫能使高锰酸钾溶液褪色;
(2)根据氧化铁的颜色、性质分析回答;
(3)根据反应物、生成物和条件,运用质量守恒定律解答;
(4)根据质量守恒定律和化学式的意义进行计算.
【交流讨论】(1)根据实验中要持续通入氮气的作用,分析x的变化;
(2)根据糖衣片能隔绝氧气分析还具有的作用.【数据分析】
(1)图1装置B中无水硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,生成水的质量是12.6g.二氧化硫能使高锰酸钾溶液褪色,所以根据题意可知,硫酸亚铁晶体分解生成水和二氧化硫;
(2)由题意可知,硫酸亚铁晶体加热会失去结晶水,高温会继续分解产生金属氧化物和非金属氧化物,结合A中固体呈红棕色,放入足量稀盐酸,固体全部溶解,得到黄色溶液的信息,可判断A中红色固体是Fe2O3 .
(3)FeSO4的分解产物是Fe2O3、SO2、SO3,配平即可,故答案为:2FeSO4
△
.
Fe2O3+SO2↑+SO3↑
(4)由题意和图象可知,生成水的质量是12.6g,生成的氧化铁的质量是8g.
通过FeSO4•xH2O的化学式可知铁原子和水的个数比为1:x
2FeSO4•xH2O
高温
.
Fe2O3+SO2↑+SO3↑+2xH2O(方程式或关系式1分)
160 36x
8g 12.6g
[160/8g=
36x
12.6g]
解得:x=7
【交流讨论】(1)反应完全后仍要要持续通入氮气,将生成的水蒸气全部排出,并被B装置吸收,否则测出的x值会偏小.
(2)由于亚铁离子遇具有氧化性的物质易被氧化成铁离子的性质,所以,硫酸亚铁糖衣片的糖衣除了用于包装药物外,还可能具有的作用是 防止亚铁离子被氧化.
故答案为:((10分),化学方程式(2分),计算(3分),其余每空1分)
【数据分析】(1)H2O; SO2(2)Fe2O3
(3)2FeSO4
高温
.
Fe2O3+SO2↑+SO3↑
(4)由题意和图象可知,生成水的质量是12.6g,生成氧化铁的质量是8g.
2FeSO4•xH2O
高温
.
Fe2O3+SO2↑+SO3↑+2xH2O(方程式或关系式1分)
160 36x
8g 12.6g
160/36x=8g/12.6g (过程1分)x=7(结果1分)(其他合理方法均可)
【交流讨论】(1)偏小(2)隔绝空气,防止药品变质(合理答案即可)点评:
本题考点: 实验探究物质的组成成分以及含量;常见气体的检验与除杂方法;盐的化学性质;根据化学反应方程式的计算.
考点点评: 该题考查了学生从资料中获得有效信息的能力、实验分析能力、根据化学式的计算能力等,综合性强考查全面;有关实验方案的设计和对实验方案的评价是中考的热点之一,设计实验方案时,要注意用最少的药品和最简单的方法;本考点主要出现在实验题中.1年前查看全部
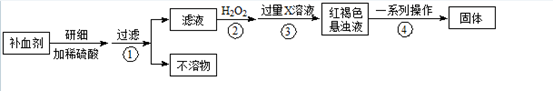
- Ⅰ:硫酸亚铁晶体(FeSO4•7H2O)在医药上作补血剂.为测定补血剂中铁元素的含量,某化学兴趣小组设计了两套实验方案:
Ⅰ:硫酸亚铁晶体(FeSO4•7H2O)在医药上作补血剂.为测定补血剂中铁元素的含量,某化学兴趣小组设计了两套实验方案:
方案一 滴定法 用酸性KMnO4溶液滴定测定铁元素的含量.
反应原理:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O
(1)实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需______(填仪器名称).
(2)上述实验中KMnO4溶液需要酸化,用于酸化的酸是______.
A.稀硫酸 B.浓硝酸 C.稀硝酸 D.稀盐酸
(3)某同学设计的下列滴定方式中,最合理的是______(夹持部分略去)(填字母序号).
方案二 重量法 操作流程如下:
(4)步骤②是否可以省略,其理由是______.
(5)步骤④中一系列操作依次是:过滤、洗涤、______、冷却、称量. xyhe_19821年前1
xyhe_19821年前1 -
 deryuy 共回答了18个问题
deryuy 共回答了18个问题 |采纳率88.9%解题思路:(1)精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器有天平、药匙、玻棒、烧杯、胶头滴管、250mL容量瓶;
(2)酸化KMnO4溶液的酸本身不能具有还原性,如果有还原要被高锰酸钾氧化,本身也不能具有强氧化性,所以只能选硫酸;
(3)酸性溶液或强氧化性溶液应用酸式滴定管;
(4)Fe2+与碱反应后不能保证Fe2+全部转化为Fe3+,加热不能得到纯净的Fe2O3,故无法准确计算Fe的含量;
(5)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量;(1)精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器有天平、药匙、玻棒、烧杯、胶头滴管、250mL容量瓶;
故答案为:250mL容量瓶;
(2)酸化KMnO4溶液的酸本身不能具有还原性,如果有还原性要被高锰酸钾氧化,本身也不能具有强氧化性,所以只能选硫酸,故答案为:A;
(3)酸性溶液或强氧化性溶液应用酸式滴定管,故答案为:B;
(4)Fe2+与碱反应后不能保证Fe2+全部转化为Fe3+,加热不能得到纯净的Fe2O3,故无法准确计算Fe的含量,故步骤②不能省略;
故答案为:不能,Fe2+与碱反应后不能保证Fe2+全部转化为Fe3+,加热不能得到纯净的Fe2O3,故无法准确计算Fe的含量;
(5)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量;
故答案为:灼烧.点评:
本题考点: 探究物质的组成或测量物质的含量.
考点点评: 本题考查学生对实验原理与实验操作的理解、物质分离提纯、元素化合物性质、氧化还原反应滴定、化学计算等,难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.1年前查看全部
- 硫酸亚铁晶体(FeSO 4 ·7H 2 O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下 请回答
硫酸亚铁晶体(FeSO 4 ·7H 2 O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下 
请回答下列问题:
(1)证明步骤①滤液中含有Fe 2+ 的方法是先滴加KSCN溶液,再滴加__________,该过程的现象为:
____________________
(2)步骤②加入过量H 2 O 2 的目的:__________________________。
(3)步骤③中反应的离子方程式:____________________。
(4)步骤④中一系列处理的操作步骤:过滤、__________、灼烧、__________、称量。
(5)若实验无损耗,则每片补血剂含铁元素的质量__________g。
(6)该小组有些同学认为用KMnO 4 溶液滴定也能进行铁元素含量的测定。
(5Fe 2+ +MnO 4 - +8H + →5Fe 3+ +Mn 2+ +4H 2 O)
①实验前,首先要精确配制一定物质的量浓度的KMnO 4 溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管外,还需____________________
②上述实验中的KMnO 4 溶液需要酸化,用于酸化的酸是____________________。
a.稀硝酸 b.稀硫酸 c.稀盐酸 d.浓硝酸
③滴定到终点时的颜色为__________色。
(7)正常人每天应补充14mg左右的铁,如果全部通过服用含FeSO 4 ·7H 2 O的片剂来补充铁,则正常人每天服需用含__________mgFeSO 4 ·7H 2 O的片剂。 takeru_71年前1
takeru_71年前1 -
 米澈_贵族血统 共回答了18个问题
米澈_贵族血统 共回答了18个问题 |采纳率88.9%(1)氯水(或双氧水、稀硝酸等合理氧化剂);现象:溶液由浅绿色变为血红色
(2)将Fe 2+ 全部氧化为Fe 3+
(3)Fe 3+ +3OH - ==Fe(OH) 3 ↓(或Fe 3+ +3NH 3 ·H 2 O==Fe(OH) 3 ↓+3NH 4 + )
(4)洗涤;冷却
(5)0.07a
(6)①250mL容量瓶;②b;③紫(或紫红)
(7)69.5mg1年前查看全部
- 在实验室中硫酸亚铁晶体溶于水后,滴入硫酸氢钾溶液为甚么显红色
 shuishui3041年前1
shuishui3041年前1 -
 玻璃杯2003 共回答了22个问题
玻璃杯2003 共回答了22个问题 |采纳率81.8%滴入硫酸氢钾溶液后,溶液变为在碱性环境,在碱性条件下二价的亚铁离子被氧化为三价的铁离子,因而显示出红色,不过这个变色要经过一个过程的,在实验中应注意观察.1年前查看全部
- 硫酸亚铁晶体隔空气加强热有哪些气体(除水蒸气外)
 突破不分球1年前1
突破不分球1年前1 -
 lake3177 共回答了15个问题
lake3177 共回答了15个问题 |采纳率93.3%SO2 SO3
方程式
2FeSO4·7H2O=(强热) Fe2O3 + SO2 + SO3 + 14H2O1年前查看全部
- 硫酸亚铁晶体受热分解的化学方程式
 天空里的云彩1年前2
天空里的云彩1年前2 -
 A阿拉蕾 共回答了15个问题
A阿拉蕾 共回答了15个问题 |采纳率73.3%2FeSO4====Fe2O3+SO2+SO3(后面两个生成物是气体)
加热1年前查看全部
- (2011•延庆县一模)硫酸亚铁晶体(FeSO4•7H2O)在医药上作补血剂.某课外小组测定该补血剂中铁元素的含量.实验
(2011•延庆县一模)硫酸亚铁晶体(FeSO4•7H2O)在医药上作补血剂.某课外小组测定该补血剂中铁元素的含量.实验步骤如下:

请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是______.
(2)写出②中的离子反应方程式:______.
(3)步骤③中反应的离子方程式:______.
(4)步骤④中一系列处理的操作步骤:过滤、______、灼烧、冷却、称量.
(5)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定.(5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除药匙、天平(附砝码)、玻棒、烧杯、胶头滴管外,还需______.
②滴定到终点时的颜色为______色.
(6)正常人每天应补充16.8mg左右的铁.其中绝大部分来自于食物.如果全部通过服用含FeSO4•7H2O的片剂.来补充铁,则正常人每天服需用含______mgFeSO4•7H2O片剂. zjc12151年前1
zjc12151年前1 -
 NothingisImpress 共回答了19个问题
NothingisImpress 共回答了19个问题 |采纳率84.2%解题思路:由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量.
(1)Fe3+遇KSCN溶液显红色,该现象用于检验Fe3+存在,可以加入氧化剂将Fe2+氧化为Fe3+.检验Fe2+可以先滴加KSCN溶液,溶液不变色,再滴加氯水或双氧水,溶液变为血红色,说明含有Fe2+;
(2)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,同时生成水.
(3)步骤③是将Fe3+转化为氢氧化铁沉淀.
(4)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量;
(5)①精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管,250mL容量瓶;
②高锰酸钾为紫色,当滴定到终点时,Fe2+被完全氧化,加入的最后一滴高锰酸钾不反应,溶液的颜色为紫色.
(6)根据铁元素守恒可知16.8mg铁即为FeSO4•7H2O片剂中铁的质量,根据化学式中铁元素质量分数的计算来求算FeSO4•7H2O的片剂的质量.(1)Fe3+遇KSCN溶液显红色,该现象用于检验Fe3+存在,可以加入氧化剂将Fe2+氧化为Fe3+,检验Fe2+可以先滴加KSCN溶液,溶液不变色,再滴加氯水或双氧水,溶液变为血红色,说明含有Fe2+.
故答案为:取少量滤液加入试管中,先滴加KSCN溶液,溶液不变色,再滴加氯水(或双氧水、稀硝酸),溶液变为血红色.
(2)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,同时生成水,反应离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O.
故答案为:2Fe2++H2O2+2H+═2Fe3++2H2O.
(3)步骤③是将Fe3+转化为氢氧化铁沉淀,反应离子方程式为Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+.
故答案为:Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+.
(4)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量,
故答案为:洗涤;冷却;
(5)①精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管,250mL容量瓶;
故答案为:250mL容量瓶;
②高锰酸钾为紫色,当滴定到终点时,Fe2+被完全氧化,加入的最后一滴高锰酸钾不反应,溶液的颜色为紫色,故答案为:紫.
(6)16.8mg铁即为FeSO4•7H2O片剂中铁的质量,所以需要FeSO4•7H2O片剂质量为16.8mg÷[56/278]=83.4mg.
故答案为:83.4mg.点评:
本题考点: 探究物质的组成或测量物质的含量;二价Fe离子和三价Fe离子的检验.
考点点评: 本题考查学生对实验原理与实验操作的理解、物质分离提纯、元素化合物性质、氧化还原滴定应用、化学计算等,难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.1年前查看全部
- 某校化学实验室废液缸中收集他溶解大量右eS24、CuS243废水,设计除去铜离子,回收硫酸亚铁晶体和铜3实验方案,讨论有
某校化学实验室废液缸中收集他溶解大量右eS24、CuS243废水,设计除去铜离子,回收硫酸亚铁晶体和铜3实验方案,讨论有关问题:

(他)废水在加入金属X前需进行过滤,目3是将其中______性杂质除去.进行过滤操作所需3玻璃仪器有:______、______.(填写两种仪器名称)
(五)金属X是______,其加入废水后发生反应3化学方程式为______;溶液Y是______,利用其除去铜中杂质,有关反应3化学方程式为______.
(3)从滤液中获取硫酸亚铁晶体3操作方法是______. Femenome1年前1
Femenome1年前1 -
 rainbow急速 共回答了15个问题
rainbow急速 共回答了15个问题 |采纳率93.3%解题思路:(1)根据过滤的原理及操作过程分析解答;
(2)根据实验方案可知,由于目的是获得铜单质和硫酸亚铁,所以需要将铜离子转化为铜单质,而溶液中需要的是硫酸亚铁而不能引入新的杂质,所以加入的能够将铜离子转化为铜单质的只能是单质铁;由于加入的铁是过量的,加入过量稀硫酸的目的是除去铜中的铁;
(3)从溶液中获取晶体一般都是通过结晶的方法来获取,可以据此解答.(1)过滤是将不溶性固体从溶液3分离出来的操作,组装过滤器需要的仪器有:铁架台、漏斗、烧杯和玻璃棒,其3玻璃仪器有:烧杯、漏斗、玻璃棒;
(大)为回收废液3的Cu大+需加入铜前面的金属进行置换,但要五到较为纯净FesO4的溶液,只能向废液3加入过量的铁粉与硫酸铜发生置换反应,生成物3只有硫酸亚铁,加入其它金属溶液3又混有其它溶质.所以金属X是铁粉,反应的方程式是:Fe+CusO4=FesO4+Cu;铜排在氢后面,不与酸反应,而铁排在氢前面,与酸反应,因此为除去混在铜粉里的铁粉并且五到FesO4溶液,把金属混合物放入足量的稀硫酸并过滤即可,所以,溶液1是稀硫酸,反应的方程式是:Fe+H大sO4=FesO4+H大↑;
(3)要从滤液3获取硫酸亚铁晶体,需要采取蒸发结晶或降温结晶,使硫酸亚铁从溶液3结晶析出.
故答案为:(1)不溶性杂质,烧杯、玻璃棒;(大)铁,Fe+CusO4=FesO4+Cu;稀硫酸,Fe+H大sO4=FesO4+H大↑;(3)结晶.点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 金属活动顺序表是解决与金属相关变化的重要工具,表中H元素为标志性参考元素,H之前为活泼金属,H之后金属性质不活泼.1年前查看全部
- 硫酸亚铁溶液怎么变成硫酸亚铁晶体
硫酸亚铁溶液怎么变成硫酸亚铁晶体
和一个溶液反应的 zfymhx1年前1
zfymhx1年前1 -
 我是hh人我怕谁 共回答了11个问题
我是hh人我怕谁 共回答了11个问题 |采纳率90.9%加热蒸走溶剂结晶1年前查看全部
- FeSO4·7H2O是硫酸亚铁晶体,请问它的相对分子质量如何计算?
FeSO4·7H2O是硫酸亚铁晶体,请问它的相对分子质量如何计算?
如题 懒懒HE1年前2
懒懒HE1年前2 -
 niq123 共回答了17个问题
niq123 共回答了17个问题 |采纳率94.1%56+32+16*4+7*(2+16)=278
因为是晶体,所以是要算上结晶水的.1年前查看全部
- (2004•昆明)从含有大量硫酸亚铁、少量硫酸铜以及不溶性杂质的工业废水中回收金属铜并获得硫酸亚铁晶体,操作步骤和目的如
(2004•昆明)从含有大量硫酸亚铁、少量硫酸铜以及不溶性杂质的工业废水中回收金属铜并获得硫酸亚铁晶体,操作步骤和目的如下表,请填出表中未完成部分.
操作步骤 目的 (1)将废水过滤
(2)向滤液中加入过量铁粉
(3)______
(4)在过滤后的固体混合物中加入过量稀硫酸
(5)将反应后的混合物过滤
(6)______(1)______
(2)______
(3)将Cu和过量的铁粉与FeSO4溶液分离
(4)______
(5)______
(6)得到硫酸亚铁晶体 bhtdw1年前1
bhtdw1年前1 -
 一见倾心误终身 共回答了17个问题
一见倾心误终身 共回答了17个问题 |采纳率88.2%解题思路:由于得到的是铜和硫酸亚铁,所以用铁进行置换反应即可,不溶性杂质用过滤的方法除去.(1)将废水过滤,就可以把不溶于液体的固体与液体分离,即出去了不溶性杂质;
(2)加入过量铁粉,铁与硫酸铜反应得到铜和硫酸亚铁,所以出去了硫酸铜;
(3)铜和过量铁粉都不溶于水而硫酸亚铁溶于水,所以过滤即可分离;
(4)过滤后的固体是铁和铜,加入过量硫酸是利用铁可以与硫酸反应的性质,把铁除去;
(5)将反应后的混合物过滤就可把固体除去从而得到硫酸亚铁溶液;
(6)将硫酸亚铁溶液中分离出硫酸亚铁,主要是利用蒸发结晶,把液体除去即可.
故答案为:
操作步骤 目 的
(1)
(2)
(3)过滤
(4)
(5)
(6)将滤液蒸发结晶 (1)除去不溶性杂质
(2)除去少量硫酸铜
(3)
(4)除去过量的铁
(5)得到硫酸亚铁溶液
(6)点评:
本题考点: 混合物的分离方法;金属的化学性质.
考点点评: 不溶于液体的固体与液体分离的方法是过滤,从溶液中得到一种金属时,加入排在该金属前面的金属利用置换反应就行.1年前查看全部
- 用硫酸亚铁晶体配制硫酸亚铁溶液时,硫酸亚铁水解有什么影响
 75058201年前2
75058201年前2 -
 大树下的蚂蚁 共回答了20个问题
大树下的蚂蚁 共回答了20个问题 |采纳率85%无空气存在时,硫酸亚铁水解生成难溶的氢氧化亚铁,所得溶液浓度偏小
当有空气存在的情况下,硫酸亚铁水解生成难溶的氢氧化亚铁Fe(OH)2,这是一个可逆反应,反应产物Fe(OH)2又会被迅速氧化成Fe(OH)3而消耗,所以不断拉动反应向正方向进行,也就是说会看到褐色沉淀不断生成,而配置的溶液浓度也在不断下降1年前查看全部
- 研究性学习小组对某硫酸亚铁晶体(FeSO 4 •xH 2 O)热分解研究,该小组同学称取ag硫酸亚铁晶体样品按图1高温加
研究性学习小组对某硫酸亚铁晶体(FeSO 4 •xH 2 O)热分解研究,该小组同学称取ag硫酸亚铁晶体样品按图1高温加热,使其完全分解,对所得产物进行探究,并通过称量装置B质量测出x的值。

(1)装置B中硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中还有 。
(2)实验中要持续通入氮气,否则测出的x会 (填“偏大”、“偏小”或“不变”)。
(3)硫酸亚铁晶体完全分解后装置A中还残留红棕色固体Fe 2 O 3 。
(4)从理论上分析得出硫酸亚铁分解还生成另一物质SO 3 ,写出FeSO 4 分解的化学方程式 。
(5)装置D球形干燥管的作用 。
(6)某研究所利用SDTQ600热分析仪对硫酸亚铁晶体(FeSO 4 •xH 2 O)进行热分解,获得相关数据,绘制成固体质量——分解温度的关系图如图2,根据图2中有关数据,可计算出FeSO 4 •xH 2 O中的x= 。 lilykon1年前1
lilykon1年前1 -
 兴趣之人 共回答了15个问题
兴趣之人 共回答了15个问题 |采纳率93.3%1年前查看全部
- 硫酸亚铁晶体(FeSO4•7H2O)在医药上作补血剂.某课外小组测定该补血剂中铁元素的含量.实验步骤如下:
硫酸亚铁晶体(FeSO4•7H2O)在医药上作补血剂.某课外小组测定该补血剂中铁元素的含量.实验步骤如下:

请回答下列问题:
(1)步骤②加入过量H2O2的目的:______
(2)步骤③中反应的离子方程式:______
(3)步骤④中一系列处理的操作步骤:过滤、______、灼烧、______、称量.
(4)若实验无损耗,则每片补血剂含铁元素的质量______g(用含a的代数式表示).
(5)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定.(5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需______.
②上述实验中的KMnO4溶液需要酸化,用于酸化的酸是______.
a.稀硝酸b.稀硫酸c.稀盐酸d.浓硝酸
③某同学设计的下列滴定方式中,最合理的是______. (夹持部分略去)(填字母序号)
(6)正常人每天应补充14mg左右的铁.其中绝大部分来自于食物.如果全部通过服用含FeSO4•7H2O的片剂来补充铁,则正常人每天服需用含______mgFeSO4•7H2O的片剂. fristsl1年前1
fristsl1年前1 -
 glamorlady 共回答了21个问题
glamorlady 共回答了21个问题 |采纳率90.5%解题思路:(1)双氧水具有氧化性,还原产物是水;
(2)三价铁和碱反应生成氢氧化铁沉淀;
(3)氢氧化铁不稳定受热易分解,从悬浊液中的沉淀到分解产物要经过的途径过滤、洗涤、灼烧、冷却、称量;
(4)根据铁元素守恒类解答;
(5)①根据配制一定物质的量浓度的溶液所需要的仪器来回答;
②硝酸、高锰酸钾有强氧化性、盐酸具有还原性;
③高锰酸钾具有强氧化性,能腐蚀碱式滴定管的橡皮管,应用酸式滴定管盛装,滴定时为便于观察颜色变化,滴定终点颜色由浅变深易于观察;
(6)根据铁元素守恒来计算.(1)双氧水具有氧化性,能将Fe2+全部氧化为Fe3+,故答案为:将Fe2+全部氧化为Fe3+;
(2)三价铁和碱反应生成氢氧化铁红褐色沉淀,所以加入的X为碱,故答案为:Fe3++3OH-=Fe(OH)3↓(或Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+);
(3)从悬浊液中将沉淀物分离出来要先过滤,然后对固体洗涤,至洗涤干净后再灼烧分解,待冷却后称量,故答案为:过滤;冷却;
(4)最终固体为Fe2O3,铁元素的质量百分数为[56×2/56×2+16×3]×100%=70%,所以ag固体中铁元素0.7ag,所以10片补血剂含铁元素的质量0.7ag,则每片补血剂含铁元素的质量0.07ag,故答案为:0.07a;
(5)①根据配制一定物质的量浓度的溶液所需要的仪器有:250mL容量瓶、天平、玻棒、烧杯、量筒、药匙、胶头滴管,故答案为:250mL容量瓶;
②高锰酸钾有强氧化性,能将盐酸氧化,硝酸具有氧化性,能亚铁离子氧化,故只能用稀硫酸酸化,故答案为:b;
③高锰酸钾具有强氧化性,能腐蚀碱式滴定管的橡皮管,应用酸式滴定管盛装,滴定时为便于观察颜色变化,滴定终点颜色由浅变深易于观察,应将高锰酸钾滴到待测液中,
故答案为:b;
(6)根据铁元素守恒,14mg的铁即为FeSO4•7H2O片剂中铁的质量,所以需要FeSO4•7H2O片剂质量=14mg÷[56 /278]=69.5mg,故答案为:69.5mg.点评:
本题考点: 铁盐和亚铁盐的相互转变;探究物质的组成或测量物质的含量.
考点点评: 本题是一道考查金属铁的化合物性质的综合性知识题目,要求学生具有分析和解决问题的能力.1年前查看全部
- 40度时,100克水溶解110.3克7水合硫酸亚铁晶体得到饱和溶液.40度时,硫酸亚铁溶解度时几克
40度时,100克水溶解110.3克7水合硫酸亚铁晶体得到饱和溶液.40度时,硫酸亚铁溶解度时几克
请仔细给讲一下,并且用的哪个公式. 木吒1年前1
木吒1年前1 -
 错乱的全部 共回答了15个问题
错乱的全部 共回答了15个问题 |采纳率93.3%110.3gFeSO4·7H20中,含有110.3*(7*18/278)=50.0g水,60.3gFeSO4
设溶解度为X,则有
x/100=60.3/(100+50.0)
x=40.2g
在相同条件下比值是相同的1年前查看全部
- (2011•东城区模拟)硫酸亚铁晶体(FeSO4•7H2O)在医药上作补血剂.某课外小组测定该补血剂中铁元素的含量.实验
(2011•东城区模拟)硫酸亚铁晶体(FeSO4•7H2O)在医药上作补血剂.某课外小组测定该补血剂中铁元素的含量.实验步骤如下:

请回答下列问题:
(1)步骤②加入过量H2O2的目的:______
(2)步骤③中反应的离子方程式:______
(3)步骤④中一系列处理的操作步骤:过滤、______、灼烧、______、称量.
(4)若实验无损耗,则每片补血剂含铁元素的质量______ g(用含a的代数式表示,不用化简).
(5)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定.(5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需______.
②上述实验中的KMnO4溶液需要酸化,用于酸化的酸是______.
a.稀硝酸b.稀硫酸c.稀盐酸d.浓硝酸. 湮没的传奇1年前1
湮没的传奇1年前1 -
 hsiasin 共回答了24个问题
hsiasin 共回答了24个问题 |采纳率83.3%解题思路:由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量.
(1)双氧水具有强氧化性,由流程图可知,加入双氧水目的是将Fe2+全部氧化为Fe3+;
(2)由流程图可知,步骤③是将Fe3+转化为氢氧化铁沉淀,加入的X可以是碱或氨水;
(3)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量;
(4)根据铁元素守恒可知ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,据此计算.
(5)①精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器有天平、药匙、玻棒、烧杯、胶头滴管、250mL容量瓶;
②加入的酸不能具有强氧化性,不能被酸性高锰酸钾氧化,防止影响酸性高锰酸钾溶液的体积,影响测定结果.由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量.
(1)双氧水具有强氧化性,由流程图可知,加入双氧水目的是将Fe2+全部氧化为Fe3+,
故答案为:将Fe2+全部氧化为Fe3+;
(2)由流程图可知,步骤③是将Fe3+转化为氢氧化铁沉淀,加入的X可以是氢氧化钠溶液或氨水,反应方程式为Fe3++3OH-=Fe(OH)3↓[或Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+],
故答案为:Fe3++3OH-=Fe(OH)3↓[或Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+];
(3)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量,
故答案为:洗涤;冷却;
(4)ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,所以每片补血剂含铁元素的质量
ag×
112
160
10=0.07ag,故答案为:0.07a;
(5)①精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器有天平、药匙、玻棒、烧杯、胶头滴管、250mL容量瓶,故答案为:250mL容量瓶;
②高锰酸钾有强氧化性,能将盐酸氧化,硝酸具有氧化性,能亚铁离子氧化,故只能用稀硫酸酸化,答案为:b.点评:
本题考点: 探究物质的组成或测量物质的含量;铁的氧化物和氢氧化物.
考点点评: 本题考查学生对实验原理与实验操作的理解、物质分离提纯、元素化合物性质、氧化还原反应滴定、化学计算等,难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.1年前查看全部
- 向40g氧化铁粉末中通入一氧化碳使其充分反应,用制得的铁与硫酸反应制取硫酸亚铁晶体.(1)要使氧化铁完全被还原,需要一氧
向40g氧化铁粉末中通入一氧化碳使其充分反应,用制得的铁与硫酸反应制取硫酸亚铁晶体.(1)要使氧化铁完全被还原,需要一氧化碳的质量是?(2)通过计算求理论上可制得的硫酸亚铁晶体的质量.
 超级数控机床1年前3
超级数控机床1年前3 -
 江湖客0142 共回答了16个问题
江湖客0142 共回答了16个问题 |采纳率68.8%3CO+ Fe2O3 =高温= 2Fe + 3CO2
84 160 112
x 40g y
84/x=160/40g=112/y
x=21g
y=28g
Fe + H2SO4 === FeSO4 + H2↑
Fe----------FeSO4*7H2O
56 278
28g z
56/28g=278/z
z=139g
(1)要使氧化铁完全被还原,需要一氧化碳的质量是21g
(2)理论上可制得的硫酸亚铁晶体的质量 139g1年前查看全部
- 某兴趣小组的同学从实验室收集到一桶含有FeSO 4 、CuSO 4 的废液,他们想从中回收金属铜和硫酸亚铁晶体,设计了如
某兴趣小组的同学从实验室收集到一桶含有FeSO 4 、CuSO 4 的废液,他们想从中回收金属铜和硫酸亚铁晶体,设计了如下实验方案.结合实验方案回答下列问题: 
(1)步骤①中,金属X是 _____ ,该反应的化学方程式为 ________________ ;
(2)步骤②中,加入过量稀硫酸的目的是 _______________ ;
(3)从滤液中获得硫酸亚铁晶体采用的方法是 _______ . hkx19831年前1
hkx19831年前1 -
 szseesea 共回答了24个问题
szseesea 共回答了24个问题 |采纳率91.7%(1)铁;Fe+CuSO 4 ==FeSO 4 +Cu;
(2)除去铜中的铁;
(3)蒸发.1年前查看全部
- 硫酸亚铁晶体(FeSO4•7H2O)在医药上常用作补血剂.某课外小组欲测定该补血剂中铁元素的含量.实验步骤如图1所示:
硫酸亚铁晶体(FeSO4•7H2O)在医药上常用作补血剂.某课外小组欲测定该补血剂中铁元素的含量.实验步骤如图1所示:

请回答下列问题:
(1)步骤②加入过量H2O2的目的是______;步骤③中的过量的X也可以改通入足量的NH3,反应的离子方程式:______.如图2所示有关NH3的实验室制取等问题描述正确的是______.(填选项)
(2)步骤④中一系列处理的操作步骤:过滤、______、灼烧、______、称量.若实验无损耗,则每片补血剂含铁元素的质量[112a/1600][112a/1600]g(用含a的代数式表示,不用化简).
(3)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定(5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O).实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需______.上述实验中的KMnO4溶液需要酸化,用于酸化的酸是______.
a.稀硝酸b.稀硫酸c.稀盐酸d.浓硝酸. zys0191年前1
zys0191年前1 -
 kanglongyouhui 共回答了21个问题
kanglongyouhui 共回答了21个问题 |采纳率81%解题思路:由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量.
(1)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,氨水和铁离子反应生成氢氧化铁红褐色沉淀;实验室用氯化铵和氢氧化钙制取氨气,用向下排空气法收集氨气,用湿润的红色石蕊试纸检验氨气,氨气有刺激性气味,所以最后要有尾气处理装置;
(2)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量;根据原子守恒计算铁的质量;
(3)精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管,250mL容量瓶;
加入的酸不能具有强氧化性,不能被酸性高锰酸钾氧化,防止影响酸性高锰酸钾溶液的体积,影响测定结果.(1)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,步骤③是将Fe3+转化为氢氧化铁沉淀,反应离子方程式为Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+,
A.氯化铵和氢氧化钙反应生成氨气和水、氯化钙,反应中有水生成,为防止液化水蒸气倒流而炸裂试管,试管口要低于试管底,故A错误;
B.氨气极易溶于水,氨气的密度小于空气且和空气不反应,所以可以采用向下排空气法收集,故B错误;
C.氨气能使湿润的红色石蕊试纸变蓝,所以检验氨气要使用湿润的红色石蕊试纸,故C错误;
D.氨气有刺激性气味,所以最后要有尾气处理装置,氨气极易溶于水,为防止倒吸,尾气处理中要有缓冲装置,故D正确;
故答案为:将Fe2+全部氧化为Fe3+;Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+;D;
(2)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量,ag氧化铁中铁的质量=[ag/160g/mol×112g/mol=
112a
160g,则每片补血剂含铁元素的质量为
112a
1600]g,
故答案为:洗涤,冷却,[112a/1600];
(3)精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管,250mL容量瓶;高锰酸钾有强氧化性,能将盐酸氧化,硝酸具有氧化性,能亚铁离子氧化,故只能用稀硫酸酸化,
故答案为:250 mL容量瓶,b.点评:
本题考点: 探究物质的组成或测量物质的含量.
考点点评: 本题考查学生对实验原理与实验操作的理解、物质分离提纯、元素化合物性质、氧化还原反应滴定、化学计算等,难度中等,清楚实验原理是解题的关键,注意(2)中计算的是每片补血剂中铁的质量而不是铁的总质量,为易错点.1年前查看全部
- 硫酸亚铁晶体(FeSO 4 ·7H 2 O)在医药上可作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下 请同
硫酸亚铁晶体(FeSO 4 ·7H 2 O)在医药上可作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下 
请同答下列问题:
(1)步骤②加入过量H 2 O 2 的目的为________。
(2)步骤③中反应的离子方程式为____________。
(3)步骤④中的一系列操作依次为:过滤、____、灼烧、____ 、称量。
(4)若实验无损耗,则每片补血剂含铁元素的质量为____g(用含a的代数式表示,不用化简)。
(5)该小组有些同学认为用KMnO 4 溶液滴定也能进行铁元素含量的测定。反应原理为:
5Fe 2+ +MnO 4 - +8H + = 5Fe 3+ +Mn 2+ +4H 2 O。
①实验前,首先要精确配制一定物质的量浓度的KMnO 4 溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需要的玻璃仪器为____________;
②上述实验中的KMnO 4 溶液需要酸化,可用于酸化的酸是__________。
a.稀硝酸 b.稀硫酸 c.稀盐酸 d.浓硝酸 楚天雄1年前1
楚天雄1年前1 -
 没有了如果 共回答了23个问题
没有了如果 共回答了23个问题 |采纳率91.3%(1)将Fe 2+ 全部氧化为Fe 3+
(2)Fe 3+ +3OH - =Fe(OH) 3 ↓
(3)洗涤;冷却
(4)112a/1600
(5)①250mL容量瓶;②b1年前查看全部
- (2012•泰安)某兴趣小组的同学从实验室收集到一桶含有FeSO4、CuSO4的废液,他们想从中回收金属铜和硫酸亚铁晶体
(2012•泰安)某兴趣小组的同学从实验室收集到一桶含有FeSO4、CuSO4的废液,他们想从中回收金属铜和硫酸亚铁晶体,设计了如下实验方案.结合实验方案回答下列问题:

(1)步骤①中,金属X是铁(或Fe)铁(或Fe),该反应的化学方程式为Fe+CuSO4=Cu+FeSO4Fe+CuSO4=Cu+FeSO4;
(2)步骤②中,加入过量稀硫酸的目的是除去铜中的铁除去铜中的铁;
(3)从滤液中获得硫酸亚铁晶体采用的方法是蒸发蒸发. cc_20001年前1
cc_20001年前1 -
 sulia 共回答了13个问题
sulia 共回答了13个问题 |采纳率92.3%(1)由题意可知,由于需要将铜离子转化为铜单质,而溶液还必须为硫酸亚铁,即不能引入新的杂质,所以可以加入铁将铜离子转化为铜单质.该反应的化学方程式为:Fe+CuSO4 ═FeSO4 +Cu;
(2)步骤②中,加入过量稀硫酸的目的是 除去铜中的铁;
(3)从滤液中获得硫酸亚铁晶体采用的方法是蒸发.
故答为:(1)铁,Fe+CuSO4 ═FeSO4 +Cu;(2)除去铜中的铁;(3)蒸发.1年前查看全部
- 硫酸亚铁晶体(FeSO 4 ·7H 2 O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
硫酸亚铁晶体(FeSO 4 ·7H 2 O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
 请回答下列问题:
请回答下列问题:
(1)证明步骤①滤液中含有Fe 2+ 的方法是先滴加KSCN溶液,再滴加 ,该过程的现象为: 。
(2)步骤②加入过量H 2 O 2 的目的: 。
(3)步骤③中反应的离子方程式: 。
(4)步骤④中一系列处理的操作步骤:过滤、 、灼烧、 、称量。
(5)若实验无损耗,则每片补血剂含铁元素的质量 g。
(6)该小组有些同学认为用KMnO 4 溶液滴定也能进行铁元素含量的测定。
(5Fe 2+ +MnO 4 — +8H + →5Fe 3+ +Mn 2+ +4H 2 O)
①实验前,首先要精确配制一定物质的量浓度的KMnO 4 溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管外,还需 。
②上述实验中的KMnO 4 溶液需要酸化,用于酸化的酸是 。
a.稀硝酸 b.稀硫酸 c.稀盐酸 d.浓硝酸
③滴定到终点时的颜色为 色。
(7)正常人每天应补充14mg左右的铁。其中绝大部分来自于食物。如果全部通过服用含FeSO 4 ·7H 2 O的片剂。来补充铁,则正常人每天服需用含 mgFeSO 4 ·7H 2 O为片剂。 vv伦谈1年前1
vv伦谈1年前1 -
 小小不一 共回答了19个问题
小小不一 共回答了19个问题 |采纳率94.7%(1)氯水(或双氧水、稀硝酸等合理氧化剂)(1分)现象:或溶液由浅绿色变为血红色(1分)
(2)将Fe 2+ 全部氧化为Fe 3+ (2分)
(3)Fe 3+ +3OH — →Fe(OH) 3 ↓(或Fe 3+ +3NH 3 ·H 2 O→Fe(OH) 3 +3NH 4 + )(2分)
(4)洗涤、冷却(各1分,共2分) (5)0.07a(2分)
(6)①250mL容量瓶(1分)②b(2分)③紫(或紫红)(1分) (7)69.5mg(2分)
1年前查看全部
- Fe是人体不可缺少的微量元素,摄入含铁化合物可补充铁.硫酸亚铁晶体(FeSO4•7H2O)在医药上作补血剂.某课外小组测
Fe是人体不可缺少的微量元素,摄入含铁化合物可补充铁.硫酸亚铁晶体(FeSO4•7H2O)在医药上作补血剂.某课外小组测定该补血剂中铁元素的含量.实验步骤如下:

请回答下列问题:
(1)步骤②加入过量H2O2的目的:______;
(2)步骤③中反应的离子方程式:______;
(3)步骤④中一系列处理的操作步骤:______、洗涤、______、冷却、称量.
(4)实验中用浓硫酸配制1mol/L的稀硫酸,配制时用到定量的玻璃仪器有______、______(答出两个仪器).
(5)若实验无损耗,则每片补血剂含铁元素的质量______g(用含a的代数式表示). 清风谷1年前1
清风谷1年前1 -
 lecots 共回答了15个问题
lecots 共回答了15个问题 |采纳率80%解题思路:由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量.
(1)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,由流程图可知,加入H2O2是将Fe2+氧化为Fe3+;
(2)步骤③是将Fe3+转化为氢氧化铁沉淀;
(3)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量;
(4)配制一定体积的1mol/L的稀硫酸,配制时需要的仪器有量筒、玻棒、烧杯、胶头滴管,容量瓶;
(5)根据铁元素守恒可知ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,据此计算.(1)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,故答案为:将Fe2+全部氧化为Fe3+;
(2)步骤③是将Fe3+转化为氢氧化铁沉淀,反应离子方程式为Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+,
故答案为:Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+;
(3)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量,
故答案为:过滤;灼烧;
(4)配制一定体积的1mol/L的稀硫酸,配制时需要的仪器有玻棒、烧杯、胶头滴管、容量瓶、量筒,故答案为:容量瓶;量筒;
(5)ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,所以每片补血剂含铁元素的质量
ag×
112
160
10=0.07ag,
故答案为:0.07a.点评:
本题考点: 探究物质的组成或测量物质的含量;常见金属元素的单质及其化合物的综合应用.
考点点评: 本题考查学生对实验原理与实验操作的理解、物质分离提纯、元素化合物性质、化学计算等,难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.1年前查看全部
- 从硫酸铜废液中回收金属铜得到硫酸亚铁晶体
 笑笑的vv密1年前3
笑笑的vv密1年前3 -
 童年的毛毛虫吆 共回答了21个问题
童年的毛毛虫吆 共回答了21个问题 |采纳率85.7%1、先在硫酸铜溶液中加入铁钉或铁粉(如果加还原铁粉,同时硫酸铜浓度较大的话,会有明显放热)同时加热.
2、待反应几近完全后,趁热过滤出还原出的铜粉(一定要趁热,铁质过量,以防氧化).
3、过滤出的溶液应该呈现浅绿色,加入少量还原铁粉,加热浓缩溶液到溶液呈现较深的绿色(硫酸亚铁为浅绿色,无法变为深绿色,加铁粉防氧化).
4、再次趁热过滤,冷却结晶.
应该是这样了.1年前查看全部
- 三氧化硫和水蒸气的冷凝试管中的硫酸亚铁晶体加强热,分解出氧化铁、二氧化硫、三氧化硫和水蒸气.将其通入浸泡在冷水中的试管中
三氧化硫和水蒸气的冷凝
试管中的硫酸亚铁晶体加强热,分解出氧化铁、二氧化硫、三氧化硫和水蒸气.将其通入浸泡在冷水中的试管中,得到无色液体.请问无色液体的主要成分是什么?三氧化硫和水蒸气哪个更多一些呢? 彩排生命1年前3
彩排生命1年前3 -
 51france 共回答了23个问题
51france 共回答了23个问题 |采纳率82.6%根据
2FeSO4·7H2O=Fe2O3 + SO2 + SO3 +7H20
SO3 80,7H20:7*18=126
所以水蒸气更多一些1年前查看全部
- 硫酸亚铁晶体制备时,为什么要用碳酸钠溶液洗涤废铁屑?
硫酸亚铁晶体制备时,为什么要用碳酸钠溶液洗涤废铁屑?
为什么废铁屑表面会有油污啊? 瑞阳才子1年前3
瑞阳才子1年前3 -
 seahaihh 共回答了23个问题
seahaihh 共回答了23个问题 |采纳率100%因为废铁屑表面有油污,油污能溶于碱.
氢氧化钠比较贵,所以实验室里不用氢氧化钠除油污.
碳酸钠水解显碱性,且加热时水解程度变大:CO3 2- + H2O HCO3- + OH-
所以用加热的碳酸钠溶液除油污,效果较好.1年前查看全部
- 硫酸亚铁晶体(FeSO 4 ·7H 2 O)在医药上作补血剂。为测定补血剂中铁元素的含量,某化学兴趣小组设计了两套实验方
硫酸亚铁晶体(FeSO 4 ·7H 2 O)在医药上作补血剂。为测定补血剂中铁元素的含量,某化学兴趣小组设计了两套实验方案:
方案一 滴定法 用酸性KMnO 4 溶液滴定测定铁元素的含量。
反应原理:5Fe 2 + +MnO 4 — +8H + ===5Fe 3 + +Mn 2 + +4H 2 O
(1)实验前,首先要精确配制一定物质的量浓度的KMnO 4 溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需________(填仪器名称)。
(2)上述实验中KMnO 4 溶液需要酸化,用于酸化的酸是________。
(3)某同学设计的下列滴定方式中,最合理的是________(夹持部分略去)(填字母序号)。A.稀硫酸 B.浓硝酸 C.稀硝酸 D.稀盐酸 
方案二 重量法 操作流程如下: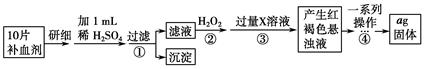
(4)步骤②中除用H 2 O 2 外还可以使用的物质是__________________________。
(5)步骤②是否可以省略________,理由是________________________________
_______________________________________。
(6)步骤④中一系列操作依次是:过滤、洗涤、________、冷却、称量。
(7)假设实验无损耗,则每片补血剂含铁元素的质量________g(用含a的代数式表示)。 小颜1111年前1
小颜1111年前1 -
 散步的鱼mm 共回答了18个问题
散步的鱼mm 共回答了18个问题 |采纳率88.9%(1)250 mL容量瓶 (2)A (3)B (4)氯水(等其他合理的氧化剂) (5)不能 因为Fe 2 + 与碱反应后在空气中加热不能得到纯净的Fe 2 O 3 ,故无法准确计算Fe的含量 (6)灼烧 (7)0.07a
(1)据题意,配制一定物质的量浓度的KMnO 4 溶液250 mL,还需250 mL容量瓶(必须带上容量瓶的规格)。(2)由于高锰酸钾有强氧化性不能用盐酸酸化,也不用强氧化性酸(硝酸)酸化,通常用稀硫酸酸化。(3)由于高锰酸钾有强氧化性会腐蚀橡皮管,故只能用酸式滴定管(B装置)进行滴定实验。(4)除用H 2 O 2 外还可以使用氯水氧化Fe 2 + ,不引入新的杂质离子。(5)因为Fe 2 + 与碱反应后在空气中加热不能得到纯净的Fe 2 O 3 ,无法准确计算Fe的含量,所以必须先用H 2 O 2 氧化Fe 2 + 来实现。(6)步骤④依次将Fe(OH) 3 过滤、洗涤、灼烧(Fe(OH) 3 分解得Fe 2 O 3 、冷却、称量。(7)每片补血剂含铁元素的质量:a g÷160 g·mol -1 ×2×56 g·mol -1 ÷10片=0.07a g/片1年前查看全部
- (14分)Fe是人体不可缺少的微量元素,摄入含铁化合物可补充铁。硫酸亚铁晶体(FeSO 4 ·7H 2 O)在医药上作补
(14分)Fe是人体不可缺少的微量元素,摄入含铁化合物可补充铁。硫酸亚铁晶体(FeSO 4 ·7H 2 O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
请回答下列问题:
(1)步骤②加入过量H 2 O 2 的目的: ;
(2)步骤③中反应的离子方程式: ;
(3)步骤④中一系列处理的操作步骤: 、洗涤、 、冷却、称量。
(4)实验中用浓硫酸配制1 mol/L的稀硫酸,配制时用到定量的玻璃仪器有 、
(答出两个仪器)。
(5)若实验无损耗,则每片补血剂含铁元素的质量 g(用含a的代数式表示)。 zeng虫虫1年前1
zeng虫虫1年前1 -
 adele0124 共回答了24个问题
adele0124 共回答了24个问题 |采纳率79.2%(14分)(1)将Fe 2+ 全部氧化为Fe 3+ (2分)
(2)Fe 3+ +3NH 3 ·H 2 O=Fe(OH) 3 ↓+3NH 4 + (2分)
(3)过滤 (2分) 灼烧 (2分)
(4)容量瓶(2分) 量筒 (2分)
(5)0.07a (2分)
1年前查看全部
- (2011•丹徒区模拟)硫酸亚铁晶体是一种重要的食品和饲料添加剂.某化学兴趣小组的学生打算用化工厂里的含有少量铜的废铁屑
(2011•丹徒区模拟)硫酸亚铁晶体是一种重要的食品和饲料添加剂.某化学兴趣小组的学生打算用化工厂里的含有少量铜的废铁屑来制取硫酸亚铁晶体:
收集资料:①硫酸亚铁晶体易溶于水,难溶于酒精 ②硫酸亚铁晶体强热能分解③硫酸亚铁在不同温度下的溶解度如下表所示:
实验方案:温度/℃ 0 10 30 50 60 70 80 90 溶解度/g 14.0 17.0 25.0 33.0 35.3 33.0 30.5 27.0 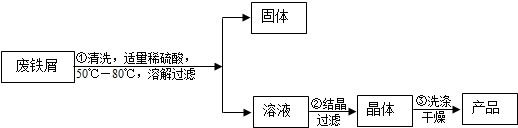
问题讨论:
(1)步骤①得到的固体中一定含有的金属单质的化学式为______.步骤①的温度控制在50℃至80℃的目的是______.
(2)步骤②适宜用______结晶法.
(3)洗涤干燥时,设计以下三种方案:
A.用水洗涤后再用滤纸吸干表面的水 B.使用无水酒精洗涤快速晾干 C.用水洗涤后,放在蒸发皿中烘干
上述方案中你认为:最好的方案是______,理由是______. ydj0071年前1
ydj0071年前1 -
 伤心雨1987 共回答了18个问题
伤心雨1987 共回答了18个问题 |采纳率100%解题思路:(1)铜不会和硫酸反应,所以可以过滤出来;根据硫酸亚铁的溶解性表格可知.
(2)根据硫酸亚铁的溶解性表格可知.
(3)硫酸亚铁难溶于酒精可知.(1)加入稀硫酸后,铁可以和硫酸反应生成硫酸亚铁和氢气,但铜不会和硫酸反应,因此铜就被过滤出来;根据硫酸亚铁的溶解表格可知,硫酸亚铁在50℃到80℃时溶解度是比较大的;故答案为:Cu,增大硫酸亚铁的溶解度.
(2)根据溶解性表格可知,随着温度的降低,硫酸亚铁的溶解度也随之降低,从而结晶析出.故答案为:冷却.
(3)根据题目信息可知,硫酸亚铁晶体易溶于水,说明A方法硫酸亚铁损耗较大;难溶于酒精,说明B方法较合适;硫酸亚铁晶体强热能分解,说明C方法也有较大的损耗.故答案为:B,硫酸亚铁的损耗较少.点评:
本题考点: 物质的相互转化和制备;化学实验方案设计与评价;金属活动性顺序及其应用.
考点点评: 通过这个题培养学生观察视图的能力,以及比较分析的能力.1年前查看全部
- 某兴趣小组的同学从实验室收集到一桶含有FeSO4、CuSO4的废液,他们想从中回收金属铜和硫酸亚铁晶体,设计了如下实验方
某兴趣小组的同学从实验室收集到一桶含有FeSO4、CuSO4的废液,他们想从中回收金属铜和硫酸亚铁晶体,设计了如下实验方案.

金属X是
加入过量稀硫酸的目的是除去铜中的铁 Jasmine21051年前5
Jasmine21051年前5 -
 把酒送月色 共回答了25个问题
把酒送月色 共回答了25个问题 |采纳率100%1.x是铁,因为他要回收硫酸亚铁,要把CuSO4转化为FeSO4,用其他金属会带入新杂质
2.是为了吧铜中的铁转化为硫酸亚铁1年前查看全部
- 用硫酸亚铁晶体配制硫酸亚铁溶液时,还需加入铁粉和稀硫酸抑制水解,防止氧化,但是铁粉与稀硫酸难道不反应么?
 努力活着801年前3
努力活着801年前3 -
 hxyhw 共回答了22个问题
hxyhw 共回答了22个问题 |采纳率90.9%反应的,但稀硫酸只是起到一时的作用,就是在配置的时候浓度会差异很大,稀硫酸就是在这个时候起到防止亚铁离子水解的作用,之后浓度稳定后便没有作用了,就与铁粉反应成硫酸亚铁了1年前查看全部
- 硫酸亚铁晶体隔绝空气加强热,如何反应?
硫酸亚铁晶体隔绝空气加强热,如何反应?
硫酸亚铁晶体:FeSO4.7H2O 魔术师之手1年前1
魔术师之手1年前1 -
 临风沐雪 共回答了18个问题
临风沐雪 共回答了18个问题 |采纳率88.9%如果实在加热的条件下:FeSO4.7H2O=FeSO4+7H2O
如果是在高温的条件下:FeSO4.7H2O=FeSO4+7H2O FeSO4=FeO+SO3
2FeO+SO3=Fe2O3+SO21年前查看全部
- 硫酸亚铁晶体写在离子方程式中是否需要拆开 是否写出结晶水 为什么
 冰钰1年前1
冰钰1年前1 -
 dengyianping4780 共回答了17个问题
dengyianping4780 共回答了17个问题 |采纳率94.1%离子反应是在溶液或熔融状态下进行的,所以要拆开,不写结晶水.1年前查看全部
- 硫酸亚铁溶液在工业上有什么用途?注:是硫酸亚铁溶液,不是硫酸亚铁晶体!
 洪baobao1年前1
洪baobao1年前1 -
 尴尬人 共回答了18个问题
尴尬人 共回答了18个问题 |采纳率94.4%还原剂
铁肥1年前查看全部
- 如何从硫酸亚铁溶液中提取硫酸亚铁晶体
如何从硫酸亚铁溶液中提取硫酸亚铁晶体
急 wangmao7751年前1
wangmao7751年前1 -
 sqx_0_ren 共回答了15个问题
sqx_0_ren 共回答了15个问题 |采纳率93.3%在硫酸亚铁里加入少量铁粉.
然后直接蒸发就可以了,因为硫酸亚铁不需要考虑水解(硫酸根不变少,但是氯化亚铁就不行,氯离子会变成HCl逸出使得蒸发后无法得到氯化亚铁).只需考虑亚铁离子的氧化,用铁粉可以抑制氧化.
最后用磁铁吸去铁不就行了?1年前查看全部
- 硫酸亚铁晶体制备保持温度在50℃—80℃之间,不要煮沸原因是什么
 见风另我流泪1年前2
见风另我流泪1年前2 -
 wetgygdyh 共回答了14个问题
wetgygdyh 共回答了14个问题 |采纳率92.9%关键是硫酸亚铁晶体有结晶水的,防止在过高的温度下失水而形有成FeSO4*7H2O.1年前查看全部
- 硫酸亚铁晶体变质最终变成什么颜色
 尘封的记忆1年前3
尘封的记忆1年前3 -
 _帆儿 共回答了14个问题
_帆儿 共回答了14个问题 |采纳率92.9%在氧气中被氧化为三价的铁离子,故会变为浅黄色(略微显示淡绿色).
至于那个怎么被氧化成了红色,说真的,我还没听说过.1年前查看全部
- 为测定该补血剂样品[主要成分是硫酸亚铁晶体(FeSO 4 •7H 2 O)]中铁元素的含量,某化学兴趣小组设计了两套实验
为测定该补血剂样品[主要成分是硫酸亚铁晶体(FeSO 4 •7H 2 O)]中铁元素的含量,某化学兴趣小组设计了两套实验方案:
方案一:用酸性KMnO 4 溶液滴定测定铁元素的含量
(1)写出滴定反应的离子方程式______.
(2)下列滴定方式中,最合理的是______(夹持部分略去)(填字母序号).
(3)实验前,首先要准确配制一定物质的量浓度的KMnO 4 溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需______(填仪器名称).
(4)某同学设计以原电池的形式实现Fe 2+ 至Fe 3+ 的转化,电解质溶液为稀硫酸,请写出负极的电极反应式______
方案二 将FeSO 4 转化为Fe 2 O 3 ,测定质量变化操作流程如下:
(3)步骤②中除用H 2 O 2 外还可以使用的物质是______.
(5)步骤②是否可以省略______,理由是______.
(6)步骤④中一系列操作依次是:过滤、洗涤、______、冷却、称量.
(7)假设实验无损耗,则每片补血剂含铁元素的质量______g(用含a的代数式表示). 丢rr码的俗人1年前1
丢rr码的俗人1年前1 -
 83ny 共回答了13个问题
83ny 共回答了13个问题 |采纳率84.6%方案一:(1)酸性高锰酸钾具有强氧化性,将Fe 2+ 氧化为Fe 3+ ,被还原为Mn 2+ ,同时生成水,反应离子方程式为5Fe 2+ +MnO 4 - +8H + =5Fe 3+ +Mn 2+ +4H 2 O;
故答案为:5Fe 2+ +MnO 4 - +8H + =5Fe 3+ +Mn 2+ +4H 2 O;
(2)酸性高锰酸钾具有强氧化性,可以发生橡皮管,应盛放在酸式滴定管内,硫酸亚铁溶液呈酸性,应盛放在酸式滴定管内,故B最合适;
故答案为:B;
(3)精确配制一定物质的量浓度的KMnO 4 溶液250mL,配制时需要的仪器有天平、药匙、玻棒、烧杯、胶头滴管、250mL容量瓶;
故答案为:250mL容量瓶;
(4)原电池负极反应氧化反应,Fe 2+ 在负极放电生成Fe 3+ ,负极电极反应式为Fe 2+ -e - ═Fe 3+ ;
故答案为:Fe 2+ -e - ═Fe 3+ ;
方案二:
(3)步骤②加入有强氧化性试剂,能将Fe 2+ 全部氧化为Fe 3+ ,除用H 2 O 2 外还可以使用氯水等;
故答案为:氯水;
(5)Fe 2+ 与碱反应后不能保证Fe 2+ 全部转化为Fe 3+ ,加热不能得到纯净的Fe 2 O 3 ,故无法准确计算Fe的含量,故步骤②不能省略;
故答案为:不能,Fe 2+ 与碱反应后不能保证Fe 2+ 全部转化为Fe 3+ ,加热不能得到纯净的Fe 2 O 3 ,故无法准确计算Fe的含量;
(6)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量;
故答案为:灼烧;
(7)ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,所以每片补血剂含铁元素的质量
ag×
112
160
10 =0.07ag;
故答案为:0.07a.1年前查看全部
- (2012•泰安)某兴趣小组的同学从实验室收集到一桶含有FeSO4、CuSO4的废液,他们想从中回收金属铜和硫酸亚铁晶体
(2012•泰安)某兴趣小组的同学从实验室收集到一桶含有FeSO4、CuSO4的废液,他们想从中回收金属铜和硫酸亚铁晶体,设计了如下实验方案.结合实验方案回答下列问题:

(1)步骤①中,金属X是______,该反应的化学方程式为______;
(2)步骤②中,加入过量稀硫酸的目的是______;
(3)从滤液中获得硫酸亚铁晶体采用的方法是______. 踩了谁的尾巴1年前1
踩了谁的尾巴1年前1 -
 流浪的ll 共回答了14个问题
流浪的ll 共回答了14个问题 |采纳率92.9%解题思路:(1)由于目的是获得铜单质和硫酸亚铁,所以需要将铜离子转化为铜单质,而溶液中需要的是硫酸亚铁而不能引入新的杂质,所以加入的能够将铜离子转化为铜单质的只能是单质铁;
(2)由于加入的铁是过量的,加入过量稀硫酸的目的是除去铜中的铁;
(3)蒸发从溶液中获得晶体常采用的方法.(1)由题意可知,由于需要将铜离子转化为铜单质,而溶液还必须为硫酸亚铁,即不能引入新的杂质,所以可以加入铁将铜离子转化为铜单质.该反应的化学方程式为:Fe+CuSO4 ═FeSO4 +Cu;
(2)步骤②中,加入过量稀硫酸的目的是:使铁完全反应,除去铜中的铁;
(3)从滤液中获得硫酸亚铁晶体采用的方法是蒸发.
故答为:(1)铁,Fe+CuSO4 ═FeSO4 +Cu;(2)使铁完全反应,除去铜中的铁;(3)蒸发.点评:
本题考点: 金属活动性顺序及其应用.
考点点评: 解答本题时要注意混合物的分离要考虑为彻底分开而加入过量试剂,所以后一环节需要将之除去.1年前查看全部
大家在问
- 1把1-25这25个数无重复地填到一个5×5的方格中,使得去掉任意一行和一列后,剩下的16个数的和均为偶数.谢
- 2同问甲从A地到B地要走m小时,乙从B地到A地要走n小时,甲、乙两人同时从A、B两地同时出发,相向而行
- 3钠着火如何熄灭?钠着火不能用( )也不能用( )应用( )盖灭.
- 4若函数f(x)=lg(2/(1-x)+m)是奇函数 求m的值 解不等式f(x)
- 5《枣儿》中的矛盾冲突和人物性格
- 6英语翻译这些是谚语,是关于天气的.有以下几个需要帮忙翻译:1.There is something in the win
- 7我们常见的食物有肉类、蛋类、豆类和奶制品等,请根据问题分析回答.
- 8解方程 (2x+1)(2x+3)=15
- 9人生的价值在于奉献而不在于索取。
- 10妈妈买4千克苹果和3千克梨,共付21.6元;爸爸买同样规格的梨3千克,苹果6千克,共付28.8元.每千克苹果几
- 11小学六年级下册精读课文列表
- 12(2012•龙岩)在平面直角坐标系xOy中,一块含60°角的三角板作如图摆放,斜边AB在x轴上,直角顶点C在y轴正半轴上
- 132x²-3x+1=6x
- 14一道化学题现有BaCl2,氯化氢,NH4Cl ,Na2SO4,蔗糖五种物质(1)熔化时不需要破坏化学键的是——溶解时不破
- 15蜻蜓和娥子是胎生动物还是卵生动物?

