锂亚硫酰氯电池正负极和电液问题锂亚硫酰氯电池的正极、负极是什么,有人说电液是亚硫酰氯,它也是活性物质也参与反应,那电池本
 雾岚2022-10-04 11:39:542条回答
雾岚2022-10-04 11:39:542条回答锂亚硫酰氯电池的正极、负极是什么,有人说电液是亚硫酰氯,它也是活性物质也参与反应,那电池本身不是短路了吗?

已提交,审核后显示!提交回复
共2条回复
 huangwyu 共回答了20个问题
huangwyu 共回答了20个问题 |采纳率100%- 对于电池来说,本身就可以看做短路,否则就没回路了
- 1年前
 zhangpeng870105 共回答了1个问题
zhangpeng870105 共回答了1个问题 |采纳率- 中间有隔膜,防止短路,你最好找些资料自己看看,一两句说不清楚
- 1年前
相关推荐
- 二甲亚砜的结构好象是sp3杂化,但是硫氧双键怎么办?d轨道成键么?亚硫酰氯也是这个样子吗意思就是硫使用了配位键?那为什么
二甲亚砜的结构
好象是sp3杂化,但是硫氧双键怎么办?d轨道成键么?亚硫酰氯也是这个样子吗
意思就是硫使用了配位键?那为什么书上是使用双键和单键的共振来表示的? kc9e1年前1
kc9e1年前1 -
 bryantsbright 共回答了18个问题
bryantsbright 共回答了18个问题 |采纳率94.4%电子对的分布是sp3杂化形式.
硫氧双键是形式上的双键(便于用价键理论描述),其实应该是:
(CH3)2S+-O-,即S带正电荷,O带负电荷.(S上有一对孤对电子)
不需要考虑d轨道.1年前查看全部
- (2009•湛江一模)锂电池用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯()中形成的
(2009•湛江一模)锂电池用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯(
 )中形成的,该电池的总反应方程式为:8Li+3SOCl2═6LiCl+Li2SO3+2S,下列叙述中正确的是( )
)中形成的,该电池的总反应方程式为:8Li+3SOCl2═6LiCl+Li2SO3+2S,下列叙述中正确的是( )
A.电解质溶液中混入水,对电池反应无影响
B.金属锂作电池的负极,石墨作电池的正极
C.电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3
D.电池工作过程中,金属锂提供电子的物质的量与析出硫的物质的量之比为4:1 流浪菟丝花1年前1
流浪菟丝花1年前1 -
 AntionBai 共回答了17个问题
AntionBai 共回答了17个问题 |采纳率76.5%解题思路:该电池的负极材料为锂,性质活泼,易与水反应,则电解质为非水溶液,根据总反应8Li+3SOCl2═6LiCl+Li2SO3+2S可知,亚硫酰氯(SOCl2)被还原为S,由反应的总方程式可知金属锂提供的电子与正极区析出硫的物质的量之比.A.锂性质活泼,易与水反应,则电解质为非水溶液,故A错误;
B.该电池的负极材料为锂,被氧化生成LiCl和Li2SO3,石墨作正极,故B正确;
C.根据总反应8Li+3SOCl2═6LiCl+Li2SO3+2S可知,亚硫酰氯(SOCl2)被还原为S,故C错误;
D.根据总反应8Li+3SOCl2═6LiCl+Li2SO3+2S可知,8mol锂反应失去8mol电子,生成2molS,金属锂提供的电子与正极区析出硫的物质的量之比为4:1,故D正确;
故选:BD.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查锂电池的组成和工作原理,题目难度不大,注意从原电池总反应中元素化合价变化判断原电池的正负极反应.1年前查看全部
- 锂亚硫酰氯(Li/SOCl2)电池中的正极反应产物之一到底写亚硫酸根离子还是二氧化硫啊?其区别在哪里?
 飞力1年前1
飞力1年前1 -
 luiyuling 共回答了22个问题
luiyuling 共回答了22个问题 |采纳率86.4%是二氧化硫,本身亚硫酰氯就是强酸性的溶剂,不会产生亚硫酸根的.形成的阴离子是氯离子不是亚硫酸根.
2SOCl2十4e- =SO2十S十4Cl-1年前查看全部
- 有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯化铝锂(LiAlCl4)溶解在亚硫酰氯()中形成的,其电池总反
有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯化铝锂(LiAlCl4)溶解在亚硫酰氯(
 )中形成的,其电池总反应方程式为:8Li+3SOCl2═6LiCl+Li2SO3+2S.下列叙述中正确的是( )
)中形成的,其电池总反应方程式为:8Li+3SOCl2═6LiCl+Li2SO3+2S.下列叙述中正确的是( )
A.电解质溶液可以用水,也可以用饱和食盐水
B.电池工作过程中,亚硫酰氯(SOCl2)被还原成Li2SO3
C.电池工作时,锂电极为正极,石墨电极为负极
D.电池工作过程中,金属锂提供的电子与正极区析出的硫的物质的量之比为4:1 0sbza1年前1
0sbza1年前1 -
 卖唱为生 共回答了14个问题
卖唱为生 共回答了14个问题 |采纳率100%解题思路:该电池的负极材料为锂,性质活泼,易与水反应,则电解质为非水溶液,根据总反应8Li+3SOCl2=6LiCl+Li2SO3+2S可知,亚硫酰氯(SOCl2)被还原为S,由反应的总方程式可知金属锂提供的电子与正极区析出硫的物质的量之比.A、锂性质活泼,易与水反应,则电解质为非水溶液,故A错误;
B、根据总反应8Li+3SOCl2=6LiCl+Li2SO3+2S可知,亚硫酰氯(SOCl2)被还原为S,故B错误;
C、该电池的负极材料为锂,被氧化生成LiCl和Li2SO3,故C错误;
D、根据总反应8Li+3SOCl2=6LiCl+Li2SO3+2S可知,8mol锂反应失去8mol电子,生成2molS,金属锂提供的电子与正极区析出硫的物质的量之比为4:1,故D正确;
故选D.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查锂电池的组成和工作原理,题目难度不大,注意从原电池总反应判断原电池的正负极反应.1年前查看全部
- 已知亚硫酰氯(SOCl 2 )溶于水产生大量白雾和刺激性气味气体.有一种锂电池,用锂与石墨作电极材料,电解质溶液是由四氯
已知亚硫酰氯(SOCl 2 )溶于水产生大量白雾和刺激性气味气体.有一种锂电池,用锂与石墨作电极材料,电解质溶液是由四氯化铝锂(LiAlCl 4 )溶解在亚硫酰氯(SOCl 2 )中形成的,电池总反应方程式为8Li+3SOCl 2 =6LiCl+Li 2 SO 3 +2S。下列有关叙述中,正确的是
A.锂为电池的正极,石墨作电池的负极 B.电池工作过程中,亚硫酰氯(SOCl 2 )被还原为Li 2 SO 3 C.电解质溶液中混入水,对电池反应无影响 D.电池工作过程中,锂提供的电子与正极区析出硫的物质的量之比为4:1  肖舒元1年前1
肖舒元1年前1 -
 csp516 共回答了17个问题
csp516 共回答了17个问题 |采纳率82.4%D
根据电池总反应方程式,可知负极反应为8li-8e - =8Li + ,正极反应为3SOCl 2 +8e - =SO 3 2- +2S+6Cl - :金属锂作电池的负极,石墨为电池的正极,A选项错误;电池工作过程中,亚硫酰氯(SOCl 2 )被还原为硫,B选项错误;电解质溶液中混有水,锂与水反应:2Li+2H 2 O=2LiOH+H 2 ↑,同时发生水SOCl 2 +H 2 O=SO 2 ↑+2HCl,对电池反应有影响,C选项错误;由电反应式判断D正确。1年前查看全部
- 锂经常被用来做锂电池,有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯(S
锂经常被用来做锂电池,有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯(SOCl2)中形成的,电池总反应方程式为:8Li+3SOCl2=6LiCl+Li2SO3+2S,已知亚硫酰氯和AlCl3•6H2O混合共热蒸干,可制得无水AlCl3.则下列叙述中正确的是( )
A. 电解质溶液中混入水,对电池反应无影响
B. 金属锂作电池的正极,石墨作电池的负极
C. 电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3
D. 电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4:1 s606931年前2
s606931年前2 -
 angela2003 共回答了21个问题
angela2003 共回答了21个问题 |采纳率76.2%解题思路:该电池的负极材料为锂,性质活泼,易与水反应,则电解质为非水溶液,根据总反应8Li+3SOCl2=6LiCl+Li2SO3+2S可知,亚硫酰氯(SOCl2)被还原为S,由反应的总方程式可知金属锂提供的电子与正极区析出硫的物质的量之比.A、锂性质活泼,易与水反应,则电解质为非水溶液,故A错误;
B、该电池的负极材料为锂,被氧化生成LiCl和Li2SO3,故B错误;
C、根据总反应8Li+3SOCl2=6LiCl+Li2SO3+2S可知,亚硫酰氯(SOCl2)被还原为S,故C错误;
D、根据总反应8Li+3SOCl2=6LiCl+Li2SO3+2S可知,8mol锂反应失去8mol电子,生成2molS,金属锂提供的电子与正极区析出硫的物质的量之比为4:1,故D正确.
故选D.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查锂电池的组成和工作原理,题目难度不大,注意从原电池总反应判断原电池的正负极反应.1年前查看全部
- (2008•东莞一模)有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂溶解在亚硫酰氯(SOCl2)中形成,
(2008•东莞一模)有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂溶解在亚硫酰氯(SOCl2)中形成,电池总反应方程式为:8Li+3SOCl2=6LiCl+Li2SO3+2S,已知亚硫酰氯和AlCl3•6H2O混合共热蒸干,可制得无水AlCl3,则下列叙述正确的是( )
A.电解质溶液中混入水,对电池反应无影响
B.金属锂作电池的负极,石墨作电池的正极
C.电池工作过程中,SOCl2被还原为Li2SO3
D.电池工作过程中,负极消耗锂与正极区析出的S的质量之比为7:8 aaawwwaaa1年前1
aaawwwaaa1年前1 -
 jingjingxiaoyu 共回答了21个问题
jingjingxiaoyu 共回答了21个问题 |采纳率90.5%解题思路:电池的负极材料为锂,性质活泼,易与水反应,则电解质为非水溶液,根据总反应8Li+3SOCl2=6LiCl+Li2SO3+2S可知,亚硫酰氯(SOCl2)被还原为S,由反应的总方程式可知金属锂提供的电子与正极区析出硫的物质的量之比.A、锂性质活泼,易与水反应,则电解质为非水溶液,故A错误;
B、该电池的负极材料为锂,被氧化生成LiCl和Li2SO3,石墨作电池的正极,故B正确;
C、根据总反应8Li+3SOCl2=6LiCl+Li2SO3+2S可知,亚硫酰氯(SOCl2)被还原为S,故C错误;
D、根据总反应8Li+3SOCl2=6LiCl+Li2SO3+2S可知,8mol锂反应失去8mol电子,生成2molS,负极消耗锂与正极区析出的S的质量之比为[8×7/2×32]=7:8,故D正确.
故选BD.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查锂电池的组成和工作原理,题目难度不大,注意从原电池总反应判断原电池的正负极反应.1年前查看全部
- 为什么亚硫酰氯和醇反应的时候氧会配到硫上面?
为什么亚硫酰氯和醇反应的时候氧会配到硫上面?
而且后来会出现极化反应,氧会出现分子内的极化,这是怎么回事?机理是什么?
一定要有机理的说明! songhaiwen1年前1
songhaiwen1年前1 -
 13166294155 共回答了21个问题
13166294155 共回答了21个问题 |采纳率90.5%因为硫的电负性比氯弱,配到硫上更稳定.1年前查看全部
- 有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂溶解在亚硫酰氯(SOCl 2 )中形成,电池的总反应式为8
有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂溶解在亚硫酰氯(SOCl 2 )中形成,电池的总反应式为8Li+3SOCl 2 =6LiCl+Li 2 SO 3 +2S,则下列叙述正确的是 ( )
A.用该电池电解CuCl 2 溶液产生2.24LCl 2 时,有0.2mol电子转移 B.金属锂作电池的负极,石墨作电池的正极,加入硫酸可提高电解质的导电性 C.电池工作(放电)过程中,SOCl 2 被还原为Li 2 SO 3 D.电池工作过程中,负极消耗的锂与正极生成的硫质量之比为7:8  力力力力1年前1
力力力力1年前1 -
 我爱影子 共回答了19个问题
我爱影子 共回答了19个问题 |采纳率89.5%D
1年前查看全部
- 推断结构:化合物a(C5H6O3),与乙醇反应生成互为异构的化合物b和c,他们分别再与亚硫酰氯反应再与乙醇反应,
 思恋d1年前0
思恋d1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 有一种锂电池,用金属锂和石墨做电极材料,电解质溶液是由四氯铝锂(LiAlCl 4 )溶解在亚硫酰氯(
有一种锂电池,用金属锂和石墨做电极材料,电解质溶液是由四氯铝锂(LiAlCl 4 )溶解在亚硫酰氯( 
)中而形成的,电池总反应方程式为:8Li+3SOCl 2 ═6LiCl+Li 2 SO 3 +2S,下列叙述中正确的是( )A.电解质溶液中混入水,对电池反应无影响 B.金属锂作电池的正极,石墨作电池的负极 C.电池工作过程中,亚硫酰氯(SOCl 2 )被还原为Li 2 SO 3 D.电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4:1  寂静港湾1年前1
寂静港湾1年前1 -
 王大牛88 共回答了21个问题
王大牛88 共回答了21个问题 |采纳率100%A.锂性质活泼,易与水反应,则电解质为非水溶液,故A错误;
B.该电池的负极材料为锂,被氧化生成LiCl和Li 2 SO 3 ,故B错误;
C.根据总反应8Li+3SOCl 2 =6LiCl+Li 2 SO 3 +2S可知,亚硫酰氯(SOCl 2 )被还原为S,故C错误;
D.根据总反应8Li+3SOCl 2 =6LiCl+Li 2 SO 3 +2S可知,8mol锂反应失去8mol电子,生成2molS,金属锂提供的电子与正极区析出硫的物质的量之比为4:1,故D正确.
故选D.1年前查看全部
- 1.化合物A(C5H6O3)可与1mol乙醇反应得到两个互为异构体的B和C.B和C分别与亚硫酰氯
1.化合物A(C5H6O3)可与1mol乙醇反应得到两个互为异构体的B和C.B和C分别与亚硫酰氯
(SOCl2)作用后再与乙醇作用生成同一化合物D.试推测A~D的结构. 竹雨林风1年前1
竹雨林风1年前1 -
 守候着 共回答了21个问题
守候着 共回答了21个问题 |采纳率95.2%根据分子式计算出该化合物的不饱和度为3,说明含有双键或环.最终推断为:甲基琥珀酸酐(亦称甲基丁二酸酐).CAS:4100-80-51年前查看全部
- 抑制水解的效果问题亚硫酰氯为什么比氯化氢抑制氯化物水解效果更好呢,
 KTV231年前1
KTV231年前1 -
 lnzy026 共回答了25个问题
lnzy026 共回答了25个问题 |采纳率80%亚硫酰氯遇水水解可水解成:SOCl2 + 2H2O = H2SO3 + 2HCl
等量的亚硫酰氯水解生成的氯离子和氢离子要比氯化氢多,所以亚硫酰氯比氯化氢抑制氯化物水解效果更好1年前查看全部
- 锂经常被用来做锂电池,有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯(S
锂经常被用来做锂电池,有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯(SOCl2)中形成的,电池总反应方程式为:8Li+3SOCl2=6LiCl+Li2SO3+2S,已知亚硫酰氯和AlCl3•6H2O混合共热蒸干,可制得无水AlCl3.则下列叙述中正确的是( )
A. 电解质溶液中混入水,对电池反应无影响
B. 金属锂作电池的正极,石墨作电池的负极
C. 电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3
D. 电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4:1 whl11251年前1
whl11251年前1 -
 G_Ximena 共回答了21个问题
G_Ximena 共回答了21个问题 |采纳率100%解题思路:该电池的负极材料为锂,性质活泼,易与水反应,则电解质为非水溶液,根据总反应8Li+3SOCl2=6LiCl+Li2SO3+2S可知,亚硫酰氯(SOCl2)被还原为S,由反应的总方程式可知金属锂提供的电子与正极区析出硫的物质的量之比.A、锂性质活泼,易与水反应,则电解质为非水溶液,故A错误;
B、该电池的负极材料为锂,被氧化生成LiCl和Li2SO3,故B错误;
C、根据总反应8Li+3SOCl2=6LiCl+Li2SO3+2S可知,亚硫酰氯(SOCl2)被还原为S,故C错误;
D、根据总反应8Li+3SOCl2=6LiCl+Li2SO3+2S可知,8mol锂反应失去8mol电子,生成2molS,金属锂提供的电子与正极区析出硫的物质的量之比为4:1,故D正确.
故选D.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查锂电池的组成和工作原理,题目难度不大,注意从原电池总反应判断原电池的正负极反应.1年前查看全部
- 锂经常被用来做锂电池,有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯(S
锂经常被用来做锂电池,有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯(SOCl2)中形成的,电池总反应方程式为:8Li+3SOCl2=6LiCl+Li2SO3+2S,已知亚硫酰氯和AlCl3•6H2O混合共热蒸干,可制得无水AlCl3.则下列叙述中正确的是( )
A. 电解质溶液中混入水,对电池反应无影响
B. 金属锂作电池的正极,石墨作电池的负极
C. 电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3
D. 电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4:1 qw3980111151年前1
qw3980111151年前1 -
 狮子宝宝713 共回答了19个问题
狮子宝宝713 共回答了19个问题 |采纳率89.5%解题思路:该电池的负极材料为锂,性质活泼,易与水反应,则电解质为非水溶液,根据总反应8Li+3SOCl2=6LiCl+Li2SO3+2S可知,亚硫酰氯(SOCl2)被还原为S,由反应的总方程式可知金属锂提供的电子与正极区析出硫的物质的量之比.A、锂性质活泼,易与水反应,则电解质为非水溶液,故A错误;
B、该电池的负极材料为锂,被氧化生成LiCl和Li2SO3,故B错误;
C、根据总反应8Li+3SOCl2=6LiCl+Li2SO3+2S可知,亚硫酰氯(SOCl2)被还原为S,故C错误;
D、根据总反应8Li+3SOCl2=6LiCl+Li2SO3+2S可知,8mol锂反应失去8mol电子,生成2molS,金属锂提供的电子与正极区析出硫的物质的量之比为4:1,故D正确.
故选D.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查锂电池的组成和工作原理,题目难度不大,注意从原电池总反应判断原电池的正负极反应.1年前查看全部
- 有一种锂电池,它是用金属锂和石墨作电极材料,电解质溶液是由四氯化铝锂( LiAlCl 4 )溶解在亚硫酰氯 (SOCl
有一种锂电池,它是用金属锂和石墨作电极材料,电解质溶液是由四氯化铝锂( LiAlCl 4 )溶解在亚硫酰氯 (SOCl 2 )中形成的,电池总反应方程式为:8Li+3SOCl 2 ==6LiCl+Li 2 SO 3 +2S。下列有关叙述中,正确的是 [ ]A.金属锂做电池的正极,石墨做电池的负极
B.电池工作过程中,亚硫酰氯(SOCl 2 )被还原为Li 2 SO 3
C.电解质溶液中混入水,对电池反应无影响
D.电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4:1 隔世狂人1年前1
隔世狂人1年前1 -
 www0371 共回答了16个问题
www0371 共回答了16个问题 |采纳率100%D1年前查看全部
- 锂电池用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯 中形成的,
锂电池用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯
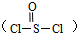 中形成的,电池的总反应方程式为:8Li+3SOCl2═6LiCl+Li2SO3+2S,下列叙述中正确的是( )
中形成的,电池的总反应方程式为:8Li+3SOCl2═6LiCl+Li2SO3+2S,下列叙述中正确的是( )
A.电解质溶液中混入水,对电池反应无影响
B.金属锂作电池的负极,石墨作电池的正极
C.电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3
D.电池工作过程中,金属锂提供电子的物质的量与析出硫的物质的量之比为2:1 星空精灵网1年前1
星空精灵网1年前1 -
 行走雪域之颠 共回答了13个问题
行走雪域之颠 共回答了13个问题 |采纳率84.6%解题思路:该电池的负极材料为锂,性质活泼,易与水反应,则电解质为非水溶液,根据总反应8Li+3SOCl2=6LiCl+Li2SO3+2S可知,亚硫酰氯(SOCl2)被还原为S,由反应的总方程式可知金属锂提供的电子与正极区析出硫的物质的量之比.A、锂性质活泼,易与水反应,则电解质为非水溶液,故A错误;
B、该电池的负极材料为锂,被氧化生成LiCl和Li2SO3,正极为石墨,故B正确;
C、根据总反应8Li+3SOCl2=6LiCl+Li2SO3+2S可知,亚硫酰氯(SOCl2)被还原为S,故C错误;
D、根据总反应8Li+3SOCl2=6LiCl+Li2SO3+2S可知,8mol锂反应失去8mol电子,生成2molS,金属锂提供的电子与正极区析出硫的物质的量之比为4:1,故D错误.
故选B.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查锂电池的组成和工作原理,题目难度不大,注意从原电池总反应判断原电池的正负极反应.1年前查看全部
大家在问
- 1100道一元一次方程运算题!只要计算题!分不多,100道,
- 2英语中的团结就是力量是?
- 3听下面一段对话,回答第1、2小题。 1. Where does the man want to go? A. A hot
- 4Everyone knows that “I” ___ a word and also a letter in Engl
- 5关于“能量”的物理定律有哪些?
- 6(2013•岱岳区模拟)如图所示,小磁针处于静止状态,请在图中甲、乙处标出磁极极性(用“或S表示)并画出磁感线(每个磁极
- 7仔细填空
- 8有难度的英语问题“If you'd been a minite earlier,you would have seen
- 93070米=______千米______米 2.5时=______分.
- 10( )〈hunt〉 can' t kill the wild animals any more
- 11围绕“信赖,能够创造奇迹”写80字左右的短文.拜托各位大神
- 12(2008•湖北模拟)一质量为M、倾角为θ的斜面体放在水平地面上,质量为m的小木块(可视为质点)放在斜面上,现用一平行于
- 13年份 1985 1990 1995 1998 2000 2002 2005
- 14英语翻译急
- 15说一个有趣的英语故事是关于自己有趣的事情大概6-7句左右就好了简单易懂的
