在Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O反应中,______是氧化剂;______是还原剂;__
 zhaominiloveyou2022-10-04 11:39:541条回答
zhaominiloveyou2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 一剑疯猴 共回答了14个问题
一剑疯猴 共回答了14个问题 |采纳率78.6%- 解题思路:反应Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O中,Cu元素化合价由0价升高到+2价,N元素化合价由+5价降低到+4价,结合化合价的变化解答该题.
反应Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O中,Cu元素化合价由0价升高到+2价,N元素化合价由+5价降低到+4价,则HNO3为氧化剂,Cu为还原剂,Cu元素被氧化,N元素被还原,Cu(NO3)2为氧化产物,NO2为还原产物,被还原的HNO3与参加反应的HNO3物质的量之比是1:2,
故答案为:HNO3;Cu;Cu;N;Cu(NO3)2;NO2;1:2.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,侧重于学生的分析能力和计算能力的考查,为高频考点,注意从化合价的角度解答该题,结合反应的方程式解答该题. - 1年前
相关推荐
- 在反应Cu+4HNO3(浓)=Cu(NO3)2+2NO2(向上箭头)+H2O中,被还原的硝酸与未被还原的硝酸的质量之比为
 KingDiChang1年前1
KingDiChang1年前1 -
 lsx5210 共回答了13个问题
lsx5210 共回答了13个问题 |采纳率92.3%Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+H2O
由于生成NO2中含2个氮、生成Cu(NO3)2中也含2个氮,所以被还原的硝酸与未被还原的硝酸的质量之比为1:11年前查看全部
- 化学方程试中电子转移的问题!CU+4HNO3(浓)=======CU(NO3)2+2NO2+H2O中 铜是0价,CU(N
化学方程试中电子转移的问题!
CU+4HNO3(浓)=======CU(NO3)2+2NO2+H2O中 铜是0价,CU(NO)3中CU是+2价就是转移了2个,但HNO3中N是+5价,干嘛NO2才+4价,意思才转了1个电子.这样不守恒啊! kang96501年前3
kang96501年前3 -
 kokom 共回答了13个问题
kokom 共回答了13个问题 |采纳率84.6%1mol铜被氧化,失去2mol电子,1mol硝酸被还原成二氧化氮,得到1mol电子,就说明1mol铜被氧化了,就要有2mol硝酸被还原.这样就守恒了.要搞清楚量的关系,不能说“铜是0价,CU(NO)3中CU是+2价就是转移了2个”,要说清楚几摩尔铜被氧化了,才能说转移了多少电子.1年前查看全部
- 标出下列化学方程式中电子转移的方向及数目.Cl2+H2O=HCl+HClO Cu+4HNO3[浓]=Cu{NO3}2+2
标出下列化学方程式中电子转移的方向及数目.Cl2+H2O=HCl+HClO Cu+4HNO3[浓]=Cu{NO3}2+2NO2↑+2H2O 2KClO3=2KCl+3O2↑(补充:=上有加热MnO2的条件)
 玉扣1年前2
玉扣1年前2 -
 csnowp 共回答了19个问题
csnowp 共回答了19个问题 |采纳率84.2%第一个
Cl2+H2O=HCl+HClO HCl中的氯是-1价 HClO中氯为+1价 反应物的两个氯 一个氯失去一个电子化合价升高 一个氯得到电子化合价降低
第二个
每个铜的失去两个电子升高 HNO3中的其中的两个氮元素(+5)得到两个电子(一个氮得到一个电子)变成NO2(+4价)化合价降低
第三个
2KClO3中氯为+5价 每个氯得到6个电子变为HCl(-1价) 氧元素失去6个电子到从-2价变为氧气(0价)1年前查看全部
- 金属铜和浓硝酸、稀硝酸反应的方程式如下:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
金属铜和浓硝酸、稀硝酸反应的方程式如下:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O(NO、NO2气体都是空气的污染物)3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O(NO极易与O2化合生成NO2)
工业上常用铜屑为原料制取硝酸铜,在实际生产中,需把浓硝酸用水稀释.试回答:
(1)为什么用稀硝酸而不用浓硝酸:______;
(2)从经济效益和环保角度考虑、设计制取硝酸铜的最适宜方法:某同学设想:先将铜屑______转化为黑色固体,再用______溶解;有关化学方程式为:2Cu+O2
2CuO△ .2Cu+O2,______.你认为他这种做法是否可以(简述理由)______.
2CuO△ . 海漂一男1年前1
海漂一男1年前1 -
 五岳寨 共回答了18个问题
五岳寨 共回答了18个问题 |采纳率100%解题思路:(1)根据用铜屑和浓硝酸、稀硝酸为原料制取硝酸铜分别生成了二氧化氮、一氧化氮,结合反应的化学方程式进行分析解答.
(2)根据铜能与氧气在加热的条件下生成氧化铜,氧化铜与硝酸反应生成硝酸铜和水,进行分析解答.(1)用铜屑和浓硝酸、稀硝酸为原料制取硝酸铜分别生成了二氧化氮、一氧化氮,都属于空气的污染气体,污染了环境;由反应的化学方程式可知:Cu~4HNO3(浓),3Cu~8HNO3(稀),制备等质量的硝酸铜时消耗的稀硝酸比浓硝酸少,节约了原料,产生污染空气的气体少.
(2)从经济效益和环保角度考虑、设计制取硝酸铜的最适宜方法是:先把铜和氧气在加热的条件下生成氧化铜,再利用氧化铜与稀硝酸反应生成硝酸铜和水,这样反应效率高,即节约了原料,又避免了污染;反应的化学方程式分别是2Cu+O2
△
.
2CuO、CuO+2HNO3═Cu(NO3)2+H2O.
故答案为:(1)稀硝酸生成硝酸铜的转化率高(或产生污染空气的气体少等,合理即可);
(2)与氧气反应,硝酸,2Cu+O2
△
.
2CuO;CuO+2HNO3═Cu(NO3)2+H2O;可以,反应效率高,不产生污染空气的气体.点评:
本题考点: 物质的相互转化和制备;金属的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度不大,掌握选择实验方案通常要考虑:是否操作简单、是否产生污染、是否节约能源等是正确解答此类题的关键.1年前查看全部
- 已知Cu+4HNO3(浓)==Cu(NO3)2+2NO2+2H2O,计算:若有3.2gCu被氧化,则反应消耗的硝酸和被还
已知Cu+4HNO3(浓)==Cu(NO3)2+2NO2+2H2O,计算:若有3.2gCu被氧化,则反应消耗的硝酸和被还原的硝酸的n为
 86003221年前2
86003221年前2 -
 moyan9 共回答了17个问题
moyan9 共回答了17个问题 |采纳率70.6%反应中,硝酸5价的N变成4价的NO2,所以被还原的硝酸和铜是1:2的关系,0.05mol铜反应,0.1mol硝酸被还原,根据化学式,消耗0.2mol硝酸.1年前查看全部
- 在反应Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O中:
在反应Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O中:
(1)该反应被氧化的元素______,被还原的元素______.(填元素符号)
(2)该反应中氧化剂为______,还原剂为______;氧化产物为______,还原产物为______.
(3)当该反应有32gCu被消耗,被消耗的HNO3的物质的量是______,被还原的HNO3的物质的量是______,转移的电子的物质的量是______.
(4)用单线桥法标出该反应的电子转移方向和数目:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O. pariah_guan1年前1
pariah_guan1年前1 -
 快乐大马车 共回答了19个问题
快乐大马车 共回答了19个问题 |采纳率84.2%解题思路:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O中,Cu元素的化合价升高,N元素的化合价降低,结合氧化还原反应基本概念来解答.(1)Cu元素的化合价升高,失去电子被氧化,N元素的化合价降低,得到电子被还原,故答案为:Cu;N;
(2)N元素的化合价降低,则HNO3为氧化剂,对应还原产物为NO2,Cu元素的化合价升高,则Cu为还原剂,对应氧化产物为Cu(NO3)2,
故答案为:HNO3;Cu;Cu(NO3)2;NO2;
(3)有32gCu被消耗,n(Cu)=[32g/64g/mol]=0.5mol,则被消耗的HNO3的物质的量是0.5mol×4=2mol,被还原的HNO3的物质的量是1mol,转移电子为0.5mol×(2-0)=1mol,故答案为:0.5mol;2mol;1mol;
(4)Cu失去电子,N得到电子,该反应转移2e-,则单线桥法标出该反应的电子转移方向和数目为 ,故答案为:
,故答案为: .
.点评:
本题考点: 氧化还原反应;硝酸的化学性质.
考点点评: 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.1年前查看全部
- 下列离子方程式正确的是( )A.Cu与浓硝酸反应:Cu+4HNO3(浓)=Cu2++2NO3-+2NO2↑+2H2OB
下列离子方程式正确的是( )
A.Cu与浓硝酸反应:Cu+4HNO3(浓)=Cu2++2NO3-+2NO2↑+2H2O
B.食醋溶解水垢中的碳酸钙:2CH3COOH+CaCO3=Ca2++2CH3COO-+H2O+CO2↑
C.氯化铝溶液中加入过量的氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O
D.向KAl(SO4)2 溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ Chancinderella1年前1
Chancinderella1年前1 -
 渔傲 共回答了14个问题
渔傲 共回答了14个问题 |采纳率100%A.Cu与浓硝酸反应的离子反应为Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,故A错误;
B.食醋溶解水垢中的碳酸钙的离子反应为2CH3COOH+CaCO3=Ca2++2CH3COO-+H2O+CO2↑,故B正确;
C.氯化铝溶液中加入过量的氨水的离子反应为Al3++3NH3•H2O=Al(OH)2↓+3NH4+,故C错误;
D.向KAl(SO4)2 溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全的离子反应为Al3++2SO42-+2Ba2++4OH-=AlO2-+2H2O+2BaSO4↓,故D错误;
故选B.1年前查看全部
- 下列反应中:(1)3Cl2+8NH3═6NH4Cl+N2;(2)Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O
下列反应中:
(1)3Cl2+8NH3═6NH4Cl+N2;
(2)Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O
(3)3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O;
(4)KClO3+6HCl═KCl+3Cl2↑+3H2O
其中氧化剂中只有[1/4]被还原的是( )
A.(1)、(4)
B.只有(3)
C.只有(2)
D.(1)(2)(3)(4) xircom1年前1
xircom1年前1 -
 倒影年华的梦 共回答了13个问题
倒影年华的梦 共回答了13个问题 |采纳率100%解题思路:氧化剂具有氧化性,在反应中得电子,所含元素化合价降低,结合反应的化学方程式计算.(1)反应3Cl2+8NH3═6NH4Cl+N2中Cl元素化合价降低,被还原,为氧化剂,全部被还原,故错误;
(2)反应Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O中,N元素化合价由+5价降低到+4价,被还原,由方程式可知氧化剂中只有[1/2]被还原,故错误;
(3)反应3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O中,N元素化合价由+5价降低到+2价,被还原,由方程式可知氧化剂中只有[1/4]被还原,故正确;
(4)反应KClO3+6HCl═KCl+3Cl2↑+3H2O中,只有Cl元素化合价发生变化,KClO3为氧化剂,全被还原,故错误.
故选B.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查氧化还原反应,侧重于学生的分析能力和计算能力的考查,为高频考点,注意从元素化合价的角度解答该题,难度不大.1年前查看全部
- 已知铜在常温下能被浓HNO3溶解,反应的化学方程式为Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O
已知铜在常温下能被浓HNO3溶解,反应的化学方程式为Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O
(1)标出上面反应中的电子转移情况.______
(2)反应中生成1mol NO2,则被还原HNO3的物质的量为______. 雪饮狂刀20081年前1
雪饮狂刀20081年前1 -
 langshou0531 共回答了24个问题
langshou0531 共回答了24个问题 |采纳率87.5%解题思路:Cu+4HN03==Cu(N03)2+2NO2↑+2H20中,Cu元素的化合价由 0升高为+2价,N元素的化合价由+5价降低为+4价,该反应中转移2mol电子,以此来解答.(1)Cu+4HN03═Cu(N03)2+2NO2↑+2H20中,Cu元素的化合价由 0升高为+2价,N元素的化合价由+5价降低为+4价,该反应中转移2mol电子,则电子转移的方向和数目为
 ,
,
故答案为: ;
;
(2)由反应可知,生成1mol气体就有1mol硝酸被还原,则反应中生成1mol NO2,则被还原HNO3的物质的量为1mol,
故答案为:1mol.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重电子转移及计算的考查,注意硝酸在反应中的两个作用,题目难度不大.1年前查看全部
- 铜与浓硝酸反应的化学方程式如下:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O将 3.2g铜完
铜与浓硝酸反应的化学方程式如下:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O将 3.2g铜完全溶于足量的 50mL 11.0mol•L-1 的浓硝酸中,只生成NO2气体,假设反应后溶液的体积仍为 50mL.试计算:
(1)反应后可生成标准状况下NO2气体多少L?(写计算过程)
(2)反应后溶液中NO3-物质的量浓度为______. 暗夜gg1年前1
暗夜gg1年前1 -
 yangamanda 共回答了20个问题
yangamanda 共回答了20个问题 |采纳率100%解题思路:(1)根据n=[m/M]计算铜的质量,再根据方程式计算生成的NO2的物质的量,根据V=nVm计算NO2的体积;
(2)根据氮元素守恒,反应后溶液中n(NO3-)=n原(HNO3)-n(NO2),再根据c=[n/V]计算.(1)3.2g铜的物质的量为[3.2g/64g/mol]=0.05mol,则:
Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O
1 2
0.05mol0.1mol
故NO2的体积为:0.1mol×22.4L/mol=2.24L,
答:生成的NO2的体积为2.24L;
(2)50mL 11.0mol•L-1 的浓硝酸中n(HNO3)=0.05L×11.0mol•L-1=0.55mol,
故反应后溶液中n(NO3-)=n原(HNO3)-n(NO2)=0.55mol-0.1mol=0.45mol,
故反应后溶液中c(NO3-)=[0.45mol/0.05L]=9mol/L,
故答案为:9mol/L.点评:
本题考点: 化学方程式的有关计算.
考点点评: 考查根据方程式的计算,难度不大,注意(2)中根据氮原子守恒的利用.1年前查看全部
- 已知Cu和HNO3可以发生如下反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3(
已知Cu和HNO3可以发生如下反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
已知22.4g铜与140mL一定浓度的硝酸恰好完全反应,产生的NO和NO2混合气体在标准状况下的体积为11.2L.试求:Cu和硝酸反应,被还原硝酸的物质的狼 以及生成No转移的电子的物质的量 , aiguozhe2001年前2
aiguozhe2001年前2 -
 lgmql113 共回答了21个问题
lgmql113 共回答了21个问题 |采纳率95.2%设生成的NO和NO2的物质的量分别为 x mol y mol
Cu+4HNO3(浓)=Cu(NO3)2 + 2NO2↑+2H2O
1 2
x/2 x
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
3 2
3y/2 y
x+y=11.2/22.4=0.5
x/2 + 3y/2=22.4/64=0.35
x=0.375mol
y=0.125mol
被还原的硝酸的物质的量=0.5mol
生成NO转移的电子数=0.125*3=0.375mol1年前查看全部
- 铜与浓硝酸可发生反应:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O,其中铜被______(填“氧化”或
铜与浓硝酸可发生反应:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O,其中铜被______(填“氧化”或“还原”),浓硝酸作______(填“氧化”或“还原”)剂.在该反应中,若消耗了1mol Cu,则生成______mol NO2.
 xiebbs1年前1
xiebbs1年前1 -
 19700219 共回答了16个问题
19700219 共回答了16个问题 |采纳率81.3%解题思路:该反应中,铜元素化合价由0价变为+2价、N元素化合价由+5价变为+4价,失电子化合价升高的反应物被氧化,得电子化合价降低的反应物是氧化剂,根据铜和二氧化氮之间的关系式计算.该反应中,铜元素化合价由0价变为+2价、N元素化合价由+5价变为+4价,所以硝酸是氧化剂、Cu是还原剂,还原剂被氧化,所以Cu被氧化,在该反应中,根据Cu和二氧化氮之间的关系式知,若消耗了1mol Cu,则生成2mol NO2,故答案为:氧化;氧化;2.
点评:
本题考点: 氧化还原反应.
考点点评: 本题考查了氧化还原反应,根据化学反应中元素化合价变化结合基本概念来分析解答,注意结合方程式进行计算,题目难度不大.1年前查看全部
- 铜既能与稀硝酸反应,也能与浓硝酸反应,反应方程式为:Cu+4HNO3(浓)→Cu(NO3)2+2NO2↑+2H2O;
铜既能与稀硝酸反应,也能与浓硝酸反应,反应方程式为:Cu+4HNO3(浓)→Cu(NO3)2+2NO2↑+2H2O;
3Cu+8HNO3(稀)→3Cu(NO3)2↑+2NO+4H2O.
现将25.6g Cu投入50mL 12mol/L的浓硝酸中,充分反应后,收集到4.48L(标准状态)NO和NO2的混合气体.
(1)被还原硝酸的物质的量是______;
(2)判断25.6g Cu和50mL 12mol/L的硝酸反应后何者有剩余?______,其物质的量是______;
(3)如果4.48L(标准状态)NO和NO2的混合气体是通过排水法进行收集,则收集到的气体的体积是______L气体(标准状态);
(4)如果往反应后的体系内再加入200mL 4mol/L的稀硫酸,又会产生______ L气体(标准状态). xxwsz10231年前1
xxwsz10231年前1 -
 巴巴子 共回答了25个问题
巴巴子 共回答了25个问题 |采纳率88%解题思路:(1)根据氮原子守恒计算被还原的硝酸的物质的量;
(2)先根据硝酸的总量计算起酸作用的硝酸的物质的量,根据酸和铜的物质的量的关系判断哪种物质过量;根据铜原子守恒计算参加反应的铜的物质的量;
(3)先根据得失电子守恒计算一氧化氮和二氧化氮的物质的量,再根据二氧化氮和水的反应计算二氧化氮转化为一氧化氮的物质的量,总的一氧化氮的体积即为收集到的气体的体积;
(4)当向反应后的溶液 加稀硫酸后,溶液又有硝酸了,所以剩余的铜又和稀硝酸反应生成一氧化氮,先根据硝酸和铜的物质的量判断铜是否过量,然后根据不足量的物质计算生成一氧化氮气体的体积.(1)4.48L(标准状态)NO和NO2的混合气体的物质的量=[4.48L/22.4mol/L]=0.2mol,无论硝酸被还原成一氧化氮还是二氧化氮,根据氮原子守恒知,被还原的硝酸与气体物质的量之比为1:1,所以被还原的硝酸的物质的量是0.2mol,故答案为0.2mol;
(2)25.6g Cu的物质的量=[25.6g /64g/mol=0.4mol,50mL 12mol/L的硝酸的物质的量=12mol/L×0.05L=0.6mol,由(1)知被还原的硝酸的物质的量是0.2mol,所以剩余硝酸0.6mol-0.2mol=0.4mol,如果铜完全被氧化成铜离子,生成硝酸铜需要硝酸的物质的量(起酸作用的硝酸的物质的量)为0.4mol×2=0.8mol>0.4mol,所以铜剩余.
根据铜原子守恒得,铜被氧化的物质的量=
1
2]起酸作用的硝酸的物质的量=[1/2×0.4mol=0.2mol,所以还剩余铜0.4mol-0.2mol=0.2mol.
故答案为:铜;0.2mol;
(3)设一氧化氮的物质的量为xmol,二氧化氮的物质的量为ymol.
(x+y)mol×22.4L/mol=4.48L,x+y=0.2mol①
根据氧化还原反应中得失电子守恒知,铜失电子的物质的量0.2mol×2=0.4mol,氮原子的得电子的物质的量为3x+1y=0.4mol,
x+y=0.2mol
3x+1y=0.4mol]
x=0.1mol
y=0.1mol
所以混合气体中二氧化氮和一氧化氮的体积都是2.24L.
3NO2+H2O=2HNO3+NO
3mol 1mol
0.1mol[1/30]mol
所以最后收集的气体体积为(0.1+[1/30])mol×22.4L/mol=2.99L,
故答案为:2.99L;
(4)当向反应后的溶液中加稀硫酸后,溶液相当于又变成硝酸溶液,根据铜和稀硝酸反应的方程式计算生成气体的体积,
根据(2)知,硝酸的物质的量为0.4mol,铜的物质的量为0.2mol,根据铜和稀硝酸反应的方程式知,
3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O
32 44.8L
0.2mol [2/15]mol2.99L
[2/15]mol<0.4mol,所以硝酸过量,
根据铜和硝酸的反应方程式知,生成气体的点评:
本题考点: 氧化还原反应的计算;硝酸的化学性质.
考点点评: 本题考查了氧化还原反应的有关计算,难度较大,注意:如果题目中告诉两种反应物的量,要进行过量计算,然后根据不足量的物质为标准进行计算.1年前查看全部
- 已知Cu+4HNO3(浓)==Cu(NO3)2+2NO2+2H2O,现将足够的浓硝酸与铜发生应,结果生成NO2,气体的体
已知Cu+4HNO3(浓)==Cu(NO3)2+2NO2+2H2O,现将足够的浓硝酸与铜发生应,结果生成NO2,气体的体积为4.48L

 jamespan20041年前1
jamespan20041年前1 -
 水漪清荷 共回答了21个问题
水漪清荷 共回答了21个问题 |采纳率95.2%Cu+4HNO3(浓)=Cu(NO3)2+2NO2+2H2O
m(Cu)=64*4.48/(2*22.4)=6.4g
n(HNO3)=4.48/22.4=0.2mol
c=0.1/0.5=0.2mol/L1年前查看全部
- 现要制取一些二氧化氮气体来做演示分子运动的实验.已知二氧化氮气体可以通过铜和浓硝酸反应Cu+4HNO3(浓)═Cu(NO
现要制取一些二氧化氮气体来做演示分子运动的实验.已知二氧化氮气体可以通过铜和浓硝酸反应Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O得到.二氧化氮是一种红棕色的气体,密度比空气大,能和水反应生成HNO3和NO气体,NO和NO2都是大气污染物.现给出下列装置(A~F):

(1)写出二氧化氮和水反应的化学方程式______;
(2)制二氧化氮的发生装置可以选______,收集二氧化氮的装置应该选______;
(3)要得到干燥的二氧化氮可将其通过______;E装置中NaOH溶液的作用是______.
(4)NO一遇到O2就会变成NO2,收集NO应用______法;
(5)用如图F装置演示分子运动时,为了缩短演示的时间,NO2最好放在______(选填“上”或“下”)面的集气瓶中,另一瓶是空气,抽去两瓶之间的玻璃片,可以看到______. 新编游戏规则1年前1
新编游戏规则1年前1 -
 abcdb 共回答了22个问题
abcdb 共回答了22个问题 |采纳率86.4%解题思路:(1)依据反应物、生成物、反应条件写出反应的化学方程式;
(2)发生装置主要由反应物的状态和反应条件决定;收集装置主要由气体的密度和溶水性决定;
(3)常用的干燥剂一般有浓硫酸、固体氢氧化钠等;
(4)气体的收集装置主要由气体的密度和溶水性决定,另外还要考虑气体是否有毒、是否与空气反应、是否与水反应等等;
(5)从分子的性质进行分析.(1)二氧化氮和水反应生成硝酸和一氧化氮;
(2)反应物的状态是固态和液态,反应条件是常温,应选固-液不加热型的发生装置;二氧化氮是空气污染物,不能用排空气法收集,二氧化氮和水反应,不能用排水法收集,可用E装置收集;
(3)浓硫酸具有吸水性,可用来干燥二氧化氮;氢氧化钠溶液可以吸收多余的二氧化氮,防止污染空气;
(4)一氧化氮会与空气中的氧气发生反应,还会污染空气,不能用排空气法收集,一氧化氮难溶于水,可用排水法收集;
(5)一切物质的分子都在不停的运动,将密度大的气体放在上面,密度小的气体放在下面会加快分子运动的速度;
故答案为:(1)B;E(2)3NO+H2O=2HNO3+NO(3)浓硫酸(4)排水(5)上;红综色气体飘下,最终两个瓶子中充满了红棕色气体.(1)
(1)3NO2+H2O═2HNO3+NO;
(2)B;E;
(3)浓硫酸;吸收NO2,防止大气污染;
(4)排水;
(5)上;上面集气瓶中红棕色气体向下面集气瓶扩散直到均匀混合.点评:
本题考点: 常用气体的发生装置和收集装置与选取方法.
考点点评: 本题能很好的考查学生对装置选取的掌握和应用,要收集一种既有毒又与水发生反应的气体时,应用排空气法收集,后面再加一个尾气处理装置.1年前查看全部
- 已知Cu+4HNO3(溶)=Cu(NO3)2+2NO2+2H2O.现将足够的溶销酸与铜反应,结果生成NO2气体的体积为4
已知Cu+4HNO3(溶)=Cu(NO3)2+2NO2+2H2O.现将足够的溶销酸与铜反应,结果生成NO2气体的体积为4.48L
试求
(1)参加反应铜的质量
(2)被还原的销酸铜的物质的量
(3)将得到的溶酸稀释到500ml,求溶液中Cu(NO3)2的物质的量的溶度 猫咪的ww1年前2
猫咪的ww1年前2 -
 liuchuang008 共回答了20个问题
liuchuang008 共回答了20个问题 |采纳率90%1.6.4g
NO2的物质的量是n=V/Vm=4.48/22.4=0.2mol
Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O
1 4 1 2
x y z 0.2mool
x=0.1mol
y=0.4mol
z=0.1mol
参加反应的Cu的质量是m=nM=0.1*64=6.4g
2.0.2mol
4个HNO3中只有2个被还原为NO2,被还原的硝酸占1/2,所以被还原的硝酸的物质的量是0.4*1/2=0.2mol
3.0.2mol/L
Cu(NO3)2的浓度是c=n/V=0.1/0.5=0.2mol/L1年前查看全部
- 已知:Cu+4HNO3(浓)==Cu+(NO3)2+2NO2+4H2O.现有38.4mg铜跟适量的浓硝酸反应,铜全部作用
已知:Cu+4HNO3(浓)==Cu+(NO3)2+2NO2+4H2O.现有38.4mg铜跟适量的浓硝酸反应,铜全部作用时,共收集到气体22.4ml(标准状况),则反应消耗HNO3的物质的量为多少?
 fofun11年前1
fofun11年前1 -
 xiaobaozhuzhu 共回答了15个问题
xiaobaozhuzhu 共回答了15个问题 |采纳率80%先把数据扩大1000倍(比较好算)38.4gCun(Cu)=0.6mol设生成n(NO2)=X n(N0)=Y生成NO,HNO3得3各电子,生成NO2,HNO3得1各电子Cu失0.6*2mol电子电子守恒X+3Y=1.2气体的物质量为1molX+Y=1X=0.9mol Y=0.1mol6Cu+22HNO3=6Cu(...1年前查看全部
- 已知:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+4H2O 现有38.4mg铜跟适量的浓硝酸反应,铜全部作用时
已知:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+4H2O 现有38.4mg铜跟适量的浓硝酸反应,铜全部作用时,共收集到气体22.4mol(标准状况).则反应消耗HNO3的物质的量为多少?
 cqryan1年前1
cqryan1年前1 -
 爱娜永不改变 共回答了10个问题
爱娜永不改变 共回答了10个问题 |采纳率90%CU+4HNO3(浓)=CU(NO3)2+2NO2↑+4H2O
3CU+8HNO3(稀)=3CU(NO3)2+2NO↑+4H2O
由于反应的进行~!HNO3由 浓→稀
(1)CU+4HNO3(浓)=CU(NO3)2+2NO2↑+4H2O
1--- 4 ------------------2
X----4X------------------2X
(2)3CU+8HNO3(稀)=3CU(NO3)2+2NO↑+4H2O
3 8 2
Y 8Y/3 2y/3
x+y=0.0384/64=0.0006mol
2x+2y/3=0.0224/22.4=0.001mol
x=0.00045
y=0.00015
n(HNO3)=4x+8Y/3=0.0018+0.0004= 0.0022mol1年前查看全部
- 在Cu+4HNO3(浓)==Cu(NO3)2+NO2+2H2O反应中,若有32g铜被氧化,则被还原的HNO3的质量是多少
在Cu+4HNO3(浓)==Cu(NO3)2+NO2+2H2O反应中,若有32g铜被氧化,则被还原的HNO3的质量是多少?
如题 商务神灯1年前1
商务神灯1年前1 -
 tutugege 共回答了12个问题
tutugege 共回答了12个问题 |采纳率91.7%HNO3的物质的量为1摩尔,即质量为63g
这个很简单,上了高中就学了!1年前查看全部
- 有足量的浓硝酸与铜反应生成二氧化氮体积为4.48L(标准状况下),已知Cu+4HNO3(浓) =CU(NO3)2+2NO
有足量的浓硝酸与铜反应生成二氧化氮体积为4.48L(标准状况下),已知Cu+4HNO3(浓) =CU(NO3)2+2NO2↑+2...
有足量的浓硝酸与铜反应生成二氧化氮体积为4.48L(标准状况下),已知Cu+4HNO3(浓) =CU(NO3)2+2NO2↑+2H2O 1.参加反应的铜的量2.被还原的硝酸的物质的量3.将得到的溶液稀释到500mL,求溶液中Cu(NO3)2的物质量浓度 jiu_00741年前2
jiu_00741年前2 -
 gaoshancaoliu 共回答了20个问题
gaoshancaoliu 共回答了20个问题 |采纳率95%Cu+4HNO3(浓)=Cu(NO3)2+2NO2+2H2O
m(Cu)=64*4.48/(2*22.4)=6.4g
n(HNO3)=4.48/22.4=0.2mol
c=0.1/0.5=0.2mol/L1年前查看全部
- 反应Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O中,氧化剂是______(填化学式),若消耗了1mol
反应Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O中,氧化剂是______(填化学式),若消耗了1mol Cu,则生成NO2______mol.
 闲云X孤鹤1年前1
闲云X孤鹤1年前1 -
 没有名zi 共回答了18个问题
没有名zi 共回答了18个问题 |采纳率88.9%解题思路:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O中,N元素的化合价降低,由反应可知,1molCu反应生成2molNO2,以此来解答.由Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O可知,
HNO3中N元素的化合价由+5价降低为+4价,则HNO3为氧化剂,
由反应可知,1molCu反应生成2molNO2,
故答案为:HNO3;2.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,明确反应中N元素的化合价降低与氧化剂的概念即可解答,注意反应中化学计量数与物质的量成正比,题目难度不大.1年前查看全部
- Cu+4HNO3(浓)==Cu(NO3)2+2H2O+2NO2的还原剂是?还原产物是?氧化剂与氧化产
Cu+4HNO3(浓)==Cu(NO3)2+2H2O+2NO2的还原剂是?还原产物是?氧化剂与氧化产
物的量比是? hellorunrun1年前1
hellorunrun1年前1 -
 lxqui 共回答了18个问题
lxqui 共回答了18个问题 |采纳率88.9%还原剂是Cu ,还原产物是NO2
氧化剂是HNO3(浓)
氧化产物是Cu(NO3)2
氧化剂与氧化产物的量比是 2:11年前查看全部
- 已知Cu和HNO3可以发生如下反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3(
已知Cu和HNO3可以发生如下反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
已知22.4g铜与140mL一定浓度的硝酸恰好完全反应,产生的NO和NO2混合气体在标准状况下的体积为11.2L.试求:
(1)标准状况下NO和NO2的体积分别是多少?
(2)待产生的气体全部释放后,向溶液中加入2mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化为沉淀,所需NaOH溶液的体积是多少?
(1)设NO的体积为VL,NO2的体积为(11.2-V)L.因为铜与硝酸的反应是一个氧化还原反应,
根据题意及电子得失守恒,有:22.4g64g/mol×2=VL22.4L/mol×3+(11.2-V)L22.4L/mol×1,
解得:V=2.24L.即NO的体积为2.24L,则NO2的体积为11.2L-2.24L=8.96L,
这个步骤是怎么来的?求电子守恒那部求详细解释
还有这个步骤(2)当Cu2+全部转化成沉淀时,溶液中的溶质为NaNO3,因此,根据氮元素守恒,
HNO3的物质的量为:n(Na+)+n(NO)+n(NO2)=(22.4g64g/mol×2+11.2L22.4L/mol),
n(Na+)=0.7mol,
感激不尽! 旱不hh的鱼1年前2
旱不hh的鱼1年前2 -
 joycelin305 共回答了12个问题
joycelin305 共回答了12个问题 |采纳率100%就是Cu失去的电子要等於NO3-得到的电子,而1molNO得到3mol所以×3,1molNO2得到1mol电子所以×1.
第二问何必那麼麻烦?
64 2
22.4g n=0.7mol
不觉得这样更加快?不要理答案.1年前查看全部
- 在反应Cu+4HNO3(浓)=CU(NO3)2+2NO2+2H2O种,若有12.8克铜被氧化时,参加反应的硝酸质量是多少
在反应Cu+4HNO3(浓)=CU(NO3)2+2NO2+2H2O种,若有12.8克铜被氧化时,参加反应的硝酸质量是多少?被还原的硝酸质量是多少?生成NO2气体的质量是多少?越详细越好,谢啦)
 liuxin1212851年前2
liuxin1212851年前2 -
 14sqj0809 共回答了22个问题
14sqj0809 共回答了22个问题 |采纳率86.4%12.8g铜是0.2mol 所以参加反应的硝酸的物质的量为0.8mol,质量为50.4g,被还原的硝酸质量为参加反应的一半(另一半体现酸性)为25.2g,生成NO2气体的物质的量为0.4mol,质量为18.4g1年前查看全部
- 在Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O反应中,还原剂是______,若反应过程中转移1mol电
在Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O反应中,还原剂是______,若反应过程中转移1mol电子,生成的NO2在标准状况下的体积为______L.
 51228361年前1
51228361年前1 -
 bumptop 共回答了13个问题
bumptop 共回答了13个问题 |采纳率84.6%解题思路:在Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O反应中,Cu元素化合价升高,被氧化,Cu为还原剂,N元素化合价降低,被还原,硝酸为氧化剂,结合电子转移的数目解答该题.Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O反应中,Cu元素化合价升高,被氧化,Cu为还原剂,由方程式可知,N元素化合价由+5价降低到+4价,则反应过程中转移1mol电子,生成1molNO2,体积为22.4L,
故答案为:Cu;22.4.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高考常见题型和高频考点,侧重于学生的分析能力和计算能力的考查,注意从元素化合价的角度认识相关概念,判断相关物质的性质,难度不大.1年前查看全部
- 已知CU+4HNO3(浓)=CU(NO3)+2NO2+2H2O 现将足量的浓硝酸与铜发生反应 结果生成NMMNO2气体的
已知CU+4HNO3(浓)=CU(NO3)+2NO2+2H2O 现将足量的浓硝酸与铜发生反应 结果生成NMMNO2气体的体为4.48...
已知CU+4HNO3(浓)=CU(NO3)+2NO2+2H2O 现将足量的浓硝酸与铜发生反应 结果生成NMMNO2气体的体为4.48 求参加反应铜的质量()被还原的硝酸的物质的量(将得到的溶液稀释到500ml求溶液cu(no3)2的物质的量浓度 A3161年前1
A3161年前1 -
 在那片天空下 共回答了20个问题
在那片天空下 共回答了20个问题 |采纳率95%Cu+4HNO3(浓)=Cu(NO3)2+2NO2+2H2O
m(Cu)=64*4.48/(2*22.4)=6.4g
n(HNO3)=4.48/22.4=0.2mol
c=0.1/0.5=0.2mol/L1年前查看全部
- Cu+4HNO3(浓)=Cu(NO3)2+2NO2+2H2O 生成的NO2为什么不与H2O反应
 feixue1023261年前3
feixue1023261年前3 -
 tgp168 共回答了19个问题
tgp168 共回答了19个问题 |采纳率84.2%就像 小fate侠 所说 反应放热 气体逸出 并且收集气体时要用向上排空气法 然而即使少量no2会与水反应是放热 二氧化氮溶于水后并不会完全反应所以会有少量二氧化氮分子存在,为黄色. 因此硝酸溶液会呈现黄色.这个反应可以认为其为可逆反应,因为硝酸同时会分解 那么加上cu与HNO3反应放出热量使其反应逆向移动 因此可认为不反应1年前查看全部
- 铜和浓硝酸的反应Cu+4HNO3(浓)====Cu(NO3)2+2NO2↑+2H2O 这是反应方程式,那NO2与HNO3
铜和浓硝酸的反应
Cu+4HNO3(浓)====Cu(NO3)2+2NO2↑+2H2O
这是反应方程式,那NO2与HNO3的物质的量之比应该为1:2呀,为何不是?
ps:根据质量守恒,何以求出物质的量之比,这我会.请回答上面的问题就ok了,3Q了~ 左右KINKIN1年前1
左右KINKIN1年前1 -
 bingqier 共回答了20个问题
bingqier 共回答了20个问题 |采纳率85%这是浓硝酸与铜的反应方程式,如果浓硝酸与铜反应之后变稀了就不发生这个反应了,将发生铜与稀硝酸反应:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O 也就是说你要想保证一直能进行铜与浓硝酸的反应就要保证反应后剩余液中的硝酸也是浓的才行.从这个角度上说NO2与HNO3的物质的量之比为应小于1:2.1年前查看全部
- 在Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O的反应中,作为氧化剂的物质是______(填化学式),发
在Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O的反应中,作为氧化剂的物质是______(填化学式),发生了氧化反应的物质是______(填化学式);若反应中生成了 1mol NO2,则需消耗______mol浓HNO3.
 乌贼吃章鱼1年前1
乌贼吃章鱼1年前1 -
 yanfang07 共回答了18个问题
yanfang07 共回答了18个问题 |采纳率100%解题思路:在Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O的反应中,N元素化合价由+5价降低到+4价,被还原,HNO3为氧化剂,Cu元素化合价由0价升高到+2价,被氧化,Cu为还原剂,结合元素化合价的变化解答该题.在Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O的反应中,N元素化合价由+5价降低到+4价,被还原,HNO3为氧化剂,Cu元素化合价由0价升高到+2价,被氧化,
由方程式可知,若反应生成2molNO2,则消耗4mol浓HNO3,所以若反应中生成了 1mol NO2,则需消耗2mol浓HNO3.
故答案为:HNO3;Cu;2.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高考高频考点,侧重于学生的分析能力和计算能力的考查,注意从元素化合价的角度认识相关概念、判断物质具有的性质,难度不大.1年前查看全部
- 在Cu+4HNO3(浓)==Cu(NO3)2+NO2+2H2O反应中,若有32g铜被氧化,则被还原的HNO3的物质的量是
在Cu+4HNO3(浓)==Cu(NO3)2+NO2+2H2O反应中,若有32g铜被氧化,则被还原的HNO3的物质的量是多少?
 邓肯的弟弟1年前2
邓肯的弟弟1年前2 -
 zzzwbd520 共回答了27个问题
zzzwbd520 共回答了27个问题 |采纳率92.6%被还原的HNO3指的是生成NO2的HNO3
.1.2
32/64=0.5mol.x
x=1mol1年前查看全部
- 用双线桥法分析氧化还原反应:Cu+4HNO3(浓)==Cu(NO3)2+2NO2(气体)+2H2O
用双线桥法分析氧化还原反应:Cu+4HNO3(浓)==Cu(NO3)2+2NO2(气体)+2H2O
该反应中氧化剂和氧化产物的物质的量之比是( ) 清音袅雅1年前2
清音袅雅1年前2 -
 艾伶 共回答了20个问题
艾伶 共回答了20个问题 |采纳率100%HNO3中 N为+5价 一部分N被还原生成+4价的NO2 这一部分的硝酸为氧化剂,另一部分表现出酸性 即提供Cu(NO3)2中的硝酸根 所以 氧化剂为浓硝酸中的一部分 氧化产物为Cu(NO3)2 比值为
2:11年前查看全部
- 下列有三种制取硝酸铜的方案:下列有三种制取硝酸铜的方案:方案一:Cu+4HNO3(浓) = Cu(NO3)2 + 2NO
下列有三种制取硝酸铜的方案:
下列有三种制取硝酸铜的方案:
方案一:Cu+4HNO3(浓) = Cu(NO3)2 + 2NO2↑+ 2H2O
方案二:3Cu+8HNO3(稀) = 3Cu(NO3)2 + 2 NO↑+ 4H2O
方案三:2Cu+O2+4HNO3(稀) = 2Cu(NO3)2+ 2H2O
请你从经济、环保的角度分析考虑选择一种最适宜的方案 ,你选择该方案而不选其它方案的理由 写两点 lchenf1年前1
lchenf1年前1 -
 xue0457300 共回答了21个问题
xue0457300 共回答了21个问题 |采纳率76.2%选方案三,因为方案三在制得相同的硝酸铜时消耗的原料硝酸最少,也没有产生污染气体.比如要得到6mol的硝酸铜.方案三只需12mol硝酸,方案一要24mol硝酸,还产生污染气体2NO2↑,方案二要16mol的硝酸,也产生了污染气体 NO.所以方案三最好!1年前查看全部
- Cu+4HNo3(浓)==Cu(NO3)2+2NO2+2H2O
Cu+4HNo3(浓)==Cu(NO3)2+2NO2+2H2O
1还原剂 还原产物 氧化剂 氧化产物 各是什么
2.氧化剂与氧化产物物质的量之比是多少
3.当有2MolHNO3被还原时 被氧化的物质的质量为多少?反应中转移的电子数为多少 zamcckbr1年前3
zamcckbr1年前3 -
 木_我是dd 共回答了15个问题
木_我是dd 共回答了15个问题 |采纳率86.7%1、还原剂 Cu; 还原产物 NO2; 氧化剂 HNO3; 氧化产物 Cu(NO3)2
2、上述方程式中,4个分子的HNO3中,只有2个分子作为氧化剂,其他2个未参加氧化还原反应
所以氧化剂与氧化产物物质的量的比为 2:1
3、2mol HNO3被还原,则Cu的物质的量为 1mol,质量为 64g
转移的电子数为 2mol,数量为 2Na1年前查看全部
- 二氧化氮气体可以通过下面反应制取:Cu+4HNO3(浓)=Cu(NO3)2+2H2O+2NO2↑.二氧化氮是一种红棕色气
二氧化氮气体可以通过下面反应制取:Cu+4HNO3(浓)=Cu(NO3)2+2H2O+2NO2↑.二氧化氮是一种红棕色气体,密度比空气大,能和水反应生成硝酸和NO.NO和NO2都是空气的污染物.现给出下列装置(A-F):

(1)制取二氧化氮的发生装置和收集装置应分别选用上述哪些装置?
(2)写出二氧化氮和水反应的化学方程式.
(3)NO遇到氧气就会变成NO2,如何收集NO?
(4)用上图F演示分子运动时,为了缩短演示实验的时间,NO2最好放在______(选填“上”或“下”)面的集气瓶中,另一瓶是空气,抽去两瓶之间的玻璃片,可以看到什么现象? 贾柳春1年前1
贾柳春1年前1 -
 19734205206 共回答了19个问题
19734205206 共回答了19个问题 |采纳率89.5%解题思路:(1)根据制取二氧化氮的反应物的状态、反应条件、二氧化氮的性质可以选择发生装置和收集装置;
(2)根据反应物、生成物、反应条件及其质量守恒定律可以书写反应的化学方程式;
(3)根据一氧化氮的性质可以选择收集的方法;
(4)微观粒子是不断运动的,密度越大的气体,运动的越慢,密度越小的气体,运动的越快.(1)利用铜和浓硝酸反应制取二氧化氮不需要加热,应该用B装置作为发生装置;
二氧化氮的密度比空气大,可以用向上排空气法收集,二氧化氮有毒,扩散到空气中会污染环境,为了防止二氧化氮污染环境,可以用氢氧化钠溶液吸收二氧化氮气体,即用E装置收集二氧化氮较好.
由分析可知,制取二氧化氮的发生装置和收集装置应分别选用B、E装置.
(2)二氧化氮和水反应的化学方程式为:3NO2+H2O═2HNO3+NO.
(3)一氧化氮能和空气中的氧气反应,所以不能用排空气法收集,一氧化氮难溶于水,可以用排水法收集.
(4)因为二氧化氮的密度比空气大,所以二氧化氮比空气运动的慢,为了缩短演示实验的时间,二氧化氮最好放在上面的集气瓶中.
故填:上.
抽去两瓶之间的玻璃片,能够观察到:红棕色气体向下扩散,最后两个集气瓶中的气体都变成红棕色.点评:
本题考点: 常用气体的发生装置和收集装置与选取方法;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要考查装置的选择、化学方程式的书写,选择发生装置时,要考虑反应物的状态、反应条件等因素;选择收集装置时,要考虑气体的水溶性、密度、能否和空气中的物质发生化学反应等因素.1年前查看全部
- 已知:Cu+4HNO3(浓)==Cu+(NO3)2+2NO2+4H2O.现有38.4mg铜跟适量的浓硝酸反应,铜全部作用
已知:Cu+4HNO3(浓)==Cu+(NO3)2+2NO2+4H2O.现有38.4mg铜跟适量的浓硝酸反应,铜全部作用时,共收集到气体22.4ml(标准状况),则反应消耗HNO3的物质的量为多少?
 petrasssbvv1年前2
petrasssbvv1年前2 -
 晓晓草_L 共回答了15个问题
晓晓草_L 共回答了15个问题 |采纳率86.7%浓硝酸在反映过程中会慢慢变稀,那方程式就不是这个了,生成的就有一氧化氮,又有二氧化氮,答案应该是一个范围
假设铜全部与浓硝酸反应,则根据反应Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,可求得消耗的HNO3为2.4×10-3mol 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,可求得消耗的HNO3的物质的量为1.6×10-3mol;而实际上铜既与浓硝酸反应,又与稀硝酸反应,则反应消耗的HNO3的物质的量介于1.6×10-3mol与2.4×10-3mol之间,1年前查看全部
- 下列离子方程式正确的是( )A.Cu与浓硝酸反应:Cu+4HNO3(浓)=Cu2++2NO3-+2NO2↑+2H2OB
下列离子方程式正确的是( )
A.Cu与浓硝酸反应:Cu+4HNO3(浓)=Cu2++2NO3-+2NO2↑+2H2O
B.食醋溶解水垢中的碳酸钙:2CH3COOH+CaCO3=Ca2++2CH3COO-+H2O+CO2↑
C.氯化铝溶液中加入过量的氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O
D.向KAl(SO4)2 溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ lihuahui1年前1
lihuahui1年前1 -
 D-579915025 共回答了17个问题
D-579915025 共回答了17个问题 |采纳率105.9%解题思路:A.硝酸为强酸、完全电离;
B.反应生成醋酸钙、二氧化碳、水;
C.反应生成氢氧化铝和氯化铵;
D.至SO42-恰好沉淀完全,以1:2反应.A.Cu与浓硝酸反应的离子反应为Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,故A错误;
B.食醋溶解水垢中的碳酸钙的离子反应为2CH3COOH+CaCO3=Ca2++2CH3COO-+H2O+CO2↑,故B正确;
C.氯化铝溶液中加入过量的氨水的离子反应为Al3++3NH3•H2O=Al(OH)2↓+3NH4+,故C错误;
D.向KAl(SO4)2 溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全的离子反应为Al3++2SO42-+2Ba2++4OH-=AlO2-+2H2O+2BaSO4↓,故D错误;
故选B.点评:
本题考点: 离子方程式的书写.
考点点评: 本题考查离子反应书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、复分解反应的离子反应考查,选项D为易错点,题目难度不大.1年前查看全部
- NO2是一种有毒易溶于水的红棕色气体,实验室制取NO2的原理是:Cu+4HNO3(浓) △
NO2是一种有毒易溶于水的红棕色气体,实验室制取NO2的原理是:Cu+4HNO3(浓)
Cu(NO3)2+2H2O+2NO2↑. 据此回答下列问题:△ .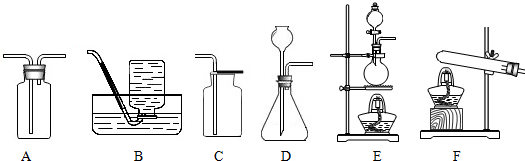
(1)任意写出上面装置中四种仪器的名称:a______ b______ c______ d______
(2)制取NO2的发生装置选择______,收集装置选择______ (填代号)
(3)装置F除了用来制取氧气外,还可以用来______. 城市小骆驼1年前1
城市小骆驼1年前1 -
 西子风流 共回答了21个问题
西子风流 共回答了21个问题 |采纳率90.5%解题思路:(1)要熟悉各种仪器的名称、用途和使用方法;
(2)根据制取气体的反应物状态、反应条件、气体的性质可以选择发生装置和收集装置;
(3)同种装置可以完成不同内容的实验.(1)B是水槽,常用于排水法收集气体;C是集气瓶,常用来收集气体;D是锥形瓶,常用作反应容器;E是铁架台,常用于固定、支持实验装置.
故填:B是水槽;C是集气瓶;D是锥形瓶;E是铁架台.
(2)制取二氧化氮时需要加热,反应物是固体和液体,应该用E装置作为发生装置;
二氧化氮易溶于水,不能用排水法收集,密度比空气大,可以用向上排空气法收集,为了尽可能地防止二氧化氮向外扩散,最好用A装置收集.
故填:E;A.
(3)装置F除了用来制取氧气外,还可以用来完成炭还原氧化铜实验.
故填:完成炭还原氧化铜实验.点评:
本题考点: 常用气体的发生装置和收集装置与选取方法;常用仪器的名称和选用.
考点点评: 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.1年前查看全部
大家在问
- 124点3 4 -6 -10 怎么样组成24?
- 2动物与植物之间的关系是什么?就是四年级下语文练习册的39页第三题
- 3两圆的周长和是75.36cm,大圆的周长是小圆的3倍,求两圆的面积(五年级
- 4已知F(X)=∫sin(x^2)dx ,求dF(x^2)=?我算了半天结果算了个2xsin(x^2),但是自己感觉不对~
- 5简算14.8×6.3-6.3×6.5+8.3×3.7要有解题思路
- 6以《做事情要做好充分准备》为题目写一篇不少于800字的议论文
- 7英文中5位数怎么读?例如68500(用英文单词拼出来)
- 8(2008•上杭县)把长4厘米,宽3厘米的长方形纸片剪去一个最大的正方形,剩下的面积比原来减少了______%.
- 9小芳喜欢喂金鱼爸爸准备买一个,长8dm,宽5dm,高4.5dm金鱼水缸.需要多少平方分米的玻璃?
- 10英语翻译家贫多故,二十七方从乡试.既第之后,虽专于科试,亦不废诗.及授校书郎时,已盈三四百首,或出示交友如足下辈,见皆谓
- 11急求能提高阅读水平和写作能力的书籍,可以是某些散文合集且旁有赏析评注的,.
- 12人的肌肉细胞中有23对染色体,那人的神经细胞中有多少条染色体?
- 13一个等腰梯形上底长a米,下底长b米,腰长c米.这个梯形的周长是( )米.
- 14以我和什么的约定为题目的作文
- 15我认为用英语写日记很有用.英语翻译这句话
