NH4+ 价层电子对数1.NH4+ 离子的价层电子对数 如何计算?公式里的每个配位原子提供的价电子数*配位原子个数这两个
 梦想在行动2022-10-04 11:39:541条回答
梦想在行动2022-10-04 11:39:541条回答
NH4+ 价层电子对数
1.NH4+ 离子的价层电子对数 如何计算?
公式里的每个配位原子提供的价电子数*配位原子个数
这两个值分别的是多少?4*1还是3*1 为什么?
2.为什么离子的价层电子对数要加(减)离子带的电荷数?
举例:
NH4+ 中心原子的西格玛键电子对数是4 孤电子对数是0 如果再减去所带电荷数1的话 价层电子对数不就成了3了吗?
不要复制公式......看清楚我问的问题
1.NH4+ 离子的价层电子对数 如何计算?
公式里的每个配位原子提供的价电子数*配位原子个数
这两个值分别的是多少?4*1还是3*1 为什么?
2.为什么离子的价层电子对数要加(减)离子带的电荷数?
举例:
NH4+ 中心原子的西格玛键电子对数是4 孤电子对数是0 如果再减去所带电荷数1的话 价层电子对数不就成了3了吗?
不要复制公式......看清楚我问的问题

已提交,审核后显示!提交回复
共1条回复
 荒村沽酒 共回答了21个问题
荒村沽酒 共回答了21个问题 |采纳率90.5%- 你对公式的研究不够深入:
NH4+ (5+4*1-1)/2=4 ,不存在4*1还是3*1 的问题!
SO32-比SO3 多两个电子,当然空间结构也会不同.
是先算出电子总数,在根据分子离子带电情况,从总数中减去或加上有关电子数. - 1年前
相关推荐
- 急急急,本科无机化学题,悬赏根据实验测得的有效磁矩,判断下列各配离子的中心离子价层电子排布,中心离子的杂化类型,配离子是
急急急,本科无机化学题,悬赏
根据实验测得的有效磁矩,判断下列各配离子的中心离子价层电子排布,中心离子的杂化类型,配离子是内轨型还是外轨型,以及配离子空间构型。 (1)【CO(NH3)6] 2+ 3.88uB (2)Cd(CN)4 2- u=0
2+和2-是价位,不好打,所以。。。
高悬赏,着急
 欧阳炯1年前2
欧阳炯1年前2 -
 费小炯 共回答了17个问题
费小炯 共回答了17个问题 |采纳率94.1%(1)3个成单电子,3d7 sp3d2 外轨 八面体
(2)无成单电子,4d10 sp3 外轨,四面体1年前查看全部
- 价层电子对是什么例如一个主族元素,价层电子对相当于是在最外电子层中成对存在的电子 这是我的理解
 没有后悔药吃1年前1
没有后悔药吃1年前1 -
 邓见华 共回答了22个问题
邓见华 共回答了22个问题 |采纳率90.9%错
价层电子对综合考虑了中心原子的价电子数以及配位原子提供的电子数和整个微粒带的电荷数.
价层电子对数是用来判断分子构型的依据,同一原子与不同原子结合,其价层电子对数都不同.
例如PCl3,价层电子对数为4,而PCl5的价层电子对数为51年前查看全部
- 运用价层电子对理论解答的一道填空题
运用价层电子对理论解答的一道填空题
现有下列9种物质:BiF5,CO2 ,PCl3 ,OF2,HCHO,H3O+,SF6
1,分子中有π键,又是极性分子的是——;
2中心原子以sp3杂化轨道成键,分子或离子的空间几何构型为V型的是——;
3,中心离子以sp3d轨道成键,分子或离子的空间几何构型为变形四面体的是——;
4中心原子价层电子对空间分布为八面体构型,分子或离子空间几何构型为四方锥(题目这个看不清,可能是四角锥)的是——;
我第一个问觉得是OF2;
第二个填H3O+,OF2;
第三个填BiF5;
第四个还没搞明白...
请哪位同学指导...给出个完整的答案,比较复杂的结构请简要说明理由. spring391年前1
spring391年前1 -
 mc__chan 共回答了20个问题
mc__chan 共回答了20个问题 |采纳率80%1、是HCHO
单键中没有π键,所以只有CO2 、 HCHO含π键,其中只有HCHO是极性分子
2、是OF2
分子中价电子总数=6+1*2=8,所以是sp3杂化,三原子为v型
3、是BiF5
sp3d杂化轨道数是5,所以成键数为5,只有BiF5符合
4、是SF6
八面体构型配位数是6,所以只有SF61年前查看全部
- 价层电子排布啥叫价层电子,如何写价层点子,比如112号元素,77号元素,33号元素,的价层电子怎么写,是只写最外能层中的
价层电子排布
啥叫价层电子,如何写价层点子,比如112号元素,77号元素,33号元素,的价层电子怎么写,是只写最外能层中的各能级还是依据其他什么原则 开心11281年前1
开心11281年前1 -
 HYMMY 共回答了11个问题
HYMMY 共回答了11个问题 |采纳率90.9%价电子,简单理解就是影响化合价的电子,所以,
主族元素的价电子,就是最外层电子
过渡元素的价电子,除了最外层电子之外,还可以是次外层甚至是倒数第三层的电子
对照周期表,可以发现,
d区元素的价电子包括最外层电子,还有次外层上的d电子
f区元素,甚至倒数第三层上的f电子也可以是价电子
ds区的IB族元素价电子包括最外层电子和次外层的d电子,而IIB元素的价电子则主要就是最外层的s电子
一般,我会要学生注意周期表中的上下递增关系,然后记忆2个关系:
一是,周期表从左到右的族的变化,IA、IIA、IIIB、IVB、VB、VIB、VIIB、VIII包括3个纵行、IB、IIB、IIIA、IVA、VA、VIA、VIIA、0;
第IA主族的核电荷数,H-1,Li-3,Na-11,K-19,Rb-37,Cs-55,Fr-87,下一个-119,
一般记住这几个就够了,
若给出一个不熟悉的,就和这几个对照,看在它们的后面还是前面,再推算具体的位置
112号,在119前第7个位置,所以从119倒推,处于第7周期IIB族,价电子是7s2
77号,在87号前第10个位置,处于第6周期第VIII族,价电子是5d7 6s2
33号,在37号前第4个,处于第4周期VA族,价电子4s2 4p31年前查看全部
- 怎样求离子的价层电子对数?我知道分子的是价层电子对数目=那个键对数+中心原子的孤对电子而中心原子的孤对电子=1\2(中心
怎样求离子的价层电子对数?
我知道分子的是
价层电子对数目=那个键对数+中心原子的孤对电子
而中心原子的孤对电子=12(中心原子的价电子数-n与中心原子结合的原子最多能接受的电子数)
我想知道类似CO2- SO3- 这样的离子或酸根离子怎样求价层电子对数目 路有冻kk骨11年前3
路有冻kk骨11年前3 -
 红香椿 共回答了15个问题
红香椿 共回答了15个问题 |采纳率73.3%先求孤电子对数,阴离子:a=中心原子最外层电子数+电荷数 阳离子:a=中心原子最外层电子数-电荷数 然后再用 孤电子对数=1/2(a-xb) 最后加上中心原子&(先代替一下哈)键的个数.例:CO32-:a=1/2(4+2-3×2)=0 &键数是3,所以价层电子对数是0+3=3 我这么说可以明白么?1年前查看全部
- 急……高中化学选修三,价层电子互斥理论
急……高中化学选修三,价层电子互斥理论
谁能告诉高中化学选修三,价层电子互斥理论的知识点?或者说怎样判断一个分子或离子的空间构型? tait11年前2
tait11年前2 -
 yukiy031225 共回答了19个问题
yukiy031225 共回答了19个问题 |采纳率84.2%空间构型取决于 成键的杂化轨道形式以及键角和键能大小.
这些知识在大学的无机化学中会学到.
对于高中只要记住一些常见物质就行啦,比如铵根离子是正四面体,氨气分子是三角锥,二氧化碳直线型1年前查看全部
- SO3 .CH4 .NH4+ .H2O .BF3 .CO3 2- .SO2 .NH3 的价层电子对数,孤电子对数,VSE
SO3 .CH4 .NH4+ .H2O .BF3 .CO3 2- .SO2 .NH3 的价层电子对数,孤电子对数,VSEPR模型的名称,分子或离子的立体构型名称.VSEPR模型?
 小海50731年前1
小海50731年前1 -
 羽毛来 共回答了19个问题
羽毛来 共回答了19个问题 |采纳率89.5%价层 孤 VS 立体
SO3 .3 0 sp2 平面三角
CH4 4 0 sp3 正四面体
NH4+ 4 0 sp3 正四面体
H2O .4 2 sp3 V
BF3 .3 0 sp2 平面三角
CO3 2- .3 0 sp2 平面三角
SO2 .3 1 sp2 V
NH3 4 1 sp4 三角锥1年前查看全部
- 配位原子数怎么算,SnBr2分子中,Sn原子的价层电子对数目是(4+2)/2=3,配位原子数为2,故Sn原子含有孤对电子
配位原子数怎么算,
SnBr2分子中,Sn原子的价层电子对数目是(4+2)/2=3,配位原子数为2,故Sn原子含有孤对电子,SnBr2空间构型为V型,键角小于120°.(Sn是碳族元素)解释一下,我有点看不懂.
一个孤对电子是两个电子吗?
配位原子提供的价电子数是5吗?是不是∵3+2=5? 若比邻111年前1
若比邻111年前1 -
 amorechou 共回答了16个问题
amorechou 共回答了16个问题 |采纳率81.3%首先,你可以参考我另外两处的回答,都是关于用这种方法判断构型的.
简而言之,配位原子,就是与你所选定的中心原子直接成键的原子,它们的总数就是配位原子数.你的例子中,选定Sn为中心原子,它分别与两个Br成键,所以有两个Br原子配位,故配位原子数为2.
价层电子对数目,注意“对”字,所以要除以2,是对数,不是个数.
一对电子被两个原子所共用(即中心原子和一个配位原子共用),共有3对价层电子,减去配位原子数(等于与配位原子成键所用去的电子对数),则是未用于成键的电子对数,称为孤对电子.如你所言,其实应该称为一对孤对电子,它代表两个电子.
关于配位原子提供的电子数,规定:卤素原子或氢原子提供1个,氧、硫按不提供算.再复杂的,本科涉及不到,可能要参考高等无机结构化学(麦松威等著).中心原子提供的电子数,就按中心原子的价层电子数计算,碳族就是4了(2s2 2p2)1年前查看全部
- 价层电子互斥理论中说是孤电子对?
价层电子互斥理论中说是孤电子对?
为什么不能是单个电子(没成对),书上举的例子全是有孤电子对的,难道没有单个电子的?
书上说的什么成键电子对。都是针对它说的?
看不懂百科的?谁给我通俗点的讲法?选修3学的 我的心事请别猜1年前2
我的心事请别猜1年前2 -
 孝存 共回答了25个问题
孝存 共回答了25个问题 |采纳率96%中心原子 就是分子中间那个原子.比如甲烷的中心原子是C
NO2就是有单电子的.
http://zhidao.baidu.com/question/257667020.html
我更倾向于结构式A的表示方法.
即认为存在∏43,存在单电子.
这主要是考虑键角是134度,大于sp2杂化的120度1年前查看全部
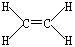
- c2h4的杂化类型能用价层电子对理论计算吗
 一万年的孤寂1年前2
一万年的孤寂1年前2 -
 nichoias 共回答了20个问题
nichoias 共回答了20个问题 |采纳率100%可以的
sp2杂化1年前查看全部
- 甲醛是平面三角形结构,根据价层电子互斥理论算出来有没有孤对电子?
甲醛是平面三角形结构,根据价层电子互斥理论算出来有没有孤对电子?
我看到有本书上说中心原子有两个西格玛键,一个孤对电子.难道氧是以配位结合?
C和O之间是双键还是配位键? sdfsduifg1年前2
sdfsduifg1年前2 -
 如何结束暗 共回答了19个问题
如何结束暗 共回答了19个问题 |采纳率94.7%中学教材上的价层电子对互斥理论只研究ABn型的分子.甲醛中存在三种元素,依据达到稳定结构的理论,碳氧之间为双键,碳与两个氢为单键.中心原子碳有四个键达到稳定结构,双键中一个σ键一个π键,所以中心原子有三个σ键,无孤对电子,价层电子对为3,呈三角形结构.1年前查看全部
- 中心原子价层电子对数与成键电子对数的区别,这些里面的电子包括配位原子中的电子吗?
 ooqjf1年前3
ooqjf1年前3 -
 tttt 共回答了16个问题
tttt 共回答了16个问题 |采纳率93.8%中心原子价层电子对数等于成键电子对数加孤电子对数,如水的中心原子为氧原子,氧原子与两个氢原子成键,成键电子对为2,除此以外,氧原子还有两个孤电子对(即未成键的电子对),故价层电子对为4.
中心原子价层电子对包括中心原子未成键的电子对和已经成键的共用电子对,配位原子的电子与中心原子共用的算中心原子价层电子对,不共用的不算.1年前查看全部
- 知道价层电子对数和中心原子上孤电子对数怎么就能确定VSEPR结构.请举个例子
 jackey3073071年前1
jackey3073071年前1 -
 风之鱼 共回答了23个问题
风之鱼 共回答了23个问题 |采纳率95.7%BF3
B:3个电子;F:提供一个电子;共6个电子,3对.所以结构为平面三角.1年前查看全部
- 若一个元素位于第三周期,则当它处于基态时,其原子的价层电子()A 只有S电子和P电子 B只有p电子和d电子
 ham7771年前3
ham7771年前3 -
 bluebirdlover 共回答了18个问题
bluebirdlover 共回答了18个问题 |采纳率83.3%第三周期即主量子数n=3,价层电子排布为3s 3p.不会出现3d轨道,而且3d轨道能量高于4s轨道,所以电子会优先排布4s轨道,那就是第四周期及以后的元素了.1年前查看全部
- 基态氮原子的价层电子排布为2s2 2p3,试用4个量子数的组合表示各价电子的运动状态.求
基态氮原子的价层电子排布为2s2 2p3,试用4个量子数的组合表示各价电子的运动状态.求
基态氮原子的价层电子排布为2s2 2p3,试用4个量子数的组合表示各价电子的运动状态. a4417955301年前1
a4417955301年前1 -
 -天堂制造- 共回答了14个问题
-天堂制造- 共回答了14个问题 |采纳率92.9%试用4个量子数的组合表示各层电子的运动状态.
主量子数n 角量子数l 磁量子数m 自旋量子数ms
1 0 0 1/2
1 0 0 -1/2
2 0 0 1/2
2 0 0 -1/2
2 1 0 1/2
2 1 1 1/2
2 1 -1 1/2
本人水平有限,回答仅供参考.1年前查看全部
- 求助关于ClF3的几何构型,利用价层电子互斥原理,有图,求解图下的数字是怎么得来的.
求助关于ClF3的几何构型,利用价层电子互斥原理,有图,求解图下的数字是怎么得来的.
a b c
90°孤电子对—孤电子对排斥的作用数 0 0 1
90°孤电子对—成键电子对排斥的作用数4 6 3
90°成键电子对-成键电子对排斥作用数 2 0 2
我想知道abc下边的数字是怎么数出来的.
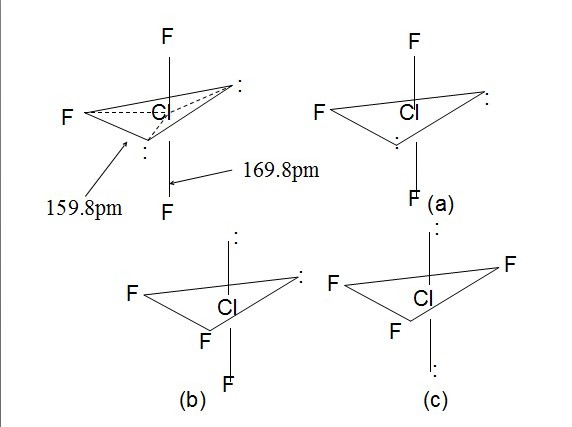
 H有梦的人1年前3
H有梦的人1年前3 -
 4fb9oe 共回答了21个问题
4fb9oe 共回答了21个问题 |采纳率95.2%五对电子,在空间分布成三角双锥结构,正三角形的平面正上和正下方各有一对电子(垂直三角形平面).
a中:孤电子对都在三角平面内,之间成120度角,即不成90度,因此为0;三角平面上下方各有一对成键电子(Cl-F键),它们都分别与两对孤电子对成90度,因此孤电子对与成键电子对的作用对数为2*2 = 4;平面中只有一个F(成键电子对),因此平面上下F与其作用时成90度角,所以成键电子对间的作用对数为2;
同理可以得出其它两种结构的作用方式.1年前查看全部
- 怎样用价层电子互斥理论判断HCN的立体构型
怎样用价层电子互斥理论判断HCN的立体构型
HCN中中心原子是哪一个(怎么来的),还有就是对于中心原子结合不同原子时又该怎样计算孤电子对数即公式0.5(a-xb)怎么变 zengzhihai1年前1
zengzhihai1年前1 -
 呼啦呼啦一大圈 共回答了18个问题
呼啦呼啦一大圈 共回答了18个问题 |采纳率72.2%是C,因为实际上是碳原子分别与氢原子和氮原子成键.
确定中心原子中价层电子对数
中心原子的价层电子数和配体所提供的共用电子数的总和减去离子带电荷数除以2[价电子对数=1/2(中心原子的价电子数+配位原子提供的σ电子数-离子电荷代数值)],即为中心原子的价层电子对数.规定:(1)作为配体,卤素原子和H 原子提供1个电子,氧族元素的原子不提供电子;(2)作为中心原子,卤素原子按提供7个电子计算,氧族元素的原子按提供6个电子计算;(3)对于复杂离子,在计算价层电子对数时,还应加上负离子的电荷数或减去正离子的电荷数;(4)计算电子对数时,若剩余1个电子,亦当作 1对电子处理.(5) 双键、叁键等多重键作为1对电子看待.1年前查看全部
- 请教下如何用杂化轨道解释乙烯的构型,就是如何求它的中心原子C的价层电子对数
 秋梨1年前2
秋梨1年前2 -
 黎gg 共回答了10个问题
黎gg 共回答了10个问题 |采纳率80%乙烯碳采取sp2杂化,平面构型.每个碳分别用两个杂化轨道与氢成键,用一个杂化轨道与另一个碳成σ键,两个碳未杂化的p轨道重叠形成π键.
价层电子对数是价层电子对互斥理论中的概念,似乎不能归入杂化轨道理论.前者一般只用于单中心分子(如MLn),不用来研究乙烯这种分子.
中心碳原子价层电子对数是3,由等性sp2杂化平面三角形构型可知.1年前查看全部
- 现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期,B元素原子的价层电子总数是内层电子总
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期,B元素原子的价层电子总数是内层电子总数的2倍;D元素原子的L电子层中只有两对成对电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子。请回答下列问题:
(1) E元素基态原子的核外价层电子排布式为_________。
(2)用元素符号表示B、C、D三种元素的第一电离能由低到高的排序_________。
(3) A元素与B、C元素可形成化合物B 2 A 4 、C 2 A 4 。
①B 2 A 4 的结构式为_________。
②下列有关C 2 A 4 的说法正确的是_________。
a.一个该分子中含有4个σ键
b.该分子可作为配位体形成配位键
c.该分子是非极性分子 d.1mol该分子最多可形成4mol氢键
e.该分子的稳定性与氢键无关
f.该分子中C的原子轨道是sp 3 杂化
(4)B单质的一种的晶体结构如图甲所示,E单质的一种的晶体结构如图乙所示。
则图中的单质B的名称_________,图甲中B原子的配位数与图乙中E原子的配位数之_________。
E元素与D元素形成的ED晶体与NaCl晶体一样,欲比较ED与NaCl的晶格能大小,需考虑的数据是_______________________________________________________________________________。
(5)据最新资料显示,F单质的晶胞可能有多种,若其晶胞分别以六方紧密堆积和面心立方堆积存在时,其单质的密度之比为_________。 宝货JR1年前1
宝货JR1年前1 -
 fylsx 共回答了22个问题
fylsx 共回答了22个问题 |采纳率81.8%1年前查看全部
- 化学学科的特点经历了价键理论、杂化轨道、价层电子对互斥、分子轨道等等好多理论,请问这些理论都是正确的么,怎么感觉这些理论
化学学科的特点
经历了价键理论、杂化轨道、价层电子对互斥、分子轨道等等好多理论,请问这些理论都是正确的么,怎么感觉这些理论的出现就是上一个理论出现了问题然后“编”了新的东西去解释.就没有一个完整的东西吗?杂化轨道真的存在吗? 5401885401881年前1
5401885401881年前1 -
 爱枫枫f 共回答了15个问题
爱枫枫f 共回答了15个问题 |采纳率100%化,变化;学,科学.
科学,是研究事物的客观规律的
所以说:化学是物质变化规律的科学.
数理化所研究的对象都不发生变化.
生物所涉及的变化,不是物质的变化,而是生命的变化.1年前查看全部
- 某元素基态原子的价层电子组态为nsx npx+1,由此可知该原子中未成对电子数是
 renwoxing0061年前1
renwoxing0061年前1 -
 多久多久 共回答了19个问题
多久多久 共回答了19个问题 |采纳率94.7%未成对是3.
排到了np,ns是排满的,也就是x=2,p排满是6个电子,半满时3个电子各占一个轨道,故未成对电子数是3.1年前查看全部
- 某元素的原子序数为16(1)写出该原子的核外电子排布式及其价层电子构型;(2)指出该元素在周期表中的位置(周期、族、分区
某元素的原子序数为16
(1)写出该原子的核外电子排布式及其价层电子构型;
(2)指出该元素在周期表中的位置(周期、族、分区),其最高氧化数?
(3)指出该元素的电子层、能级组、轨道各有多少个?价电子数为多少?
尽量清楚点 谢谢 环境与我1年前3
环境与我1年前3 -
 煞冰 共回答了19个问题
煞冰 共回答了19个问题 |采纳率94.7%1、核外电子排布:-2-8-6,是元素硫(元素S)
价层电子结构:3s2-3p4
2、位置:第三周期,第6主族,分区指的是什么?(非金属?)
最高价氧化物:三氧化硫,SO3
3、电子层:3层
能级组:3(一般为轨道数)
轨道:3
价电子数:6(最外层电子数)1年前查看全部
- 求SO2的价层电子对数的计算过程.
 asd3591年前1
asd3591年前1 -
 可爱猫猫咪 共回答了15个问题
可爱猫猫咪 共回答了15个问题 |采纳率100%(6-2×2)/2+2=31年前查看全部
- brcl3- 价层电子对数原题出了点问题,我找到出处了。题目是IBrCl3-
 最怕吃肥猪肉1年前1
最怕吃肥猪肉1年前1 -
 馨馨看股 共回答了22个问题
馨馨看股 共回答了22个问题 |采纳率81.8%麻烦以后打成BrCl3-行不
一开始没看懂
对数=(7+3*1+1)/2=5.5=6(进位,一个也算一对)1年前查看全部
- 计算中心原子的价层电子时为什么不考虑氧原子提供的价电子数,
 z兆龙1年前2
z兆龙1年前2 -
 八少1979 共回答了13个问题
八少1979 共回答了13个问题 |采纳率100%因为O原子是形成双键,而考虑结构是单键;中心原子也提供了2个电子(相当于一个单键的电子数),所以就不要考虑氧原子的提供电子数了.1年前查看全部
- 【大学无机化学】由外层电子构型怎么推断价层电子构型
【大学无机化学】由外层电子构型怎么推断价层电子构型
由外层电子构型怎么推断价层电子构型
例如这道题:其X3+离子中的最高能级的3个电子的主量子数n为3,角量子数l为2,写出该元素符号,并确定其属于第几周期,第几族的元素.
求这个题整个思路的过程. xiaoxiao2461年前1
xiaoxiao2461年前1 -
 笑傲S人生态 共回答了18个问题
笑傲S人生态 共回答了18个问题 |采纳率94.4%最高能级的3个电子 主量子数n为3,角量子数l为2,
即为3d3 (1s2 2s2 2p6 3s2 3p6 3d3)
因为是X3+ :
所以:X 是1s2 2s2 2p6 3s2 3p6 3d5 4s1
即为铬
则写出该元素符号:Cr ,并确定其属于第四周期,第VIB族的元素1年前查看全部
- 试用价层电子对互斥理 试用价层电子对互斥理论判断下列分子或离子的空间构型.BCl 3 、NH 3 、H 2 O、CO 2
试用价层电子对互斥理
试用价层电子对互斥理论判断下列分子或离子的空间构型.
BCl 3 、NH 3 、H 2 O、CO 2 、SO 2 、COCl 2 、NH 4 + 、CCl 4
_________________________________ yhz51年前1
yhz51年前1 -
 lige2000 共回答了11个问题
lige2000 共回答了11个问题 |采纳率100%BCl 3 、COCl 2 是平面三角形;H 2 O、SO 2 是V形;NH 3 是三角锥形;CO 2 是直线形;NH 4 + 、CCl 4 是正四面体形.1年前查看全部
- 怎么用价层互斥理论中的价层电子对数公式判断乙炔的结构
怎么用价层互斥理论中的价层电子对数公式判断乙炔的结构
乙炔有中心原子吗?H-C三C-H,若C为中心原子,那么算得的价电子对数怎么是
(4+1)/2=2.5再进到3,为什么不是sp2杂化? frank_lan1年前3
frank_lan1年前3 -
 我要跑步 共回答了24个问题
我要跑步 共回答了24个问题 |采纳率100%乙炔中两个C原子都是中心原子.
价电子对数=(中心原子的价电子数+配位原子提供的σ电子数-离子电荷代数值)/2
对于碳原子,价电子数就是最外层电子数4
配位原子提供的σ电子数:H原子提供1个
离子电荷代数值显然是0
所以价电子对数=(4+1+0)/2=2.5
乙炔中激发态的C原子2s和2px轨道杂化成2个sp轨道,其中一个与H原子形成σ单键,另一个与C原子形成σ单键,而2px和2py以肩并肩的方式与另一个C原子形成π键.
对于为什么不是sp2杂化,从比较直观的角度解释下吧
如果是sp2杂化,形成的3个轨道相互之间的夹角为120°,其中一个轨道与H原子形成σ单键,另外2个轨道都要与另一个C原子成键,但由于夹角为120°,所以这种情况是不可能的.1年前查看全部
- (1)写出Cr、Cu+的价层电子排布式______、______.
 (1)写出Cr、Cu+的价层电子排布式______、______.
(1)写出Cr、Cu+的价层电子排布式______、______.
(2)乙烯分子中有______个σ键,______π键.
(3)基态Fe原子的未成对电子数有______个.
(4)一元素原子的N层上只有1个电子,该元素原子各内层均已充满,写出该原子电子排布式:______.
(5)写出过氧化钠的电子式______. 你就是我的天使1年前1
你就是我的天使1年前1 -
 flyerler 共回答了10个问题
flyerler 共回答了10个问题 |采纳率100%解题思路:(1)价电子排布式即外围电子排布式;
(2)乙烯中存在4个C-H键和1个C=C双键,没有孤对电子,成键数为3,则C原子采取sp2杂化,以此来解答;
(3)Fe基态原子电子排布式1s22s22p63s23p63d64s2;
(4)该元素为铜元素;
(5)过氧化钠是离子化合物,由钠离子与过氧根离子构成.(1)Cr、Cu+的价层电子排布式分别为3d54s1、3d10,故答案为:3d54s1; 3d10;
(2)乙烯中存在4个C-H键和1个C=C双键,没有孤对电子,成键数为3,则C原子采取sp2杂化,C-H之间是sp2形成的σ键,C-C之间有1个是sp2形成的σ键,C-C之间还有1个是未参加杂化的2p轨道形成的π键,故答案为:5;1;
(3)Fe基态原子电子排布式1s22s22p63s23p63d64s2,故答案为:4;
(4)铜的电子排布式:[Ar]3d104S1,故答案为:[Ar]3d104S1;
(5)过氧化钠是离子化合物,由钠离子与过氧根离子构成,电子式为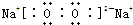 ,故答案为:
,故答案为: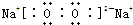 .
.点评:
本题考点: 原子核外电子排布;共价键的形成及共价键的主要类型.
考点点评: 本题考查常用化学用语的理解,难度中等,注意价层电子排布式与电子排布式的区别.1年前查看全部
- 金元素的价层电子排布式.只求解释为什么金的价电子排布是6s1而不是5d106s1?
 失忆亚当1年前1
失忆亚当1年前1 -
 aimar2010 共回答了24个问题
aimar2010 共回答了24个问题 |采纳率95.8%5d^10 6s^11年前查看全部
- 怎样判断中心原子的价层电子对中的孤对电子对?
 我rr都BH1年前3
我rr都BH1年前3 -
 gang012 共回答了17个问题
gang012 共回答了17个问题 |采纳率94.1%中心原子的价层电子对中的孤对电子对 = 中心原子的最外层电子数 - 2*成键个数
因为形成一根键需要共用2个电子1年前查看全部
- 价层电子对数的问题高中老师说:价层电子对数=成键数+孤电子对数,孤电子对数=(中心原子最外层电子数-配原子数×配原子孤电
价层电子对数的问题
高中老师说:价层电子对数=成键数+孤电子对数,孤电子对数=(中心原子最外层电子数-配原子数×配原子孤电子数)/2,大学老师说:价层电子对数=(中心原子最外层电子数+配位原子提供电子数)/2,请问谁能帮我解释下这两个公式为什么相等? 阳阳我爱你1年前1
阳阳我爱你1年前1 -
 karanhu 共回答了24个问题
karanhu 共回答了24个问题 |采纳率91.7%举例PCl3 第一种算法,成键数为3,孤电子对=(5-3×1)/2=1 所以价层电子对数=4
第二种算法,价层电子对数=(5+3)/2=4
Cl最外层7个电子,三个成对,一个孤电子
Cl最为配位原子只能提供一个电子和P形成价层电子对.1年前查看全部
- 磷酸根中心原子价层电子对数?磷酸根的中心原子价层电子数是4,为什么我用公式算的是(5-4*2+3)/2=0啊?为什么书上
磷酸根中心原子价层电子对数?
磷酸根的中心原子价层电子数是4,为什么我用公式算的是(5-4*2+3)/2=0啊?
为什么书上算的是(5+0+3)/2=4呢? dukou5651年前1
dukou5651年前1 -
 心理暗示 共回答了20个问题
心理暗示 共回答了20个问题 |采纳率85%中心原子P,VA族元素,提供5个电子.
周围原子O,VIA族元素,当VIA族元素作为周围电子的时候,不提供电子.
还有3个负电荷,所以3个电子
一共8个价电子,4对.P是sp3杂化.
完全不知道你那个怎么来的1年前查看全部
- 当氧作为配位原子时计算中心原子的价层电子对数,为什么不考虑氧原子提供的价电子数
 123庆华1年前1
123庆华1年前1 -
 橄榄园下 共回答了10个问题
橄榄园下 共回答了10个问题 |采纳率100%因为是双键呀1年前查看全部
- 关于价层电子互斥模型VSEPR通式中m的值的确定中,A的族价 族价是如何确定?另外这个通式也不是很理解,比如化合价的取值
关于价层电子互斥模型VSEPR
通式中m的值的确定中,A的族价 族价是如何确定?
另外这个通式也不是很理解,比如化合价的取值中,是取绝对值,还是要带上正负号?
而它后面 (+/-)离子电荷相应的电子数 + -又是.
PS:m=(A的族价-X的化合价×X的个数+/-离子电荷相应的电子数)÷2
AXnEm
取自无机化学(吴国庆)第四版P71
A是中心原子 X是配位原子 linq41年前1
linq41年前1 -
 eallysky 共回答了15个问题
eallysky 共回答了15个问题 |采纳率93.3%A的族价通常指最高价,与族序数相同
化合价通常指得电子数,所以可以看成绝对值
(+/-)离子电荷相应的电子数 阴离子是得电子应该加,阳离子减
如硫酸根离子SO4 2-
m=(6-2*4+2)/2=0
没有孤电子对,只有四个成键电子对,所以是正四面体结构1年前查看全部
- 化学问题、什么是孤电子对数目、价层电子对数目、
化学问题、什么是孤电子对数目、价层电子对数目、
还有配位化合物、配体提供了电子、受体用空轨道接受、想问的就是、我要怎样才知道配体提供了多少电子、受体提供的什么轨道、还有反馈配键是怎么回事?用硫酸四水合铜、二氧化硫说明看、谢谢了、 yy2mine1年前2
yy2mine1年前2 -
 大大的一頭羊 共回答了16个问题
大大的一頭羊 共回答了16个问题 |采纳率93.8%孤电子对(英语:Lone pair)或称孤对电子,是不与其他原子结合或共享的成对价电子.存在于原子的最外围电子壳层.
孤对电子在分子中的存在和分配影响分子的形状等,对轻原子组成的分子影响尤为显著.配体通过与的,的发生等均通过孤对电子.指分子中未成键的价电子对.
举例说明
例如,氨分子的氮原子上有一对孤对电子;水分子的原子上有两对孤对电子对.由于孤对电子对比成键电子对在空间的伸展大,对成键电子有更强的排斥作用,致使分子的减少.如无孤对电子,键角为109°28’,而氨和水分子的键角分别为107°18’和104.5°.在描述分子几何构型时,不包括孤对电子,故甲烷分子为正四面体形;氨分子为三角锥形而水分子则为弯曲形.[1]
相关资料
价层电子对互斥理论的基础是,分子或离子的几何构型主要决定于与中心原子相关的电子对之间的排斥作用.该电子对既可以是成键的,也可以是没有成键的(叫做孤对电子).只有中心原子的价层电子才能够对分子的形状产生有意义的影响.
分子中电子对间的排斥的三种情况为:
孤对电子间的排斥(孤-孤排斥);
孤对电子和成键电子对之间的排斥(孤-成排斥);
成键电子对之间的排斥(成-成排斥).
一个分子需尽力避免这些排斥来保持稳定.这个理论称,仅当温度在约115-120℃时,排斥力才能变成零.当排斥力不能避免的时候,整个分子则倾向于形成排斥最弱的方式(与理想形状有最小差异的方式).
孤对电子间的排斥被认为大于孤对电子和成键电子对之间的排斥,后者又大于成键电子对之间的排斥.因此,分子更倾向于最弱的成-成排斥.
配体较多的分子中,电子对间甚至无法保持90°的夹角,因此它们的电子对更倾向于分布在多个平面上.
词条:价层电子对互斥模型
英文:(valence-shell electron-pair repulsion model) (VSEPR)
简称: VSEPR
概念:VSEPR模型是将共用电子对与孤对电子的概念,与原子轨道的概念相结合,且电子斥力达到最小.在这个模型中电子对相互排斥,成键电子与孤对电子距离越远越好.VSEPR模型以最简单的方法形象化了化学变化,也很容易判断物质的空间构型.
简介
在1940年,希吉维克(Sidgwick)和坡维尔(Powell)在总结实验事实的基础上提出了一种简单的理论模型,用以预测简单分子或离子的立体结构.这种理论模型后经吉列斯比(R.J,Gillespie)和尼霍尔姆(Nyholm)在20世纪50年代加以发展,定名为价层电子对互斥模型,简称VSEPR(Valence Shell Electron Pair Repulsion).
价层电子对互斥理论(英文VSEPR),是一个用来预测单个共价分子形态的化学模型.理论通过计算中心原子的价层电子数和配位数来预测分子的几何构型,并构建一个合理的路易斯结构式来表示分子中所有键和孤对电子的位置.同时,也是一种较简便的判断共价分子几何形状的方法,该理论紧紧抓住中心原子价层电子对数目这一关键因素,运用分子的几何构型取决于价层电子对数目这一假设,成功的解释并推测了许多简单分子的几何形状.
常见分子构型
二氧化硫 4sp3杂化 正四面体 0 正四面体 甲烷 1 三角锥 氨 2V字型 水 5sp3d 三角双锥 0 三角双锥 PCl5 1 变形四面体(跷跷板型) TeCl4 2T字型 ClF3 3 直线型 I3 6sp3d2 正八面体 0 正八面体 六氟化硫 1 四方锥 IF5 2 平面四边形 ICl4 3T字型 4 直线型 7sp3d3五角双锥 0 五角双锥 IF7
AXE方法
价层电子对互斥理论常用AXE方法计算分子构型.这种方法也叫ABE,其中A代表中心原子,X或B代表配位原子,E代表孤电子对.
甲烷分子(CH4)是四面体结构,是一个典型的AX4型分子.中心碳原子周围有四个电子对,四个氢原子位于四面体的顶点,键角(H-C-H)为109°28'.
一个分子的形状不但受配位原子影响,也受孤对电子影响.氨分子(NH3)中心原子杂化类型与甲烷相同(sp3),分子中有四个电子云密集区,电子云分布依然呈四面体.其中三个是成键电子对,另外一个是孤对电子.虽然它没有成键,但是它的排斥力影响着整个分子的形状.因此,这是一个AX3E型分子,整个分子的形状是三角锥形,因为孤对电子是不可“见”的.
事实上,电子对数为七是有可能的,轨道形状是五角双锥.但是它们仅存在于不常见的化合物之中.一种如六氟化氙,有一对孤电子,它的构型趋向于八面体结构,因为孤对电子倾向于位于五角形的平面上.另一种如七氟化碘,没有孤电子,七个氟原子呈五角双锥状排列.
电子对数为八也是有可能的.
A.理论要点
①对于ABm型共价分子:中心原子周围电子对排布的几何形状,主要取决于中心原子的价电子对数,而价电子数等于成键电子对和未成键的孤电子对之和.
②价电子对要尽量远离,减小排斥
两对────180°最远
三对────平面三角形最远
四对────四面体
五对────三角双锥
六对────正八面体
一般说来,孤电子对、成键电子对之间斥力大小的顺序为
孤电子对~孤电子对>孤电子对~成键电子对>成键电子对~成键电子对
③价层电子对排布方式与分子构型有关
只有σ键才能撑起分子骨架,所以分子构型与价对构型有时一致有时不一致,根据键对与孤对数目判断构型.
B.计算方法
m+n规则:
m为中心原子周围B原子个数.
n=(中心原子价电子数-直接相连原子数×该原子达稳定结构所需电子数)÷2
特别注意:当算出的n值不是整数值时,有2种取值方法.
①n>3时,只取整数位.(例如n=3.9只取n=3)
②n双键排斥>单键排斥.
2.孤对电子与键对电子间的排斥大小为:孤对/孤对>孤对/键对>键对/键对.
3.配位原子的电负性增大或中心原子电负性减小,也会使键角偏离标准值.端原子电负性增加时,共享电子对将偏向配位体,从而减少成键电子对之间的斥力,键角的度数随之减小.
4.价电子对的相邻电子对越多,所受斥力就越大,距离原子核也越远.
VSEPR能够广泛预测定性预测各类ABn型分子的几何构型,但也有例外.例如BaI2,SrCl2都是弯曲形构型而非预计的直线性型;对过渡金属化合物几何构型的判断也有一定的局限性,对于过度元素配位场理论则能更好说明.1年前查看全部
- 根据价层电子互斥理论判断出分子构型后再怎么判断中心原子杂化类型?
 wuzao1年前1
wuzao1年前1 -
 小阳703 共回答了14个问题
小阳703 共回答了14个问题 |采纳率85.7%价层电子对确定后如2对电子,则中心原子为sp杂化,3对为sp2杂化,4对sp3杂化.5对sp3d杂化,6对sp3d2杂化.1年前查看全部
- 为什么价层电子对不包括π键?
 东方神游1年前2
东方神游1年前2 -
 cwgg198265 共回答了19个问题
cwgg198265 共回答了19个问题 |采纳率78.9%价层电子对理论是用来解释单中心分子空间构型的理论,只看键的数目,不看键的类型,只要是两个原子之间的键,不论是单键(即只有一个σ键),双键(一个σ键和一个π键)还是三键(一个σ键和两个π键),都只算一个键,因为这些键都只有同一个空间指向,只需算一个键;
每个键都含有一个σ键,所以σ键的数目是与键的数目相同的.为简单起见,只需考虑σ键.1年前查看全部
- 二氯化锡的价层电子对构型是平面三角形还是平面正三角形?
 shijie20081年前1
shijie20081年前1 -
 猪猪在找 共回答了15个问题
猪猪在找 共回答了15个问题 |采纳率100%平面三角形吧1年前查看全部
- 如何计算分子中中心原子的价层电子对数?
如何计算分子中中心原子的价层电子对数?
书上写的是分子中中心原子的价层电子对数=(中心8原子的价电子对数+配位原子提供的价电子数)/2 ,但是中心8原子的价电子对数看不懂是什么意思啊?比如说SO2,S的价电子结构是3S23P4,那么SO2中中心原子的价层电子对数为什么是3啊?如果按照公式计算那么配位原子O原子提供的价电子数是O原子个数2吗?但是S原子的价电子对数如何计算?由于我没学过结构化学,但是考研要考这章, sixhu1年前2
sixhu1年前2 -
 预知者 共回答了16个问题
预知者 共回答了16个问题 |采纳率75%这是大一化学的东西!
路易斯(电子对)结构的画法1年前查看全部
- 如何用价层电子互斥理论解释臭氧负离子的杂化轨道类型
 游离在天上的鱼1年前2
游离在天上的鱼1年前2 -
 社ii会 共回答了21个问题
社ii会 共回答了21个问题 |采纳率85.7%O3(-)
一个氧是中心离子,另外两个氧是配位原子,所以根据价层电子对互斥理论可知,
其成对电子数=(6+1)/2=3.5
所以中心离子氧是sp3杂化,电子空间结构为四面体形.
但由于有两个轨道上被电子占据(一个轨道上占两个电子,另外一个为一个电子),所以臭氧分子的空间构型是V字型,杂化类型为sp3不等性杂化.1年前查看全部
- 怎么求中心原子的价层电子对数 例co2 h2o
 hy19871111年前3
hy19871111年前3 -
 175586899 共回答了21个问题
175586899 共回答了21个问题 |采纳率90.5%中心原子的价层电子对数(注意可不是价电子数)=中心原子孤电子对数+中心原子与周围原子形成σ键电子对数.
(1)先找到中心原子,一般为化合价数值较大,结合原子较多,电负性较小(除H外).
(2)看中心原子在哪一主族,族序数也就是最外层电子数.
(3)再看和中心原子结合的原子所需电子数(8-其族序数).
(4)中心原子的最外层电子数减去周围原子所需电子总数,再除以2就是中心原子的孤电子对数.
(5)数数周围有几个原子和中心原子结合,中心原子与周围原子形成σ键电子对数就是几.
下面以CO2为例说明一下,首先确定中心原子为C,然后知道C是第IVA族元素,C原子最外层电子数为4,减去两个O原子成键所需电子数(每个O需要8-6=2电子,两个O共需2×2=4电子),也就是4-4=0,说明C原子没有孤对电子,而要与两个O结合需要σ键2个,C原子的价层电子对为0+2=2.中心C原子是sp杂化,VSEPR构型和分子构型均为直线型.
再如H2O,中心原子是O,O属第VIA族,最外层电子数为6,减去两个H需要的电子数(由于基态H原子只有1s能级,再有一个电子就可稳定)6-2×1=4,O的孤对电子数就是4÷2=2.加上要与两个H形成两个σ键,O的价层电子对数为2+2=4.中心原子O是sp3杂化,VSEPR构型为四面体,分子构型忽略孤对电子是V形.1年前查看全部
- 价层电子组态为ns1,ns2的元素都在s区吗?
 kevin1231年前3
kevin1231年前3 -
 蚂蚁尚书童童 共回答了19个问题
蚂蚁尚书童童 共回答了19个问题 |采纳率89.5%不一定,除了第一、第二主族元素的价层电子组态为ns1、ns2,第一第二副族元素的价层电子组态也为ns1、ns2,如CuAgAu和ZnCdHg.1年前查看全部
- 如何根据价层电子对数判断其理想构型
 lzyg1年前1
lzyg1年前1 -
 janyjane 共回答了19个问题
janyjane 共回答了19个问题 |采纳率94.7%理想构型,你是打错了还是?判断空间构型
你可以写电子式(多中心原子)来判断,如果是单中心原子可以用价层电子对互斥理论(也叫VSEPR理论)
有一个公式是
n=a+1/2(b-xy)就是sp^n
a是成键电子对数(结合原子数)b是价电子对数x是共有几个结合的原子y是该原子的化合价(我忘了反正差不多那个意思
sp(1省略)是直线形
sp2是平面三角形
sp3是正四面体1年前查看全部
- 麻烦各位详细说明为什么有时候价层电子不等于价电子
 janeliu13141年前1
janeliu13141年前1 -
 小艾tracy 共回答了12个问题
小艾tracy 共回答了12个问题 |采纳率91.7%因时间关系,现摘录网友的精彩文章作为回答:
①当最外层电子数小于四时,易失去电子,呈现正价,此时最外层电子数有几个便是正几价
当最外层电子数大于四时,易得到电子,呈现负价,此时化合价为8-最外层电子数
x05
x05
x05
x05
②价电子数是能与其它原子相互作用形成化学键的电子.主族元素的价电子就是主族元素原子的最外层电子;过渡元素的价电子不仅是最外层电子,次外层电子及某些元素的倒数第三层电子也可成为价电子.
③一个概念,价层电子指原子核外电子中能与其他原子相互作用形成化学键,跟元素化合价有关的电子,又称价电子.顾名思义,价电子表明原子价数的电子.主族元素的价电子就是主族元素原子的最外层电子;过渡元素的价电子不仅是最外层电子,次外层电子及某些元素的倒数第三层电子也可成为价电子.电子在原子中处于不同的能级状态,粗略说是分层分布的,故电子层又叫能层.电子层可用n(n=1、2、3…)表示,n=1表明第一层电子层(K层),n=2表明第二电子层(L层),依次n=3、电子层4、5时表明第三(M层)、第四(N层)、第五(O层).电子在原子核外排布时,要尽可能使电子的能量最低.一般来说,离核较近的电子具有较低的能量,随着电子层数的增加,电子的能量越来越大;同一层中,各亚层的能量是按s、p、d、f的次序增高的.这两种作用的总结果可以得出电子在原子核外排布时遵守下列次序:1s、2s、2p、3s、3p、4s、 3d、4p、5s、4d、5p.1年前查看全部
- 基态院子价层电子排布满足下列条件之一的是哪一类或者哪一个元素
基态院子价层电子排布满足下列条件之一的是哪一类或者哪一个元素
1,具有2个P电子
2,有2个量子数为N=4,L=0的电子,有6个量子数为N=3和L=2的电子
3,3D为全充满,4S只有一个电子的元素 yfyxb1年前1
yfyxb1年前1 -
 leizongpingapple 共回答了12个问题
leizongpingapple 共回答了12个问题 |采纳率100%1,具有两个p电子,所以是ⅣA主族元素,如C、Si等,
2,有2个量子数为N=4,L=0的电子就是4s2,有6个量子数为N=3和L=2的电子就是3d6,所以就是3d6 4s2,即铁.
3,就是3d10 4s1,就是Cu.
希望对你有所帮助!1年前查看全部
- 元素周期表的价层电子构型表记,如"氟--2s^2 2p^5",是如何表示实际构型的?
 joke_qin1年前2
joke_qin1年前2 -
 phyzju 共回答了16个问题
phyzju 共回答了16个问题 |采纳率93.8%这是电子亚层,说起来比较复杂
一般简单将比较电子能量大小,2s层电子能量低于2p层,2s层电子稳定,出现在外层的几率要小1年前查看全部
- 亚硫酸根离子的价层电子对数是几对?
 cyc04591年前1
cyc04591年前1 -
 98589536 共回答了26个问题
98589536 共回答了26个问题 |采纳率84.6%楼主可以通过亚硫酸根的杂化形态来判断 .亚硫酸根为sp3杂化 所以有4对价层电子对
至于杂化的判断.我有一个办法 不知是从哪本书上看来的 和高中讲的和一些大学教材上的的不太一样 但是比较简单 分享给楼主
方法就是 1.元素的最外层电子数 如 氧为6 硫也是6 氮是5
2.加上配体数 如NH3为 5+1+1+1 但是氧氟作配体时要记做零 如NO3- 为5+0+0+0 亚硫酸根为6+0+0+0
3.有电荷的加上或减去电荷 亚硫酸根为 6+0+0+0+2=8 此为价层电子数
4.除2 得到价层电子对数如为单数如7 需+1 变成8 因为一个电子同样要占一对电子的空间
5.和高中判断方法一样 如亚硫酸根 6+0+0+0+2=8 8/2=4 == sp3杂化1年前查看全部
大家在问
- 1小明将今年的压岁钱的一半还多50元存入银行,把剩下的一半捐给了老年人,还剩250元交学费.小明今年有...
- 2(2012•郑州模拟)有黑、白、黄色袜子各10只,不用眼睛看,任意地取出袜子来,使得至少有两双袜子不同色,那么至少要取出
- 3(2014•西藏模拟)观赏植物藏报春是一种多年生草本植物,两性花、异花传粉.在温度为20℃~25℃的条件下,红色(A)对
- 41.某固体仅有一种元素组成,其密度为5g.cm-3,用X射线研究该固体的结果表明,在棱长为1×10^-7cm的立方体中含
- 5品物咸亨 是什么意思?
- 61.被 除数、除数、商相加的和是26,已知商是3.5,被除数是( )除数是( )不要用方程!
- 7c/c++ 问题已知fun(int)是类Test的公有成员函数,p是指向成员函数fun()的指针,采用( )是正确的.
- 8How to say你太过分了!连方便面都懒得泡in English?
- 9在四边形ABCD中,已知AB∥CD,∠B=60°,
- 10用1-8可以组成______个没有重复数字,且能被11整除的8位数.
- 11jack often _____ (take) walks with his parents after dinner.
- 12解释英语区别many\lots of\a lot of的不同:I‘d like a lot of ice cream w
- 13people有复数形式吗?We will not succumb to terrorism,and we will ma
- 14以下不规则动词的过去式与过去分词
- 15(2012•宿迁三模)三草酸合铁(Ⅲ)酸钾晶体(K3[Fe(C2O4)3]•3H2O)有很重要的用途.可用如下流程来制备