金属钠与氯化钾稀溶液反应反应式是什么?原理是什么?
 寻找阳光的日子2022-10-04 11:39:543条回答
寻找阳光的日子2022-10-04 11:39:543条回答
已提交,审核后显示!提交回复
共3条回复
 music19850526 共回答了17个问题
music19850526 共回答了17个问题 |采纳率94.1%- Na 与KCl不反应,只会与H2O反应.
方程式:2 Na + H2O = 2 NaOH + H2↑.
实质是Na与水的反应 - 1年前
 shujianzhen 共回答了14319个问题
shujianzhen 共回答了14319个问题 |采纳率- 2NA+2H2O=2NAOH+H2
- 1年前
 shjm 共回答了61个问题
shjm 共回答了61个问题 |采纳率- 金属钠太活泼,先和水反应:2Na+2H2O=2NaOH+H2,就这样。注意钠和氯化钾不能发生置换反应。钾钙钠这类金属遇到溶液都会和水先反应,生成相应的碱,再发生后续的反应。
- 1年前
相关推荐
- 二氧化碳与金属钠反应生成金刚石和碳酸钠的化学反应的方程式是什么?
 zwk19877251年前1
zwk19877251年前1 -
 驰吃迟 共回答了22个问题
驰吃迟 共回答了22个问题 |采纳率100%3CO2 + 4Na = 2Na2CO3 + C
基本思路为:先根据题目给的条件写出反应物和生成物,再根据升降守恒配钠和碳为4和1.
然后再根据钠元素守恒配碳酸钠为2,再根据碳元素守恒配二氧化碳为3,最后用氧元素守恒检验方程式正确即可.1年前查看全部
- 46g金属钠在空气中充分燃烧得到淡黄色粉末,该粉末跟足量水反应放出气体的体积
46g金属钠在空气中充分燃烧得到淡黄色粉末,该粉末跟足量水反应放出气体的体积
A.44.8L B.11.2L C.22.4L D.5.6L
2Na + O2 == Na2O2 2Na2O2 + 2H2O == 4NaOH + O2↑
关系式:4Na ————O2
4×23 g 22.4L
46 g V(O2)
V(O2)=11.2L
为什么关系式可以写成4Na ————O2呢? cinkum1年前6
cinkum1年前6 -
 Royph 共回答了19个问题
Royph 共回答了19个问题 |采纳率84.2%(1)式乘以2,然后加上(2)式
4Na + 2O2 + 2Na2O2 + 2H2O = 2Na2O2 + 4NaOH + O2
化简 得到
4Na + O2 + 2H2O = 4NaOH
因此有这个关系式
也可以有另外的理解方法
1个Na原子可以失去一个电子成为Na+
1个O2一共可以失去4个电子成为O 2-
因此根据氧化还原反应电子转移要守恒,必须有4个Na对应1个O21年前查看全部
- 化学方程式计算的应用1.15g金属钠与水反应得到100ml溶液,问;(要化学方程式)(1)生成的气体在标准状况下是多少毫
化学方程式计算的应用
1.15g金属钠与水反应得到100ml溶液,问;(要化学方程式)
(1)生成的气体在标准状况下是多少毫升?
(2)反应的所得溶液的物质的量浓度是多少?
2、把5.4gAL放入足量氢氧化钠溶液中完全反应,计算生成氢气的体积?(标准状况) 自如飞翔1年前1
自如飞翔1年前1 -
 Hanny3515 共回答了10个问题
Hanny3515 共回答了10个问题 |采纳率90%1(1)2Na+2H2O=2NaOH+H2
Na为1.15/23mol=0.05mol,
∴氢气为0.025mol
∴为0.025*22.4L=560mL
(2)NaOH为0.05mol
∴物质的量浓度为0.05mol/100mL=0.5mol/L
2、2Al+2NaOH+2H2O=2NaAlO2+3H2
Al为0.2mol
∴氢气为0.3mol
∴为0.3*22.4L=6.72L1年前查看全部
- 将一小块吸尽表面煤油的金属钠,置于试管的底部,加热使其熔化,迅速压入一小试 管,
将一小块吸尽表面煤油的金属钠,置于试管的底部,加热使其熔化,迅速压入一小试 管,
观察金属钠的表面的金属光泽. kjshow1年前2
kjshow1年前2 -
 jayzfan 共回答了24个问题
jayzfan 共回答了24个问题 |采纳率91.7%钠单质很软,可以用小刀切割.切开外皮后,可以看到钠具有银白色的金属光泽,很快就会被氧化失去光泽.1年前查看全部
- 一道关于Na的化学题金属钠、氧化钠、过氧化钠的混合物的质量为3.72g,与足量的水反应生成0.36g混合气体,引燃混合气
一道关于Na的化学题
金属钠、氧化钠、过氧化钠的混合物的质量为3.72g,与足量的水反应生成0.36g混合气体,引燃混合气体恰好完全反应,则原混合物中钠、氧化钠、过氧化钠的质量之比为多少? 越狱小公主1年前3
越狱小公主1年前3 -
 fmo168 共回答了12个问题
fmo168 共回答了12个问题 |采纳率100%设金属钠、氧化钠、过氧化钠的物质的量分别为Xmol,Ymol,Zmol.按题意列出第一个方程.23X+62Y+78Z=3.72
再分别列出三者与水反应的化学方程式,有如下的对应关系:2Na--H2;
2Na2O2---O2,XmolNa对应生成H2的物质的量为X/2,YmolNa2O2对应生成O2的物质的量为Y/2,根据生成的气体质量列出第二个方程:2*X/2+32*Y/2=0.36
再根据混合气体恰好完全反应列出第三个方程:X/2=2*Y/2.
三个方程,三个未知数,联合起来解方程组就OK了.但是题目要问的是质量之比.接下来就好办了.1年前查看全部
- (2008•驻马店二模)将一块银白色的金属钠放在空气中会发生一系列的变化:表面迅速变暗→“出汗”→变成白色固体(粉末),
(2008•驻马店二模)将一块银白色的金属钠放在空气中会发生一系列的变化:表面迅速变暗→“出汗”→变成白色固体(粉末),下列有关叙述不正确的是( )
A.表面迅速变暗是因为钠与空气中的氧气反应生成了氧化钠
B.“出汗”是因为生成的氢氧化钠吸收空气中的水蒸气在表面形成了溶液
C.最后变成碳酸钠粉末
D.该过程的所有化学反应均为氧化还原反应 渐近稳定1年前1
渐近稳定1年前1 -
 JoannaMo 共回答了13个问题
JoannaMo 共回答了13个问题 |采纳率92.3%解题思路:A.金属钠在空气中易氧化形成氧化钠,出现变暗现象;
B.氧化钠与空气中的水反应生成氢氧化钠,NaOH具有吸水性;
C.氢氧化钠再与空气中的二氧化碳反应生成碳酸钠和水,最终变成白色粉末为碳酸钠;
D.整个过程中只有Na→Na2O的过程为氧化还原反应.A.因钠很活泼,易被氧化,则金属钠在空气中易氧化形成氧化钠,出现变暗现象,故A正确;
B.氧化钠与空气中的水反应生成氢氧化钠,氢氧化钠吸收空气中的水蒸气在表面形成了溶液,可观察到“出汗”,故B正确;
C.生成的氢氧化钠再与空气中的二氧化碳反应生成碳酸钠的结晶水合物,最终风化变成白色粉末为碳酸钠,故C正确;
D.整个过程中只有Na→Na2O的过程中有元素的化合价变化,属于氧化还原反应,其余均不是氧化还原反应,故D错误;
故选D.点评:
本题考点: 钠的化学性质.
考点点评: 本题考查钠在空气中的一系列变化,明确钠及其化合物的性质是解答本题的关键,注意发生的化学反应及氧化还原反应的判断,题目难度不大.1年前查看全部
- 在实验室里,某同学取一小块金属钠做与水反应的实验.试完成下列问题:
在实验室里,某同学取一小块金属钠做与水反应的实验.试完成下列问题:
(1)切开的金属钠暴露在空气中,最先观察到的现象是______,所发生反应的化学方程式是______.
(2)将钠投入水中后,钠融化成一个小球,根据这一现象你能得出的结论是:①______,②______.将一小块钠投入盛有饱和石灰水的烧杯中,不可能观察到的现象是______(填编号).
A.有气体生成 B.钠融化成小球并在液面上游动
C.溶液底部有银白色的金属钙生成D.溶液变浑浊
(3)在钠与水反应过程中,若生成标准状况下224mL的H2,则转移的电子的物质的量为______.
(4)根据上述实验过程中钠所发生的有关变化,试说明将金属钠保存在煤油中的目的是______. 酒窝女人1年前1
酒窝女人1年前1 -
 wolfljj 共回答了21个问题
wolfljj 共回答了21个问题 |采纳率76.2%解题思路:(1)钠暴露在空气中和氧气反应生成氧化钠而变暗;
(2)钠熔成小球,说明钠和水放出的热量使钠熔化;
钠的密度小于水,钠的熔点较低,钠和水反应生成氢氧化钠和氢气且放出热量,钠和水反应生成氢氧化钠和氢气,随着反应的进行水的量减少,氢氧化钙溶液成为过饱和溶液,溶液中析出部分氢氧化钙,因为有氢氧化钠的存在,抑制氢氧化钙的溶解;
(3)根据氢气和转移电子之间的关系式计算;
(4)钠能和氧气、水反应,和煤油不反应.(1)钠放置在空气中和氧气反应生成氧化钠而变暗,反应方程式为:4Na+O2═2Na2O,
故答案为:钠块表面由银白色变为暗灰色(或钠块表面变暗);4Na+O2═2Na2O;
(2)钠熔成小球,说明钠和水放出的热量使钠熔化,同时说明钠的熔点较低;
A.钠和水反应生成氢气,所以能观察到,故错误;
B.钠的熔点较低且钠和水反应放出大量的热使钠熔成小球,所以能观察到,故错误;
C.钙的活泼性大于钠,且钠、钙都易和水反应生成碱,所以钠不可能置换出钙,则看不到有金属钙生成,故正确;
D.因为有部分溶质析出而导致溶液成悬浊液,所以看到溶液变浑浊,故错误;
故选C;
故答案为:钠与水反应放出热量;钠的熔点低;C;
(3)224mL氢气的物质的量=[0.224L/22.4L/mol]=0.01mol,转移电子的物质的量=0.01mol×2×(1-0)=0.02mol,故答案为:0.02mol;
(4)根据以上知,钠能和氧气、水反应,和煤油不反应,且钠的密度大于煤油,所以钠可以保存在煤油中以隔绝空气和水,故答案为:隔绝钠与空气中的氧气和水蒸气的接触.点评:
本题考点: 钠的化学性质.
考点点评: 本题考查了钠的性质,根据钠的物理性质和化学性质分析钠和水反应现象、钠的贮存,注意钠和饱和氢氧化钙溶液反应现象,氢氧化钙的溶解度随着温度的升高而降低,为易错点.1年前查看全部
- 写出下列反应的化学方程式和离子方程式,是氧化还原反应的指出氧化剂和还原剂 (1)金属钠投入水中(2)铝丝加入到氢氧化钠溶
写出下列反应的化学方程式和离子方程式,是氧化还原反应的指出氧化剂和还原剂 (1)金属钠投入水中(2)铝丝加入到氢氧化钠溶液中(3)铝丝加入到稀硫酸中
 64518201年前1
64518201年前1 -
 笔迷麦兜兜 共回答了1个问题
笔迷麦兜兜 共回答了1个问题 |采纳率100%Na十H2O=Na0H十H2(气体符号)1年前查看全部
- 将一小块金属钠放置在空气中较长时间,请描述 可能出现的现象,写出可能发生的化学反应方程式
将一小块金属钠放置在空气中较长时间,请描述 可能出现的现象,写出可能发生的化学反应方程式
我自己做这个题,写出的化学方程式是
①4Na+O2==2Na2O
②Na2O+H2O==2NaOH
③Na2O+CO2==Na2CO3
④2NaOH+CO2==Na2CO3+H2O
可是从往常一查,发现没有第三个方程式,为什么? 撒旦先生牛1年前2
撒旦先生牛1年前2 -
 心自罗衣 共回答了13个问题
心自罗衣 共回答了13个问题 |采纳率84.6%a.变暗,是Na与空气中的O2反应,生成了Na2O
Na+O2=2Na2O
b.变成白色固体,是Na2O与空气中的水反应生成NaOH
Na2O+H2O=2NaOH
c.变成液体,是因为生成的NaOH会潮解,与水结合形成溶液
d.变成白色粉末,是NaOH溶液与空气中的CO2反应,生成Na2CO3后水分挥发风化形成的,达到最后一步需要较长时间.
2NaOH+CO2=Na2CO3+H2O
空气中只有百分之0.03的CO2,无论和Na20反应多剧烈,反应物太少,反应速度并不快.但是NaOH的潮解可是非常快的,10分钟就可以让一小块NaOH成为一小摊溶液,所以一旦Na2O与水形成了NaOH,NaOH就会吸收更多的水来和Na2O反应,所以是先生成NaOH,同时潮解,再慢慢地成为Na2CO3溶液,再蒸发为Na2CO3-10H2O结晶,再风化为Na2CO3粉末.1年前查看全部
- 下列叙述中不正确的是( ) A.铝制、铁制容器常温下可以盛放浓硫酸和浓硝酸 B.久置的浓硝酸呈黄色 C.金属钠与CuS
下列叙述中不正确的是( ) A.铝制、铁制容器常温下可以盛放浓硫酸和浓硝酸 B.久置的浓硝酸呈黄色 C.金属钠与CuSO 4 溶液反应能析出单质Cu D.浓硫酸是一种干燥剂,能够干燥Cl 2 、氧气等气体  wergredf1年前1
wergredf1年前1 -
 陶晶姚莹 共回答了22个问题
陶晶姚莹 共回答了22个问题 |采纳率86.4%A.常温下,Al、Fe和浓硫酸、浓硝酸反应生成一层致密的氧化物薄膜而阻止进一步被氧化,该现象是钝化现象,故A正确;
B.浓硝酸不稳定,易分解生成二氧化氮,二氧化氮溶于稀硝酸而使溶液呈黄色,故B正确;
C.钠投入硫酸铜溶液中时,钠和水反应生成NaOH和氢气,NaOH和硫酸铜发生复分解反应生成氢氧化铜,所以不能置换出Cu,故C错误;
D.浓硫酸具有酸的通性、强氧化性,能干燥酸性或中性的非还原性气体,浓硫酸和Cl 2 、氧气等气体不反应,所以可以干燥Cl 2 、氧气等气体,故D正确;
故选C.1年前查看全部
- 问几道高一化学题.急!1、有一块表面部分被氧化为氧化钠的金属钠试样,设其钠在反应中生成氢气的质量为m3g,中和反应所得的
问几道高一化学题.急!
1、有一块表面部分被氧化为氧化钠的金属钠试样,设其钠在反应中生成氢气的质量为m3g,中和反应所得的氢氧化钠消耗H2SO4的质量为m4g,写出计算钠纯度的数学表达式.
2、将ag的钠投入bg水中{水过量},在反应后所得溶液中溶质的质量分数是多少?
3、将一块29.2g表面被氧化{氧化产物是氧化钠}的金属钠,分多次小心投入71.8水里,最终得到100g溶液.
(1)金属钠的纯度
(2)所得溶液中溶质的质量分数.
P.S以上问题请写过程,今晚之内要,会悬赏.
 心呢1年前1
心呢1年前1 -
 jdgdwl 共回答了19个问题
jdgdwl 共回答了19个问题 |采纳率94.7%1.
2Na--H2--2NaOH
46 2 80
23M3 M3 40M3
2NaOH--H2SO4
80 98
M4 40M4/49
所以 钠纯度的数学表达=40M3/(40M4/49)
2.
Na--NaOH--- 差量
23 40 1
a 40a/23 a/23
溶液的质量 a+b-a/23=22a/23+b
溶质的质量分数是多少 40a/23 /(22a/23+b)
3.
H2的质量为 29.2+71.8-100=1 g
2Na--H2--2NaOH
46 2 80
X 1 Y=8
X=23g 金属钠的纯度=23/29.2=78.8%
那么Na20的质量 29.2-23=6.2
Na2O-2NaOH
62 80
6.2 Z=8
那么NaOH的质量为8+8=16
溶质的质量分数16/100=16%
不懂+我Q 4598129871年前查看全部
- .2.3 g金属钠变为钠离子失去电子数为0.1NA
 毛毛她ee1年前1
毛毛她ee1年前1 -
 moon蝙蝠小侠 共回答了19个问题
moon蝙蝠小侠 共回答了19个问题 |采纳率94.7%正确
2.3gNa为0.1mol,转化为Na+时失0.1mol电子,即0.1NA1年前查看全部
- 高一化学将金属钠分别投入下列物质的水溶液中,有气体放出,且溶液质量减轻的是
高一化学将金属钠分别投入下列物质的水溶液中,有气体放出,且溶液质量减轻的是
将金属钠分别投入到下列物质的溶液中,有气体放出,且溶液质量减轻的是( )
A、HCl
B、K2SO4
C、CuCl2
D、饱和NaOH溶液 范伟1年前1
范伟1年前1 -
 lianjing 共回答了19个问题
lianjing 共回答了19个问题 |采纳率84.2%C D1年前查看全部
- 用铝 包裹2.3g金属钠用铝箔包裹住2.3g金属钠,用针扎出一些小孔,用镊子夹住,放入水中,待完全反应后,收集到的气体在
用铝 包裹2.3g金属钠
用铝箔包裹住2.3g金属钠,用针扎出一些小孔,用镊子夹住,放入水中,待完全反应后,收集到的气体在标准状况下的体积为().
A.1.12L B.0.56L
C.大于1.12L D.小于1.12L
我要知道理由. wxs4251年前1
wxs4251年前1 -
 d9gb 共回答了20个问题
d9gb 共回答了20个问题 |采纳率100%首先钠要和水反应生成氢氧化钠 放出氢气
然后铝和氢氧化钠和水反应放出氢气
因此生成2份氢气
化学方程式太麻烦我不打了
你算一下应该是C
麻烦你了哈1年前查看全部
- 将4.6g金属钠投入一定量水中,反应完成后得100mL溶液.求:
将4.6g金属钠投入一定量水中,反应完成后得100mL溶液.求:
(1)生成气体在标准状况下的体积?______
(2)反应后溶液中溶质的物质的量浓度是多少?______. nl10011年前1
nl10011年前1 -
 鸟成皿 共回答了19个问题
鸟成皿 共回答了19个问题 |采纳率100%解题思路:n(Na)=[4.6g/23g/mol]=0.2mol,与水发生2Na+2H2O=2NaOH+H2↑,结合反应的方程式计算该题.n(Na)=[4.6g/23g/mol]=0.2mol,与水发生2Na+2H2O=2NaOH+H2↑,则
2Na+2H2O=2NaOH+H2↑,
2mol 2mol22.4L
0.2mol 0.2mol 2.24L
(1)由以上分析可知生成气体在标准状况下的体积为2.24L,故答案为:2.24L;
(2)c(NaOH)=[0.2mol/0.1L]=2mol•L-1,故答案为:2mol•L-1.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查化学方程式的计算,侧重于学生的分析能力和计算能力的考查,注意根据反应的化学方程式可计算该题,难度不大.1年前查看全部
- 乳酸和氢氧化钠反应时乳酸的羟基中的氢不会被钠取代,而和金属钠反应时乳酸中的羟基的氢就会被取代呢?
乳酸和氢氧化钠反应时乳酸的羟基中的氢不会被钠取代,而和金属钠反应时乳酸中的羟基的氢就会被取代呢?
CH3CH(OH)COOH+NaOH→CH3CH(OH)COONa+H2O
CH3CH(OH)COOH+Na→CH3CHONaCOONa+H2↑ 花骨朵儿20061年前2
花骨朵儿20061年前2 -
 爱睡觉的小胖 共回答了18个问题
爱睡觉的小胖 共回答了18个问题 |采纳率94.4%这个取代就用错了,严格说这不是取代.第一个反应是中和反应,不是钠取代了氢,这实际是氢氧根离子和氢离子的中和反应,氢氧根很多,乳酸的羧酸基团不断离解出氢离子与之反应,而羟基基团不参与反应.
第二个反应是个置换反应.由于钠的还原性极强,极易失去电子,乳酸的羧酸和羟基两个基团中的氢都被钠还原出来了,这个解释不太准确,但应该能有助你理解.虽然这是有机反应,但从离子反应的角度理解还是很有价值的.
不能看表象应该看实质,第一个钠是正一价离子,反应其实就没有参与不是说“置换”上去了
第二个是0价的钠单质,参与了反应,由0价变成了正一价.1年前查看全部
- 阿司匹林(结构简式如图)又名乙酰水杨酸,推断它不应具有的性质( ) A.与Na 2 CO 3 反应 B.与金属钠反应
阿司匹林(结构简式如图)又名乙酰水杨酸,推断它不应具有的性质( ) A.与Na 2 CO 3 反应 B.与金属钠反应 C.与乙酸发生酯化反应 D.与乙醇发生酯化反应 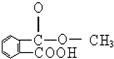
 jammsl1年前1
jammsl1年前1 -
 puma_df 共回答了17个问题
puma_df 共回答了17个问题 |采纳率76.5%A、乙酰水杨酸中含有羧基,具有羧酸的性质,能和碳酸钠反应生成盐和水、二氧化碳,故A正确;
B、乙酰水杨酸中含有羧基,具有酸的性质,能和金属钠发生置换反应生成氢气和盐,故B正确;
C、该物质中不含醇羟基,所以和乙酸不能发生酯化反应,但该物质含有羧基,能和醇发生酯化反应,故C错误;
D、乙酰水杨酸中含有羧基,具有酸的性质,能和醇发生酯化反应,故D正确;
故选C.1年前查看全部
- A、B、C三种醇同足量的金属钠完全反应,在相同条件下产生相同体积的氢气,消耗这三种醇的物质的量之比为2:6:3,则A、B
A、B、C三种醇同足量的金属钠完全反应,在相同条件下产生相同体积的氢气,消耗这三种醇的物质的量之比为2:6:3,则A、B、C三种醇分子里羟基数之比是多少?(答案是3:1:2)
 空山寂静1年前3
空山寂静1年前3 -
 shmily3216 共回答了21个问题
shmily3216 共回答了21个问题 |采纳率90.5%因为一个羟基能和NA反应得0.5MOL的氢气,所以在产生相同氢气时,羟基的摩尔量相同.设醇的羟基分别为X,Y,Z,则2X=6Y=3Z,所以答案为X:Y:Z=3:1:21年前查看全部
- 目前,世界上多采用电解熔融氯化钠的方法来生产金属钠:2NaCl(熔融) 通电 . 2Na+
目前,世界上多采用电解熔融氯化钠的方法来生产金属钠:2NaCl(熔融)
2Na+Cl2↑.已知物质A、B、C、D、E、F有如图所示转化关系:通电 .
(1)试根据上述变化写出A、B、C、D、E、F的化学式:
A______,B______,C______,
D______,E______,F______.
(2)电子工业常用30%的D溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出D溶液与铜反应的离子方程式:______,反应后可用______(填化学式)来检验溶液中D的阳离子有无剩余. kbds1231年前1
kbds1231年前1 -
 佳期想约 共回答了10个问题
佳期想约 共回答了10个问题 |采纳率90%解题思路:由转化流程可知,A与水反应生成C,且C与二氧化碳反应,则A为Na,C为NaOH、E为Na2CO3,B为Cl2,D为FeCl3,F为CaCl2,然后结合元素化合价知识及化学用语来解答.由转化流程可知,A与水反应生成C,且C与二氧化碳反应,则A为Na,C为NaOH、E为Na2CO3,B为Cl2,D为FeCl3,F为CaCl2,
(1)由流程可知,A为Na,C为NaOH、E为Na2CO3,B为Cl2,D为FeCl3,F为CaCl2,故答案为:Na;Cl2;NaOH;FeCl3;Na2CO3;CaCl2;
(2)D为FeCl3,具有强氧化性,可与铜反应,反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+,如Fe3+无剩余,加入KSCN后溶液不变色,
故答案为:2Fe3++Cu=2Fe2++Cu2+;KSCN.点评:
本题考点: 无机物的推断.
考点点评: 本题考查无机物的推断,为高频考点,把握钠及其化合物的性质、氯气的性质是解答本题的关键,注意物质之间的转化即可解答,题目难度不大.1年前查看全部
- 在我们的化学课本上有这样一句话“金属钠在空气中燃烧生成过氧化钠”,但是下面的化学式是这样的:
在我们的化学课本上有这样一句话“金属钠在空气中燃烧生成过氧化钠”,但是下面的化学式是这样的:
2Na+O2〓Na2O2(2钠和1氧气加热生成1过氧化钠)
这个不是加热吗?上面说的“燃烧”应该指点燃吧? erwig1年前5
erwig1年前5 -
 19870523 共回答了24个问题
19870523 共回答了24个问题 |采纳率87.5%△ 高三后就代表点燃、加热.点燃就点一下,之后不管他,而加热是持续的.燃烧是一种现象,而点燃是过程.
△ 高三后就不那么有准确的含义了,高温煅烧、点燃、加热都用△ 表示,没必要太较真,但有的反应要注意可逆号、是否用催化剂(用就在等号上标出,没地方就标下边)1年前查看全部
- 某饱和一元醇37g跟足量金属钠反应,收集到5.6L的氢气.此醇是
某饱和一元醇37g跟足量金属钠反应,收集到5.6L的氢气.此醇是
答案是C4H9OH! 756181841年前1
756181841年前1 -
 江龙河 共回答了14个问题
江龙河 共回答了14个问题 |采纳率92.9%条件不充分,氢气的体积应注明标准状况下.
假设是在标准状况下,1mol气体的体积是22.4L,5.6L氢气是0.25mol(0.5g),由方程式的定量关系可计算出醇的分子量为74,CnH(n+2)O 12n+2n+2+16=74,n=41年前查看全部
- 一块表面已部分氧化(氧化层为Na2O)的金属钠样品质量为0.77g,放入100mL水中后,得到标准状况下氢气的体积224
一块表面已部分氧化(氧化层为Na2O)的金属钠样品质量为0.77g,放入100mL水中后,得到标准状况下氢气的体积224mL,求:
(1)该金属钠样品中含金属钠多少克?
(2)所得溶液溶质的物质的量浓度约为多少?(设所得溶液的体积仍为100mL) wu7301951年前1
wu7301951年前1 -
 天天4927 共回答了17个问题
天天4927 共回答了17个问题 |采纳率82.4%解题思路:(1)根据n=[n/V]计算氢气的物质的量,再根据反应2Na+2H2O=2NaOH+H2↑计算样品中Na的质量;
(2)计算Na2O的质量,利用n=[m/M]计算二者的物质的量,再利用钠元素守恒计算生成NaOH的总物质的量,根据c=[n/V]计算氢氧化钠的浓度.(1)n(H2)=[0.224L/22.4L/mol]=0.01mol,
2Na+2H2O=2NaOH+H2↑
46g1mol
m(Na) 0.01mol
m(Na)=0.46g,
答:金属钠样品中含金属钠质量是0.46g;
(2)m(Na2O)=0.77g-0.46g=0.31g,n(Na2O)=[0.31g/62g/mol]=0.005mol,混合物中n(Na)=[0.46g/23g/mol]=0.02mol,
根据钠元素守恒,与水反应生成的n(NaOH)=0.02mol+0.005mol×2=0.03mol,
c(NaOH)=[0.03mol/0.1L]=0.3mol/L,
答:所得溶液的溶质的物质的量浓度是0.3mol/L.点评:
本题考点: 化学方程式的有关计算;有关混合物反应的计算.
考点点评: 本题考查混合物的计算、根据方程式的计算等,难度不大,注意根据Na元素质量守恒计算氢氧化钠.1年前查看全部
- 将表面已被氧化为氧化钠的金属钠10.8g投入89.4g水中溶解,共收集到2.24L气体(标准状况),所得.溶液密度为1.
将表面已被氧化为氧化钠的金属钠10.8g投入89.4g水中溶解,共收集到2.24L气体(标准状况),所得.溶液密度为1.2g/mL.
1.氧化钠的质量是多少?
2.所得溶液的质量分数是多少?
3.所得溶液的物质的量浓度是多少? Jesse_丁点1年前1
Jesse_丁点1年前1 -
 xilinx2001 共回答了15个问题
xilinx2001 共回答了15个问题 |采纳率93.3%气体是H2,是Na和H2O反应得到的,n(H2)=2.24/22.4 = 0.1mol
2Na+2H2O==2NaOH+H2↑
2.1
n(Na).0.1
所以2/n(Na) = 1/0.1
解得n(Na) = 0.2mol
m(Na) = 23*0.2=4.6g
所以m(Na2O) = 10.8-4.6 = 6.2g
n(Na2O) = 6.2/62 = 0.1mol
反应后Na和Na2O中的Na元素全部转化为NaOH
所以n(NaOH) = 0.2+2*0.1 = 0.4mol
m(NaOH) = 40*0.4 = 16g
溶液质量 = 10.8+89.4 - 2*0.1 = 100g
所以溶液质量分数 = 40*0.4/100 = 16%
溶液体积 = 100/1.2 = 83.3ml = 0.0833L
溶液的物质的量浓度 = 0.4/0.0833 = 4.8mol/L1年前查看全部
- 由于金属钠很容易与空气中的______、______等物质反应,少量的钠通常将它保存在______里;在实验室里做钠跟水
由于金属钠很容易与空气中的______、______等物质反应,少量的钠通常将它保存在______里;在实验室里做钠跟水反应的实验时,用到的仪器是______.(填序号)
a.试管夹b.镊子c.小刀 d.冷凝管e.滤纸f.研钵
g.烧杯 h.坩埚 i.石棉网j.玻璃片 k.药匙 l.燃烧匙. zycyn20041年前1
zycyn20041年前1 -
 mtl1123 共回答了17个问题
mtl1123 共回答了17个问题 |采纳率94.1%解题思路:金属钠是活泼金属易和空气中的水蒸气、氧气发生反应变质,所以保存金属钠需要隔绝空气,密度大于煤油,小于水,实验室中把少量钠保存在煤油中,钠和水反应剧烈,依据实验过程分析需要的仪器.金属钠是活泼金属易和空气中的水蒸气、氧气发生反应变质,2Na+2H2O=2NaOH+H2↑,4Na+O2=2Na2O,所以保存金属钠需要隔绝空气,密度大于煤油,小于水,实验室中把少量钠保存在煤油中,钠和水反应剧烈,依据实验过程分析需要的仪器,取用金属钠用镊子,用滤纸擦干净表面煤油,在玻璃片上用小刀切一粒金属钠放入盛水的烧杯中,观察防辐射反应的现象,需要的仪器bcej;
故答案为:氧气;水;煤油;bcej.点评:
本题考点: 常见金属元素的单质及其化合物的综合应用.
考点点评: 本题考查了钠的性质分析应用,钠和水反应的实验过程基本操作,掌握基础是关键,题目较简单.1年前查看全部
- 金属钠,钾除煤油外还与哪些液体不反应?
金属钠,钾除煤油外还与哪些液体不反应?
煤油在化学试剂店买不到,有哪些液体可以代替煤油? 彬璇1年前1
彬璇1年前1 -
 浪子353 共回答了22个问题
浪子353 共回答了22个问题 |采纳率86.4%烃类都行,苯,汽油,柴油等1年前查看全部
- 下列过程中,不涉及氧化还原反应的是( ) A.浓硫酸加入蔗糖固体中 B.金属钠放置在空气中变质 C.SO 2 使品红溶
下列过程中,不涉及氧化还原反应的是( ) A.浓硫酸加入蔗糖固体中 B.金属钠放置在空气中变质 C.SO 2 使品红溶液褪色 D.NO 2 形成酸雨  dixq5481年前1
dixq5481年前1 -
 黑皮游 共回答了10个问题
黑皮游 共回答了10个问题 |采纳率100%A.浓硫酸加入蔗糖固体中,浓硫酸使蔗糖发生了脱水反应,该反应中硫元素化合价由+6价变为+4价,所以涉及氧化还原反应,故A错误;
B.钠和氧气反应生成氧化钠,该反应中氧元素化合价由0价变为-2价,所以涉及氧化还原反应,故B错误;
C.二氧化硫使品红溶液褪色,是因为二氧化硫和有色物质反应生成了无色物质,该反应中没有元素化合价变化,所以不涉及氧化还原反应,故C正确;
D.二氧化氮和水反应生成硝酸和一氧化氮,该反应中N元素化合价由+4价变为+5价和+2价,所以有元素化合价变化,涉及氧化还原反应,故D错误;
故选C.1年前查看全部
- 等质量的金属钠,氧化钠,过氧化钠和氢氧化钠分别投入100g水中,所得稀溶液的质量分数大小顺序为
等质量的金属钠,氧化钠,过氧化钠和氢氧化钠分别投入100g水中,所得稀溶液的质量分数大小顺序为
除了死算,我想问还有没有别的好的解题技巧,可以考试节约时间的那种. smweb1年前1
smweb1年前1 -
 ketav123 共回答了21个问题
ketav123 共回答了21个问题 |采纳率90.5%真是一个勤于思考的学生!
我认为可以这样来思考:钠的质量分数越大,所得稀溶液的质量分数越大.因为它们的产物都是氢氧化钠,钠的质量分数越大,等质量投入100g水中后生产的氢氧化钠的质量越大,有的虽然放出了气体,但是影响不大.从而可以较快的得到答案.1年前查看全部
- A和B两种物质的分子式都是C 7 H 8 O,它们都能跟金属钠反应放出氢气。A不溶于NaOH溶液,而B能溶于NaOH溶液
A和B两种物质的分子式都是C 7 H 8 O,它们都能跟金属钠反应放出氢气。A不溶于NaOH溶液,而B能溶于NaOH溶液。B能使适量溴水褪色,并产生白色沉淀,A不能。B苯环的一溴代物有两种结构。
写出A和B的结构简式。 A:_____________________________,B:_____________________________。 最酷的Tony1年前1
最酷的Tony1年前1 -
 forget5 共回答了12个问题
forget5 共回答了12个问题 |采纳率100%1年前查看全部
- 钠与水反应,用镊子从煤油中取出金属钠,切下绿豆大小的钠,放入装满水的烧杯中.
钠与水反应,用镊子从煤油中取出金属钠,切下绿豆大小的钠,放入装满水的烧杯中.
哪里错误?理由. 超爱坤1年前4
超爱坤1年前4 -
 其实我不爱八卦 共回答了23个问题
其实我不爱八卦 共回答了23个问题 |采纳率91.3%第一:放金属钠块的小烧杯里的纯水的体积应该为烧杯容积的1/2~1/3之间.
如果水是满杯的,钠与水的剧烈反应能使溶液溢出烧杯,可能发生安
全事故.
第二:切金属钠后要用清洁、干燥的滤纸把金属钠块表面的煤油吸附掉后再
投放于水中使其反应平稳、顺利.1年前查看全部
- 用金属钠或则镁来处理95.6%的乙醇,就不用考虑钠和酒精的反应么?
用金属钠或则镁来处理95.6%的乙醇,就不用考虑钠和酒精的反应么?
用金属钠或则镁来处理95.6%的乙醇,
利用活泼金属与微量水反应形成无水乙醇,
就不用考虑钠和酒精的反应么?镁也可以和乙醇反应的 yc91r7zvcjojc41年前2
yc91r7zvcjojc41年前2 -
 黏鞑鞑 共回答了9个问题
黏鞑鞑 共回答了9个问题 |采纳率88.9%知道是95.6%了就可以算出钠或镁的用量了,它们与更活泼的水反应完了就不会和影响乙醇了1年前查看全部
- 2.22g某醇与足量的金属钠反应收集到标准状况下的气体336mL,则该醇分子式
 xuanzhe7771年前1
xuanzhe7771年前1 -
 ah_sba 共回答了13个问题
ah_sba 共回答了13个问题 |采纳率76.9%醇与钠反应生成醇钠与氢气2ROH+2Na====2RONa+H2生成氢气物质的量n(H2)=0.336/22.4=0.015mol2.22g该醇中醇羟基的物质的量n(-OH)=0.015*2=0.03mol于是含有1mol醇羟基的该醇,质量为2.22/0.03=74g假定该醇是饱和一元醇,...1年前查看全部
- 0.2mol的C2H6O2恰与9.2克金属钠完全反应,试确定有机物的结构简式
 littlejew1年前2
littlejew1年前2 -
 岭水 共回答了11个问题
岭水 共回答了11个问题 |采纳率100%9.2g钠即有0.4mol 钠,说明C2H6O2有两个基团可以与钠反应,这两个基团为-OH,
所以C2H6O2的结构为HO-CH2-CH2-OH1年前查看全部
- 为什么金属钠与水反应会熔化成一个光亮的小球?
为什么金属钠与水反应会熔化成一个光亮的小球?
原理是什么? apple520871年前3
apple520871年前3 -
 悠然子涯 共回答了18个问题
悠然子涯 共回答了18个问题 |采纳率83.3%Na+H2O-》NaOH+H2
因为钠的熔点比较低,当与水发生剧烈反映的时候,产生的热足以使它融化.
在看为什么融化了的钠会有自动形成球形的趋势.
这个是由于液体的表面张力造成的.由于表面张力,液体表面的分子会使这个液滴有“自我束缚”的效果,结果就是成了球形了.如果是在外太空的失重条件下,会形成一个绝对的球体,由于地球有引力,所以,你说的球其实不是一个真正的圆球,而是一个椭球.1年前查看全部
- 将4.6g金属钠投入到95.6g的水中,得到的溶液溶质的质量分数是?
将4.6g金属钠投入到95.6g的水中,得到的溶液溶质的质量分数是?
(溶质溶液都是什么啊?如何算溶质的质量分数..我认为溶质是Na啊.溶质质量分数不就是用4.6/2+4.[2是计算出水的质量)
2.同温同压下,等质量的二氧化硫和二氧化碳相比较,下列叙述正确的
A.氧原子数之比为16:11 B密度比为11:16
C.体积比为1:1 D 体积比为11:16
(真搞不懂和密度有什么关系.我目前只能理解1:1 这些11、16数字都是从哪里来的.) ccaijh1年前1
ccaijh1年前1 -
 一般般7 共回答了26个问题
一般般7 共回答了26个问题 |采纳率100%1溶质是钠与水反应生成的NaOH,2Na+2H2O==2NaoH+H2
于是反应生成了0.1mol的氢气.故溶液总质量是4.6+95.6-0.2=100
溶液溶质的质量分数为0.2*40(NaOH的质量)/100(总质量)=8%
二氧化硫与二氧化碳摩尔质量之比为64比44,化简为16比11
同温同压下,等质量则物质的量之比和摩尔质量之比成反比.n(二氧化硫)比n(CO2)=11比16
体积比=物质的量之比11比16
氧原子数之比为11*2比16*2=11比16
由PV=nRT得体积比为11:16(P是压强,V是体积,n是物质的量,R是一个常数,可以不管,T是温度)
密度=质量/体积.质量一样,密度与体积成反比,而体积比又等于物质的量之比
所以密度比为16:11
选D1年前查看全部
- 将2.3g金属钠放入91.8g水中,反应完全后,溶液中Na+与H2O分子的个数比为( )
将2.3g金属钠放入91.8g水中,反应完全后,溶液中Na+与H2O分子的个数比为( )
A. 1:50
B. 1:25
C. 2:75
D. 1:51 光明31年前1
光明31年前1 -
 benmba2005 共回答了11个问题
benmba2005 共回答了11个问题 |采纳率100%解题思路:根据n=[m/M]计算Na、水的物质的量,根据2Na+2H2O═2NaOH+H2↑,计算参加反应水的物质的量,进而计算形成的溶液中水的物质的量,溶液中n(Na+)=n(Na),进而计算溶液中Na+与H2O分子的个数比.2.3g Na的物质的量=[2.3g/23g/mol]=0.1mol,
91.8g 水的物质的量=[91.8g/18g/mol]=5.1mol,
根据2Na+2H2O═2NaOH+H2↑,可知参加反应水的物质的量为0.1mol,故溶液中水的物质的量=5.1mol-0.1mol=5mol,
溶液中n(Na+)=n(Na)=0.1mol,
故溶液中Na+与H2O分子的个数比=0.1mol:5mol=1:50,
故选A.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查化学方程式的有关计算,难度不大,学生容易忽略参加反应的水,而导致错误的答案.1年前查看全部
- 下列说法正确的是( )A. 铅蓄电池放电时铅电极发生还原反应B. 电解饱和食盐水在阳极得到氯气,阴极得到金属钠C. 给
下列说法正确的是( )
A. 铅蓄电池放电时铅电极发生还原反应
B. 电解饱和食盐水在阳极得到氯气,阴极得到金属钠
C. 给铁钉镀铜可采用CuSO4作电镀液
D. 生铁浸泡在食盐水中发生析氢腐蚀 雪晶乐乐1年前1
雪晶乐乐1年前1 -
 persha 共回答了19个问题
persha 共回答了19个问题 |采纳率78.9%解题思路:A.铅蓄电池放电时铅电极为原电池的负极;
B.电解饱和食盐水得到氢气、氯气和氢氧化钠;
C.电镀时用含镀层金属的阳离子的盐做电解质溶液;
D.生铁浸泡在食盐水中发生吸氧腐蚀.A.铅蓄电池放电时铅电极为原电池的负极,发生氧化反应,正极发生还原反应,故A错误;
B.电解饱和食盐水得到氢气、氯气和氢氧化钠,阴极上得到氢气和氢氧化钠,故B错误;
C.电镀时用含镀层金属的阳离子的盐做电解质溶液,则给铁钉镀铜可采用CuSO4作电镀液,故C正确;
D.生铁浸泡在食盐水中发生吸氧腐蚀,在酸性溶液中发生析氢腐蚀,故D错误.
故选C.点评:
本题考点: 常见化学电源的种类及其工作原理;原电池和电解池的工作原理.
考点点评: 本题考查电化学知识,题目难度不大,注意原电池的工作原理、电镀以及金属的腐蚀及防护措施.1年前查看全部
- (1)某芳香族化合物A的分子式为C7H8O,A与金属钠不发生反应,与浓的氢碘酸反应生成两个化合物B和C。
(1)某芳香族化合物A的分子式为C7H8O,A与金属钠不发生反应,与浓的氢碘酸反应生成两个化合物B和C。
B能溶于氢氧化钠溶液中,并与三氯化铁显色。C与硝酸银的醇溶液作用,生成黄色的碘化银。试写出A、B、C的结构式,并写出各步反应式
 走掉了1年前1
走掉了1年前1 -
 茶亭佬 共回答了23个问题
茶亭佬 共回答了23个问题 |采纳率82.6%A为C6H5-O-CH3甲基苯基醚,B为C6H5-OH苯酚,C为CH3I一碘甲烷,C6H5-O-CH3+HI----C6H5-OH+CH3I,C6H5-OH+NaOH----C6H5-ONa+H2O,CH3I+AgNO3+CH3CH2OH---CH3OCH2CH3+AgI+HNO31年前查看全部
- 将1.2MOL 金属钠与下列物质反应在标准状况下能生成11.2L氢气的是
将1.2MOL 金属钠与下列物质反应在标准状况下能生成11.2L氢气的是
(A)1MOL乙醇
(B)1MOL乙二醇
(C)含1MOL甲醇的水溶液
(D)1MOL丙二醇
我做出来怎么每个选项都是生成0.6mol的氢气啊 uway1年前1
uway1年前1 -
 nqwi 共回答了20个问题
nqwi 共回答了20个问题 |采纳率85%2NA+2H2O=2NaOH+H2
2CH3CH2OH+2NA=2CH3CH2ONA+H2
选A的.1MOL乙醇反应完了就完了,NA是过量的.没有水的.1年前查看全部
- 金属钠和水反应生成氢氧化钠和氢气的化学方程式
 生晓百湖江1年前8
生晓百湖江1年前8 -
 海上花2007 共回答了15个问题
海上花2007 共回答了15个问题 |采纳率80%2Na+2H2O=2NaOH+H2↑1年前查看全部
- 在一块表面氧化成氧化钠的金属钠,总质量为5.22g,投入到94.88g水(足量)中,待充分反应后收集到氢气0.2g
在一块表面氧化成氧化钠的金属钠,总质量为5.22g,投入到94.88g水(足量)中,待充分反应后收集到氢气0.2g
求(1)其中含氧化钠的质量是多少克?
(2)反应后所得氢氧化钠溶液的质量分数是多少?
 独孤百1年前1
独孤百1年前1 -
 ll_sky 共回答了14个问题
ll_sky 共回答了14个问题 |采纳率100%2Na+2H2O=2NaOH+H2
46 2
m 0,2
46/m=2/0.2
m=4.6g
所以其中含氧化钠的质量为5.22-4.6=0.62g
(2)
4.6gNa生成4.6/23*40=8gNaOH
0.62gNa2O生成0.62/62*2*40=0.8gNaOH
一共生成8+0.8=8.8gNaOH
反应后所得氢氧化钠溶液的质量分数为8.8/(5.22+94.88-0.2)=8.7%1年前查看全部
- 把一小块银白色的金属钠投入盛有蒸馏水的烧杯中(如图a所示).可以看到钠块浮在水面上,与水发生剧烈反应,反应放出的热量使钠
把一小块银白色的金属钠投入盛有蒸馏水的烧杯中(如图a所示).可以看到钠块浮在水面上,与水发生剧烈反应,反应放出的热量使钠熔成小球,并使生成的氢气燃烧.
如果在上述盛蒸馏水的烧杯中先注入一些煤油,再投入金属钠,可以看到金属钠悬浮在煤油和水的界面上(如图b所示),同样与水发生剧烈的反应,但是不发生燃烧.
1.金属钠的物理性质有_____ _____ ______
2.通过以上现象可以判断出化学反应伴随的现象之一____________.
3.图b中不发生燃烧现象说明煤油隔绝了_____.

 指着太阳说R1年前4
指着太阳说R1年前4 -
 万里追情 共回答了20个问题
万里追情 共回答了20个问题 |采纳率95%密度比水小(因为钠块浮在水面上)、熔点低(使钠熔成小球)、银白色金属(题目原话)
产生气体 (或 热量变化)
氧气(或 空气)(产生H2,所以有可燃物;放出的热量也没有减少.因此只能是缺少氧气)1年前查看全部
- 将2.3g金属钠放入91.8g水中,反应后,溶液中钠离子与水分子的个数比为()
 有一说一1年前1
有一说一1年前1 -
 maniacsprite 共回答了14个问题
maniacsprite 共回答了14个问题 |采纳率92.9%Na与水1:1反应,2.3gNa为0.1mol,共有Na0.1mol,反应后水剩(91.8)/18-0.1=5mol
故比例为1:501年前查看全部
- 制金属钠和氯气是________(根据卤素形成的单质或化合物的性质回答)
 wojk0031年前1
wojk0031年前1 -
 云之一角 共回答了15个问题
云之一角 共回答了15个问题 |采纳率86.7%熔融的氯化钠1年前查看全部
- 金属钠到底能否区别乙酸和乙醇.我知道都生成氢气.到底有没有快慢之说.参考书和老师讲的不一样.jiu
 ergt1年前1
ergt1年前1 -
 zzk0012300 共回答了24个问题
zzk0012300 共回答了24个问题 |采纳率79.2%能.乙酸具有酸性,和Na剧烈反应,发出大量的热和氢气,反应太激烈还会有爆炸的危险.而和乙醇的反应比较缓慢,可以感受到放热和有气泡缓慢放出1年前查看全部
- PH咋算啊!(1),一块表面有氧化钠的金属钠5.4克,放入1000ml水中,放出1.12L氢气(标况),将此溶液稀释为2
PH咋算啊!
(1),一块表面有氧化钠的金属钠5.4克,放入1000ml水中,放出1.12L氢气(标况),将此溶液稀释为2L,此溶液的PH值( ).(2),PH=2的溶液其H+是PH=4的溶液的多少倍?将PH=2的盐酸和PH=10的氢氧化钠混合制PH=7,盐酸和氢氧化钠溶液的体积比?自学者 Paradise_flower1年前1
Paradise_flower1年前1 -
 younijiujingcai 共回答了12个问题
younijiujingcai 共回答了12个问题 |采纳率100%PH值就是氢离子,或氢氧根离子的浓度的对数,但我的对数学的太烂了,现在都忘的差不多了,
你自己算下吧1年前查看全部
- 把一小块金属钠投入100 mL 0.15 mol/LCuCl2溶液中,收集到产生的气体的体积为
把一小块金属钠投入100 mL 0.15 mol/LCuCl2溶液中,收集到产生的气体的体积为
把一小块金属钠投入100 mL 0.15 mol/LCuCl2溶液中,收集到产生的气体的体积为
1.456L(标准状况下),此时溶液体积仍然为100 mL 计算
⑴加入金属钠的质量
⑵反应后溶液的pH 单gg1231年前2
单gg1231年前2 -
 凌潇芊 共回答了15个问题
凌潇芊 共回答了15个问题 |采纳率86.7%2Na+2H2O=2NaOH+H2
46 2 1
x y 1.456/22.4=0.065
x=2.99g y=0.13mol
CuCl2+2NaOH=Cu(OH)2+2NaCl
1 2
0.015 Z
z=0.03mol
n(NaOH)=0.13-0.03=0.1mol
C(OH-)=0.1/0.1=1mol/L
C(H+)=10(-14次方)/1=10(-14次方)
pH=-lgc(H+)=pH=-lgc[10(-14次方)]=141年前查看全部
- 现有一块金属钠放在水中充分反应,溶液质量增加4.4克.则消耗钠多少克.
 包晚娘1年前1
包晚娘1年前1 -
 summermore 共回答了17个问题
summermore 共回答了17个问题 |采纳率82.4%2Na+2NaOH=2NaOH+H2 △
46 36 80 80-36=44
X 4.4g
Na反应4.6g1年前查看全部
- 金属钠区分甲醇和甲醚
 ChildrenLi1年前1
ChildrenLi1年前1 -
 就是要你的人 共回答了25个问题
就是要你的人 共回答了25个问题 |采纳率88%可以
金属钠和甲醇放出气体,而甲醚没有
2CH3OH+2Na===CH3ONa+H2气体1年前查看全部
- 几个方程式 (急!)工业制盐酸方程式?漂白粉在空气中久置失效的原因?金属钠在空气中放置最终变成碳酸钠涉及到的四个方程式?
 chongqinglijun1年前1
chongqinglijun1年前1 -
 xukunwww2006 共回答了16个问题
xukunwww2006 共回答了16个问题 |采纳率87.5%工业制盐酸方程式?
两个步骤:
1,电解饱和食盐水
2NaCl+2H2O=Cl2+H2+2NaOH
2,氯气氢气混合
H2+Cl2=2HCl
漂白粉在空气中久置失效的原因?
漂白粉的有效成分是Ca(ClO)2,失效方程式为:
Ca(ClO)2+H2O+CO2=CaCO3+2HClO
次氯酸分解;
4HClO=2H2O+O2+2Cl2
金属钠在空气中放置最终变成碳酸钠涉及到的四个方程式?
这个问题应该是:金属钠在空气中放置最终变成碳酸氢钠涉及到的三个方程式?
第一个方程;
2Na+2H20=2NaOH+H2O
第二个方程;
2NaOH+CO2=Na2CO3+H2O
第三个方程;
Na2CO3+CO2+H2O=2NaHCO31年前查看全部
大家在问
- 1土豆和西红柿共300千克,土豆每千克6块钱,西红柿每千克9块钱,土豆和西红柿的总价相同,买了多少千克土豆,多少千克西红柿
- 2一个人口调查员到某妇女家,询问他三个女儿年龄.三个女儿年龄相乘是72,相加是门牌号.
- 3我的乡愁,是牵着线的风筝,离乡愁越远,思念越长;我的乡愁,___________,___________,_______
- 4若{an}是等差数列,公差d≠0,a2,a3,a6成等比数列,则公比为 ______.
- 5已知x+2的绝对值与(y+7)的平方互为相反数,就负x正y的值.
- 6如何来区分水和过氧化氢溶液 方法 现象 结论
- 7“歙”字怎么念?安徽的歙县,怎么念?
- 8右图是四乘三的网格,仔细观察,数一数:图中有几个一乘一的小正方形.
- 97下关于三角形的填空题题如图所示,在锐角△ABC中,CD,BE分别是AB,AC边上的高,且CD,BE交于一点P,若∠A=
- 10求曲线(如图)的切线与法线方程
- 11一只小羊被6米长的绳子拴在一块长20米 宽12米的长方形草地上
- 12小张每天读书的页数比小刘多四分之一,有一本书小张8天读完,小刘几天读完
- 13四面山光照,( )填一个对联.
- 14答得好再加20--501.一条大鲨鱼,头长3米,身长等于头加尾长,而尾长等于头加身长的一半,这条大鲨鱼从头到尾全长多少米
- 15秋天的巧克力北极君秋天的糖果诗歌?


