0.03mol铜完全溶于硝酸,产生氮的氧化物NO、NO2、N2O4混合气体共0.05mol.
 lhysoft2022-10-04 11:39:541条回答
lhysoft2022-10-04 11:39:541条回答该混合气体的平均相对分子质量可能是:(A) 30,(B)46,(C)50,(D)66可用极限法求解:
(1)假设混合气体中无NO,则混合气体的平均相对分子质量为最大值.
设NO2、N2O4的物质的量分别为x、y,由电子守恒和原子守恒得方程组:
x+2y=0.06,x+y=0.05
解之,得x=0.04mol,y=0.01mol
则,混合气体的平均相对分子质量M=(46*0.04+92*0.01)/0.05=55.2
(2)假设混合气体中无N2O4,则混合气体的平均相对分子质量为最小值.
设NO、NO2的物质的量分别为x、y,由电子守恒和原子守恒得方程组:
3x+y=0.06,x+y=0.05
解之,得x=0.005mol,y=0.045mol
则,混合气体的平均相对分子质量M=(30*0.005+46*0.045)/0.05=44.4
(3)所以,44.4<M<55.2,选(B)(C)
方法我看懂了,但是就想请问一下,为什么这里要假设没有NO、N2O4呢?
而不可以是其他的呢?

已提交,审核后显示!提交回复
共1条回复
 兔兔gogo 共回答了26个问题
兔兔gogo 共回答了26个问题 |采纳率84.6%- 解题过程就采用的极限法.
氮氧化合物很不稳定,容易相互转换,极限法就是假设其中有一项物质没有(实际不可能的),只要得出两个极值(最大值和最小值),那么实际中的平均相对分子质量可以为两个极值中的任何一数值即可.
从三种氮氧化合物的质量分数来说,若假设无NO,则平均质量分数是最高的(因为NO得质量分数最小);若假设无N2O4,则平均质量分数是最低的.
既然是混合气体,不可能假设没有两种气体;也不可假设无NO2(它的质量分数居中),没有假设意义. - 1年前
相关推荐
- 有四氧化三铁和铁38.4g 溶于120ml的盐酸 产生0.03mol氢气 若完全反应后无三价铁离子 求铁和四氧化三铁的质
有四氧化三铁和铁38.4g 溶于120ml的盐酸 产生0.03mol氢气 若完全反应后无三价铁离子 求铁和四氧化三铁的质
量 还有盐酸的量浓度 bhng1年前1
bhng1年前1 -
 帕布蝴蝶 共回答了22个问题
帕布蝴蝶 共回答了22个问题 |采纳率86.4%根据题意,发生了下列反应
Fe3O4+Fe+8HCl=4FeCl2+4H2O …………①
Fe+2HCl=FeCl2+H2↑ …………………………②
因为产生了0.03mol氢气,所以应是Fe过量
所以反应②产生氢气消耗了Fe的质量=1.68g
由于Fe3O4是完全反应,所以在反应①中消耗的Fe3O4和Fe的比值=216:56=27:7
又知四氧化三铁和铁的总量为38.4g ,减去反应②产生氢气消耗的Fe的质量1.68g
则可得:Fe3O4的总质量=29.16g,Fe的总质量=9.24g
这里如果是盐酸刚好反应
那么盐酸的总物质的量=(8×29.16/216)+(2×1.68/56)=1.14mol
那么盐酸的物质的量浓度=1.14/0.12=9,5mol/L1年前查看全部
- 0.03mol铜完全溶于硝酸,产生氮的氧化物(NO、NO2、N2O4)混合气体共0.05mol.该混合气体的平均相对分子
0.03mol铜完全溶于硝酸,产生氮的氧化物(NO、NO2、N2O4)混合气体共0.05mol.该混合气体的平均相对分子质量可能是( )
A. 30
B. 46
C. 66
D. 69 lanyang_91年前1
lanyang_91年前1 -
 p025 共回答了23个问题
p025 共回答了23个问题 |采纳率95.7%解题思路:Cu-2e=Cu2+,0.03mol铜完全溶于硝酸失去电子为0.06mol,根据氧化还原反应规律,HNO3→NO2+NO+N2O4,0.05mol氮氧化物共得到0.06mol电子,从两个极端来考虑:(1)假设混合气体为NO、NO2;(2)假设混合气体是N2O4、NO2.据此计算平均相对分子质量,实际混合气体的相对分子质量介于两者之间.假设一种情况为混合气体中没有N2O4时,设NO的物质的量为x,则NO2的物质的量为0.05mol-x,根据电子得失守恒,铜失去的电子数等于NO3-得到的电子数,所以有0.03mol×2=3x+(0.05mol-x)×1,得:x=0.005mol,NO2的物质的量为0.05mol-0.005mol=0.045mol,所以混合气体的平均相对分子质量为[30×0.005+46×0.045/0.005+0.045]=44.4;
同理,假设另一种情况为混合体中没有NO时,设N2O4、NO2物质的量分别为m,n,m+n=0.05mol,2m+n=0.06mol,联立解得m=0.01mol,n=0.04mol,所以混合气体的平均相对分子质量为
.
Mr(NO2、N2O4)=46×[4/5]+92×[1/5]=55.2.
所以该混合气体的平均相对分子质量应在44.4~55.2之间.
故选:B.点评:
本题考点: 有关混合物反应的计算.
考点点评: 考查混合物的计算、氧化还原反应的计算等,难度中等,利用极限法判断相对分子质量的范围是解题的关键.1年前查看全部
- 铜和硝酸反应的题目0.03mol铜完全溶解于硝酸,长生单的氧化物(NO、NO2、N2O4)混合气体共0.05mol.改好
铜和硝酸反应的题目
0.03mol铜完全溶解于硝酸,长生单的氧化物(NO、NO2、N2O4)混合气体共0.05mol.改好呢和气体的平均相对分子质量可能是( )
A 30 B 46 C 50 D 66
答案是BC
为啥? 曲径蝉鸣1年前2
曲径蝉鸣1年前2 -
 随心非随欲 共回答了22个问题
随心非随欲 共回答了22个问题 |采纳率100%0.03mol Cu 失去 0.06mol 电子,分别给了NO、NO2、N2O4中的N,
每个NO、NO2、N2O4中N分别得到3,1,2个电子.
设x mol NO,y mol NO2,0.05-x-y mol N2O4
3x+y+0.1-2x-2y=0.06
即y=x+0.04
0.05-x-y=0.01-2x
所以01年前查看全部
- 用水配0.03mol浓度的氯化钴溶液怎么配?
用水配0.03mol浓度的氯化钴溶液怎么配?
工业化生产配置,最好有好操作性,谢谢 yangf231年前2
yangf231年前2 -
 rain_xyz 共回答了14个问题
rain_xyz 共回答了14个问题 |采纳率78.6%氯化钴的配制除了一般的溶液配制流程(具体实验书上多多),还注意三价态的钴离子的强氧化性,以及强水解,所以配制时还要加入一些浓盐酸,一方面提高酸度,防止钴的水解.1年前查看全部
- 高二化学题(氮族元素)0.03mol铜完全溶于稀硝酸,产生氮的氧化物(NO NO2 N2O4)混合气体共0.05mol.
高二化学题(氮族元素)
0.03mol铜完全溶于稀硝酸,产生氮的氧化物(NO NO2 N2O4)混合气体共0.05mol.该气体的平均分子质量可能是
A.30 B.46 C.50 D.66
上面应该是“硝酸”不是“稀硝酸” 喜欢发言1年前2
喜欢发言1年前2 -
 PUCCA123 共回答了17个问题
PUCCA123 共回答了17个问题 |采纳率94.1%0.03mol铜可以提供0.06mol电子.
生成1molNO得到3mol电子.
生成1molNO2得到1mol电子.
生成1molN2O4得到2mol电子.
混合气体共0.05mol,设NO的物质的量为x,NO2的为y,N2O4的为z.则可得不定方程组:3x+y+2z=0.06 x+y+z=0.05.
(1)设混合气体中没有NO,解得y=0.04 z=0.01
(2)设混合气体中没有NO2,此时方程无两个正数解.
(3)设混合气体中没有N2O4,解得x=0.005 y=0.045
(1)情况的平均相对分子质量为55.2
(3)情况的平均相对分子质量为44.4
所以44.4<M<55.2
所以选 BC1年前查看全部
- 现将0.03mol Cl2缓缓通入含0.02molH2SO3和0.02mol HBr的混合溶液中
现将0.03mol Cl2缓缓通入含0.02molH2SO3和0.02mol HBr的混合溶液中
方程式
那个先 那个后 菊花淡茶1年前1
菊花淡茶1年前1 -
 吾身每日三省 共回答了18个问题
吾身每日三省 共回答了18个问题 |采纳率94.4%还原性:SO32- > Br-,所以SO32-先与Cl2反应生成,生成Cl-和SO42-,此时消耗Cl2共0.02 mol,之后剩余的0.01 mol Cl2再恰好与0.02 mol的HBr反应,生成HCl和Br21年前查看全部
- 关于氮的化学题某溶液100ml,其中含硫酸0.03mol.硝酸0.04mol ,若在该溶液中投入1.92g铜粉微热,反应
关于氮的化学题
某溶液100ml,其中含硫酸0.03mol.硝酸0.04mol ,若在该溶液中投入1.92g铜粉微热,反应后放出一氧化氮气体的物质的量约为多少 百合花哭了1年前1
百合花哭了1年前1 -
 zxwtq 共回答了16个问题
zxwtq 共回答了16个问题 |采纳率87.5%0.025mol
3Cu+8H++2NO3-=3Cu2++4H2O+2NO
反应物的物质的量分别为0.3/0.1/0.04
所以一氧化氮气体的物质的量约为0.025mol1年前查看全部
- 有含有0.03mol的Ca(OH)2的石灰水中通入0.040mol的CO2气体,生成的沉淀物的物质的含量是多少?
 蜗牛爬爬1年前1
蜗牛爬爬1年前1 -
 84755945 共回答了23个问题
84755945 共回答了23个问题 |采纳率91.3%CO2 + Ca(OH)2 = CaCO3 + H2O
从方程式,我们可以看出,每mol的二氧化碳要和相同mol数的氢氧化钙反应,所以,该题中,二氧化碳气体过量,将继续发生下列化学反应:
CaCO3 + CO2 + H2O = Ca(HCO3)2
计算如下:
CO2 + Ca(OH)2 = CaCO3 + H2O CaCO3 + CO2 + H2O = Ca(HCO3)2
1 1 1 1 1
X=0.03mol 0.03mol Y=0.03mol Z=0.01 0.04-X=0.01
所以,最后沉淀物质的量为 :Y - Z = 0.02mol1年前查看全部
- 6.4g铜放入400m10.5mol/L的硝酸中,充分反应后,被还原的HNO 3 的量为( ) A.0.03mol B
6.4g铜放入400m10.5mol/L的硝酸中,充分反应后,被还原的HNO 3 的量为( ) A.0.03mol B.0.05mol C.0.1mol D.0.2mol  baichenglove1年前1
baichenglove1年前1 -
 孩脚 共回答了24个问题
孩脚 共回答了24个问题 |采纳率87.5%铜与稀硝酸发生反应3Cu+8HNO 3 (稀)=3Cu(NO 3 ) 2 +2NO↑+4H 2 O,
6.4g铜的物质的量为
6.4g
64g/mol =0.1mol.400m10.5mol/L的硝酸中n(HNO 3 )=0.4L×0.5mol/L=0.2mol,
根据方程式可知0.2molHNO 3 完全反应,需Cu
0.2mol×3
8 =0.075mol,小于0.1mol,所以硝酸不足,硝酸完全反应,铜有剩余.
反应中硝酸起酸的作用,生成Cu(NO 3 ) 2 ,起氧化剂作用生成NO,
由产物中氮元素化合价可知,起氧化剂作用的硝酸占参加反应硝酸的
1
4 ,氧化剂被还原,
所以被还原的HNO 3 的量为0.2mol×
1
4 =0.05mol.
故选:B.1年前查看全部
- 0.03mol的铜与一定浓度的硝酸反应,产生0.05mol的混合气体(NO,NO2,N2O4).则该混合气体的摩尔质量可
0.03mol的铜与一定浓度的硝酸反应,产生0.05mol的混合气体(NO,NO2,N2O4).则该混合气体的摩尔质量可能是?...
0.03mol的铜与一定浓度的硝酸反应,产生0.05mol的混合气体(NO,NO2,N2O4).则该混合气体的摩尔质量可能是? jiajiadream1年前1
jiajiadream1年前1 -
 gua3gua 共回答了16个问题
gua3gua 共回答了16个问题 |采纳率100%n(NO)+n(NO2)+n(N2O4)=0.05
3n(NO)+n(NO2)+2n(N2O4)=0.03*2=0.06
用线性规划(令NO,N2O4,NO2分别是x,y,z)
得两端点是n(NO)=0.005,n(NO2)=0.045;n(NO2)=0.04,n(N2O4)=0.01
摩尔质量在44.4g/mol至55.2g/mol之间1年前查看全部
- 在100ml水溶液中含有0.03mol蔗糖和0.1molHCl,测得在28℃经20 min有32%的蔗糖发生了水解.已知
在100ml水溶液中含有0.03mol蔗糖和0.1molHCl,测得在28℃经20 min有32%的蔗糖发生了水解.已知其水解为一级反应,求:
(1)反应速率常数
(2)反应开始时和反应至20 min时的反应速率
(3)40 min时已水解的百分数 369wox1年前1
369wox1年前1 -
 妞妞姐 共回答了15个问题
妞妞姐 共回答了15个问题 |采纳率93.3%(1) ln1/0.68=20k
(2) v0=0.3k, v20=0.3*0.68k
(3) ln1/(1-F)=40k1年前查看全部
- 0.05mol so2与0.03mol o2在1L的密闭容器中反应,平衡时测得o2 0.01mol/L 求平衡常数K.
 重拾浪漫1年前0
重拾浪漫1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 将0.01mol氯气通入含0.03mol溴离子和0.03mol碘离子的混合溶液中,再加入Ccl4溶液,则Ccl4层的颜色
将0.01mol氯气通入含0.03mol溴离子和0.03mol碘离子的混合溶液中,再加入Ccl4溶液,则Ccl4层的颜色是
A.紫
B.橙红
C.棕
D.紫黑
请给讲一讲 2d2ihk1年前1
2d2ihk1年前1 -
 du6859 共回答了17个问题
du6859 共回答了17个问题 |采纳率94.1%a1年前查看全部
- 0.03mol铜粉与浓硝酸反应,铜粉完全作用同时生成0.05mol气体,所消耗
0.03mol铜粉与浓硝酸反应,铜粉完全作用同时生成0.05mol气体,所消耗
浓硝酸物质的量为多少
方程式能不能写写? 蚊子不洗脚1年前1
蚊子不洗脚1年前1 -
 mgmsjj 共回答了14个问题
mgmsjj 共回答了14个问题 |采纳率92.9%0.11mol
设生成xmol 的NO2 ymol 的 NO 且x+y=0.05
消耗的浓硝酸 一部分生成气体 根据N守恒 气体量就是这部分浓硝酸的量 ;另一部分作为酸介质 与 Cu反映生成Cu(NO3)2 CU物质量的2倍就是这部分浓硝酸的量
所以 n= 0.05+0.03*2=0.11mol
------------------------
(1)Cu+4HNO3(浓)====Cu(NO3)2+2NO2↑+2H2O;
(2)3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
----------------------------
这个计算不用看方程式
列式只要根据物料守恒 (即HNO3=NO+NO2)和最后不带电 一个铜得对应2个硝酸根
所以结果是两部分和 0.111年前查看全部
- 请问,高温下,0.03mol铁和足量水蒸气反应转移的电子数为多少,
 火车司机1年前1
火车司机1年前1 -
 13加油17 共回答了22个问题
13加油17 共回答了22个问题 |采纳率86.4%3Fe+4H2O(g)=Fe3O4+4H2,
Fe+4/3H2O(g)=1/3Fe3O4+4/3H2,
8/3e↓→→→→→→→→→↑
也就是说1mol铁转移8/3mol电子,0.03mol铁转移0.08mol电子1年前查看全部
- 0.03mol铜完全溶于硝酸,产生氮的氧化物NO、NO2、N2O4混合气体共0.05mol
0.03mol铜完全溶于硝酸,产生氮的氧化物NO、NO2、N2O4混合气体共0.05mol
该混合气体的平均相对分子质量可能是:(A) 30, (B)46,(C)50,(D)66可用极值法求解:
(1)假设混合气体中无NO,则混合气体的平均相对分子质量为最大值.
设NO2、N2O4的物质的量分别为x、y,由电子守恒和原子守恒得方程组:
x+2y=0.06,x+y=0.05
解之,得x=0.04mol,y=0.01mol
则,混合气体的平均相对分子质量M=(46*0.04+92*0.01)/0.05=55.2
(2)假设混合气体中无N2O4,则混合气体的平均相对分子质量为最小值.
设NO、NO2的物质的量分别为x、y,由电子守恒和原子守恒得方程组:
3x+y=0.06,x+y=0.05
解之,得x=0.005mol,y=0.045mol
则,混合气体的平均相对分子质量M=(30*0.005+46*0.045)/0.05=44.4
(3)所以,44.4<M<55.2,选(B)(C)
以上过程我想问怎样根据电子守恒和原子守恒,在不列化学方程式的情况下得到相加=0.6的那两个方程式?还有用极值法做题时如果有三种物质怎么判断是假设没有其中一种还是假设全部都是其中一种?这类题有什么技巧?
 JiaHaoisback1年前1
JiaHaoisback1年前1 -
 xhhloveshy 共回答了22个问题
xhhloveshy 共回答了22个问题 |采纳率100%0.03molCu与HNO3完全反应时,氧化产物是Cu2+,失电子物质的量为0.06mol
列方程的原理都是根据得失电子守恒
得电子的是作为氧化物的HNO3,还原产物为氮氧化物,得电子数目看产物中N元素价态和N原子数目.
HNO3→NO,+5→+2,得3e-
HNO3→NO2,+5→+4,得1e-
2HNO3→N2O4,+5→+4,得2e-
至于“NO2+N2O4”以及“NO+NO2”这两个最大、最小相对分子质量的假设是这么来的:
在总物质的量一定的情况下,要使混合气体平均相对分子质量最大,则混合气体总质量最大
很容易可以得出:
NO2+N2O4总质量最大
NO+NO2总质量最小1年前查看全部
- 0.03mol铜完全溶于硝酸,产生氮的氧化物(NO、NO2、N2O4)混合气体共0.05mol.该混合气体的平均相对分子
0.03mol铜完全溶于硝酸,产生氮的氧化物(NO、NO2、N2O4)混合气体共0.05mol.该混合气体的平均相对分子质量可能是( )
A. 30
B. 46
C. 66
D. 69 xx是无涯1年前1
xx是无涯1年前1 -
 只能看不会写 共回答了19个问题
只能看不会写 共回答了19个问题 |采纳率94.7%解题思路:Cu-2e=Cu2+,0.03mol铜完全溶于硝酸失去电子为0.06mol,根据氧化还原反应规律,HNO3→NO2+NO+N2O4,0.05mol氮氧化物共得到0.06mol电子,从两个极端来考虑:(1)假设混合气体为NO、NO2;(2)假设混合气体是N2O4、NO2.据此计算平均相对分子质量,实际混合气体的相对分子质量介于两者之间.假设一种情况为混合气体中没有N2O4时,设NO的物质的量为x,则NO2的物质的量为0.05mol-x,根据电子得失守恒,铜失去的电子数等于NO3-得到的电子数,所以有0.03mol×2=3x+(0.05mol-x)×1,得:x=0.005mol,NO2的物质的量为0.05mol-0.005mol=0.045mol,所以混合气体的平均相对分子质量为[30×0.005+46×0.045/0.005+0.045]=44.4;
同理,假设另一种情况为混合体中没有NO时,设N2O4、NO2物质的量分别为m,n,m+n=0.05mol,2m+n=0.06mol,联立解得m=0.01mol,n=0.04mol,所以混合气体的平均相对分子质量为
.
Mr(NO2、N2O4)=46×[4/5]+92×[1/5]=55.2.
所以该混合气体的平均相对分子质量应在44.4~55.2之间.
故选:B.点评:
本题考点: 有关混合物反应的计算.
考点点评: 考查混合物的计算、氧化还原反应的计算等,难度中等,利用极限法判断相对分子质量的范围是解题的关键.1年前查看全部
- 6mol /L硝酸是浓还是稀?那么0.06mol的此硝酸和0.03mol的铜共热生成的气体体积是多少?(标况)怎么算?
 594161年前3
594161年前3 -
 zzw01899 共回答了20个问题
zzw01899 共回答了20个问题 |采纳率95%浓硝酸 3Cu+8HNO3==3Cu(NO3)2+2NO↑+4H2O 硝酸过量 按铜算 0.03乘以三分之二乘以22.4就可以了,不加热的话就不一样了 新年快乐!1年前查看全部
- 将0.03mol Cl2缓缓通入含0.02mol H2SO3和0.02mol HBr的混合
将0.03mol Cl2缓缓通入含0.02mol H2SO3和0.02mol HBr的混合溶液中,在此过程溶液的c(H+)与Cl2用量的关系示意图是(溶液的体积视为不变)( )
A.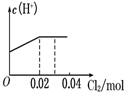
B.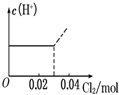
C.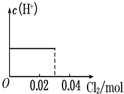
D.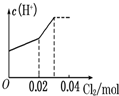
 晓晨必胜1年前2
晓晨必胜1年前2 -
 hnkl 共回答了16个问题
hnkl 共回答了16个问题 |采纳率75%解题思路:亚硫酸根离子与溴离子都具有还原性,但是亚硫酸根离子还原性强于溴离子,通入氯气后,氯气首先氧化H2SO3为H2SO4,H2SO3反应完毕,然后再氧化Br-,由于Br-全部转变Br2,所以HBr和H2SO3都完全被氧化.亚硫酸根离子与溴离子都具有还原性,但是亚硫酸根离子还原性强于溴离子,通入氯气后,氯气首先氧化H2SO3为H2SO4,H2SO3反应完毕,然后再氧化Br-.
氯气氧化亚硫酸生成硫酸:
Cl2 +H2SO3 +H2O=H2SO4 +2HCl
0.02mol 0.02mol 0.02mol 0.04mol
H2SO3为弱酸,生成两种强酸:H2SO4和HCl,c(H+)增大,H2SO3反应完毕,消耗 Cl20.02mol,Cl2过量0.01mol,然后再氧化Br-:
Cl2 +2HBr=Br2 +2HCl
0.01mol 0.02mol
HBr全部被氯气氧化转变为Br2 和HCl,HCl和HBr都是强酸,所以c(H+)不变;
故选:A.点评:
本题考点: 氯气的化学性质.
考点点评: 本题考查了氯气的性质已经有关氧化还原反应的计算,明确亚硫酸根离子与溴离子还原性强弱顺序是解题关键,难度不大.1年前查看全部
- 高一化学题(高考题)(一)0.03mol铜完全融于硝酸,产生氮的氧化物(NO,NO2和N2O4)共0.05mol,该混合
高一化学题(高考题)
(一)0.03mol铜完全融于硝酸,产生氮的氧化物(NO,NO2和N2O4)共0.05mol,该混合物平均相对分子质量:A 30 B 46 C 50 D 66 (二)9.7克Cu锌与足量稀硝酸反应,还原产物只有0.1mol NO,将该溶液稀释至1L,测得PH=1,此时硝酸根离子浓度?A 0.3 B 0.4 C 0.5 D 0.6 mol/L 先答案,对了我会追问
 sweetpig111年前1
sweetpig111年前1 -
 114491663 共回答了11个问题
114491663 共回答了11个问题 |采纳率72.7%第一题感觉B..C都有可能...第二题B1年前查看全部
- 0.03mol铜完全溶于硝酸中,产生氮的氧化物(NO NO2 N2O4)
0.03mol铜完全溶于硝酸中,产生氮的氧化物(NO NO2 N2O4)
的混合气体共0.05mol该混合气体的平均相对分子质量可能是多少?
A.30
B.46
c.50
D.66 铃音991年前1
铃音991年前1 -
 kaixinjiuhao666 共回答了17个问题
kaixinjiuhao666 共回答了17个问题 |采纳率94.1%设与硝酸反应分别产生NO,NO2,N2O4的铜的摩尔数分别为x,y,z.则有x+y+z=0.03,这是方程式1.则产生的NO,NO2,N2O4的摩尔数分别为0.667(即三分之二)x,2y,z(这是根据化学反应式得到的),则有0.667x+2y+z=0.05,这是方程式2.最后根据平均相对分子质量的备选答案,有30×0.667x+46×2y+92×z=备选的平均相对分子质量×0.05,这是方程式3.将备选答案B,C,D分别代入方程式3,(A显然不对,不用算了)联立解方程组,有合理解的即为正确答案.太复杂了,我不算了.1年前查看全部
- 溶液中含有0.03mol/L Pb2+和0.02mol/L Cr3+,向其中逐滴加入浓度NaOH溶液,忽略体积变化,Pb
溶液中含有0.03mol/L Pb2+和0.02mol/L Cr3+,向其中逐滴加入浓度NaOH溶液,忽略体积变化,Pb2+和Cr3+
均有可能形成沉淀,问1.哪种离子先形成沉淀2.是否可以分离这两种离子 玉蝴蝶19821年前1
玉蝴蝶19821年前1 -
 whfqf 共回答了18个问题
whfqf 共回答了18个问题 |采纳率83.3%氢氧化铅的溶度积为1.43*10^-20,氢氧化铬的溶度积为6.3*10^-31,因此0.03mol/L的铅离子开始沉淀所需的氢氧根浓度为6.9*10^-10mol/L,0.02mol/L的铬离子开始沉淀所需的氢氧根浓度为3.16*10^-10mol/L,因此铬离子先形成沉淀,当氢氧根浓度为6.9*10^-10mol/L时,溶液中的铬离子浓度为0.00192mol/L,浓度降为初始的1/10,因此加氢氧化钠能一定程度上分离这两种离子,但分离不完全.1年前查看全部
- 高一化学 ,445℃,将0.1molI2与0.02molH2通入2L密闭容器中,达平衡后有0.03molHI生成,求:1
高一化学 ,445℃,将0.1molI2与0.02molH2通入2L密闭容器中,达平衡后有0.03molHI生成,求:1)各物质的起
始浓度与平衡浓度 2)平衡混合气中氢气的体积分数
 摆布午狼1年前1
摆布午狼1年前1 -
 sqm_黑马 共回答了18个问题
sqm_黑马 共回答了18个问题 |采纳率94.4%I2(g) + H2(g) = 2HI(g)
初始(mol): 0.1 0.02 0
平衡(mol): 0.1-0.03/2 0.02-0.03/2 0.03
=0.085 =0.085
平衡浓度: 0.085/2 0.085/2 0.03/2
初始浓度: 0.1/2 0.02/2 0
平衡混合气体中气氛的体积分数:
总的物质的量:0.1-0.03/2 + 0.02-0.03/2 + 0.03= 0.2
平衡混合气中氢气的体积分数: 0.03/0.2 = 0.151年前查看全部
- 在含有0.03mol氢氧化钠的石灰水中通入0.04mol的二氧化碳气体.生成了沉淀物的物质的量是多少?
在含有0.03mol氢氧化钠的石灰水中通入0.04mol的二氧化碳气体.生成了沉淀物的物质的量是多少?
要用物质的量做 allen_xie1年前2
allen_xie1年前2 -
 东方不败322 共回答了17个问题
东方不败322 共回答了17个问题 |采纳率88.2%是氢氧化钙吧
Ca(OH)2+CO2=CaCO3+H2O
1 1 1
0.03 0.03 0.03
剩下0.01molCO2
CaCO3+CO2+H2O=Ca(HCO3)2
1 1 1
0.01 0.01 0.01
0.03-0.01=0.02mol
结果剩下0.02mol沉淀1年前查看全部
- 向含有0.03mol稀硫酸和0.04mol稀硝酸中加入1.92克铜充分反应后得到无色气体,求气体标况下体积
 风吹龙城1年前1
风吹龙城1年前1 -
 梦幻shark 共回答了13个问题
梦幻shark 共回答了13个问题 |采纳率76.9%8H+ + 3Cu + 3(SO4)2- + 2(NO3)- =4H2O + 3CuSO4↓ + 2NO↑
由题意 铜为0.03mol ,H+为0.1mol,(NO3)-0.04mol,(SO4)2- 0.03mol 可得铜完全反应
可得产生气体0.03/3 *2=0.02mol 所以标况下V(NO)=0.02*22.4L/mol =0.448L1年前查看全部
- 关于化学式的确定可以根据物质的量来确定物质的化学式么?例如某物质只含Fe与O,求得含Fe:0.03mol,O:0.04m
关于化学式的确定
可以根据物质的量来确定物质的化学式么?例如某物质只含Fe与O,求得含Fe:0.03mol,O:0.04mol,是不是可以确定化学式为Fe3O4?
上面 Fe3O4只是个例子,我是说如果这样确定行不行! dongaaron1年前5
dongaaron1年前5 -
 过客zqc 共回答了14个问题
过客zqc 共回答了14个问题 |采纳率92.9%可以 以为此物质只含有而且告诉你质量了,算下就知道肯定是Fe3O4!1年前查看全部
- 向含有0.03mol硫酸和0.04mol硝酸中加入1.92克铜充分反应后得到一氧化氮,求气体标况下体积
向含有0.03mol硫酸和0.04mol硝酸中加入1.92克铜充分反应后得到一氧化氮,求气体标况下体积
向含有0.03mo硫酸和0.04mol硝酸中加入1.92克铜充分反应后得到一氧化氮,求气体标况下体积. 82128061年前2
82128061年前2 -
 ff8cdg 共回答了23个问题
ff8cdg 共回答了23个问题 |采纳率95.7%8HNO3+3Cu=3Cu(NO3)2+2NO↑+4H2O
离子方程式:
8H+ + 2NO3- + 3Cu = 3Cu2+ + 2NO↑ +4H2O
0.03molH2SO4 含有0.6molH+
0.04HNO3含有0.04molH+;0.04molNO3-
共有0.1molH+,0.04molNO3-
Cu的物质的量1.92/64=0.03mol]
所以NO3- ,H+都过量.铜完全反应.
3 2
0.03 0.02
生成一氧化氮的体积=22.4*0.02=.448L
答.1年前查看全部
- 关于氮的一道计算题0.03mol铜完全溶于硝酸 产生氮的氧化物(NO NO2 N2O4)混合气体共0.05mol,求该混
关于氮的一道计算题
0.03mol铜完全溶于硝酸 产生氮的氧化物(NO NO2 N2O4)混合气体共0.05mol,求该混合气体平均相对分子质量的范围.
答案中说氮元素化合价变化为6/5 所以产物中一定有NO2 为什么? 水蓝1234567891年前1
水蓝1234567891年前1 -
 亲能近来看 共回答了11个问题
亲能近来看 共回答了11个问题 |采纳率72.7%生成的NO在释出的过程中又被硝酸氧化,从而生成NO2,且生成NO2是不可避免的1年前查看全部
- 3.84克铁与氧化铁的混合物溶于过量盐酸中,生成0.03mol氢气,反应后的溶液加入kscn溶液检验,不显红色
3.84克铁与氧化铁的混合物溶于过量盐酸中,生成0.03mol氢气,反应后的溶液加入kscn溶液检验,不显红色
球员混合物中氧化铁的质量 loveqgp1年前3
loveqgp1年前3 -
 yyh4545 共回答了24个问题
yyh4545 共回答了24个问题 |采纳率91.7%设生成0.03molH2需要铁的质量为X,原混合物中含氧化铁的物质的量为YFe + 2HCl =FeCl2 + H2↑ 56 1X 0.03molX=1.68gFe2O3 + 6HCl =2FeCl3 + 3H2O 2FeCl3+Fe=3FeCl2根据氧化剂与多种还原剂反应时,先与氧化性强的反应,再...1年前查看全部
大家在问
- 1曾不能损魁父之丘中“曾”的读音
- 2关于气节高尚的成语
- 3MY father stayed there for two months for two months 画上
- 4i am tired改为一般疑问句
- 5溜达的近义词,动听的近义词,缓缓的近义词,平坦的反义词,微小的反义词.
- 6春天的雨特别多、特别柔,我特别喜欢春天的和风细雨.诗句:【 】
- 7盛碱液的试剂瓶不能用玻璃塞?说是碱液与玻璃塞中的二氧化硅反应生成硅酸钠 硅酸钠粘稠性 所以导致瓶塞不易拔出说是所有碱液都
- 8温文而雅的意思是什么?
- 9"照人胆似秦时月,送我情如岭上云"是什么意思.出自何处?
- 10是不是所有的硝酸盐溶于水温度都要降低?
- 11怎样永不求甚解造句怎样用不求甚解造句?
- 12叫和说分别换一个词和字,但意思不变
- 13英语:什么时候用被动语态?要通俗易懂,举例,我的理解力不是很好,不要说一大堆费话,
- 14说说y=k/x(k≠0)2x 4y=48
- 15我想问一下,课间应该干什么 假如刚下语文课下节数学课,应该复习上节语文课还是复习数学还是预习数学
