门捷列夫有什么杰出化学成果?元素周期表结构与意义
 rita丽达2022-10-04 11:39:542条回答
rita丽达2022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 娃哈哈db3 共回答了20个问题
娃哈哈db3 共回答了20个问题 |采纳率85%- 俄国化学家门捷列夫
到1869年止,已有63种元素被人们所认识.进一步寻找新元素成为当时化学家最热门的课题.但是地球上究竟有多少元素?怎样去寻找新的元素?却没有人能作比较科学的回答.寻找新元素的工作也固缺乏正确的理论指导,而带有很大的盲目性,常常白白地耗费了许多精力.
在对物质、元素的广泛研究中,关于各种元素的性质的资料,积累日愈丰富,但是这些资料却是繁杂纷乱的,人们很难从中获得清晰的认识.整理这些资料,概括这些感性知识,从中摸索总结出规律,这是摆在当对化学家面前一个急待解决的课题,同时也是科学和生产发展的必然要求.在这样的科学背景下,从事元素分类工作和寻找元素之间内在联系的许多化学家,经过长期的共同努力,取得了一系列研究成果,其中最辉煌的成就是俄国化学家门捷列夫和德国化学家迈尔先后发现的化学元素周期律.
门捷列夫化学元素周期表的意义在于:
按照原子量大小排列起来的元素,在性质上呈现明显的周期性. 原子量的大小决定元素的特征应该预料到许多未知元素的发现,例如类似铝和硅的,原子量位于65一75之间的元素. 当我们知道了某些元素的同类元素后,有时可以修正该元素的原子量.自化学元素周期表被归纳后,化学领域实现了巨大的腾飞! - 1年前
 hs1972 共回答了33个问题
hs1972 共回答了33个问题 |采纳率- 把化学有机的联系起来,不再是孤立的元素了...
- 1年前
相关推荐
- 科学家的重要成就波义耳、拉瓦锡、道尔顿、阿伏伽德罗、门捷列夫在化学学科中的重要成就是什么尽量简短
 万木复苏1年前2
万木复苏1年前2 -
 ampop 共回答了18个问题
ampop 共回答了18个问题 |采纳率94.4%波义耳:石蕊试纸和黑墨水的发明建立了元素的新定义:不能用化学方法再分解的简单物质才是元素实验化学的创始人门捷列夫:元素周期律的发现成功地预测了镭的原子数及其性质,且研制了镭制品门氡(液态镭).拉瓦锡:拉...1年前查看全部
- 下列叙述正确的是( )A.门捷列夫发现元素周期律和元素周期表奠定了近代化学的基础B.绿色化学的核心就是要利用化学原理从
下列叙述正确的是( )
A.门捷列夫发现元素周期律和元素周期表奠定了近代化学的基础
B.绿色化学的核心就是要利用化学原理从源头消除污染
C.化学研究的是自然界已存在的物质及其变化
D.化学的发展必然导致生态环境的恶化 小小破孩661年前1
小小破孩661年前1 -
 黑夜好kk哦 共回答了17个问题
黑夜好kk哦 共回答了17个问题 |采纳率94.1%解题思路:A、根据原子论和分子学说的创立的意义;
B、根据绿色化学的核心,从源头消除污染的说明;
C、化学能生成新物质;
D、化学的发展可能导致生态环境的恶化.A、原子分子论是认识和分析化学现象及本质的基础,原子论和分子学说的创立奠定近代化学基础,故说法错误;
B、绿色化学的核心就是要利用化学原理从源头消除污染,说法正确;
C、化学能研究自然界已存在的物质及其变化,也能创造自然界不存在的新物质,故说法错误;
D、化学的发展可能导致生态环境的恶化,故原说法错误.
故选:B.点评:
本题考点: 化学的历史发展过程;化学的研究领域;绿色化学.
考点点评: 了解化学发展的历史,有利于激发学生学习化学的兴趣,培养社会责任感,理解绿色化学的核心,防止环境污染人人有责.1年前查看全部
- 镓是1871年俄国化学家门捷列夫在编制元素周期表时曾预言的“类铝”元素,镓的原子序数为31,属ⅢA元素,镓的熔点为29.
镓是1871年俄国化学家门捷列夫在编制元素周期表时曾预言的“类铝”元素,镓的原子序数为31,属ⅢA元素,镓的熔点为29.78℃,沸点高达2403℃,镓有过冷现象(即冷至熔点以下不凝固),它可过冷到-120℃.下列有关镓的性质及其用途的叙述不正确的是( )
A.镓是制造高温温度计的上佳材料
B.镓能溶于强酸或强碱溶液中
C.镓与锌、锡等金属制成合金,可提高其硬度
D.镓可用于制造半导体材料,这是因为镓的导电性介于导体和绝缘体之间 baobeici1年前1
baobeici1年前1 -
 狐狼yq 共回答了18个问题
狐狼yq 共回答了18个问题 |采纳率94.4%解题思路:根据镓的原子序数为31,属ⅢA元素,镓的熔点为29.78℃,沸点高达2403℃,镓有过冷现象及第ⅢA族元素的性质的相似性和递变性来解答.A.由信息可知镓的沸点高,沸点高达2403℃,,则能制作高温温度计,故A正确;
B.因性质与Al相似,为“类铝”元素,则镓能溶于强酸或强碱溶液中,故B正确;
C.镓与锌、锡等金属制成合金,合金的硬度比金属单质的大,故C正确;
D.第ⅢA族元素金属性较强,则不能用于制造半导体材料,故D错误;
故选D.点评:
本题考点: 元素周期律和元素周期表的综合应用.
考点点评: 本题以信息的方式考查金属的性质,明确镓的物理性质和化学性质是解答本题的关键,题目难度不大.1年前查看全部
- 1.旧版化学元素周期表是苏联科学家 门捷列夫的杰作,新版周期表是谁的杰作?
1.旧版化学元素周期表是苏联科学家 门捷列夫的杰作,新版周期表是谁的杰作?
2.新、旧版周期表为何从序号105开始化学元素符号不一样? leew_yu1年前2
leew_yu1年前2 -
 映辉工作室 共回答了16个问题
映辉工作室 共回答了16个问题 |采纳率93.8%1、自从门捷列夫以后,元素周期表在不断发展之中,不是一个人的杰作.
2、原来103号以后元素的发现者有了命名,这体现在旧版周期表上.后来世界上统一对此规定103号以后的元素都根据原子序号命名.
数字 0 1 2 3 4 5 6 7 8 9
字头 Nil Un Bi Tri Quad Pent Hex Sept Oct Enn
104.Unq(Unnilquadium),也称Rf(Rutherfordium),以纪念英国核物理学家卢瑟福
(Ernest Ruther-ford),他获得过1909年诺贝尔化学奖,还发现了原子核和质子(获奖后
的贡献).
105.Unp(Unnilpentium),过去称Ha(Hahnium),以纪念犹太裔德国核物理学家哈恩
(Otto Harn),他发现了铀原子的核裂变反应,是1944年诺贝尔化学奖奖获得者,现在称
Db(Dubnium),是以莫斯科杜布纳(Dubna)核研究中心命名的.
106.Unh(Unnilhexium),也称Sg(Seaborgium),以纪念美国核物理学家西伯格(Gle
nn Theodore Sea-borg,1912-1999),他发现了镎(93),是1951年诺贝尔化学奖获得者
.
107.Uns(Unnilseptium),也称Bh(Bohrium),以纪念丹麦物理学家玻尔(Niels
Henrik David Bohr,1885-1962),他是量子力学的奠基人之一,1922年诺贝尔物理学奖
获得者.
108.Uno(Unniloctium),也称Hs(Hassium),该原子由德国达姆施塔特(Darmstardt
)重离子研究中心获得,用该实验室的所在地黑森州(Hessen)命名.
109.Une(Unnilenntium),也称Mt(Meitnerium),以纪念犹太裔瑞典核物理学家麦
特纳(Lise Meitner,1878-1968),他和哈恩(参见第105号元素)共同发现了铀原子的核
裂变反应.
109号以后的元素不再用科学家的名字命名.1年前查看全部
- 19世纪中叶,俄国化学家门捷列夫对化学学科的巨大贡献是( ) A.提出了原子学说 B.提出了元素周期律 C.提出了分子
19世纪中叶,俄国化学家门捷列夫对化学学科的巨大贡献是( ) A.提出了原子学说 B.提出了元素周期律 C.提出了分子学说 D.制定了科学的元素周期表  ONE_NIGHT_HEFEI1年前1
ONE_NIGHT_HEFEI1年前1 -
 lighten007 共回答了18个问题
lighten007 共回答了18个问题 |采纳率72.2%A.道尔顿提出了近代原子学说,故A错误;
B.1869年,俄国化学家门捷列夫发现了元素周期律,故B正确;
C.阿佛加德罗提出了分子学说,故C错误;
D.1869年,俄国化学家门捷列夫发现了元素周期律,并编制出元素周期表,故D正确.
故选BD.1年前查看全部
- 创立原子论和分子学说的科学家是( ) A门捷列夫 B道尔顿 C拉瓦锡 D道尔顿和啊福家德罗
 yuyun031年前1
yuyun031年前1 -
 duguanji 共回答了18个问题
duguanji 共回答了18个问题 |采纳率83.3%D道尔顿和啊福家德罗1年前查看全部
- ()的创立,奠定了近代化学的基础.1869年,门捷列夫发现了()并编制出(),使化学学习和研究变得有
()的创立,奠定了近代化学的基础.1869年,门捷列夫发现了()并编制出(),使化学学习和研究变得有
规律可循.现代化学已在()()()()等研究上发挥越来越重要的作用
 Jacktws1年前1
Jacktws1年前1 -
 Triffids 共回答了17个问题
Triffids 共回答了17个问题 |采纳率94.1%在书上《化学使世界变得更加绚丽多彩》中有
(原子论和分子论)的创立,奠定了近代化学的基础.1869年,门捷列夫发现了(元素周期律)并编制出(元素周期表),使化学学习和研究变得有 规律可循.现代化学已在(材料)(能源)(环境)(生命科学)等研究上发挥越来越重要的作用1年前查看全部
- 门捷列夫在哪一年正式公布了元素周期律?
 幻之鸢尾蝶1年前2
幻之鸢尾蝶1年前2 -
 spinning狂人 共回答了31个问题
spinning狂人 共回答了31个问题 |采纳率93.5%是1869年
当有人将门捷列夫对元素周期律的发现看得很简单,轻松地说他是用玩扑克牌的方法得到这一伟大发现的,门捷列夫却认真地回答说,从他立志从事这项探索工作起,一直花了大约20年的功夫,才终于在1869年发表了元素周期律.他把化学元素从杂乱无章的迷宫中分门别类地理出了一个头绪.此外,因为他具有很大的勇气和信心,不怕名家指责,不怕嘲讽,勇于实践,敢于宣传自己的观点,终于得到了广泛的承认.为了纪念他的成就,人们将美国化学家希伯格在1955年发现的第101号新元素命名为Mendelevium,即“钔”.1年前查看全部
- 门捷列夫的化学原理里面讲了什么.上哪去买这本书
门捷列夫的化学原理里面讲了什么.上哪去买这本书
门捷列夫的化学原理整个都是写的什么 小谳1年前2
小谳1年前2 -
 wlmqdustma 共回答了15个问题
wlmqdustma 共回答了15个问题 |采纳率93.3%随着元素原子量的递增,元素性质呈现周期性变化.1年前查看全部
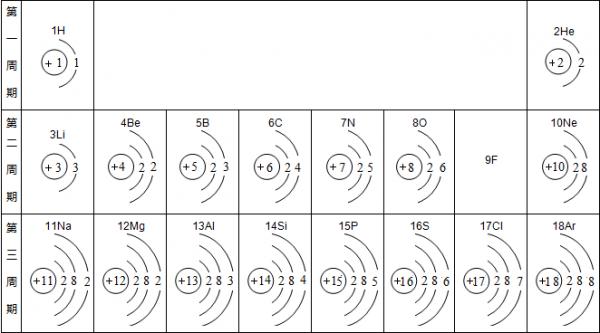
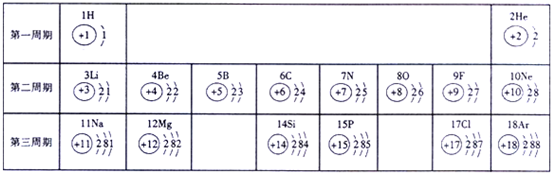
- 俄国化学家门捷列夫在总结前人经验的基础上,通过艰辛的努力,终于提出了现代元素周期表的雏形.下表为元素周期表的部分示意图,
俄国化学家门捷列夫在总结前人经验的基础上,通过艰辛的努力,终于提出了现代元素周期表的雏形.下表为元素周期表的部分示意图,横行为“周期”,竖列为“族”请利用下表回答相关问题.
(1)用符号表示:带两个单位负电荷的离子 ___ (写一种),Mg 2+ 的电子排布和 ___ 原子的电子排布完全相同.
(2)由这部分元素周期表你能发现并归纳很多规律,请你模仿例子写出另外两个规律.例如:在同一个周期中从左向右随着原子序数的增加,原子的最外层电子数也依次递增;
① ______________________________________ ;
② ______________________________________ .
(3)图甲是两种元素在周期表中的信息,图乙是氟原子的原子结构示意图.请完成下列问题: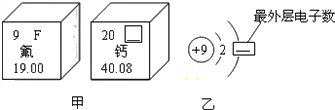
①图甲方框的横线上填的是 ___ ,图乙方框横线上的数字是 ___ ;
②图甲所示两种元素形成化合物的化学式为 ___ . The_one就是yy1年前1
The_one就是yy1年前1 -
 蛋蛋爱多 共回答了18个问题
蛋蛋爱多 共回答了18个问题 |采纳率83.3%(1)O 2﹣ 或S 2﹣ ;Ne
(2)根据元素周期表得规律:
①在同一周期中从左到右随着原子序数(或质子数)的增加,原子的电子总数也依次递增;
②在同一周期中,各原子的电子层数相同;
(3)
①Ca;7
②CaF 2 .1年前查看全部
- 简述门捷列夫的元素周期律
 蝙蝠一1年前1
蝙蝠一1年前1 -
 一笑红尘104 共回答了15个问题
一笑红尘104 共回答了15个问题 |采纳率93.3%元素周期律
元素的物理、化学性质随原子序数逐渐变化的规律叫做元素周期律.元素周期律由门捷列夫首先发现,并根据此规律创制了元素周期表.
结合元素周期表,元素周期律可以表述为:
随着原子序数的增加,元素的性质呈周期性的递变规律:
在同一周期中,元素的金属性从左到右递减,非金属性从左到右递增,
在同一族中,元素的金属性从上到下递增,非金属性从上到下递减;
同一周期中,元素的最高正氧化数从左到右递增(没有正价的除外),最低负氧化数从左到右逐渐增高;
同一族的元素性质相近.
以上规律不适用于稀有气体.
此外还有一些对元素金属性、非金属性的判断依据,可以作为元素周期律的补充:
元素单质的还原性越强,金属性就越强;单质氧化性越强,非金属性就越强.
元素的最高价氢氧化物的碱性越强,元素金属性就越强;最高价氢氧化物的酸性越强,元素非金属性就越强.
元素的气态氢化物越稳定,非金属性越强.
还有一些根据元素周期律得出的结论:
元素的金属性越强,其第一电离能就越小;非金属性越强,其第一电子亲和能就越大.
元素周期律的预见性
门捷列夫在创制周期表时,没有完全按照原子量的大小排列,而是严格遵守了“同族元素性质相近”这一规律.在周期表中留下的空位后来都被填上(如钪、镓等),而且性质也与门氏的预言吻合.他还根据周期律更正了铟等元素的原子量.
时至今日,人们还在用元素周期律来推测已发现和未发现的放射性元素的性质.
元素周期律的本质
电子构型是元素性质的决定性因素,而元素周期律是电子构型呈周期性、递变性变化规律的体现.
为了达到稳定状态,不同的原子选择不同的方式.同一周期元素中,轨道越“空”的元素越容易失去电子,轨道越“满”的越容易得电子.随着从左到右价层轨道由空到满的逐渐变化,元素也由主要显金属性向主要显非金属性逐渐变化.同一族元素中,由于周期越高,价电子的能量就越高,就越容易失去,因此排在下面的元素一般比上面的元素更具有金属性.具有同样价电子构型的原子,理论上得或失电子的趋势是相同的,这就是同一族元素性质相近的原因.1年前查看全部
- 关于元素周期律1869年,俄国化学家门捷列夫讲元素按照( )由小到大排列,将( )相似的元素放在一个( )行,通过分类,
关于元素周期律
1869年,俄国化学家门捷列夫讲元素按照( )由小到大排列,将( )相似的元素放在一个( )行,通过分类,归纳,制出了第一张元素周期表,揭示了化学元素间( )使其构成了一个( )成为化学发展史上的重要里程碑之一
注意咯:是门捷列夫之前做的那个元素周期表,并不是现在大家通常用的那个~急着做卷子,知道的告诉下啦 xfxf99211年前1
xfxf99211年前1 -
 CMDLOVECMD 共回答了15个问题
CMDLOVECMD 共回答了15个问题 |采纳率93.3%原子量
性质相似
相同
周期律
周期表1年前查看全部
- 下列科学家中,主要贡献不是在化学领域的科学家是( ) A.牛顿 B.道尔顿 C.阿伏加德罗 D.门捷列夫
 aihe25081年前1
aihe25081年前1 -
 lidtin 共回答了28个问题
lidtin 共回答了28个问题 |采纳率89.3%A、牛顿是著名的物理学家,主要贡献是在力学方面,不是在化学领域.
B、道尔顿在化学上的主要贡献是提出了原子学说,主要贡献是在化学领域,故选项错误.
C、阿伏加德罗在化学上的主要贡献是提出了分子的概念,并创立了分子学说,主要贡献是在化学领域.
D、门捷列夫在化学上的主要贡献是发现了元素周期律,并编制出元素周期表,主要贡献是在化学领域.
故选A.1年前查看全部
- 下列叙述中错误的是( )A.化学是研究物质的组成、结构、性质以及变化规律的一门科学B.1869年,门捷列夫发现了元素周
下列叙述中错误的是( )
A.化学是研究物质的组成、结构、性质以及变化规律的一门科学
B.1869年,门捷列夫发现了元素周期律和元素周期表
C.第一次明确提出“空气由氮气和氧气组成“的科学家是拉瓦锡
D.道尔顿和阿伏伽德罗分别创立了分子学说和原子学说 zxyyi1年前1
zxyyi1年前1 -
 红花nn 共回答了19个问题
红花nn 共回答了19个问题 |采纳率89.5%解题思路:化学是一门在分子、原子的层次上研究物质的性质、组成、结构、及其变化规律的科学,科学家们各自在科学上做出的贡献,进行分析判断即可.A、化学是一门在分子、原子的层次上研究物质的组成、结构、性质以及变化规律的一门科学,故选项说法正确.
B、1869年,门捷列夫发现了元素周期律和元素周期表,故选项说法正确.
C、第一次明确提出“空气由氮气和氧气组成“的科学家是拉瓦锡,故选项说法正确.
D、道尔顿在化学上的主要贡献是提出了原子学说,阿伏加德罗在化学上的主要贡献是提出了分子的概念,并创立了分子学说,故选项说法错误.
故选:D.点评:
本题考点: 化学的研究领域;化学的历史发展过程.
考点点评: 本题难度不大,了解化学研究的内容、化学的发展历史即可正确解答本题.1年前查看全部
- 从现在的角度来看,1869年门捷列夫论文中存在这不正确的地方是?
从现在的角度来看,1869年门捷列夫论文中存在这不正确的地方是?
论文内容:(1)按照相对原子质量带线排列起来的元素,在性质上呈现明显的周期性.(2)化学性质相似的元素,或者是相对原子质量相近,或者是依次递增相同的数量.(3)各元素及各族 按相对原子质量大小排列的对比与各元素的所谓的原子价相一致.(4)相对原子质量的大小决定元素的特征. 孜孜不倦1年前1
孜孜不倦1年前1 -
 may005 共回答了15个问题
may005 共回答了15个问题 |采纳率86.7%门捷列夫当初是用相对原子质量来区分元素种类和元素性质的,但实际应该是质子数.
所以,要把每点描述中的相对原子质量都改成质子数.1年前查看全部
- 19世纪中叶,俄国化学家门捷列夫的突出贡献是 (&
19世纪中叶,俄国化学家门捷列夫的突出贡献是()
A.提出原子学说 B.提出分子学说 C.发现元素周期律 D.发现氧气  sdhashja1年前1
sdhashja1年前1 -
 zxd8809 共回答了25个问题
zxd8809 共回答了25个问题 |采纳率92%C
1年前查看全部
- 需要 阿伏伽德罗 汤姆生 门捷列夫和道尔顿的化学贡献
需要 阿伏伽德罗 汤姆生 门捷列夫和道尔顿的化学贡献
别沾那么多没用的 我只需要 他们的贡献!】 错爱流星1年前2
错爱流星1年前2 -
 jian200081 共回答了24个问题
jian200081 共回答了24个问题 |采纳率87.5%阿伏伽德罗:发现了阿伏伽德罗定律,计算出阿伏伽德罗常数
汤姆生:发现电子,提出葡萄干面包原子模型
门捷列夫:发现元素周期律,设计门捷列夫元素周期表
道尔顿:提出近代原子论1年前查看全部
- 俄国化学家门捷列夫在总结前人经验的基础上,通过艰辛的努力,终于提出了现代元素周期表的雏形.下表为元素周期表的部分示意图,
俄国化学家门捷列夫在总结前人经验的基础上,通过艰辛的努力,终于提出了现代元素周期表的雏形.下表为元素周期表的部分示意图,请利用下表回答相关问题.
(1)用符号表示:带两个单位负电荷且质子数为8的离子______(写一种).
(2)一个水分子共有______个原子核、______个质子.一个Mg2+核外共有______个电子;Cl-的最外层电子数和______原子的最外层电子数相同.
(3)我发现如下规律:
①在化学反应中,第Ⅰ纵行的元素比较容易______电子;第Ⅵ纵行的元素比较容易______
电子,(除H外)都通常达到8个电子的稳定结构.可见元素的化学性质主要决定于原子的______数.
②从原子结构方面看:同一横行的元素具有相同的______数;同一纵行的元素具有相同的
______数.此外还有:______;
(4)如图甲是两种元素在周期表中的信息,图乙是氟原子的原子结构示意图.请完成下列问题: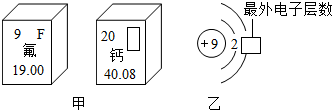
①如图甲方框的横线上填的是______,如图乙方框横线上的数字是______;
②如图甲所示两种元素形成化合物的化学式为______. glmt1年前1
glmt1年前1 -
 winds779 共回答了12个问题
winds779 共回答了12个问题 |采纳率91.7%解题思路:(1)根据离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略,进行解答;(2)根据标在元素符号右下角的数字表示一个分子中所含原子的个数;根据常用化学用语及其含义进行解答;(3)①根据原子结构示意图和金属元素的原子最外层电子数一般少于4个,非金属元素的原子最外层电子数一般多于4个;金属元素在化学反应中易失去电子,非金属元素在化学反应中易得到电子,元素的化学性质与最外层电子数有关,进行解答;②根据原子结构示意图进行分析解答本题;(4)①根据元素名称写出元素符号即可;根据在原子中,原子序数=质子数=核外电子数,进行解答;②根据化合价利用十字交叉法写出化学式即可.(1)根据离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略,带两个单位负电荷且质子数为8的离子表示为:O2-;故答案为::O2-;
(2)根据标在元素符号右下角的数字表示一个分子中所含原子的个数;依次一个水分子H2O共有 3个原子核、10个质子.一个Mg2+核外共有 10个电子;Cl-的最外层电子数和 Ar原子的最外层电子数相同.
故答案为:3; 10; 10; Ar;
(3)①根据原子结构示意图和金属元素的原子最外层电子数一般少于4个,非金属元素的原子最外层电子数一般多于4个;金属元素在化学反应中易失去电子,非金属元素在化学反应中易得到电子,元素的化学性质与最外层电子数有关;
故答案为:失;得;最外层电子;
②根据原子结构示意图分析可知:同一横行的元素具有相同的电子层数;同一纵行的元素具有相同的最外层电子数;
同一周期中最外层电子数1--8依次增大;故答案为:电子层;最外层电子;同一周期中最外层电子数1--8依次增大;
(4)①根据元素名称写出元素符号为Ca;
根据在原子中,原子序数=质子数=核外电子数,乙中的最外层电子数为7;
②根据化合价利用十字交叉法,两种元素形成化合物的化学式为:CaF2;
故答案为:Ca; 7;CaF2.点评:
本题考点: 元素周期表的特点及其应用;原子结构示意图与离子结构示意图.
考点点评: 本题考查学生根据原子结构示意图分析总结元素周期律及对元素的性质与最外层电子数的关系的理解与掌握,并能在解题中灵活应用.1年前查看全部
- 阅读材料,回答问题:材料一:l869年,俄国化学家门捷列夫对已发现的元素进行研究,制作了元素周期表,并在他的元素周期表中
阅读材料,回答问题:
材料一:l869年,俄国化学家门捷列夫对已发现的元素进行研究,制作了元素周期表,并在他的元素周期表中留下了许多空位代表尚未发现的新元素,其中就预言了“类铝”这种新元素.
材料二:l875年,法国化学家布瓦博德朗公布了他发现的新元素镓(元素符号为Ga)的性质:镓是银白色金属,密度4.7g•cm-3,能与沸水剧烈反应生成氢气和氢氧化镓.不久,他收到门捷列夫的来信称:镓就是我预言的“类铝”,其密度应在5.9-6.0g•cm-3之间.
材料三:l876年,布瓦博德朗将金属镓提纯后测得镓的密度为5.94g•cm-3,从而验证了元素周期表的正确性.随后科学家根据元素周期表的空位,按图索骥,发现了许多新元素.目前金属镓广泛用于制造半导体材料.在镓原子中原子核外有31个电子.
(1)镓元素的质子数为______;
(2)请根据上述材料,总结金属镓的有关知识:
物理性质:______;
化学性质(用文字表达式表示):______;
用途:______. 虚心学习学校1年前1
虚心学习学校1年前1 -
 yangsong12 共回答了18个问题
yangsong12 共回答了18个问题 |采纳率88.9%解题思路:(1)原子中,质子数=核外电子数,据此进行分析解答.
(2)物质的化学性质是需要通过化学变化才能表现出来的性质,物理性质是不需要发生化学变化就能表现出来的性质,包括物质的颜色、状态、气味、熔点、沸点、密度、溶解性等,化学性质一般包括可燃性、氧化性、稳定性、还原性等.(1)原子中,质子数=核外电子数,由镓的原子结构示意图可知,x=2+8=18+3=31;
(2)物理性质是不需要发生化学变化就能表现出来的性质,镓是银白色金属,密度4.7g•cm-3,不需要通过化学变化就能表现出来,属于物理性质.
能与沸水剧烈反应生成氢气和氢氧化镓,需要通过化学反应才能表现出来,属于化学性质,反应的化学方程式为:2Ga+6H2O=3H2↑+2Ga(OH)3.
目前金属镓广泛用于制造半导体材,属于金属镓的用途.
故答案为:(1)31;(2)银白色,密度为5.94g.Cm-3;镓+水→氢气+氢氧化镓;制造半导体材料;点评:
本题考点: 元素周期表的特点及其应用;原子的有关数量计算;化学性质与物理性质的差别及应用;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度不大,掌握元素周期表中元素的信息、原子结构示意图的意义、物理性质与化学性质的区别方法、化学方程式的书写等是正确解答本题的关键.1年前查看全部
- 19世纪中叶,俄国化学家门捷列夫对化学学科的巨大贡献是( )
19世纪中叶,俄国化学家门捷列夫对化学学科的巨大贡献是( )
A.提出了原子学说
B.提出了元素周期律
C.提出了分子学说
D.制定了科学的元素周期表 xuemeifei1年前1
xuemeifei1年前1 -
 明教猫儿是个黑 共回答了24个问题
明教猫儿是个黑 共回答了24个问题 |采纳率91.7%解题思路:1869年,俄国化学家门捷列夫发现了元素周期律,并编制出元素周期表,使得化学学习和研究变得有规律可循.A.道尔顿提出了近代原子学说,故A错误;
B.1869年,俄国化学家门捷列夫发现了元素周期律,故B正确;
C.阿佛加德罗提出了分子学说,故C错误;
D.1869年,俄国化学家门捷列夫发现了元素周期律,并编制出元素周期表,故D正确.
故选BD.点评:
本题考点: 化学史;元素周期表的结构及其应用.
考点点评: 本题考查化学史,熟记化学发展史中各科学家所作出的巨大贡献.1年前查看全部
- 俄国化学家门捷列夫在总结前人经验的基础上,通过艰辛的努力,终于提出了现代元素周期表的雏形.如表为元素周期表的部分元素的相
俄国化学家门捷列夫在总结前人经验的基础上,通过艰辛的努力,终于提出了现代元素周期表的雏形.如表为元素周期表的部分元素的相关信息,利用下表回答相关问题
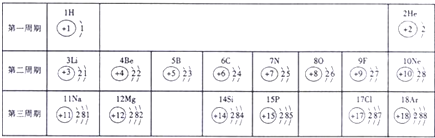
(1)请画出16号元素原子结构示意图______,化学反应中该原子比较容易______(填“得到”或“失去”)电子变成离子;
(2) 表示的是______(填粒子符号);
表示的是______(填粒子符号);
(3)在元素周期表中,同一族的元素的原子因为最外层电子数相同而具有相似的化学性质.则下列各组元素具有相似化学性质的是______(填标号).
a.He和Beb.Li和Nac.Si和Pd.F和Cl
(4)上表中第二、三周期元素最外层电子数的变化规律是______.
(5)不含原子团的物质是______.
A、KClB、NaOHC、NH4Cl D、BaSO4. calykuang1年前1
calykuang1年前1 -
 李木染 共回答了19个问题
李木染 共回答了19个问题 |采纳率94.7%解题思路:(1)根据原子结构示意图的各部分的意义分析解答;
(2)根据粒子结构示意图分析解称
(3)根据元素原子结构示意图和最外层电子数相同进行解答;
(4)根据表中各元素最外层电子数的特点分析规律.
(5)在许多化学反应里,常常作为一个整体参加反应,这样的原子集团叫做原子团;在初中常见的有:硫酸根、碳酸根、氢氧根、硝酸根、磷酸根、氯酸根等.(1)根据原子结构示意图的画法画出硫原子的结构示意图为
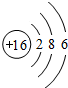 ,最外层有6个电子,易得到两个成为8电子稳定结构.
,最外层有6个电子,易得到两个成为8电子稳定结构.
(2)此粒子结构图中质子数为13,是硫元素,核外有10个电子,是阳离子,故符号为Al3+;
(3)根据元素原子结构示意图和最外层电子数相同,可知Li和Na;F和Cl具有相似化学性质;故选b、d;
(4)观察表中第二三周期各元素最外层电子数的变化可以看出最外层电子数从左到右由1递增到8;
(5)A、KCl中只含有铝元素和氧元素,不含原子团;B、NaOH含有氢氧根;C、NH4Cl含有铵根;D、BaSO4含有硫酸根;
故答案为:(1) 得到 (2)Al3+;(3)b、d(4)最外层电子数从左到右由1递增到8.(5)A.
得到 (2)Al3+;(3)b、d(4)最外层电子数从左到右由1递增到8.(5)A.点评:
本题考点: 元素周期表的特点及其应用;原子结构示意图与离子结构示意图.
考点点评: 本题考查学生根据原子结构示意图分析总结元素周期律及对元素的性质与最外层电子数的关系的理解与掌握,并能在解题中灵活应用.1年前查看全部
- 门捷列夫到底用了多少年时间发现并制定了元素周期表?
 依然_1年前1
依然_1年前1 -
 linkkkk 共回答了17个问题
linkkkk 共回答了17个问题 |采纳率82.4%19世纪中期,俄国化学家门捷列夫制定了化学元素周期表
门捷列夫出生于1834年,他出生不久,父亲就因双目失明出外就医,失去了得以维持家人生活的教员职位.门捷列夫14岁那年,父亲逝世,接着火灾又吞没了他家中的所有财产,真是祸不单行.1850年,家境困顿的门捷列夫藉着微薄的助学金开始了他的大学生活,后来成了彼得堡大学的教授.
幸运的是,门捷列夫生活在化学界探索元素规律的卓绝时期.当时,各国化学家都在探索已知的几十种元素的内在联系规律.
1865年,英国化学家纽兰兹把当时已知的元素按原子量大小的顺序进行排列,发现无论从哪一个元素算起,每到第八个元素就和第一个元素的性质相近.这很像音乐上的八度音循环,因此,他干脆把元素的这种周期性叫做“八音律”,并据此画出了标示元素关系的“八音律”表.
显然,纽兰兹已经下意识地摸到了“真理女神”的裙角,差点就揭示元素周期律了.不过,条件限制了他作进一步的探索,因为当时原子量的测定值有错误,而且他也没有考虑到还有尚未发现的元素,只是机械地按当时的原子量大小将元素排列起来,所以他没能揭示出元素之间的内在规律.
可见,任何科学真理的发现,都不会是一帆风顺的,都会受到阻力,有些阻力甚至是人为的.当年,纽兰兹的“八音律”在英国化学学会上受到了嘲弄,主持人以不无讥讽的口吻问道:“你为什么不按元素的字母顺序排列?”
门捷列夫顾不了这么多,他以惊人的洞察力投入了艰苦的探索.直到1869年,他将当时已知的仍种元素的主要性质和原子量,写在一张张小卡片上,进行反复排列比较,才最后发现了元素周期规律,并依此制定了元素周期表.
门捷列夫的元素周期律宣称:把元素按原子量的大小排列起来,在物质上会出现明显的周期性;原子量的大小决定元素的性质;可根据元素周期律修正已知元素的原子量.
门捷列夫元素周期表被后来一个个发现新元素的实验证实,反过来,元素周期表又指导化学家们有计划、有目的地寻找新的化学元素.至此,人们对元素的认识跨过漫长的探索历程,终于进入了自由王国.
门捷列夫,这位化学巨人的元素周期表奠定了现代化学和物理学的理论基础.
在他死后;人们格外怀念这位个子魁伟,留着长发,有着碧蓝的眼珠、挺直的鼻子、宽广的前额的化学家.他生前总是穿着自己设计的似乎有点古怪的衣服.上衣的口袋特别大,据说那是便于放下厚厚的笔记本——他一想到什么,总是习惯地立即从衣袋里掏出笔记本,把它顺手记下.
门捷列夫生活上总是以简朴为乐.即使是沙皇想接见他,他也事先声明——平时穿什么,接见时就穿什么.对于衣服的式样,他毫不在乎,说:“我的心思在周期表上,不在衣服上.”他的头发式样也很随便.那时,男人们流行戴假发,对此,门捷列夫总是摇着头说:“我喜欢我的真头发.”
捷列夫把元素卡片进行系统地整理.门捷列夫的家人看到一向珍惜时间的教授突然热衷于“纸牌”感到奇怪.门捷列夫旁若无人,每天手拿元素卡片像玩纸牌那样,收起、摆开,再收起、再摆开,皱着眉头地玩“牌”……
冬去春来.门捷列夫没有在杂乱无章的元素卡片中找到内在的规律.有一大,他又坐到桌前摆弄起“纸牌”来了,摆着,摆着,门捷列夫像触电似的站了起来,在他面前出现了完全没有料到的现象,每一行元素的性质都是按照原子量的增大而从上到下地逐渐变化着.
门捷列夫激动得双手不断颤抖着.“这就是说,元素的性质与它们的原子量呈周期性有关系.”门捷列夫兴奋地在室内踱着步子,然后,迅速地抓起记事簿在上面写道:“根据元素原子量及其化学性质的近似性试排元素表.”
1869年2月底,门捷列夫终于在化学元素符号的排列中,发现了元素具有周期性变化的规律.同年,德国化学家迈尔根据元素的物理性质及其他性质,也制出了一个元素周期表.到了1869年底,门捷列夫已经积累了关于元素化学组成和性质的足够材料.
元素周期律一举连中三元,使人类认识到化学元素性质发生变化是由量变到质变的过程,把原来认为各种元素之间彼此孤立、互不相关的观点彻底打破了,使化学研究从只限于对无数个别的零星事实作无规律的罗列中摆脱出来,从而奠定了现代化学的基础.1年前查看全部
- 下列叙述不符合化学史实的是 A.俄国化学家门捷列夫发现了元素周期律,并编制了第一张元素周期表 B.法国化学家拉瓦锡测定出
下列叙述不符合化学史实的是
A.俄国化学家门捷列夫发现了元素周期律,并编制了第一张元素周期表 B.法国化学家拉瓦锡测定出了空气中所有成份的具体含量 C.首先提出分子概念的是意大利科学家阿伏加德罗 D.近代原子学说是由英国科学家道尔顿提出的  爱上安然1年前1
爱上安然1年前1 -
 opheliahan 共回答了17个问题
opheliahan 共回答了17个问题 |采纳率82.4%B
A、俄国化学家门捷列夫在化学上的主要贡献是发现了元素周期律,并编制出第一张元素周期表,故选项说法正确.
B、法国科学家拉瓦锡通过实验得出空气是由氮气和氧气组成的结论,但没有测定出空气中所有成份的具体含量,故选项说法错误.
C、意大利科学家阿伏加德罗在化学上的主要贡献是首先提出了分子的概念,并创立了分子学说,故选项说法正确.
D、英国科学家道尔顿在化学上的主要贡献是提出了近代原子学说,故选项说法正确.
故选B.1年前查看全部
- 沥青铀矿主要成分是铀(U)和氧元素.现已测定其中U、O两种元素的质量分数.如果按照门捷列夫的相对原子质量U为240,此时
沥青铀矿主要成分是铀(U)和氧元素.现已测定其中U、O两种元素的质量分数.如果按照门捷列夫的相对原子质量U为240,此时沥青铀矿的化学式为U3O8.历史上柏齐里乌斯认为U的相对原子质量为120,而阿姆斯则认为U的相对原子质量为180.试推断柏齐乌斯和阿姆斯给沥青铀矿所写的化学式分别为 U3O4U3O4、UO2UO2.
 说好我请客1年前1
说好我请客1年前1 -
 lalaono 共回答了21个问题
lalaono 共回答了21个问题 |采纳率95.2%解题思路:根据:物质中某元素的质量分数=[该元素的相对原子质量×原子个数/化合物的相对分子质量]×100%.
(1)因为U3O8,已测定其中U、O两种元素的质量分数,设齐乌斯给沥青铀矿所写的化学式中U原子个数为x、O原子个数为y,则化学式为UxOy,则根据U3O8中的U元素的质量分数与UxOy中的U元素的质量分数相等,可以列比例式,求得x与y的比值,便可求得化学式为UxOy;所以化学式为U3O4;
(2)因为U3O8,已测定其中U、O两种元素的质量分数,设阿姆斯给沥青铀矿所写的化学式中U原子个数为x、O原子个数为y,则化学式为UxOy,则根据U3O8中的U元素的质量分数与UxOy中的U元素的质量分数相等,可以列比例式,求得x与y的比值,便可求得化学式为UxOy;所以化学式为UO2.(1)因为U3O8,已测定其中U、O两种元素的质量分数,设齐乌斯给沥青铀矿所写的化学式中U原子个数为x、O原子个数为y,则化学式为UxOy,则根据U3O8中的U元素的质量分数与UxOy中的U元素的质量分数相等,可以列等式:
240×3
240×3+16×8×100%=
120x
120x+16y×100%,显然:
x
y=
3
4,所以为U3O4.
(2)因为U3O8,已测定其中U、O两种元素的质量分数,设阿姆斯给沥青铀矿所写的化学式中U原子个数为x、O原子个数为y,则化学式为UxOy,则根据U3O8中的U元素的质量分数与UxOy中的U元素的质量分数相等,可以列等式:
240×3
240×3+16×8×100%=
180x
180x+16y×100%,显然:
x
y=
1
2,所以UO2.
故答为:U3O4,UO2点评:
本题考点: 化学式的书写及意义;相对分子质量的概念及其计算.
考点点评: 本题主要考查化学式的意义、根据化学式确定组成物质元素之间的质量关系以及有机物的定义,掌握相对分子质量及其计算.1年前查看全部
- 门捷列夫提出元素周期律,研究元素性质的周期性变化时,主要是按什么规律排列的
门捷列夫提出元素周期律,研究元素性质的周期性变化时,主要是按什么规律排列的
A.原子序数的递增 B.相对原子质量的递增
C.核外电子的排布 D.质子数的递增
参考答案是B 可是我想不通啊
为什么不是A呢 yikan1年前3
yikan1年前3 -
 青灯陵魍魉 共回答了17个问题
青灯陵魍魉 共回答了17个问题 |采纳率100%应该是C
注意题目是规律性,如果选A ,就没规律可言了.每一个周期,核外电子数依次递增,每一层电子数目多少也是有规律的1年前查看全部
- 下列那一个是数学家?1.钱斯尔2.门捷列夫3.巴斯夫4.高斯
 1762360011年前1
1762360011年前1 -
 yck732 共回答了16个问题
yck732 共回答了16个问题 |采纳率87.5%高斯是一个从小就有数学天赋的孩子,当小学老师出了一道从1加到100的题目后, 他当时就很快地得出5050 的答案了.1年前查看全部
- 化学元素周期表是如何产生的门捷列夫是在什么情况下提出的
 oasis233321年前1
oasis233321年前1 -
 yeyuhuan 共回答了29个问题
yeyuhuan 共回答了29个问题 |采纳率89.7%19世纪中期,俄国化学家门捷列夫制定了化学元素周期表
门捷列夫出生于1834年,他出生不久,父亲就因双目失明出外就医,失去了得以维持家人生活的教员职位.门捷列夫14岁那年,父亲逝世,接着火灾又吞没了他家中的所有财产,真是祸不单行.1850年,家境困顿的门捷列夫藉着微薄的助学金开始了他的大学生活,后来成了彼得堡大学的教授.
幸运的是,门捷列夫生活在化学界探索元素规律的卓绝时期.当时,各国化学家都在探索已知的几十种元素的内在联系规律.
1865年,英国化学家纽兰兹把当时已知的元素按原子量大小的顺序进行排列,发现无论从哪一个元素算起,每到第八个元素就和第一个元素的性质相近.这很像音乐上的八度音循环,因此,他干脆把元素的这种周期性叫做“八音律”,并据此画出了标示元素关系的“八音律”表.
显然,纽兰兹已经下意识地摸到了“真理女神”的裙角,差点就揭示元素周期律了.不过,条件限制了他作进一步的探索,因为当时原子量的测定值有错误,而且他也没有考虑到还有尚未发现的元素,只是机械地按当时的原子量大小将元素排列起来,所以他没能揭示出元素之间的内在规律.
可见,任何科学真理的发现,都不会是一帆风顺的,都会受到阻力,有些阻力甚至是人为的.当年,纽兰兹的“八音律”在英国化学学会上受到了嘲弄,主持人以不无讥讽的口吻问道:“你为什么不按元素的字母顺序排列?”
门捷列夫顾不了这么多,他以惊人的洞察力投入了艰苦的探索.直到1869年,他将当时已知的仍种元素的主要性质和原子量,写在一张张小卡片上,进行反复排列比较,才最后发现了元素周期规律,并依此制定了元素周期表.
门捷列夫的元素周期律宣称:把元素按原子量的大小排列起来,在物质上会出现明显的周期性;原子量的大小决定元素的性质;可根据元素周期律修正已知元素的原子量.
门捷列夫元素周期表被后来一个个发现新元素的实验证实,反过来,元素周期表又指导化学家们有计划、有目的地寻找新的化学元素.至此,人们对元素的认识跨过漫长的探索历程,终于进入了自由王国.
门捷列夫,这位化学巨人的元素周期表奠定了现代化学和物理学的理论基础.
在他死后;人们格外怀念这位个子魁伟,留着长发,有着碧蓝的眼珠、挺直的鼻子、宽广的前额的化学家.他生前总是穿着自己设计的似乎有点古怪的衣服.上衣的口袋特别大,据说那是便于放下厚厚的笔记本——他一想到什么,总是习惯地立即从衣袋里掏出笔记本,把它顺手记下.
门捷列夫生活上总是以简朴为乐.即使是沙皇想接见他,他也事先声明——平时穿什么,接见时就穿什么.对于衣服的式样,他毫不在乎,说:“我的心思在周期表上,不在衣服上.”他的头发式样也很随便.那时,男人们流行戴假发,对此,门捷列夫总是摇着头说:“我喜欢我的真头发.”1年前查看全部
- 请个高手帮我一个忙(化学题)沥青铀矿主要成分的化学式为U3O8.历史上,贝采利乌斯把U的相对原子质量定位120,门捷列夫
请个高手帮我一个忙(化学题)
沥青铀矿主要成分的化学式为U3O8.历史上,贝采利乌斯把U的相对原子质量定位120,门捷列夫建议改为240,阿姆斯特朗又认为是180.现已证明门氏正确,请推测贝氏与阿氏给沥青铀矿写的化学式.
(须过程及答案)
无 王老五的石头1年前1
王老五的石头1年前1 -
 huadabj 共回答了11个问题
huadabj 共回答了11个问题 |采纳率100%无论沥青铀矿主要成分的化学式怎样书写,沥青铀矿中铀元素与氧元素的质量比总是一定的.由门氏化学式可知:沥青铀矿中铀元素与氧元素的质量比为:
m(U)∶m(O)=240*3∶16*8=45∶8
若铀的相对原子质量为120,则:
N(U)∶N(O)=(45÷120)∶(8÷16)=3∶4
所以贝氏给沥青铀矿写的化学式为U3O4
若铀的相对原子质量为180,则:
N(U)∶N(O)=(45÷180)∶(8÷16)=1∶2
所以阿氏给沥青铀矿写的化学式为UO21年前查看全部
- 门捷列夫的名言到底有多少,就要门捷列夫的名言
 心冷无余1年前0
心冷无余1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 元素周期表是由门捷列夫提出的,是按照质子数排的,有按中子数排的吗?肯定也有规律
 骑着托把看日落1年前1
骑着托把看日落1年前1 -
 红雨9044 共回答了22个问题
红雨9044 共回答了22个问题 |采纳率86.4%应该是没有按中子数排列的. 因为同一种元素只有唯一确定的质子数, 但中子数可以是多种的. 如氢元素, 它有一个质子, 零个中子,叫氕; 一个质子, 一个中子, 叫氘; 一个质子, 两个中子, 叫氚.1年前查看全部
- 俄国化学家门捷列夫在总结前人经验的基础上,通过艰辛的努力,终于提出了现代元素周期表的雏形.下表为元素周期表的部分元素的相
俄国化学家门捷列夫在总结前人经验的基础上,通过艰辛的努力,终于提出了现代元素周期表的雏形.下表为元素周期表的部分元素的相关信息,利用下表回答相关问题
(1)请画出16号元素原子结构示意图______化学反应中该原子比较容易______(填“得到”或“失去”)电子变成离子;第一周期 
第二周期 
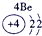
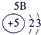
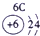
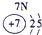

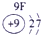
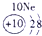
第三周期 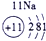





(2) 表示的是______(填离子符号);
表示的是______(填离子符号);
(3)上表中最活泼的金属元素与地壳中含量最多的元素组成的化合物是______(填化学式,任意填写一种);
(4)上表中第二、三周期元素最外层电子数的变化规律是______. ctao1601年前1
ctao1601年前1 -
 MS薛宝钗 共回答了19个问题
MS薛宝钗 共回答了19个问题 |采纳率94.7%解题思路:(1)原子核内质子数=核电荷数=原子序数;
(2)根据离子的核电荷数与核外电子数的关系来回答;
(3)周期表中最活泼金属元素在右下角位置,地壳中含量最多的元素是Al;
(4)根据元素周期律中每一周期元素原子的最外层电子数的地变规律来回答.根据原子结构知识,可以确定16号元素原子是硫原子,核外16个电子,最外层6个电子,S元素的非金属性较强,在反应中易得到电子,原子结构示意图为:
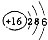 ,故答案为:
,故答案为: ;得到;
;得到;
(2)阳离子的核电荷数=核外电子数+失电子数,原子核内质子数=核电荷数,所以13号元素是Al,核外电子数是10,所以表示的是Al3+,故答案为:Al3+;
(3)周期表中从左到右金属的活泼性逐渐减弱,从上到下,金属的活泼性逐渐增强,所以最活泼金属元素在右下角位置,应为Na,地壳中含量最多的元素是O,二者可以形成氧化钠或是过氧化钠,故答案为:Na2O(或Na2O2);
(4)第二、三周期元素最外层电子数随着原子序数的递增逐渐从1增加到7,故答案为:最外层电子数随着原子序数的递增逐渐从1增加到7.点评:
本题考点: 元素周期律和元素周期表的综合应用;原子结构示意图;原子核外电子排布.
考点点评: 本题考查学生元素周期表和元素周期律的综合知识,难度不大.1年前查看全部
- 组成物质的基本成分—元素.门捷列夫发现了_____和_____,使化学学习和研究变得有规律可寻
组成物质的基本成分—元素.门捷列夫发现了_____和_____,使化学学习和研究变得有规律可寻
我只知道其中的一个空是“元素周期律”,不知另一个是什么?请赐教 baoyongcheng1年前1
baoyongcheng1年前1 -
 依稀西若 共回答了20个问题
依稀西若 共回答了20个问题 |采纳率90%元素周期表(笑).1年前查看全部
- 元素周期表是门捷列夫做梦
 5浪1年前4
5浪1年前4 -
 torchzhang 共回答了17个问题
torchzhang 共回答了17个问题 |采纳率82.4%不是,他通过数十年的研究而发现的.有趣的是,德国化学家库勒在做梦中意识到苯是环状的1年前查看全部
- 俄国化学家门捷列夫在总结前人经验的基础上,通过艰辛的努力,终于提出了现代元素周期表的雏形.如图为元素周期表的部分元素的相
俄国化学家门捷列夫在总结前人经验的基础上,通过艰辛的努力,终于提出了现代元素周期表的雏形.如图为元素周期表的部分元素的相关信息,利用下表回答相关问题

(1)请指出16号元素原子结构示意图中的最外层电子数______化学反应中该原子比较容易______(填“得到”或“失去”)电子变成离子;
(2) 表示的是______(填离子符号);
表示的是______(填离子符号);
(3)如图中最活泼的金属元素与地壳中含量最多的元素组成的化合物是______(填化学式,任意填写一种);
(4)如图中第二、三周期元素最外层电子数的变化规律是______. sweetdays1年前1
sweetdays1年前1 -
 hupiero1 共回答了23个问题
hupiero1 共回答了23个问题 |采纳率100%解题思路:(1)根据原子结构示意图来分析其最外层电子数和得失电子的情况;
(2)根据粒子结构示意图分析;
(3)根据地壳中含量最多的元素是氧元素,该表中活泼的金属元素如:钠、镁、铝的化合价和化学式的书写方法书写化学式;
(4)根据表中各元素最外层电子数的特点分析规律.(1)由16号元素也就是硫元素的原子结构示意图可知,其最外层电子数为6,在化学反应中易得电子;
(2)此粒子结构图中质子数为13,是铝元素,核外有10个电子,是阳离子,故符号为Al3+;
(3)在此表中,钠元素是最活泼的金属元素,通常在化合物中显+1价,氧-2价,所形成化合物的化学式为Na2O;
(4)观察表中第二、三周期各元素最外层电子数的变化可以看出最外层电子数从左到右由1递增到8.
故答案为:(1)6;得到;(2)Al3+;(3)Na2O;(4)从1--8逐渐递增.点评:
本题考点: 元素周期表的特点及其应用;原子结构示意图与离子结构示意图.
考点点评: 本题考查学生根据原子结构示意图分析总结元素周期律及对元素的性质与最外层电子数的关系的理解与掌握,并能在解题中灵活应用.1年前查看全部
- 俄国化学家门捷列夫在总结前人经验的基础上,通过艰辛的努力,终于提出了现代元素周期表的雏形.下表为元素周期表的部分元素的相
俄国化学家门捷列夫在总结前人经验的基础上,通过艰辛的努力,终于提出了现代元素周期表的雏形.下表为元素周期表的部分元素的相关信息,利用下表回答问题.

(1)请画出16号元素的原子结构示意图______,化学反应中该原子比较容易______(填“得到”或“失去”)电子变成离子.
(2)上表第二周期元素中具有相对稳定结构的是______(填元素符号).
(3) 表示的是______(填离子符号).
表示的是______(填离子符号).
(4)上表中第二、三周期元素最外层电子数的变化规律是______. 对外S周洁1年前1
对外S周洁1年前1 -
 云龙梦梦 共回答了14个问题
云龙梦梦 共回答了14个问题 |采纳率85.7%解题思路:(1)根据原子结构示意图的各部分的意义分析解答;
(2)根据最外层电子数决定元素的化学性质来分析.
(3)根据粒子结构示意图分析解称;
(4)根据表中各元素最外层电子数的特点分析规律.(1)根据原子结构示意图的画法画出硫原子的结构示意图为:
 ;最外层有6个电子,易得到两个成为8电子稳定结构.故填:
;最外层有6个电子,易得到两个成为8电子稳定结构.故填: ;得到;
;得到;
(2)最外层电子数为8(一个电子层最外层是2)属于相对稳定结构,所以第二周期中具有相对稳定结构的元素是氖元素,其元素符号位Ne.故填:Ne;
(3)此粒子结构图中质子数为13,是硫元素,核外有10个电子,是阳离子,故符号为Al3+;故填:Al3+;
(4)观察表中第二、三周期各元素最外层电子数的变化可以看出最外层电子数从左到右由1递增到8.故填:同一周期从左到右最外层电子数依次增加.点评:
本题考点: 元素周期表的特点及其应用;原子结构示意图与离子结构示意图.
考点点评: 本题考查学生根据原子结构示意图分析总结元素周期律及对元素的性质与最外层电子数的关系的理解与掌握,并能在解题中灵活应用.1年前查看全部
- 化学之父是()A.波意耳 B.拉瓦锡 C.道尔顿 D.门捷列夫
 冷树叶5311年前1
冷树叶5311年前1 -
 笑脸为形 共回答了19个问题
笑脸为形 共回答了19个问题 |采纳率89.5%19世纪初,道尔顿创立了近代原子论.近代原子论使当时的化学知识和理论得到了合理的解释,成为说明化学现象的统一理论.
C1年前查看全部
- 道尔顿、卢瑟福、波尔、居里夫人、门捷列夫、凯库勒、侯德榜这些化学家的主要贡献
 scandy51611年前1
scandy51611年前1 -
 aloneship 共回答了17个问题
aloneship 共回答了17个问题 |采纳率88.2%1.道尔顿发现原子
2.卢瑟福提出带核的原子模型,并用α散射实验证明
3.波尔发现原子核外电子有规律运动
4.居里夫人发现镭
5.门捷列夫发现元素周期律,并制元素周期表
6.凯库勒总结出苯环的结构(单双键交替)【其实是错的】
7.侯德榜发明侯氏制碱法
以上皆为中学课本所学,当然还有很多贡献.既然是主要贡献,就点到为止,更不可能与百度百科相比.1年前查看全部
- 门捷列夫的化学元素周期表图
 精灵小石1年前2
精灵小石1年前2 -
 yy7577777oo 共回答了21个问题
yy7577777oo 共回答了21个问题 |采纳率76.2%http://www.***.com.cn/200406/ca525708.htm1年前查看全部
- 门捷列夫的元素周期表有什么规律呀,怎么递推出元素的性质
 happy-life1年前2
happy-life1年前2 -
 胡豆-- 共回答了19个问题
胡豆-- 共回答了19个问题 |采纳率100%【元素周期律的发现】
19世纪60年代,化学家已经发现了60多种元素,并积累了这些元素的原子量数据,为寻找元素间的内在联系创造必要的条件.俄国著名化学家门捷列夫和德国化学家迈耶尔等分别根据原子量的大小,将元素进行分类排队,发现元素性质随原子量的递增呈明显的周期变化的规律.1868年,门捷列夫经过多年的艰苦探索,发现了自然界中一个极其重要的规律—元素周期规律.这个规律的发现是继原子-分子论之后,近代化学史上的又一座光彩夺目的里程碑,它所蕴藏的丰富和深刻的内涵,对以后整个化学和自然科学的发展都具有普遍的知道意义.1869年,门捷列夫提出第一张元素周期表,根据周期律修正了铟、铀、钍、铯等9种元素的原子量;他还预言了三种新元素及其特性,并暂时取名为类铝、类硼、类硅,这就是1871年发现的镓、1880年发现的钪和1886年发现的锗.这些新元素的原子量、密度和物理化学性质都与门捷列夫的预言惊人相符,周期律的正确性由此得到了举世公认.
[编辑本段]【元素周期律的内涵】
结合元素周期表,元素周期律可以表述为:元素的性质 随着原子序数的递增而呈周期性的递变规律.
元素周期律的本质:元素核外电子排布的周期性决定了元素性质的周期性.
元素周期律的内容:
原子半径变化示意图一、原子半径
同一周期(稀有气体除外),从左到右,随着原子序数的递增,元素原子的半径递减;
同一族中,从上到下,随着原子序数的递增,元素原子半径递增.
二、主要化合价(最高正化合价和最低负化合价)
同一周期中,从左到右,随着原子序数的递增,元素的最高正化合价递增(从+1价到+7价),第一周期除外,第二周期的O、F元素除外;
最低负化合价递增(从-4价到-1价)第一周期除外,由于金属元素一般无负化合价,故从ⅣA族开始.
三、元素的金属性和非金属性
同一周期中,从左到右,随着原子序数的递增,元素的金属性递减,非金属性递增;
同一族中,从上到下,随着原子序数的递增,元素的金属性递增,非金属性递减;
四、单质及简单离子的氧化性与还原性
同一周期中,从左到右,随着原子序数的递增,单质的氧化性增强,还原性减弱;所对应的简单阴离子的还原性减弱,简单阳离子的氧化性增强.
同一族中,从上到下,随着原子序数的递增,单质的氧化性减弱,还原性增强;所对应的简单阴离子的还原性增强,简单阳离子的氧化性减弱.
元素单质的还原性越强,金属性就越强;单质氧化性越强,非金属性就越强.
五、最高价氧化物所对应的水化物的酸碱性
同一周期中,元素最高价氧化物所对应的水化物的酸性增强(碱性减弱);
同一族中,元素最高价氧化物所对应的水化物的碱性增强(酸性减弱).
六、单质与氢气化合的难易程度
同一周期中,从左到右,随着原子序数的递增,单质与氢气化合越容易;
同一族中,从上到下,随着原子序数的递增,单质与氢气化合越难.
七、气态氢化物的稳定性
同一周期中,从左到右,随着原子序数的递增,元素气态氢化物的稳定性增强;
同一族中,从上到下,随着原子序数的递增,元素气态氢化物的稳定性减弱.
此外还有一些对元素金属性、非金属性的判断依据,可以作为元素周期律的补充:
随着从左到右价层轨道由空到满的逐渐变化,元素也由主要显金属性向主要显非金属性逐渐变化.
随同一族元素中,由于周期越高,价电子的能量就越高,就越容易失去,因此排在下面的元素一般比上面的元素更具有金属性.
元素的最高价氢氧化物的碱性越强,元素金属性就越强;最高价氢氧化物的酸性越强,元素非金属性就越强.
元素的气态氢化物越稳定,非金属性越强.
同一族的元素性质相近.
具有同样价电子构型的原子,理论上得或失电子的趋势是相同的,这就是同一族元素性质相近的原因.
以上规律不适用于稀有气体.
还有一些根据元素周期律得出的结论:
元素的金属性越强,其第一电离能就越小;非金属性越强,其第一电子亲和能就越大.
同一周期元素中,轨道越“空”的元素越容易失去电子,轨道越“满”的越容易得电子.
[编辑本段]【元素周期律的意义】
元素周期律是自然科学的基本规律,也是无机化学的基础.各种元素形成有周期性规律的体系,成为元素周期系,元素周期表则是元素周期系的表现形式.
元素周期表是学习和研究化学的一种重要工具.元素周期表是元素周期律的具体表现形式,它反映了元素之间的内在联系,是对元素的一种很好的自然分类.我们可以利用元素的性质、它在周期表中的位置和它的原子结构三者之间的密切关系来指导我们对化学的学习研究.
过去,门捷列夫曾用元素周期律来预言未知元素并获得了证实.此后,人们在元素周期律和周期表的指导下,对元素的性质进行了系统的研究,对物质结构理论的发展起了一定的推动作用.不仅如此,元素周期律和周期表为新元素的发现及预测它们的原子结构和性质提供了线索.
元素周期律和周期表对于工农业生产也有一定的指导作用.由于在周期表中位置靠近的元素性质相近,这样就启发了人们在周期表中一定的区域内寻找新的物质.
元素周期律的重要意义,还在于它从自然科学方面有利地论证了事物变化中量变引起质变的规律性.
元素周期律和周期表,揭示了元素之间的内在联系,反映了元素性质与它的原子结构的关系,在哲学、自然科学、生产实践各方面,都有重要意义.1年前查看全部
- 19世纪中叶,俄国化学家门捷列夫对化学这一学科的巨大贡献是( )
19世纪中叶,俄国化学家门捷列夫对化学这一学科的巨大贡献是( )
A. 提出了原子学说
B. 发现了元素周期律
C. 提出了分子学说
D. 发现了新的元素 sg_wyl1年前4
sg_wyl1年前4 -
 atonomy 共回答了20个问题
atonomy 共回答了20个问题 |采纳率85%解题思路:1869年,俄国化学家门捷列夫发现了元素周期律,并编制出元素周期表,使得化学学习和研究变得有规律可循.A.道尔顿提出了近代原子学说,故A错误;
B.1869年,俄国化学家门捷列夫发现了元素周期律,故B正确;
C.阿佛加德罗提出了分子学说,故C错误;
D.俄国化学家门捷列对已发现的元素进行研究,未发现了新的元素,故D错误.
故选B.点评:
本题考点: 化学史.
考点点评: 本题主要考查了化学史,难度不大.了解化学的发展史,有利于激发学生学习化学的兴趣,培养社会责任感.1年前查看全部
- 门捷列夫的化学原理讲的是什么
 猪头猪脑猪尾巴11年前1
猪头猪脑猪尾巴11年前1 -
 哭泣的秋天 共回答了20个问题
哭泣的秋天 共回答了20个问题 |采纳率90%门捷列夫
俄罗斯化学家门捷列夫(1834~1907),生在西伯利亚.他从小热爱劳动,喜爱大自然,学习勤奋.
1860年门捷列夫在为著作《化学原理》一书考虑写作计划时,深为无机化学的缺乏系统性所困扰.于是,他开始搜集每一个已知元素的性质资料和有关数据,把前人在实践中所得成果,凡能找到的都收集在一起.人类关于元素问题的长期实践和认识活动,为他提供了丰富的材料.他在研究前人所得成果的基础上,发现一些元素除有特性之外还有共性.例如,已知卤素元素的氟、氯、溴、碘,都具有相似的性质;碱金属元素锂、钠、钾暴露在空气中时,都很快就被氧化,因此都是只能以化合物形式存在于自然界中;有的金属例铜、银、金都能长久保持在空气中而不被腐蚀,正因为如此它们被称为贵金属.
于是,门捷列夫开始试着排列这些元素.他把每个元素都建立了一张长方形纸板卡片.在每一块长方形纸板上写上了元素符号、原子量、元素性质及其化合物.然后把它们钉在实验室的墙上排了又排.经过了一系列的排队以后,他发现了元素化学性质的规律性.
因此,当有人将门捷列夫对元素周期律的发现看得很简单,轻松地说他是用玩扑克牌的方法得到这一伟大发现的,门捷列夫却认真地回答说,从他立志从事这项探索工作起,一直花了大约20年的功夫,才终于在1869年发表了元素周期律.他把化学元素从杂乱无章的迷宫中分门别类地理出了一个头绪.此外,因为他具有很大的勇气和信心,不怕名家指责,不怕嘲讽,勇于实践,敢于宣传自己的观点,终于得到了广泛的承认.1年前查看全部
- 拉瓦锡 道尔顿 门捷列夫 到底哪个才是近代化学之父啊!
 haiguitiancai1年前6
haiguitiancai1年前6 -
 东海草 共回答了11个问题
东海草 共回答了11个问题 |采纳率72.7%道尔顿既具有敏锐的理论思维头脑,又具有卓越的实验才能,尤其是在对原子的研究方面取得了非凡的成果,因而被称为“近代化学之父”,成为近代化学的奠基人.1年前查看全部
- 仔细阅读下列材料。材料一:1869年,俄国化学家门捷列夫对已发现的元素进行研究,制作了元素周期表(右表是其片段),并在他
仔细阅读下列材料。
材料一:1869年,俄国化学家门捷列夫对已发现的元素进行研究,制作了元素周期表(右表是其片段),并在他的元素周期表中留下了许多空位代表尚未发现的新元素,其中就预言了“类铝”这种新元素。
材料二:1875年,法国化学家布瓦博德朗公布类铝他发现的新元素镓(元素符号Ga)X的性质;镓是银白色金属,密度4.7g/cm3,能与沸水剧烈反应生成氢气和氢氧化镓。不久,他收到门捷列夫的来信称:镓就是我预言的“类铝”,其密度应在5.9g/cm3~6.0g/cm3之间。
材料三:1876年,布瓦博德朗将金属镓提纯后测得镓的密度为5.94g/com3,从而验证了元素周期表的正确性。随后科学家根据元素周期表的空位,按图索骥,发现了许多新元素。目前金属镓广泛用于制造半导体材料。镓的原子结构示意图如右,常见化合价为-3。
请回答下列问题:
(1)镓元素原子的质子数为__________________,其原子最外层电子数为_____________;
(2)请根据上述材料,总结金属镓的有关知识:
物理性质:_________________________________________-;
化学性质(请用化学方程式表示):;
用途:___________________________________________________________。
(3)氢氧化镓与氢氧化钾都具有碱的性质,则氢氧化镓与稀硫酸反应生成盐的化学式为
。 jxhsh1年前1
jxhsh1年前1 -
 goodtolove 共回答了25个问题
goodtolove 共回答了25个问题 |采纳率80%(1)31 3
(2)物理性质:银白色金属,密度为5.94g/com3
化学性质:2Ga+6H20 2Ga(OH)3+3H2↑
2Ga(OH)3+3H2↑
用途:制造半导体材料
(3)Ga2(SO4)3
分析:(1)根据在原子中,质子数=核外电子数,进行解答;
离原子核最远的是最外层,依据原子结构示意图即可解答;
(2)物质的色、味、态、熔、沸点、密度、硬度、水溶性等属于物理性质;物质的化学性质包括可燃性、氧化性、还原性、稳定性、酸性、碱性、热解性等,通常描述的语句中有能、可以、可等字眼儿进行解答;
(3)由于镓常见化合价为+3,硫酸根的根价为-2,利用十字交叉法即可写出化学式.
(1)根据在原子中,质子数=核外电子数,由原子结构示意图可知镓元素原子的质子数为:31;
最外层电子数为:3;
(2)根据物质的色、味、态、熔、沸点、密度、硬度、水溶性等属于物理性质,从题中可知
镓的物理性质为:镓是银白色金属,密度为5.94g?cm -3 ;
根据镓能与沸水剧烈反应生成氢气和氢氧化镓反应化学方程式为:2Ga+6H 2 O 2Ga(OH) 3 +3H 2 ↑;
2Ga(OH) 3 +3H 2 ↑;
根据目前金属镓广泛用于制造半导体材料,可知镓的用途为:制造半导体材料;
故答案为:银白色金属,密度为5.94g?cm -3 ; 2Ga+6H 2 O 2Ga(OH) 3 +3H 2 ↑; 制造半导体材料;
2Ga(OH) 3 +3H 2 ↑; 制造半导体材料;
(3)由于镓常见化合价为+3,硫酸根的根价为-2,利用十字交叉法写出硫酸镓的化学式为:Ga 2 (SO 4 ) 3 ;
故答案为:Ga 2 (SO 4 ) 3 .1年前查看全部
- 求元素周期表其他的排列方法就是除了门捷列夫的那种方法以外的排列方法,要好画的,
 oracle_qi1年前1
oracle_qi1年前1 -
 wangbin11 共回答了26个问题
wangbin11 共回答了26个问题 |采纳率96.2%就是不要用s、p、d、f、g等的排列方式,比如:可以用纯粹价电子的排布方法:
从左边顶格开始,以价电子的数目来自1~8依次排列.
这种排法可以帮助判断主要化合价和电离能大小,但是对于ds区过渡金属会比较麻烦.所以,仅作参考吧!1年前查看全部
- 俄国化学家门捷列夫在总结前人经验的基础上,通过艰辛的努力,终于提出了现代元素周期表的雏形.下表为元素周期表的部分示意图1
俄国化学家门捷列夫在总结前人经验的基础上,通过艰辛的努力,终于提出了现代元素周期表的雏形.下表为元素周期表的部分示意图1,请利用下表回答相关问题.

(1)用符号表示:带两个单位负电荷且质子数为8的离子______.
(2)我发现如下规律:
①在化学反应中,第1纵行的元素比较容易______电子(除H外);第7纵行的元素比较容易______电子,可见元素的化学性质主要决定于原子的______数.
②从原子结构方面看:同一横行的元素具有相同的______数;同一纵行的元素具有相同______数.
(3)图2甲是两种元素在周期表中的信息,图2乙是氟原子的原子结构示意图.请完成下列问题:
①图2甲方框的横线上填的是______,图2乙方框横线上的数字是______;
②图2甲所示两种元素形成化合物的化学式为______. serap123451年前1
serap123451年前1 -
 当缘分不在 共回答了13个问题
当缘分不在 共回答了13个问题 |采纳率84.6%解题思路:(1)根据质子数判断元素为O,据此可写出该元素的离子;
(2)①根据原子结构示意图和金属元素的原子最外层电子数一般少于4个,非金属元素的原子最外层电子数一般多于4个;金属元素在化学反应中易失去电子,非金属元素在化学反应中易得到电子,元素的化学性质与最外层电子数有关,进行解答;②根据原子结构示意图进行分析解答本题;
(3)①根据元素名称写出元素符号即可;根据在原子中,原子序数=质子数=核外电子数,进行解答;②根据化合价利用十字交叉法写出化学式即可.(1)根据质子数判断元素为O,带两个单位负电荷,由此可知该离子为:O2-,故答案为:O2-;
(2)①根据原子结构示意图和金属元素的原子最外层电子数一般少于4个,非金属元素的原子最外层电子数一般多于4个;金属元素在化学反应中易失去电子,非金属元素在化学反应中易得到电子,元素的化学性质与最外层电子数有关;故答案为:失;得;最外层电子;
②根据原子结构示意图分析可知:同一横行的元素具有相同的电子层数;同一纵行的元素具有相同的最外层电子数;故答案为:电子层;最外层电子;
(3)①根据元素名称写出元素符号为Ca;根据在原子中,原子序数=质子数=核外电子数,乙中的最外层电子数为7;②根据化合价利用十字交叉法,两种元素形成化合物的化学式为:CaF2;故答案为:Ca;7;CaF2.点评:
本题考点: 元素周期表的特点及其应用;原子结构示意图与离子结构示意图;化学式的书写及意义.
考点点评: 本题考查学生根据原子结构示意图分析总结元素周期律及对元素的性质与最外层电子数的关系的理解与掌握,并能在解题中灵活应用.1年前查看全部
- 俄国化学家门捷列夫在总结前人经验的基础上,通过艰辛的努力,终于提出了现代元素周期表雏形,如图为元素周期表的部分元素的相关
俄国化学家门捷列夫在总结前人经验的基础上,通过艰辛的努力,终于提出了现代元素周期表雏形,如图为元素周期表的部分元素的相关信息,利用如图回答相关问题
(1)16号元素的原子在化学反应中比较容易______(填“得到”或“失去”)电子变成离子;
(2)如图中11号元素与地壳中含量最多的元素组成的化合物的化学式是______
(3)如图中17号元素原子的化学性质与图中______号元素的原子化学性质相似
(4)从原子结构方面看,同一横行的元素具有相同的______,同一纵行的元素具有相同的______. fengcan11年前1
fengcan11年前1 -
 一段老哑木 共回答了18个问题
一段老哑木 共回答了18个问题 |采纳率100%解题思路:(1)根据原子结构示意图的各部分的意义分析解答;
(2)周期表中最活泼金属元素在右下角位置,地壳中含量最多的元素是氧;由化合价书写化学式;
(3)根据最外层电子数相同化学性质相似来回答;
(4)根据原子结构示意图进行分析解答本题.(1)根据原子结构示意图,16号元素的最外层有6个电子,易得到两个成为8电子稳定结构.
(2)周期表中从左到右金属的活泼性逐渐减弱,从上到下,金属的活泼性逐渐增强,所以最活泼金属元素在右下角位置,应为钠,地壳中含量最多的元素是氧,二者可以形成氧化钠;钠的化合价为+1,氧的化合价为-2,故为Na2O;
(3)根据最外层电子数相同化学性质相似,17号元素原子的最外层有7个电子与9号元素氟的化学性质相似;
(4)根据原子结构示意图分析可知:同一横行的元素具有相同的电子层数;同一纵行的元素具有相同的最外层电子数;同一周期中最外层电子数1到8依次增大等;
故答案为:(1)得到;(2)Na2O;(3)9;
(4)电子层;最外层电子.点评:
本题考点: 元素周期表的特点及其应用;原子结构示意图与离子结构示意图.
考点点评: 本题考查学生根据原子结构示意图分析总结元素周期律及对元素的性质与最外层电子数的关系的理解与掌握,并能在解题中灵活应用.1年前查看全部
- 19世纪中叶,俄国化学家门捷列夫对化学学科的巨大贡献是( ) A.提出了原子学说 B.提出了元素周期律 C.提出了分子
19世纪中叶,俄国化学家门捷列夫对化学学科的巨大贡献是( ) A.提出了原子学说 B.提出了元素周期律 C.提出了分子学说 D.制定了科学的元素周期表  魔鬼的ll1年前1
魔鬼的ll1年前1 -
 CryingJoker 共回答了15个问题
CryingJoker 共回答了15个问题 |采纳率80%A.道尔顿提出了近代原子学说,故A错误;
B.1869年,俄国化学家门捷列夫发现了元素周期律,故B正确;
C.阿佛加德罗提出了分子学说,故C错误;
D.1869年,俄国化学家门捷列夫发现了元素周期律,并编制出元素周期表,故D正确.
故选BD.1年前查看全部
- 门捷列夫短元素周期表什么样?与维尔纳式长周期表有什么不同?还有哪些形式的周期表?
 牛李想1年前0
牛李想1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 门捷列夫除了绘制元素周期表,还有什么成就
 2007进ss1年前1
2007进ss1年前1 -
 云开远见 共回答了21个问题
云开远见 共回答了21个问题 |采纳率85.7%1860年门捷列夫在为著作《化学原理》一书考虑写作计划时,深为无机化学的缺乏系统性所困扰.于是,他开始搜集每一个已知元素的性质资料和有关数据,把前人在实践中所得成果,凡能找到的都收集在一起.人类关于元素问题的长期实践和认识活动,为他提供了丰富的材料.他在研究前人所得成果的基础上,发现一些元素除有特性之外还有共性.例如,已知卤素元素的氟、氯、溴、碘,都具有相似的性质;碱金属元素锂、钠、钾暴露在空气中时,都很快就被氧化,因此都是只能以化合物形式存在于自然界中;有的金属例铜、银、金都能长久保持在空气中而不被腐蚀,正因为如此它们被称为贵金属.
于是,门捷列夫开始试着排列这些元素.他把每个元素都建立了一张长方形纸板卡片.在每一块长方形纸板上写上了元素符号、原子量、元素性质及其化合物.然后把它们钉在实验室的墙上排了又排.经过了一系列的排队以后,他发现了元素化学性质的规律性.
因此,当有人将门捷列夫对元素周期律的发现看得很简单,轻松地说他是用玩扑克牌的方法得到这一伟大发现的,门捷列夫却认真地回答说,从他立志从事这项探索工作起,一直花了大约20年的功夫,才终于在1869年发表了元素周期律.他把化学元素从杂乱无章的迷宫中分门别类地理出了一个头绪.此外,因为他具有很大的勇气和信心,不怕名家指责,不怕嘲讽,勇于实践,敢于宣传自己的观点,终于得到了广泛的承认.为了纪念他的成就,人们将美国化学家希伯格在1955年发现的第101号新元素命名为Mendelevium,即“钔”.1年前查看全部
大家在问
- 1在已经平衡的醋酸中 加入冰醋酸 电离常数为什么会下降
- 2椭圆的第二定义(有图像说明)?
- 3千淘万漉虽辛苦,吹尽狂沙始到金体现了什么哲学观点
- 4千淘万漉虽辛苦,吹尽狂沙始到金的解释
- 5我真的很在乎你用 (英语)
- 6有关 山水作文开头形容中国的山水
- 7快速背诵元素周期表
- 8做凸透镜成像的实验中所需要的实验器材有哪些?
- 9在探究凸透镜成像规律的实验中 实验前必须将()()和()调节在()上
- 10赞扬老师的作文,开头和结尾
- 11射出去的箭能向前飞行,是由于受到一个向前的冲力作用对吗
- 12海浪为什么有向前的冲力海浪是一种波,波是由质点震动形成.海浪应该是一种纵波,应该是海水质点上下震动形成,那为什么会感觉海
- 13电解熔融氧化铝为什么铝在下层
- 14傅雷家书课后题答案快啊,急用
- 15傅雷家书的有哲理的句子20句要写出句子出自哪封信.就是几几年几月几日写的复制一大堆的不要
