富马酸亚铁中C、H、Fe、O的原子个数比为多少?又有几种元素?急,知道的请马上回复,
 uggw12022-10-04 11:39:541条回答
uggw12022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 lovemedown 共回答了13个问题
lovemedown 共回答了13个问题 |采纳率84.6%- 富马酸亚铁 :C4H2FeO4
C、H、Fe、O的原子个数比为4:2:1:4
含有4种元素,分别是碳、氢、铁、氧 - 1年前
相关推荐
- 富马酸亚铁中c丶h丶fe丶o质量比
 谦E君1年前2
谦E君1年前2 -
 seekyou929 共回答了16个问题
seekyou929 共回答了16个问题 |采纳率93.8%富马酸亚铁 :C4H2FeO4
C、H、Fe、O的原子个数比为4:2:1:4
含有4种元素,分别是碳、氢、铁、氧1年前查看全部
- 富马酸亚铁中砷盐的检查加入无水碳酸钠和酸性氯化亚锡的作用分别是什么?
 gancai1年前1
gancai1年前1 -
 为你我披上mm 共回答了19个问题
为你我披上mm 共回答了19个问题 |采纳率89.5%古蔡法检查砷盐是样品经消化后,以碘化钾、氯化亚锡将高价砷还原为三价砷然后注入l000毫升不含二氧化碳的水中,混匀. 14、1N硫酸溶液.四、操作方法:1年前查看全部
- (2011•南京一模)富马酸亚铁(分子式C4H2O4Fe,结构简式
(2011•南京一模)富马酸亚铁(分子式C4H2O4Fe,结构简式
 是一种可限量使用的铁强化剂
是一种可限量使用的铁强化剂
(1)如图为实验室模拟工业制取富马酸亚铁的流程图: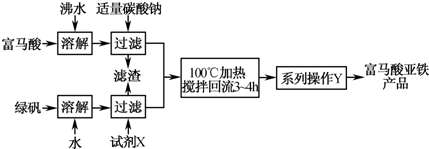
①绿矾(FeSO4•7H20)在保存过程中形成的杂质主要有______(填写化学式).
②操作Y包括______冷却结晶、过滤、洗涤、干燥等.
③判断操作Y中“洗涤”富马酸亚铁产品已洗净的实验方法是______.
(2)设计一个实验方案,证明所得富马酸亚铁产品属于亚铁盐(可供选用的试剂有:KSCN溶液、KMn04溶液、稀硫酸.已知SCN一能被MnO4-氧化).填写下表相应空格:
步骤 实验操作与现象 ① 取富马酸亚铁产品l.5g,加入稀硫酸25mL,用水稀释至50ml,加热使其完全溶解并反应,冷却后过滤(除去生成的富马酸及可能过量的反应物),保存滤液. ② ______ ③ ______ ④ ______  天子挟1年前1
天子挟1年前1 -
 留德狠 共回答了19个问题
留德狠 共回答了19个问题 |采纳率100%解题思路:(1)①根据亚铁离子容易被氧化成三价铁离子及铁离子的水解进行分析;
②得到的含有富马酸亚铁的溶液需要经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作,最后得到富马酸亚铁产品;
③富马酸亚铁表面的可溶性杂质离子有Na+、SO42-等,可以从检验洗涤液中是否含Na+或SO42-来设计实验;
(2)②先滴加硫氰化钾检验溶液中不存在三价铁离子;
③加入氧化剂将亚铁离子氧化成三价铁离子;
④再加入硫氰化钾溶液,溶液变成红色,证明原溶液中存在亚铁离子.(1)①由于亚铁离子不稳定,容易被氧化成三价铁离子,铁离子在溶液中会发生水解,生成氢氧化铁,所以绿矾(FeSO4•7H20)在保存过程中形成的杂质主要有硫酸铁、氢氧化铁等杂质,
故答案为:Fe2(SO4)3、Fe(OH)3等(其他合理答案均可);
②得到的含有富马酸亚铁的溶液需要经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作,最后得到富马酸亚铁产品,
故答案为:蒸发浓缩;
③富马酸亚铁表面的可溶性杂质离子有Na+、SO42-等,可以从检验洗涤液中是否含Na+或SO42-来设计实验.所以检验方法是:取最后一次洗涤液,先加入稀盐酸,再加入氯化钡溶液,无白色沉淀生成,说明已洗涤干净.
故答案为:取最后洗涤液,向其中加入少量盐酸酸化的氯化钡溶液,无白色沉淀(其他合理答案均可);
(2)检验亚铁离子的方法,
②滴加硫氰化钾溶液,溶液没有变成红色,证明溶液中没有三价铁离子;
③然后加入氧化剂高锰酸钾溶液将亚铁离子氧化成三价铁离子;
④再加入硫氰化钾溶液,溶液变成红色,证明原溶液中存在亚铁离子,
故答案为:
② 取少量滤液,滴加KSCN溶液,不显红色
③ 取酸性高锰酸钾溶液适量,向其中滴加滤液至溶液褪色
④ 取上述褪色后的溶液,滴加KSCN溶液显红色(其他合理答案均可).点评:
本题考点: 制备实验方案的设计.
考点点评: 本题考查了实验室模拟工业制取富马酸亚铁方法,涉及了亚铁离子的检验知识考查,注意合理分析题中信息,本题难度中等.1年前查看全部
- 下图是某品牌补铁剂的标签.(1)富马酸亚铁 C4H2FeO4中含有______种元素,C、H、Fe、O原子个数
 下图是某品牌补铁剂的标签.
下图是某品牌补铁剂的标签.
(1)富马酸亚铁 C4H2FeO4中含有______种元素,C、H、Fe、O原子个数比为______.
(2)富马酸亚铁的相对分子质量为______.
(3)中各元素的质量比C:H:Fe:O=______. djhly0161061年前1
djhly0161061年前1 -
 我想当小资 共回答了19个问题
我想当小资 共回答了19个问题 |采纳率89.5%解题思路:(1)由富马酸亚铁的化学式C4H2FeO4可知它是由几种元素组成和C、H、Fe、O原子个数比;
(2)根据相对分子质量为组成分子的各原子的相对原子质量之和,进行分析解答.
(3)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.(1)由富马酸亚铁的化学式C4H2FeO4可知,它是由C、H、Fe、O这四种元素组成,C、H、Fe、O原子个数比为4:2:1:4;
(2)富马酸亚铁的相对分子质量为12×4+1×2+56+16×4=170.
(3)富马酸亚铁中碳、氢、铁、氧四种元素的质量比为(12×4):(1×2):(56×1):(16×4)=24:1:28:32.
故答案为:(1)四;4:2:1:4;(2)170;(3)24:1:28:32.点评:
本题考点: 化学式的书写及意义;相对分子质量的概念及其计算;元素质量比的计算.
考点点评: 本题难度不大,考查同学们结合新信息、灵活运用化学式的有关计算进行分析问题、解决问题的能力.1年前查看全部
- (2014•黄浦区三模)如图是某品牌补铁剂的标签.请回答:富马酸亚铁有______种元素组成,其摩尔质量为______.
 (2014•黄浦区三模)如图是某品牌补铁剂的标签.请回答:富马酸亚铁有______种元素组成,其摩尔质量为______.若该物质含0.1mol氢原子,则分子个数是______个.
(2014•黄浦区三模)如图是某品牌补铁剂的标签.请回答:富马酸亚铁有______种元素组成,其摩尔质量为______.若该物质含0.1mol氢原子,则分子个数是______个.  陇中H老农1年前1
陇中H老农1年前1 -
 mm不是伊拉克 共回答了20个问题
mm不是伊拉克 共回答了20个问题 |采纳率100%解题思路:根据物质的化学式来分析其组成元素的种类,摩尔质量与其相对分子质量有关,根据物质的分子构成情况来分析0.1mol该物质中所含氢原子个数.由富马酸亚铁的化学式C4H2FeO4可知:它是由四种元素组成的;C4H2FeO4的相对分子质量是170,故其摩尔质量是170g/mol,1mol任何物质中含有6.02×1023个分子,一个富马酸亚铁分子含有2个氢原子,故,0.05mol富马酸亚铁分子中有0.1mol氢原子.0.05mol富马酸亚铁中含有:0.05mol×6.02×1023=3.01×1022个
富马酸亚铁分子.
故答案为:4;170g/mol;3.01×1022.点评:
本题考点: 化学式的书写及意义;有关化学式的计算和推断.
考点点评: 本题难度不大,考查同学们结合新信息、灵活运用化学式的有关计算进行分析问题、解决问题的能力.1年前查看全部
- (2008•潮州二模)富马酸亚铁FeH2C4O4,商品名富血铁,含铁量高,是治疗缺铁性贫血常见的药物.某校研究性学习小组
(2008•潮州二模)富马酸亚铁FeH2C4O4,商品名富血铁,含铁量高,是治疗缺铁性贫血常见的药物.某校研究性学习小组通过查阅大量资料后,决定自行制备富血铁并检测其含铁量.
富马酸(HOOC-CH=CH-COOH)的性质:
Fe2+的性质:分子式 相对分子质量 溶解度和溶解性 酸性 H4C4O4 116 在水中:0.7g(25℃)、9.8g(97.5℃).
盐酸中:可溶.二元酸,且0.1mol/L H4C4O4的pH=2.
Ⅰ、富马酸亚铁的制备开始沉淀时的pH 完全沉淀时的pH 7.6 9.6
①将适量的富马酸置于100mL烧杯中,加水20mL在热沸搅拌下,加入Na2CO3溶液10mL,使其pH为6.5~6.7;
②将上述溶液转移至100mL圆底烧瓶中,装好回流装置,加热至沸;
③缓慢加入新制的FeSO4溶液30mL,维持温度100℃,充分搅拌1.5小时.
④冷却、过滤,洗涤沉淀,然后水浴干燥,得到棕色粉末.
试回答:
步骤①中加入Na2CO3,反应的离子方程式______(富马酸及其酸根用化学式表示).
步骤①中反应后控制溶液pH为6.5~6.7;若反应后溶液的pH太小,则引起的后果是______.若反应后溶液的pH太大则引起的后果是______.
Ⅱ、产品纯度测定
准确称取富血铁0.3200g,加煮沸过的3mol/LH2SO4溶液15mL,待样品完全溶解后,加煮沸过的冷水50mL和4滴邻二氮菲-亚铁指示剂,立即用(NH4)2Ce(SO4)3(硫酸高铈铵)0.1000mol/L标准溶液进行滴定.直至溶液刚好变为浅蓝色即为终点.测得其体积为18.50mL,计算样品中富血铁的质量分数,写出计算过程.(Fe2++Ce4+═Fe3++Ce3+)n(FeH2C4O4)=n(Ce4+)=0.1000mol/L×0.01850L=0.001850mol,
m(FeH2C4O4)=0.001850mol×170g/mol=0.3145g,
w(FeH2C4O4)=[0.3145g/0.3200g]×100%=98.28%n(FeH2C4O4)=n(Ce4+)=0.1000mol/L×0.01850L=0.001850mol,.
m(FeH2C4O4)=0.001850mol×170g/mol=0.3145g,
w(FeH2C4O4)=[0.3145g/0.3200g]×100%=98.28% 我是鄂人1年前1
我是鄂人1年前1 -
 dd7355 共回答了11个问题
dd7355 共回答了11个问题 |采纳率81.8%解题思路:Ⅰ、根据制备流程可知,富马酸的酸性大于碳酸,富马酸与碳酸钠反应生成H2C4O42-和二氧化碳气体,据此写出反应的离子方程式;若pH太小,富马酸与碳酸钠反应生成的H2C4O42-的浓度过低;若反应后溶液的pH太大,亚铁离子与氢氧根离子反应生成氢氧化亚铁,氢氧化亚铁进一步反应生成氢氧化铁,导致降低了富马酸亚铁的产率;
Ⅱ、先计算出消耗的Ce4+离子的物质的量,然后根据反应方程式计算出亚铁离子的物质的量、质量,最后计算出样品中富血铁的质量分数.Ⅰ、富马酸与碳酸钠反应生成富马酸钠和二氧化碳、水,反应的离子方程式为:H4C4O4+CO32-═H2C4O42-+CO2↑+H2O;反应后控制溶液pH为6.5~6.7,若反应后溶液的pH太小,反应生成的H2C4O42-的浓度过低,影响富马酸亚铁的制取;若反应后溶液的pH太大,亚铁离子能够与氢氧根离子反应生成氢氧化亚铁,而氢氧化亚铁进一步被氧化成氢氧化铁,影响富马酸亚铁的产率,
故答案为:H4C4O4+CO32-═H2C4O42-+CO2↑+H2O;H2C4O42-的浓度过低(或生成的阴离子含有H3C4O4-);Fe2+易转化为Fe(OH)2,并进一步被氧化为Fe(OH)3,从而降低富马酸亚铁的产率;
Ⅱ、滴定过程中消耗的Ce4+离子的物质的量为:n(Ce4+)=0.1000mol/L×0.01850L=0.001850mol,
根据反应方程式Fe2++Ce4+═Fe3++Ce3+可知:n(FeH2C4O4)=n(Ce4+)=0.001850mol,
富马酸亚铁的质量为:m(FeH2C4O4)=0.001850mol×170g/mol=0.3145g,
样品中富血铁的质量分数为:w(FeH2C4O4)=[0.3145g/0.3200g]×100%=98.28%,
故答案为:n(FeH2C4O4)=n(Ce4+)=0.1000mol/L×0.01850L=0.001850mol,
m(FeH2C4O4)=0.001850mol×170g/mol=0.3145g,
w(FeH2C4O4)=[0.3145g/0.3200g]×100%=98.28%.点评:
本题考点: 探究物质的组成或测量物质的含量.
考点点评: 本题考查了制取富马酸亚铁方法及测定富马酸亚铁样品中的质量分数,题目难度中等,注意掌握根据滴定原理计算样品纯度的方法,试题有利于培养学生的分析、理解能力.1年前查看全部
大家在问
- 1抽象代数证明:域E包含域F,L,M是E,F的中间域,L包含F是代数扩张.R={x...
- 2英语阅读帮帮忙啊In Spain in summer there are many villages with a lo
- 3由密度公式,密度等于质量比体积,可以得出体积等于---,从密度表中查出他的--测出物体的--就可知道体积
- 4(2008•邵阳)乞拉朋齐成为世界“雨极”的主要原因是( )
- 5m的平方-n的平方等于6 m-n=2 求m+n等于?
- 6行旅诗有哪些?求学霸指点
- 7木工师傅要把一块长2.4米,宽1米的三合板割成规格为底60厘米,高40厘米的直角三角形板,最多能分割成______块这样
- 8英语翻译i think i grow tensionslike flowers in a wood where nobo
- 9如图,平行四边形ABCD中,AC、BD相交于O点,M、N分别是OA、OC的中点,求证:BM∥DN且BM=DN.
- 10某化肥包装上的标签如图所示.请你通过计算,判断图这则广告的真实性.
- 11叶怎样为人类提供食物和能源急
- 12two and five is s( ) 填空
- 13两个数之和比一个加数大30,比另一个加数大63.这两个加数的和与差各是多少
- 14我这几天几乎抽不出时间,翻译成英语
- 15一列火车每隔四分钟显示一次到站信息并持续一分钟,求一个人到车站刚好显示到站信息的概率
