(2013•东河区二模)青藏地区发展河谷农业的主要自然原因是( )
 lanmail2022-10-04 11:39:541条回答
lanmail2022-10-04 11:39:541条回答A.纬度因素
B.地形因素
C.海陆因素
D.经济因素

已提交,审核后显示!提交回复
共1条回复
 小B路过 共回答了16个问题
小B路过 共回答了16个问题 |采纳率93.8%- 解题思路:青藏地区由于海拔较高,气温较低,其牧草矮小,畜牧能力较低,并且不利于农作物的生长,农业主要分布在海拔较低,气温较高的河谷地带.
青藏高原气候高寒,只有河谷地带由于地势较低,气温较高,无霜期长,土壤比较肥沃,又有河水作为灌溉水源,因而适宜耕作,成为农业发达地带,被称为河谷农业,主要分布在青藏高原地区,以青海的湟水谷地、西藏的雅鲁藏布江谷地也就是藏南谷地最典型.
故选:B.点评:
本题考点: 青藏河谷农业和高原牧业的特点.
考点点评: 了解青藏高原地区的自然特征,是解题的关键. - 1年前
相关推荐
- (2013•东河区一模)进入21世纪,全球拥有的化合物已超过2000万种,其中部分物质由碳、氢、氧、钠、氯中某些元素组成
(2013•东河区一模)进入21世纪,全球拥有的化合物已超过2000万种,其中部分物质由碳、氢、氧、钠、氯中某些元素组成,请用上述元素,按要求各写出一种常见物质的化学式:
①用于高炉炼铁的氧化物是______;②可用于舞台人工云雾的一种氧化物是______;
③厨房中常用的调味品是______;④“西气东输”工程中输送的有机物是______. 阿湖GOGO1年前1
阿湖GOGO1年前1 -
 wufwufwuf 共回答了22个问题
wufwufwuf 共回答了22个问题 |采纳率81.8%解题思路:首先根据题意确定物质的化学名称,然后根据题目所提供的元素、书写化学式的方法和步骤写出物质的化学式即可.①一氧化碳具有还原性,是用于高炉炼铁的氧化物,其化学式为:CO.
②干冰(固体的二氧化碳)升华时吸收大量的热,是可用于舞台人工云雾的一种氧化物,其化学式为:CO2.
③氯化钠是厨房中常用的调味品,其化学式为:NaCl.
④“西气东输”工程中输送的有机物是甲烷,其化学式为:CH4.
故答案为:①CO;②CO2;③NaCl;④CH4.点评:
本题考点: 化学式的书写及意义.
考点点评: 本题难度不大,熟练掌握常见物质的性质、用途、组成及化学式的书写是正确解答此类题的关键所在;解题时应注意只能从给出的元素中选择来组成物质.1年前查看全部
- (2013•东河区二模) 读“中国政区图”回答下列问题.
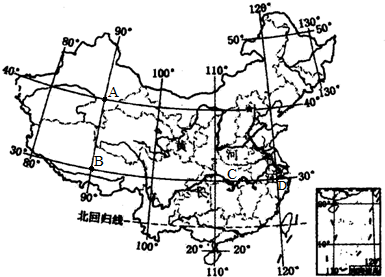 (2013•东河区二模) 读“中国政区图”回答下列问题.
(2013•东河区二模) 读“中国政区图”回答下列问题.
(1)某科考队从北京(40°N、116°E)出发,向西跨26个经度到达A点,此省区主要面临的生态问题是______,从A出发向南跨10个纬度到达B点,B省区的自然环境特征是______,A、B两省农业以______为主,从B向东跨25个经度到C点,此省的简称是______,其所在的地形区是______,所属的温度带是______.
(2)从C点出发向东跨5个经度到达D点,D点附近有我国最大的综合性工业基地是______,分析其工业发达的主要原因______.
(3)历史上黄河下游经常决口泛滥,建国后,对黄河进行了综合治理,确保两岸人民生命财产的安全,具体措施有______. 各有千秋1年前1
各有千秋1年前1 -
 1763 共回答了17个问题
1763 共回答了17个问题 |采纳率82.4%解题思路:读图可得,A是新疆维吾尔自治区,B是西藏自治区,C是湖北省,D是沪宁杭工业基地.(1)A省区即新疆维吾尔自治区主要面临的生态问题是土地荒漠化,从A出发向南跨10个纬度到达B点,B省区的自然环境特征是高寒,A、B两省农业以畜牧业为主,从B向东跨25个经度到C点即湖北省,此省的简称是鄂,其所在的地形区是长江中下游平原,所属的温度带是亚热带.
(2)从C点出发向东跨5个经度到达D点,D点附近有我国最大的综合性工业基地是沪宁杭工业基地,其工业发达的主要原因交通运输便利,有广阔的消费市场,工业基础雄厚.
(3)历史上黄河下游经常决口泛滥,建国后,对黄河进行了综合治理,确保两岸人民生命财产的安全,具体措施有 在上中游地区特别是黄土高原地区,植树种草,加强水土保持;在下游地区修筑堤坝,加固黄河大堤.
故答案为:
(1)土地荒漠化;高寒;畜牧业;鄂;长江中下游平原;亚热带;
(2)沪宁杭工业基地;交通运输便利,有广阔的消费市场,工业基础雄厚;
(3)在上中游地区特别是黄土高原地区,植树种草,加强水土保持;在下游地区修筑堤坝,加固黄河大堤.点评:
本题考点: 用经纬网确定方向和任意地点的位置;长江三角洲工业基地的位置和特点.
考点点评: 本题考查我国不同地区的相关知识点,熟记课本知识点解答即可.1年前查看全部
- (2013•东河区一模)请根据下列实验和溶解度曲线回答问题:(已知水的密度约为1g/cm3)
 (2013•东河区一模)请根据下列实验和溶解度曲线回答问题:(已知水的密度约为1g/cm3)
(2013•东河区一模)请根据下列实验和溶解度曲线回答问题:(已知水的密度约为1g/cm3)
(1)从图中溶解度曲线可以得到的信息是(写一条)______.实验操作 实验结果 取100mL水加入25g硝酸钾搅拌恢复至20℃ 全部溶解,得溶液① 再加Wg硝酸钾,搅拌,恢复至20℃ 恰好饱和,得溶液② 再加25g硝酸钾,搅拌,恢复至20℃ 得溶液③ 加热 全部溶解,得溶液④ 冷却至20℃ 析出晶体,得溶液⑤
(2)③中溶液的质量为______g;一定属于不饱和溶液的是______(填序号,下同);溶液中溶质的质量分数一定相等的是______. 璀璨星辰881年前1
璀璨星辰881年前1 -
 无辜的薄荷 共回答了18个问题
无辜的薄荷 共回答了18个问题 |采纳率94.4%解题思路:由物质的溶解度曲线,根据饱和溶液和不饱和溶液的判断方法,可以确定③中溶液的质量、变化后溶液是否饱和以及析出晶体的质量.(1)从图中可以看出,固体硝酸钾在20℃时的溶解度是31.6g、固体硝酸钾的溶解度随着温度的升高而增大等;
(2)20℃时,硝酸钾的溶解度为31.6g,故取100mL水,加入25g硝酸钾,搅拌,恢复至20°C,所得溶液①为不饱和溶液;
再加w g硝酸钾,搅拌,恢复至20°C,恰好饱和,所得溶液②,为饱和溶液;
再加25g硝酸钾,搅拌,恢复至20°C,硝酸钾不能继续溶解,故所得溶液③为饱和溶液,③中饱和溶液的质量为131.6g;
加热后,全部溶解,溶液④可能恰好饱和,也可能为不饱和溶液;
冷却至20°C,有晶体析出,故所得溶液⑤为饱和溶液;
故答案为:(1)固体硝酸钾在20℃时的溶解度是31.6g;
(2)131.6;①;②③⑤;(2)A.点评:
本题考点: 饱和溶液和不饱和溶液;固体溶解度曲线及其作用;溶质的质量分数、溶解性和溶解度的关系.
考点点评: 主要考查了对固体溶解度的概念的理解和固体溶解度曲线的意义,以此培养学生的理解能力、培养学生分析问题、解决问题的能力.1年前查看全部
- (2013•东河区一模)化学是一门以实验为基础的学科,化学所取得的丰硕成果,是与实验的重要作用分不开的,结合下列实验装置
(2013•东河区一模)化学是一门以实验为基础的学科,化学所取得的丰硕成果,是与实验的重要作用分不开的,结合下列实验装置图回答问题:

(1)写出图中带标号仪器的名称:①______ ②______.
(2)用A装置制取一种你熟悉的气体,该气体是______,反应的化学方程式是2KMnO4
K2MnO4+MnO2+O2↑△ .2KMnO4,检验该气体的方法是______;选择的收集装置是______.
K2MnO4+MnO2+O2↑△ .
(3)装置B虽然操作简便,但无法控制反应速率,请从图2中选取______(填序号)取代B中的单孔塞,以达到控制反应速率的目的. 鱼刺_刺鱼1年前1
鱼刺_刺鱼1年前1 -
 梅雨将去 共回答了20个问题
梅雨将去 共回答了20个问题 |采纳率85%解题思路:酒精灯是常用的加热仪器,长颈漏斗方便加液体药品;制取装置包括加热和不需加热两种,如果用双氧水制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集;高锰酸钾受热分解生成锰酸钾和二氧化锰和氧气,要注意配平; 氧气的检验方法是:将带火星的木条伸入集气瓶内,木条复燃,证明收集的气体是氧气.装置B虽然操作简便,但无法控制反应速率,请从图2中选取带注射器的橡皮塞,取代B中的单孔塞,以达到控制反应速率的目的.(1)酒精灯是常用的加热仪器,长颈漏斗方便加液体药品,故答案为:酒精灯;长颈漏斗;
(2)高锰酸钾受热分解生成锰酸钾和二氧化锰和氧气,要注意配平;氧气的检验方法是:将带火星的木条伸入集气瓶内,木条复燃,证明收集的气体是氧气;氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集;故答案为:氧气;2KMnO4
△
.
K2MnO4+MnO2+O2↑;将带火星的木条伸入集气瓶内,木条复燃,证明收集的气体是氧气;C或D;
(3)装置B虽然操作简便,但无法控制反应速率,请从图2中选取带注射器的橡皮塞,取代B中的单孔塞,以达到控制反应速率的目的;故答案为:Ⅲ点评:
本题考点: 常用气体的发生装置和收集装置与选取方法;实验室制取氧气的反应原理;氧气的检验和验满;书写化学方程式、文字表达式、电离方程式.
考点点评: 本考点主要考查了仪器的名称、气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.1年前查看全部
- (2013•东河区一模)在化合、分解、置换、复分解四类基本反应类型中,可能生成水的反应共有( )
(2013•东河区一模)在化合、分解、置换、复分解四类基本反应类型中,可能生成水的反应共有( )
A.一类
B.二类
C.三类
D.四类 糊涂妹妹1年前1
糊涂妹妹1年前1 -
 卡卡的ta 共回答了13个问题
卡卡的ta 共回答了13个问题 |采纳率92.3%解题思路:可以根据物质之间发生反应时生成物的组成情况进行分析、考虑,从而得出正确的结论.化合反应可以生成水.例如,氢气和氧气反应生成水.
分解反应可以生成水.例如,过氧化氢分解生成水和氧气.
置换反应可以生成水.例如,氧化铜和氢气反应生成铜和水.
复分解反应可以生成水.例如,盐酸和氢氧化钠反应生成氯化钠和水.
故选D点评:
本题考点: 反应类型的判定.
考点点评: 本题主要考查了四种基本反应类型方面的内容.1年前查看全部
- (2013•东河区一模)做化学实验时,不小心皮肤沾上了硝酸银溶液,过一段时间会出现黑色斑迹,很难洗去,这是因为硝酸银见光
(2013•东河区一模)做化学实验时,不小心皮肤沾上了硝酸银溶液,过一段时间会出现黑色斑迹,很难洗去,这是因为硝酸银见光分解生成一种金属、一种红棕色气体(NO2)和一种能供给呼吸的气体,请写出此反应的化学方程式2AgNO3
2Ag+2NO2↑+O2↑光 .2AgNO3.写出该反应中含氮元素物质的化学式并标出其中氮元素的化合价
2Ag+2NO2↑+O2↑光 .Ag
O3+5 N Ag、
O3+5 N
O2+4 N .
O2+4 N  新人1111年前1
新人1111年前1 -
 我在乎你的 共回答了15个问题
我在乎你的 共回答了15个问题 |采纳率86.7%解题思路:根据题意,硝酸银见光分解生成一种金属(银)、一种红棕色气体(NO2)和一种能供给呼吸的气体(氧气),写出反应的化学方程式即可;根据在化合物中正负化合价代数和为零,结合含氮物质的化学式、化合价的表示方法,在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,进行解答.硝酸银见光分解生成一种金属(银)、一种红棕色气体(NO2)和一种能供给呼吸的气体(氧气),反应的化学方程式为2AgNO3
光
.
2Ag+2NO2↑+O2↑;该反应符合“一变多”的特征,属于分解反应;
硝酸银中,银元素的化合价是+1价,氧元素的化合价是-2价,设氮元素的化合价是x,根据在化合物中正负化合价代数和为零,则氮元素的化合价为(+1)+x+(-2)×3=0,x=+5价;由化合价的表示方法,在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,故硝酸银中氮元素显+5价可表示为:Ag
+5
NO3.
二氧化氮中,氧元素的化合价是-2价,设氮元素的化合价是y,根据在化合物中正负化合价代数和为零,则氮元素的化合价为y+(-2)×2=0,y=+4价;由化合价的表示方法,在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,故二氧化氮中氮元素显+4价可表示为:
+4
NO2.
故答案为:2AgNO3
光
.
2Ag+2NO2↑+O2↑;Ag
+5
NO3;
+4
NO2.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式;有关元素化合价的计算.
考点点评: 本题难度不大,掌握化学方程式的书写方法、利用化合价的原则计算指定元素的化合价的方法及化合价的表示方法是正确解答本题的关键.1年前查看全部
- (2013•东河区一模)不用其他试剂,可以鉴别石蕊、盐酸、氢氧化钙、氢氧化钠、碳酸钠五种溶液,第三个被鉴别出来的物质是_
(2013•东河区一模)不用其他试剂,可以鉴别石蕊、盐酸、氢氧化钙、氢氧化钠、碳酸钠五种溶液,第三个被鉴别出来的物质是______(填化学式).
 爱过坑宠1年前1
爱过坑宠1年前1 -
 liupengz 共回答了13个问题
liupengz 共回答了13个问题 |采纳率84.6%解题思路:不用其他试剂进行物质的鉴别,是根据物质间的相互反应进行,首先观察颜色,第一个被鉴别出来的是显明显颜色的物质,然后把鉴别出来的物质依次加入剩余溶液中进行鉴别.首先观察颜色,第一个被鉴别出来的是紫色的石蕊溶液,剩余的无色溶液中盐酸为酸性,氢氧化钙、氢氧化钠、碳酸钠三种溶液为碱性;
根据紫色石蕊溶液遇酸性溶液变红,遇碱性溶液变蓝的性质,向少许剩余的溶液中分别滴加石蕊溶液,变红的是盐酸,所以第二个被鉴别出来的物质是盐酸;
再将盐酸滴分别入少许剩余的三种溶液中,根据盐酸与碳酸钠溶液反应有气体生成,有气泡产生的是碳酸钠溶液,所以第三个被鉴别出来的物质是碳酸钠溶液.
故答案为;Na2CO3.点评:
本题考点: 酸、碱、盐的鉴别.
考点点评: 本题难度不是很大,解此类题的思路是:先用物理性质,一般先看颜色、闻气味;再用化学性质,用已鉴定出的药品依次去鉴别其他物质,有不同现象时方可鉴别.1年前查看全部
- (2013•东河区一模)在一个密闭容器内有四种物质,在一定条件下完全反应后,测得反应前后各物质的质量如下:
(2013•东河区一模)在一个密闭容器内有四种物质,在一定条件下完全反应后,测得反应前后各物质的质量如下:
已知X的相对分子质量为N,Q的相对分子质量为2N,下列推理正确的是( )物质 X Y Z Q 反应前质量/g 4 10 1 21 反应后质量/g 0 12 15 待测
A.反应后Q的质量为9g
B.反应中Y与Q发生改变的质量之比为1:1
C.反应后生成15gZ
D.X与Q前的化学计量数之比为2:1 gaobee1年前1
gaobee1年前1 -
 瑜悦珈人 共回答了21个问题
瑜悦珈人 共回答了21个问题 |采纳率95.2%解题思路:在化学反应中,如果反应前后物质的质量没有发生变化,这种可能是催化剂或没有参加反应;如果反应后质量增加了,该物质是生成物;如果反应后质量减小了,那么该物质是反应物.据此分析有关的问题.由质量守恒定律和表中的数据可知,4g+10g+1g+21g=0g+12g+15g+待测,则待测=9g,则X、Q的质量减少了,是反应物;Y、Z质量增加了,是生成物.
由以上分析可知:
A、反应后Q的质量为9g.故A正确;
B、反应中Y与Q发生改变的质量比为(12g-10g):(21g-9g)=1:6.故B不正确;
C、反应生成15g-1g=14g的Z,而非15g.故C不正确;
D、根据分析,“X的相对分子质量为N,Q的相对分子质量为2N”,则设其化学方程式为aX+bQ=cY+dZ.则:[aN/4g=
b2N
21g−9g],解得[a/b=
2
3],故D不正确.
故选:A.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本考点是有关质量守恒定律的实验探究,有关质量守恒定律的考题在中考中经常出现,要抓住要点:五个一定不变,一个一定变.本考点经常出现在选择题、填空题和实验题中.1年前查看全部
- (2013•东河区一模)小麦的高杆和矮杆分别受基因D、d控制,则在卵细胞中控制矮杆的基因是( )
(2013•东河区一模)小麦的高杆和矮杆分别受基因D、d控制,则在卵细胞中控制矮杆的基因是( )
A.基因d
B.基因dd
C.基因D或d
D.基因DD或Dd 31175421年前1
31175421年前1 -
 不知打 共回答了23个问题
不知打 共回答了23个问题 |采纳率87%解题思路:本题考查的知识点是基因的显性与隐形以及基因的传递,解答时可以从显性基因和隐性基因以及它们控制的性状和基因在亲子代间的传递方面来切入.显性基因控制显性性状,隐性基因控制隐性性状,当控制某个性状的基因一个是显性,一个是隐性时,只表现出显性基因控制的性状.大写字母表示显性基因,小写字母表示隐性基因,小麦的高茎是由显性基因D控制,基因组成可能是DD或Dd,小麦的矮秆是由隐性基因d控制,其基因组成是dd.染色体和基因在体细胞中成对,在生殖细胞中成单.卵细胞属于生殖细胞.因此小麦的卵细胞中控制矮茎的基因是d.
故选:A点评:
本题考点: 基因的显性和隐性以及它们与性状表现之间的关系.
考点点评: 解答此类题目的关键是理解基因的显性与隐性以及基因在亲子代间的传递.1年前查看全部
- (2013•东河区一模)向pH<7的某无色溶液中加入氯化钡溶液产生白色沉淀,该溶液的组成不可能为( )
(2013•东河区一模)向pH<7的某无色溶液中加入氯化钡溶液产生白色沉淀,该溶液的组成不可能为( )
A.HNO3、K2CO3、Na2SO4
B.HNO3、AgNO3、Ca(NO3)2
C.HCl、Na2SO4、MgCl2
D.HNO3、NaCl、Na2SO4 飘零葉1年前1
飘零葉1年前1 -
 不是海南人 共回答了19个问题
不是海南人 共回答了19个问题 |采纳率94.7%解题思路:BaCl2溶液中含有钡离子和氯离子,钡离子能形成硫酸钡沉淀,氯离子能形成氯化银沉淀,二者都是不溶于稀HNO3的白色沉淀,白色沉淀可能为氯化银或硫酸钡,由此可做出判断.向pH<7的某无色溶液中加入BaCl2溶液,生成不溶于稀酸溶液的白色沉淀,白色沉淀可能是硫酸钡或氯化银,故原溶液中含有SO42-离子或Ag+离子中的一种都可以;
A.HNO3、K2CO3、Na2SO4,溶液中含有SO42-离子但A中硝酸与碳酸钾不能共存,该溶液的组成不可能为A
B.HNO3、AgNO3、Ca(NO3)2,含有Ag+离子,能生成不溶于稀酸溶液的白色沉淀;
C.HCl、Na2SO4、MgCl2,溶液中含有SO42-离子能生成不溶于稀酸溶液的白色沉淀;
D.HNO3、NaCl、Na2SO4,溶液中含有SO42-离子能生成不溶于稀酸溶液的白色沉淀;
答案:故选A.点评:
本题考点: 盐的化学性质;溶液的酸碱性与pH值的关系.
考点点评: 初中化学中不溶于稀硝酸的白色沉淀有硫酸钡和氯化银两种,不溶性碱和碳酸盐沉淀都溶于稀硝酸.1年前查看全部
- (2013•东河区一模)生物体内残留有毒物质的情况如下表:
(2013•东河区一模)生物体内残留有毒物质的情况如下表:
那么,最可能的食物链构成是( )生物体 A B C D 有毒物质浓度 0.06 8 78 1.23
A.B→A→C→D
B.A→C→D→B
C.A→D→B→C
D.C→A→B→D 陨石sq1年前1
陨石sq1年前1 -
 ltming 共回答了17个问题
ltming 共回答了17个问题 |采纳率94.1%解题思路:在食物链中,营养级别越高,体内积累的有毒物质就越多.解此题的关键是从表格信息中提取有利于解题的信息(生物富集关系),与所学知识建立链接,从而得出答案.生物富集作用是指环境中一些有害物质(如重金属、化学农药等),通过食物链在生物体内不断积累的过程.因为这些有害物质具有化学性质稳定、不易分解的特点,会在生物体内积累而不易排出,所以随着营养级的升高而不断积累,危害最大的是这一食物链的最高级消费者.依题意,由表格中的数据可以推出这些生物组成的食物链是:A→D→B→C.
故选:C点评:
本题考点: 某些有害物质沿食物链积累.
考点点评: 人类活动会通过食物链影响生态系统,要从现在做起、从自己做起,不应该随意把有毒物质排放到生态系统中.1年前查看全部
- (2013•东河区一模)下列四个图象分别对应四种操作过程,其中不正确的是( )
(2013•东河区一模)下列四个图象分别对应四种操作过程,其中不正确的是( )
A.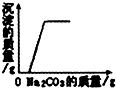
向一定量的稀盐酸和氯化钙的混合溶液中不断入碳酸钠溶液至过量
B.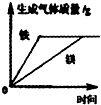
等质量的铁和镁同时分别放入两份溶质质量分数相同的一定量稀盐酸中
C.
用H2还原CuO来测定CuO中铜元素的含量
D.
向一定质量的氢氧化钠溶液中滴加过量的盐酸 ta_ko1年前1
ta_ko1年前1 -
 极品副总监的小工 共回答了16个问题
极品副总监的小工 共回答了16个问题 |采纳率93.8%解题思路:A、根据加入碳酸钠时溶液发生的反应,碳酸钠首先是和盐酸发生反应,没有沉淀产生,继续加碳酸钠溶液才和CaCl2反应,生成沉淀分析;
B、由于Mg比Fe活泼,所以二者和盐酸反应速度不一样,Mg反应要快;
C、根据铜元素是氧化铜中的一部分,要比氧化铜的质量小;
D、根据向NaOH溶液中加入HCl时溶液pH的变化分析;A、加入碳酸钠溶液首先是和盐酸发生反应,没有沉淀产生,继续加碳酸钠溶液才和CaCl2反应,生成沉淀;所以A图象正确;
B、发生的反应为Fe+2HCl=FeCl2+H2↑,Mg+2HCl=MgCl2+H2↑,因为加入的盐酸质量相等,Mg和Fe足量,根据化学方程式可知生成的H2质量相等,但由于Mg比Fe活泼,所有Mg和盐酸首先反应完,所用时间少,所以B图象错误.
C、铜元素是氧化铜中的一部分,要比氧化铜的质量小;所以C图象错误.
D、NaOH溶液显碱性,起点时溶液pH大于7,加入HCl发生的反应为NaOH+HCl=NaCl+H2O,正好反应时为中性溶液,pH为7,盐酸过量时pH小于7.所以D图象错误;
故选A.点评:
本题考点: 盐的化学性质;金属的化学性质;中和反应及其应用;氢气的化学性质与燃烧实验.
考点点评: 本题是图象与反应的考查题,在处理图象类问题时,曲线的起点、折点及变化趋势是进行判断的要点.1年前查看全部
- (2013•东河区一模)要除去下列物质中括号内的物质:甲:KCl(MnO2) 乙:NaCl(CaCl2) 丙:NH3(H
(2013•东河区一模)要除去下列物质中括号内的物质:甲:KCl(MnO2) 乙:NaCl(CaCl2) 丙:NH3(H2O) 丁:Cu(CuO)可选择的试剂和操作方法有:①加入适量水,过滤、蒸发 ②加适量Na2CO3溶液,搅拌、过滤 ③通过足量的浓硫酸,洗气 ④加适量的稀盐酸,过滤,洗涤,干燥.下列除杂试剂,方法和对应选项不正确的是( )
A.甲-①乙-②
B.甲-①丙-③
C.乙-②丁-④
D.丙-③丁-② Brouo1年前1
Brouo1年前1 -
 绮罗轻风 共回答了21个问题
绮罗轻风 共回答了21个问题 |采纳率81%解题思路:根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.甲:氯化钾易溶于水,二氧化锰难溶于水,可采取加水溶解、过滤、蒸发的方法进行分离除杂.
乙:CaCl2能与适量Na2CO3溶液反应生成碳酸钙沉淀和氯化钠,再过滤,能除去杂质且没有引入新的杂质,符合除杂原则.
丙:浓硫酸具有吸水性,但能与氨气反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则.
丁:CuO能与稀盐酸反应生成氯化铜和水,铜不与稀盐酸反应,再过滤,洗涤,干燥,能除去杂质且没有引入新的杂质,符合除杂原则.氧化铜不能与碳酸钠溶液反应,选用碳酸钠溶液不能除去杂质.
故甲-①,乙-②,丁-④对应的方法正确,丙-③、丁-②对应的方法错误.
故选:D.点评:
本题考点: 物质除杂或净化的探究;气体的干燥(除水);盐的化学性质.
考点点评: 物质的分离与除杂是中考的重点,也是难点,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键.1年前查看全部
- (2013•东河区一模)“关爱生命,拥抱健康”是人类永恒的主题,下列说法不正确的是( )
(2013•东河区一模)“关爱生命,拥抱健康”是人类永恒的主题,下列说法不正确的是( )
A.胃酸过多的病人可以多喝碳酸饮料
B.牛奶、豆浆是富含蛋白质的食品
C.大米、玉米是富含糖类的物质
D.多吃水果和蔬菜,给人体补充维生素 haifeng1981年前1
haifeng1981年前1 -
 nn97cn 共回答了25个问题
nn97cn 共回答了25个问题 |采纳率100%解题思路:A、要治疗胃酸过多,可以选用能与盐酸反应的物质;
B、C、D根据人体所需六大营养素的种类、食物来源,结合题中所给的食物判断所含的营养素,进行分析判断.A、人的胃液中含有盐酸,对于胃酸过多的人应降低其酸性,可食用碱性食物以中和多余的酸.而碳酸饮料的pH<7,即呈酸性.故A说法错误;
B、牛奶、豆浆中富含蛋白质.故B说法正确;
C、玉米中含有淀粉,属于糖类物质.大米中含有糖类物质.故C说法正确;
D、水果和蔬菜中含有丰富的维生素,从人体所需的营养素角度看,食用蔬菜、水果主要是补充维生素.故D说法正确.
故选:A.点评:
本题考点: 食品、药品与健康食品中的有机营养素;中和反应及其应用.
考点点评: 本题考查了化学与生活的知识,完成此题,可以依据已有的物质中所含有的营养素的类别进行.1年前查看全部
- (2013•东河区一模)向一定量含有NaCl和CaCl2的混合溶液中逐滴加入溶质质量分数为21.2%的Na2CO3溶液,
 (2013•东河区一模)向一定量含有NaCl和CaCl2的混合溶液中逐滴加入溶质质量分数为21.2%的Na2CO3溶液,所加入Na2CO3溶液的质量与生成沉淀的质量关系如图所示,请根据题意计算:
(2013•东河区一模)向一定量含有NaCl和CaCl2的混合溶液中逐滴加入溶质质量分数为21.2%的Na2CO3溶液,所加入Na2CO3溶液的质量与生成沉淀的质量关系如图所示,请根据题意计算:
(1)生成沉淀多少克?
(2)原混合溶液中氯化钙的质量?
(3)若恰好完全反应后得到溶质质量分数为12.0%的溶液195g,则原混合溶液中氯化钠的质量分数是多少?(计算结果保留一位小数) 韵臻1年前1
韵臻1年前1 -
 tengqm 共回答了21个问题
tengqm 共回答了21个问题 |采纳率100%解题思路:根据碳酸钠溶液的质量及其质量分数可以计算碳酸钙、氯化钙、氯化钠的质量,进一步可以计算原混合溶液中氯化钠的质量分数.(1)设生成沉淀的质量为x,氯化钙的质量为y,生成氯化钠的质量为z,
Na2CO3+CaCl2═CaCO3↓+2NaCl,
106111100 117
50g×21.2% y x z
[106/50g×21.2%]=[111/y]=[100/x]=[117/z],
x=10g,y=11.1g,z=11.7g,
答:生成碳酸钙沉淀10g.
(2)答:原混合溶液中氯化钙的质量是11.1g.
(3)溶液中氯化钠的质量为:195g×12.0%=23.4g,
原混合溶液质量为:195g+10g-50g=155g,
则原混合溶液中氯化钠的质量分数为:[23.4g-11.7g/155g]×100%=7.5%,
答:原混合溶液中氯化钠的质量分数为7.5%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.1年前查看全部
- (2013•东河区一模)实验室里同学们正在进行探究实验.用A、B、C、D四支试管各取室温下等体积的氢氧化钙饱和溶液,再向
(2013•东河区一模)实验室里同学们正在进行探究实验.用A、B、C、D四支试管各取室温下等体积的氢氧化钙饱和溶液,再向A试管中滴加碳酸钠溶液,B试管中滴加氯化铜溶液,C试管中滴加氯化铵溶液,D试管中滴加氯化钠溶液,振荡.
(1)提出问题:他们在探究的问题是______;
(2)表达与交流:阳阳同学根据在D试管中没有看到现象,判断D试管中无化学反应发生.你认为此判断的依据是否合理______(填“合理”或“不合理”),并解释其原因是______.
(3)为科学处理实验过程中产生的废液,同学们对B试管中反应后过滤得到的无色滤液继续进行探究.阳阳同学猜想滤液中含有一种溶质,娇娇同学猜想滤液中含有两种溶质.
为验证哪位同学的猜想是正确的,同学们选用不同类别的物质进行以下两个实验.请填写下列实验报告:
反思与评价:通过上述实验,同学们认为实验过程中产生的废液必须处理后再排放.实验内容 实验现象 实验结论 方案一:取少量滤液加入试管中,向其中______ 产生白色沉淀 娇娇同学的猜想是正确的.
滤液中含有的两种溶质是______方案二:取少量滤液加入试管中,向其中______ ______  小123种1年前1
小123种1年前1 -
 君汐 共回答了20个问题
君汐 共回答了20个问题 |采纳率90%解题思路:(1)进行以下操作:用A、B、C、D四支试管各取室温下等体积的氢氧化钙饱和溶液,再向A试管中滴加碳酸钠溶液、B试管中滴加氯化铜溶液、C试管中滴加氯化铵溶液、D试管中滴加氯化钠溶液,可见此实验是为了探究:氢氧化钙是否与盐发生反应;
(2)“没有看到现象,便判断D试管中无化学反应发生”,判断不合理是因为有些反应看不出现象;故填:有些化学反应发生时无明显现象
(3)氢氧化钙溶液与氯化铜溶液反应生成了氢氧化铜沉淀和氯化钙,反应后的溶液是无色的,溶液中溶质一定有氯化钙,一定没有氯化铜,可能有氢氧化钙,通过通入二氧化碳和加入酚酞试液的方法来进行确定.(1)通过氢氧化钙溶液与碳酸钠、氯化铜、氯化氨、氯化钠溶液的反应,振荡,让其成分反应,可知此实验是为了探究:氢氧化钙是否与盐发生反应;故填:氢氧化钙与盐反应的性质
(2)“没有看到现象,便判断D试管中无化学反应发生”,判断不合理,因为有些反应看不出现象,但是却已经反应了,如:二氧化碳和氢氧化钠反应.
(3)B试管中的废液显碱性,不能直接排放,必须将碱性物质调节至中性再排放.
实验内容实验现象实验结论
通入少量CO2 产生白色沉淀CaCl2、Ca(OH)2
滴2滴酚酞试液 溶液变红故答案为:(1)氢氧化钙与盐反应的性质;(2)不合理;有些化学反应发生时无明显现象;
(3)
实验内容实验现象实验结论
通入少量CO2 产生白色沉淀CaCl2、Ca(OH)2
滴2滴酚酞试液 溶液变红点评:
本题考点: 探究酸碱的主要性质;碱的化学性质;盐的化学性质.
考点点评: 本题通过实验探究氢氧化钙的性质及变化规律.在判定物质的变化时,是否发生了化学变化,不是以是否有明显的现象为依据,而是以是否生成了其他物质为判断的依据.1年前查看全部
- (2013•东河区一模)甲、乙、丙是初中化学常见的物质,其转化关系如图所示:
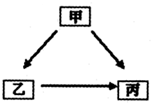 (2013•东河区一模)甲、乙、丙是初中化学常见的物质,其转化关系如图所示:
(2013•东河区一模)甲、乙、丙是初中化学常见的物质,其转化关系如图所示:
(1)甲、乙组成元素相同,甲、乙、丙中有一种物质为水,则甲为______;
(2)若乙、丙含相同两种元素,且其一有毒,则甲乙丙可能是______.
(3)若甲、乙、丙都含有三种元素,甲、乙、丙的相对分子质量依次增大,其中一种物质广泛用于玻璃、造纸、纺织和洗涤剂的生产.由甲到乙反应的化学方程式为______. 99strong991年前1
99strong991年前1 -
 jerryuiii 共回答了22个问题
jerryuiii 共回答了22个问题 |采纳率90.9%解题思路:(1)根据甲、乙、丙是初中化学常见的物质,甲、乙组成元素相同,甲、乙、丙中有一种物质为水,所以甲是过氧化氢,乙可以是水,丙可以是氧气,然后进行验证即可;
(2)根据甲、乙、丙是初中化学常见的物质,若乙、丙含相同两种元素,且其一有毒,乙会转化成丙,所以乙是一氧化碳,丙是二氧化碳,甲就是木炭,然后进行验证即可;
(3)根据甲、乙、丙是初中化学常见的物质,若甲、乙、丙都含有三种元素,甲、乙、丙的相对分子质量依次增大,其中一种物质广泛用于玻璃、造纸、纺织和洗涤剂的生产,所以该物质是碳酸钠,所以甲可以是氢氧化钠,乙可以是碳酸钠,丙可以是硫酸钠,然后进行验证即可.(1)甲、乙、丙是初中化学常见的物质,甲、乙组成元素相同,甲、乙、丙中有一种物质为水,说明有一种物质是过氧化氢,又因为过氧化氢能通过反应生成水,而水不能通过化学反应生成过氧化氢,由于甲能到乙,而乙不能到甲,所以甲为过氧化氢,乙为水,所以丙为氧气;
(2)甲、乙、丙是初中化学常见的物质,若乙、丙含相同两种元素,且其一有毒,乙会转化成丙,所以乙是一氧化碳,丙是二氧化碳,甲就是木炭,所以甲、乙、丙可能是木炭、一氧化碳、二氧化碳;
(3)甲、乙、丙是初中化学常见的物质,若甲、乙、丙都含有三种元素,甲、乙、丙的相对分子质量依次增大,其中一种物质广泛用于玻璃、造纸、纺织和洗涤剂的生产,所以该物质是碳酸钠,所以甲可以是氢氧化钠,乙可以是碳酸钠,丙可以是硫酸钠,所以甲到乙的反应是氢氧化钠和二氧化碳反应生成碳酸钠和水,化学方程式为:2NaOH+CO2=Na2CO3+H2O.
故答案为:(1)过氧化氢;
(2)木炭、一氧化碳、二氧化碳;
(3)2NaOH+CO2=Na2CO3+H2O.点评:
本题考点: 物质的鉴别、推断;书写化学方程式、文字表达式、电离方程式.
考点点评: 在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可.1年前查看全部
大家在问
- 1某温度时,蒸干35g氯化钾溶液,得到10g 氯化钾,求该溶液中溶质的质量分数.
- 2铁心桥邮政编码是210012表达了哪些信息
- 3后天的英文怎么写
- 4分数单位是7分之1的最大真分数是多少?最小假分数是多少?
- 5七加一等于多少(打一字)拜托各位大神
- 6所有的非自然数都是1的倍数.(判断题)
- 7一本书降价9分之1出售,我带了50元,用其中的25分之18买了一本书,这本书的原价是多少元
- 8甲乙两车同时从AB两地相向而行,他们相遇时距AB两地中点8千米,已知甲车的速度是乙车的1.4倍,求AB距离.
- 9匀速运动的平均速度是v=s/t,那么一物体运动一周后回到起点,它的平均速度怎样算
- 10如图所示,M1、M2是2块竖直放置的平面镜,相距4米,一个小孩站在两镜中间的位置,则他从镜
- 11英语解释句子!急!1. It was hard work, but I enjoy it. 2. Can you com
- 12怎样去自来水氯气
- 13矩形的面积是12平方厘米,一边与一条对角线的比为3:5,则矩形的对角线长是多少
- 14我国长江,黄河,珠江,松花江四大河流的水量平衡示意图,哪个是珠江 哪个是长江
- 15小学数学概念“几个”包括哪些数?包括1和2吗?
