电解液导电原理是什么?
 haiou131452022-10-04 11:39:541条回答
haiou131452022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 sophiezyh 共回答了16个问题
sophiezyh 共回答了16个问题 |采纳率93.8%- 因电场原因造成溶液中正负离子向两极移动,并且在电极上放电,如果是物理题这样答一般就可以了,化学的话可能还要视具体问题,可能要写电极方程式什么的.
- 1年前
相关推荐
- 原电池的电极和电解液有什么要求?
原电池的电极和电解液有什么要求?
为什么锌做负极时,电解液不能是硫酸铜? ID被封一个月1年前2
ID被封一个月1年前2 -
 shehebeai 共回答了16个问题
shehebeai 共回答了16个问题 |采纳率93.8%Zn可以把溶液中的Cu置换出来,损坏电极1年前查看全部
- 船用启动铅酸蓄电池 有单格电解液密度非常低,不到1.1.是怎么回事.什么原因导致的?怎么解决.
 dou21年前2
dou21年前2 -
 9号台 共回答了17个问题
9号台 共回答了17个问题 |采纳率100%应该是单格冒泡了,是短路的一种现象.在三包期间内可以赔新池,如果过了三包期间,就购买新电池.如果是微短路还可以用的话也可以继续用,但是船用的风险我觉得大了一点.统一电池,德利达新电池商行黎工回.1年前查看全部
- 电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液c;A、B分别是两块电极板,通过导线与直流电源相连.
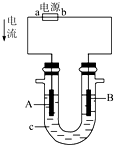 电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液c;A、B分别是两块电极板,通过导线与直流电源相连.
电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液c;A、B分别是两块电极板,通过导线与直流电源相连.
(1)若A、B都是惰性电极,电解质溶液c是饱和NaCl溶液,实验开始时,同时在U形管两边各滴入几滴酚酞溶液,试判断:
①a是______极(填“正”或“负”),B是______极(填“阴”或“阳”);
②A电极上的电极反应式为______,B电极上的电极反应式为______;
③检验A电极产物的方法是______.
(2)用惰性电极电解CuSO4溶液.若阴极上析出Cu的质量为3.2g,则阳极上产生的气体在标准状况下的体积为______;常温下,若将电解后的溶液稀释至1L,则溶液的pH约为______. tianqibucuo1年前1
tianqibucuo1年前1 -
 bobhmz 共回答了17个问题
bobhmz 共回答了17个问题 |采纳率88.2%解题思路:(1)电解饱和食盐水时,由电流流向可知,A为阳极与电源正极相连,B为阴极与电源负极相连,阳极上是氯离子失电子,阴极上是氢离子得电子;A电极生成的氯气检验方法是利用氯气使湿润的淀粉碘化钾试纸变蓝检验;
(2)根据电解精硫酸铜的电极反应和电子守恒,氢离子守恒分析计算.(1)①由电流流向可知,和电源的正极相连的电极A极是阳极,和电源的负极相连的电极B极是阴极,该a为正极,b为负极.A为阳极,B为阴极,
故答案为:正;阴;
②A电极为阳极,溶液中氯离子发生失电子的氧化反应,即2Cl--2e-=Cl2↑,B电极为电解池的阴极,电极上氢离子发生得电子的还原反应,即2H++2e-=H2↑;
故答案为:2Cl--2e-=Cl2↑;2H++2e-=H2↑;
③检验氯气的方法是用湿润的淀粉碘化钾试纸检验生成的气体,气体能使试纸变蓝色,
故答案为:用湿润的淀粉碘化钾试纸检验生成的气体,气体能使试纸变蓝色;
(2)电解硫酸铜溶液时,阳极上氢氧根离子放电,生成1mol氧气需要4mol电子;生成3.2gCu转移电子数为[3.2g/64g/mol]×2=0.1mol,根据转移电子相等得阳极上产生的气体在标准状况下的体积=[0.1mol/4]×22.4L/mol=0.56L;阴极电极反应:4OH--4e-=2H2O+O2↑,消耗氢氧根离子物质的量,0.1mol,溶液中增加氢离子物质的量为0.1mol,常温下,若将电解后的溶液稀释至1L,溶液中氢离子浓度=[0.1mol/1L]=0.1mol/L,溶液pH=1,
故答案为:0.56L;1.点评:
本题考点: 电解原理.
考点点评: 本题考查学生电解池的工作原理知识,明确图中电源的正负极确定电解池的阴阳极是解答的关键,并熟悉电极反应及离子的放电顺序来解答,题目难度中等.1年前查看全部
- 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下
 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下
问题:
(1)若A、B都是惰性电极,c是饱和NaCl溶液,实验开始时,同时在U形管两边各滴入几滴酚酞试液,则:
①a是正正 极(填“正”或“负”) B极附近溶液呈碱碱性.
②电解池中A极上的电极反应式为2Cl--2e-═Cl2↑2Cl--2e-═Cl2↑.
(2)如要进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,电解液c选用CuSO4溶液,则:
①A电极的材料是粗铜粗铜,B电极反应式是Cu2++2e-═CuCu2++2e-═Cu.
②下列说法正确的是bdbd.
a.电能全部转化为化学能
b.在电解精炼过程中,电解液中伴随有Al3+、Zn2+产生
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
(3)用惰性电极电解CuSO4溶液.若阴极析出Cu的质量为12.8g,则阳极上产生的气体在标准状况下的体积为2.242.24L.
(4)利用反应2Cu+O2+2H2SO4═2CuSO4+2H2O可制备CuSO4,若将该反应设计为电解池,其电解质溶液需用稀硫酸稀硫酸,阳极材料是用CuCu,阴极电极反应式O2+4H++4e-=2H2OO2+4H++4e-=2H2O. cornermen1年前1
cornermen1年前1 -
 茕孑yyw 共回答了15个问题
茕孑yyw 共回答了15个问题 |采纳率66.7%(1)①根据电流方向知,a是正极、b是负极,则A是阳极、B是阴极,阴极上氢离子放电,同时阴极附近有氢氧根离子生成,导致溶液碱性增强,无色酚酞试液遇碱变红色,所以B电极附近溶液呈红色,故答案为:正;碱;
②A电极上氯离子放电生成氯气,电极反应式为2Cl--2 e-═Cl2↑,故答案为:2Cl--2 e-═Cl2↑;
(2)①电解精炼粗铜时,粗铜作阳极、纯铜作阴极,所以A的电极材料是粗铜,阴极上铜离子放电生成铜,
电极反应式为Cu2++2e-═Cu,故答案为:粗铜;Cu2++2e-═Cu;
②a.电能全部转化为化学能、热能等,故错误;
b.粗铜中,越活泼的金属越容易失电子,所以电解液中伴随有Al3+、Zn2+产生,故正确;
c.电解质溶液中Cu2+向阴极移动,硫酸根离子向阳极移动,故错误;
d.阳极上较活泼的金属失电子,导致阳极材料疏松,则Ag、Pt、Au以单质进入电解质溶液中,所以利用阳极泥可回收Ag、Pt、Au等金属,故正确;
故选b、d;
(3)阴极析出Cu的质量为12.8g转移电子的物质的量=
12.8g
64g/mol×2=0.4mol,根据转移电子相等得氧气体积=
0.4mol
4×22.4L/mol=2.24L,故答案为:2.24;
(4)根据电池反应式知,稀硫酸作电解质溶液,阳极是Cu,阴极上氧气得电子发生还原反应,电极反应式为O2+4H++4e-=2H2O,故答案为:H2SO4;Cu;O2+4H++4e-=2H2O.1年前查看全部
- 欧姆定律适用于电解液导电电解液有电阻吗
 心易碎1年前3
心易碎1年前3 -
 tsm9005 共回答了20个问题
tsm9005 共回答了20个问题 |采纳率85%不适用,欧姆定律只适用纯电阻电路的1年前查看全部
- PbO2接电源负极,Pb接电源正极,H2SO4为电解液,电极反应为?
 jordanagan1年前2
jordanagan1年前2 -
 leoro 共回答了24个问题
leoro 共回答了24个问题 |采纳率79.2%正极:PbO2+H2SO4+2e+2H+=PbSO4+2H2O
负极:Pb+H2SO4-2e=PbSO4+2H+
总反应:Pb+PbO2+2H2SO4=PbSO4+2H2O
还有什么不明白的可以追问我1年前查看全部
- (2012•台州一模)Li-SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和石墨,电解液是LiAlCl4-SO
(2012•台州一模)Li-SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和石墨,电解液是LiAlCl4-SOCl2.电池的总反应可表示为:4Li+2SOCl2=4LiCl+SO2+S.下列叙述中不正确的是( )
A.组装该电池必须在无水、无氧的条件下进行
B.电池在工作时Li+向负极移动
C.正极的电极反应式为:2SOCl2+4e-=4Cl-+SO2+S
D.选用该电池作为心脏起搏器的电源,主要原因是单位质量提供的电量多,电池的寿命长 nyw123451年前1
nyw123451年前1 -
 mrsnake 共回答了19个问题
mrsnake 共回答了19个问题 |采纳率94.7%解题思路:分析反应的化合价变化,可得Li为还原剂,SOCl2为氧化剂,负极材料为Li(还原剂),发生氧化反应,电极反应式为Li-e-=Li+,正极发生还原反应,电极方程式为:2SOCl2+4e-=4Cl-+S+SO2,因为构成电池的两个主要成份Li能和氧气水反应,且SOCl2也与水反应.A.因为构成电池的两个主要成份Li能和氧气、水反应,且SOCl2也与水反应,必须在无水、无氧条件下进行,故A正确;
B.Li为还原剂,为原电池的负极,电极反应式为Li-e-=Li+,电池在工作时Li+向正极移动,故B错误;
C.SOCl2为氧化剂,正极发生还原反应,电极方程式为:2SOCl2+4e-=4Cl-+S+SO2,故C正确;
D.选用该电池作为心脏起搏器的电源,具有能量高、电池电压高、工作温度范围宽、贮存寿命长等优点,故D正确;
故选B.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查了原电池原理的分析判断,主要是电极名称和电极反应的分析应用,题目难度中等.1年前查看全部
- 蓄电池中所用的电解液是质量分数约为28%的硫酸.若用1升98%的浓硫酸(密度为1.84克
蓄电池中所用的电解液是质量分数约为28%的硫酸.若用1升98%的浓硫酸(密度为1.84克
蓄电池中所用的电解液是质量分数约为28%的硫酸.若用1升98%的浓硫酸(密度为1.84克/立方厘米)稀释成28%的硫酸,可得28%的硫酸溶液多少克?需加水多少毫升?
要列方程做
急用
长期床的病人可用50%的酒精擦洗受压部位,以促进血液流通防止生疮.医生欲用500ml无水酒精(密度可用近似值0.8g/mL)配置50%的酒精,求可配置多少克这样的溶液?(通过列式计算) tim7806151年前1
tim7806151年前1 -
 火山_yzq 共回答了12个问题
火山_yzq 共回答了12个问题 |采纳率91.7%1L×1000mL/L×1.84g/mL×98%=m×28% m=6440g
需加水6440-1840=4600g1年前查看全部
- 问一下化学里面的电解镀锌~电镀的时候,假如电解液用硫酸锌,阳极用锌棒,阴极用惰性电极,那锌能被镀到阴极上去吗?阴极为什么
问一下化学里面的电解镀锌~
电镀的时候,假如电解液用硫酸锌,阳极用锌棒,阴极用惰性电极,那锌能被镀到阴极上去吗?阴极为什么不先产生氢气?水里面的氢离子氧化性应该比锌离子强啊?不解... roziho19861年前4
roziho19861年前4 -
 郁闷De蚂蚁 共回答了27个问题
郁闷De蚂蚁 共回答了27个问题 |采纳率88.9%在溶液浓度大时,氢离子的放电顺序就要排到锌离子的后面.这样,工业上就可以实现镀锌,镀镍等一些活动性比较强的金属.1年前查看全部
- 蓄电池在充电时电解液密度如何变化
 ei_kl04can22f6_1年前3
ei_kl04can22f6_1年前3 -
 amigo_kai 共回答了16个问题
amigo_kai 共回答了16个问题 |采纳率87.5%一:铅酸蓄电池放电过程的电化反应
1.铅酸蓄电池放电时,在蓄电池的电位差作用下,负极板上的电子经负载进入正极板形成电流I.同时在电池内部进行化学反应.
2.负极板上每个铅原子放出两个电子后,生成的铅离子(Pb+2)与电解液中的硫酸根离子(SO4-2)反应,在极板上生成难溶的硫酸铅(PbSO4).
3.正极板的铅离子(Pb+4)得到来自负极的两个电子(2e)后,变成二价铅离子(Pb+2),与电解液中的硫酸根离子(SO4-2)反应,在极板上生成难溶的硫酸铅(PbSO4).正极板水解出的氧离子(O-2)与电解液中的氢离子(H+)反应,生成稳定物质水.
4.电解液中存在的硫酸根离子和氢离子在电力场的作用下分别移向电池的正负极,在电池内部形成电流,整个回路形成,蓄电池向外持续放电.
5.放电时H2SO4浓度不断下降,正负极上的硫酸铅(PbSO4)增加,电池内阻增大(硫酸铅不导电),电解液浓度下降,电池电动势降低.
6.化学反应式为:
正极活性物质 电解液 负极活性物质 正极生成物 电解液生成物 负极生成物
PbO2 + 2H2SO4 + Pb PbSO4 + 2H2O + PbSO4
二氧化铅 稀硫酸 铅 硫酸铅 水 硫酸铅
二:铅酸蓄电池充电过程的电化反应
1.充电时,应在外接一直流电源(充电极或整流器),使正、负极板在放电后生成的物质恢复成原来的活性物质,并把外界的电能转变为化学能储存起来.
2.在正极板上,在外界电流的作用下,硫酸铅被离解为二价铅离子(Pb+2)和硫酸根负离子(SO4-2),由于外电源不断从正极吸取电子,则正极板附近游离的二价铅离子(Pb+2)不断放出两个电子来补充,变成四价铅离子(Pb+4),并与水继续反应,最终在正极极板上生成二氧化铅(PbO2).
3.在负极板上,在外界电流的作用下,硫酸铅被离解为二价铅离子(Pb+2)和硫酸根负离子(SO4-2),由于负极不断从外电源获得电子,则负极板附近游离的二价铅离子(Pb+2)被中和为铅(Pb),并以绒状铅附着在负极板上.
4.电解液中,正极不断产生游离的氢离子(H+)和硫酸根离子(SO4-2),负极不断产生硫酸根离子(SO4-2),在电场的作用下,氢离子向负极移动,硫酸根离子向正极移动,形成电流.
5.充电后期,在外电流的作用下,溶液中还会发生水的电解反应.
6.化学反应式为:
正极物质 电解液 负极物质 正极生成物 电解液生成物 负极生成物
PbSO4 + 2H2O + PbSO4 PbO2 + 2H2SO4 + Pb
硫酸铅 水 硫酸铅 氧化铅 硫酸 铅
三:铅酸蓄电池充放电后电解液的变化
1.从上面可以看出,铅酸蓄电池放电时,电解液中的硫酸不断减少,水逐渐增多,溶液比重下降.
2.从上面可以看出,铅酸蓄电池充电时,电解液中的硫酸不断增多,水逐渐减少,溶液比重上升.
3.实际工作中,可以根据电解液比重的变化来判断铅酸蓄电池的充电程度.1年前查看全部
- 请问锌作负极铜作正极稀硫酸作电解液的原电池,正负极的反应是什么?
 andrew991年前2
andrew991年前2 -
 桔子味棒棒糖 共回答了13个问题
桔子味棒棒糖 共回答了13个问题 |采纳率76.9%正 2H*+2e=H2
负 Zn-2e=Zn2*1年前查看全部
- 电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.
电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.
请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式为______,在X极附近观察到的现象是______.
电解液中向X极方向移动的离子是______.
②Y电极上的电极反应式为______.
(2)如要用电解方法精炼粗铜,电解液a选用CuSO 4 溶液,则:
①X电极的材料是______.
②Y电极的电极反应式为______.(说明:杂质发生的反应不必写出)
③溶液中的c(Cu 2+ )与电解前相比______(填“变大”、“变小”或“不变”).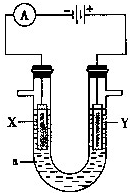
 L柒八zao1年前1
L柒八zao1年前1 -
 superzhu 共回答了21个问题
superzhu 共回答了21个问题 |采纳率85.7%(1)①和电源的负极相连的电极X极是阴极,该电极上氢离子发生得电子的还原反应,即2H + +2e - =H 2 ↑,所以该电极附近氢氧根浓度增大,碱性增强,滴入几滴酚酞试液会变红,
故答案为:2H + +2e - =H 2 ↑或2H 2 O+2e-=H 2 +2OH - ;放出气体,溶液变红;
②和电源的正极相连的电极Y极是阳极,该电极上氯离子发生失电子的氧化反应,即2Cl - -2e - =Cl 2 ↑,故答案为:2Cl - -2e - =Cl 2 ↑;
(2)①电解方法精炼粗铜,电解池的阴极材料是纯铜,电极反应为:Cu 2+ +2e - =Cu,故答案为:精铜;
②电解方法精炼粗铜,电解池的阳极材料是粗铜,电极反应为:Cu-2e - =Cu 2+ ,故答案为:粗铜;Cu-2e - =Cu 2+ ;
③粗铜做阳极,其中的杂质锌、镍等也会失电子,所以依据电子守恒,阴极析出的铜比阳极溶解的铜多,溶液中铜离子浓度减小,故答案为:变小.1年前查看全部
- 用银做阴阳极HCL做电解液为什么能使2HCl+2Ag===2AgCl+H2↑发生
用银做阴阳极HCL做电解液为什么能使2HCl+2Ag===2AgCl+H2↑发生
银失电子后阴离子不是会在H离子前面得电子变为银单质么 ele543211年前1
ele543211年前1 -
 yxy2000 共回答了18个问题
yxy2000 共回答了18个问题 |采纳率83.3%用活泼电极进行电解,阳极的金属发生氧化反应 Ag-e-==Ag+
此时Ag+一生成,就和溶液中的Cl-产生AgCl沉淀,所以Ag+无法到阴极发生还原反应,只能由H+代替,发生2H+ +2e-==H2的反应
故总反应为2HCl+2Ag===2AgCl+H2↑1年前查看全部
- 高二的一道物理题~~~在电解液中,5.0S内沿相反方向通过液体横截面的正.负离子的电量均为5.0C,则电解液中的电流强度
高二的一道物理题~~~
在电解液中,5.0S内沿相反方向通过液体横截面的正.负离子的电量均为5.0C,则电解液中的电流强度是?
答案是2A.可是我不知道为什么...请各位详细解释一下...谢谢啦... 开泵灌水1年前3
开泵灌水1年前3 -
 八神吹雪nabiki 共回答了23个问题
八神吹雪nabiki 共回答了23个问题 |采纳率87%在金属中电流是自由电子移动造成的.所以如果题目说流过横截面的负电荷是5C那么电流就是一安.但是在液体中除了负电荷之外还有正电荷也在移动.也就是:正.负离子.所以实际上在液体中流动的电荷是被分被正负两种离子运输每种离子各运5C的电量,所以总的是10C的电量10/5=2A
够明白了吧1年前查看全部
- 原电池书写以N2和H2为正负极以氯化氢和氯化铵为电解液原电池的正负极书写
 855645311年前4
855645311年前4 -
 soinhhb 共回答了21个问题
soinhhb 共回答了21个问题 |采纳率85.7%N2+3H2+2HCl=2NH4Cl
负极反应:H2-2e-=2H+
正极反应:N2+6e- +2HCl+6H+=2NH4Cl
就是这样的,应为电解液是酸性的,所以生成氯化铵1年前查看全部
- 锌电池在放电过程中,其电解液比重将 __.
锌电池在放电过程中,其电解液比重将 __.
A 升高 B 降低 C 基本不变 inct1年前1
inct1年前1 -
 332846595 共回答了19个问题
332846595 共回答了19个问题 |采纳率78.9%锌电池在放电过程中,其电解液比重将_C__.1年前查看全部
- CH4的燃料电池 NaCO3溶液电解液 正负极 方程式
CH4的燃料电池 NaCO3溶液电解液 正负极 方程式
要准确啊 ..........Na2CO3(打错了) psomer1年前2
psomer1年前2 -
 yooyuan87 共回答了19个问题
yooyuan87 共回答了19个问题 |采纳率89.5%负极:CH4 -8e + 9OH(-) = HCO3(-) + 6H2O
正极:O2 + 4e + 2H2O = 4OH(-)
总反应:CH4 + 2O2 + OH(-) = HCO3(-) + 2H2O1年前查看全部
- 电解液配制的浓度跟理论差距太大1、目标浓度:[Cu2+]=85g/L,[H2SO4]=130g/L2、取[Cu2+]=1
电解液配制的浓度跟理论差距太大
1、目标浓度:[Cu2+]=85g/L,[H2SO4]=130g/L
2、取[Cu2+]=150g/L的硫酸铜溶液11.5L,硫酸1500mL(约2700g),添加纯水6L,理论上应该能满足目标浓度,但实际检测结果只有:[Cu2+]=76g/L,[H2SO4]=108g/L,
3、再次添加[Cu2+]=150g/L的硫酸铜溶液3L,理论上可升铜20g/L以上,但检测结果:[Cu2+]=86.5g/L,[H2SO4]=99g/L
请问各位大侠,这是什么原因?
体积误差是存在的,但是差距不应该这么大啊 nashs1年前1
nashs1年前1 -
 today_yesterday 共回答了16个问题
today_yesterday 共回答了16个问题 |采纳率81.3%你计算错了.总体积不能按11.5L+1.5L+6L=19L算
因为浓硫酸与水体积不是总和相加,浓硫酸遇水会放热,总体积大于相加体积.1年前查看全部
- 电池补充液和电解液有什么不一样
 lqw7402281年前2
lqw7402281年前2 -
 mazing安蓝 共回答了15个问题
mazing安蓝 共回答了15个问题 |采纳率80%补充液比重1.05,作用和蒸馏水接近,是蒸馏水里加了微量的酸
电解液一般是比重1.28的稀硫酸溶液
电瓶只有开始的时候需要加入电解液,以后只需要定期加蒸馏水或者补充液就可以了.除非使用过程中有电解液泄漏否则一般不要要加电解液1年前查看全部
- ①原子团,右上角的M+或M-表示的是整体带多少电荷吗?②无论在酸性介质,碱性介质还是在中性介质.氢氧燃料电池电解液的ph
①原子团,右上角的M+或M-表示的是整体带多少电荷吗?②无论在酸性介质,碱性介质还是在中性介质.氢氧燃料电池电解液的ph是否保持不变?
 fengshicanying1年前1
fengshicanying1年前1 -
 季风3318 共回答了19个问题
季风3318 共回答了19个问题 |采纳率84.2%1正确,2
pH偏向中性变化,生成水稀释了1年前查看全部
- 制备制备KMnO4的最佳方法是电解法,工业上以K2MnO4的水溶液为电解液,镍板(不参与反
制备制备KMnO4的最佳方法是电解法,工业上以K2MnO4的水溶液为电解液,镍板(不参与反
制备制备KMnO4的最佳方法是电解法,工业上以K2MnO4的水溶液为电解液,镍板(不参与反应)为阳极,铁板为阴极进行电解.分别写出阴、阳的电极反应式:_________________,电解总反应式_:_______ zhangyuecuicui1年前1
zhangyuecuicui1年前1 -
 xiyuxingyue 共回答了19个问题
xiyuxingyue 共回答了19个问题 |采纳率94.7%阴极:2H^++2e^-=H2↑
阳极:2MnO4^2--2e^-=2MnO4^-
电解总反应式:2K2MnO4+2H2O=2KMnO4+2KOH+H2↑1年前查看全部
- 1 ) Ag-Zn电池 zn+ag2o=zno+2ag 电解液为koh溶液
1 ) Ag-Zn电池 zn+ag2o=zno+2ag 电解液为koh溶液
为什么负极反应式的右边是zno+h2o而不可以写成zn(oh)2?
2)为什么有些时候电解液可以参与负极的反应 如 硫酸 氢离子失去电子变成氢气 而有些原电池的电解液 如以上反应 为什么就不可以是钾离子失去电子的反应式呢? weisenzhang1年前7
weisenzhang1年前7 -
 hhctais 共回答了16个问题
hhctais 共回答了16个问题 |采纳率93.8%第一个问题:难溶于水的金属氢氧化物均不稳定,易分解生成对应的金属氧化物.
第二个问题:与离子在溶液中得失电子的难易有关,通常易得电子的离子先得电子被还原.
注意:你的说法有严重错误,氢离子没有电子怎能失去电子?钾离子也只能得到电子生成单质钾,不可能在溶液中存在,会和水剧烈反应.1年前查看全部
- 电解液为硅酸钠,电极为钛铝合金,问在放电过程中都发生了哪些电化学反应方程式?求您专业一点
 飘出风格1年前1
飘出风格1年前1 -
 pk888 共回答了19个问题
pk888 共回答了19个问题 |采纳率89.5%电解液的离子组成:Na(+) 、H(+) 、OH(-)、SiO3(2-)
如果以钛铝合金为电极,那Ti和Al都是活泼金属,是很容易在阳极放电的,因此:
阳极可能放电的物质:Al、Ti、OH(-)、SiO3(2-),但放电顺序显然是:Al>Ti>OH(-)>SiO3(2-)
Al = Al(3+) + 3e
再与溶液中的OH(-)反应:
Al(3+) + 3OH(-) = Al(OH)3
阴极可能放电的物质:Na(+)、H(+)、Al(3+),但放电顺序显然是:H(+) > Al(3+) > Na(+),所以:
2H(+) + 2e = H2
总电解反应:2Al + 6H2O = 2Al(OH)3 + 3H21年前查看全部
- 在用银作为阳极,金作为阴极,0.5mol/L的KCl作为电解液,极化电压为0.67V,如果在电解液中插入一银棒,它与阴极
在用银作为阳极,金作为阴极,0.5mol/L的KCl作为电解液,极化电压为0.67V,如果在电解液中插入一银棒,它与阴极间会有电流吗?大小与阴阳极间的电流大小的关系?
 梦中女孩的梦1年前1
梦中女孩的梦1年前1 -
 月舞云飞 共回答了22个问题
月舞云飞 共回答了22个问题 |采纳率90.9%两极需有连接,会有电流,大小于电解液浓度成及浸极面积成正比!1年前查看全部
- 铝为阳极,浓硫酸为电解液,如果可以,电极反应式是什么
 野狼20311年前4
野狼20311年前4 -
 行而上玄 共回答了16个问题
行而上玄 共回答了16个问题 |采纳率81.3%应该会发生钝化反应,除非电压高到一定程度,否则几乎不反应.
如果高电压强行电解,电解生成硫酸铝和二氧化硫.1年前查看全部
- 定硫仪配置电解液能用电瓶补液吗
 qo_el_f_bdnp6ea61年前2
qo_el_f_bdnp6ea61年前2 -
 zhangbaoqin 共回答了20个问题
zhangbaoqin 共回答了20个问题 |采纳率95%配制电解液:称取 6克碘化钾,6克溴化钾,溶于约250毫升蒸馏水中,然后加入10毫升冰醋酸即可.电解液可重复使用,使用的时间长短根据重复使用次数和试样含硫量高低而定,电解液的PH值在1—3时可以使用,当PH值小于1时,此电解液应弃除.1年前查看全部
- 电子表和计算机的电源是微型银锌电池,其电极材料分别为Ag2O和Zn,电解液为KOH溶液,电极反应
电子表和计算机的电源是微型银锌电池,其电极材料分别为Ag2O和Zn,电解液为KOH溶液,电极反应
为:Zn+2OH--2e-=ZnO+H2O,Ag2O+H2 O+2e-=2Ag+2OH-,下列说法中正确的是()
A.Zn为正极,Ag2O为负极
B.电子由锌极经外电路流人Ag2O极
C.Zn为负极,Ag2O为正极
D.工作一段时间后,Zn的质量减少,Ag2O的质量增加
(化学原电池8) tyzhangzhr1年前2
tyzhangzhr1年前2 -
 joe407 共回答了14个问题
joe407 共回答了14个问题 |采纳率100%BC
在这个反应中,Zn失去电子,电路中规定流出电子的一极为负极,因此A错误,C正确.你看看这两个电极方程式就知道B是对的.D中,氧化银的质量也会减少.
我不知道你是哪个省的,有没有多选题1年前查看全部
- 原电池对电解液有啥要求?譬如是否 需要 电解液和负极金属能单独反应?
原电池对电解液有啥要求?譬如是否 需要 电解液和负极金属能单独反应?
例如锌、铜这两个负正电极,电解液可以是CUSO4也可以是NACL溶液,是硫酸铜的话还说得过去,那NACL是怎么使锌失电子的?锌和水反应?
是原电池 魏程宇741年前1
魏程宇741年前1 -
 阿德巴约 共回答了18个问题
阿德巴约 共回答了18个问题 |采纳率94.4%锌失去电子是因为它的电势比铜高,电子有从电势高的物质向电势低的物质移动的性质,所以锌才会失电子,电解质在其中只是起导电的作用,阳离子在正极得到电子生成新物质.电解质不是使锌失去电子的原因,只要能导电就行,电解质是什么不重要.1年前查看全部
- 另一化学研究性学习小组在实验室条件下用以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回
另一化学研究性学习小组在实验室条件下用以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定.已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应).
步骤一:电解精制:电解时,粗铜应与电源的______极相连.阴极上的电极反应式为______.
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理: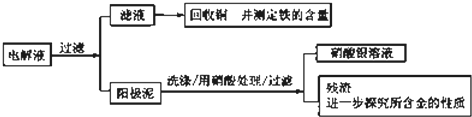
(1)阳极泥的综合利用:稀硝酸处理阳极泥得到硝酸银稀溶液,请写出该步反应的离子方程式:______,残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的信息:
请根据以上信息简要解释溶解阳极泥不用王水的原因______.序号 反应 平衡常数 1 Au+6HNO3⇌Au(NO3)3+3NO2↑+3H20 <<1 2 Au3++4Cl-⇌AuCl4 _ >>1
(2)滤液含量的测定:以下是该小组探究滤液的一个实验流程.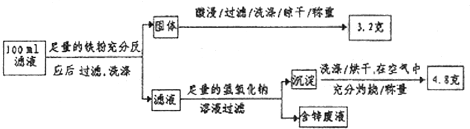
则100mL滤液中Cu2+的浓度为______mol•L-1,Fe2+的浓度为______mol•L-1. 爱笑的小桃夭夭1年前1
爱笑的小桃夭夭1年前1 -
 xhj_he 共回答了21个问题
xhj_he 共回答了21个问题 |采纳率90.5%解题思路:步骤一:电解精炼铜时,精铜做阴极,粗铜作阳极,阴极上是铜离子得电子;
步骤二:(1)金属银可以和硝酸反应得到硝酸银以及水和一氧化氮;金离子可以和氯离子之间发生反应,形成稳定的AuCl4-离子,可以根据化学平衡移动原理来解释;
(2)根据化学反应原理结合原子守恒的思想来计算回答.步骤一:在电解精炼铜时,阳极反应是金属锌、铁、镍等先失电子,阴极上是铜离子得电子产生铜,精铜做阴极,粗铜作阳极,
故答案为:正;Cu2++2e=Cu;
步骤二:(1)金属银可以和稀硝酸反应生成硝酸银、一氧化氮和水,即3Ag+4H++NO3-=3Ag++NO↑+2H2O;根据表中的信息,Au+6HNO3(浓)=Au(NO3)3+3NO2↑+3H2O,并且Au3++4Cl-=AuCl4-,在王水中,含有浓硝酸和浓盐酸,浓盐酸含有大量氯离子,Au3+离子与氯离子形成稳定的AuCl4-离子,使反应2平衡向右移动,则金溶于王水中,故答案为:3Ag+4H++NO3-=3Ag++NO↑+2H2O;浓盐酸含有大量氯离子,Au3+离子与氯离子形成稳定的AuCl4-离子,使反应2平衡向右移动,则金溶于王水中;
(2)100mL的滤液中含有亚铁离子、铜离子、锌离子,当加入足量的金属Fe以后,会将金属铜全部置换出来,所以生成的3.2g金属是Cu,所以铜离子的浓度c=[n/V]=[0.05mol/0.1L]=0.5 mol/L,亚铁离子和氢氧化钠反应生成氢氧化亚铁,在空气中更易被氧化为氢氧化铁,受热分解生成的氧化铁的质量是4.8g,根据原子守恒,亚铁离子的物质的量是:[4.8g/160g/mol]×2=0.06mol,所以亚铁离子的浓度c=[n/V]=[0.06mol/0.1L]=0.6mol/L,故答案为:0.5;0.6.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用;电解原理.
考点点评: 本题考查有关电解精炼铜、化学平衡移动原理以及物质的含量的测定的综合知识,为高频考点,注意把握实验方法设计与装置的综合分析,题目难度中等.1年前查看全部
- 若要在铁制品表面上镀上一层银,则可选用什么溶液为电解液. 我要解释
 fanga0011年前3
fanga0011年前3 -
 zhangdi2178256 共回答了18个问题
zhangdi2178256 共回答了18个问题 |采纳率94.4%用氯化铁做电解质.首先会是阳极的铁失去电子,成为离子,然后在阴极得到电子生成铁(保留了) 一旦出现沉淀(AgCl),马上停止电解,银也被电解了,马上停止,剩下的就是银了1年前查看全部
- 铅蓄电池在现代生活中有广泛应用,其电极材料是Pb和PbO2,电解液是硫酸溶液.现用铅蓄电池电解饱和硫酸钠溶液一段时间,假
铅蓄电池在现代生活中有广泛应用,其电极材料是Pb和PbO2,电解液是硫酸溶液.现用铅蓄电池电解饱和硫酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法正确的是( )
A.蓄电池放电时,每消耗0.1molPb,共生成0.1mol PbSO4
B.电解硫酸钠溶液时的阳极反应式为:4OH--4e-=2H2O+O2↑
C.电解后,硫酸钠溶液中有晶体析出,但c(Na2SO4)会变小
D.蓄电池放电一段时间后其电解液中H2SO4的浓度、密度都变小 WTYDT1年前1
WTYDT1年前1 -
 子gg 共回答了21个问题
子gg 共回答了21个问题 |采纳率81%解题思路:A、放电是原电池反应,根据电极反应计算;
B、电解硫酸钠溶液实质是电解水;
C、溶液是饱和溶液,电解水后有晶体析出,但温度不变,溶液浓度不变;
D、电解过程中消耗硫酸生成硫酸铅和水;A、负极:Pb-2e-+SO42-=PbSO4,正极:PbO2+2e-+4H++SO4=PbSO4+2H2O,蓄电池放电时,每消耗0.1molPb,转移电子物质的量为0.2mol,正负极生成硫酸铅共生成0.2mol PbSO4,故A错误;
B、电解硫酸钠溶液实质是电解水,阳极反应式为:4OH--4e-=2H2O+O2↑,故B正确;
C、电解饱和硫酸钠溶液后,饱和硫酸钠溶液中有晶体析出,但c(Na2SO4)不变,故C错误;
D、蓄电池放电一段时间后,生成硫酸铅和水,其电解液中H2SO4的浓度变小、密度都变小,故D正确;
故选BD.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池的工作原理,主要是原电池的电极反应,电子守恒应用,饱和溶液电解水后的浓度变化,关键是两个电解生成硫酸铅.1年前查看全部
- 蓄电池液面下降是加蒸馏水还是电解液?
 a2453b15370a31841年前1
a2453b15370a31841年前1 -
 自叹BLUE 共回答了27个问题
自叹BLUE 共回答了27个问题 |采纳率81.5%有的驾驶员对蓄电池电解液下降是选择补充蒸馏水,还是补充电解液犹豫不定,正确的是应补充蒸馏水,不要补充电解液.蓄电池液面下降,是充电时水的电解与水的蒸发导致的.补充电解液应依据地区季节变换,电解液溅出或倒出再定.在检测电解液比重后.才能补充相应密度的电解液.1年前查看全部
- 某电解槽的横截面积为0.5m2,10s内沿相反方向通过某横截面的正、负离子各有10C,则该电解液中的电流为______A
某电解槽的横截面积为0.5m2,10s内沿相反方向通过某横截面的正、负离子各有10C,则该电解液中的电流为______A.
 dfzuo0071年前1
dfzuo0071年前1 -
 kezsheng 共回答了28个问题
kezsheng 共回答了28个问题 |采纳率100%解题思路:在电解槽中,通过某一个横截面的电荷量是正负电荷电荷量绝对值的总和,由此再根据I=qt求电流.根据电流强度的定义式可得10s通过电解槽横截面积的电荷量绝对值之和:
q=10C+10C=20C
所以电解液中的电流为:
I=[20/10]A=2A
故答案为:2点评:
本题考点: 电流、电压概念.
考点点评: 在计算通过电解液的电流强度的大小的时候,一定要注意,电解液中既有正电荷,也有负电荷,通过截面的电荷量的大小为它们的总和,这是经常出错的地方.1年前查看全部
- 精炼铜时,电解液的阳离子浓度为什么减小?
 不怕也得怕1年前3
不怕也得怕1年前3 -
 Honey李易峰 共回答了23个问题
Honey李易峰 共回答了23个问题 |采纳率91.3%阳极是粗铜,其中含有杂质,阳极失去电子的除了Cu,含有杂质中比Cu活泼的Fe、Zn等.
在阴极得到电子的只有Cu2+,所以得到了精铜.
相当于溶液中的部分Cu2+换成了Fe2+、Zn2+,所以电解液的浓度会降低,指的是电解液中Cu2+的浓度减小.1年前查看全部
- 下列叙述正确的是 A.电解饱和食盐水制烧碱采用离子交换膜法,可以阻止阳离子通过 B.在铁上镀锌时,锌棒作阴极,且电解液硫
下列叙述正确的是
A.电解饱和食盐水制烧碱采用离子交换膜法,可以阻止阳离子通过 B.在铁上镀锌时,锌棒作阴极,且电解液硫酸锌的浓度是不变的 C.用惰性电极电解Na 2 SO 4 溶液,阴阳两极产物的物质的量之比为1: 2 D.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH  十月听雨1年前1
十月听雨1年前1 -
 谁也不会ff 共回答了13个问题
谁也不会ff 共回答了13个问题 |采纳率76.9%D
1年前查看全部
- 化学问题,请教各位高手.蓄电池电解液.用36%的纯硫酸和64%水混合成电解液混合物.为什么还是64%的
 qq3939521001年前1
qq3939521001年前1 -
 荷兰巡抚 共回答了18个问题
荷兰巡抚 共回答了18个问题 |采纳率66.7%这个是体积比吧,也叫体积分数1年前查看全部
- 氢氧燃料电池氢气氧气怎么进入电解液?
氢氧燃料电池氢气氧气怎么进入电解液?
不是被多孔金属挡住了么,还怎么进去? 完美jx1年前1
完美jx1年前1 -
 wyblrxwb 共回答了19个问题
wyblrxwb 共回答了19个问题 |采纳率94.7%直接通入就可以了,气体可以从孔中穿过的嘛1年前查看全部
- 原电池中,硝酸做电解液,氢氧根和硝酸根谁失电子
 hasee11年前3
hasee11年前3 -
 cold_hot 共回答了15个问题
cold_hot 共回答了15个问题 |采纳率86.7%这个问题应该没有答案.因为没有给出电极材料、参加反应的物质等条件.
但可以肯定的是,硝酸为电解液的强酸性氛围中,氢氧根浓度本来就小,很难作为反应物提供电子.而有什么氧化剂能强到让硝酸根给电子,我尚未听说.故也不大可能.1年前查看全部
- 电解池中两极为铁和碳棒,电解液可以为纯水吗?
电解池中两极为铁和碳棒,电解液可以为纯水吗?
如果可以,那么生成的沉淀是在两极之间的溶液中生成还是在电极上生成? hxy12121年前3
hxy12121年前3 -
 aa一族 共回答了20个问题
aa一族 共回答了20个问题 |采纳率90%纯水是极弱电解质,理论上是可以,如果你有耐心等上几天到几个月的话````因为铁被氧化,进入溶液,所以电导率会随反应进程而逐渐增大,还是可行的.如果惰性电极电解纯水的话,几百年都有可能.
生成的沉淀在两极之间.1年前查看全部
- 1%硝酸银怎么配置?我是用来用分光光度机做电解液中的Cl的!是不是溶于水啊?要加热什么的吗?
 batatg1年前1
batatg1年前1 -
 zhp0306 共回答了21个问题
zhp0306 共回答了21个问题 |采纳率90.5%是溶于水的,但配制时水中加1ml 1+1 的硝酸溶液1年前查看全部
- 燃料电池的 碱性反应不明白为什么用naOH 在两两个金属能组成原电池 为什么用Nacl溶液做电解液也能组成电池 我们原电
燃料电池的 碱性反应不明白为什么用naOH 在两两个金属能组成原电池 为什么用Nacl溶液做电解液也能组成电池 我们原电池都学完了就这点不明白 哪个朋友要是明白
 三百六十五天1年前4
三百六十五天1年前4 -
 猩猩点灯 共回答了19个问题
猩猩点灯 共回答了19个问题 |采纳率100%燃料电池碱作电解质正极氧气得电子生成氢氧根离子,负极燃料:H2失电子后结合氢氧根生成水.如果是甲烷或甲醇有CO2生成应该继续与OH-反应生成CO32-和水.
用naOH 在两两个金属能组成原电池,一定是因为某一种金属是铝能和碱反应.
用Nacl溶液做电解液也能组成电池 ,应该用金属的电化学腐蚀来解释,你们可能还没学到,把教材往后看几节就会了.学习是有阶段性的,有时学到后边,前面的知识会突然明白,1年前查看全部
- (2010•杭州二模)Li-SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOC
(2010•杭州二模)Li-SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2.电池的总反应可表示为:4Li+2SOCl2=4LiCl+S+SO2 下列说法错误的是( )
A.该电池工作时,正极反应为:2SOCl2+4e-=4Cl-+S+SO2
B.锂电极作该电池负极,负极反应为:Li-e-=Li+
C.该电池工作时,电子通过外电路从正极流向负极
D.该电池组装时,必须在无水无氧条件下进行 jameszhang10101年前1
jameszhang10101年前1 -
 我们他们 共回答了19个问题
我们他们 共回答了19个问题 |采纳率100%解题思路:分析反应的化合价变化,可得Li为还原剂,SOCl2为氧化剂,负极材料为Li(还原剂),发生氧化反应,电极反应式为Li-e-=Li+,正极发生还原反应,电极方程式为:2SOCl2+4e-=4Cl-+S+SO2,因为构成电池的两个主要成份Li能和氧气水反应,且SOCl2也与水反应.A.SOCl2为氧化剂,正极发生还原反应,电极方程式为:2SOCl2+4e-=4Cl-+S+SO2,故A正确;
B.Li为还原剂,为原电池的负极,电极反应式为Li-e-=Li+,故B正确;
C.电池工作时,电子通过外电路从负极流向正极,故C错误;
D.因为构成电池的两个主要成份Li能和氧气水反应,且SOCl2也与水反应,必须在无水无氧条件下进行,故D正确.
故选C.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查原电池知识,题目难度不大,本题注意根据反应的总方程式判断反应的变化为解答该题的关键,答题中注意电极的判断和电极反应式的书写.1年前查看全部
- 我想用这种硫酸 加上蒸馏水做蓄电池的电解液可以吗?可以的话比例是多少?在调制时要注意什么?
 yanhuahaoa1年前3
yanhuahaoa1年前3 -
 sunfai 共回答了18个问题
sunfai 共回答了18个问题 |采纳率83.3%一般来说,不建议自己这样进行配制的,因为蓄电池在充放电时会因为电流工作而温度升高,这样会造成内部水分的流失,而酸的流失量过小.建议用市场上已配好的添加液.而且价格不贵的.
不满意可以追问.望采纳!1年前查看全部
- 铜金合金用途广泛,而且Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等.金稳定性强
铜金合金用途广泛,而且Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等.金稳定性强,常作为首饰.请回答以下问题:
(1)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O△ .Cu+2H2SO4(浓);
CuSO4+SO2↑+2H2O△ .
(2)CuSO4粉末常用来检验一些有机物中的微量水分,其原因是______;SO42-中S原子的杂化轨道类型是______;
(3)元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子最外层电子排布式为______;一种铜金合金晶体具有面心立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为______;该晶体中,原子之间的作用力是______;若该晶体的晶胞边长为a nm,则合金的密度为[0.65a3  求不他1年前0
求不他1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 右图表示一个电解池,电解液ɑ是足量的饱和NaCl溶液,X、Y都是石墨电极,实验开始前,在两边各滴入几滴酚酞试液,则:
 右图表示一个电解池,电解液ɑ是足量的饱和NaCl溶液,X、Y都是石墨电极,实验开始前,在两边各滴入几滴酚酞试液,则:
右图表示一个电解池,电解液ɑ是足量的饱和NaCl溶液,X、Y都是石墨电极,实验开始前,在两边各滴入几滴酚酞试液,则:
(1)X电极上的电极反应式为______,在X极附近观察到的现象是______.
(2)Y电极上的电极反应式为______,若在X电极处收集到标准状况下的气体224mL,则Y电极处生成物的质量为______ g. mcpbv1年前1
mcpbv1年前1 -
 安徽rr 共回答了19个问题
安徽rr 共回答了19个问题 |采纳率94.7%解题思路:(1)依据装置图可知X为电解池阴极,溶液中氢离子得到电子发生还原反应生成氢气,破坏了水的电离平衡,溶液中氢氧根离子浓度增大;
(2)Y电极和电源正极连接是电解池的阳极,溶液中氯离子失电子发生氧化反应失电子生成氯气;依据X电极生成的氢气物质的量计算Y电极生成的氯气;(1)装置图可知X连接电源负极,为电解池阴极,溶液中氢离子得到电子发生还原反应生成氢气,电极反应为:2H++2e-=H2↑,破坏了水的电离平衡,溶液中氢氧根离子浓度增大,酚酞变红色;
故答案为:2H++2e-=H2↑,生成无色气体,X电极附近溶液变红;
(2)Y电极和电源正极连接是电解池的阳极,溶液中氯离子失电子发生氧化反应失电子生成氯气,Y电极上的电极反应式为2Cl--2e-=Cl2↑,若在X电极处收集到标准状况下的气体224mL是氢气,物质的量为0.01mol,依据电子守恒计算得到氯气为0.01mol,生成氯气质量=0.01mol×71g/mol=0.71g;
故答案为:2Cl--2e-=Cl2↑,0.71g;点评:
本题考点: 电解原理.
考点点评: 本题考查电解原理的应用,主要是电极判断,电极反应应用,题目较简单.1年前查看全部
- 电解银生产过程中,电解液中银离子过高,有什么好的方法控制?
 tuntun19831年前1
tuntun19831年前1 -
 武小山 共回答了15个问题
武小山 共回答了15个问题 |采纳率86.7%好办啊!可以向溶液中加入铜或者比银活泼的金属,发生置换反应,之后再除杂除去这种带来的杂质,银离子浓度就降低了1年前查看全部
- 稀硫酸为电解液 白金电极加入10A的电流流动电解时间为64分20秒 阴极生成气体在27度 1atm时是多少升?
稀硫酸为电解液 白金电极加入10A的电流流动电解时间为64分20秒 阴极生成气体在27度 1atm时是多少升?
A2.5 B4.5 C4.9 D9.0 E10 F13
急得很 无限感激 钟吾手心1年前1
钟吾手心1年前1 -
 传说断 共回答了16个问题
传说断 共回答了16个问题 |采纳率100%10A的电流流动电解时间为64分20秒,则电量为38600C,即0.4mol电子.
2H+ +2e-=H2
所以生成0.2molH2,阴极生成气体在27度 1atm时是4.9升1年前查看全部
- 干式荷电蓄电池加入电解液后可以不经充电直接使用对吗,由于蓄电池电解液中有硫酸所以不会再低温下冻结
干式荷电蓄电池加入电解液后可以不经充电直接使用对吗,由于蓄电池电解液中有硫酸所以不会再低温下冻结
以上说的正确 过弯挂5挡1年前1
过弯挂5挡1年前1 -
 liunani 共回答了12个问题
liunani 共回答了12个问题 |采纳率91.7%不对,新电瓶加完水后,至少充电30分钟再使用.1年前查看全部
- AlCl3水溶液作电解液 产物是?
 林清荣bk1年前2
林清荣bk1年前2 -
 宏云苍紫 共回答了16个问题
宏云苍紫 共回答了16个问题 |采纳率81.3%前期主要是CL与H+放电,生成H2和CL2,然后阴极附近会产生OH-,并与AL3+结合生成沉淀.后期CL-消耗完以后就是电解水了,生成氢气和氧气1年前查看全部
大家在问
- 1少而好学,如日出之阳;壮而好学,如日中之光;老而好学,如炳烛之明.英语翻译
- 2用英文翻译那些绿色笔记本大约(about)5美元,(30元)要两种
- 3Physics makes use of mathematics.
- 4当电解液导电时,电解液中的阴阳离子是否会发生氧化还原反应?
- 5少而好学,如日出之阳;壮而好学,如日中之光,老而好学,(
- 6be separated from and lose touch with each
- 7这句话里的with flexible points that moved in rhythm什么意思 尤其是with f
- 8电解液或自来水导电吗?我是说他们具有 自由电子 导电性吗?自由电子流能通过他们吗? 以上 电子 都是指 自由电子
- 9南极大陆属于什么气候
- 10请问水溶性淀粉,水溶性淀粉在50%的乙醇水溶液里面的溶解度是多少?溶液还是透明的吗?
- 11怎样的有机物可以发生取代反应怎样的有机物可以发生加成反应怎样的有机物可以发生消去反应怎样的有机物可以发生水解反应怎样的有
- 12一本书,小冲看了25页,正好是余下页数的7分之5,这本书一共有多少页?
- 1310吨200千克=()吨 0.04千克=()克 34千克60克=()千克
- 143千克60克等于多少千克
- 15小刚看一本书,已经看了全书的七分之三,这时剩下的页数比已看的页数多二十五页.这本书一共有多少页?咋写?

