0族元素原子半径的递变规律如何?和主族元素一样吗?同周期时他们的原子半径是不是最小?
 失得哎2022-10-04 11:39:541条回答
失得哎2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 若若心酸 共回答了14个问题
若若心酸 共回答了14个问题 |采纳率92.9%- 从上到下逐渐增大,和主族元素相同,同周期他们最大,因为他们测的是原子半径,其他的都是共价半径或是金属半径,有电子重合区域,被平分了,而原子半径,电子云空间没有交叠
- 1年前
相关推荐
- 为什么0族元素只能失去2个或4个电子,不能失去8个电子?
为什么0族元素只能失去2个或4个电子,不能失去8个电子?
4楼的,是0族元素,即VIIIA族,不是氧族元素! wangshanlg1年前5
wangshanlg1年前5 -
 clarino 共回答了21个问题
clarino 共回答了21个问题 |采纳率85.7%一二三楼的,尤其是二三楼的,去看看Os元素的化合价,有+8
别那么肯定,尤其是抄袭别人的时候.
至于氧为什么不能有+8,因为它失去六个后,就变成二/八电子稳定结构(和稀有气体的一样,你知道稀有气体很稳定)1年前查看全部
- 0族元素电子排布式0族元素的电子排布式怎么写?
 韩韩19821年前1
韩韩19821年前1 -
 aaa千江月儿 共回答了11个问题
aaa千江月儿 共回答了11个问题 |采纳率100%氦:1s2
氖:1s2 2s2 2p6 或 [He] 2s2 2p6
氩:1s2 2s2 2p6 3s2 3p6 或 [Ne] 3s2 3p6
氪:1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 或 [Ar] 3d10 4s2 4p6
氙:1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6 或 [Kr] 4d10 5s2 5p6
氡:1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 6s2 6p6
· 或 [Xe] 4f14 5d10 6s2 6p61年前查看全部
- 外围电子排布式:是指将过渡元素原子的电子排布式中符合稀有气体的原子的电子排布的部分(原子实)或主族、0族元素的内层电子排
外围电子排布式:是指将过渡元素原子的电子排布式中符合稀有气体的原子的电子排布的部分(原子实)或主族、0族元素的内层电子排布省略后剩下的式子.
 咿哑千年1年前1
咿哑千年1年前1 -
 ff无戒 共回答了17个问题
ff无戒 共回答了17个问题 |采纳率88.2%你按照能量最低原理、保里原理、洪特规则写出过渡元素核外电子排布式的时候,你会发现其中必然有一部分(靠前的较长一串)与某种稀有气体原子的电子排布式完全相同,这部分电子能量很低,不活波,不参与化学反应,所以通常没有必要把它们都罗列出来,只写剩余部分,称为外围电子排布式.前面的一串电子和原子核共同构成所谓的原子实.
过渡元素的次外层有未填满(可以参与化学反应的)能量较高的电子,因此不能像主族或零族原子那样,只保留最外层电子,而应将这些可以参与反应的部分次外层电子也写出来(f区的原子还应写出倒数第三层的部分电子).1年前查看全部
- 下列叙述中正确的是 [ ] A.除0族元素外,短周期元素的最高化合价在数
下列叙述中正确的是 [ ]A.除0族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数
B.除短周期外,其他周期均有18种元素
C.副族元素中没有非金属元素
D.碱金属元素是指ⅠA族的所有元素 cdgjd1年前1
cdgjd1年前1 -
 ygf0725 共回答了24个问题
ygf0725 共回答了24个问题 |采纳率91.7%C1年前查看全部
- 为什么我们将稀有气体元素称为0族元素?
为什么我们将稀有气体元素称为0族元素?
RT 过客2191年前4
过客2191年前4 -
 nara_nj 共回答了12个问题
nara_nj 共回答了12个问题 |采纳率91.7%由于它们的核外电子排布中,最外层电子数为8(氦为2),已经稳定,故常以单质气体存在.化学性质极不活泼,几乎不与其他物质在任何情况发生化学反应.
叫它们为0族,就是最外层电子排布已经稳定的原因.化合价为01年前查看全部
- 如果有第8周期的话,那0族元素是稀有气体还是金属?
如果有第8周期的话,那0族元素是稀有气体还是金属?
我看元素周期表上面金属与非金属分界线是斜的或者阶梯状的,第七周期117号元素是金属,118就是稀有气体了.那假如存在第八周期的话,按照“阶梯分界线”(暂且这么称呼)0族就是金属,但是在0族又都是稀有气体,那么到底应该是什么呢? lxp8881年前1
lxp8881年前1 -
 飞鱼9905 共回答了15个问题
飞鱼9905 共回答了15个问题 |采纳率80%按照阶梯分界线肯定是金属.但是有这么一点,0族元素在任何情况下都是稀有气体.因为他们最外层都是8个电子稳定结构.1年前查看全部
- 除0族元素以外,短周期元素的最高化合价在数值上等于该元素的族序数
 clw35331年前3
clw35331年前3 -
 香草之爱 共回答了18个问题
香草之爱 共回答了18个问题 |采纳率88.9%错误.
比如氟元素只有-1价、0价,最高价是0价,没有+6价.氧元素也没有+6价.1年前查看全部
- 第七周期0族元素的原子序数是多少?
第七周期0族元素的原子序数是多少?
为什么? yuyu12161年前2
yuyu12161年前2 -
 jcw9 共回答了15个问题
jcw9 共回答了15个问题 |采纳率93.3%118
因为第6周期的为86,根据元素周期表的规律,5到6多了32个元素,所以6到7也多了32个元素
所以86+32=1181年前查看全部
- 0族元素是周期中的吗?例如:氦是第一周期中的吗?氖是第二周期中的吗?
 随远1年前4
随远1年前4 -
 农信通 共回答了24个问题
农信通 共回答了24个问题 |采纳率95.8%1.0族元素是周期中的,是惰性气体元素
2.10 18 36 54 86 氦 氖 氩 氪 氙 氡
0族元素由于已经稳定,最外层电子数为8(氦为2),故常以单质气体存在.化学性质极不活泼,除如XeF2等极少数化合物外几乎不与其他物质在任何情况发生化学反应.其中氦、氖没有化合物.
2.氦是第一周期中的,氖是第二周期中的
正确1年前查看全部
- 下列叙述中正确的是( )A.周期表中0族元素的单质常温常压下均为气体B.周期表中含元素种类最多的族为Ⅷ族C.所有主族元
下列叙述中正确的是( )
A.周期表中0族元素的单质常温常压下均为气体
B.周期表中含元素种类最多的族为Ⅷ族
C.所有主族元素均在短周期中
D.第n周期n主族的元素均为非金属元素 南瓜头1年前1
南瓜头1年前1 -
 慕容雨儿 共回答了15个问题
慕容雨儿 共回答了15个问题 |采纳率86.7%解题思路:A.零族元素单质常温下都是气体;
B.ⅢB族中存在锕系元素、镧系元素;
C.第一、二、三为短周期,长周期也包含主族元素;
D.主族元素中金属元素族序数≤周期数,氢元素除外.A.零族元素单质为稀有气体,常温下都是气体,故A正确;
B.ⅢB族中存在锕系元素、镧系元素,ⅢB族含有元素种类最多,故B错误;
C.第一、二、三为短周期,长周期包含部分主族元素、过渡元素、部分零族元素,故C错误;
D.主族元素中金属元素族序数≤周期数,但氢元素除外,故D错误,
故选A.点评:
本题考点: 元素周期表的结构及其应用.
考点点评: 本题考查元素周期表结构及应用,难度不大,注意熟练掌握元素周期表,D选项为易错点,学生容易忽略氢元素.1年前查看全部
- 以1~18号元素和0族元素为例,说明核外电子摆布规律.
 MMyuan1年前2
MMyuan1年前2 -
 煽你两巴掌 共回答了17个问题
煽你两巴掌 共回答了17个问题 |采纳率82.4%H 1 Ne 28
He 2 Na 281
Li 21 Mg 282
Be 22 Al 283
B 23 Si 284
C 24 P 285
N 25 S 286
O 26 Cl 287
F 27 Ar 288
核外电子总数等于原子核内质子数
从内到外一次排布 内层排满才能在外层排列
第一层最多2个 第二层最多8个 第三层最多18个 以此类推1年前查看全部
- 【高一化学】常温下0族元素都是气体?》》》
【高一化学】常温下0族元素都是气体?》》》
如题,判断正误,并且简要说明理由,最好的理由就是举例子说明,0族元素是不是像卤族元素一样,气态》也太》固态? 吴浩然1年前1
吴浩然1年前1 -
 guol000 共回答了21个问题
guol000 共回答了21个问题 |采纳率85.7%0族还是氧族啊?0族话都是稀有气体.氦氖氩氪氙氡.常温都是气体.
氧族.O S As Ti Bi.金属性依次增强啦.常温是 气 固 固 固 固1年前查看全部
- 元素周期表可分为周期和族.其中,0族元素又称作( ) A.稀有气体 B.卤族元素 C.碱金属元素 D.过渡元素
 宝宝爱饭饭1年前1
宝宝爱饭饭1年前1 -
 wongyei 共回答了20个问题
wongyei 共回答了20个问题 |采纳率95%A、稀有气体包含氦、氖、氩、氪、氙、氡,元素处于0族,故A正确;
B、卤族元素包含F、Cl、Br、I、At,故B错误;
C、碱金属包含Li、Na、K、Rb、Cs、Fr,故C错误;
D、过渡元素包含副族元素与第Ⅷ元素,故D错误;
故选A.1年前查看全部
- 稀有气体(0族元素)有哪些?氦(He)、氖(Ne)、氩(Ar)、氪(Kr)、氙(Xe)、氡(Rn)之后的元素是什么?
 xiaotaoyan006a1年前1
xiaotaoyan006a1年前1 -
 风_凌_雪 共回答了19个问题
风_凌_雪 共回答了19个问题 |采纳率89.5%118号元素:Ununoctium(元素符号Uuo)是一种人工合成的化学元素,原子量为293,半衰期12毫秒(千分之一秒).属于气体元素,化学性质很不活泼.属于稀有气体一类.1年前查看全部
- 元素周期表可分为周期和族.其中,0族元素又称作( ) A.稀有气体 B.卤族元素 C.碱金属元素 D.过渡元素
 qinqin84101年前1
qinqin84101年前1 -
 tonyscau 共回答了16个问题
tonyscau 共回答了16个问题 |采纳率100%A、稀有气体包含氦、氖、氩、氪、氙、氡,元素处于0族,故A正确;
B、卤族元素包含F、Cl、Br、I、At,故B错误;
C、碱金属包含Li、Na、K、Rb、Cs、Fr,故C错误;
D、过渡元素包含副族元素与第Ⅷ元素,故D错误;
故选A.1年前查看全部
- 氦 氖 氩 氪 氙 氡 0族元素由于已经稳定,最外层电子数为8(氦为2),故常以单质气体存在 为什么?
氦 氖 氩 氪 氙 氡 0族元素由于已经稳定,最外层电子数为8(氦为2),故常以单质气体存在 为什么?
为什么稳定了就一定以气体存在?
jkrowing2006,我的意思就是“氦 氖 氩 氪 氙 氡 0族元素由于已经稳定,最外层电子数为8(氦为2),故常以单质气体存在”这句话中那个“故”字省略的内容怎么解释一下? hongmeiwodeai1131年前3
hongmeiwodeai1131年前3 -
 shi709394 共回答了14个问题
shi709394 共回答了14个问题 |采纳率92.9%稀有气体原子因为本身是8(氦为2)电子稳定结构,所以不需要通过得失电子形成离子进而形成离子化合物或者通过共有电子对作用形成共价分子来达到稳定,而是形成单原子分子,也就是一个原子就是一个分子.
稀有气体分子(实际上也就是稀有气体原子)与其他分子相比分子较小,分子可视为球形,电子云变形性差,电性引力或者说分子间作用力不强,单质的熔沸点就不高,通常状况下均为气体.1年前查看全部
- 下表是元素周期表的前三周期主族和0族元素区,表中虚线处为ⅡA、ⅢA族的连接处,请用相应的化学用语回答下列问题:
下表是元素周期表的前三周期主族和0族元素区,表中虚线处为ⅡA、ⅢA族的连接处,请用相应的化学用语回答下列问题:
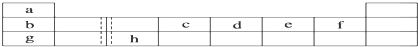
(1)写由仅由e形成的两种带有相同电荷数的阴离子的符号______、______.
(2)d元素名称为______,其双原子分子的电子式为______.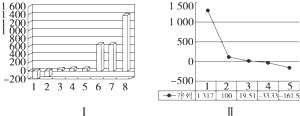
(3)图Ⅰ是表示第三周期8种元素单质的熔点(℃)柱形图,已知柱形“1”代表Ar,则其中柱形“8”代表的是(填化学式)______晶体,1mol该晶体中含有______mol化学键.
(4)b、c、d、e、f的氢化物的沸点(℃)直角坐标图(图Ⅱ)中序列“5”的氢化物的名称是______,空间构型为______;序列“2”的氢化物的结构式是______,属于______(填“极性”或“非极性”)分子. umika20081年前1
umika20081年前1 -
 syh3068 共回答了18个问题
syh3068 共回答了18个问题 |采纳率88.9%解题思路:根据元素在周期表中的位置,可知a为H,b为Li,c为C,d为N,e为O,f为F,g为Na,h为Al,
(1)由氧元素形成的两种带有相同电荷数的阴离子为氧离子、过氧根离子;
(2)氮气分子中N原子之间形成3对共用电子对,且N原子含有1对孤对电子;
(3)第三周期8种元素单质的熔点最高的为原子晶体Si,Si晶体中每个Si与成4个Si-Si键,每个Si-Si键为1个Si原子提供[1/2];
(4)b、c、d、e、f的氢化物中,沸点最高为离子化合物LiH,水的沸点为100℃,序列“2”为水,HF分子之间、氨气分子之间都存在氢键,沸点比较甲烷高,沸点最低的为甲烷.根据元素在周期表中的位置,可知a为H,b为Li,c为C,d为N,e为O,f为F,g为Na,h为Al,
(1)由氧元素形成的两种带有相同电荷数的阴离子为O2-、O22-,
故答案为:O2-、O22-;
(2)d为氮元素,氮气分子中N原子之间形成3对共用电子对,且N原子含有1对孤对电子,其电子式为,
故答案为:氮;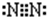 ;
;
(3)第三周期8种元素单质的熔点最高的为原子晶体Si,Si晶体中每个Si与成4个Si-Si键,每个Si-Si键为1个Si原子提供[1/2],故1mol该晶体中含有Si-Si键1mol×4×[1/2]=2mol,
故答案为:Si;2;
(4)序列“5”的氢化物的沸点最低为甲烷,分子为正四面体结构,序列“2”为水,其结构式为H-O-H,为V型结构,正负电荷重心不重合,为极性分子,
故答案为:甲烷;正四面体;H-O-H;极性.点评:
本题考点: 元素周期律和元素周期表的综合应用;极性键和非极性键;极性分子和非极性分子.
考点点评: 本题考查元素周期表与元素周期律的综合应用,难度中等,(3)为易错点,注意晶体硅的结构,利用均摊法计算.1年前查看全部
- “第三周期元素原子的半径从左到右逐渐减小” 考不考虑0族元素?
“第三周期元素原子的半径从左到右逐渐减小” 考不考虑0族元素?
下列说法正确的是( )
A IA族元素的失电子能力比IIA族元素的强
B VIA族元素的氢化物中,稳定性最好的其沸点也最高
C 同周期非金属氧化物对应的水化物的酸性从左到右依次增强
D 第三周期元素原子的半径从左到右逐渐减小 klfqj1年前5
klfqj1年前5 -
 农药1605 共回答了16个问题
农药1605 共回答了16个问题 |采纳率93.8%第三周期元素原子的半径从左到右逐渐减小” 不考虑0族元素.
这种规律只是用于主族元素,对于0族元素不适用的.
选B
A错,同周期的IA族元素的失电子能力比IIA族元素的强,但并不是所有IA族元素的失电子能力比IIA族元素的强,如Ca>Li
B对,VIA族元素的氢化物中,稳定性最好的是H2O,沸点最高,因为含有氢键
C错,应该是【最高价氧化物的水化物】
D错,0族元素不算.1年前查看全部
- 0族元素是主族元素还是副族元素啊
 余生不作孽1年前1
余生不作孽1年前1 -
 我马维骆 共回答了30个问题
我马维骆 共回答了30个问题 |采纳率90%有一个口诀:七个周期分长短,
三短三长一不全;
十八纵行十六族,
七主七副八和零.
从口诀就可以看出,第八族和零族都既不是主族也不是副族.
不要以为元素周期表只分为主族和副族啊1年前查看全部
- 元素周期表中0族元素的第一电离能是零么
元素周期表中0族元素的第一电离能是零么
印象当中好像看过 规定0族的第一电离能是 0 像是 幻觉 谁能 给我确定的 三ke1年前3
三ke1年前3 -
 特爱看超女 共回答了16个问题
特爱看超女 共回答了16个问题 |采纳率87.5%不可能.如果第一电离能是0,意味着不需要能量就会有一个电子脱离原子核的束缚.可是如果真的是那样,那么这个电子根本就不能认为属于这个原子,因为原子核对它没有引力可言.那么又何来电离这种说法.所以任何原子的第一电离能不可能是0.0族的第一电离能很大.
那个之所以叫做0族,估计是因为化合价一般都是0.也就是以单质形态存在.当然,其实是可以反应的,但是化合物种类很少.1年前查看全部
大家在问
- 1已知多项式x的三次方+kx+6能被x+2整除,求k的值.
- 2几米增加五分之一等于五?
- 3已知x的3次方+kx+6能被x+2整除,求k的值
- 4已知多项式X^4-X^3+KX^2+X-6,能被x-1整除,求K的值和商式
- 5初三圆弧面积公式
- 6完全燃烧4.2克的焦炭可以放出多少热量
- 721个相同的铁圆锥,可以熔铸成( )个和他们等底等高的圆柱.
- 899分之8乘98怎样简便算
- 9怎样判断两种量成正比例还是反比例
- 10地球上的地震带为什么这样分布?
- 11我现在要做一个可以装2.5吨水的圆桶,它的直径和高是多少?公式是?
- 12一个圆桶直径68厘米高252厘米能装多少水
- 13一个高66厘米直径32厘米的圆桶能装多少公斤水
- 14一支长1的蜡烛,底部插入一块铁片后使其能直立漂浮在水中,露出水面部分的长度是h.已点燃蜡烛到遇水自然熄灭,蜡烛被燃烧的长
- 15△ABC≌△ADE,∠BAE=88°,∠CAD=26°,求∠DAE的度数
