黄铜是铜和锌的合金,可以用来制造机器、电器零件及日常用品.为了测定某黄铜样品中铜的质量分数,取10
 zhangfenfen_19822022-10-04 11:39:541条回答
zhangfenfen_19822022-10-04 11:39:541条回答克该样品粉末粉碎,加到50克稀盐酸中,恰好完全反应,测得剩余固体质量为3.5克计算 (1)黄铜样品中铜质量分数 (2)稀硫酸中溶质质量分数

已提交,审核后显示!提交回复
共1条回复
 vscrash 共回答了19个问题
vscrash 共回答了19个问题 |采纳率89.5%- 很简单,把化学方程式写出来咯1,要学会自主学习
- 1年前
相关推荐
- 急!化学计算题(初三的)黄铜是铜(Cu)与锌(Zn)的合金.取黄铜样本16.25克与烧杯里充足的稀硫酸(H2SO4)反应
急!化学计算题(初三的)
黄铜是铜(Cu)与锌(Zn)的合金.取黄铜样本16.25克与烧杯里充足的稀硫酸(H2SO4)反应.反应前,烧杯与稀硫酸的质量是85克,反应后烧杯与物质的质量是101.11克.求合金中铜的质量比.(详细的过程) sqi33331年前3
sqi33331年前3 -
 yx900210 共回答了22个问题
yx900210 共回答了22个问题 |采纳率90.9%16.25+85=101.25克 相对剩下的总质量101.11克,减少的0.14克是跑走的氢气的质量.因为Cu的金属活动性比H弱,所以它置换不出氢气,也就是Cu不与稀硫酸反应的.利用化学方程式Zn+H2SO4==ZnSO4+H2 可以计算出Zn 的质量了.题目求Cu 的质量,再减去下就得了.1年前查看全部
- 0.5厚的黄铜每平方米多重啊
 0516_V1年前2
0516_V1年前2 -
 寻找影子 共回答了23个问题
寻找影子 共回答了23个问题 |采纳率87%黄铜密度8.9g/cm3,
你说的0.5是cm吧
M=0.5*100*100*8.9=44500g 44.5KG
如果是mm 重量 4.45KG1年前查看全部
- 一质量为20g的黄铜样品(铜、锌混合物),与足量稀硫酸反应,放出0.2g氢气,则溶液的质量为
 hpp551年前2
hpp551年前2 -
 flighttt 共回答了13个问题
flighttt 共回答了13个问题 |采纳率100%根据原子质量守恒,溶液的质量=20g+稀硫酸的质量-0.2g
如果是AmL密度为Bg/mL的稀硫酸那就是(20g+A*Bg-0.2g)1年前查看全部
- 16g黄铜加入100g稀硫酸恰好完全反应,烧杯内物质的总质量为115.6g.求:
16g黄铜加入100g稀硫酸恰好完全反应,烧杯内物质的总质量为115.6g.求:
所得溶液中溶质的质量分数 cycmarketing1年前1
cycmarketing1年前1 -
 r09kp813 共回答了21个问题
r09kp813 共回答了21个问题 |采纳率100%黄铜是铜锌合金
Zn + H2SO4 = ZnSO4 + H2
65 98 161 2
烧杯内物质总量为115.6克,比之前减少了0.4克,即生成了0.4克的H2
根据化学方程式可以算出
黄铜中有锌13g,有铜3g,生成的硫酸锌为32.2g
溶质的质量分数为32.2/(115.6-3)=28.6%1年前查看全部
- 为什么黄铜片与紫铜片相互刻划后在紫铜片上有明显的划痕
 tangzhu1年前3
tangzhu1年前3 -
 xihuanxiaos 共回答了20个问题
xihuanxiaos 共回答了20个问题 |采纳率100%黄铜的硬度比紫铜大
紫铜为纯铜,硬度小
黄铜为铜锌合金,硬度大.1年前查看全部
- 一道关于比的应用题有一种黄铜是由铜和锌按5:6熔制而成的,现在再加入10克,从而得新合金154克.求黄铜中含铜多少克?
 为爱等待一生1年前1
为爱等待一生1年前1 -
 xinyi2065 共回答了26个问题
xinyi2065 共回答了26个问题 |采纳率96.2%是指现在的黄铜里的铜吗?是70克1年前查看全部
- 白铜、黄铜和紫铜的区别是什么?
 advenire1年前1
advenire1年前1 -
 wzh-h 共回答了12个问题
wzh-h 共回答了12个问题 |采纳率75%白铜是铜镍合金
黄铜是铜锌合金
紫铜是纯铜
它们的外观、密度和熔点都不同1年前查看全部
- 1.黄铜是铜和锌的合金.为了确定某黄铜样品中的铜的质量分数,取10g该黄铜样品加入到50g稀硫酸中,恰好完全反映,产生氢
1.黄铜是铜和锌的合金.为了确定某黄铜样品中的铜的质量分数,取10g该黄铜样品加入到50g稀硫酸中,恰好完全反映,产生氢气0.2g.求:
(1)黄铜样品中铜的质量分数 (2)原稀硫酸溶液中的溶液的质量分数
2.据报道,在通入空气并加热的条件下,铜于稀硫酸反应转化为硫酸铜
(1)该反应的反应化学方程式 :2Cu+2H2So4+O2=2CuSo4+( )
(2)稀硫酸溶质的质量分数为20%,用100ml的98%的浓硫酸(密度:1.84gcm3)配置该稀硫酸,需加水多少ml?
(3)取一定量上述稀释后的硫酸(其中含溶质98%)于铜恰好完全反应,假设硫酸不和其他杂质反应,则反应后硫酸铜的质量是多少? cipinger1年前1
cipinger1年前1 -
 jngo 共回答了18个问题
jngo 共回答了18个问题 |采纳率88.9%2(1)2H2O:这题要用到高中知识,你先了解一下.因为氢离子的氧化性不够强,无法将铜氧化到2价,所以只能是氧气作为氧化剂,生成-2价的氧离子,与氢离子结合成水分子.你也可以根据原子守恒来推,这在题目中帮你配平的情况下还是可以使用的.
(2)根据溶质的质量守恒,可得
m浓硫酸w=m稀硫酸w(w为溶质质量分数)
100ml×1.84g/cm³×98%=m稀硫酸×20%
然后解出稀硫酸质量,再减去浓硫酸质量,就可求得加水的质量,具体我就不算了,你自己按计算器吧
(3)由于反应过后铜全部转化为硫酸铜,所以
mCu/硫酸铜中铜的质量分数=硫酸铜质量
同样你就自己算吧,我这不方便
最后,采纳一下吧,我打这么累
对了,第一题已经有人解答了,我就不多事了
还有什么不懂的可以来问我1年前查看全部
- 一种黄铜是由锌和铜按3:7熔铸而成的.生产这种黄铜100吨,需要锌多少吨?
 internetcom1年前1
internetcom1年前1 -
 优选网 共回答了17个问题
优选网 共回答了17个问题 |采纳率82.4%解题思路:由题意可知:锌的含量占黄铜含量的[3/3+7],把黄铜的重量看作单位“1”,根据一个数乘分数的意义,用乘法解答即可.3+7=10,
100×[3/10]=30(吨);
答:需要锌30吨.点评:
本题考点: 按比例分配应用题.
考点点评: 此题主要考查按比例分配应用题的特点:已知两个数的比(三个数的比),两个数的和(三个数的和),求这两个数(三个数),用按比例分配解答.1年前查看全部
- 你说黄铜与稀盐酸反应,但是在现实中.却不同稀盐酸反应.请问为什么?
 8天边81年前1
8天边81年前1 -
 lgj52007 共回答了17个问题
lgj52007 共回答了17个问题 |采纳率94.1%纯铜是不会和稀盐酸反应的,黄铜不是单质,是合金,里面应该有能和盐酸反应的金属,钾,钙、钠、镁、铝、锌、铁、锡、铅,这些就能反应1年前查看全部
- 1.45克黄铜(铜、锌合金)跟足量的盐酸反应,工放出0.02克氢气,黄铜中含锌百分之几?
 icerainer1年前1
icerainer1年前1 -
 as1g 共回答了16个问题
as1g 共回答了16个问题 |采纳率93.8%解,设锌的质量为xg
Zn+2HCl======ZnCl2+H2↑
65 2
x 0.02g
所以锌的质量为0.65g
所以Zn%=0.65g/1.45g=44.8%1年前查看全部
- 在红磷和白磷、氧气和溴气、铜和黄铜、石墨和金刚石中,哪一组与其他组不同?
 gvjncx1年前6
gvjncx1年前6 -
 RJAOIEN 共回答了15个问题
RJAOIEN 共回答了15个问题 |采纳率93.3%要看你是要哪方面的,为了方便我把这四组列为一二三四,四组 .二组与其它不同原因是为气体,是双分子单质,两者不含相同的元素.或者是三组不同原因是为金属,两者中有混合物.1年前查看全部
- (2007•江西)为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品10g,向其中逐滴加入9.8%的稀硫酸至刚
 (2007•江西)为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品10g,向其中逐滴加入9.8%的稀硫酸至刚好不再产生气体为止.反应过程中生成的气体与所用硫酸溶液的质量关系如图所示.试计算:
(2007•江西)为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品10g,向其中逐滴加入9.8%的稀硫酸至刚好不再产生气体为止.反应过程中生成的气体与所用硫酸溶液的质量关系如图所示.试计算:
(1)样品中铜的质量分数;
(2)反应所消耗的硫酸溶液质量;
(3)反应后所得溶液的溶质的质量分数. 倾心聆听1年前1
倾心聆听1年前1 -
 haidaoxu 共回答了24个问题
haidaoxu 共回答了24个问题 |采纳率100%解题思路:根据锌与硫酸反应的化学方程式,由图中最多生成的氢气质量0.10g,可以计算出:(1)参加反应的锌的质量,进而计算出样品中铜的质量分数;(2)参加反应的硫酸的质量,进而计算出硫酸溶液的质量;(3)生成硫酸锌的质量,进而计算出所得硫酸锌溶液的溶质质量分数.设样品中铜的质量分数为x;
消耗硫酸溶液的质量为y;
生成硫酸锌的质量为z.
Zn+H2SO4=ZnSO4+H2↑
65 98 161 2
10g(1-x) y×9.8% z 0.10g
(1)[65/2]=
10g×(1−x)
0.10g,x=67.5%
(2)[98/2]=[y×9.8%/0.10g],y=50g
(3)[161/2]=[z/0.10g],z=8.05g
所得溶液的溶质质量分数为:
8.05g
10g×(1−67.5%)+50g−0.10g×100%≈15.1%
答:(1)样品中铜的质量分数为67.5%;
(2)消耗硫酸溶液的质量为50g;
(3)所得溶液的溶质质量分数为15.1%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算;金属活动性顺序及其应用.
考点点评: 本题主要考查有关化学方程式的计算和质量分数的计算,难度较大.计算所得溶液质量时,要注意:①不能把铜的质量计算在所得溶液中;②不能把生成氢气的质量计算在所得溶液中.1年前查看全部
- 黄铜是铜和锌的合金,在20g黄铜样品中加入足量稀盐酸使其完全反应,生成氢气0.2g,求样品中铜的质量.
 seabeachking28861年前3
seabeachking28861年前3 -
 金斯沃 共回答了23个问题
金斯沃 共回答了23个问题 |采纳率95.7%解题思路:位于H前面的金属能置换出盐酸、稀硫酸中的氢(除浓硫酸、硝酸外),Cu的活动性在(H)后,故不能和稀盐酸发生反应.只有锌和稀盐酸发生了反应.根据化学方程式即可计算出黄铜中锌的质量,进而计算出铜的质量.设生成0.2g氢气,需锌的质量为X,
Zn+2HCl═ZnCl2+H2↑
65 2
X 0.2g
∴65:2=x:0.2g,
解之得:x=6.5g,
铜的质量=20g-6.5g=13.5g.
答:铜的质量为13.5g.点评:
本题考点: 根据化学反应方程式的计算;金属活动性顺序及其应用.
考点点评: 此题通过对生活实践中的具体问题,考查了运用活动性顺序等基础知识解决实际问题的能力以及对实际问题进行分析综合的能力,理解有关规律:金属与酸、盐溶液发生置换反应的条件,Zn与酸、盐溶液发生置换反应时,生成物中Zn显+2价,金属与混合盐溶液反应的优先置换原理.1年前查看全部
- 为测定某黄铜样品中铜的质量分数,现取10克该样品粉碎,加入到50克稀硫酸中,恰好完全反应测得剩余固体质量
为测定某黄铜样品中铜的质量分数,现取10克该样品粉碎,加入到50克稀硫酸中,恰好完全反应测得剩余固体质量
测得剩余固体质量为3.5克 求稀硫酸中溶质的质量分数.黄铜样品中的铜的质量分数 冷风雪1年前1
冷风雪1年前1 -
 wuyin27 共回答了20个问题
wuyin27 共回答了20个问题 |采纳率90%10g-3.5g=6.5g
Zn + H2SO4 === ZnSO4 + H2↑
65 98
6.5g x
65/98=6.5g/x
x=9.8g
稀硫酸中溶质的质量分数 9.8g/50g*100%=19.6%.
黄铜样品中的铜的质量分数 3.5g/10g*100%=35%1年前查看全部
- (2011•湖北)向16g黄铜(由锌、铜形成的合金)样品中加入稀硫酸充分反应,所加稀硫酸与生成气体的质量关系如图所示.
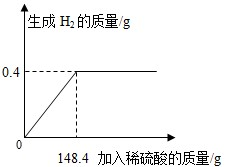 (2011•湖北)向16g黄铜(由锌、铜形成的合金)样品中加入稀硫酸充分反应,所加稀硫酸与生成气体的质量关系如图所示.
(2011•湖北)向16g黄铜(由锌、铜形成的合金)样品中加入稀硫酸充分反应,所加稀硫酸与生成气体的质量关系如图所示.
求:
(1)样品中锌的质量.
(2)恰好完全反应时,所得溶液中溶质的质量分数. xucheng99331年前1
xucheng99331年前1 -
 salesman2 共回答了21个问题
salesman2 共回答了21个问题 |采纳率95.2%解题思路:本题涉及的反应Zn+H2SO4═ZnSO4+H2↑,图象为充分反应所生成氢气的质量随加入稀硫酸质量的变化情况.根据曲线可确定加入148.4g稀硫酸时与锌恰好完全反应放出0.4g氢气,运用化学方程式由氢气质量计算参加反应锌的质量及生成硫酸锌的质量,最后由质量守恒定律计算反应后所得溶液质量,完成所得溶液中溶质的质量分数的计算.设样品中锌的质量为x,生成硫酸锌的质量为y.由图分析可知产生氢气0.4g.
Zn+H2SO4═ZnSO4+H2↑
65 161 2
x y 0.4g
[65/x]=[2/0.4g] x=13g
[161/y]=[2/0.4g] y=32.2g
恰好完全反应时,所得溶液中溶质的质量分数=[32.2g/13g+148.4g−0.4g]×100%=20%
答:(1)样品中锌的质量为13g;(2)所得硫酸锌溶液中溶质的质量分数为20%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 解答此类问题的根本点在于对反应图象的曲线进行分析,曲线的折点表示此时恰好完全反应.1年前查看全部
- 黄铜是铜和锌的合金,在20g黄铜样品中加入足量稀盐酸使其完全反应,生成氢气0.2g,求样品中铜的质量.
 bernie11221年前2
bernie11221年前2 -
 jqq790913 共回答了15个问题
jqq790913 共回答了15个问题 |采纳率86.7%解题思路:位于H前面的金属能置换出盐酸、稀硫酸中的氢(除浓硫酸、硝酸外),Cu的活动性在(H)后,故不能和稀盐酸发生反应.只有锌和稀盐酸发生了反应.根据化学方程式即可计算出黄铜中锌的质量,进而计算出铜的质量.设生成0.2g氢气,需锌的质量为X,
Zn+2HCl═ZnCl2+H2↑
65 2
X 0.2g
∴65:2=x:0.2g,
解之得:x=6.5g,
铜的质量=20g-6.5g=13.5g.
答:铜的质量为13.5g.点评:
本题考点: 根据化学反应方程式的计算;金属活动性顺序及其应用.
考点点评: 此题通过对生活实践中的具体问题,考查了运用活动性顺序等基础知识解决实际问题的能力以及对实际问题进行分析综合的能力,理解有关规律:金属与酸、盐溶液发生置换反应的条件,Zn与酸、盐溶液发生置换反应时,生成物中Zn显+2价,金属与混合盐溶液反应的优先置换原理.1年前查看全部
- 求你了,黄铜是Cu和Zn的合金,课取10g黄铜样品放入烧杯,滴入稀硫酸至不再产生气泡时,测得消耗了稀硫酸30g,烧杯里剩
求你了,
黄铜是Cu和Zn的合金,课取10g黄铜样品放入烧杯,滴入稀硫酸至不再产生气泡时,测得消耗了稀硫酸30g,烧杯里剩余固体质量6.1g,请回答:{1}测定过程中发生反应的化学方程式是_____{2}烧杯中剩余固体的成分为____;黄铜样品中Cu的质量分数为____.{3}求反应后烧杯中所得溶液的质量.【题目简化了,】 ahl00111年前1
ahl00111年前1 -
 意-悠然 共回答了14个问题
意-悠然 共回答了14个问题 |采纳率85.7%(1)Zn+H2SO4=ZnSO4+H2,氢气加气体符号,(2)Cu,6.1/10=61%,(3)(10-6.1)*2/65=0.12g(氢气)结果是:10+30-0.12-6.1=33.78g1年前查看全部
- (9分)黄铜(由锌和铜形成的合金)有较强的耐磨性能,在生活中有广泛的用途。晓军同学为了测定黄铜屑样品组成,分四次取样品与
(9分)黄铜(由锌和铜形成的合金)有较强的耐磨性能,在生活中有广泛的用途。晓军同学为了测定黄铜屑样品组成,分四次取样品与稀硫酸反应,其实验数据记录如下表:
1 2 3 4 样品质量/g 25.0 25.0 25.0 30.0 稀硫酸质量/g 80 100 120 100 产生气体质量/g 0.4 0.5 0.5 0.5
计算:
(1)黄铜样品(25.0g)中锌的质量
(2)所用稀硫酸中溶质质量分数 zzfe1年前0
zzfe1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 下列材料中,属于复合材料的是( ) A.碳纤维 B.聚乙烯塑料 C.黄铜 D.天然橡胶
 价值cc6661年前1
价值cc6661年前1 -
 ghghggfg 共回答了19个问题
ghghggfg 共回答了19个问题 |采纳率94.7%A、碳纤维是由有机纤维经碳化及石墨化处理而得到的微晶石墨材,是复合材料;故正确.
B、聚乙烯塑料是有机高分子合成材料,故不是复合材料.
C、黄铜是金属材料合金,故不选.
D、橡胶是有机高分子物质不属于复合材料;故不选;
故选A1年前查看全部
- 铅黄铜Hpb59-压延铜是什么材料?与Hpb59-1,Hpb59-2,Hpb59-3有什么区别
 鱼网袜1年前1
鱼网袜1年前1 -
 zjjun24 共回答了18个问题
zjjun24 共回答了18个问题 |采纳率88.9%6663
+5132
56
3
.
65+96+
32
26
3
6+6++62
3
6+635686565686156 5345+
53353
543535
3536
53
5
35
333333333
3
3
3
33
3
3
3
3
33
3
3
3
3
3
3
3
33
3
333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333333331年前查看全部
- 10克黄铜加入装有100克稀硫酸的烧杯中,假定反应物完全,待不再产生气泡时杯中质量减少0.2克 计算(1)黄铜中铜的质量
10克黄铜加入装有100克稀硫酸的烧杯中,假定反应物完全,待不再产生气泡时杯中质量减少0.2克 计算(1)黄铜中铜的质量分数(2)100克稀硫酸中溶质硫酸质量为 溶剂水质量为 (3)反应后所得溶液中溶质质量为 溶剂质量为 溶液质量为
 susanhenry09141年前0
susanhenry09141年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 初三化学题目,求解,写过程“黄铜”是铜锌合金,具有较机械性能,比纯铜耐腐蚀,街头许多“金色”饰品就是用它来制作的.现取2
初三化学题目,求解,写过程
“黄铜”是铜锌合金,具有较机械性能,比纯铜耐腐蚀,街头许多“金色”饰品就是用它来制作的.现取20.0g某种黄铜投入154.7g某浓度的稀硫酸中,完全反应后剩余的溶液和参与固体总质量为174.5g.请计算:
1.产生氢气的质量为多少g
2.这种黄铜中铜的质量分数为多少
3.剩余溶液中溶质的质量分数是多少?写出计算过程,结果精确到0.1%
某同学在实验室用含碳酸钙80%的石灰石和溶质质量分数为10%的稀盐酸恰好完全反应制取8.8g二氧化碳(杂质不与盐酸反应).问:
1.他需取用这种石灰石多少克?
2.所用10%的稀盐酸多少克?
3.反应后溶液中溶质质量分数?
金属钠跟硫酸铜溶液发生如下反应:2Na+2H2O+CuSO4=Na2SO46Cu(OH)2↓+H2↑,向73.7g硫酸铜溶液中加入2.3g钠,恰好反应完全(溶剂水有剩余).试计算:
1.得到的沉淀是纯净物的Cu(OH)2,它的质量是多少?
2.生成氢气的质量是多少?
3.反应停止后,滤去沉淀,所得溶液中溶质的质量分数是多少?
 stevenjing1年前1
stevenjing1年前1 -
 zhou827 共回答了22个问题
zhou827 共回答了22个问题 |采纳率90.9%“黄铜”是铜锌合金,具有较机械性能,比纯铜耐腐蚀,街头许多“金色”饰品就是用它来制作的.现取20.0g某种黄铜投入154.7g某浓度的稀硫酸中,完全反应后剩余的溶液和参与固体总质量为174.5g.请计算:
1.产生氢气的质量为多少g
20+154.7-174.5=0.2g
2.这种黄铜中铜的质量分数为多少
2 65
--- = ---
0.2 x
X=6.5g
C%=(20-6.5)/20=67.5%
某同学在实验室用含碳酸钙80%的石灰石和溶质质量分数为10%的稀盐酸恰好完全反应制取8.8g二氧化碳(杂质不与盐酸反应).问:
1.他需取用这种石灰石多少克?
44/8.8=100/x
X=20g
20/80%=25G
2.所用10%的稀盐酸多少克?
44/8.8=2X36.5/Y
Y=14.6G
14.6/10%=146G
3.反应后溶液中溶质质量分数?
44/8.8=111/Z
Z=22.2G
C=22.2/(25+146-8.8)=13.687%
金属钠跟硫酸铜溶液发生如下反应:2Na+2H2O+CuSO4=Na2SO4+Cu(OH)2↓+H2↑,向73.7g硫酸铜溶液中加入2.3g钠,恰好反应完全(溶剂水有剩余).试计算:
1.得到的沉淀是纯净物的Cu(OH)2,它的质量是多少?
2X23/2.3=98/X
X=4.9G
2.生成氢气的质量是多少?
2X23/2.3=2/X
X=0.1G
3.反应停止后,滤去沉淀,所得溶液中溶质的质量分数是多少?
2X23/2.3=142/X
X=7.1G
C=7.1/(73.7+2.3-4.9-0.1)=10%1年前查看全部
- 使用真空镀怎样才能得到水电镀黄铜效果
 makeyjw1年前1
makeyjw1年前1 -
 hnplgg 共回答了23个问题
hnplgg 共回答了23个问题 |采纳率78.3%答:镀氮化钛.1年前查看全部
- 材料六角黄铜,对边14,长55毫米.求重量及价格?详细计算公式,谢谢!直径10毫米的黄铜,长12毫米,重量价
 百变小樱5101年前1
百变小樱5101年前1 -
 姜伟利 共回答了16个问题
姜伟利 共回答了16个问题 |采纳率81.3%0
0.00736*14*14*0.055=0.081年前查看全部
- 取20克黄铜样品于烧杯中,向其中分5次加入相同溶质质量分数的稀硫酸,使之充分反映.每次所用的稀硫酸的质量及剩余固体的质量
取20克黄铜样品于烧杯中,向其中分5次加入相同溶质质量分数的稀硫酸,使之充分反映.每次所用的稀硫酸的质量及剩余固体的质量记录于下表.
加入稀硫酸的质量(g) 充分反映后剩余固体的质量(g)
第一次 20 17.4
第二次 20 14.8
.20 12.2
.20 12.0
.20 M
M的值?
黄铜样品中锌的质量分数为?
所用稀硫酸中硫酸的质量分数是多少? caxli1年前1
caxli1年前1 -
 wqzsscc 共回答了19个问题
wqzsscc 共回答了19个问题 |采纳率84.2%1、根据已知数据的变化规律,可判断最后剩余铜12克,所以锌质量为17.4-12=5.4克,质量分数为5.4÷17.4×100%=31%;
2、由于每次加入硫酸20ml,而对应的锌消耗量为2.6克,所以锌物质的量为0.04mol,由反应式Zn + H2SO4===ZnSO4 + H2↑,所以硫酸的质量为0.04×96=3.84克,所以质量分数为3.84÷20×100%=19.2%.1年前查看全部
- 黄铜是CU和ZN合金,可用于制作各种仪器零件.为测定黄铜的组成,课外活动小组的同学取黄铜样品10g放入烧杯
黄铜是CU和ZN合金,可用于制作各种仪器零件.为测定黄铜的组成,课外活动小组的同学取黄铜样品10g放入烧杯
中,滴入稀硫酸至不再产生气泡时,测得消耗了稀硫酸100g,烧杯中剩余固体质量3.5g.(1)测定过程中发生的化学方程式为
(2)烧杯中剩余固体的成分为-----;黄铜样品中Cu的质量分数-----
(3)求2反应后烧杯中所得溶液的质量 fei191年前1
fei191年前1 -
 0000100 共回答了20个问题
0000100 共回答了20个问题 |采纳率90%1.Zn+H2SO4=ZnSO4+H2↑
2.Cu,35%(3.5/10*100%=35%)
3.106.3g
Zn的质量为10-3.5=6.5g,设反应生成H2的质量为x.
Zn+H2SO4=ZnSO4+H2↑
65 2
6.5g x
65/6.5=2/x
x=0.2g
反应后溶液的质量是6.5+100-0.2=106.3g1年前查看全部
- Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种电器零件和日用品.某化学兴趣小组的同学为了测定某黄铜样品中
Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种电器零件和日用品.某化学兴趣小组的同学为了测定某黄铜样品中锌的质量分数,将150g稀硫酸分三次加入到50g黄铜样品中,每次充分反应后,测定生成氢气的质量,实验数据见下表:
请回答下列问题:第一次 第二次 第三次 加入稀硫酸的质量(g) 50 50 50 生成氢气的质量(g) 0.4 m 0.2
(1)m=______;
(2)该黄铜样品中锌的质量分数为______;
(3)所用稀硫酸中溶质的质量分数为______. 维娜斯1年前1
维娜斯1年前1 -
 yunhai6688 共回答了26个问题
yunhai6688 共回答了26个问题 |采纳率84.6%解题思路:根据金属活动顺序表可知铜和锌的合金中只有锌能与硫酸反应生成氢气;由表格数据可知第三次加50g稀硫酸时,锌已经反应完全,总共收集到氢气为三次之和;再根据化学方程式,利用氢气的质量求出锌的质量,然后再求出合金中铜的质量分数.(1)根据表格可以发现,第一次加入50g硫酸生成0.4g氢气,第三次加入50g硫酸还能生成并且只生成0.2g氢气,说明直到第三次反应才结束,并且硫酸有剩余(按照比例,正好剩余一半);同时说明第二次加入50g硫酸时完全反应,生成氢气的质量可按照第一次的数量关系(50g对应0.4g)类推,而得出m为0.4g.
故答案为:0.4;
(2)根据表格可知,共生成氢气的质量为1.0g,设需要锌的质量为x,则有
Zn+H2SO4=ZnSO4+H2↑
65 2
x 1.0g
[65/x]=[2/1g]
x=32.5g
所以此黄铜样品中锌的质量分数为:[32.5g/50g]×100%=65%.
(3)设硫酸的质量分数是y
Zn+H2SO4=ZnSO4+H2↑
98 2
50g×y0.4g
[98/2]=[50g×y/0.4g]
y=39.2%
故答案为:39.2%点评:
本题考点: 金属活动性顺序及其应用;有关溶质质量分数的简单计算.
考点点评: 本题以信息的方式来考查合金中金属与酸的反应及合金中金属质量分数的计算,学生应能利用表格进行数据分析和应用,要注意利用化学方程式计算的格式规范.1年前查看全部
- 一种黄铜是由锌和铜按3:7熔炼而成,生产这种黄铜160吨,需要锌和铜各多少吨?
 幸福的妞妞1年前1
幸福的妞妞1年前1 -
 tomzeng75712 共回答了19个问题
tomzeng75712 共回答了19个问题 |采纳率84.2%需要锌48t,铜112t.
锌占3/10:3/(3+7)
铜占7/10:7/(3+7)
需要锌:160*3/10=48t
需要铜:160*7/10=112t1年前查看全部
- 黄铜是铜和锌的合金,分析:根据黄铜的成分铜和锌的性质可知,加入稀硫酸时,只有锌与硫酸反应生成了硫酸锌和氢气;根据质量守恒
黄铜是铜和锌的合金,
分析:根据黄铜的成分铜和锌的性质可知,加入稀硫酸时,只有锌与硫酸反应生成了硫酸锌和氢气;根据质量守恒定律,烧杯内质量的减少的质量即生成的氢气质量,据此根据反应的化学方程式列式计算出参加反应锌的质量,进而计算出铜的质量和铜的质量分数.
(1)根据质量守恒定律,产生氢气的质量为:20g+100g-119.8g=0.2g.故答案为:0.2.
(2)设黄铜样品中锌的质量为x,
Zn+H2SO4=ZnSO4+H2↑
65 2
x 0.2g
65/x=2/0.2g x=6.5g
黄铜样品中铜的质量分数为:20g-6.5g20g×100%=67.5%.
答:黄铜样品中铜的质量分数为67.5%.
为何要用锌和氢的质量比 而用锌和硫化锌的质量比做不出来?
65/x=161/106.3g x≠6.5g? snowflack1年前1
snowflack1年前1 -
 小蚊子爱小王子 共回答了14个问题
小蚊子爱小王子 共回答了14个问题 |采纳率85.7%因为106.3g并不是硫酸锌的质量,而是硫酸锌与水(稀硫酸酸的水)的总质量.1年前查看全部
- 黄铜是铜和锌的合金,其中铜的含量是百分之六十八.一块黄铜里含锌十六克,这块黄铜重多少千克?怎么算?
 pj影子1年前1
pj影子1年前1 -
 皱菊 共回答了19个问题
皱菊 共回答了19个问题 |采纳率100%因为铜的含量是68%,所以锌的含量是1-68%=32%
所以黄铜
16÷32%=50g1年前查看全部
- 两道初中化学选择题~快1.由铜、锌组成的黄铜合金11g,投入到一定量20%的稀硫酸溶液中恰好完全反应,将水除去后,得到2
两道初中化学选择题~快
1.由铜、锌组成的黄铜合金11g,投入到一定量20%的稀硫酸溶液中恰好完全反应,将水除去后,得到20.6g固体物质(不含结晶水).则反应中生成的氢气为( )
A.0.4g B.0.2g C.0.3g D.0.1g
2.有5g CO和CO2 的混合气体,其中含氧元素64%,将此混合气体通过足量灼热氧化铁后,再将生成的气体通过足量的澄清石灰水,则生成沉淀的质量是( )
A.20g B.15g C.10g D.5g
要过程哈~~~~谢! Po1nt1年前1
Po1nt1年前1 -
 SHEDE偶像 共回答了18个问题
SHEDE偶像 共回答了18个问题 |采纳率100%1、B
2、B1年前查看全部
- 一种黄铜是由锌和铜按2:3熔铸而成的,现有锌60吨,需要铜多少吨?
 博果尔1年前3
博果尔1年前3 -
 cyf2008 共回答了20个问题
cyf2008 共回答了20个问题 |采纳率90%2份锌需要3份铜,所以需要铜
60÷2×3=90吨1年前查看全部
- 尊敬的网友!黄铜粉与盐酸在加热情况下,生成氢气还是盐酸被挥发?反应是否完全?
 xierushang1年前1
xierushang1年前1 -
 黄小米 共回答了22个问题
黄小米 共回答了22个问题 |采纳率90.9%有加热这个条件,铜就很有可能和盐酸反应,但是是在锌反应完了之后了.锌与盐酸反应生成氢气逸出,但是黄铜中锌的含量很低.必须考虑到盐酸的易挥发特性,在加热的情况下,盐酸中HCL很快就挥发了.1年前查看全部
- 市面上有不法分子用黄铜(铜锌合金)制成假黄金首饰行骗,极大损害了消费者的利益.根据你所学的化学知识,下列哪种化学试剂无法
市面上有不法分子用黄铜(铜锌合金)制成假黄金首饰行骗,极大损害了消费者的利益.根据你所学的化学知识,下列哪种化学试剂无法鉴别用黄铜做成的假黄金首饰( )
A.稀盐酸
B.稀硫酸
C.硫酸铜溶液
D.硫酸铝溶液 hanqilu_30001年前1
hanqilu_30001年前1 -
 对影徘徊 共回答了16个问题
对影徘徊 共回答了16个问题 |采纳率87.5%解题思路:在金属活动性顺序中,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来.A、合金中的锌能与盐酸反应生成氢气,表面冒气泡,故A正确;
B、合金中的锌能与稀硫酸反应生成氢气,表面冒气泡,故B正确;
C、合金中的锌能与硫酸铜反应生成铜,表面有红色物质析出,故C正确;
D、铜和锌都不与硫酸铝反应,无法证明,故D错误.
故选D.点评:
本题考点: 金属的化学性质.
考点点评: 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行.1年前查看全部
- 将黄铜样品粉末(含锌.铜)7.0g投入到49.0g稀硫酸中,恰好完全反应.
将黄铜样品粉末(含锌.铜)7.0g投入到49.0g稀硫酸中,恰好完全反应.
将黄铜样品粉末(含锌.铜)7.0g投入到49.0g稀硫酸中,恰好完全反应,生成氢气0.06g.求1.黄铜中铜的质量分数是多少?2.生成硫酸锌的质量为多少?
(铜相对原子质量取64 锌取65) 黄后进1年前1
黄后进1年前1 -
 五月桑桑 共回答了20个问题
五月桑桑 共回答了20个问题 |采纳率85%设锌的质量是x,硫酸锌的质量为y
Zn + 2Hcl = Zncl2 + H2↑
65 136 2
x y 0.06g
65/x = 2/0.06
x=1.95g
所以:Cu 的质量为 7.0g-1.95g=5.05g
Cu%=5.05g/7.0g=72.14%
136/y = 2/0.06g
y=4.08
以上是解题过程,可能算得跟别人不一样 但是 做法是对的1年前查看全部
- Cu和Zn的合金称为黄铜.某化学兴趣小组的同学为了探究黄铜的组成,取40g该黄铜样品于烧杯中,向其中分5次加入相同溶质质
Cu和Zn的合金称为黄铜.某化学兴趣小组的同学为了探究黄铜的组成,取40g该黄铜样品于烧杯中,向其中分5次加入相同溶质质量分数的稀硫酸,使之充分反应.每次所用稀硫酸的质量及剩余固体的质量记录于下表.
加入稀硫酸的质量(g) 充分反应后剩余固体的质量(g)
第一次 40 37.4
第二次 40 m
第三次 40 32.2
第四次 40 32.0
第五次 40 32.0
(1)上述表格中m的值为_______?
(2)黄铜样品中铜的质量分数为________?
(3)所用稀硫酸中硫酸的质量是多少?
第一二问都知道了,只是第三问不知道该怎么解, 点点的心房1年前1
点点的心房1年前1 -
 jswent 共回答了13个问题
jswent 共回答了13个问题 |采纳率100%从前后的质量差值,可以知道Zn的量是8g,Zn+H2SO4=ZnSO4+H2,第一步,消耗了所有的硫酸,那么消耗的Zn是2.6g,带入方程就可以解出来一份的稀硫酸中含有的硫酸质量了,65/2.6=98/x,x=3.92g,那么5份稀硫酸中含有的硫酸量是3.92x5=19.6g1年前查看全部
- 现将一黄铜样品粉末(含锌、铜)7.0g,投入到36.5g稀盐酸溶液中恰好完全反应,生成氢气0.06g.(1)黄铜样品中铜
现将一黄铜样品粉末(含锌、铜)7.0g,投入到36.5g稀盐酸溶液中恰好完全反应,生成氢气0.06g.(1)黄铜样品中铜的质量分数是多少?(2)生成氯化锌多少克?(3)所得溶液质量分数
 missnna1年前1
missnna1年前1 -
 le69215 共回答了21个问题
le69215 共回答了21个问题 |采纳率85.7%Cu与稀盐酸不反应(因为Cu在氢气置换表中排在氢的后面,所以 不能置换出氢气)
因为粉末投入到36.5g稀盐酸溶液中恰好完全反应生成氢气0.06g
Zn + 2Hcl= Zncl2 + H2(向上)
65
73
136
2
x
y
z
0.06g
73/y=2/0.06
y=2.19g
2.191年前查看全部
- 在“氮气、焦炭、黄铜、明矾、压缩天然气、氯化钠”中选择合适的物质填空:
在“氮气、焦炭、黄铜、明矾、压缩天然气、氯化钠”中选择合适的物质填空:
(1)可用于炼铁的是焦炭(C)焦炭(C);
(2)在医疗上配制“生理盐水”的是氯化钠 (NaCl)氯化钠 (NaCl);
(3)标有“CNG”标志的汽车使用的燃料是压缩天然气压缩天然气;
(4)充入食品包装袋中防腐的是氮气 (N2)氮气 (N2);
(5)用于制造机器零件、仪表的是黄铜黄铜;
(6)常用于净水作絮凝剂的是明矾明矾. ligq19751年前1
ligq19751年前1 -
 网上小棉袄 共回答了15个问题
网上小棉袄 共回答了15个问题 |采纳率86.7%(1)可用于炼铁的是焦炭;
(2)用于医疗上配制“生理盐水”的是氯化钠;
(3)标有“CNG”标志的汽车使用的燃料是压缩天然气.
(4)充入食品包装袋中防腐的是氮气;
(5)用于制造机器零件、仪表的是黄铜;
(6)明矾能吸附悬浮在水中的固体小颗粒形成大颗粒而沉淀,故能用来净水.
故答案为:(1)焦炭;(2)氯化钠.(3)天然气;(4)氮气.(5)黄铜.(6)明矾1年前查看全部
- 向16g黄铜(由锌、铜形成的合金)样品中加入稀硫酸充分反应,所加稀硫酸与生成气体的质量关系如图所示,求:
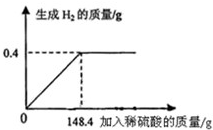 向16g黄铜(由锌、铜形成的合金)样品中加入稀硫酸充分反应,所加稀硫酸与生成气体的质量关系如图所示,求:
向16g黄铜(由锌、铜形成的合金)样品中加入稀硫酸充分反应,所加稀硫酸与生成气体的质量关系如图所示,求:
(1)样品中锌的质量分数.(保留一位小数)
(2)所用的稀硫酸中溶质的质量.
(3)恰好完全反应时,所得反应后溶液中溶质的质量分数. t3wbc1年前1
t3wbc1年前1 -
 **盼望 共回答了14个问题
**盼望 共回答了14个问题 |采纳率78.6%解题思路:本题涉及的反应Zn+H2SO4═ZnSO4+H2↑,图象为充分反应所生成氢气的质量随加入稀硫酸质量的变化情况.根据曲线可确定加入148.4g稀硫酸时与锌恰好完全反应放出0.4g氢气,运用化学方程式可求反应的硫酸的质量,由氢气质量计算参加反应锌的质量及生成硫酸锌的质量,最后由质量守恒定律计算反应后所得溶液质量,完成所得溶液中溶质的质量分数的计算.设样品中锌的质量为x,生成硫酸锌的质量为y.反应的硫酸的质量是z,由图分析可知产生氢气0.4g.
Zn+H2SO4═ZnSO4+H2↑
6598161 2
xzy 0.4g
[65/x=
98
z=
161
y=
2
0.4g]
x=13g y=32.2g z=19.6g
(1)样品中锌的质量分数为[13g/16g]×100%=81.25%
(2)所用的稀硫酸中溶质的质量为19.6g;
(3)恰好完全反应时,所得溶液中溶质的质量分数=[32.2g/13g+148.4g-0.4g]×100%=20%
答:(1)样品中锌的质量分数为81.25%;(2)所用的稀硫酸中溶质的质量为19.6g;(3)所得硫酸锌溶液中溶质的质量分数为20%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 解答此类问题的根本点在于对反应图象的曲线进行分析,曲线的折点表示此时恰好完全反应.1年前查看全部
- 某化学兴趣小组的同学为了测定某黄铜(Cu与Zn的合金)的组成,取10g该黄铜样品于烧杯中,向其中分5次加入相同溶质质量分
某化学兴趣小组的同学为了测定某黄铜(Cu与Zn的合金)的组成,取10g该黄铜样品于烧杯中,向其中分5次加入相同溶质质量分数的稀硫酸,使之充分反应.每次所用稀硫酸的质量及剩余固体的质量记录于下表:
试回答下列问题:加入稀硫酸的质量(g) 充分反应后剩余固体的质量(g) 第1次 10 8.7 第2次 10 7.4 第3次 10 6.1 第4次 10 5.6 第5次 10 5.6
(1)黄铜样品中锌的质量分数为______.
(2)计算所用稀硫酸中硫酸的质量分数是多少? 征婚女一号1年前1
征婚女一号1年前1 -
 woceci 共回答了25个问题
woceci 共回答了25个问题 |采纳率80%解题思路:(1)根据第四次和第五次剩余固体质量相等可知,剩余的5.6g固体即为样品中铜的质量,故第4次实验结束时样品中的锌就已完全反应进行解答.
(2)根据金属活动性可知,铜排在氢后,不能与稀硫酸发生反应,故发生反应的是锌,减少的固体的质量就是参加反应的锌的质量,由题目可知:第1次反应消耗锌的质量=10g-8.7g=1.3g,根据反应的化学方程式,可计算出所加10g稀盐酸中溶质的质量,由溶质的质量分数公式,求出所用稀盐酸中溶质的质量分数;(1)根据第4次和第5次剩余固体质量相等可知,剩余的5.6g固体即为样品中铜的质量,所以样品中锌的质量为10g-5.6g=4.4g,故黄铜样品中锌的质量分数为[4.4g/10g]×100%=44%;
(2)根据金属活动性可知,铜排在氢后,不能与稀硫酸发生反应,故发生反应的是锌,减少的固体的质量就是参加反应的锌的质量,由题目可知:第1次反应消耗锌的质量=10g-8.7g=1.3g;
设参加反应的H2SO4质量为x
Zn+H2SO4=ZnSO4+H2↑
65 98
1.3g x
[65/1.3g=
98
x]
x=1.96g
则所用稀硫酸的溶质质量分数=[1.96g/10g]×100%=19.6%
故答案为:(1)44%;(2)答:反应后所得溶液中溶质的质量分数为19.6%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 计算所用稀硫酸的溶质质量分数时,一定要确保稀硫酸完全反应,此时计算出的硫酸的质量才是稀硫酸溶液中所含溶质的质量.1年前查看全部
- 我国早在南北朝时就开始冶炼黄铜.黄铜是铜和锌的
我国早在南北朝时就开始冶炼黄铜.黄铜是铜和锌的
我国约在南北朝时就开始冶炼黄铜.黄铜是铜和锌的合金(Cu-Zn),它可用来制造及其、电器零件及日用品.为了测定某黄铜样品中锌的质量分数(不考虑黄铜中的其他杂质),现将15mL稀盐酸分三次加入到5g黄铜样品粉末中,每次充分反应后,测定生成氢气的质量,实验数据见下表:
第一次 第二次 第三次
加入稀盐酸的体积(mL) 5 5 5
生成氢气的质量(g) 0.04 m 0.02
我知道第二次生成氢气的质量为0.04g但是不晓得为什么,就只有这一个问题,理由详细一点,不可以很简单的草草了事哦!不要复制别人的答案...
 成吉思汗2221年前1
成吉思汗2221年前1 -
 小马慢慢跑 共回答了17个问题
小马慢慢跑 共回答了17个问题 |采纳率82.4%第三次加入盐酸时还有气体生成,说明第二次加入酸反应之后依然有金属剩余.那么也就是第二次加酸还是金属过量酸不足,所以一定是0.04,1年前查看全部
- (2014•孝感一模)黄铜是铜和锌的合金.向一定质量的黄铜样品中加入50g稀硫酸,恰好完全反应,产生0.2g氢气.
(2014•孝感一模)黄铜是铜和锌的合金.向一定质量的黄铜样品中加入50g稀硫酸,恰好完全反应,产生0.2g氢气.
(1)计算所用稀硫酸的溶质质量分数;
(2)除了可求出稀硫酸的溶质质量分数外,下列化学量中,你还能求出的化学量有______(填序号).
①合金中锌的质量②合金中铜的质量分数③合金中锌的质量分数
④生成硫酸锌的质量⑤硫酸溶液的体积⑥反应后溶液中溶质的质量分数. 小妖怪是我1年前1
小妖怪是我1年前1 -
 小酒窝waiting 共回答了14个问题
小酒窝waiting 共回答了14个问题 |采纳率85.7%解题思路:根据金属活动性强弱关系锌>氢>铜可知,把黄铜放入稀硫酸时,锌可与硫酸反应生成硫酸锌同时放出氢气;利用反应的化学方程式,由反应生成氢气的质量可计算消耗锌的质量、消耗硫酸的质量及生成硫酸锌的质量,然后利用硫酸质量与稀硫酸质量比还可计算出稀硫酸中硫酸的溶质质量分数;根据质量守恒定律,还可计算出反应后所得溶液的质量,因此还可计算反应后硫酸锌溶液的溶质质量分数.(1)设参加反应的硫酸的质量为x,
Zn+H2SO4=ZnSO4+H2↑
982
x 0.2g
[98/x=
2
0.2g]
x=9.8g
稀硫酸的质量分数为
9.8g
50g×100%=19.6%;
答:所用稀硫酸的溶质质量分数为19.6%;
(2)根据反应的化学方程式,还可以计算出锌的质量、硫酸锌的质量;但由于不知道黄铜的质量,因此不能计算出黄铜中铜的质量分数、锌的质量分数;由于不知道硫酸溶液的密度,因此也不能把硫酸溶液的质量转变为体积;根据质量守恒定律,反应后溶液质量可由参加反应锌的质量+所加稀硫酸的质量-放出氢气的质量而计算出来,因此,还可以计算出所加稀硫酸的溶质质量分数;
故答案为:①④⑥.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 反应的化学方程式可以表现出反应中各物质的质量关系,因此,利用反应的化学方程式可由反应中任一物质质量计算出反应中其它物质的质量.1年前查看全部
- 如何辨别黄铜和金黄金饰品假货常常用黄铜和铅再加入一定量的铅外观和密度上很难区分,如何辨认真假黄金饰品,简要叙述检验的步骤
如何辨别黄铜和金
黄金饰品假货常常用黄铜和铅再加入一定量的铅外观和密度上很难区分,如何辨认真假黄金饰品,简要叙述检验的步骤、现象和结论.
Cu能和盐酸反应吗? iwken1年前3
iwken1年前3 -
 我爱你利物浦 共回答了16个问题
我爱你利物浦 共回答了16个问题 |采纳率93.8%加入稀盐酸,有气泡的是黄铜
密度大的是黄金
放入王水中,溶解的是黄铜1年前查看全部
- 黄铜为什么不生锈?如果是因为原电池的话青铜为什么有有铜绿生成?
 cowalai1年前1
cowalai1年前1 -
 喜随 共回答了14个问题
喜随 共回答了14个问题 |采纳率100%全都错了,就是因为原电池原理
黄铜主要是由铜和锌所组成的合金,而青铜主要是由铜和锡所组成的合金
锌比铜活泼,根据原电池原理铜不易被氧化
而铜比锡活泼,根据原电池原理铜易被氧化1年前查看全部
- (7分)“黄铜”是铜锌合金,具有较强机械性能,街头许多“金色”饰品就是用它来制作的。某研究性学习小组为了测定黄铜中铜的质
(7分)“黄铜”是铜锌合金,具有较强机械性能,街头许多“金色”饰品就是用它来制作的。某研究性学习小组为了测定黄铜中铜的质量分数,称取20g黄铜样品,放入烧杯中,然后加入某浓度的稀盐酸100 g(足量),用玻璃棒搅拌至不再产生气泡为止(反应的化学方程式为:Zn+2HCl====ZnCl 2 +H 2 ↑),称量剩余物质的总质量为119.8g。请计算:
⑴实验过程中,产生氢气的质量 __ ,你的计算依据是 。
⑵该铜锌合金中铜的质量分数。 tyhg123451年前1
tyhg123451年前1 -
 给自己的未来 共回答了29个问题
给自己的未来 共回答了29个问题 |采纳率89.7%(7分)
⑴0.2g 2分
设反应消耗锌的质量为m(Zn)
⑵Zn+2HCl====ZnCl 2 +H 2 ↑
65 2
m(Zn) 0.2g 2分
m(Zn)=65×0.2g/2
="6.5g " 2分
w(Cu)=20g-6.5g/20g×100% 1分
=67.5 %
答: 该铜锌合金中铜的质量分数为67.5 %。
略1年前查看全部
- 向16g黄铜(由锌、铜形成的合金)样品中加入稀硫酸充分反应,所加稀硫酸与生成气体的质量关系如图所示,求:
向16g黄铜(由锌、铜形成的合金)样品中加入稀硫酸充分反应,所加稀硫酸与生成气体的质量关系如图所示,求:

(1)样品中锌的质量分数.(保留一位小数)
(2)所用的稀硫酸中溶质的质量.
(3)恰好完全反应时,所得反应后溶液中溶质的质量分数. 1jxw1年前1
1jxw1年前1 -
 xysth 共回答了23个问题
xysth 共回答了23个问题 |采纳率87%解题思路:本题涉及的反应Zn+H2SO4═ZnSO4+H2↑,图象为充分反应所生成氢气的质量随加入稀硫酸质量的变化情况.根据曲线可确定加入148.4g稀硫酸时与锌恰好完全反应放出0.4g氢气,运用化学方程式可求反应的硫酸的质量,由氢气质量计算参加反应锌的质量及生成硫酸锌的质量,最后由质量守恒定律计算反应后所得溶液质量,完成所得溶液中溶质的质量分数的计算.设样品中锌的质量为x,生成硫酸锌的质量为y.反应的硫酸的质量是z,由图分析可知产生氢气0.4g.
Zn+H2SO4═ZnSO4+H2↑
6598161 2
xzy 0.4g
[65/x=
98
z=
161
y=
2
0.4g]
x=13g y=32.2g z=19.6g
(1)样品中锌的质量分数为[13g/16g]×100%=81.25%
(2)所用的稀硫酸中溶质的质量为19.6g;
(3)恰好完全反应时,所得溶液中溶质的质量分数=[32.2g/13g+148.4g-0.4g]×100%=20%
答:(1)样品中锌的质量分数为81.25%;(2)所用的稀硫酸中溶质的质量为19.6g;(3)所得硫酸锌溶液中溶质的质量分数为20%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 解答此类问题的根本点在于对反应图象的曲线进行分析,曲线的折点表示此时恰好完全反应.1年前查看全部
- 一种黄铜是有锌和铜按2:7熔铸成的,现有铜112吨,可铸成多少吨黄铜?(带分析)
 殊雍玄儿1年前3
殊雍玄儿1年前3 -
 weihuqing 共回答了17个问题
weihuqing 共回答了17个问题 |采纳率94.1%可以112÷7×(2+7)=144吨1年前查看全部
- 了测定黄铜(铜,锌混合物)的组成,某研究性学习小组称取黄铜样品10g,向其中加入19.5百分号的稀硫酸50g
了测定黄铜(铜,锌混合物)的组成,某研究性学习小组称取黄铜样品10g,向其中加入19.5百分号的稀硫酸50g
完全反应后,称得烧杯中剩余的物质质量为59.9g.
①10g+50g-59.9g=0.1g表示( )的质量
②样品中铜的质量分数为( )
③通过计算反应后的溶液溶质中有无硫酸
麻烦哪位高手给我细细讲解下,我的化学真的不好~ 2727843451年前1
2727843451年前1 -
 clmmiky 共回答了17个问题
clmmiky 共回答了17个问题 |采纳率76.5%①10g+50g-59.9g=0.1g表示( 生成氢气 )的质量
铜与稀硫酸不反应
Zn+H2SO4=ZnSO4+H2
65 98 2
x y 0.1g
65/x=98/y=2/0.1g
x=3.25g
y=4.9g
②样品中铜的质量分数为(10g-3.25g)/10g*100%=67.5%
50g*19.5%=9.75g>4.9g
③反应后的溶液溶质中有硫酸1年前查看全部
大家在问
- 1英语翻译
- 2英语翻译 不要翻译器 急!这是一部讲一个得癌症即将离开人世的母亲为给女儿全部爱的电影
- 3根号3分之2-根号216+42倍的根号6分之一等于什么
- 4感情激动,控制不住自己的感情的成语
- 5555..100个..55除3,商是整数时,余数是多少
- 6阅读以下材料,并回答下列问题:A、哺乳期间的母狗为母亲不肯喂奶的小老虎当奶妈,并对小虎关怀备至.B、幼小的黑猩猩能模仿成
- 7Linda,t() up your room.It's too dirty.
- 8I usually get up early but this morning I ______ up at 9:30.
- 9若a1、a2、a3、a4是互不相等的整数,a1>a2>a3>a4,且a1a2a3a4=121,则(a1a3)÷(a2a4
- 10read sth for sb 和 read sth to sb有什么区别啊?
- 11乳酸和柠檬酸哪个酸性强
- 12甲和乙管每小时各注入水池6分之1 甲乙两水管同时注水几小时满?
- 13直线方程的斜截式与直线的解析式有什么不同
- 14英语作文My First Day on the CampusThe first morning,My father,gr
- 15The train is about to leave in 10 minates.
