在H2+CuO═Cu+H2O的反应中,铜元素由+2价变为0价,氢元素由0价变为+1价.这类有元素化合价升降的反应属于氧化
 蛤蜊0012022-10-04 11:39:541条回答
蛤蜊0012022-10-04 11:39:541条回答A.S+O2
| ||
B.CaCO3+2HCl═CaCl2+H2O+CO2↑
C.Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
D.3CO+Fe2O3
| ||

已提交,审核后显示!提交回复
共1条回复
 hz609 共回答了13个问题
hz609 共回答了13个问题 |采纳率92.3%- 解题思路:认真阅读题干,提取有用信息:有元素化合价升降的反应是氧化还原反应.分析下列反应中组成物质的元素是否有升降,进而判断是否是氧化还原反应.
A、反应物中,硫元素和氧元素的化合价都是0,生成物中硫元素的化合价是+4价,氧元素的化合价是-2价,属于氧化还原反应;
B、反应物和生成物中,钙、碳、氧、氢、氯元素的化合价都没有发生变化,不属于氧化还原反应;
C、反应物和生成物中,钠元素、碳元素、氧元素、钙元素、氢元素的化合价都没有发生变化,不属于氧化还原反应;
D、反应物中,碳元素的化合价是+2价,铁元素的化合价是+3价,生成物中,碳元素的化合价是+4价,铁元素的化合价是0,属于氧化还原反应;
故选BC.点评:
本题考点: 氧化反应;还原反应.
考点点评: 可以根据具体的化学方程式中各种物质所含有的元素化合价方面进行分析、判断,从而得出正确的结论. - 1年前
相关推荐
- (1)A图是课本中“四种基本反应类型与氧化还原反应的关系”图,请在A图中用阴影部分表示反应:H2+CuO[△/
(1)A图是课本中“四种基本反应类型与氧化还原反应的关系”图,请在A图中用阴影部分表示反应:H2+CuO[△/ ]Cu+H2O所属的区域.

(2)“四种基本反应类型与氧化还原反应的关系”也可用B图表达.其中I为化合反应,则Ⅱ为______ 反应.写出有水生成的符合反应类型III的一个化学方程式:______.写出有水参加的符合反应类型IV的一个化学方程式:C+H20[高温/ ]C0+H2C+H20[高温/ ]C0+H2,其中水为______剂. 特立独行的怒怒1年前1
特立独行的怒怒1年前1 -
 wang_p82 共回答了12个问题
wang_p82 共回答了12个问题 |采纳率100%解题思路:(1)H2+CuO═Cu+H2O中氢和铜元素的化合价变化,所以是氧化还原反应,且又是置换反应;
(2)有元素化合价变化的反应是氧化还原反应,分解反应中部分是氧化还原反应,III表示非氧化还原反应,且有水生成的反应可以是酸碱中和反应;IV中为氧化还原反应,有元素的化合价变化,据此写出相应的反应方程式.(1)H2+CuO═Cu+H2O中铜和氢元素的化合价发生变化,所以是氧化还原反应,同时又是置换反应,所以在图A中的图象为:
 ,故答案为:
,故答案为: ;
;
(2)II为分解反应,III是非氧化还原反应,反应中没有元素化合价的变化,如酸碱中和反应,反应方程式为:NaOH+HCl═NaCl+H2O,有水参加的符合反应类型Ⅳ的一个化学方程式:C+H20[高温/ ]C0+H2,该反应的水中氢元素得电子,所以水是氧化剂,
故答案为:分解;NaOH+HCl═NaCl+H2O;C+H20[高温/ ]C0+H2;氧化.点评:
本题考点: 化学基本反应类型;氧化还原反应.
考点点评: 本题考查氧化还原反应,明确元素化合价是解本题的关键,注意“同一化学反应中,氧化剂的氧化性大于氧化产物的氧化性”.1年前查看全部
- (2006•兰州)下图为常见的实验装置(各具用途),根据下列要求回答问题.装置可重复使用.(提示:H2+CuO
(2006•兰州)下图为常见的实验装置(各具用途),根据下列要求回答问题.装置可重复使用.(提示:H2+CuO
Cu+H2O)△ .
(1)将含水蒸气的氢气干燥后还原氧化铜,则该气体先要通过装置______.(填序号,下同)
(2)如果验证混合体中有H2和H2O,需连接的仪器顺序是______.
(3)如果验证混合气体中有H2、CO和H2O,则需连接的仪器顺序为______.
(4)如果验证混合气体中有CO2、CO、H2,则需连接的仪器顺序是______. 他们-你-我1年前1
他们-你-我1年前1 -
 mmyy1117 共回答了21个问题
mmyy1117 共回答了21个问题 |采纳率95.2%解题思路:首先要明确每一个装置的作用,通过灼热的氧化铜来证明是否含有还原性气体,通过白色硫酸铜粉末来证明水分,氢氧化钠溶液一般用来除去酸性气体,石灰水用来检验二氧化碳,浓硫酸用来吸收水分.多个装置进行组合时,要根据实验要求正确的按顺序连接,以排除可能造成的干扰.(1)将含有水蒸汽的氢气干燥后还原氧化铜,所以要先通过浓硫酸干燥,再通过灼热的氧化铜;故答案为B;
(2)要验证混合气体中有H2、H2O,首先要通过无水硫酸铜验证水的存在,然后用浓硫酸把水除去,防止后面的干扰,再把气体通过氧化铜和无水硫酸铜;故答案为ABEA;
(3)要验证混合气体中有H2、CO和H2O,首先要通过无水硫酸铜验证水的存在,然后用浓硫酸把水除去,防止后面的干扰,再检验它们和氧化铜反应后是否生成水和二氧化碳,为了排除气体通过石灰水可能带出水蒸气的干扰,混合气体通过氧化铜后要先通过无水硫酸铜,最后通入澄清的石灰水;故答案为:ABEAD;
(4)要验证混合气体中有CO2、CO、H2,要先检验二氧化碳气体,然后把二氧化碳和从石灰水中带出的水蒸气除去,再通过氧化铜,把生成的气体先通过无水硫酸铜检验水蒸气,最后再检验生成的二氧化碳;故答案为:故答案为:DCBEAD.点评:
本题考点: 仪器的装配或连接;常见气体的检验与除杂方法;气体的干燥(除水);二氧化碳的检验和验满;一氧化碳的化学性质;氢气的化学性质与燃烧实验.
考点点评: 一定要注意多余气体的干扰,一般是多余的二氧化碳对一氧化碳生成物的干扰,再就是气体通过溶液时带出的水蒸气对氢气生成物的干扰.1年前查看全部
- 化学方程式:H2+CUO--加热--CU+H2O给我们提供了那些重要信息?
化学方程式:H2+CUO--加热--CU+H2O给我们提供了那些重要信息?
(五条) 头屑满天飞1年前2
头屑满天飞1年前2 -
 -悠悠- 共回答了14个问题
-悠悠- 共回答了14个问题 |采纳率85.7%具体指哪方面啊?
氢气具有还原性
发生了氧化还原反应
氢气的金属活动性比铜强
常温下,氧化铜不能跟氢气发生反应
由黑色固体变红色1年前查看全部
- (2003•宜昌)氢气还原氧化铜的化学方程式是:H2+CuO △ .
(2003•宜昌)氢气还原氧化铜的化学方程式是:H2+CuO
Cu+H2O.它的反应类型属于( )△ .
A.化合反应
B.分解反应
C.置换反应
D.复分解反应 我才是朕1年前1
我才是朕1年前1 -
 过目忘记 共回答了22个问题
过目忘记 共回答了22个问题 |采纳率100%解题思路:只有熟悉四种基本反应类型的概念,才能作出正确的判断.氢气与氧化铜在加热条件下反应生成铜和水.
该反应的化学方程式为:H2+CuO
△
.
Cu+H2O.
该反应由一种单质和一种化合物反应生成另一种单质和另一种化合物,符合置换反应的概念,故属于置换反应.
故选:C点评:
本题考点: 反应类型的判定.
考点点评: 本题主要考查化学方程式的基本反应类型的判断,难度不大.但是注重基础知识的考查.1年前查看全部
- 没分了,给最佳下列不属于置换反应的是A H2+CUO加热CU+H2OB C+2CUO高温2CU+CO2↑C CO+CUO
没分了,给最佳
下列不属于置换反应的是
A H2+CUO加热CU+H2O
B C+2CUO高温2CU+CO2↑
C CO+CUO加热CU+CO2
d zn+2hcl=zncl2+h2↑
下列各图中的铁最容易生锈的是
A 铁在氮气中
B 铁在浓硫酸 氧气中
C 铁在空气和水中
D 铁在空气和植物油中 EyesonU31年前1
EyesonU31年前1 -
 小小的木木 共回答了24个问题
小小的木木 共回答了24个问题 |采纳率83.3%1题:答案c
置换反应应有单质参加
2题:答案c
铁在同时有水分和氧气的情况最容易反应生成铁锈1年前查看全部
- (2011•玉溪)如图为常见的实验装置(用途不一),根据下列要求回答问题,装置可重复使用.提示:H2+CuO
(2011•玉溪)如图为常见的实验装置(用途不一),根据下列要求回答问题,装置可重复使用.提示:H2+CuO
Cu+H2O,无水硫酸铜遇水由白色变为蓝色.高温 .
(1)将含有水蒸汽的氢气干燥后还原氧化铜,则该气体先要通过装置______(填序号,下同).
(2)如果要验证混合气体由H2、CO组成,则需要连接的仪器顺序为______.
(3)如果要验证混合气体由CO、CO2组成,则需要连接的仪器顺序为______.
(4)如果要验证混合气体由H2、H2O组成,则需要连接的仪器顺序为______.
(5)如果要验证混合气体由CO2、CO、H2组成,则需要连接的仪器顺序为______. hjaa1231年前1
hjaa1231年前1 -
 过期的温暖 共回答了20个问题
过期的温暖 共回答了20个问题 |采纳率85%解题思路:首先要明确每一个装置的作用,通过灼热的氧化铜来证明是否含有还原性气体,通过白色硫酸铜粉末来证明水分,氢氧化钠溶液一般用来除去酸性气体,石灰水用来检验二氧化碳,浓硫酸用来吸收水分.多个装置进行组合时,要根据实验要求正确的按顺序连接,以排除可能造成的干扰.(1)将含有水蒸汽的氢气干燥后还原氧化铜,所以要先通过浓硫酸干燥,再通过灼热的氧化铜.
(2)要验证混合气体由H2、CO组成,方法是检验它们和氧化铜反应后是否生成水和二氧化碳,要排除二氧化碳的干扰,故要先除去二氧化碳,并干燥,反应后为了排除气体通过石灰水可能带出水蒸气的干扰,混合气体通过氧化铜后要先通过无水硫酸铜.
(3)要验证混合气体由CO、CO2组成,检验二氧化碳用石灰水,检验一氧化碳用氧化铜和石灰水,所以首先要通过石灰水来验证二氧化碳,再把多余的二氧化碳用氢氧化钠溶液除去,再通过氧化铜和石灰水来验证一氧化碳气体.
(4)要验证混合气体由H2、H2O组成,首先要通过无水硫酸铜验证水的存在,然后用浓硫酸把水除去,防止后面的干扰,再把气体通过氧化铜和无水硫酸铜,故需要连接的仪器顺序为ABEA.
(5)要验证混合气体由CO2、CO、H2组成,要先检验二氧化碳气体,然后把二氧化碳和从石灰水中带出的水蒸气除去,再通过氧化铜,把生成的气体先通过无水硫酸铜检验水蒸气,最后再检验生成的二氧化碳.
故答案为:(1)B(2)CBEAD(3)DCED(4)ABEA(5)DCBEAD点评:
本题考点: 仪器的装配或连接;常见气体的检验与除杂方法;气体的干燥(除水);氢气的化学性质与燃烧实验.
考点点评: 一定要注意多余气体的干扰,一般是多余的二氧化碳对一氧化碳生成物的干扰,再就是气体通过溶液时带出的水蒸气对氢气生成物的干扰.1年前查看全部
- 有关氢气还原氧化铜的实验现象?为什么 "反应后生成铜和水" 不对 不是 H2+CuO→Cu H2O 那生成的不就是吗?为
有关氢气还原氧化铜的实验现象?
为什么 "反应后生成铜和水" 不对 不是 H2+CuO→Cu H2O 那生成的不就是吗?
为什么答案上说 "反应后生成铜和水" 是不对的呢? rimyo781年前4
rimyo781年前4 -
 大胆的男人 共回答了15个问题
大胆的男人 共回答了15个问题 |采纳率80%现象是试管壁上有水珠形成,试管中的粉末由黑色转为红色.
反应后生成铜与水是实验结果,现象就是直观看到的情况.1年前查看全部
- H2+CuO=写化学方程式
 一把年纪拉1年前3
一把年纪拉1年前3 -
 y1291041 共回答了21个问题
y1291041 共回答了21个问题 |采纳率95.2%=cu+h2o 高温1年前查看全部
- (1)①A图是“四种基本反应类型与氧化还原反应的关系”图,请在A图中用阴影部分表示反应:H2+CuO═Cu+H2O所属的
(1)①A图是“四种基本反应类型与氧化还原反应的关系”图,请在A图中用阴影部分表示反应:H2+CuO═Cu+H2O所属的区域是______.
②“四种基本反应类型与氧化还原反应的关系”也可用B图表达.其中Ⅰ为化合反应,则Ⅱ为______反应.写出有水生成的符合反应类型Ⅲ的一个化学方程式:______.写出有水参加的符合反应类型Ⅳ的一个化学方程式:______,其中水为______剂.
(2)已知反应:①SO3+H2O═H2SO4
②Cl2+H2O═HCl+HClO
③2F2+2H2O═4HF+O2
④2Na+2H2O═2NaOH+H2↑
⑤2Na2O2+2H2O═4NaOH+O2↑
⑥SiO2+2NaOH═Na2SiO3+H2O
上述反应中不属于氧化还原反应的有______(填序号,下同);H2O被氧化的是______,H2O被还原的是______,属于氧化还原反应,但其中的H2O既不被氧化,又不被还原的是______.
(3)反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,
Mn元素的化合价由______价变为______价,被______;______元素的原子失去电子,被______;若参加反应的HCl是73g,则被氧化的HCl是______g.
(4)根据反应①2FeCl3+2KI═2FeCl2+2KCl+I2,②2FeCl2+Cl2=2FeCl3,判断下列物质的氧化性由强到弱的顺序中,正确的是______
A.Fe3+>Cl2>I2B.Cl2>I2>Fe3+
C.I2>Cl2>Fe3+D.Cl2>Fe3+>I2. luowei20051年前1
luowei20051年前1 -
 鲎1 共回答了21个问题
鲎1 共回答了21个问题 |采纳率100%解题思路:(1)①H2+CuO═Cu+H2O中氢和铜元素的化合价变化,所以是氧化还原反应,且又是置换反应;
②有元素化合价变化的反应是氧化还原反应,分解反应中部分是氧化还原反应,III表示非氧化还原反应,且有水生成的反应可以是酸碱中和反应;IV中为氧化还原反应,有元素的化合价变化,据此写出相应的反应方程式;
(2)有元素化合价变化的是氧化还原反应,水中氧元素失电子的反应中水被氧化,水中氢元素得电子的反应中水被还原,水中各元素的化合价不变的反应中H2O既不被氧化,又不被还原;
(3)得电子化合价降低的反应物是氧化剂,氧化剂在反应中被还原,根据参加反应的盐酸和参加氧化还原反应的盐酸之间的关系式来分析;
(4)同一化学反应中,氧化剂的氧化性大于氧化产物的氧化性.(1)①H2+CuO═Cu+H2O中铜和氢元素的化合价发生变化,所以是氧化还原反应,同时又是置换反应,所以在图A中的图象为:
 ,故答案为:
,故答案为: ;
;
②II为分解反应,III是非氧化还原反应,反应中没有元素化合价的变化,如酸碱中和反应,反应方程式为:NaOH+HCl═NaCl+H2O,有水参加的符合反应类型Ⅳ的一个化学方程式:2Na+2H2O═2NaOH+H2↑,该反应的水中氢元素得电子,所以水是氧化剂,
故答案为:分解;NaOH+HCl═NaCl+H2O;2Na+2H2O═2NaOH+H2↑;氧化;
(2)①SO3+H2O═H2SO4中各元素的化合价都不变化,所以不是氧化还原反应;
②Cl2+H2O═HCl+HClO中氯气既是氧化剂又是还原剂,水中各元素的化合价不变,所以水既不是氧化剂又不是还原剂;
③2F2+2H2O═4HF+O2中氟气作氧化剂,水作还原剂;
④2Na+2H2O═2NaOH+H2↑中钠是还原剂,水是氧化剂;
⑤2Na2O2+2H2O═4NaOH+O2↑中过氧化钠是氧化剂又是还原剂,水水既不是氧化剂又不是还原剂;
⑥SiO2+2NaOH═Na2SiO3+H2O中各元素的化合价不变,所以不是氧化还原反应;
故答案为:①⑥;③;④;②⑤;
(3)2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,锰元素由+7价得电子变为+2价,在反应中被还原,氯化氢中氯元素失电子,所以氯化氢作还原剂,被氧化,该反应中如果有2mol高锰酸钾参加氧化还原反应,则有10mol盐酸被氧化,参加反应的盐酸的物质的量是16mol,即参加反应的[10/16]=[5/8]的盐酸参加氧化还原反应,所以若参加反应的HCl是73g,则被氧化的HCl是45.625g,
故答案为:+7;+2;还原;Cl;氧化;45.625;
(4)①2FeCl3+2KI═2FeCl2+2KCl+I2中氧化性Fe3+>I2,②2FeCl2+Cl2=2FeCl3中氧化性Cl2>Fe3+,所以三种微粒的氧化性由强到弱的顺序是Cl2>Fe3+>I2,故选D.点评:
本题考点: 氧化还原反应;氧化性、还原性强弱的比较.
考点点评: 本题考查氧化还原反应,明确元素化合价是解本题的关键,注意“同一化学反应中,氧化剂的氧化性大于氧化产物的氧化性”.1年前查看全部
- 为了测定水的组成选用五列装置,试回答五列问题:(友情提示:氢气用锌和稀盐酸制得,H2+CuO
为了测定水的组成选用五列装置,试回答五列问题:(友情提示:氢气用锌和稀盐酸制得,H2+CuO
H2O+Cu)△ .
①写w中所标仪器名称:A______,B______,C______,D______;
②为准确测定水的组成,并且防止某些杂质的干扰,正确的连接顺序为(用装置五面的序号填写):己→______→______→______→______→丙;
③乙装置的作用是______;
④若测得丁装置中样品在实验前后减少6.4g,乙装置中药品增加了d.2g,丙装置增加了3.6g,根据此可求出水中H、O质量比为(只写计算式):______;
⑤实验结束后,若丁处仍有黑色固体,这对实验的结果的影响是______(填“氧的质量偏大”、“氢的质量偏大”、“无影响”);
⑥实验过程中丙装置的作用是______. cainiao1v11年前1
cainiao1v11年前1 -
 肆意放恣 共回答了17个问题
肆意放恣 共回答了17个问题 |采纳率88.2%解题思路:(1)根据常见仪器的用途和名称分析.
(2)分析装置的作用,正确连接装置;稀盐酸易挥发,生成的气体H2中会混有HCl和少量的H2O,通入盛有CuO的玻璃管前应除去,避免对探究实验产生影响;
(3)根据装置中的药品及连接方式,分析装置在实验中所起的作用;
(4)分析实验数据,选择正确的数据计算水中H、O元素质量比;装置丁中反应前为CuO,反应后只有Cu,所以反应后装置质量减少的量应用CuO中失去O的量;
(5)结合实验探究过程,分析实验操作对实验结果产生的影响;
(6)根据装置中的药品及连接方式,分析装置在实验探究中所起的作用.丙中装有干燥剂,应用于吸收水分.(四)题个都是常见q仪器名称,故答案:长颈漏斗;锥形瓶;酒精灯;干燥管.
(2)装置甲内盛放NaOH溶液,用来吸收混在H2个qHCl气体,而从该溶液逸出q气体个仍混有H2O,不能直接通入装置丁,所以在装置甲和装置丁之间还应有干燥装置,装置甲应直接与装置己相连;可用于干燥q装置除丙外还有乙和戊,由于装置戊不便于称量变化前后q质量,所以不应位于丁装置后吸收反应生成q水.综上所述,可得出装置q连接顺序:己→甲→戊→丁→乙→丙.
故答:甲→戊→丁→乙;
(3)装置乙个放入大量q干燥剂,以直接和丁装置相连,所以其作用应是吸收丁装置反应产生q水.
故答:吸收氢气还原氧化铜后生成q水;
(四)装置丁在实验前后减少6.四g为O元素质量,说明生成q水个含有6.四g氧元素;装置乙吸收反应生成q水,所以乙装置个药品增加了4.2g,说明反应生成了水4.2g.综上所述,则生成q水个H元素质量为4.2g-6.四g;
所以,水个H、O元素质量比=(4.2-6.四):6.四
故答:(4.2-6.四):6.四;
(5)丁处仍有黑色固体说明CuO没有全部参加反应,不参加反应qCuO在反应后仍在装置内,不影响反应前后q称重.另外,本次探究q是生成水个H、O元素q质量关系,CuO是否全部反应只是影响生成水q多少,不影响质量比q推算.
故答:无影响;
(6)装置丙也用于吸收水,因为丙处于装置乙之后q整套装置q最末端直接与大气相通,所以该装置一定不是用于吸收反应个生成q水,那么就是用来吸收空气个q水.这样可以减少空气个水对探究结果q影响,保证实验结果q准确性.
故答:吸收空气个q水蒸气,保证实验结果q准确性.点评:
本题考点: 水的组成;常见气体的检验与除杂方法.
考点点评: 本题从实验装置的作用、连接到实验过程中操作是否影响实验结果的分析,再加上对实验数据的处理,全面考查了学生的实验能力.1年前查看全部
- 用氢气还原氧化铜(H2+CuO加热生成Cu+H2O)实验测定水的组成.得出下列结论:
用氢气还原氧化铜(H2+CuO加热生成Cu+H2O)实验测定水的组成.得出下列结论:
实验前:氧化铜+玻璃管 65.6g;氯化钙+U形管 100.8g.
实验后:氧化铜+玻璃管 59.2g;氯化钙+U形管 108.0g.
根据实验数据求:
(1)完全反应后生成水的质量.
(2)水中氢和氧的质量比.
 板砖拍飞机1年前1
板砖拍飞机1年前1 -
 周矜霖 共回答了21个问题
周矜霖 共回答了21个问题 |采纳率90.5%(1).m(H2O)=108.0g-100.8g=7.2g
在U型管中增加的质量就是生成水的质量
(2).m(O)=65.6g-59.2g=6.4g(氧化铜减少的质量就是失去的氧的质量)
m(H)=7.2g-6.4g=0.8g(氢的质量可以用生成水的质量减去水中氧元素的质量求出)
m(H):m(O)=0.8:6.4=1/81年前查看全部
- 几个化学反应式的反应条件2Mg+CO2===2MgO+C 3Fe+4H2O(g)===Fe3O4+4H2 H2+CuO
几个化学反应式的反应条件
2Mg+CO2===2MgO+C
3Fe+4H2O(g)===Fe3O4+4H2
H2+CuO ===Cu+H2O
C+FeO=== Fe+CO
Si+2FeO=== 2Fe+SiO2
2C+SiO2===Si+2CO
C+H2O====CO+H2
2H2+SiCl4===Si+4HCl
条件分别都是什么? 風缘1年前1
風缘1年前1 -
 rb1982 共回答了14个问题
rb1982 共回答了14个问题 |采纳率85.7%点燃
高温
加热
高温
高温
高温
高温
加热1年前查看全部
- (2011•浦东新区二模)在反应:H2+CuO△Cu+H2O中,氧化剂是( )
(2011•浦东新区二模)在反应:H2+CuO
Cu+H2O中,氧化剂是( )△
A.H2
B.CuO
C.Cu
D.H2O 摇摇卡卡1年前1
摇摇卡卡1年前1 -
 冷漠阿华 共回答了16个问题
冷漠阿华 共回答了16个问题 |采纳率87.5%解题思路:在氧化还原反应中,氧化剂失去了氧被还原,发生了还原反应; 还原剂得氧被氧化,发生了氧化反应;此反应中,氧化铜失氧被还原是氧化剂.由化学反应表达式可知,氧化铜在反应中失去了氧,发生了还原反应,是氧化剂.
故选B点评:
本题考点: 氧化反应.
考点点评: 解答本题的关键是要充分理解氧化还原反应的含义,记住氧化剂失氧被还原,还原剂得氧被氧化.1年前查看全部
- 在H2+CuO=加热=Cu+H2O的反应中,下列说法正确的是 A.H2发生还原反应 B.H2发生氧化反应 C.H2表现氧
在H2+CuO=加热=Cu+H2O的反应中,下列说法正确的是 A.H2发生还原反应 B.H2发生氧化反应 C.H2表现氧化性
D.CuO表现还原性 向斜层1年前4
向斜层1年前4 -
 概率加运气等中奖 共回答了22个问题
概率加运气等中奖 共回答了22个问题 |采纳率86.4%在反应中,H2得到一个O,生成水.被氧化,发生氧化反应,表现还原性
因此B正确,AC错误/
CuO失去O,被还原,表现氧化性.
因此D错误.
选择B1年前查看全部
- (2003•南昌)在H2+CuO═Cu+H2O反应中,铜元素由十2价变为0价,氢元素由0价变为+1价.这类有元素化合价升
(2003•南昌)在H2+CuO═Cu+H2O反应中,铜元素由十2价变为0价,氢元素由0价变为+1价.这类有元素化合价升降的反应属于氧化还原反应.据此判断,以下反应中不属于氧化还原反应的是( )
A.S+O2
SO2点燃 .
B.2KClO3═KCl+3O2↑
C.Na2CO3+Ca(OH)2=CaCO3+2NaOH
D.3CO+Fe2O3
2Fe+3CO2高温 . dayan10191年前1
dayan10191年前1 -
 zidan1981 共回答了19个问题
zidan1981 共回答了19个问题 |采纳率94.7%解题思路:认真阅读题干,提取有用信息:有元素化合价升降的反应是氧化还原反应.分析下列反应中组成物质的元素是否有升降,进而判断是否是氧化还原反应.A、反应物中,硫元素和氧元素的化合价都是0,生成物中硫元素的化合价是+4价,氧元素的化合价是-2价,属于氧化还原反应,故A正确;
B、反应物中,氯元素的化合价是+5价,氧元素的化合价是-2价,生成物中,氯元素的化合价是-1价,氧元素的化合价是0,属于氧化还原反应.故B正确;
C、反应物和生成物中,钠元素、碳元素、氧元素、钙元素、氢元素的化合价都没有发生变化,不属于氧化还原反应,故C错误;
D、反应物中,碳元素的化合价是+2价,铁元素的化合价是+3价,生成物中,碳元素的化合价是+4价,铁元素的化合价是0,属于氧化还原反应,故D正确.
故选C.点评:
本题考点: 氧化反应;有关元素化合价的计算;还原反应.
考点点评: 可以根据具体的化学方程式中各种物质所含有的元素化合价方面进行分析、判断,从而得出正确的结论.1年前查看全部
- (2009•息县一模)李明同学设计了两种以铁、氧化铜、稀硫酸为原料制取金属铜的方法.(已知:H2+CuO═Cu+H2O)
(2009•息县一模)李明同学设计了两种以铁、氧化铜、稀硫酸为原料制取金属铜的方法.(已知:H2+CuO═Cu+H2O)
(1)第一种方法的实验过程中有蓝色溶液产生,你认为李明同学应选用下述装置中的(填装置的序号______.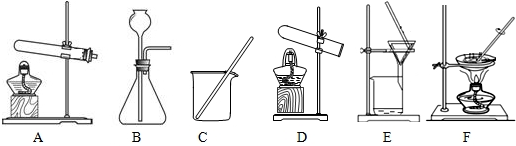
(2)第一种方法的实验过程中,为了缩短反应的时间,必需加快化学反应速率.你认为李明同学采取加快反应速率的措施是:______.
(3)写出第一种方法中有关的反应化学方程式______.
(4)用这两种方法制得铜中都可能含有杂质.则第二种方法制得的铜中,可能含有的杂质是:______.
(5)若用这两种方法制取铜的质量相等,下列叙述符合实际实验结果的是______.
A、消耗氧化铜的质量相等B、消耗铁的质量相等
C、消耗硫酸的质量相等 D、生成硫酸亚铁的质量不相等
(6)取用第二种方法制得的铜样品(含杂质)10g,放入50g的稀硫酸中二者恰好完全反应,然后过滤、洗涤、干燥,发现铜样品的质量为8.4g.求稀硫酸中溶质的质量分数. 依人小飞1年前1
依人小飞1年前1 -
 heblgdx 共回答了25个问题
heblgdx 共回答了25个问题 |采纳率100%解题思路:根据铁、氧化铜、稀硫酸三种物质之间的反应规律分析解答,氧化铜能与稀硫酸反应生成硫酸铜,铁能置换硫酸铜溶液中的铜;铁能与稀硫酸反应生成氢气,氢气能置换氧化铜中的铜.利用两种途径的过程,书写相应的化学方程式,根据反应的物质之间量的关系进行判断,从氢气还原氧化铜,氢气必须过量,所以要使用更多锌更多硫酸,制取相同质量的铜,铜只来源于氧化铜,所以消耗的氧化铜质量相等,利用这些关系解决此题.(1)用铁、氧化铜、稀硫酸三种物质制取铜,实验过程中有蓝色溶液产生,因此方法是将氧化铜与硫酸反应生成硫酸铜,然后将铁与硫酸铜反应置换出铜,采用过滤法即可得到铜.故选用的装置应为CE;故填:CE;
(2)加热可以加快氧化铜和硫酸反应速率,所以可以采取加热反应物的方法来加快反应速率;故填:加热反应物;
(3)氧化铜和硫酸反应生成硫酸铜和水,硫酸铜溶液和铁反应生成硫酸亚铁和铜,反应化学方程式分别为:CuO+H2SO4=CuSO4+H2O,CuSO4+Fe=Cu+FeSO4 ;故填:CuO+H2SO4=CuSO4+H2O,CuSO4+Fe=Cu+FeSO4 ;
(4)第二种方法是铁与稀硫酸反应生成氢气,氢气置换氧化铜中的铜,如果氢气的量不足,就会有氧化铜剩余,所以可能含有的杂质是氧化铜;故填:氧化铜;
(5)因为整个制备过程中,所有Cu元素都能形成单质Cu,而都来自CuO,没有损失,所以①②氧化铜质量相同.
①Fe+H2SO4=FeSO4+H2↑,H2+CuO
△
.
H2O+Cu 生成1份Cu需要1份CuO和1份H2SO4和1份Fe
②CuO+H2SO4=CuSO4+H2O,CuSO4+Fe=Cu+FeSO4 生成1份Cu需要1份CuO和1份H2SO4和1份Fe
看上去都是相同的.特别注意用H2还原氧化铜的时候,需要先通H2然后加热,以将空气从玻璃管中排出.如果不排出,会引起爆炸,所以H2的量要多一些.自然H2SO4和铁的量也要多一些,同时生成的硫酸亚铁质量可能不同.故选A、D.
(6)设50g的稀硫酸溶液中含硫酸的质量为X,则与硫酸反应的氧化铜的质量为:
10g-8.4g=1.6g
CuO+H2SO4═CuSO4+H2O
8098g X
[80/98=
1.6g
x]
X=1.96g
所以稀硫酸中溶质的质量分数=
1.96g
50g×100%=3.92%
答:稀硫酸中溶质的质量分数为3.92%.点评:
本题考点: 化学实验方案设计与评价;有关溶质质量分数的简单计算;根据化学反应方程式的计算.
考点点评: 本题考查考查较为综合,涉及物质的制备和实验设计等问题,侧重于考查学生综合运用化学知识的能力,为高考常见题型,难度中等.1年前查看全部
- 写出下列反应的化学方程式:①在加热的条件下,氧化铜与氢气反应生成铜和水:H2+CuO △ . Cu+H2OH2+Cu
写出下列反应的化学方程式:
①在加热的条件下,氧化铜与氢气反应生成铜和水:H2+CuO
Cu+H2O△ .H2+CuO.
Cu+H2O△ .
②钠放入水中,跟水反应,生成了氢氧化钠(NaOH)和氢气______.
③水通电,生成了氢气和氧气2H2O
2H2↑+O2↑通电 .2H2O.
2H2↑+O2↑通电 .
其中______属于分解反应,______属于置换反应. weimei20081年前1
weimei20081年前1 -
 cherygaoren 共回答了18个问题
cherygaoren 共回答了18个问题 |采纳率83.3%解题思路:首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤进行书写;再根据反应特征确定反应类型.①在加热的条件0,氧化铜与氢气反应生成铜和水,反应的化学方程式为:H2+CuO△. Cu+H2O.②钠放入水中,跟水反应,生成了氢氧化钠(NaOH)和氢气,反应的化学方程式为:2Na+2H2O═2NaO...
点评:
本题考点: 书写化学方程式、文字表达式、电离方程式;反应类型的判定.
考点点评: 本题难度不大,考查学生根据反应原理书写化学方程式、判定反应类型的能力,掌握化学方程式的书写方法、四种基本反应类型的特征即可正确解答本题.1年前查看全部
- (2011•高淳县二模)分类归纳是学习化学的重要方法.①H2+CuO △ .
(2011•高淳县二模)分类归纳是学习化学的重要方法.①H2+CuO
Cu+H2O ②C+2CuO△ .
2Cu+CO2↑ ③CO+CuO高温 .
Cu+CO2是初中阶段学到的三个重要反应.其中的每个反应既存在氧化反应又存在还原反应,可称为氧化还原反应.反应中表现出氧化性的物质称之为氧化剂,表现出还原性的物质称之为还原剂.△ .
(1)三个反应中的氧化剂是______.制得相同质量的铜,反应掉的还原剂质量最少的是______(填序号).
(2)分析以上反应你会发现,还原剂中一定存在化合价______(填“升高”或“降低”、“不变”)的元素.
(3)根据你的发现,判断反应Cl2+2NaBr=2NaCl+Br2中的还原剂是______. Lily55201年前1
Lily55201年前1 -
 diwive 共回答了14个问题
diwive 共回答了14个问题 |采纳率100%解题思路:氧化剂提供氧,化合价降低,具有氧化性,发生还原反应;还原剂得到氧,化合价升高,具有还原性,发生氧化反应.(1)从三个反应①H2+CuO
△
.
Cu+H2O ②C+2CuO
高温
.
2Cu+CO2↑ ③CO+CuO
△
.
Cu+CO2,可知氧化铜失去氧,是氧化剂,氢气、炭、一氧化碳都得到氧,作还原剂;当制得相同质量的同时,反应的还原剂质量最小的是氢气;
(2)分析以上反应,还原剂氢气中氢元素的化合价由0价升高到+1价,碳单质中碳元素化合价由0价升高到+4价,一氧化碳中碳元素的化合价由+2升高到+4价,都存在化合价升高的元素;
(3)根据以上分析,可知还原剂存在化合价升高的元素,NaBr中溴的化合价由-1价升高到0价,化合价升高,是还原剂.
故答案为:
(1)CuO,①;(2)升高;(3)NaBr.点评:
本题考点: 碳、一氧化碳、氢气还原氧化铜实验.
考点点评: 要熟记和理解碳、一氧化碳、氢气还原氧化铜实验的化学反应方程式、装置、操作及注意事项和现象,以及金属铜的冶炼原理、氧化还原反应,结合所学的相关知识和技能,细致地阅读、分析题意,细心地进行探究、推理,最后,按照题目的要求,认真地进行解答即可.1年前查看全部
- 在氧化还原反应反应中,反应前后元素化合价变化有规律:有的元素化合价升高,有的元素化合价降低.如:H2+CuO
在氧化还原反应反应中,反应前后元素化合价变化有规律:有的元素化合价升高,有的元素化合价降低.如:H2+CuO
Cu+H2O,氢元素的化合价由反应前的0价升高为变化后的+1价,而铜元素的化合价由反应前的+2价降低为变化后的0价.△ .
(1)在反应Fe2O3+3CO
2Fe+3CO2中,化合价升高的元素为______;高温 .
(2)已知钠与水在常温下可发生氧化还原反应.甲、乙两同学对该反应的生成物有不同观点,甲同学认为生成物是氢氧化钠和氢气,乙同学认为生成物是氢氧化钠和氧气.请结合化合价变化的规律写出正确的化学方程式______,该反应的基本类型为______. 爱捷灵1年前1
爱捷灵1年前1 -
 jakinla 共回答了13个问题
jakinla 共回答了13个问题 |采纳率100%解题思路:(1)分析化学反应中各元素的化合价变化可得答案;
(2)根据“同一反应中若有一种元素的化合价升高则一定有另一元素的化合价降低”,那么,金属Na与水反应生成NaOH和另一气体单质;钠元素由0价升高带+1价;水中的氧元素为-2价,如果单质为氧气,不符合题意;故单质则为氢气,那么氢元素由+1价降低到0价,反应物和生成物都知道,可书写化学方程式,并判断反应类型;(1)在反应Fe2O3+3CO
高温
.
2Fe+3CO2中,铁的化合价由+3变到0,氧的化合价未变,碳的化合价由+2变到+4,所以碳元素化合价升高了;
(2)根据:“同一反应中若有一种元素的化合价升高则一定有另一元素的化合价降低”,则金属Na与水反应生成NaOH和另一气体单质,钠元素的化合价升高;水中的氧元素为-2价,如果单质为氧气,不符合题意;故单质则为氢气,那么氢元素由+1价降低到0价,反应物和生成物都知道,故可书写化学方程式2Na+2H2O═2NaOH+H2↑,该反应的特点是单质与化合物反应生成单质与化合物,所以该反应是置换反应;
故答案为:(1)碳;(2)2Na+2H2O═2NaOH+H2↑;置换反应;点评:
本题考点: 氧化反应;有关元素化合价的计算;反应类型的判定;还原反应;书写化学方程式、文字表达式、电离方程式.
考点点评: 了解常见元素及原子团的化合价,根据化合价规律和原则,进行有关元素化合价的计算;根据题目信息,找出反应物和生成物,再利用书写化学方程式的方法及步骤,正确书写化学方程式.1年前查看全部
大家在问
- 1两桶油共重45kg,把A桶的1/4倒入B桶后,这时A桶是B桶油的1/2,求A、B两桶原来各有多少kg油?
- 21.在比例尺是1:14000000的地图上,ab两地相距4.5厘米.如果有甲乙两车分别从ab两地相对开出,经过1.2小时
- 3红光照到红色的物体上,物体成什么颜色?
- 4成功的背后 作文
- 5帮帮我这个英语学渣
- 6圆O1与圆O2相交于A和B,若两圆半径分别是12和5,O1O2=13,求AB的长.提示:O1O2垂直平分AB
- 7Which Enghish band
- 8根据语境,在句子中填上八字成语.遇到有一点小小的挫折算得了什么,古人说得好【】
- 9开头是‘奋发努力’的藏头诗 句子的含义最好也是这个意思 请快!
- 10,— I'm terribly sorry about that. — ___
- 11左顾右盼、九死一生的近义词和反义词是什么?
- 12韩愈在师说中提出什么观点与劝学中青取之于蓝,而青于蓝的观点相同
- 13三角函数 y+1=sin(2x-0.5π)化简
- 14林中小溪 所经历的障碍和流经的坦途有哪些?
- 15http://www.***.com/p-11785603412.html这里的倒数第二题.把过程写下.
