“天蓝蓝海蓝蓝,海边小城威海卫”.威海海水资源丰富,回答下列问题:
 天下卓龙2022-10-04 11:39:541条回答
天下卓龙2022-10-04 11:39:541条回答(1)海水中主要含有______等离子(写离子符号,至少答出4种).
(2)海水脱硫是一种有效除去火力发电产生的SO2的方法.其工艺流程如图甲所示,天然海水吸收了含硫烟气后,要用O2进行氧化处理,其反应的化学方程式是:______;氧化后的“海水”需要用大量的天然海水与之混合后才能排放,该操作的主要目的是______.
(3)图乙是海水综合利用的一个方面.
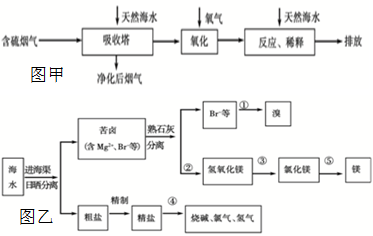
请回答下列问题:
Ⅰ.①步主要反应的离子方程式:______.溴及其化合物的用途有很多,写出其中的一种______.
Ⅱ.第③步需要加入______,其前面分离出氢氧化镁的操作称为______,将镁条在二氧化碳中燃烧的产物为______.
Ⅲ.粗盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;
②加入稍过量的NaOH溶液;
③加入稍过量的BaCl2溶液;
④滴入稀盐酸至无气泡产生;
⑤过滤
正确的操作顺序是______.

已提交,审核后显示!提交回复
共1条回复
 hoholong 共回答了22个问题
hoholong 共回答了22个问题 |采纳率100%- 解题思路:(1)根据海水中主要含有氯化钠、氯化镁、氯化钙、硫酸镁等;
(2)天然海水吸收了含硫烟气后,含有亚硫酸,具有还原性,可被氧气氧化生成硫酸;利用酸、碱反应分析混合的目的;
(3)Ⅰ.①步主要反应是氯气氧化溴离子生成单质溴和氯离子;根据溴化银可作感光材料;
Ⅱ.氢氧化镁能与盐酸反应生成氯化镁和水;分离固体难溶物与水用过滤的方法;镁能在二氧化碳中燃烧,方程式为2Mg+CO2
2MgO+C;点燃 .
Ⅲ.溶液中的杂质离子为钙离子、镁离子、和硫酸根离子,根据镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子进行分析.(1)海水中主要含有氯化钠、氯化镁、氯化钙、硫酸镁等,所以海水中主要含有Na+、Ca2+、Mg2+、Cl-、SO42-;故答案为:Na+、Ca2+、Mg2+、Cl-、SO42-;(2)天然海水吸收了含硫烟气后,要用O2进行氧化处理,氧气将H2SO...
点评:
本题考点: 海水资源及其综合利用;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题较为综合,涉及知识点较多,需要灵活运用所学知识解答,培养了学生的思维能力,难度较大. - 1年前
相关推荐
- “天蓝蓝海蓝蓝,海边小城威海卫”。威海海水资源丰富,回答下列问题:
“天蓝蓝海蓝蓝,海边小城威海卫”。威海海水资源丰富,回答下列问题:
(1)海水中主要含有 等离子(写离子符号,至少答出4种)。
(2)海水脱硫是一种有效除去火力发电产生的SO 2 的方法。其工艺流程如下图所示: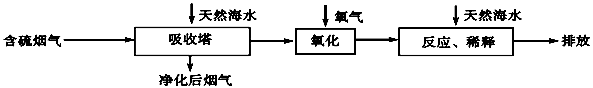
天然海水吸收了含硫烟气后,要用O 2 进行氧化处理,其反应的化学方程式是: ;氧化后的“海水”需要用大量的天然海水与之混合后才能排放,该操作的主要目的是 。
(3)下图是海水综合利用的一个方面。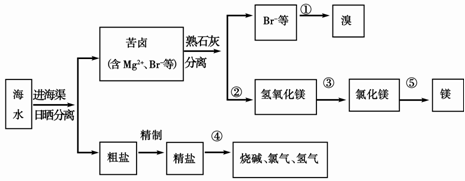
请回答下列问题:
I.①步主要反应的离子方程式: 。
溴及其化合物的用途有很多,写出其中的一种 。
II.第③步需要加入 ,其前面分离出氢氧化镁的操作称为 ,将镁条在二氧化碳中燃烧的产物为 。
III.粗盐水仍含有可溶性的CaCl 2 、MgCl 2 、Na 2 SO 4 等杂质,通过如下几个实验步骤,可制得纯净的食盐水:① 加入稍过量的Na 2 CO 3 溶液;② 加入稍过量的NaOH溶液;③ 加入稍过量的BaCl 2 溶液;④滴入稀盐酸至无气泡产生;⑤ 过滤正确的操作顺序是 lgm2wjn1年前1
lgm2wjn1年前1 -
 qianchao123 共回答了18个问题
qianchao123 共回答了18个问题 |采纳率94.4%(1)Na + 、K + 、Ca 2+ 、Mg 2+ 、Cl - 、SO 4 2 - 、Br - 、I - 、CO 3 2 - 、HCO 3 - (2分)
(2)2H 2 SO 3 +O 2 === 2H 2 SO 4 (1分)
中和、稀释经氧气氧化后海水中生成的酸(1分)
(3)I.2Br - +Cl 2 ===2Cl - +Br 2 (1分)
抗爆剂 感光材料 杀虫剂 镇静剂等(1分)
II. 盐酸(1分)过滤 (1分) MgO C(1分)
III.③②①⑤④或③①②⑤④(2分)
1年前查看全部
- 跪求天蓝蓝海蓝蓝阅读答案
 雨夜蒙蒙1年前1
雨夜蒙蒙1年前1 -
 xhliucem 共回答了15个问题
xhliucem 共回答了15个问题 |采纳率100%为什么说是“青涩时光”?
突出了在那一段时光中,同学从不成熟与幼稚的思想中逐渐长大.
理解题目标题
以老师蔚海蓝的名字命名,引出以下的故事,概括了故事的情节.
海蓝蓝指的是地理课老师(蔚海蓝),天蓝蓝只的是彭涛.
因为本文的题目以老师——蔚海蓝的名字命名,突出了在那一段时光中,同学从不成熟与幼稚的思想中逐渐长大
二人相识“戏剧性”指什么而言
指彭涛捧着本子撞上地理老师而言1年前查看全部
- “天蓝蓝海蓝蓝,海边小城威海卫”.威海海水资源丰富,回答下列问题:
“天蓝蓝海蓝蓝,海边小城威海卫”.威海海水资源丰富,回答下列问题:
(1)海水中主要含有______等离子(写离子符号,至少答出4种).
(2)海水脱硫是一种有效除去火力发电产生的SO2的方法.其工艺流程如图所示:
天然海水吸收了含硫烟气后,要用O2进行氧化处理,其反应的化学方程式是:______;氧化后的“海水”需要用大量的天然海水与之混合后才能排放,该操作的主要目的是______.
(3)如图是海水综合利用的一个方面.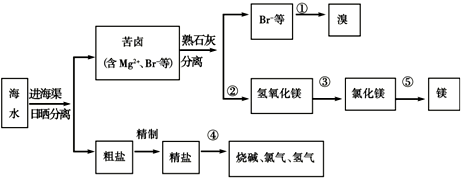
请回答下列问题:
I.①步主要反应的离子方程式:______.
溴及其化合物的用途有很多,写出其中的一种______.
Ⅱ.第③步需要加入______,其前面分离出氢氧化镁的操作称为______,将镁条在二氧化碳中燃烧的产物为______.
Ⅲ.粗盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2溶液;④滴入稀盐酸至无气泡产生;⑤过滤;正确的操作顺序是______. ysddyyj1年前1
ysddyyj1年前1 -
 袂拍ss 共回答了21个问题
袂拍ss 共回答了21个问题 |采纳率100%解题思路:(1)根据海水中主要含有氯化钠、氯化镁、氯化钙、硫酸镁等;
(2)天然海水吸收了含硫烟气后,含有亚硫酸,具有还原性,可被氧气氧化生成硫酸;利用酸、碱反应分析混合的目的;
(3)海水日晒分离析出氯化钠和卤水,粗盐提纯精制得到精盐,电极饱和食盐水生成氢氧化钠、氯气和氢气;苦卤加入熟石灰过滤得到氢氧化镁沉淀和滤液,通入氯气氧化溴离子得到溴单质;氢氧化镁分解生成氧化镁,电解熔融氧化镁得到镁单质;
Ⅰ.①步主要反应是氯气氧化溴离子生成单质溴和氯离子;根据溴化银可作抗爆剂 感光材料 杀虫剂 镇静剂等;
Ⅱ.氢氧化镁能与盐酸反应生成氯化镁和水;分离固体难溶物与水用过滤的方法;镁能在二氧化碳中燃烧,方程式为2Mg+CO2
2MgO+C;点燃 .
Ⅲ.溶液中的杂质离子为钙离子、镁离子、和硫酸根离子,根据镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子进行分析.(1)海水中主要含有氯化钠、氯化镁、氯化钙、硫酸镁等,所以海水中主要含有Na+、Ca2+、Mg2+、Cl-、SO42-、Br-、I-、CO32-、HCO3-,
故答案为:Na+、Ca2+、Mg2+、Cl-、SO42-、Br-、I-、CO32-、HCO3-;
(2)天然海水吸收了含硫烟气后,要用O2进行氧化处理,氧气将H2SO3氧化为硫酸,该反应为:2H2SO3+O2═2H2SO4;氧化后的“海水”呈酸性,天然海水呈碱性,两者混合后才能排放,是为了中和、稀释经氧气氧化后海水中生成的酸,
故答案为:2H2SO3+O2═2H2SO4;中和、稀释经氧气氧化后海水中生成的酸;
(3)Ⅰ.第①步主要反应是氯气氧化溴离子生成单质溴和氯离子,离子方程式为:2Br-+Cl2═2Cl-+Br2;溴及其化合物的用途为抗爆剂、感光材料、杀虫剂、镇静剂等,如AgBr作感光材料,
故答案为:2Br-+Cl2═2Cl-+Br2;抗爆剂、感光材料、杀虫剂、镇静剂等;
II.第③步是氢氧化镁与盐酸反应生成氯化镁和水,需要加入盐酸;氢氧化镁不溶于水,可用过滤分离;镁能在二氧化碳中燃烧,方程式为:2Mg+CO2
点燃
.
2MgO+C,
故答案为:盐酸;过滤;MgO、C;
III.首先要把粗盐溶于水形成溶液,然后镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可以将镁离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,至于先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,所以正确顺序为:②③①⑤④或③②①⑤④或③①②⑤④;
故答案为:②③①⑤④或③②①⑤④或③①②⑤④.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用;海水资源及其综合利用.
考点点评: 本题较为综合,涉及知识点较多,需要灵活运用所学知识解答,培养了学生的思维能力,难度较大.1年前查看全部
- “天蓝蓝海蓝蓝,海边小城威海卫”.威海海水资源丰富,回答下列问题:
“天蓝蓝海蓝蓝,海边小城威海卫”.威海海水资源丰富,回答下列问题:
(1)海水中主要含有______等离子(写离子符号,至少答出4种).
(2)海水脱硫是一种有效除去火力发电产生的SO 2 的方法.其工艺流程如图甲所示,天然海水吸收了含硫烟气后,要用O 2 进行氧化处理,其反应的化学方程式是:______;氧化后的“海水”需要用大量的天然海水与之混合后才能排放,该操作的主要目的是______.
(3)图乙是海水综合利用的一个方面.
请回答下列问题:
Ⅰ.①步主要反应的离子方程式:______.溴及其化合物的用途有很多,写出其中的一种______.
Ⅱ.第③步需要加入______,其前面分离出氢氧化镁的操作称为______,将镁条在二氧化碳中燃烧的产物为______.
Ⅲ.粗盐水仍含有可溶性的CaCl 2 、MgCl 2 、Na 2 SO 4 等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na 2 CO 3 溶液;
②加入稍过量的NaOH溶液;
③加入稍过量的BaCl 2 溶液;
④滴入稀盐酸至无气泡产生;
⑤过滤
正确的操作顺序是______. vbane22aj787a1年前1
vbane22aj787a1年前1 -
 luxingyi 共回答了16个问题
luxingyi 共回答了16个问题 |采纳率93.8%(1)海水中主要含有氯化钠、氯化镁、氯化钙、硫酸镁等,所以海水中主要含有Na + 、Ca 2+ 、Mg 2+ 、Cl - 、SO 4 2- ;
故答案为:Na + 、Ca 2+ 、Mg 2+ 、Cl - 、SO 4 2- ;
(2)天然海水吸收了含硫烟气后,要用O 2 进行氧化处理,氧气将H 2 SO 3 氧化为硫酸,该反应为:2H 2 SO 3 +O 2 ═2H 2 SO 4 ;氧化后的“海水”呈酸性,天然海水呈碱性,两者混合后才能排放,是为了中和、稀释经氧气氧化后海水中生成的酸;
故答案为:2H 2 SO 3 +O 2 ═2H 2 SO 4 ;中和、稀释经氧气氧化后海水中生成的酸;
(3)Ⅰ.第①步主要反应是氯气氧化溴离子生成单质溴和氯离子,离子方程式为:2Br - +Cl 2 ═2Cl - +Br 2 ;溴化银可作感光材料;
故答案为:2Br - +Cl 2 ═2Cl - +Br 2 ;溴化银可作感光材料;
II.第③步是氢氧化镁与盐酸反应生成氯化镁和水,需要加入盐酸;氢氧化镁不溶于水,可用过滤分离;镁能在二氧化碳中燃烧,方程式为:2Mg+CO 2
点燃
.
2MgO+C,
故答案为:盐酸;过滤;MgO和C;
III.首先要把粗盐溶于水形成溶液,然后镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可以将镁离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,至于先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,所以正确顺序为:②③①⑤④或③②①⑤④或③①②⑤④;
故答案为:②③①⑤④或③②①⑤④或③①②⑤④;1年前查看全部
大家在问
- 1假设变量lng为长整形变量,下面不能正常执行的语句是()a.lng=4*0.5*16384 b.lng=190^2 c.
- 21+2+3-4+5+6+7-8+······+29+30+31-32=
- 3英语翻译
- 4逻辑推理题求解,逻辑推理题:如果:1=1,2=2,3=3,4=5,5=8,6=10,7=13,8=16,9=23,10=
- 5你认为无土栽培液中含有哪些无机盐
- 6哪位化学高手能够帮我找一下人教版的选修三,选修四的跟踪练习题?网址也行!(=^ω^=)要精炼点的……跪...
- 7一条路已修的是未修的5分之4,已经修了全长的几分之几,未修的比已修的多全长的几分之几
- 8( )实践,()长逝,( )早生,( )追求.
- 9如何看化学课本
- 10在一个三角形中有两个内角都是35度则第三个内角是多少.这个三角形按角分是什么三角形,按边分是什么三角
- 11急求小学美术有创新的教案,内容要求限定在四到6年级的第一册,一单元里,随便哪课都可以,
- 12Direction:Complete the following sentences by translating in
- 13有一桶百分之45的盐水,加入一些水后,变成了百分之30的盐水,再加入20千克百分之10的盐水混合后变为百分之
- 14如图,△ABC≌△CDE,∠BAC=44°,∠BCA=36°,则∠EDC=______度.
- 15图凑活看吧,郁闷的画了半天...
