含氮化合物芳香性(11-2中的三如何判断)
 wtysteven2022-10-04 11:39:540条回答
wtysteven2022-10-04 11:39:540条回答
已提交,审核后显示!提交回复
共0条回复
相关推荐
- (2012•昌平区一模)氮气是制备含氮化合物的一种重要物质.工业上可在碱性溶液中,通过电解的方法实现由N2制取NH3,反
(2012•昌平区一模)氮气是制备含氮化合物的一种重要物质.工业上可在碱性溶液中,通过电解的方法实现由N2制取NH3,反应的化学方程式为:2N2+6H2O
4NH3+3O2.计算生产136t NH3所需N2的质量.通电 . kattyxia1年前1
kattyxia1年前1 -
 津元宝 共回答了18个问题
津元宝 共回答了18个问题 |采纳率77.8%生产136t NH3所需N2的质量为X则:
2N2+6H2O
通电
.
4NH3+3O2.
56 68
X 136t
[56/68=
X
136t]
解得X=112t;
答:生产136t NH3所需N2的质量为112t.1年前查看全部
- 下列含氮化合物中,氮元素化合价由高到低排列的一组是 [ ]
下列含氮化合物中,氮元素化合价由高到低排列的一组是 [ ]
下列含氮化合物中,氮元素化合价由高到低排列的一组是 [ ]
A.NH3 NO HNO3
B.N2O5 N2O4 NO2
C.HNO3 NO2 NH3
D.NO NO2 N2O3
为什么选C,我觉得B 也对啊,又没说不能一样. 张喜11年前1
张喜11年前1 -
 frank_c_xiang 共回答了21个问题
frank_c_xiang 共回答了21个问题 |采纳率85.7%里面涉及到的物质有:
NH3 NO HNO3 N2O5 N2O4 NO2 N2O3
根据化合物中各元素化合价的代数和为零的原则,其余的元素就是氢(+1)和氧元素(-2)了,
可求 得各物质中氮元素的化合价为NH3 中负3、NO中正2、HNO3中正5、N2O5 中正5、N2O4 正4、NO2 中正4、N2O3正3,所以在各选项中:
A.NH3(-3) NO(+2) HNO3(+5)
B.N2O5(+5) N2O4(+4) NO2(+4)
C.HNO3(+5) NO2(+4) NH3)(-3)
D.NO(+2)NO2 (+4)N2O3(+3)
应该选择C.
你认为B也可以,但是N2O4和NO2是一样的化合价,谈不上高低,而题目问的却是由高到低,B自然不符合题意了.1年前查看全部
- (2010•石家庄模拟)某化学课外活动小组为探究氮化合物的性质,设计了如图所示实验装置,A处是气体发生装置.
(2010•石家庄模拟)某化学课外活动小组为探究氮化合物的性质,设计了如图所示实验装置,A处是气体发生装置.

按如图连接好各仪器,检查装置气密性后,先将C处铂丝网加热至红热,再将A处产生的无色气体通过后面装置.片刻后可观察到F中Cu片慢慢溶解.请回答下列问题:
(1)A中制取气体时只使用一种药品,它可以是______(填字母);
a.NH4HCO3固体b.NH4C1固体 C.NaHCO3固体d.浓氨水
在以上几种情况下A装置中均适用的玻璃仪器有______(填字母).
a.烧瓶b.试管c.烧杯d.锥形瓶e.酒精灯
(2)E装置可防止F中溶液倒吸进入D,请在图中画出装置E中的导气管.
(3)写出C中发生反应的化学方程式4NH3+5O2
4NO+6H2O催化剂 .△ 4NH3+5O2,C处加热片刻后撤去酒精灯,铂丝仍保持红热,原因是______.
4NO+6H2O催化剂 .△
(4)若进入F装置的物质成分和质量一定,可向F中加入下列物质中的______(填字母)使Cu片溶解的质量增多.
a.Na2 CO3b.NaClc.CuSO4d.H2SO4
(5)指导老师认为他们设计的这套实验装置还存在一处明显的缺陷,改进建议为______. 怀恨天1年前1
怀恨天1年前1 -
 水间梦 共回答了17个问题
水间梦 共回答了17个问题 |采纳率88.2%解题思路:(1)根据题中信息推断装置A中产生的气体,然后根据要求判断药品;根据反应原理选择使用的仪器;
(2)根据E的作用是防止F中溶液倒吸进入D分析导气管长短情况;
(3)C中发生反应为氨气和氧气在催化剂作用下发生氧化还原反应生成一氧化氮和水;根据该反应为放热反应分析C处加热片刻后撤去酒精灯,铂丝仍保持红热原因;
(4)根据铜与稀硝酸反应的离子方程式判断氢离子和硝酸根离子消耗情况;
(5)没有处理尾气,尾气中的有毒气体会污染空气,应加上尾气处理装置.(1)根据题意:C处铂丝网加热至红热,再将A处产生的气体通过B装置片刻后,撤去C处酒精灯,铂丝继续保持红热,F处铜片逐渐溶解,说明有硝酸生成,所以A中获得的是氨气,加热NH4HCO3或浓氨水都可以产生氨气,制取氨气反应中A装置均适用的玻璃仪器有试管和酒精灯,
故答案为:ad;be;
(2)由于E的作用是防止F中溶液倒吸进入D,所以连接D的导管不能够伸入集气瓶底部即可,如图: ,
,
故答案为: ;
;
(3)C中氨气与氧气发生了氧化还原反应,反应的方程式为:4NH3+5O2
催化剂
.
△ 4NO+6H2O,由于该反应为放热反应,C处加热片刻后撤去酒精灯,铂丝仍保持红热,
故答案为:4NH3+5O2
催化剂
.
△ 4NO+6H2O;该反应为放热反应;
(4)根据反应可知,3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,反应中消耗的氢离子物质的量大于硝酸根离子的物质的量,所以向溶液中只要加入氢离子,就可以溶解更多的铜,所以应该加入硫酸,故选d;
(5)铜和硝酸反应的产物一氧化氮以及生成的二氧化氮均有毒,能够污染大气,应加一个尾气吸收装置,故答案为:应在F后面加上尾气处理装置.点评:
本题考点: 氨的制取和性质.
考点点评: 本题主要考查学生氨气的化学性质,题目难度较大,结合实验的方式来考查,增大了难度,要求学生熟练掌握氨气的制法及化学性质,是高考中的常见题型,对学生的思维能力提出了较高的要求,充分考查了学生灵活应用所学知识解决实际问题的能力.1年前查看全部
- 下列说法不正确的是( ) A.所有的复分解反应都是非氧化还原反应 B.使空气中游离态的氮转化为含氮化合物的方法叫做氮的
下列说法不正确的是( ) A.所有的复分解反应都是非氧化还原反应 B.使空气中游离态的氮转化为含氮化合物的方法叫做氮的固定 C.静电除尘利用了胶体能发生电泳的性质 D.液氨、液氯、液态氯化氢都是非电解质  13520XIXI1年前1
13520XIXI1年前1 -
 761011 共回答了20个问题
761011 共回答了20个问题 |采纳率100%A、复分解反应中没有电子的转移,所以不是氧化还原反应,故A正确.
B、氮的固定就是把氮的单质转化为化合物的方法,注意氮的固定是方法,故B正确.
C、胶体具有吸附性,所以胶粒带电,在通电情况下,胶粒能定向移动,所以静电除尘利用了胶体能发生电泳的性质,故C正确.
D、液氨是非电解质,液氯既不是电解质也不是非电解质,液态氯化氢是电解质,故D错误.
故选D.1年前查看全部
- 下列含氮化合物中,氮元素化合价之和为零的是 NH3 NH4NO3 NH4NO2 NO2
 uu夜半1年前3
uu夜半1年前3 -
 胭脂香R 共回答了15个问题
胭脂香R 共回答了15个问题 |采纳率93.3%应该是NH4N02 前面的N属于铵根 所以NH4为+1价 N就为-3价 因为化合物单质单独出现是显0价 所以NO2应该为-1价以配合前面的NH4的+1价 所以N应该为+3价 (NO2中02为-4那么N就为+3价) NH4中的N为-3价 而NO2中的N为+3价 所以两者之和是0.1年前查看全部
- 含氮化合物如何鉴别?
 dxzll1年前2
dxzll1年前2 -
 52mj 共回答了13个问题
52mj 共回答了13个问题 |采纳率92.3%例如:氯化胆碱掺入含氮化合物的识别:
当氯化胆碱中掺入氯化铵、硝酸盐、亚硝酸盐、尿素及脲醛聚合物时,不能用凯氏定氮法测定,可利用四苯硼钠沉淀提取定氮法来加以识别.即把四苯硼钠重量法形成的沉淀,以凯氏定氮法测其沉淀物中的含氮量,再间接地测出氯化胆碱的含量.
当掺入或氯化胆碱合成过程中人为残留的三甲胺时,用雷氏盐重量法可较准确地检测出氯化胆碱的含量.因该方法在用雷氏盐沉淀前已将样品经加碱煮沸去氨,可达到分解三甲胺的目的,而氯化胆碱为季胺盐,与碱作用可形成一个平衡体系,不会生成三甲胺(或氨).此外,若要同时测氯化胆和三甲胺的含量,可用凯氏定氮法,即先将样品加水提取、过滤出可溶性的含氮物,滤液用凯氏定氮法经消化、蒸馏、定氮,测出样品中总的含氮量(N总),另取滤液不经消化直接蒸馏、定氮,测出样品中三甲胺的含氮量(N三甲胺),样品中氯化胆碱的实际含氮量(N胆碱 = N总 - N三甲胺).这是根据三甲胺加碱可分解成氨来定氮,而氯化胆碱(为四级胺盐)不能直接与碱反应分解成氨定氮,必须经浓硫酸消化、蒸馏后才能定氮.
当掺入四级胺(如六次甲基四胺)时,由于它和氯化胆碱一样为季胺盐,用雷氏盐重量法检测时,不能被碱分解而干扰测定.此时,必须采用酸、碱水解雷氏盐重量法,即先将样品加2 mol/L硫酸溶液10 ml煮沸30 min ,使六次甲基四胺分解后,再加碱煮沸去氨,在PH 6 左右与雷氏盐反应,形成的粉红色沉淀用重量法即可准确地检测出氯化胆碱的含量.1年前查看全部
- 含氮化合物碱性大小判断
 飞的日子1年前1
飞的日子1年前1 -
 yijuyy799 共回答了19个问题
yijuyy799 共回答了19个问题 |采纳率84.2%仲胺>伯胺>叔胺>NH3>吡啶>Ph-NH2
如果是氨基酸,则需比较氨基和羧基的数目,氨基越多碱性越大.1年前查看全部
- 比金刚石硬的碳氮化合物的化学式!急
 快意浮生1年前2
快意浮生1年前2 -
 我补充几点 共回答了28个问题
我补充几点 共回答了28个问题 |采纳率85.7%C3N41年前查看全部
- (2012•株洲)下列含氮化合物中,氮元素化合价由高到低排列的一组是( )
(2012•株洲)下列含氮化合物中,氮元素化合价由高到低排列的一组是( )
A.NH3NOHNO3
B.N2O5N2O4NO2
C.HNO3 NO2NH3
D.NONO2N2O3 2q2q2q2q2q1年前1
2q2q2q2q2q1年前1 -
 andy_yangs 共回答了23个问题
andy_yangs 共回答了23个问题 |采纳率95.7%解题思路:根据在化合物中正负化合价代数和为零,结合各选项中的化学式进行解答本题.A、根据在化合物中正负化合价代数和为零,NH3、NO、HNO3中氮元素的化合价分别为-3、+2、+5,故选项不符合题意.
B、根据在化合物中正负化合价代数和为零,N2O5、N2O4、NO2中氮元素的化合价分别为+5、+4、+4,故选项不符合题意.
C、根据在化合物中正负化合价代数和为零,HNO3、NO2、NH3中氮元素的化合价分别为+5、+4、-3,故选项符合题意.
D、根据在化合物中正负化合价代数和为零,NO、NO2、N2O3中氮元素的化合价分别为+2、+4、+3,故选项不符合题意.
故选C.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题难度不大,考查学生利用化合价的原则计算指定元素的化合价的能力.1年前查看全部
- 现代无机化学对硫--氮化合物的研究是最为活跃的领域之一。其中下图所示是已合成的最著名的硫--氮化合物的分子结构。下列说法
现代无机化学对硫--氮化合物的研究是最为活跃的领域之一。其中下图所示是已合成的最著名的硫--氮化合物的分子结构。下列说法正确的是  [ ]
[ ]A.该物质的分子式为SN
B.该物质的分子中既有极性键,又有非极性键
C.该物质在固态时形成原子晶体
D.该物质与化合物S 2 N 2 互为同素异形体 轩辕枫1年前1
轩辕枫1年前1 -
 wsp001 共回答了19个问题
wsp001 共回答了19个问题 |采纳率100%B1年前查看全部
- 下列与含氮化合物有关的说法不正确的是
下列与含氮化合物有关的说法不正确的是
A合成氨是氮的固定的主要方法之一
B向硝酸亚铁溶液中滴加盐酸,溶液颜色会由浅绿色变为黄色
C浓硝酸具有强氧化性,但是不能氧化金属铝,所以可用铝制容器盛装
D NO2与水的反应中,当有22.4LNO(标况下)生成时,需要转移2Na个电子(Na为阿伏伽德罗常数) joy2410151年前1
joy2410151年前1 -
 鱼峰啤酒 共回答了29个问题
鱼峰啤酒 共回答了29个问题 |采纳率96.6%C浓硝酸具有强氧化性,但是不能氧化金属铝,所以可用铝制容器盛装
解析
不是铝和浓硝酸不反应而是因为铝遇见浓硝酸后表面会生成一层致密的氧化膜阻止反应继续发生!1年前查看全部
- 若生活污水中含有大量的氮化合物,通常用生物膜脱氮工艺进行处理:首先在硝化细菌的作用下将NH4+氧化为NO3-:NH4+
若生活污水中含有大量的氮化合物,通常用生物膜脱氮工艺进行处理:首先在硝化细菌的作用下将NH4+氧化为NO3-:NH4+ +2O2 =NO3- +2H+ +H2O,然后加入甲醇,NO3-和甲醇转化为两种无毒气体.请写出加入甲醇后反应的离子方程式:
最好能有系数比~ chenweiwei_fiend1年前3
chenweiwei_fiend1年前3 -
 poipoi小虫 共回答了20个问题
poipoi小虫 共回答了20个问题 |采纳率85%6H+ + 6NO3- +5CH3OH === 5CO2 + 3N2 +13H2O1年前查看全部
- (2013•闵行区二模)现代无机化学对硫-氮化合物的研究是最为活跃的领域之一.如图是已经合成的最著名的硫-氮化合物的分子
 (2013•闵行区二模)现代无机化学对硫-氮化合物的研究是最为活跃的领域之一.如图是已经合成的最著名的硫-氮化合物的分子结构.下列说法正确的是( )
(2013•闵行区二模)现代无机化学对硫-氮化合物的研究是最为活跃的领域之一.如图是已经合成的最著名的硫-氮化合物的分子结构.下列说法正确的是( )
A.该物质的分子式为SN
B.该物质的分子中既含有极性键又含有非极性键
C.该物质具有很高的熔、沸点
D.该物质与化合物S2N2互为同素异形体 cc上太阳升1年前1
cc上太阳升1年前1 -
 luotao047 共回答了14个问题
luotao047 共回答了14个问题 |采纳率92.9%解题思路:A.该化合物属于分子晶体,该结构中的原子个数属于一个分子中的,根据结构确定其分子式;
B.不同非金属元素之间形成极性键;
C.根据晶体类型确定其熔沸点高低;
D.由同种元素组成的不同单质互称同素异形体,同素异形体首先必须是单质.A.由图知该物质的分子式为S4N4,故A错误;
B.该物质的分子中既有极性键(N-S)又有非极性键(S-S),故B正确;
C.该物质属于分子晶体,分子晶体的熔沸点一般较低,故C错误;
D.由同种元素组成的不同单质互称同素异形体,S2N2和S4N4都是化合物,故D错误.
故选:B.点评:
本题考点: 物质的结构与性质之间的关系.
考点点评: 本题考查分子式的确定、极性键、同素异形体等知识点,注意分子晶体的熔沸点一般较低,易错选项是A,注意不能利用均摊法确定其化学式.1年前查看全部
- (2010•合肥三模)现代无机化学对硫一氮化合物的研究是最为活跃的领域之一.其中图是已经合成的最著名的硫一氮化合物的分子
 (2010•合肥三模)现代无机化学对硫一氮化合物的研究是最为活跃的领域之一.其中图是已经合成的最著名的硫一氮化合物的分子结构.下列说法错误的是( )
(2010•合肥三模)现代无机化学对硫一氮化合物的研究是最为活跃的领域之一.其中图是已经合成的最著名的硫一氮化合物的分子结构.下列说法错误的是( )
A.该物质的分子式为S4N4
B.该物质与化合物s2N2互为同素异形体
C.该物质的分子结构中含有极性键
D.该物质中所含化学键S-N键能小于N2中N≡N键能 娜帝阿1年前1
娜帝阿1年前1 -
 找不到港湾的船 共回答了15个问题
找不到港湾的船 共回答了15个问题 |采纳率93.3%解题思路:A、根据图片确定该物质的分子式.
B、同种元素的不同单质互称同素异形体.
C、同种非金属元素之间形成非极性共价键,不同非金属元素之间形成极性共价键.
D、键长越短,键能越大.A、根据图片知,该物质的分子式是S4N4,故A正确.
B、S4N4与s2N2都是化合物不是单质,所以不能互为同素异形体,故B错误.
C、该物质的分子结构中含有S-N极性键,故C正确.
D、硫原子的原子半径大于N原子的原子半径,原子半径越长,键长就越长,键长越短键能越大,所以该物质中所含化学键S-N键能小于N2中N≡N键能,故D正确.
故选B.点评:
本题考点: 判断简单分子或离子的构型;同素异形体;极性键和非极性键.
考点点评: 本题考查了化学键、同素异形体、键能与键长的关系等知识点,难度不大,注意同素异形体必须首先是单质.1年前查看全部
- 雷电交加的时候,空气里的氮气和有关的含氮化合物发生了哪些化学反应,产生了哪些物质
 瑶曦妍1年前1
瑶曦妍1年前1 -
 pluto_angle 共回答了20个问题
pluto_angle 共回答了20个问题 |采纳率90%N2+O2 --->2NO
2NO+O2--->2NO2
2NO2===N2O41年前查看全部
- 如图表示油菜种子成熟过程中各种有机物的变化情况(1表示可溶性糖,2表示淀粉,3表示含氮化合物,4表示油脂),请据图回答:
如图表示油菜种子成熟过程中各种有机物的变化情况(1表示可溶性糖,2表示淀粉,3表示含氮化合物,4表示油脂),请据图回答:

(1)油菜种子成熟过程中,______含量不断提高,而______和______含量不断下降,这说明______而来的.
(2)含氮物质在种子未成熟前为非蛋白氮,随着种子成熟程度的提高,含氮物质主要为蛋白质.这说明蛋白质是由非蛋白氮转变而来的,与这种现象相适应的是成熟种子的细胞质中______(填写物质名称)含量较多,以合成丰富的蛋白质.
(3)由图可知,油菜种子是用于检测______的好材料,采用的化学试剂是______. cy761年前1
cy761年前1 -
 hhu_06 共回答了27个问题
hhu_06 共回答了27个问题 |采纳率96.3%解题思路:由图可知,细胞中可溶性糖和淀粉的含量下降,含氮化合物含量基本不变,油脂含量升高.(1)种子成熟过程中,油脂含量不断提高,但可溶性糖、淀粉等减少,说明油脂可以由淀粉、可溶性还原糖转化而来.
(2)蛋白质合成包括转录和翻译过程,蛋白质合成增多,说明细胞中转录过程合成的RNA增多.
(3)由图可知,油菜种子中油脂含量较多,是检测油脂的好材料,脂肪用苏丹Ⅲ来鉴定,会出现橘黄色微粒.
故答案为:
(1)油脂 可溶性糖 淀粉 油脂是由糖类(或可溶性糖和淀粉)转化
(2)RNA或mRNA
(3)油脂 苏丹Ⅲ染液点评:
本题考点: 脂质的种类和作用的综合;糖类的种类及其分布和功能;检测脂肪的实验.
考点点评: 本题考查细胞中化合物相关知识,要求学生具备识图能力,理解细胞中化合物可以相互转换.1年前查看全部
- 硫单质及含硫化合物之间的关系图,氮气及含氮化合物之间的关系图,3Q
 tlltandy1年前1
tlltandy1年前1 -
 黄梁一梦 共回答了25个问题
黄梁一梦 共回答了25个问题 |采纳率88%我的百度空间有这个关系图1年前查看全部
- (2009•静安区一模)图是已经合成的一种硫氮化合物的分子结构,下列说法中正确的是( )
 (2009•静安区一模)图是已经合成的一种硫氮化合物的分子结构,下列说法中正确的是( )
(2009•静安区一模)图是已经合成的一种硫氮化合物的分子结构,下列说法中正确的是( )
A.该物质属原子晶体
B.该物质具有很高的熔、沸点
C.该物质的分子中既有极性键又有非极性键
D.该物质与化合物S2N2互为同素异形体 爱情cc绝了1年前1
爱情cc绝了1年前1 -
 deb1f7f 共回答了20个问题
deb1f7f 共回答了20个问题 |采纳率75%解题思路:原子晶体一般时空间网状结构,分子晶体的熔沸点一般较低,在化合物中非金属元素间易形成极性键,同种非金属元素间易形成非极性键;由同种元素组成的不同单质互称同素异形体,同素异形体首先必须是单质.A、根据图知,该结构不是空间网状结构,所以该物质不是原子晶体,故A错误.
B、分子晶体的熔沸点一般较低,故B错误.
C、该物质的分子中既有极性键(N-S)又有非极性键(S-S),故C正确.
D、由同种元素组成的不同单质互称同素异形体,S2N2和S4N4都是化合物,故D错误.
故选C.点评:
本题考点: 晶体的类型与物质熔点、硬度、导电性等的关系;同素异形体;极性键和非极性键.
考点点评: 本题考查了极性键、非极性键、同素异形体等知识点,难度不大,注意同素异形体首先必须是单质,注意基础知识的积累.1年前查看全部
- 简述水体中含氮化合物各型体之间的转换关系,如何利用测定结果进行水质变化趋势的
 luck881年前1
luck881年前1 -
 sunkai561 共回答了20个问题
sunkai561 共回答了20个问题 |采纳率85%有复杂有机物转换为氨氮,这叫氨化,速度较快
氨氮会在亚硝化菌、硝化菌作用下,在好氧条件下把氨氮氧化成硝酸盐和亚硝酸盐,这叫硝化
硝酸盐和亚硝酸盐在外界提供有机碳源情况下,由反硝化菌把硝酸盐和亚硝酸盐还原成氮气叫反硝化
通过测定各种态的氮就能判断水体处于哪个自净阶段了1年前查看全部
- 有NH4CI.NH3.NH4NO3.三种含氮化合物,从含氮量高低的角度判断,哪种物质做氮肥时肥效好?
有NH4CI.NH3.NH4NO3.三种含氮化合物,从含氮量高低的角度判断,哪种物质做氮肥时肥效好?
有NH4CI.NH3.NH4NO3.三种含氮化合物,从含氮量高低的角度判断,哪种物质做氮肥时肥效好? ullser1年前2
ullser1年前2 -
 心情文字 共回答了12个问题
心情文字 共回答了12个问题 |采纳率100%NH4CI.14/53.5*100%=26.17%
NH3.14/17*100%= 82.35%
NH4NO3 28/80*100%=35%
所以从含氮量高低的角度判断,氨气 做氮肥时肥效好1年前查看全部
- 大气中有哪些重要含氮化合物?说明它们的天然来源和人为来源及环境的污染?
 喃喃细语5251年前2
喃喃细语5251年前2 -
 yizhijie 共回答了10个问题
yizhijie 共回答了10个问题 |采纳率80%含氮化合物是大气中各种含氮化合物的总称.N2和02是天然大气中的重要组成成分,当空气混合燃烧时,特别是在高温下,N2和02就会化合成氮的各种化合物.
在氮氧化物这一大家族中,主要包括NO,N02,N20,N205,NH3,以及它们通过各种大气反应而生成的硝酸盐、亚硝酸盐、铵盐和过氧己酰硝酸酯(PAN)等.
除高温作用可形成NO,N02外,还可通过闪电、微生物固定及NH3的氧化等各种天然源和煤、油、天然气、机动车燃料燃烧等人为污染源进入大气.五色无味的NO和有刺激性、带红棕色的N02均是大气中重要污染物,在环境科学上通常用NOx表示.NOx的来源主要是氮肥的生产和使用、化石燃料燃烧及工业生产排放等,其中尤以汽车燃料排出的尾气造成的污染最为严重.据估计每燃烧1吨煤大约产生8—9kgNOx,全世界人为源每年排放的氮氧化物大约为10800吨,是各种天然来源的NOx数量的几倍.
硝酸盐和亚硝酸盐同样也是形成酸雨的重要因素之一,而PAN则是导致光化学烟雾的重要二次污染物.1年前查看全部
- 氨气完全燃烧产物为什么是氮气而不是正五价的氮化合物
氨气完全燃烧产物为什么是氮气而不是正五价的氮化合物
氨气燃烧同样可以生成NO啊,为什么不能是NO2或者其他的氧化物捏 8bi3fduqa1年前2
8bi3fduqa1年前2 -
 冬天戴草帽 共回答了17个问题
冬天戴草帽 共回答了17个问题 |采纳率94.1%因为N2稳定的要死,在燃烧条件下根本不会被氧化
NH3是不能燃烧生成NO的,只有在特定的催化剂下和O2才能生成NO,燃烧只能生成N21年前查看全部
- (3分)氮气是制备含氮化合物的一种重要物质。工业上可在碱性溶液中,通过电解的方法实现由N 2 制取NH 3 ,反应的化学
(3分)氮气是制备含氮化合物的一种重要物质。工业上可在碱性溶液中,通过电解的方法实现由N 2 制取NH 3 ,反应的化学方程式为:2N 2 + 6H 2 O
 4NH 3 + 3O 2 。计算生产136t NH 3 所需N 2 的质量。
4NH 3 + 3O 2 。计算生产136t NH 3 所需N 2 的质量。 夫欲静而妻不止1年前1
夫欲静而妻不止1年前1 -
 esgh 共回答了20个问题
esgh 共回答了20个问题 |采纳率90%112t
1年前查看全部
- 氮气是制备含氮化合物的一种重要物质.工业上可在碱性溶液中,通过电解的方法实现由N 2 制取NH 3 ,反应的化学方程式为
氮气是制备含氮化合物的一种重要物质.工业上可在碱性溶液中,通过电解的方法实现由N 2 制取NH 3 ,反应的化学方程式为:2N 2 +6H 2 O
4NH 3 +3O 2 .计算生产136t NH 3 所需N 2 的质量.通电 .  kikieo1年前1
kikieo1年前1 -
 ww他娘 共回答了13个问题
ww他娘 共回答了13个问题 |采纳率92.3%生产136t NH 3 所需N 2 的质量为X则:
2N 2 +6H 2 O
通电
.
4NH 3 +3O 2 .
56 68
X 136t
56
68 =
X
136t
解得X=112t;
答:生产136t NH 3 所需N 2 的质量为112t.1年前查看全部
- NH3.H2O(一水合氨)是一种重要的含氮化合物,它易溶于水、易分解,向其水溶液里滴入酚酞试液,溶液显红色.从物质化学性
NH3.H2O(一水合氨)是一种重要的含氮化合物,它易溶于水、易分解,向其水溶液里滴入酚酞试液,溶液显红色.从物质化学性质方面来看,下列物质中可以与NH3.H2O归为一类的是( )
A. NaOH
B. H2SO4
C. CaCO3
D. Na2SO4 heqq3151年前7
heqq3151年前7 -
 wjmoo 共回答了17个问题
wjmoo 共回答了17个问题 |采纳率94.1%解题思路:NH3.H2O属于纯净物中的化合物,电离时生成的阴离子全部是氢氧根离子,属于碱类.NH3.H2O属于碱类.
A、氢氧化钠属于碱,故A正确;
B、硫酸属于酸,故B错误;
C、碳酸钙属于盐,故C错误;
D、硫酸钠属于盐,故D错误.
故选A.点评:
本题考点: 酸、碱、盐、氧化物的概念及其相互联系.
考点点评: 本题考查学生物质的分类知识,可以根据教材知识来回答,难度不大.1年前查看全部
- 正4价含硫化合物有哪些?还有正5价含氮化合物有哪些?各举5个例子
 wmorning1年前1
wmorning1年前1 -
 观伊老人 共回答了20个问题
观伊老人 共回答了20个问题 |采纳率90%亚硫酸盐中的硫都是正4价的,比如亚硫酸钠,亚硫酸钾等等.硝酸盐中的氮都是正5价,比如硝酸钠,硝酸钾,硝酸钙,硝酸钡,硝酸镁等等.1年前查看全部
- 脑磷脂中含有的含氮化合物
 strawerman1年前2
strawerman1年前2 -
 liu2002777 共回答了25个问题
liu2002777 共回答了25个问题 |采纳率96%乙醇胺.结构式为
HO-CH2-CH2-NH2.脑磷脂由甘油,脂肪酸,磷酸,和乙醇胺合成,脑磷脂也叫磷脂酰乙醇胺.1年前查看全部
- 含氮化合物必须易溶于水,才可作为肥料来使用吗?
 柯以敏1年前1
柯以敏1年前1 -
 leedacao3 共回答了17个问题
leedacao3 共回答了17个问题 |采纳率88.2%是的.因为植物吸收氮肥是吸收离子态铵和硝酸根.含氮化合物如果不溶于水,无法产生离子态铵和硝酸根,就不能被植物利用1年前查看全部
- (2013•崇明县二模)生活污水中含有大量的有机物和无机含氮化合物.脱氮是污水处理的重要内容之一.下图是生物脱氮的工艺流
(2013•崇明县二模)生活污水中含有大量的有机物和无机含氮化合物.脱氮是污水处理的重要内容之一.下图是生物脱氮的工艺流程图:

Ⅰ级反应池中有机物被氧化;Ⅱ级反应池中,在pH为8.0~8.4时,硝化细菌将NH4+转化成NO3−,其反应为:NH4++2O2→NO3−+2H++H2O.
27.请标出该反应的电子转移方向和数目.
28.该反应中,被氧化的是;还原产物是.
29.在Ⅱ级反应池的反应过程中,需要添加适量的(填“酸性”、“中性”或“碱性”)物质,理由是.
(2013•崇明县二模)生活污水中含有大量的有机物和无机含氮化合物.脱氮是污水处理的重要内容之一.下图是生物脱氮的工艺流程图:
Ⅰ级反应池中有机物被氧化;Ⅱ级反应池中,在pH为8.0~8.4时,硝化细菌将NH4+转化成NO3−,其反应为:NH4++2O2→NO3−+2H++H2O.
27.请标出该反应的电子转移方向和数目.
28.该反应中,被氧化的是;还原产物是.
29.在Ⅱ级反应池的反应过程中,需要添加适量的(填“酸性”、“中性”或“碱性”)物质,理由是.
(2013•崇明县二模)生活污水中含有大量的有机物和无机含氮化合物.脱氮是污水处理的重要内容之一.下图是生物脱氮的工艺流程图:
Ⅰ级反应池中有机物被氧化;Ⅱ级反应池中,在pH为8.0~8.4时,硝化细菌将NH4+转化成NO3−,其反应为:NH4++2O2→NO3−+2H++H2O.
27.请标出该反应的电子转移方向和数目.
28.该反应中,被氧化的是;还原产物是.
29.在Ⅱ级反应池的反应过程中,需要添加适量的(填“酸性”、“中性”或“碱性”)物质,理由是.
30.Ⅲ级反应池中,在反硝化细菌作用下,同时加入适量CH3OH将NO3-还原,进行无害化处理,其变化可表述为:
______NaNO3+______CH3OH→______+______Na2CO3+______NaHCO3+______H2O
请完成上述反应的方程式并配平. hechengrens6001年前1
hechengrens6001年前1 -
 zhaofei2626vv 共回答了13个问题
zhaofei2626vv 共回答了13个问题 |采纳率92.3%解题思路:根据题给信息,甲醇将硝酸根还原为氮气,根据化合价升降法配平方程式.在反硝化细菌作用下,同时加入适量CH3OH将NO3-还原,进行无害化处理,所以甲醇将硝酸根还原为氮气,化合价变化:+5→0,甲醇被氧化成+4价C元素,化合价变化为:-2→+4,根据化合价升降总数相等配平方程式为:6NaNO3+5CH3OH═3N2+Na2CO3+4NaHCO3+8H2O,
故答案为:6;5;3N2;1;4;8.点评:
本题考点: 氧化还原反应方程式的配平.
考点点评: 本题考查了氧化还原反应的配平,正确标出变价元素并根据化合价升降总数相等进行配平是解题的关键.1年前查看全部
- 细胞合成下列物质时,不需要含氮化合物作为原料的是 A三磷酸腺苷 B过氧化氢酶 C脂肪 D DNA和RNA 分析!
 花非花221年前1
花非花221年前1 -
 2509708 共回答了19个问题
2509708 共回答了19个问题 |采纳率100%C 脂肪 脂肪的组成元素只有C,H,O 所以不需要N
A中ATP中的腺嘌呤是含氮碱基
B中过氧化氢酶为蛋白质 氨基酸中含氮
D中核酸中都有含氮碱基1年前查看全部
- 现代无机化学对硫一氮化合物的研究是最为活跃的领域之一.其中图是已经合成的最著名的硫一氮化合物的分子结构.下列说法错误的是
现代无机化学对硫一氮化合物的研究是最为活跃的领域之一.其中图是已经合成的最著名的硫一氮化合物的分子结构.下列说法错误的是( ) A.该物质的分子式为S 4 N 4 B.该物质与化合物s 2 N 2 互为同素异形体 C.该物质的分子结构中含有极性键 D.该物质中所含化学键S-N键能小于N 2 中N≡N键能 
 小吴xiao1年前1
小吴xiao1年前1 -
 富贵的竹子 共回答了23个问题
富贵的竹子 共回答了23个问题 |采纳率91.3%A、根据图片知,该物质的分子式是S 4 N 4 ,故A正确.
B、S 4 N 4 与s 2 N 2 都是化合物不是单质,所以不能互为同素异形体,故B错误.
C、该物质的分子结构中含有S-N极性键,故C正确.
D、硫原子的原子半径大于N原子的原子半径,原子半径越长,键长就越长,键长越长键能越大,所以该物质中所含化学键S-N键能小于N 2 中N≡N键能,故D正确.
故选B.1年前查看全部
- (2012•龙岩二模)尿素()和硼砂(Na2B4O7)在高温高压下反应可以获得硼氮化合物:
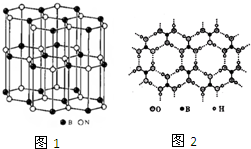 (2012•龙岩二模)尿素(
(2012•龙岩二模)尿素(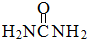 )和硼砂(na2b4o7)在高温高压下反应可以获得硼氮化合物:
)和硼砂(na2b4o7)在高温高压下反应可以获得硼氮化合物:
na2b4o7+2co(nh2)2═4(bn)+na2o+2co2↑+4h2o
(1)上述反应物中含有一种元素,其基态原子具有4种不同能量电子,写出该基态原子的电子排布式______;
(2)元素b、c、o、n第一电离能由大到小的顺序______;
(3)某硼氮化合物的结构与石墨相似(如图1),俗称“白石墨”.
①晶体中b、n原子的杂化方式分别是______;
②白石墨不能导电,原因是b、n原子之间的π键电子被______原子强烈吸引,不能自由移动;
③写出“白石墨”的一种用途______;
(4)尿素可用于制有机铁肥,主***有[fe(h2nconh2)6](no3)3[三硝酸六尿素合铁(Ⅲ)].结构测定知,1mol该配合物中含有6na个配位键.形成配位键时,提供孤对电子的原子是______;
(5)由硼砂可以制取硼酸,硼酸(h3bo3)是一种片层状结构白色晶体,层内的“h3bo3”微粒之间通过氢键相连(如图2),则下列有关说法中不正确的是______.
a.硼酸晶体属于分子晶体
b.h3bo3晶体中有氢键,因此硼酸分子较稳定
c.分子中各原子最外层均为8电子稳定结构
d.1mol h3bo3晶体中含有3mol氢键. 立志过uu1年前1
立志过uu1年前1 -
 lfz7812 共回答了21个问题
lfz7812 共回答了21个问题 |采纳率85.7%解题思路:(1)上述反应物中含有4种不同能量电子的元素是Na元素,根据构造原理书写其基态原子核外电子排布式;
(2)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第ⅡA族、第ⅤA族元素的第一电离能大于相邻元素;
(3)①根据价层电子对互斥理论确定杂化方式;
②B、N原子之间的π键电子被电负性较大的原子吸引;
③氮化硼熔点较高,能作耐火材料,故答案为:耐火材料;
(4)含有孤电子对的原子和含有空轨道的原子之间存在配位键;
(5)A.根据构成微粒判断晶体类型;
B.分子的稳定性与化学键有关;
C.该化合物中H原子不能达到8电子结构;
D.利用均摊法计算含1molH3BO3的晶体中的氢键.(1)上述反应物中含有4种不同能量电子的元素是Na元素,Na元素核外有11个电子,根据构造原理知,其基态原子核外电子排布式为:1s22s22p63s1,故答案为:1s22s22p63s1;(2)同一周期元素中,元素的第一电离能随着原...
点评:
本题考点: 原子核外电子排布;元素电离能、电负性的含义及应用;化学键;配合物的成键情况;原子轨道杂化方式及杂化类型判断.
考点点评: 本题考查核外电子排布规律、杂化轨道理论、络合物、第一电离能大小的判断等,难度中等,注意氢键不属于化学键,第一电离能规律中的异常现象,为易错点.1年前查看全部
- 现有以下6种氮化合物:NO、N2O NH3 N2O5 N2O3 NO2,按氮的化合价从低到高依次排列为.
 lingzilove20001年前2
lingzilove20001年前2 -
 mumuran 共回答了27个问题
mumuran 共回答了27个问题 |采纳率96.3%NH3 -3
N2O +1
NO +2
N2O3 +3
NO2 +4
N2O5 +51年前查看全部
- 现有一种含氮化合物组成是n2h4,他是一种离子化合物,其中阴阳离子个数比为1:1与烧碱反应生成氨气,与盐酸反应生成的产物
现有一种含氮化合物组成是n2h4,他是一种离子化合物,其中阴阳离子个数比为1:1与烧碱反应生成氨气,与盐酸反应生成的产物之一有极强***性,写出该产物在水溶液中的电离方程式.
 chenzhenhua198301年前0
chenzhenhua198301年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 生活污水中含有大量的有机物和无机含氮化合物.脱氮是污水处理的重要内容之一.下图是生物脱氮的工艺流程图:
生活污水中含有大量的有机物和无机含氮化合物.脱氮是污水处理的重要内容之一.下图是生物脱氮的工艺流程图:

Ⅰ级反应池中有机物被氧化;Ⅱ级反应池中,在pH为8.0~8.4时,硝化细菌将 转化成
转化成 ,其反应为:
,其反应为: .
.
生活污水中含有大量的有机物和无机含氮化合物.脱氮是污水处理的重要内容之一.下图是生物脱氮的工艺流程图:
Ⅰ级反应池中有机物被氧化;Ⅱ级反应池中,在pH为8.0~8.4时,硝化细菌将 转化成
转化成 ,其反应为:
,其反应为: .
.
Ⅲ级反应池中,在反硝化细菌作用下,同时加入适量CH3OH将NO3-还原,进行无害化处理,其变化可表述为:
______NaNO3+______CH3OH→______+______Na2CO3+______NaHCO3+______H2O
请完成上述反应的方程式并配平. 天上鱼6231年前1
天上鱼6231年前1 -
 乡下月光 共回答了16个问题
乡下月光 共回答了16个问题 |采纳率100%解题思路:根据题给信息,甲醇将硝酸根还原为氮气,根据化合价升降法配平方程式.在反硝化细菌作用下,同时加入适量CH3OH将NO3-还原,进行无害化处理,所以甲醇将硝酸根还原为氮气,化合价变化:+5→0,甲醇被氧化成+4价C元素,化合价变化为:-2→+4,根据化合价升降总数相等配平方程式为:6NaNO3+5CH3OH═3N2+Na2CO3+4NaHCO3+8H2O,
故答案为:6;5;3N2;1;4;8.点评:
本题考点: 氧化还原反应方程式的配平.
考点点评: 本题考查了氧化还原反应的配平,正确标出变价元素并根据化合价升降总数相等进行配平是解题的关键.1年前查看全部
- 怎样求总氮和有机氮的去除率下表列出二级污水处理厂含氮化合物废水处理过程中各种形态氮化合物的分析数据,试计算总氮和有机氮的
怎样求总氮和有机氮的去除率
下表列出二级污水处理厂含氮化合物废水处理过程中各种形态氮化合物的分析数据,试计算总氮和有机氮的去除百百分率:
形态 进水浓度(mg/l) 出水浓度(mg/l) 形态 进水浓度(mg/l) 出水浓度(mg/l)
凯式氮 40 8.2 NO2- 0 4
NH3 30 9 NO3- 0 20
感觉很多概念搞不懂 好难.一团浆糊 教下 stockgod9981年前1
stockgod9981年前1 -
 flloose 共回答了14个问题
flloose 共回答了14个问题 |采纳率100%基本上上可以这么认为:
总氮=有机氮+无机氮
无机氮=氨氮+硝态氮+亚硝态氮
凯氏氮=氨氮+有机氮1年前查看全部
- (2009•宜宾模拟)现代无机化学对硫-氮化合物的研究是最为活跃的领域之一.其中图是已经合成的最著名的硫-氮化合物的分子
 (2009•宜宾模拟)现代无机化学对硫-氮化合物的研究是最为活跃的领域之一.其中图是已经合成的最著名的硫-氮化合物的分子结构.下列说法正确的是( )
(2009•宜宾模拟)现代无机化学对硫-氮化合物的研究是最为活跃的领域之一.其中图是已经合成的最著名的硫-氮化合物的分子结构.下列说法正确的是( )
A.该物质的分子式为SN
B.该物质的分子中既有极性键又有非极性键
C.该物质具有很高的熔、沸点
D.该物质与化合物S2N2互为同素异形体 mihaxi1年前1
mihaxi1年前1 -
 zdelyy 共回答了18个问题
zdelyy 共回答了18个问题 |采纳率88.9%解题思路:A.该物质的分子式为S4N4;
B.在化合物中非金属元素间易形成极性键,同种非金属元素间易形成非极性键;
C.原子晶体一般时空间网状结构,分子晶体的熔沸点一般较低;
D.由同种元素组成的不同单质互称同素异形体,同素异形体首先必须是单质.A.由图知该物质的分子式为S4N4,故A错误;
B.该物质的分子中既有极性键(N-S)又有非极性键(S-S),故B正确;
C.该物质是分子晶体,分子晶体的熔沸点一般较低,故C错误;
D.由同种元素组成的不同单质互称同素异形体,S2N2和S4N4都是化合物,故D错误.
故选B.点评:
本题考点: 极性键和非极性键;同素异形体;判断简单分子或离子的构型.
考点点评: 本题考查分子构型的判断,极性键,同素异形体,注意分子晶体的熔沸点一般较低.1年前查看全部
- 硫氮化合物是现代无机化学研究最活跃的领域之一.某硫氮化合物X,其相对分子质量为184,S、N两元素的质量比为16:7.
硫氮化合物是现代无机化学研究最活跃的领域之一.某硫氮化合物x,其相对分子质量为184,s、n两元素的质量比为16:7.
(1)x的分子式为______.
(2)x在常温下还算稳定,但研磨、摩擦、撞击、震动和迅速加热时,会剧烈分解并引起***,生成非常稳定的单质a、单质b,a、b的相对分子质量之比为7:64,则x在研磨时发生反应的化学方程式为2s4n4
4n2↑+s8研磨 .2s4n4;b与浓硫酸在加热条件下反应,该反应的氧化产物为______.
4n2↑+s8研磨 .
(3)氯化铵作用于s2cl2的四氯化碳溶液时,可发生反应生成x、单质b和化合物c,c遇浓氨水可生成氯化铵.试写出氯化铵与s2cl2反应生成x的化学方程式:______. 抛砖引玉1年前1
抛砖引玉1年前1 -
 宁楚狂人 共回答了20个问题
宁楚狂人 共回答了20个问题 |采纳率95%解题思路:S、N两元素的质量比为16:7,则原子个数之比为[16/32]:[7/14]=1:1,设分子式为(SN)x,由相对分子质量为184,则(32+14)x=184,解得x=4,
利用元素守恒可知分解生成单质为氮气和硫的单质,硫单质与浓硫酸发生氧化还原反应,S元素的化合价升高,生成二氧化硫,并结合信息书写化学反应方程式.S、N两元素的质量比为16:7,则原子个数之比为[16/32]:[7/14]=1:1,设分子式为(SN)x,由相对分子质量为184,则(32+14)x=184,解得x=4,
(1)由上述分析可知,x=4,则分子式为S4N4,故答案为:S4N4;
(2)X生成非常稳定的单质A、单质B,A、B的相对分子质量之比为7:64,氮气的相对分子质量为28,则B为[28/7]×64=258,则B分子为S8,由原子守恒可知该化学反应为2S4N4
研磨
.
4N2↑+S8,B与浓硫酸在加热条件下反应,该反应的氧化产物为SO2,
故答案为:2S4N4
研磨
.
4N2↑+S8;SO2;
(3)氯化铵作用于S2Cl2的四氯化碳溶液时,可发生反应生成X、单质B和化合物C,C遇浓氨水可生成氯化铵,则C为HCl,该反应为4NH4Cl+6S2Cl2═S4N4+16HCl+S8,
故答案为:4NH4Cl+6S2Cl2═S4N4+16HCl+S8.点评:
本题考点: 无机物的推断.
考点点评: 本题考查无机物的推断及化学反应的书写,X的推断为解答本题的关键,注意利用元素的质量比确定物质的化学式,注重知识迁移能力的考查,题目难度不大.1年前查看全部
- 下列说法正确的是( )A.汽车尾气污染物中含有氮的氧化物,是汽油不完全燃烧造成的B.豆科作物根瘤菌将含氮化合物转化为蛋
下列说法正确的是( )
A.汽车尾气污染物中含有氮的氧化物,是汽油不完全燃烧造成的
B.豆科作物根瘤菌将含氮化合物转化为蛋白质是氮的固定
C.SiO2制成的玻璃纤维,由于导电能力强而被用于制造通讯光缆
D.乙醇、乙烯、乙醛都能使酸性高锰酸钾溶液褪色 yangyang1986071年前1
yangyang1986071年前1 -
 天下的云 共回答了21个问题
天下的云 共回答了21个问题 |采纳率100%解题思路:A.汽油的主要成分是含碳原子5~11个的烃,烃为碳氢化合物,高温富氧环境造成氮的氧化物,与汽油不完全燃烧无关;
B.空气中游离态的氮转化为化合态的氮的过程叫氮的固定;
C.SiO2制成的玻璃纤维,被用于制造通讯光缆与导电能力强弱无关;
D.酸性高锰酸钾溶液具有强氧化性,可与烯烃和乙醇、乙醛发生氧化还原反应;A.机动车在行驶中烃类不完全燃烧,产生一氧化碳甚至冒黑烟,汽车尾气排放的氮氧化物是在汽车发动机气缸内高温富氧环境下氮气和氧气的反应,不是汽油不完全燃烧造成的,故A错误;
B.豆科作物根瘤菌将含氮化合物转化为蛋白质,是氮的化合物之间的转化,不是氮的固定,故B错误;
C.二氧化硅具有良好的导光性,则用于制造通讯光缆,与导电能力强弱无关,故C错误;
D.烯烃含有碳碳双键,能被酸性高锰酸钾溶液氧化成二氧化碳,乙醛具有醛基能被酸性高锰酸钾溶液氧化成羧基,乙醇可与酸性高锰酸钾溶液发生氧化还原反应成乙酸,它们都能使酸性高锰酸钾溶液褪色,故D正确;
故选D.点评:
本题考点: 常见的生活环境的污染及治理;工业合成氨;硅和二氧化硅.
考点点评: 本题考查了汽车尾气中氮氧化物的形成、氮的固定、制光缆原料、酸性高锰酸钾溶液的强氧化性等知识,题目难度不大,注意把握概念的内涵,注意酸性高锰酸钾溶液具有强氧化性.1年前查看全部
- (2005•南汇区模拟)下列各种含氮化合物中,氮元素的质量分数最大的是( )
(2005•南汇区模拟)下列各种含氮化合物中,氮元素的质量分数最大的是( )
A.N2O
B.NO
C.NO2
D.N2O3 Gulf0071年前1
Gulf0071年前1 -
 5908966 共回答了16个问题
5908966 共回答了16个问题 |采纳率81.3%解题思路:根据化合物中元素的质量分数=[相对原子质量×原子个数/相对分子质量]×100%,把每个化学式都变形成只含一个氮原子,与氮原子结合的氧原子的个数越少,氮元素的质量分数越大,进行分析解答.把每个化学式都变形成只含一个氮原子,与氮原子结合的氧原子的个数越少,氮元素的质量分数越大;选项中化学式变形为:NO
1
2、NO、NO2、NO
3
2;则氮原子结合氧原子最少的是NO
1
2;分子相同,分母最小的氮元素的质量分数最大,故A中氮元素质量分数最大.
故选A.点评:
本题考点: 元素的质量分数计算.
考点点评: 本题难度不大,考查同学们灵活运用化学式的有关计算进行分析问题、解决问题的能力.1年前查看全部
- 在NH3、NO2、NaNO2、Cu(NO3)2四种含氮化合物中,既能被氧化又能被还原的是?为什么?理由
 liudehen19831年前2
liudehen19831年前2 -
 难民的耳朵 共回答了10个问题
难民的耳朵 共回答了10个问题 |采纳率90%选NO2、NaNO2.
元素处于最低价,只能被氧化.
元素处于最高价,只能被还原.
元素处于中间价态,既能被氧化又能被还原.
N的最低价是-3(NH3),最高价是+5(Cu(NO3)2).1年前查看全部
- 在NH3、NO2、NaNO2、Cu(NO3)2四种含氮化合物中,其中氮元素只能被氧化的是?只能被还原的是?
在NH3、NO2、NaNO2、Cu(NO3)2四种含氮化合物中,其中氮元素只能被氧化的是?只能被还原的是?
同时四种含氮化合物中既能被还原又能被氧化的是?
为什么?理由! 欢颜猫猫1年前3
欢颜猫猫1年前3 -
 baidu88s8 共回答了20个问题
baidu88s8 共回答了20个问题 |采纳率90%这种题要看其中N的价位,像氨气中的N是负三价的,这样的N的价位只能升高,所以只能被氧化,硝酸铜的N是正五价的,只能被还原,因为N的价位是最高的,剩下的二氧化氮的N是正四,亚硝酸钠的N是正三的,N的价位处于中间,所以既可以被还原,也可以被氧化1年前查看全部
- N2是大气的主要成分之一,通常情况下,氮气很稳定,含氮化合物应用广泛.
N2是大气的主要成分之一,通常情况下,氮气很稳定,含氮化合物应用广泛.
(1)N2在加热条件下可以与碱金属直接化合生产氮化物,请写出N2(g)与Li(s)化学反应方程
式N2+6Li
2Li3N△ .N2+6Li.
2Li3N△ .
(2)N2经过一系列反应,可以生成叠氮酸(HN3)叠氮化物不稳定,受到撞击或加热易发生分解,请写出LiN3受热分解的化学反应方程式3LiN3
Li3N+4N2↑△ .3LiN3.
Li3N+4N2↑△ .
(3)亚硝酸钠为白色至淡黄色粉末,易溶于水,外观及滋味都与食盐相似,并在工业、建筑业中广为使用,肉类制品中也允许作为发色剂量使用.由亚硝酸盐引起食物中毒的机率较高.食入 0.3~0.5g的亚硝酸盐即可引起中毒甚至死亡.亚硝酸根离子在酸性条件下,能将I-氧化为I2,同时生成NO,试写出该反庆的离子反应方程式:______.利用该反应可以检测亚硝酸钠的含量,操作步骤如下:①取1.0gNaO2样品,加蒸馏水溶解,用100mL容量瓶配成溶液.②用移液管量取25.00mLNaO2溶液加入到锥形瓶中,加入适量稀硫酸,再加入过量的KI溶液.③一段时间后待反应完全,用淀粉作指示剂,用0.1000mo1/LNa2S2O3溶液进行滴定(I2+2Na2S3O3═2Na1+Na2S4O5)溶液,消耗Na2S2O3溶液25.00mL.则样品中亚硝酸钠的含量为______.
(4)联氨(N2H4)是一种应用广泛的化工原料,具有很高的燃烧热,用作火箭燃料和制作电池.Ag2O-N2H4原电池称为LA-1型联氨分析仪原电池.该电池在碱性条件下工作,N2H4在负极被氧化为N2,试写出该电池的电极反应式:
正极:______;负极:______;该电池总反应的化学方程式为______. dolphin27061年前1
dolphin27061年前1 -
 foxlog 共回答了14个问题
foxlog 共回答了14个问题 |采纳率85.7%解题思路:(1)根据氮气在加热条件下与金属锂反应生成氮化锂书写;
(2)根据信息结合化合价变化分析产物;
(3)根据亚硝酸钠在酸性条件下可将I一氧化为I2,结合氧化还原反应规律来书写;根据方程式进行计算;
(4)Ag2O-N2H4原电池碱性燃料电池中,负极上燃料肼失电子和氢氧根离子反应生成水和氮气,正极上是Ag2O得电子生成银单质据此书写;(1)氮气在加热条件下与金属锂反应生成氮化锂,方程式为:N2+6Li△. 2Li3N;故答案为:N2+6Li△. 2Li3N;(2)根据信息,叠氮酸(HN3)叠氮化物不稳定...
点评:
本题考点: 探究物质的组成或测量物质的含量;原电池和电解池的工作原理;氮族元素简介.
考点点评: 本题考查了有关氮的化学方程式的书写、亚硝酸钠含量的测定及其计算以及燃料电池方程式的书写,根据物质的性质书写反应,再结合守恒进行有关计算,题目难度中等.1年前查看全部
- 已知X、Y、Z、W、Q均为含氮化合物,它们在一定条件下有如下转换关系(未配平):
已知X、Y、Z、W、Q均为含氮化合物,它们在一定条件下有如下转换关系(未配平):
(1)X→W+O2
(2)Z+Y+NaOH→H2O+W
(3)Y+SO2→Z+SO3
(4)Q+Y→Z+H2O
(5)X+Cu+H2SO4(浓)→Cu2++Y+SO2−4
则这五种含氮化合物中氮元素的化合价由高到低的顺序为:______
A.X>Y>Z>W>Q
B.X>Z>Y>Q>W
C.X>Y>W>Z>Q
D.W>X>Z>Q>Y. yunfuge1年前1
yunfuge1年前1 -
 hantao025 共回答了19个问题
hantao025 共回答了19个问题 |采纳率94.7%解题思路:在氧化还原反应中,得电子的元素化合价降低,失电子的元素化合价升高,据此判断.(1)X→W+O2中,X中氧元素失电子化合价升高,则N元素得电子化合价降低,所以N元素化合价X>W;
(3)Y+SO2→Z+SO3中,S元素失电子,则Y中N元素得电子,所以N元素化合价Y>Z;
(2)Z+Y+NaOH→H2O+W中,Y和Z发生氧化还原反应,则N元素化合价,W处于Z和Y中间,根据(2)知,N元素化合价Y>W>Z;
(4)Q+Y→Z+H2O中,N元素化合价,Z处于Q和Y之间,根据(3)知,Y>Z,所以Z>Q;
(5)X+Cu+H2SO4(浓)→Cu2++Y+SO4 2-,铜元素失电子,则X得电子生成Y,所以N元素化合价,X>Y;
所以这五种含氮化合物中氮元素的化合价由高到低的顺序为:X>Y>W>Z>Q,故选C.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查化合价高低判断,根据得失电子与元素化合价的关系来分析解答即可,难度不大.1年前查看全部
- 生物学DNA分子片段DNA分子被彻底水解后,产生的含氮化合物是什么
 cee76101年前2
cee76101年前2 -
 背着王八过海 共回答了18个问题
背着王八过海 共回答了18个问题 |采纳率83.3%含氮碱基
A、T、C、G四种含氮碱基1年前查看全部
- 大气中有哪些重要含氮化合物?说明它们的天然来源和人为来源及对环境的污染
 妖妖哭吧1年前2
妖妖哭吧1年前2 -
 海上花0510 共回答了16个问题
海上花0510 共回答了16个问题 |采纳率93.8%NOx是氮氧化合物的总称,通常包括NO和NO2等,大气中的NOx来源于自然和人为活动的排放.人类活动产生的NOx每年约一亿吨,主要是由于燃烧所致,而在燃烧排出的烟气中约90%以上为NO.NOx对大气环境以及人的生产生活环境都有直接或者间接的影响,如臭氧层的破坏、酸雨、森林及植被的衰减等都认为与NOx排放有关.有些学者认为,NOx对于人类健康以及环境的危害比SOx的更大.1年前查看全部
- 现代无机化学对硫-氮化合物的研究是最为活跃的领域之一.其中图是已经合成的最著名
现代无机化学对硫-氮化合物的研究是最为活跃的领域之一.其中图是已经合成的最著名
现代无机化学对硫-氮化合物的研究是最为活跃的领域之一.其中图是已经合成的最著名的硫-氮化合物的分子结构.下列说法正确的是( )
1mol该物质含有9个共价键为什么不对

 5523495361年前1
5523495361年前1 -
 fulll 共回答了18个问题
fulll 共回答了18个问题 |采纳率88.9%mol摩尔,物质的量单位,旧称克分子、克原子,是国际单位制7个基本单位之一,表示物质的量,符号为mol.每1摩尔任何物质含有阿伏加德罗常数(约6.02×10^23)个微粒.使用摩尔时基本微粒应予指明,可以是原子、分子、离子及其他粒子,或这些粒子的特定组合体.
共价键应该还要乘以阿伏加德罗常数1年前查看全部
- (2013•南安市一模)氮气是制备含氮化合物的一种重要物质.工业上可在碱性溶液中,通过电解的方法实现由N2制取NH3,反
(2013•南安市一模)氮气是制备含氮化合物的一种重要物质.工业上可在碱性溶液中,通过电解的方法实现由N2制取NH3,反应的化学方程式为:2N2+6H2O
4NH3+3O2.计算生产34t NH3所需N2的质量.通电 . 心自在1年前1
心自在1年前1 -
 zhangxgym 共回答了17个问题
zhangxgym 共回答了17个问题 |采纳率94.1%解题思路:根据生成氨气的质量,由反应的化学方程式计算出产生氮气的质量即可.设生产34tNH3所需N2的质量的为x,
2N2+6H2O
通电
.
4NH3+3O2
56 68
x 34t
[56/68=
x
34t] x=28t.
答:生产34tNH3所需N2的质量为28t.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题难度不大,掌握根据化学方程式的计算即可正确解答本题,解题时要注意解题的规范性.1年前查看全部
- 氮气是制备含氮化合物的一种重要物质。工业上可在碱性溶液中,通过电解的方法实现由N 2 制取NH 3 ,反应的化学方程式为
氮气是制备含氮化合物的一种重要物质。工业上可在碱性溶液中,通过电解的方法实现由N 2 制取NH 3 ,反应的化学方程式为:2N 2 +6H 2 O
 4NH 3 +3O 2 。计算生产34t NH 3 所需N 2 的质量。
4NH 3 +3O 2 。计算生产34t NH 3 所需N 2 的质量。 yxl9061年前1
yxl9061年前1 -
 红鱼游来了 共回答了17个问题
红鱼游来了 共回答了17个问题 |采纳率94.1%28t
1年前查看全部
大家在问
- 1微分方程中dx dy怎么可以乘除
- 2诺贝尔文学奖作家的名言
- 3it can be troublesome to travel (填一个介词) your own if you are
- 4When are you going in vacation?这句话对吗
- 5第二字是初第四字是食的成语
- 6绿色植物既吸收二氧化碳,又放出二氧化碳,如何实现“低碳”?
- 7已知一个椭圆的左焦点及相应的准线与抛物线 的焦点F和准线 分别重合.(1)求椭圆的短轴的端点与焦点F所连线段的中点M的轨
- 8蒸发蒸馏水和自来水现象的区别是什么?
- 9冻土层会生长植物吗?
- 10下列溶液与20ml,1mol·L^-1NaNO3溶液中的NO3物质的量浓度相等的是
- 11六年级4个班举行篮球笔赛 每只篮球队都要同其他队各赛一场,一共比赛多少场?
- 12找次品的题:五瓶药,四瓶质量相同,另一瓶不知是轻还是重,至少几次称出次品?
- 13(2004•常州二模)如图所示,A、B是两个相同的小物块,C是轻弹簧,用一根细线连接A、B使弹簧C处于压缩状态,然后放置
- 14如何判断哪些反应在内环境,哪些不在内环境中进行?
- 15下列各组词语中,没有错别字的一组是 A.逸事座右铭集腋成裘一言既出,驷马难追 B.脉膊口头禅未雨绸缪打破沙锅问到底 C.
