明矾石中硫酸根离子、钙离子、铁离子、铝离子含量的测定方法~
 东郭无伤2022-10-04 11:39:541条回答
东郭无伤2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 凌波仙子li 共回答了22个问题
凌波仙子li 共回答了22个问题 |采纳率95.5%- 硫酸根用氯化钡沉淀法测定
钙离子用原子吸收分光光度计测定
铝离子用EDTA二钠盐和硝酸铅标准溶液滴定
铁离子用邻菲罗啉比色法或分光光度计发测定 - 1年前
相关推荐
- (2013•信阳二模)明矾石的主要成分是K2SO4•Al2(SO4)3•2Al2O3•6H2O,还含有少量Fe2O3杂质
(2013•信阳二模)明矾石的主要成分是K2SO4•Al2(SO4)3•2Al2O3•6H2O,还含有少量Fe2O3杂质.利用明矾石制备氢氧化铝的流程如下:

(1)焙烧炉中发生反应的化学方程式为2Al2(SO4)3+3S
2Al2O3+9SO2,该反应的氧化剂是______,若生成1mol Al2O3,则转移的电子数为______.高温 .
(2)将标况下1.12L炉气通入100mL 0.5mol/L NaOH溶液中,得到一种酸性溶液,则该溶液中各种离子浓度由大到小的排列顺序为______.
(3)熟料溶解时反应的离子方程式为______.
(4)检验废渣中含有Fe2O3所需的试剂是______.
(5)母液中溶质主要成分的化学式为______.Al(OH)3是两性氢氧化物,写出Al(OH)3显两性的电离的离子方程式______. 一人一树1年前1
一人一树1年前1 -
 王滔 共回答了20个问题
王滔 共回答了20个问题 |采纳率90%解题思路:(1)所含元素化合价降低的反应物是氧化剂;反应中硫单质中硫元素化合价由0价升高为SO2中+4价,硫单质为还原剂,计算生成1molAl2O3需要硫的物质的量,转移电子是硫单质的4倍,再根据N=nNA转移电子数目;
(2)根据n(SO2):n(NaOH)确定反应产物,再结合溶液呈酸性对离子浓度进行排序;
(3)由工艺流程可知,熟料溶解为氧化铝与氢氧化钠溶液反应生成偏铝酸钠;
(4)由工艺流程可知,废渣的主要成分为Fe2O3,废渣中加入盐酸溶解,滴再加KSCN溶液,若溶液被红色,说明废渣中含有Fe2O3;
(5)由工艺流程可知,熟料溶解所得的溶液中含有K+、Na+、SO42-、AlO2-、OH-等,加硫酸调PH值,AlO2-转化为Al(OH)3,母液中离子主要有K+、Na+、SO42-,据此判断,Al(OH)3显两性,据此书写电离方程式.(1)反应中硫元素化合价由Al2(SO4)3中+6价降低为SO2中+4价,故Al2(SO4)3是氧化剂,反应中硫单质中硫元素化合价由0价升高为SO2中+4价,硫单质为还原剂,生成1molAl2O3需要硫的物质的量为1mol×[3/2]=1.5mol,转移电子的物质的量为1.5mol×4=6mol,转移电子数目为6mol×6.02×1023mol-1=3.612×1024,
故答案为:Al2(SO4)3;3.612×1024;
(2)1.12L二氧化硫的物质的量为 [1.12L/22.4L/mol]=0.05mol,n(NaOH)=0.1L×0.5mol/L=0.05mol,n(SO2):n(NaOH)=0.05mol:0.05mol=1:1,故反应后溶液中溶质为NaHSO3,溶液呈酸性,说明HSO3-的电离程度大于水解程度,同时水电离生成氢离子,故c(H+)>c(SO32-),HSO3-电离程度不大,故c(HSO3-)>c(H+),溶液c(OH-)等于水电离生成,浓度很小,故溶液中离子浓度由大到小的排列顺序为c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),
故答案为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);
(3)由工艺流程可知,熟料溶解为氧化铝与氢氧化钠溶液反应生成偏铝酸钠,离子方程式为Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O;
(4)由工艺流程可知,废渣的主要成分为Fe2O3,取少量废渣,加入适量盐酸溶解,再滴加KSCN溶液,若溶液被红色,说明废渣中含有Fe2O3,
故答案为:取少量废渣,加入适量盐酸溶解,再滴加KSCN溶液,若溶液被红色,说明废渣中含有Fe2O3,故答案为:稀盐酸、硫氰化钾;
(5)由工艺流程可知,熟料溶解所得的溶液中含有K+、Na+、SO42-、AlO2-、OH-等,加硫酸调PH值,AlO2-转化为Al(OH)3,母液中离子主要有K+、Na+、SO42-,含有溶质为K2SO4、Na2SO4,Al(OH)3显两性,电离的离子方程式为:Al3++3OH-⇌Al(OH)3⇌AlO2-+H++H2O,故答案为:K2SO4、Na2SO4.点评:
本题考点: 镁、铝的重要化合物;铁的氧化物和氢氧化物.
考点点评: 本题考查学生对工艺流程的理解、氧化还原反应、离子浓度大小比较、离子检验、实验方案设计等,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,题目难度中等,(2)中注意先根据计算确定反应后溶液中溶质.1年前查看全部
- 明矾石经处理后得到明矾[KAl(SO4)2•12H2O].从明矾制备Al、K2SO4、和H2SO4的工艺过程如图所示:
明矾石经处理后得到明矾[KAl(SO4)2•12H2O].从明矾制备Al、K2SO4、和H2SO4的工艺过程如图所示:

焙烧明矾的化学方程式为:4KAl(SO4)2•12H2O+3S═2K2SO4+2Al2O3+9SO2+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,氧化剂是______,氧化剂与还原剂的物质的量之比为______.
(2)从水浸后的滤液中得到K2S04晶体的方法是______.产物K2SO4中K元素的鉴定操作方法是______.
(3)向明矾溶液中逐滴加入Ba(OH)2溶液至SO2-4恰好沉淀完全的离子反应方程式为______.
(4)焙烧产生的SO2可用于制硫酸.已知25℃、l0lkPa时:
2SO2(g)+O2(g)⇌2SO3(g)△H1=-197kJ/mol;
H2O(g)⇌H2O(l)△H2=-44kJ/mol;
2SO2(g)+O2(g)+2H2O(g)═2H2SO4△H3=-545kJ/mol.
则SO3(g)与H2O(1)反应的热化学方程式是______.
(5)假设整个过程中没有物质损失,理论上三种最终产物K2SO4,Al和H2SO4的物质的量之比为______. 完美宝宝1年前1
完美宝宝1年前1 -
 cheche2311 共回答了19个问题
cheche2311 共回答了19个问题 |采纳率78.9%解题思路:(1)依据化学方程式中元素化合价变化分析判断,元素化合价降低的做氧化剂,元素化合价升高的做还原剂;
(2)从水浸后的滤液中得到K2SO4晶体的方法是利用硫酸钾溶解度随温度变化,可以利用蒸发溶剂方法结晶析出;钾离子焰色反应呈紫色;
(3)假设SO42-的物质的量为2mol,判断完全反应需要其它离子的物质的量,进而书写反应的离子方程式;
(4)依据热化学方程式和盖斯定律计算得到;
(5)Al2O3电解得到铝单质,二氧化硫氧化后全部反应得到硫酸.(1)4KAl(SO4)2•12H2O+3S═2K2SO4+2Al2O3+9SO2+48H2O反应硫单质中硫元素化合价升高为+4价.硫酸根离子中硫元素化合价从+6价变化为+4价,复印纸还原剂是硫单质,氧化剂与还原剂的物质的量之比为6:3=2:1,故答案为:KAl(SO4)2•12H2O;2:1;
(2)从水浸后的滤液中得到K2SO4晶体的方法是利用硫酸钾溶解度随温度变化不大,可以利用蒸发溶剂方法结晶析出晶体;钾离子焰色反应呈紫色,需要透过蓝色钴玻璃观察,故答案为:蒸发结晶;用盐酸洗过铂丝后,用火烧干后用铂丝蘸取待测溶液,到酒精灯火焰上灼烧,透过蓝色钴玻璃观察颜色,观察到紫色即证明有钾离子;
(3)假设SO42-的物质的量为2mol,则明矾溶液中含有2mol SO42-,1molAl3+,向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-刚好沉淀完全时,需要2molBa(OH)2,即加入的Ba2+为2mol,OH-为4mol,生成2molBaSO4,1molAl3+与4molOH-反应生成1molAlO2-,反应的离子方程式为Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O,
故答案为:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O;
(4)2SO2(g)+O2(g)⇌2SO3(g)△H1=-197kJ/mol;Ⅰ
H2O(g)⇌H2O(l)△H2=-44kJ/mol;Ⅱ
2SO2(g)+O2(g)+2H2O(g)═2H2SO4(l)△H3=-545kJ/mol.Ⅲ
依据盖斯定律Ⅲ-Ⅰ-2×Ⅱ得到:2SO3(g)+2H2O(l)=2H2SO4(l)△H=-260KJ/mol;
即反应的热化学方程式为:SO3(g)+H2O(l)=H2SO4(l)△H=-130KJ/mol;
故答案为:SO3(g)+H2O(l)=H2SO4(l)△H=-130KJ/mol;
(5)根据方程式4KAl(SO4)2•12H2O+3S═2K2SO4+2Al2O3+9SO2+48H2O,Al2O3电解得到铝单质,二氧化硫氧化后全部反应得到硫酸.可知最终产物K2SO4,Al和H2SO4的物质的量之比为2:4:9,故答案为:2:4:9.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用;热化学方程式.
考点点评: 本题考查了氧化还原反应概念分析判断,热化学方程式和盖斯定律的计算,元素守恒的计算应用,题目难度中等,注意与量有关的离子方程式的书写方法.1年前查看全部
- (2013•安徽二模)明矾石的组成和明矾相似,此外还含有Al2O3和少量的Fe2O3等杂质,它是制取钾肥和冶炼铝的重
(2013•安徽二模)明矾石的组成和明矾相似,此外还含有Al2O3和少量的Fe2O3等杂质,它是制取钾肥和冶炼铝的重 要原料,其步骤如图,回答下列问题:
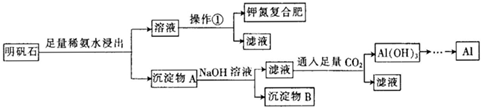
(1)明矾石加人足量的稀氨水中浸出时发生反应的离子方程式为______
(2)沉淀物A中除含有Fe2Q3外,还含有______、______.
(3)操作①的名称为______、冷却结晶、过滤.
(4)用14mol.L-1的浓氨水配制480mL 2mol.L‑1稀氨水:
①所用的容量瓶规格是______.
②稀释浓氨水用的烧杯和玻璃棒如何洗涤?______
③下列操作对所配制的稀氨水浓度的影响(填“偏大”、“偏小”或“无影响”
a.洗涤后的容量瓶中有少量蒸馏水:______.
b.浓氨水量取后,所用的量筒用蒸馏水洗涤2〜3次,并将洗涤液转人容量瓶中:.
(5)确定钾氮复合肥中含有钾元素的方法是.
(6)为测定钾氮复合肥中氮元素的质量分数,称取mg钾氮复合肥,加人足量的NaOH浓溶液加热,使产生 的气体全部逸出,收集到的氨气折箅成标准状况下的体积为V mL.则钾氮复合肥中氮元索的质量分数为[7V/112m]%[7V/112m]%(用含m、V的代数式表示). 务必公正1年前1
务必公正1年前1 -
 aoming1203 共回答了17个问题
aoming1203 共回答了17个问题 |采纳率88.2%解题思路:含有Al2O3和少量的Fe2O3等杂质,加足量的稀氨水,明矾石中的铝离子与氨水反应,过滤后沉淀A中含Al2O3、Fe2O3、Al(OH)3,溶液中含钾离子、硫酸根离子,则操作1为蒸发结晶得到硫酸钾晶体.
(1)明矾石加入足量的稀氨水中浸出时铝离子会和氨水之间反应;
(2)Al2O3和Fe2O3、Al(OH)3都和氨水之间不反应;
(3)溶液蒸发浓缩、冷却结晶、过滤可以得到其晶体物质;
(4)配制480mL溶液,应选择500mL容量瓶;根据洗涤仪器的方法来进行;根据c=[n/V]来确定引起的误差;
(5)确定钾氮复合肥中含有钾元素的方法是焰色反应;
(6)根据元素守恒来计算.含有Al2O3和少量的Fe2O3等杂质,加足量的稀氨水,明矾石中的铝离子与氨水反应,过滤后沉淀A中含Al2O3、Fe2O3、Al(OH)3,溶液中含钾离子、硫酸根离子,则操作1为蒸发结晶得到硫酸钾晶体,
(1)明矾石加入足量的稀氨水中浸出时发生反应的离子方程式为Al3++3NH3.H2O=Al(OH)3↓+3NH4+,故答案为:Al3++3NH3.H2O=Al(OH)3↓+3NH4+;
(2)杂质均不溶于氨水,铝离子与氨水反应生成沉淀,沉淀A中含Al2O3、Fe2O3、Al(OH)3,故答案为:Al2O3;Al(OH)3;
(3)由上述分析可知,操作1为蒸发浓缩,故答案为:蒸发浓缩;
(4)①配制480mL溶液,应选择500mL容量瓶,故答案为:500mL容量瓶;
②稀释浓氨水用的烧杯和玻璃棒的洗涤方法:适量的蒸馏水沿着玻璃棒注入烧杯中,倾斜转动烧杯,洗涤烧杯内壁后将洗涤液转入容量瓶中,重复操作2-3次,故答案为:适量的蒸馏水沿着玻璃棒注入烧杯中,倾斜转动烧杯,洗涤烧杯内壁后将洗涤液转入容量瓶中,重复操作2-3次;
③a、洗涤后的容量瓶中有少量蒸馏水,不会影响实验结果,故答案为:无影响;
b、用量筒量取浓氨水后,用蒸馏水洗涤量筒并转移至容量瓶中,溶质增多,浓度偏大,故答案为:偏大,
(5)确定钾氮复合肥中含有钾元素的方法是焰色反应,透过蓝色钴玻璃观察到紫色火焰,则含钾元素,故答案为:焰色反应,透过蓝色钴玻璃观察到紫色火焰,则含钾元素.
(6)足量的NaOH浓溶液加热,使产生 的气体全部逸出,收集到的氨气折箅成标准状况下的体积为VmL,根据N元素守恒,则钾氮复合肥中氮元索的物质的量为
V×10−3
22.4mol,所以钾氮复合肥中氮元索的质量分数为
V×10−3×14
22.4m×100%=[7V/112m]%,故答案为:[7V/112m]%.点评:
本题考点: 金属的回收与环境、资源保护.
考点点评: 本题考查较综合,涉及物质制备实验方案的设计及溶液配制,把握实验流程中发生的反应及分离方法为解答的关键,侧重分析能力及迁移应用能力的考查,题目难度中等.1年前查看全部
- 明矾石经处理后得到明矾[KAl(SO4)2?12H2O].从明矾制备Al、K2SO4、和H2SO4的工艺过程如图所示:焙
明矾石经处理后得到明矾[KAl(SO4)2?12H2O].从明矾制备Al、K2SO4、和H2SO4的工艺过程如图所示:焙烧明
明矾石经处理后得到明矾[KAl(SO4)2?12H2O].从明矾制备Al、K2SO4、和H2SO4的工艺过程如图所示:
焙烧明矾的化学方程式为:4KAl(SO4)2?12H2O+3S═2K2SO4+2Al2O3+9SO2+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,氧化剂是______,氧化剂与还原剂的物质的量之比为______.
(2)从水浸后的滤液中得到K2S04晶体的方法是______.产物K2SO4中K元素的鉴定操作方法是______.
(3)向明矾溶液中逐滴加入Ba(OH)2溶液至SO2-4恰好沉淀完全的离子反应方程式为______.
(4)焙烧产生的SO2可用于制硫酸.已知25℃、l0lkPa时:
2SO2(g)+O2(g)?2SO3(g)△H1=-197kJ/mol;
H2O(g)?H2O(l)△H2=-44kJ/mol;
2SO2(g)+O2(g)+2H2O(g)═2H2SO4△H3=-545kJ/mol.
则SO3(g)与H2O(1)反应的热化学方程式是______.
(5)假设整个过程中没有物质损失,理论上三种最终产物K2SO4,Al和H2SO4的物质的量之比为______.
 ljn22061年前1
ljn22061年前1 -
 hswic 共回答了21个问题
hswic 共回答了21个问题 |采纳率95.2%(1)4KAl(SO4)2?12H2O+3S═2K2SO4+2Al2O3+9SO2+48H2O反应硫单质中硫元素化合价升高为+4价.硫酸根离子中硫元素化合价从+6价变化为+4价,复印纸还原剂是硫单质,氧化剂与还原剂的物质的量之比为6:3=2:1,故答案为:KAl(SO4)2?12H2O;2:1;
(2)从水浸后的滤液中得到K2SO4晶体的方法是利用硫酸钾溶解度随温度变化不大,可以利用蒸发溶剂方法结晶析出晶体;钾离子焰色反应呈紫色,需要透过蓝色钴玻璃观察,故答案为:蒸发结晶;用盐酸洗过铂丝后,用火烧干后用铂丝蘸取待测溶液,到酒精灯火焰上灼烧,透过蓝色钴玻璃观察颜色,观察到紫色即证明有钾离子;
(3)假设SO42-的物质的量为2mol,则明矾溶液中含有2mol SO42-,1molAl3+,向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-刚好沉淀完全时,需要2molBa(OH)2,即加入的Ba2+为2mol,OH-为4mol,生成2molBaSO4,1molAl3+与4molOH-反应生成1molAlO2-,反应的离子方程式为Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O,
故答案为:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O;
(4)2SO2(g)+O2(g)?2SO3(g)△H1=-197kJ/mol;Ⅰ
H2O(g)?H2O(l)△H2=-44kJ/mol;Ⅱ
2SO2(g)+O2(g)+2H2O(g)═2H2SO4(l)△H3=-545kJ/mol.Ⅲ
依据盖斯定律Ⅲ-Ⅰ-2×Ⅱ得到:2SO3(g)+2H2O(l)=2H2SO4(l)△H=-260KJ/mol;
即反应的热化学方程式为:SO3(g)+H2O(l)=H2SO4(l)△H=-130KJ/mol;
故答案为:SO3(g)+H2O(l)=H2SO4(l)△H=-130KJ/mol;
(5)根据方程式4KAl(SO4)2?12H2O+3S═2K2SO4+2Al2O3+9SO2+48H2O,Al2O3电解得到铝单质,二氧化硫氧化后全部反应得到硫酸.可知最终产物K2SO4,Al和H2SO4的物质的量之比为2:4:9,故答案为:2:4:9.1年前查看全部
- 明矾石经处理后得到明矾 KAl(SO4)2•12H2O.从明矾制备Al、K2SO4和H2SO4的工艺过程如图所示:
明矾石经处理后得到明矾 KAl(SO4)2•12H2O.从明矾制备Al、K2SO4和H2SO4的工艺过程如图所示:
焙烧明矾的化学方程式为:4KAl(SO4)2•12H2O+3S=2K2SO4+2Al2O3+9SO2+48H2O请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是______.
(2)从水浸后的滤液中得到K2SO4晶体的方法是______.
(3)焙烧产生的SO2可用于制硫酸.已知25℃、101kPa时:
2SO2(g)+O2(g)2SO3(g)△H1=一197kJ/mol;
2H2O (g)=2H2O(1)△H2=一44kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=一545kJ/mol.
则SO3 (g)与H2O(l)反应的热化学方程式是______.
焙烧948t明矾(M=474g/mol ),若SO2的利用率为96%,可生产质量分数为98%的硫酸______t.
 jilly888881年前1
jilly888881年前1 -
 雪子绫 共回答了15个问题
雪子绫 共回答了15个问题 |采纳率73.3%解题思路:(1)根据化合价的升降可以判断氧化剂和还原剂;
(2)从水浸后的滤液中得到K2SO4晶体运用蒸发溶剂水的方法得到;
(3)利用盖斯定律,将热化学方程式进行运算;根据质量守恒或硫原子个数守恒,找出4KAl(SO4)2•12H2O与H2SO4 之间的关系.(1)4KAl(SO4)2•12H2O+3S=2K2SO4+2Al2O3+9SO2+48H2O,反应中S的由0价升高到+4价,则S为还原剂,被氧化,
故答案为:S;
(2)从水浸后的滤液中得到K2SO4晶体运用蒸发溶剂水的方法得到,需要蒸发浓缩、冷却结晶、过滤、洗剂、干燥,
故答案为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
(3)2SO2(g)+O2(g)2SO3(g)△H1=一197kJ/mol ①
2H2O (g)=2H2O(1)△H2=一44kJ/mol ②
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=一545kJ/mol③
利用盖斯定律:(③-①-②)÷2 得SO3 (g)+H2O(l)=H2SO4(l)△H=-152kJ/mol,
4KAl(SO4)2•12H2O~9H2SO4
4×474 9×98
948×96% t×98% t=432t,
故答案为:SO3 (g)+H2O(l)=H2SO4(l)△H=-152kJ/mol;432t.点评:
本题考点: 用盖斯定律进行有关反应热的计算;化学方程式的有关计算;氧化还原反应.
考点点评: 本题考查了氧化还原反应基本概念的判断,热化学方程式和盖斯定律的计算,原子守恒在计算题中的应用,难度适中.1年前查看全部
- 明矾石的主要成分为碱性硫酸铝钾KAl3(SO4)2(OH)6,可用于炼铝、净水等,焙烧碱性硫酸铝钾和硫的混合物,其反应为
明矾石的主要成分为碱性硫酸铝钾KAl3(SO4)2(OH)6,可用于炼铝、净水等,焙烧碱性硫酸铝钾和硫的混合物,其反应为4KAl3(SO4)2(OH)6+3S=2K2SO4+6Al2O3+9SO2↑+12H2O.下列说法正确的是( )
A.当生成6mol H2O时,转移的电子数为6NA
B.K2SO4为氧化产物,SO2为还原产物
C.焙烧后的固体产物不能完全溶于NaOH溶液
D.反应中体现氧化性的硫元素与体现还原性的硫元素的质量比为8:3 ninjajean1年前1
ninjajean1年前1 -
 nfsoft 共回答了25个问题
nfsoft 共回答了25个问题 |采纳率84%解题思路:4KAl3(SO4)2(OH)6+3S=2K2SO4+6Al2O3+9SO2↑+12H2O中S元素化合价由+6价、0价变为+4价,根据转移电子守恒知,有[3/4]的KAl3(SO4)2(OH)6参加氧化还原反应,据此分析解答.A.有12molH2O生成时,参加反应的S的物质的量是3mol,则转移电子的物质的量=3mol×(4-0)=12mol,所以当生成6mol H2O时,转移电子的物质的量是6mol,则转移的电子数为6NA,故A正确;
B.K2SO4既不是氧化产物也不是还原产物,SO2既是氧化产物也是还原产物,故B错误;
C.K2SO4为可溶性盐,Al2O3能溶于NaOH溶液生成可溶性的NaAlO2,故C错误;
D.有[3/4]的KAl3(SO4)2(OH)6参加氧化还原反应,所以反应中体现氧化性的硫元素与体现还原性的硫元素的质量比为6:3=2:1,故D错误;
故选A.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查了氧化还原反应,明确元素化合价变化是解本题关键,再结合物质的溶解性来分析解答,注意KAl3(SO4)2(OH)6部分参加氧化还原反应,题目难度较大.1年前查看全部
- (2014•银川模拟)利用明矾石(主要成分是K2SO4•Al2(SO4)3•2Al2O3•6H2O,此外还含有少量Fe2
(2014•银川模拟)利用明矾石(主要成分是K2SO4•Al2(SO4)3•2Al2O3•6H2O,此外还含有少量Fe2O3杂质)制备Al2O3、K2FeO4和H2SO4的工艺流程如图甲:

(1)“焙烧”过程中反应的化学方程式为2Al2(SO4)3+3S
2Al2O3+9SO2,该反应中若生成102g Al2O3,转移的电子数目为______(用NA表示阿伏伽德罗常数).高温 .
(2)写出化学式:沉淀Ⅰ是______,沉淀Ⅱ是______.
(3)熟料溶解时反应的离子方程式为______.
(4)写出Cl2将沉淀Ⅱ氧化为K2FeO4的化学方程式:______.
(5)K2FeO4也可以铁为电极,通过电解浓的KOH溶液来制取,写出电解法制取K2FeO4的阳极反应式:______.
(6)该流程的废气中含有SO2,可利用图乙所示电解装置吸收SO2.写出装置内所发生反应的离子方程式SO2+2H2O+Cu2+
4H++SO42-+Cu电解 .SO2+2H2O+Cu2+.
4H++SO42-+Cu电解 . 昊思静1年前1
昊思静1年前1 -
 86837693 共回答了19个问题
86837693 共回答了19个问题 |采纳率94.7%解题思路:(1)所含元素化合价降低的反应物是氧化剂;反应中硫单质中硫元素化合价由0价升高为SO2中+4价,硫单质为还原剂,计算生成102gAl2O3需要硫的物质的量,转移电子是硫单质的4倍,再根据N=nNA转移电子数目;
(2)分析流程结合氧化铝的性质可知,沉淀Ⅰ是Al(OH)3;沉淀Ⅱ是Fe(OH)3;
(3)由工艺流程可知,熟料溶解为氧化铝与氢氧化钠溶液反应生成偏铝酸钠;
(4)沉淀Ⅱ是Fe(OH)3,氯气将+3价的铁氧化成+6价,自身被还原成-1价,据此书写化学反应方程式;
(5)电解时阳极发生反应生成FeO42-,依据化合价的变化和电荷守恒书写电极反应;
(6)电解时阳极发生反应生成SO42-,阴极Cu2+得到电子生成Cu,依据化合价的变化和电荷守恒书写反应;利用明矾石(主要成分是K2SO4•Al2(SO4)3•2Al2O3•6H2O,此外还含有少量Fe2O3杂质)制备Al2O3、K2FeO4和H2SO4的工艺流程:明矾脱水后主要成分是K2SO4•Al2(SO4)3•2Al2O3,“焙烧”Al2(SO4)3中+6价降低为SO2中+4价,Al2(SO4)3是氧化剂,硫单质为还原剂,发生2Al2(SO4)3+3S
高温
.
2Al2O3+9SO2,熟料溶解为氧化铝与氢氧化钾溶液反应生成偏铝酸钾,离子方程式为Al2O3+2OH-=2AlO2-+H2O,熟料溶解所得的溶液中含有K+、SO42-、AlO2-、OH-等,加硫酸调PH值,AlO2-转化为Al(OH)3,灼烧生成Al2O3,母液中离子主要有K+、SO42-,含有溶质为K2SO4,滤渣为Fe2O3,加硫酸Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,
X为Fe2(SO4)3,加氢氧化钾Fe2(SO4)3+6KOH=2Fe(OH)3↓+3K2SO4,通入氯气:2Fe(OH)3+3Cl2+10KOH═2K2FeO4+6KCl+8H2O,制得K2FeO4;
(1)反应中硫元素化合价由Al2(SO4)3中+6价降低为SO2中+4价,反应中硫单质中硫元素化合价由0价升高为SO2中+4价,生成102gAl2O3的物质的量为n=[m/M]=[102g/102g/mol]=1mol,需要硫的物质的量为1mol×[3/2]=1.5mol,转移电子的物质的量为1.5mol×4=6mol,转移电子数目为N=nNA=6mol×NAmol-1=6NA,
故答案为:6NA;
(2)分析流程结合氧化铝的性质可知,铝土矿中的氧化铝和氢氧化钠反应生成偏铝酸钠,氧化铁不和氢氧化钠溶液反应过滤得到滤渣为氧化铁,熟料溶解为氧化铝与氢氧化钾溶液反应生成偏铝酸钾,离子方程式为Al2O3+2OH-=2AlO2-+H2O,熟料溶解所得的溶液中含有K+、SO42-、AlO2-、OH-等,加硫酸调PH值,AlO2-转化为Al(OH)3,沉淀Ⅰ是Al(OH)3;滤渣为Fe2O3,加硫酸Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,X为Fe2(SO4)3,加氢氧化钾Fe2(SO4)3+6KOH=2Fe(OH)3↓+3K2SO4,沉淀Ⅱ是Fe(OH)3,
故答案为:Al(OH)3;Fe(OH)3;
(3)由工艺流程可知,熟料溶解为氧化铝与氢氧化钠溶液反应生成偏铝酸钠,离子方程式为Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O;
(4)沉淀Ⅱ是Fe(OH)3,氯气将+3价的铁氧化成+6价,自身被还原成-1价,发生反应为:2Fe(OH)3+3Cl2+10 KOH═2K2FeO4+6KCl+8H2O,
故答案为:2Fe(OH)3+3Cl2+10KOH═2K2FeO4+6KCl+8H2O;
(5)阳极是铁失电子在碱性溶液中发生氧化反应生成FeO42-;电极反应为:Fe+8OHˉ-6eˉ=FeO42-+4H2O,
故答案为:Fe+8OH--6e-=FeO42-+4H2O;
(6)电解时阳极发生反应生成SO42-,阴极Cu2+得到电子生成Cu,装置内所发生反应的离子方程式为:SO2+2H2O+Cu2+
电解
.
4H++SO42-+Cu,
故答案为:SO2+2H2O+Cu2+
电解
.
4H++SO42-+Cu;点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用;制备实验方案的设计.
考点点评: 本题以铝、铁的化合物为载体考查了物质间的反应、物质的分离和电解等知识点,明确物质之间的反应是解本题关键,这种综合性较强的题型是高考热点,须利用基础知识细心分析解答,题目难度中等.1年前查看全部
- 明矾石的主要成分是K2SO4•Al2(SO4)3•2Al2O3•6H2O,还含有少量Fe2O3杂质.利用明矾石制备氢氧化
明矾石的主要成分是K2SO4•Al2(SO4)3•2Al2O3•6H2O,还含有少量Fe2O3杂质.利用明矾石制备氢氧化铝的流程如图:

(1)焙烧炉中发生反应的化学方程式为2Al2(SO4)3+3S
2Al2O3+9SO2,该反应的氧化剂是______,若生成1mol Al2O3,则转移的电子数为______.高温 .
(2)将标况下1.12L炉气通入100mL 0.5mol•L-1 NaOH溶液中,得到一种酸性溶液,则该溶液中各种离子浓度由大到小的排列顺序为______.
(3)熟料溶解时反应的离子方程式为______.
(4)母液中溶质主要成分的化学式为______,溶液调节pH后经过滤、洗涤可得Al(OH)3沉淀,证明沉淀已洗涤干净的实验操作和现象是______. 歪歪YICHT1年前1
歪歪YICHT1年前1 -
 lplzwxl2004 共回答了18个问题
lplzwxl2004 共回答了18个问题 |采纳率94.4%解题思路:焙烧炉中发生反应的化学方程式为2Al2(SO4)3+3S
2Al2O3+9SO2,故生成炉气中含二氧化硫,熟料中含氧化铝、氧化铁、硫酸钾等,加入氢氧化钠和水,高温 .
氧化铝和氢氧化钠反应生成偏铝酸钠,氧化铁不反应,过滤,滤渣中含氧化铁,滤液中含偏铝酸钠和硫酸钾、氢氧化钠等;用硫酸调节pH,得到氢氧化铝沉淀和硫酸钠、硫酸钾,过滤得母液中含硫酸钾、硫酸钠溶质.
(1)所含元素化合价降低的反应物是氧化剂;
反应中硫单质中硫元素化合价由0价升高为SO2中+4价,硫单质为还原剂,计算生成1molAl2O3需要硫的物质的量,转移电子是硫单质的4倍,再根据N=nNA转移电子数目;
(2)根据n=
计算二氧化硫的物质的量,根据n(SO2):n(NaOH)确定反应产物,再结合溶液呈酸性进行判断;V Vm
(3)由工艺流程可知,熟料溶解为氧化铝与氢氧化钠溶液反应生成偏铝酸钠;
(4)由工艺流程可知,熟料溶解所得的溶液中含有K+、Na+、SO42-、AlO2-、OH-等,加硫酸调PH值,AlO2-转化为Al(OH)3,母液中离子主要有K+、Na+、SO42-,据此判断;Al(OH)3沉淀具有吸附性,可吸附硫酸根离子,通过检验硫酸根离子的方法进行实验.(1)反应中硫元素化合价由Al2(SO4)3中+6价降低为SO2中+4价,故Al2(SO4)3是氧化剂,反应中硫单质中硫元素化合价由0价升高为SO2中+4价,硫单质为还原剂,生成1molAl2O3需要硫的物质的量为1mol×[3/2]=1.5mol,转移电子的物质的量为1.5mol×4=6mol,转移电子数目为6mol×6.02×1023mol-1=3.612×1024,
故答案为:Al2(SO4)3;3.612×1024;
(2)1.12L二氧化硫的物质的量为[1.12L/22.4L/mol]=0.05mol,n(NaOH)=0.1L×0.5mol/L=0.05mol,n(SO2):n(NaOH)=0.05mol:0.05mol=1:1,故反应后溶液中溶质为NaHSO3,溶液呈酸性,说明HSO3-的电离程度大于水解程度,同时水电离生成氢离子,故c(H+)>c(SO32-),HSO3-电离程度不大,故c(HSO3-)>c(H+),溶液c(OH-)等于水电离生成,浓度很小,故溶液中离子浓度由大到小的排列顺序为c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),
故答案为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);
(3)由工艺流程可知,熟料溶解为氧化铝与氢氧化钠溶液反应生成偏铝酸钠,离子方程式为Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O;
(4)由工艺流程可知,熟料溶解所得的溶液中含有K+、Na+、SO42-、AlO2-、OH-等,加硫酸调PH值,AlO2-转化为Al(OH)3,母液中离子主要有K+、Na+、SO42-,含有溶质为K2SO4、Na2SO4;Al(OH)3沉淀具有吸附性,可吸附硫酸根离子,通过检验硫酸根离子的方法进行实验,方法为取最后一次洗涤的流出液于试管中,滴加BaCl2溶液,若无白色沉淀生成则已洗涤干净,
故答案为:K2SO4、Na2SO4;取最后一次洗涤的流出液于试管中,滴加BaCl2溶液,若无白色沉淀生成则已洗涤干净.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用;制备实验方案的设计.
考点点评: 本题考查学生对工艺流程的理解、氧化还原反应、离子浓度大小比较、离子检验、实验方案设计等,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,题目难度中等.(2)中注意先根据计算确定反应后溶液中溶质.1年前查看全部
- (2015•成都模拟)明矾石的主要成分是K2SO4•Al2(SO4)3•2Al2O3•6H2O及少量氧化铁.利用明矾石制
(2015•成都模拟)明矾石的主要成分是K2SO4•Al2(SO4)3•2Al2O3•6H2O及少量氧化铁.利用明矾石制备K2SO4的工艺流程如下所示:

(1)焙烧炉中发生如下反应,请在方程式中表示出电子转移的方向和数目:
2Al2(SO4)3+3S
2Al2O3+9SO2↑高温 .
(2)步骤②涉及Al2O3的离子方程式为______.
(3)步骤③调pH生成Al(OH)3的离子方程式为______;不能用CO2来调pH,理由是______.
(4)步骤④的主要操作步骤是______、过滤、洗涤和干燥.
(5)炉气回收可做多种用途,请举一例:______. balu_4271年前1
balu_4271年前1 -
 几削平的 共回答了22个问题
几削平的 共回答了22个问题 |采纳率86.4%解题思路:由流程可知,明矾石和硫磺在焙烧炉中反应生成Al2O3和SO2,生成的熟料中含有Al2O3和少量氧化铁,加入KOH溶液,氢氧化钠与氧化铝反应生成偏铝酸钠和水,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,所得溶液调节溶液pH,可生成Al(OH)3,滤液中主要含有K2SO4,经蒸发结晶、过滤、洗涤和干燥,可得到硫酸钾晶体,以此解答该题.由流程可知,明矾石和硫磺在焙烧炉中反应生成Al2O3和SO2,生成的熟料中含有Al2O3和少量氧化铁,加入KOH溶液,氢氧化钠与氧化铝反应生成偏铝酸钠和水,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,所得溶液调节溶液pH...
点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用;制备实验方案的设计.
考点点评: 本题考查物质的制备、分离等知识,侧重于学生的分析能力和实验能力的考查,为高考常见题型,难度中等,注意把握物质的相关性质.1年前查看全部
- (2013•泰安一模)明矾石的主要成分是K2SO4•Al2(SO4)3•2Al2O3•6H2O,还含有少量Fe2O3杂质
(2013•泰安一模)明矾石的主要成分是K2SO4•Al2(SO4)3•2Al2O3•6H2O,还含有少量Fe2O3杂质.利用明矾石制备氢氧化铝的流程如下:

(1)焙烧炉中发生反应的化学方程式为2Al2(SO4)3+3S
2Al2O3+9SO2,该反应的氧化剂是______.若生成l mol高温 .
Al2O3,则转移的电子数为______.
(2)熟料溶解时,反应的离子方程式为______.
(3)母液中溶质主要成分的化学式为______.
(4)将标准状况下1.12L炉气通入100mL 0.5mol•L-1NaOH溶液中,得到一种酸性溶液,则该溶液中各种离子浓度由大到小的排列顺序为______.
(5)检验废渣中主要成分的方法是______(写出操作步骤、现象及结论). sofine07331年前1
sofine07331年前1 -
 叶仁美子_qq 共回答了19个问题
叶仁美子_qq 共回答了19个问题 |采纳率68.4%解题思路:(1)所含元素化合价降低的反应物是氧化剂;
反应中硫单质中硫元素化合价由0价升高为SO2中+4价,硫单质为还原剂,计算生成1molAl2O3需要硫的物质的量,转移电子是硫单质的4倍,再根据N=nNA转移电子数目;
(2)由工艺流程可知,熟料溶解为氧化铝与氢氧化钠溶液反应生成偏铝酸钠;
(3)由工艺流程可知,熟料溶解所得的溶液中含有K+、Na+、SO42-、AlO2-、OH-等,加硫酸调PH值,AlO2-转化为Al(OH)3,母液中离子主要有K+、Na+、SO42-,据此判断;
(4)根据n=
计算二氧化硫的物质的量,根据n(SO2):n(NaOH)确定反应产物,再结合溶液呈酸性进行判断;V Vm
(5)由工艺流程可知,废渣的主要成分为Fe2O3,废渣中加入盐酸溶解,滴再加KSCN溶液,若溶液被红色,说明废渣中含有Fe2O3.(1)反应中硫元素化合价由Al2(SO4)3中+6价降低为SO2中+4价,故Al2(SO4)3是氧化剂,反应中硫单质中硫元素化合价由0价升高为SO2中+4价,硫单质为还原剂,生成1molAl2O3需要硫的物质的量为1mol×[3/2]=1.5mol,转移电子的物质的量为1.5mol×4=6mol,转移电子数目为6mol×6.02×1023mol-1=3.612×1024,
故答案为:Al2(SO4)3;3.612×1024;
(2)由工艺流程可知,熟料溶解为氧化铝与氢氧化钠溶液反应生成偏铝酸钠,离子方程式为Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O;
(3)由工艺流程可知,熟料溶解所得的溶液中含有K+、Na+、SO42-、AlO2-、OH-等,加硫酸调PH值,AlO2-转化为Al(OH)3,母液中离子主要有K+、Na+、SO42-,含有溶质为K2SO4、Na2SO4,
故答案为:K2SO4、Na2SO4;
(4)1.12L二氧化硫的物质的量为[1.12L/22.4L/mol]=0.05mol,n(NaOH)=0.1L×0.5mol/L=0.05mol,n(SO2):n(NaOH)=0.05mol:0.05mol=1:1,故反应后溶液中溶质为NaHSO3,溶液呈酸性,说明HSO3-的电离程度大于水解程度,同时水电离生成氢离子,故c(H+)>c(SO32-),HSO3-电离程度不大,故c(HSO3-)>c(H+),溶液c(OH-)等于水电离生成,浓度很小,故溶液中离子浓度由大到小的排列顺序为c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),
故答案为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);
(5)由工艺流程可知,废渣的主要成分为Fe2O3,取少量废渣,加入适量盐酸溶解,再滴加KSCN溶液,若溶液被红色,说明废渣中含有Fe2O3,
故答案为:取少量废渣,加入适量盐酸溶解,再滴加KSCN溶液,若溶液被红色,说明废渣中含有Fe2O3.点评:
本题考点: 镁、铝的重要化合物;氧化还原反应;铁的氧化物和氢氧化物.
考点点评: 本题考查学生对工艺流程的理解、氧化还原反应、离子浓度大小比较、离子检验、实验方案设计等,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,题目难度中等.(4)中注意先根据计算确定反应后溶液中溶质.1年前查看全部
- 无水氯化铝是一种重要的化工原料,利用明矾石[K 2 SO 4 •Al 2 (SO 4 ) 3 •2Al 2 O 3 •6
无水氯化铝是一种重要的化工原料,利用明矾石[K 2 SO 4 •Al 2 (SO 4 ) 3 •2Al 2 O 3 •6H 2 O]制备无水氯化铝的流程如下: 
(1)焙烧炉中产生的SO 2 直接排放到空气中会形成酸雨,若某地酸雨的pH为4.6,在空气中放置一段时间后,pH变为4.0,其原因为______;(用必要的文字简述).
(2)氯化炉中发生的主要反应为:2Al 2 O 3 (s)+6Cl 2 (g)⇌4AlCl 3 (g)+3O 2 (g)△H>0.反应达平衡时,加焦炭能使平衡向正反应方向移动,理由是______.
(3)生产氯化铝的过程中会产生SO 2 、Cl 2 等大气污染物,若将二者按照一定比例通入水中可减少或消除污染.试设计简单实验检验二者是否恰好完全反应.(简要描述实验步骤、现象和结论)______.
仪器自选,可供选择试剂如下:
①滴加酚酞的氢氧化钠溶液②氯化亚铁溶液③硫氰化钾溶液④品红溶液
(4)工业上利用如下装置制备氯气:已知左侧原电池的工作原理为:2Na 2 S 2 +NaBr 3
Na 2 S 4 +3NaBr放电 .
①用惰性电极电解饱和食盐水的化学方程式为______.
②如图所示原电池放电时,电池中的Na + 向______(填“左槽”或“右槽”)移动.左槽中发生的电极反应式为______.
③该原电池工作一段时间后,测得左槽中Na + 物质的量由a mol变为b mol,则电解池中b电极上得到的气体在标准状况下的体积为______L(不考虑气体的损失). 夜静鱼思1年前1
夜静鱼思1年前1 -
 渐行渐远的jj 共回答了20个问题
渐行渐远的jj 共回答了20个问题 |采纳率95%(1)酸雨中的弱酸亚硫酸被氧化为强酸硫酸,使溶液中的c(H + )增大,pH减小,故答案为:酸雨中的弱酸亚硫酸被氧化为强酸硫酸,使溶液中的c(H + )增大,pH减小;(2)焦炭可消耗产物中的氧气,使c(O 2 )变...1年前查看全部
- (2013•临沂三模)无水氯化铝是一种重要的化工原料,利用明矾石[K2SO4•Al2(SO4)3•2Al2O3•6H2O
(2013•临沂三模)无水氯化铝是一种重要的化工原料,利用明矾石[K2SO4•Al2(SO4)3•2Al2O3•6H2O]制备无水氯化铝的流程如下:

(1)焙烧炉中产生的SO2直接排放到空气中会形成酸雨,若某地酸雨的pH为4.6,在空气中放置一段时间后,pH变为4.0,其原因为______;(用必要的文字简述).
(2)氯化炉中发生的主要反应为:2Al2O3(s)+6Cl2(g)⇌4AlCl3(g)+3O2(g)△H>0.反应达平衡时,加焦炭能使平衡向正反应方向移动,理由是______.
(3)生产氯化铝的过程中会产生SO2、Cl2等大气污染物,若将二者按照一定比例通入水中可减少或消除污染.试设计简单实验检验二者是否恰好完全反应.(简要描述实验步骤、现象和结论)______.
仪器自选,可供选择试剂如下:
①滴加酚酞的氢氧化钠溶液②氯化亚铁溶液③硫氰化钾溶液④品红溶液
(4)工业上利用如下装置制备氯气:已知左侧原电池的工作原理为:2Na2S2+NaBr3
Na2S4+3NaBr放电 .
①用惰性电极电解饱和食盐水的化学方程式为2NaCl+2H2O
2NaOH+H2↑+Cl2↑电解 .2NaCl+2H2O.
2NaOH+H2↑+Cl2↑电解 .
②如图所示原电池放电时,电池中的Na+向______(填“左槽”或“右槽”)移动.左槽中发生的电极反应式为______.
③该原电池工作一段时间后,测得左槽中Na+物质的量由a mol变为b mol,则电解池中b电极上得到的气体在标准状况下的体积为______L(不考虑气体的损失). gg1221年前1
gg1221年前1 -
 minemaggia 共回答了24个问题
minemaggia 共回答了24个问题 |采纳率83.3%解题思路:(1)酸雨中的弱酸亚硫酸被氧化为强酸硫酸;
(2)焦炭可消耗产物中的氧气,使c(O2)变小,且燃烧放出热量,温度升高;
(3)二氧化硫溶液与氯水都可以漂白品红溶液,据此设计;
(4)①惰性电极电解饱和氯化钠溶液,生成氢气、氯气、氢氧化钠;
②原电池左侧发生氧化反应,为负极,右侧为正极,电解质溶液阳离子向正极移动;
由反应2Na2S2+NaBr3
Na2S4+3NaBr可知,左侧S22-放电生成S42-放电 .
③该原电池工作一段时间后,测得左槽中Na+物质的量由a mol变为b mol,则转移电子的物质的量为(a-b)mol,电解池中b电极连接电源的正极,为阳极,得到的气体为氯气,根据电子转移计算氯气的物质的量,再根据V=nVm计算氯气的体积.(1)酸雨中的弱酸亚硫酸被氧化为强酸硫酸,使溶液中的c(H+)增大,pH减小,
故答案为:酸雨中的弱酸亚硫酸被氧化为强酸硫酸,使溶液中的c(H+)增大,pH减小;
(2)焦炭可消耗产物中的氧气,使c(O2)变小;且放出热量,温度升高,导致平衡向正反应方向移动,
故答案为:焦炭可消耗产物中的氧气,使c(O2)变小;且放出热量,温度升高,导致平衡向正反应方向移动;
(3)取少量溶液,向其中加入品红溶液,若品红溶液不褪色,说明二者恰好完全反应;否则,二者未完全反应,
故答案为:取少量溶液,向其中加入品红溶液,若品红溶液不褪色,说明二者恰好完全反应;否则,二者未完全反应;
(4)①惰性电极电解饱和氯化钠溶液,生成氢气、氯气、氢氧化钠,电解总反应式为:2NaCl+2H2O
电解
.
2NaOH+H2↑+Cl2↑,
故答案为:2NaCl+2H2O
电解
.
2NaOH+H2↑+Cl2↑;
②原电池左侧发生氧化反应,为负极,右侧为正极,电解质溶液钠离子向正极移动,即向右槽移动;
由反应2Na2S2+NaBr3
放电
.
Na2S4+3NaBr可知,左侧S22-放电生成S42-,电极反应式为:2S22--2e-=S42-,
故答案为:右槽;2S22--2e-=S42-;
③该原电池工作一段时间后,测得左槽中Na+物质的量由a mol变为b mol,则转移电子的物质的量为(a-b)mol,电解池中b电极连接电源的正极,为阳极,得到的气体为氯气,根据电子转移守恒可知氯气的物质的量为你
(a−b)mol
2,故生成氯气的体积=
(a−b)mol
2×22.4L/mol=11.2(a-b)L,
故答案为:11.2(a-b).点评:
本题考点: 制备实验方案的设计;化学电源新型电池;化学平衡的影响因素.
考点点评: 本题考查化学平衡移动、元素化合物性质、原电池、电解池、实验方案设计等,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,题目难度中等.1年前查看全部
- 明矾石的组成和明矾相似,此外还含有Al2O3和少量的Fe2O3等杂质,它是制取钾肥和冶炼铝的重 要原料,其步骤
明矾石的组成和明矾相似,此外还含有Al2O3和少量的Fe2O3等杂质,它是制取钾肥和冶炼铝的重 要原料,其步骤如下:

回答下列问题:
(1)明矾石加入足量的稀氨水中浸出时发生反应的离子方程式为______
(2)沉淀物A中除含有Fe2O3外,还含有______、______.
(3)操作①的名称为______、冷却结晶、过滤.
(4)用14mol•L-1的浓氨水配制480mL 2mol•L‑1稀氨水:
①所用的容量瓶规格是______.②稀释浓氨水用的烧杯和玻璃棒如何洗涤?______
③下列操作对所配制的稀氨水浓度的影响(填“偏大”、“偏小”或“无影响”)
a.洗涤后的容量瓶中有少量蒸馏水:______.
b.浓氨水量取后,所用的量筒用蒸馏水洗涤2〜3次,并将洗涤液转入容量瓶中:______.
(5)确定钾氮复合肥中含有钾元素的方法是______.
(6)为测定钾氮复合肥中氮元素的质量分数,称取mg钾氮复合肥,加入足量的NaOH浓溶液加热,使产生的气体全部逸出,收集到的氨气折箅成标准状况下的体积为V mL.则钾氮复合肥中氮元素的质量分数为[7V/112m% 哩哩啦啦去1年前1
哩哩啦啦去1年前1 -
 JAY_HL 共回答了19个问题
JAY_HL 共回答了19个问题 |采纳率100%解题思路:明矾石含有Al2O3和少量的Fe2O3等杂质,加足量的稀氨水,明矾石中的铝离子与氨水反应,过滤后沉淀A中含Al2O3、Fe2O3、Al(OH)3,溶液中含钾离子、硫酸根离子,操作①为蒸发结晶得到硫酸钾、硫酸铵晶体,Al2O3、Fe2O3、Al(OH)3中加入氢氧化钠,Al2O3、Fe2O3与氢氧化钠不反应,氢氧化铝与氢氧化钠反应Al(OH)3+NaOH═NaAlO2+2H2O,沉淀B为Al2O3、Fe2O3,滤液为NaAlO2溶液,通入足量的二氧化碳,NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3;氢氧化铝加热得到氧化铝,氧化铝电解得到铝.
(1)明矾石加入足量的稀氨水中浸出时铝离子会和氨水之间反应生成氢氧化铝;
(2)Al2O3和Fe2O3、Al(OH)3都和氨水之间不反应;
(3)溶液蒸发浓缩、冷却结晶、过滤可以得到其晶体物质;
(4)①配制480mL溶液,应选择500mL容量瓶;②根据洗涤仪器的方法来进行;③根据c=[n/V]来确定引起的误差;
(5)确定钾氮复合肥中含有钾元素的方法是焰色反应;
(6)根据元素守恒来计算,钾氮复合肥中氮元索的物质的量等于氨气的物质的量;明矾石含有Al2O3和少量的Fe2O3等杂质,加足量的稀氨水,明矾石中的铝离子与氨水反应,过滤后沉淀A中含Al2O3、Fe2O3、Al(OH)3,溶液中含钾离子、硫酸根离子,操作①为蒸发结晶得到硫酸钾、硫酸铵晶体,Al2O3、Fe2O3,Al2O3、Fe2O3、Al(OH)3中加入氢氧化钠,Al2O3、Fe2O3与氢氧化钠不反应,氢氧化铝与氢氧化钠反应Al(OH)3+NaOH═NaAlO2+2H2O,沉淀B为Al2O3、Fe2O3,滤液为NaAlO2溶液,通入足量的二氧化碳,NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3;氢氧化铝加热得到氧化铝,氧化铝电解得到铝.
(1)明矾石加入足量的稀氨水中浸出时发生反应的离子方程式为Al3++3NH3.H2O=Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
(2)杂质均不溶于氨水,铝离子与氨水反应生成沉淀,沉淀A中含Al2O3、Fe2O3、Al(OH)3,
故答案为:Al2O3;Al(OH)3;
(3)由上述分析可知,操作1为蒸发浓缩结晶得到硫酸钾晶体,
故答案为:蒸发浓缩;
(4)①配制480mL溶液,应选择500mL容量瓶,
故答案为:500mL容量瓶;
②稀释浓氨水用的烧杯和玻璃棒的洗涤方法:适量的蒸馏水沿着玻璃棒注入烧杯中,倾斜转动烧杯,洗涤烧杯内壁后将洗涤液转入容量瓶中,重复操作2~3次,
故答案为:取适量蒸馏水沿玻璃棒注入烧杯中,倾斜转动烧杯,洗涤烧杯内壁后将洗涤液转入容量瓶中,重复操作2~3次;
③a、定容时需加水,洗涤后的容量瓶中有少量蒸馏水,不会影响实验结果,
故答案为:无影响;
b、用量筒量取浓氨水后,用蒸馏水洗涤量筒并转移至容量瓶中,溶质增多,浓度偏大,
故答案为:偏大;
(5)确定钾氮复合肥中含有钾元素的方法是焰色反应,透过蓝色钴玻璃观察到紫色火焰,则含钾元素,
故答案为:焰色反应;
(6)足量的NaOH浓溶液加热,使产生的气体全部逸出,收集到的氨气折箅成标准状况下的体积为VmL,根据N元素守恒,则钾氮复合肥中氮元索的物质的量为
V×10−3
22.4]mol,所以钾氮复合肥中氮元索的质量分数为
V×10−3×14
22.4m×100%=[7V/112m]%,
故答案为:[7V/112m]%.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查较综合,涉及物质制备实验方案的设计及溶液配制,把握实验流程中发生的反应及分离方法为解答的关键,侧重分析能力及迁移应用能力的考查,题目难度中等.1年前查看全部
大家在问
- 1“雨是最寻常的,一下就是三两天”写出了雨的什么特点
- 2英语中4点53、10点12、3点正、4点半、12点正用两种方法写?
- 3用分析法证明,已知M使Rt△ABC的斜边AB的中点,过M作AB的垂线交AC于点D,交BC的延长线与E,求证,MC的平方=
- 4判断是否成比例,成什么比例,为什么?准确
- 5试提供一批MI值较低的材料 英文怎讲?
- 6一个圆的周长是6.28分米,它的面积是多少平方分米?
- 7热核反应中物质质量为何会有减少那能量为什么会有损耗呢?
- 8什么幸福 为题的高一英语作文
- 9判断它是什么比例非零自然数A与他的倒数说明理由
- 10已知正方形ABCD的面积是64,E,F,G,H分别是正方形四边的中点
- 11清心玉映的意思“王夫人神情散朗,故有林下风气;顾家妇清心玉映,自是闺房之秀.”——出自《世说新语·贤媛》 “清心玉映”的
- 12若将一张纸对折30次,则可以得到2的三十次方层.
- 13“先天下之忧而忧,后天下之乐而乐.”这句话出自哪?作者是谁?
- 14英语翻译The analogy,then,is not substantively empty.For some wri
- 15英语翻译This particular notion of “rationality” takes self-inter

