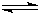将4mol A气体和2mol B气体在2L的密闭容器中混合并在一定条件下发生反应2A(g)+B(g) 2C(g),2s时
 hh大峡2022-10-04 11:39:541条回答
hh大峡2022-10-04 11:39:541条回答 将4mol A气体和2mol B气体在2L的密闭容器中混合并在一定条件下发生反应2A(g)+B(g)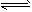 2C(g),2s时测得C的浓度为0.6mol·L -1 。下列说法正确的是 2C(g),2s时测得C的浓度为0.6mol·L -1 。下列说法正确的是 |
| [ ] |
| ①用物质A表示的平均反应速率为0.3mol/(L·s); ②用物质B表示的平均反应速率为0.6mol/(L·s); ③2 s时物质A的转化率为70%; ④2 s时物质B的浓度为0.7mol·L -1 A.①③ B.①④ C.②③ D.③④ |

已提交,审核后显示!提交回复
共1条回复
 mxyh 共回答了21个问题
mxyh 共回答了21个问题 |采纳率85.7%- B
- 1年前
相关推荐
- 将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g
将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)⇌2C(g).若经2s后测得C的浓度为0.6mol•L-1,下列几种说法错误的是( )
A.用物质A表示的反应平均速率为0.3 mol•L-1•s-1
B.2 s时物质A的转化率为70%
C.用物质B表示的反应的平均速率为0.6 mol•L-1•s-1
D.2 s时物质B的浓度为0.7 mol•L-1 户外高手1年前1
户外高手1年前1 -
 感受现实 共回答了10个问题
感受现实 共回答了10个问题 |采纳率100%解题思路:若经2s后测得C的浓度为0.6mol•L-1,则C的物质的量为1.2mol,
根据2A(g)+B(g)⇌2C(g)
开始 4 2 0
转化1.2 0.6 1.2
2s2.81.4 1.2
结合反应速率及转化率的计算公式来解答.若经2s后测得C的浓度为0.6mol•L-1,则C的物质的量为1.2mol,
根据2A(g)+B(g)⇌2C(g)
开始 4 2 0
转化1.2 0.6 1.2
2s2.81.4 1.2
A.用C表示的反应速率为[0.6mol/L/2s]=0.3mol•L-1•s-1,反应速率之比等于化学计量数之比,则用物质A表示的反应平均速率为0.3mol•L-1•s-1,故A正确;
B.2s时物质A的转化率为[1.2mol/4mol]×100%=30%,故B错误;
C.反应速率之比等于化学计量数之比,用物质B表示的反应的平均速率为0.15mol•L-1•s-1,故C错误;
D.2 s时物质B的浓度为[1.4mol/2L]=0.7mol/L,故D正确;
故选BC.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查化学平衡的计算,明确三段法计算的方法及转化率、反应速率的计算公式即可解答,题目难度不大.1年前查看全部
- 将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g
将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)⇌2C(g).若经2s后测得C的浓度为0.6mol•L-1,现有下列几种说法:其中正确的是( )
①用物质A表示的反应的平均速率为0.3mol•L-1•s-1
②用物质B表示的反应的平均速率为0.6mol•L-1•s-1
③2s时物质B的浓度为0.7mol•L-1
④2s末,物质A的转化率为70%
A. ①④
B. ①③
C. ②④
D. ③④ pixelxu1年前0
pixelxu1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 将4mol A气体和2mol B气体在2L的密闭容器中混合,在一定条件下发生如下反应:2A(g)+B(g)⇌2C(g)若
将4mol A气体和2mol B气体在2L的密闭容器中混合,在一定条件下发生如下反应:2A(g)+B(g)⇌2C(g)若经过2秒后测得C的浓度为0.6mol/L.则:
(1)2s内用B表示的反应速率______
(2)2s时A的物质的量浓度为______
(3)2s时B的物质的量为______
(4)最终C的浓度______(填“能”或“不能”)达到2mol/L. 钢玻璃1年前1
钢玻璃1年前1 -
 geyi540320 共回答了18个问题
geyi540320 共回答了18个问题 |采纳率77.8%解题思路:依据化学平衡三段式列式计算,若经过2秒后测得C的浓度为0.6mol/L.生成C物质的量=0.6mol/L×2L=1.2mol
2A(g)+B(g)⇌2C(g)
起始量(mol) 4 2 0
变化量(mol) 1.2 0.6 1.2
2s量(mol) 2.8 1.4 1.2
据此分析计算;依据化学平衡三段式列式计算,若经过2秒后测得C的浓度为0.6mol/L.生成C物质的量=0.6mol/L×2L=1.2mol,
2A(g)+B(g)⇌2C(g)
起始量(mol) 4 2 0
变化量(mol) 1.2 0.6 1.2
平衡量(mol) 2.8 1.4 1.2
(1)2s内用B表示的反应速率=
0.6mol
2L
2s=0.15 mol/(L•s);
故答案为:0.15 mol/(L•s);
(2)2s时A的物质的量浓度=[2.8mol/2L]=1.4mol/L;
故答案为:1.4mol/L;
(3)计算可知2s时B的物质的量为1.4mol;
故答案为:1.4mol;
(4)最终C的浓度若为2mol/L,需要4molA全部反应生成C4mol,但最后达到平衡状态是可逆反应,不能进行彻底,所以不能达到2mol/L;
故答案为:不能;点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查了化学平衡计算分析方法,影响平衡因素分析判断,速率、浓度计算,掌握基础是关键,题目较简单.1年前查看全部
- 将4mol A气体和2mol B气体在2L的恒容容器中混合并在一定条件下发生:2A(g)+B(g)⇌
将4mol A气体和2mol B气体在2L的恒容容器中混合并在一定条件下发生:2A(g)+B(g)⇌2C(g),经2s后测得C的浓度为0.6mol.L-1,下列几种说法中正确的是( )
A.用物质B表示反应的平均速率为0.3 mol•L-1•s-1
B.2 s时气体密度与起始时气体密度之比为3:2
C.2 s时物质A的转化率为70%
D.2 s时物质B的浓度为0.7 mol•L-1 猗嗟名兮1年前1
猗嗟名兮1年前1 -
 欢迎大虾拍砖 共回答了20个问题
欢迎大虾拍砖 共回答了20个问题 |采纳率85%解题思路:将 4mol A 气体和 2mol B 气体在 2L 的密闭容器中混合并在一定条件下发生如下反应2A(g)+B(g)⇌2C(g),若经 2s(秒)后测得 C 的浓度为0.6mol•L-1•s-1 ,依据化学平衡三段式列式计算
2A(g)+B(g)⇌2C(g)
起始量(mol) 4 2 0
变化量(mol)1.2 0.6 1.2
2s末(mol)2.81.42L×0.6mol/L=1.2mol
A、用物质B表示反应的平均速率=[△c/△t]计算;
B、反应前后气体质量和体积都不变,所以2 s时气体密度与起始时气体密度之比为1:1;
C、2s末物质A的转化率=[消耗量/起始量]×100%;
D、2s末物质B的浓度=[n/V];将 4mol A 气体和 2mol B 气体在 2L 的密闭容器中混合并在一定条件下发生如下反应2A(g)+B(g)⇌2C(g),若经 2s(秒)后测得 C 的浓度为0.6mol•L-1•s-1 ,依据化学平衡三段式列式计算
2A(g)+B(g)⇌2C(g)
起始量(mol) 4 2 0
变化量(mol)1.2 0.6 1.2
2s末(mol)2.81.42L×0.6mol/L=1.2mol
A、用物质B表示反应的平均速率=
0.6mol
2L
2s=0.15mol/L•s,故A错误;
B、反应前后气体质量和体积都不变,所以2 s时气体密度与起始时气体密度之比为1:1,故B错误;
C、2s末物质A的转化率=[1.2mol/4mol]×100%=30%,故C错误;
D、2s末物质B的浓度=[1.4mol/2L]=0.7mol•L-1,故D正确;
故选D.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查化学平衡三段式计算应用,主要是化学反应速率计算,转化率的计算应用,题目较简单.1年前查看全部
- 将4mol A气体和2mol B气体置于2L密闭容器中,混合后发生如下反应:2A(g)+B(g)⇌2C(g).若经2s后
将4mol A气体和2mol B气体置于2L密闭容器中,混合后发生如下反应:2A(g)+B(g)⇌2C(g).若经2s后侧得C的浓度为0.6mol•L -1 ,下列说法正确的是( ) A.用物质A表示的反应速率为0.6mol(L•s) -1 B.用物质B表示的反应速率为0.3mol(L•s) -1 C.2s时物质A的转化率为30% D.2s时物质B的浓度为0.3mol•L -1  magicwym1年前0
magicwym1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g) 2C(g)。若经
将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g) 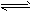 2C(g)。若经2s后测得C的浓度为0.6 mol·L -1 ,现有下列几种说法:
2C(g)。若经2s后测得C的浓度为0.6 mol·L -1 ,现有下列几种说法:
①用物质A表示的反应平均速率为0.3 mol·L -1 ·s -1
②用物质B表示的反应的平均速率为0.6 mol·L -1 ·s -1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7mol·L -1
其中正确的是[ ]A.①③
B.①④
C.②③
D.③④ xiaobo2341年前1
xiaobo2341年前1 -
 娜时的我们47 共回答了12个问题
娜时的我们47 共回答了12个问题 |采纳率100%B1年前查看全部
- 将4mol A气体和2mol B气体在2L的密闭容器内混合,并在一定条件下发生如下反应:2A(g)+B(g) 2C(g)
将4mol A气体和2mol B气体在2L的密闭容器内混合,并在一定条件下发生如下反应:2A(g)+B(g)
 2C(g),若经2s后测得C的浓度为0.6mol·L -1 ,现有下列几种说法:
2C(g),若经2s后测得C的浓度为0.6mol·L -1 ,现有下列几种说法:
①用物质A表示的反应的平均速率为0.3mol·L -1 ·s -1
②用物质B表示的反应的平均速率为0.6mol·L -1 ·s -1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7mol·L -1
其中正确的是A.①③ B.①④ C.②③ D.③④  行子何用1年前1
行子何用1年前1 -
 Bay我神人也 共回答了13个问题
Bay我神人也 共回答了13个问题 |采纳率100%B
1年前查看全部
- (2012•南昌三模)将4mol A气体和2mol B气体在2L的密闭容器内混合,并在一定条件下发生
(2012•南昌三模)将4mol A气体和2mol B气体在2L的密闭容器内混合,并在一定条件下发生如下反应:2A(g)+B(g)⇌2C(g),若经2s后测得C的浓度为0.6mol•L-1,现有下列几种说法:
①用物质A表示的反应的平均速率为0.3mol•L-1•s-1
②用物质B表示的反应的平均速率为0.6mol•L-1•s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7mol•L-1
其中正确的是( )
A.①③
B.①④
C.②③
D.③④ 雨夜的空杯1年前1
雨夜的空杯1年前1 -
 小123指 共回答了26个问题
小123指 共回答了26个问题 |采纳率92.3%解题思路:根据化学反应速率等于单位时间内浓度的变化量及根据反应2A(g)+B(g)⇌2C(g),并利用三段式法计算,据此解答.利用三段式法计算:
起始A的浓度为[4mol/2L]=2mol/L,B的浓度为 [2mol/2L]=1mol/L
2A(g)+B(g)⇌2C(g),
起始:2mol/L 1mol/L0
变化:0.6mol/L 0.3mol/L 0.6mol/L
2s时:1.4mol/L 0.7mol/L 0.6mol/L
2s内,用物质A表示的反应的平均速率为v(A)=[0.6mol/L/2s]=0.3mol•L-1•s-1;
2s内,用物质B表示的反应的平均速率为v(B)=[0.3mol/L/2s]=0.15mol•L-1•s-1;
2s时物质A的转化率为α=[0.6mol/L/2mol/L]×100%=30%;
2s时物质B的浓度为0.7mol•L-1,
显然①④正确,
故选:B.点评:
本题考点: 化学平衡的计算;化学反应速率和化学计量数的关系.
考点点评: 本题考查化学反应速率有关计算,难度不大,学生应学会利用三段式计算方法来表示各个量,并进行相关的计算.1年前查看全部
- 将4mol A气体和2mol B气体在2L的密闭容器中混合并在一定条件下发生如下反应
将4mol A气体和2mol B气体在2L的密闭容器中混合并在一定条件下发生如下反应
2A(g)+ B(g)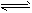 2C(g);△H <0。4s(秒)后反应达到平衡状态,此时测得C的浓度为0.6mol·L -1 。下列说法中,正确的是 [ ]
2C(g);△H <0。4s(秒)后反应达到平衡状态,此时测得C的浓度为0.6mol·L -1 。下列说法中,正确的是 [ ]A.当A 、B、C物质的量浓度之比为2:1:2时,反应即达到平衡状态
B.4s内用物质B表示的反应速率为0.075 mol·L -1 ·s -1
C.达平衡后若通入一定量氦气,A的转化率降低
D.达平衡后若升高温度,C的浓度将增大 sukik21年前1
sukik21年前1 -
 无比混蛋 共回答了20个问题
无比混蛋 共回答了20个问题 |采纳率95%B1年前查看全部
- 将4mol A气体和2mol B气体在2L的定容密闭容器中混合,并在一定条件下发生如下反应:2A(g
将4mol A气体和2mol B气体在2L的定容密闭容器中混合,并在一定条件下发生如下反应:2A(g)+B(g)⇌2C(g)△H;经2s后测得C的物质的量浓度为0.6mol•L-1,现有下列几种说法:
①用物质A表示的这段时间的平均速率为0.3mol•L-1•s-1
②此反应达到平衡状态的标志是混合气体的密度不变
③2s时物质A的转化率为30%
④此反应达到平衡时充入1mol He(不参加反应),则平衡向正反应方向移动
其中正确的是( )
A.①③
B.②④
C.①②
D.③④ 三日丧命散1年前1
三日丧命散1年前1 -
 我太油菜花了 共回答了19个问题
我太油菜花了 共回答了19个问题 |采纳率84.2%解题思路:经2s后测得C的物质的量浓度为0.6mol•L-1,则
2A(g)+B(g)⇌2C(g)
开始 2 1 0
转化 0.6 0.3 0.6
平衡 1.4 0.7 0.6
以此计算转化率及反应速率,并结合平衡的移动及判定来解答.经2s后测得C的物质的量浓度为0.6mol•L-1,则
2A(g)+B(g)⇌2C(g)
开始 2 1 0
转化 0.6 0.3 0.6
平衡 1.4 0.7 0.6
①用物质A表示的这段时间的平均速率为[0.6mol/L/2s]=0.3mol•L-1•s-1,故选;
②定容,气体的质量始终不变,则密度始终不变,此反应达到平衡状态的标志不能是混合气体的密度不变,故不选;
③2s时物质A的转化率为[0.6/2]×100%=30%,故选;
④此反应达到平衡时充入1molHe(不参加反应),因体积不变,反应体系中各物质的浓度不变,平衡不移动,故不选;
故选A.点评:
本题考点: 化学平衡的计算;化学平衡的影响因素;化学平衡状态的判断.
考点点评: 本题考查化学平衡的计算,涉及化学平衡三段法计算、转化率和反应速率的计算及平衡移动、平衡判定,综合性较强,题目难度中等,②④均为解答的易错点.1年前查看全部
- 将4mol A气体和2mol B气体在体积为2L的密闭容器中混合,并在一定条件下发生反应:2A(g)
将4mol A气体和2mol B气体在体积为2L的密闭容器中混合,并在一定条件下发生反应:2A(g)+B(g)⇌xC(g),若经2s后测得A的物质的量为2.8mol,C的物质的量浓度为0.6mol/L.现有几种说法:①2s内用物质A表示的平均反应速率为0.3mol/(L•s);②2s内用物质B表示的平均反应速率为0.6mol/(L•s);③2s时物质B的转化率为70%;④x=2.其中正确的是( ) A.①③ B.①④ C.②③ D.③④  kesnow1年前1
kesnow1年前1 -
 孤单抗体9 共回答了19个问题
孤单抗体9 共回答了19个问题 |采纳率89.5%2s后生成C为0.6mol/L×2L=1.2mol,2A(g)+B(g)⇌xC(g),
开始 4mol 2mol 0
转化 1.2mol0.6mol 1.2mol
2s 2.8mol 1.4mol 1.2mol
2s内用物质C表示的平均反应速率为
0.6mol/L
2s =0.3mol/(L•s),
①2s内用物质A表示的平均反应速率为
4mol-2.8mol
2L
2s =0.3mol/(L•s),故①正确;
②反应速率之比等于化学计量数之比,则2s内用物质B表示的平均反应速率为0.3mol/(L•s)×
1
2 =0.15mol/(L•s),故②错误;
③2s时物质B的转化率为
0.6mol
2mol ×100%=60%,故③错误;
④反应速率之比等于化学计量数之比,A、C的反应速率相同,则x=2,故④正确;
故选B.1年前查看全部
- 将4mol A气体和2 mol B气体在体积为2 L的密闭容器中混合,并在一定条
将4mol A气体和2 mol B气体在体积为2 L的密闭容器中混合,并在一定条件下发生如下反应:  若经2 s后测得A的物质的量为2.8 mol, C的浓度为0.6 mol/L。现有下列几种说法,其中正确的是 [ ]
若经2 s后测得A的物质的量为2.8 mol, C的浓度为0.6 mol/L。现有下列几种说法,其中正确的是 [ ]①2s内用物质A表示的平均反应速率为0.3 mol/(L·s)
②2s内用物质B表示的平均反应速率为0.6 mol/(L·s)
③2s时物质B的转化率为70%
④x=2
A.①③
B.①④
C.②③
D.③④ qq老彭1年前1
qq老彭1年前1 -
 怀念心蓝 共回答了21个问题
怀念心蓝 共回答了21个问题 |采纳率81%B1年前查看全部
- 将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应2A(g)+B(g)⇌2C(g),若经2
将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应2A(g)+B(g)⇌2C(g),若经2s后测得C的浓度为0.6mol•L-1,现有下列几种说法,其中正确的是( )
A.用物质A表示的反应的平均速率为0.3 mol•L-1•s-1
B.用物质B表示的反应的平均速率为0.6 mol•L-1•s-1
C.2s时物质A的转化率为70%
D.2s时物质B的体积分数为40% zeng1081年前0
zeng1081年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g) 2C(g)。若经
将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)
 2C(g)。若经2s后测得C的浓度为0.6mol·L -1 ,现有下列几种说法,其中正确的是
2C(g)。若经2s后测得C的浓度为0.6mol·L -1 ,现有下列几种说法,其中正确的是
①用物质A表示的反应平均速率为0.3 mol·L -1 ·s -1
②用物质B表示的反应平均速率为0.6mol·L -1 ·s -1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7 mol·L -1A.①③ B.①④ C.②③ D.③④  想学英语者1年前1
想学英语者1年前1 -
 winter_lover10 共回答了20个问题
winter_lover10 共回答了20个问题 |采纳率90%B
用C表示反应速率是v(C)=△c/t=0.6/2=0.3mol/L·s
反应速率之比等于化学计量数之比。
v(A)/2=v(B)/1=v(C)/2
v(A)/2=v(B)/1=0.3/2
用物质A表示2S内的平均反应速率v(A)=0.3mol/L·s
用物质B表示2S内的平均反应速率v(B)=0.15mol/L·s
2s后反应掉A的物质的量是0.3*2*2=1.2mol,物质A的转化率是1.2/4*100%=30%
2s后反应掉B的物质的量是0.15*2*2=0.6mol,剩余B的物质的量是2-0.6=1.4mol,B的浓度是c=n/V=1.4/2=0.7mol/L。
综合以上信息,可知①④分析正确,故选B。1年前查看全部
- 将4mol A气体和2mol B气体置于2L密闭容器中,混合后发生如下反应:2A(g)+B(g)⇌2C(g).若经2s后
将4mol A气体和2mol B气体置于2L密闭容器中,混合后发生如下反应:2A(g)+B(g)⇌2C(g).若经2s后侧得C的浓度为0.6mol•L-1,下列说法正确的是( )
A.用物质A表示的反应速率为0.6mol(L•s)-1
B.用物质B表示的反应速率为0.3mol(L•s)-1
C.2s时物质A的转化率为30%
D.2s时物质B的浓度为0.3mol•L-1 刘纹正1年前0
刘纹正1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g
将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)⇌2C(g).若经2s 后测得C的浓度为 0.6mol•L-1,现有下列几种说法:①用物质A表示的反应的平均速率为 0.6mol•(L•s)-1;②用物质B表示的反应的平均速率为 0.15mol•(L•s)-1;③2s 时物质A的浓度为1.4mol•L-1;④2s 时物质B的转化率为70%.其中正确的是( )
A. ①③
B. ①④
C. ②③
D. ③④ 注册太费劲1年前1
注册太费劲1年前1 -
 zhutoushabi 共回答了18个问题
zhutoushabi 共回答了18个问题 |采纳率94.4%解题思路:①根据v=[△c/△t]计算v(C),再根据速率之比等于化学计量数之比计算v(A);
②根据v=[△c/△t]计算v(C),再根据速率之比等于化学计量数之比计算v(B);
③根据浓度变化量之比等于化学计量数之比计算△c(A),2s时物质A的浓度=A的起始浓度-△c(A).
④根据浓度变化量之比等于化学计量数之比计算△n(B),进而计算△n(B),根据转化率定义计算.①v(C)=[0.6mol/L/2s]=0.3mol•L-1•s-1,速率之比等于化学计量数之比,故v(A)=v(C)=0.3mol•L-1•s-1,故①错误;
②v(C)=[0.6mol/L/2s]=0.3mol•L-1•s-1,速率之比等于化学计量数之比,故v(B)=[1/2]v(C)=[1/2]×0.3mol•L-1•s-1=0.15mol•L-1•s-1,故②正确;
③△c(A)=△n(C)=0.6mol•L-1,△n(A)=0.6mol•L-1×2L=1.2mol,平衡A的浓度c(A)=[4mol−1.2mol/2L]=1.4mol/L,故③正确;
④根据方程式可知,△c(A)=△n(C)=0.6mol•L-1,故△n(A)=0.6mol•L-1×2L=1.2mol,△(B)=[1/2]△n(A)=0.6mol,故B的转化率=[0.6mol/2mol]×100%=30%,故④错误;
故选C.点评:
本题考点: 反应速率的定量表示方法.
考点点评: 本题考查化学反应速率及化学平衡的有关计算,比较基础,注意对基础知识的理解掌握.1年前查看全部
- 将4mol A气体和2mol B气体在2L 的容器中混合发生如下反应:2A(g)+B(g)
将4mol A气体和2mol B气体在2L 的容器中混合发生如下反应:2A(g)+B(g)⇌2C(g)若经2s 后测得C的浓度为0.6mol•L-1现有下列几种说法其中不正确的是( )
A.用物质A表示的反应的平均速率为0.3 mol•L-1•s-1
B.2s时的压强是起始时的1.1倍
C.2s时物质A的转化率为30%
D.2s时物质B的浓度为0.7 mol•L-1 紫窗帘1年前1
紫窗帘1年前1 -
 aaletu 共回答了20个问题
aaletu 共回答了20个问题 |采纳率85%解题思路:A、根据 v=[△c/t]计算出C的速率,再根据速率之比等于反应计量数之比,求得A的速率;
B、根据压强之比等于物质的量之比判断;
C、根据转化率=[已转化的量/起始的量]×100%计算;
D、根据化学方程式计算出剩余B的物质的量,进而求得B的浓度;A、根据 v=[△c/t]计算出C的速率为
0.6mol•L−1
2s=0.3 mol•L-1•s-1,反应中A和C的计量数相等,所以A的速率为0.3 mol•L-1•s-1,故A正确;
B、因为起始总物质的量为4mol+2mol=6mol,2s时生成C的浓度为0.6mol•L-1,容器体积为2L,则C的物质的量为1.2mol,根据化学方程式可知,反应剩余的A的物质的量为4mol-1.2mol=2.8mol,剩余的B的物质的量为2mol-0.6mol=1.4mol,此时总物质的量为2.8mol+1.4mol+1.2mol=5.4mol,根据压强之比等于物质的量之比可知,2s时的压强是起始时的[5.4/6]倍=0.9倍,故B错误;
C、2s时生成C的浓度为0.6mol•L-1,容器体积为2L,则C的物质的量为1.2mol,根据化学方程式可知,反应中转化的A的物质的量为1.2mol,根据转化率=[已转化的量/起始的量]×100%可计算得A的转化率为[1.2/4]×100%=30%,故C正确;
D、根据B的分析可知,2s时剩余的B的物质的量为2mol-0.6mol=1.4mol,所以B的浓度为[1.4mol/2L]=0.7mol/L,故D正确;
故选D.点评:
本题考点: 化学平衡建立的过程.
考点点评: 本题主要考查了根据可逆反应计算反应速率、计算转化率、计算平衡浓度等知识,难度不大,解题时注意基础知识的运用.1年前查看全部
- 将4mol A气体和2mol B气体在2L固定体积的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)⇌2C(g
将4mol A气体和2mol B气体在2L固定体积的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)⇌2C(g).若经2s后测得C的浓度为0.6mol•L -1 ,现有下列几种说法,其中正确的是( ) A.用物质A表示的反应的平均速率为0.3mol•L -1 •s -1 B.用物质B表示的反应的平均速率为0.6mol•L -1 •s -1 C.2s时物质A的转化率为70% D.2s时物质B的浓度为0.7mol•L -1  此恨无休1年前1
此恨无休1年前1 -
 hongqiren 共回答了17个问题
hongqiren 共回答了17个问题 |采纳率94.1%1年前查看全部
- 将4mol A气体和2mol B气体在2L的密闭容器中混合,并在一定条件下发生如下可逆反应:2A(g
将4mol A气体和2mol B气体在2L的密闭容器中混合,并在一定条件下发生如下可逆反应:2A(g)+B(g)⇌2C(g).若经2s后测得C的浓度为0.6mol/L,现有下列几种说法,其中正确的是( )
A.反应达到平衡时,A、B、C的浓度不再变化,反应停止
B.升高温度、增大压强、增加A的浓度、减小C的浓度或使用催化剂等都可以使反应速率加快
C.经过足够长时间后,A和B可以完全转化为C
D.2s时物质A转化了1.2mol huzi_lj1年前1
huzi_lj1年前1 -
 HELLOBEST 共回答了11个问题
HELLOBEST 共回答了11个问题 |采纳率90.9%解题思路:A、平衡状态是动态平衡,v(正)=v(逆)≠0;
B、减小C的浓度,反应速率减慢;
C、可逆反应中反应物不可能完全转化;
D、根据化学方程式计算,据生成C的量可以计算出反应的A的量.A、平衡状态是动态平衡,v(正)=v(逆)≠0,故A错误;
B、减小C的浓度,反应速率减慢,故B错误;
C、可逆反应中反应物不可能完全转化,故C错误;
D、生成C0.6mol/L×2L=1.2mol,根据化学方程式知,n(A):n(C)=1:1,参加反应的A为,1.2mol,故A正确.
故选:D.点评:
本题考点: 化学平衡的影响因素.
考点点评: 本题考查化学反应的基本计算,理解反应速率、转化率、浓度概念和计算应用是关键,题目较简单.1年前查看全部
- 将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)⇌2C(g),若经
将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)⇌2C(g),若经2s(秒)后测得C 的浓度为0.6mol•L-1,则:
①用物质A表示的反应的平均速率______
②2s时物质B的浓度为______. zpy11131年前1
zpy11131年前1 -
 leeyoung61920 共回答了12个问题
leeyoung61920 共回答了12个问题 |采纳率91.7%解题思路:反应2s后测得C的浓度为0.6mol/L,物质的量=0.6mol/L×2L=1.2mol;
2A(g)+B(g)⇌2C(g)
起始量(mol) 4 2 0
变化量(mol)1.20.61.2
2s末量(mol)2.81.41.2
根据概念计算A的速率和B的浓度.反应2s后测得C的浓度为0.6mol/L,物质的量=0.6mol/L×2L=1.2mol;
2A(g)+B(g)⇌2C(g)
起始量(mol) 4 2 0
变化量(mol)1.20.61.2
2s末量(mol)2.81.41.2
①用物质A表示2 s内的平均反应速率=[1.2mol
2L/2S]=0.3 mol/(L•s),故答案为:0.3 mol/(L•s);
②2 s后物质B的浓度=[1.4mol/2L]=0.7mol/L,故答案为:0.7mol/L;点评:
本题考点: 反应速率的定量表示方法.
考点点评: 本题考查化学反应的基本计算,理解反应速率、浓度概念和计算应用是关键,题目较简单.1年前查看全部
- 将4mol A气体和2mol B气体在2L的密闭容器中混合并在一定条件下发生如下反应2A(g)+B(
将4mol A气体和2mol B气体在2L的密闭容器中混合并在一定条件下发生如下反应2A(g)+B(g)⇌2C(g)△H<0,4s后反应达到平衡状态,此时测得C的浓度为0.6mol/L,下列说法中正确的是( )
A.反应过程中,当A、B、C的物质的量浓度之比为2:1:2时,反应即达到平衡状态
B.达平衡后若升高温度,C的浓度将增大
C.达平衡后若增大压强,A的转化率降低
D.4 s内用物质B表示的反应速率为0.075 mol/(L•s) vv261年前1
vv261年前1 -
 水柔心 共回答了24个问题
水柔心 共回答了24个问题 |采纳率87.5%解题思路:A、当同一物质的正逆反应速率相等时,该反应达到平衡状态.
B、升高温度平衡向吸热方向移动,从而确定C的浓度变化;
C、增大压强平衡向气体体积减小的方向移动,从而确定A的转化率变化.
D、先计算C的反应速率,再根据同一化学反应中同一时间段内各物质的反应速率之比等于计量数之比计算B的反应速率.A、反应过程中,当A、B、C的物质的量浓度之比为 2:1:2时,反应不一定达到平衡状态,这与反应物的浓度及其转化率有关,故A错误.
B、该反应是一个正反应是放热的反应,升高温度平衡向逆反应方向移动,所以C的浓度将减小,故B错误;
C、该反应是一个反应前后气体体积减小的化学反应,增大压强平衡向正反应方向移动,导致A的转化率增大,故C错误.
D、C的浓度为0.6mol•L-1,则C的反应速率是0.15mol/L.s,同一化学反应中同一时间段内,各物质的反应速率之比等于其计量数之比,所以B的反应速率是0.075 mol•L-1•S-1,故D正确.
故选D.点评:
本题考点: 化学平衡的影响因素;化学平衡建立的过程.
考点点评: 本题考查了化学平衡状态的判断及外界条件对化学平衡的影响,难度不大,注意反应达到平衡状态时,正逆反应速率相等但不等于0.1年前查看全部
- 将4mol A气体和2mol B气体在2L的密闭容器中混合并在一定条件下发生如下反应2A(g)+B(
将4mol A气体和2mol B气体在2L的密闭容器中混合并在一定条件下发生如下反应2A(g)+B(g)⇌2C(g)△H<0,4s后反应达到平衡状态,此时测得C的浓度为0.6mol/L,下列说法中正确的是( )
A.反应过程中,当A、B、C的物质的量浓度之比为2:1:2时,反应即达到平衡状态
B.4 s内用物质B表示的反应速率为0.075 mol/(L•s)
C.达平衡后若增大压强,A的转化率增大
D.达平衡后若升高温度,C的浓度将增大 pyzl20051年前1
pyzl20051年前1 -
 zxq8425 共回答了18个问题
zxq8425 共回答了18个问题 |采纳率83.3%解题思路:A、当同一物质的正逆反应速率相等时,该反应达到平衡状态.
B、先计算C的反应速率,再根据同一化学反应中同一时间段内各物质的反应速率之比等于计量数之比计算B的反应速率.
C、增大压强平衡向气体体积减小的方向移动,从而确定A的转化率变化.
D、升高温度平衡向吸热方向移动,从而确定C的浓度变化.A、反应过程中,当A、B、C的物质的量浓度之比为 2:1:2时,反应不一定达到平衡状态,这与反应物的浓度及其转化率有关,故A错误.
B、C的浓度为0.6mol•L-1,则C的反应速率是0.15mol/L.s,同一化学反应中同一时间段内,各物质的反应速率之比等于其计量数之比,所以B的反应速率是0.075 mol•L-1•S-1,故B正确.
C、该反应是一个反应前后气体体积减小的化学反应,增大压强平衡向正反应方向移动,导致A的转化率增大,故C正确.
D、该反应是一个正反应是放热的反应,升高温度平衡向逆反应方向移动,所以C的浓度将减小,故D错误.
故选BC.点评:
本题考点: 化学平衡的影响因素;化学平衡建立的过程.
考点点评: 本题考查了化学平衡状态的判断及外界条件对化学平衡的影响,难度不大,注意反应达到平衡状态时,正逆反应速率相等但不等于0.1年前查看全部
- 将4mol A气体和 2mol B气体 在2L的密闭容器中混合并在一定条件下发生反应2A(g)+B(g)=(可逆)=2C
将4mol A气体和 2mol B气体 在2L的密闭容器中混合并在一定条件下发生反应2A(g)+B(g)=(可逆)=2C(g)+ D(s),2min时测得C的浓度为0.6mol/L ,则下列叙述真确的是
A 用A表示的平均反应速率为0.3 mol/L·min
B 增大压强,混合气体的平均相对分子质量增大
C 该反应的化学平衡常数K=((C)*2 x (D)*2 )/((A)*2 x(B)*2)
D 升高温度,气体的物质的量减少,则该反应是放热的
灿烂在六月高三2011版第六套模拟卷选择题11题 想不通 dsrt71年前1
dsrt71年前1 -
 wenjun1002 共回答了15个问题
wenjun1002 共回答了15个问题 |采纳率80%A反应的物质的量为:根据反应方程与C生成的是一样的,为1.2mol,反应速率为1.2mol/2l*2min=0.3mol/L·min
B答案C物质的相对分子质量未知,不能确定是否增加
C答案应该是物质浓度的平方而不是简单的*2
D答案升高温度气体的总物质的量减少说明是往正方向移动应该是吸热反应1年前查看全部
- 将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g
将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)⇌2C(g).若经2s后测得C的浓度为0.6mol•L-1,现有下列几种说法:其中正确的是( )
①用物质A表示的反应的平均速率为0.3mol•L-1•s-1
②用物质B表示的反应的平均速率为0.6mol•L-1•s-1
③2s时物质B的浓度为0.7mol•L-1
④2s末,物质A的转化率为70%
A.①④
B.①③
C.②④
D.③④ jkx19771年前0
jkx19771年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 将4mol A气体和2mol B气体在2L的密闭容器中混合并在一定条件下发生如下反应:2A(g)+B(g)⇌2C(g)△
将4mol A气体和2mol B气体在2L的密闭容器中混合并在一定条件下发生如下反应:2A(g)+B(g)⇌2C(g)△H<0,4S后反应达到平衡状态,此时测得C的浓度为0.6mol•L-1,下列说法中正确的是( )
A.反应过程中,当A、B、C的物质的量浓度之比为2:1:2时,反应即达到平衡状态
B.4s内用物质B表示的反应速率为0.075mol•L-1•s-1
C.达平衡后若增大压强,A的转化率降低,平衡常数增大
D.达平衡后若升高温度,C的浓度将增大 uog11881年前1
uog11881年前1 -
 babyface908 共回答了18个问题
babyface908 共回答了18个问题 |采纳率83.3%解题思路:A、当同一物质的正逆反应速率相等时,该反应达到平衡状态;
B、先计算C的反应速率,再根据同一化学反应中同一时间段内各物质的反应速率之比等于计量数之比计算B的反应速率;
C、增大压强平衡向气体体积减小的方向移动,从而确定A的转化率变化,平衡常数随温度变化;
D、升高温度平衡向吸热方向移动,从而确定C的浓度变化.A、反应过程中,当A、B、C的物质的量浓度之比为 2:1:2时,反应不一定达到平衡状态,这与反应物的浓度及其转化率有关,故A错误;
B、C的浓度为0.6mol•L-1,则C的反应速率=[0.6mol/L/4s]=0.15mol/L.s,同一化学反应中同一时间段内,各物质的反应速率之比等于其计量数之比,所以B的反应速率是0.075 mol•L-1•S-1,故B正确;
C、该反应是一个反应前后气体体积减小的化学反应,增大压强平衡向正反应方向移动,导致A的转化率增大,平衡常数不变,故C错误;
D、该反应是一个正反应是放热的反应,升高温度平衡向逆反应方向移动,所以C的浓度将减小,故D错误;
故选B.点评:
本题考点: 化学平衡的影响因素.
考点点评: 本题考查了化学平衡状态的判断及外界条件对化学平衡的影响,难度不大,注意反应达到平衡状态时,正逆反应速率相等但不等于0,平衡常数随温度变化.1年前查看全部
- 将4mol A气体和2mol B气体在2L的密闭容器中混合,并在一定条件下发生如下反应:2A(g)+
将4mol A气体和2mol B气体在2L的密闭容器中混合,并在一定条件下发生如下反应:2A(g)+B(g)⇌2C(g),反应2s后测得C的浓度为0.6mol/L.下列说法正确的是( )
A.用物质A表示2 s内的平均反应速率为0.3 mol/(L•s)
B.用物质B表示2 s内的平均反应速率为0.6 mol/(L•s)
C.2 s后物质A的转化率为70%
D.2 s后物质B的浓度为0.35 mol/L 小小文竹花1年前1
小小文竹花1年前1 -
 obcic6l 共回答了22个问题
obcic6l 共回答了22个问题 |采纳率100%解题思路:反应2s后测得C的浓度为0.6mol/L,物质的量=0.6mol/L×2L=1.2mol;
2A(g)+B(g)⇌2C(g)
起始量(mol) 4 2 0
变化量(mol)1.20.61.2
2s末量(mol)2.81.41.2
根据概念计算选项中的速率、转化率和浓度.反应2s后测得C的浓度为0.6mol/L,物质的量=0.6mol/L×2L=1.2mol;
2A(g)+B(g)⇌2C(g)
起始量(mol) 4 2 0
变化量(mol)1.20.61.2
2s末量(mol)2.81.41.2
A、用物质A表示2 s内的平均反应速率=
1.2mol
2L
2s=0.3 mol/(L•s),故A正确;
B、用物质B表示2 s内的平均反应速率=
0.6mol
2L
2s=0.15 mol/(L•s)故B错误;
C、2 s后物质A的转化率=[1.2mol/4mol]×100%=30%,故C错误;
D、2 s后物质B的浓度=[1.4mol/2L]=0.7mol/L,故D错误;
故选A.点评:
本题考点: 化学平衡建立的过程.
考点点评: 本题考查化学反应的基本计算,理解反应速率、转化率、浓度概念和计算应用是关键,题目较简单.1年前查看全部
- 将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应2A(气)+B(气)
将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应2A(气)+B(气)⇌2C(气),若经2秒后测得C的浓度为0.6mol•L-1,现有下列几种说法:
①用物质A表示反应的平均速率为0.3mol•L-1•s-1
②用物质B表示的反应的平均速率为0.6mol•L-1•s-1
③2s时物质A的转化率为30%
④2s时物质B的浓度为1.4mol•L-1,其中正确的是( )
A.①④
B.①③
C.②③
D.③④ 绿茶香香1年前1
绿茶香香1年前1 -
 卿狂为我 共回答了8个问题
卿狂为我 共回答了8个问题 |采纳率87.5%解题思路:①根据v=[△c/△t]计算v(C),再根据速率之比等于化学计量数之比计算v(A);
②根据v=[△c/△t]计算v(C),再根据速率之比等于化学计量数之比计算v(B);
③根据浓度变化量之比等于化学计量数之比计算△n(A),进而计算△n(A),根据转化率定义计算;
④根据浓度变化量之比等于化学计量数之比计算△c(B),2s时物质B的浓度=B的起始浓度-△c(B).①v(C)=[0.6mol/L/2s]=0.3mol•L-1•s-1,速率之比等于化学计量数之比,故v(A)=v(C)=0.3mol•L-1•s-1,故①正确;
②v(C)=[0.6mol/L/2s]=0.3mol•L-1•s-1,速率之比等于化学计量数之比,故v(B)=[1/2]v(C)=[1/2]×0.3mol•L-1•s-1=0.15mol•L-1•s-1,故②错误;
③根据方程式可知,△c(A)=△n(C)=0.6mol•L-1,故△n(A)=0.6mol•L-1×2L=1.2mol,故A的转化率=[1.2mol/4mol]×100%=30%,故③正确;
④根据浓度变化量之比等于化学计量数之比计算△c(B)=[1/2]△c(A)=[1/2]×0.6mol•L-1=0.3mol•L-1,2s时物质B的浓度=[2mol/2L]-0.3mol•L-1=0.7mol•L-1,故④错误;
故选B.点评:
本题考点: 化学平衡建立的过程;化学反应速率和化学计量数的关系.
考点点评: 本题考查化学反应速率及化学平衡的有关计算,比较基础,注意对基础知识的理解掌握.1年前查看全部
大家在问
- 1谁知道这题怎么写.x大于4.化简2减去2减x的绝对值.的绝对值
- 2秀丽的 宁静的 灿烂的 活泼的 温暖的 春意 杏花 景色 小站 喷泉(搭配)
- 3下列各项中,不属于种子萌发所需要的外界条件是 A.阳光 B.空气 C.水分 D.适宜的温度
- 4分析如何操作才可利用生长素获得无子果实.
- 5曾经听到过这么一种说法,说高中的化学里面有很多错误的说法,到底是哪些地方不完善,我都上了快一年半的大学了一直没弄清楚高中
- 6旱田地皆枯杭,谢天甘露落淋淋,花果草木皆润泽,始知一两值千金.
- 7Father__(mean)to call on a close friend,but he was very busy
- 8When &
- 9把下列词语补充完整 春光() 春花() 春意() 春风() 春雨()
- 10如图,A、B两个相同的薄壁方底柱形容器放在水平地面上,容器质量为1千克,高为0.2米,底面积为2X10的﹣2方平方米.两
- 11choose a city you like about the weather with your partner.
- 12英语翻译Metal face treatment Metal and sorption lead chromium ba
- 13红气球是气球总数的5/6中,把什么看做单位1,平均分成几份,红气球是这样的几分?
- 14英语翻译今天我算睡的不太晚了,起床的时候是9点30分.今天要去二表哥家帮忙,因为大表哥要出国了,所以我们为他践行.二表哥
- 15不可谓仁的仁是什么意思