求混合烃的组成由两种气态烃组成的混合气体20mL,跟过量氧气混合后进行完全燃烧.当燃烧后的产物通过弄H2SO4后体积减少
 胖胖的阿宝2022-10-04 11:39:545条回答
胖胖的阿宝2022-10-04 11:39:545条回答由两种气态烃组成的混合气体20mL,跟过量氧气混合后进行完全燃烧.当燃烧后的产物通过弄H2SO4后体积减少了30mL,再将气体通过碱石灰后体积又减少40mL(每步试验中气体都能被充分吸收,气体体积在相同条件下测得).则这两种烃为:
A.CH4与C2H4
B.C2H2与C2H4
C.C2H2与C2H6
D.CH4与C2H6

已提交,审核后显示!提交回复
共5条回复
 jiaxuansummer 共回答了20个问题
jiaxuansummer 共回答了20个问题 |采纳率80%- 混合烃与氧气反应生成水和二氧化碳,水被硫酸吸收,二氧化碳被碱石灰吸收,所生成的水(气态)与二氧化碳的体积比为3:4(已知),则氢元素与碳元素的比例为6:4,所以答案为B.
- 1年前
 眼睛里的背叛 共回答了8个问题
眼睛里的背叛 共回答了8个问题 |采纳率- 选A:甲烷和乙烯
- 1年前
 篮一 共回答了13个问题
篮一 共回答了13个问题 |采纳率- BC是正确的
- 1年前
 csbush 共回答了6个问题
csbush 共回答了6个问题 |采纳率- 选B.二氧化碳四十毫升,水为三十,得碳氢及气体比为二比三比一,即平均组分为碳二氢三,选b气体一比一混合
- 1年前
 别拿苍蝇不当肉 共回答了99个问题
别拿苍蝇不当肉 共回答了99个问题 |采纳率- 平均C2H3
选BC - 1年前
相关推荐
- 通常状况下,由两种气态烃组成的混合物完全燃烧后,燃烧产物与混合烃的物质的量的变化关系如图所示,下列关于混合烃组成的判断正
 通常状况下,由两种气态烃组成的混合物完全燃烧后,燃烧产物与混合烃的物质的量的变化关系如图所示,下列关于混合烃组成的判断正确的是( )
通常状况下,由两种气态烃组成的混合物完全燃烧后,燃烧产物与混合烃的物质的量的变化关系如图所示,下列关于混合烃组成的判断正确的是( )
A.一定有甲烷
B.一定有乙烯
C.一定有丙烷
D.一定有丙炔 tjnk2112051年前1
tjnk2112051年前1 -
 xujie314 共回答了18个问题
xujie314 共回答了18个问题 |采纳率83.3%解题思路:由图象可以看出,1mol混合烃完全燃烧生成的CO21.5mol,肯定含有小于1.5个C原子的烃,则一定含有甲烷.根据图象判断,1mol混合烃完全燃烧生成的CO21.5mol,2molH2O,则平均分子式为C1.5H4,在分子中,肯定有1.5个C原子的烃,则一定含有甲烷,并且另一种含有的H原子数为4,
故选A.点评:
本题考点: 有机物的推断.
考点点评: 本题考查有机物的推断,题目难度不大,解答本题的关键是根据图象判断混合物的平均分子式,注意体会.1年前查看全部
- 在120℃时,某混合烃和过量氧气在一密闭容器中完全反应,测知反应前后压强不变.则该混合烃可能是:
在120℃时,某混合烃和过量氧气在一密闭容器中完全反应,测知反应前后压强不变.则该混合烃可能是:
A:CH4和C2H4 B.CH4和CAH6 C.C2H4和C2H6 D.C3H4和C3H6
甲烷(CH4)和铵根(NH4+)所含电子数为什么相等?.到底是怎么算的?.. carlzhoujian1年前1
carlzhoujian1年前1 -
 等待的鱼 共回答了16个问题
等待的鱼 共回答了16个问题 |采纳率75%在120℃时,H2O是气态,测知反应前后的压强没有变化,压强比等于分子数之比,既是说反应前和反应后,分子的总数不变,根据方程式CxHy+(x+y/4)O2===xCO2+y/2H2O(g)应该是x+y/2===x+y/4.解得y=4
就是说凡是H的数是4的气态烃在120度燃烧前后的压强没有变化
甲烷(CH4) 所含电子数:6+1*4=10
铵根(NH4+)所含电子数:7+1*4-1=101年前查看全部
- 两种气态烃以一定比例混合,在105℃时,1升该混合烃与9升O2混合,充分燃烧后恢复到原状态,所得气体的体积为11L,设混
两种气态烃以一定比例混合,在105℃时,1升该混合烃与9升O2混合,充分燃烧后恢复到原状态,所得气体的体积为11L,设混合烃为CxHy,怎样确定x,
 xingbangsho1年前1
xingbangsho1年前1 -
 ifyoudie 共回答了18个问题
ifyoudie 共回答了18个问题 |采纳率83.3%CxHy+(x+y/2)O2==xCO2+y/2H20
1L x+y/4L xL y/2L
9-(x+y/4)+x+y/2=11
y=8
x可以是3或4或51年前查看全部
- 1.两种气态烃以任意比例混合,在150度时1L该混合烃与9L氧气混合,充分燃烧后恢复到原来状态,所得气体体积仍是10L,
1.两种气态烃以任意比例混合,在150度时1L该混合烃与9L氧气混合,充分燃烧后恢复到原来状态,所得气体体积仍是10L,下列各组混合烃中不符合此条件的是( )
A.CH4 C2H4 B CH4 C3H6 C C2H4 C3H4 D CH4 C3H4
2,在光照条件下,将1mol CH4与CL2反应,得到等物质的量的4种取代物,则耗CL2物质的量为()
A,1mol B ,2mol C,2.5mol D,10mol
3,下列各组化合物中,不论两者以什么比例混合,只要总质量一定,则完全燃烧时消耗O2的质量和生成水的质量或CO2质量不变的是( )
A CH4 C2H6 B C2H6 C3H6 C C2H4 C3H6 D C2H4 C3H4
4 下列事实可以说明甲烷分子具有正四面体结构的是()
A CH4没有同分异构体
B CH3CL没有同分异构体
C CH2CL2没有同分异构体
D CCL4没有同分异构体
5,某有机物在氧气中充分燃烧生成二氧化碳和水的物质的量之比为1比1,由此可得出的结论是()
A该有机物分子中C H O 原子个数比为1比2比3
B分子中C ,H原子个数分别为1和2
C该有机物中必定含有氧元素
D无法判断该有机物中是否含有氧元素
6,乙烯和溴气加成反应,生成""1,2-二溴乙烷",这个是怎么命名?要怎么根据这个,写出结构图来?
写出具体分析和过程,以后碰到这类题目,还有思路 leijunleon1年前4
leijunleon1年前4 -
 能干666 共回答了14个问题
能干666 共回答了14个问题 |采纳率100%楼主好!
第一题,楼主只需牢记一个规律~
看:
CH4+2O2==点燃==CO2+2H2O,左右系数加起来是3:3
C2H4+3O2==点燃==2CO2+2H2O,左右系数加起来是4:4
C3H4+4O2==点燃==3CO2+2H2O,左右系数加起来是5:5
事实上,所有H数量是4的烃都能适用这个规律.所以答案是B啦~(C3H6)
第二题:这里涉及好几个方程式.
CH4+Cl2==光照==CH3Cl(第一种)+HCl
CH4+2Cl2==光照==CH2Cl2(第二种)+2HCl
CH4+3Cl2==光照==CHCl3(第三种)+3HCl
CH4+4Cl2==光照==CCl4(第四种)+4HCl
这儿,为了使生成物都相同,每个反应的CH4就必须相同,都是0.25mol.
第一个用0.25mol氯气,第二个0.5,第三个0.75,第四个1mol,所以总共是2.5mol.
答案选C啦.
第三题:
这道题适用最简分子式.
意思就是把这个分子当作一个分数,能约分的都约分,成为一个最简单无法约分的东西.
如:A中C2H6约成CH3
B中C3H6约成CH2
C中两个都可以约成CH2
D中一个CH2一个没法约,就是C3H4
然后题目要求不管怎么变,烧出来的东西必须一样,那么意思就是C和H所占比例必须一样,所以利用最简分子式去判断,易得选C咯.
第四题:
A没法说明甲烷有四面体结构,因为只有一种构造的物质有很多,但是都不是.
B也没法说明.设想一下:
H
H——C——H
H
(上下都有化学键相连)
把一个H换成Cl~
Cl
H——C——H
H
H
H——C——Cl
H
这两种,你可以转一下就发现其实是相同的,而这个假设建立在它是平面构型的基础上,所以平面构型也可以支持没有同分异构体的一氯取代物.
C中,这个是关键~
如果平面构型,Cl可以位于上下位或上左位,你是无法把它转的相同的,但是立体构型,在每个顶点上的氢换成Cl,那么可以转成相同的了.所以,C的二氯取代物可以说明甲烷的正四面体结构.
D同A的分析,只不过把H换成Cl了嘛.
所以选C~
第五题,它燃烧生成CO2和H2O是1:1
我们仍然用最简化学式,假设CO2就是1,H2O也就是1
那么它可能是CH2Ox(x是氧的系数,不确定,但是因为有氧气参加燃烧,所以x肯定小于3,因为CO2和H2O里也就3个O)
那么A由于括号里的分析可以被排除~
B的话,这儿是用最简化学式表示的,它可能是C2H4,C3H6,C4H8等等,不一定是C1,H2.
C的话,举个反例,C2H4就可以了.
D正确,原因有下:
1,别的都被排除了(拍死~)
2,可以举出两种情况的例子:
C2H4和 CH2O就是.
所以选D啦~
第六题~我想你学过系统命名法(没有的话可以去预习,或者Hi我),它的意思就是一个正常乙烷的1号碳和2号碳上各有1个氢(共有2个)被溴取代了~画图如下:
Br Br
H C——C H
H H
每个原子之间都有单键相连~
那么答案就是这样啦~B,C,C,C,D,最后一道看上面吧~
楼主加油!1年前查看全部
- 25℃和101kPa时,甲烷、乙烷和乙烯组成的混合烃4mL,与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强
25℃和101kPa时,甲烷、乙烷和乙烯组成的混合烃4mL,与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了9mL,原混合烃中乙烯的体积分数为( )
A.12.5%
B.25%
C.50%
D.75% yoyohsu1年前1
yoyohsu1年前1 -
 长空飞鸿 共回答了15个问题
长空飞鸿 共回答了15个问题 |采纳率93.3%解题思路:根据有机物燃烧的化学反应方程式,分析反应前后气体体积的变化,利用气体体积缩小了9mL及混合气体的体积来列等式计算出乙烯的体积,最后计算乙烯的体积分数.CH4+2O2=CO2+2H2O△V
1 21 2
C2H6+[7/2]O2=2CO2+3H2O△V
1 [7/2] 2 2.5
C2H4+3O2=2CO2+H2O△V
1 3 2 2
则CH4和C2H4反应后体积缩小的量是相同的,故可将两者看成是一种物质即可,
设CH4和C2H4一共为xmL,C2H6为ymL,
则
x+y=4
2x+2.5y=9,
解之得x=2,y=2,
则原混合烃中乙烯的体积应小于2mL,则体积分数小于[2/4]×100%=50%,则A、B符合.
故选AB.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查混合物计算、根据方程式进行的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,难度不大,注意差量法运用简化计算过程.1年前查看全部
- 150℃时取1升混合烃与足量的9升O2混合,在容积固定的容器中充分燃烧,当恢复到150℃时,容器内压强增大8%,则混合烃
150℃时取1升混合烃与足量的9升O2混合,在容积固定的容器中充分燃烧,当恢复到150℃时,容器内压强增大8%,则混合烃可能的组成为( )
A. 甲烷和乙烯
B. 丙炔和乙炔
C. 丁烯和丁烷
D. 乙烯和丁烯 carlzhoujian1年前1
carlzhoujian1年前1 -
 chjwxhwxl 共回答了17个问题
chjwxhwxl 共回答了17个问题 |采纳率94.1%解题思路:假设混合烃的分子式是CxHy,其燃烧的方程式是:CxHy+(x+[y/4])O2
xCO2+[y/2]H2O.在150℃时水是气态.因此根据方程式可知1L的混合烃完全燃烧,气体体积增加了([y/4]-1)L.根据题意可得[y/4]-1=(1+9)×8%.解得y=7.2,H原子数平均为7.2个,则一种烃分子中的H原子数小于8,另一种大于8,对各个选项逐一排查解答.点燃 .假设混合烃的分子式是CxHy,在150℃时水是气态,则:
CxHy+(x+[y/4])O2
点燃
.
xCO2+[y/2]H2O 气体体积增大
1L(x+[y/4])LxL[y/2]L([y/4]-1)L
根据题意可得:[y/4]-1=(1+9)×8%,解得y=7.2,H原子数平均为7.2个,则一种烃分子中的H原子数小于7.2,另一种大于7.2,
A.甲烷和乙烯中H原子数目分别为4、4,不符合题意,故A错误;
B.丙炔和乙炔中H原子数目分别为4、2,不符合题意,故B错误;
C.丁烯和丁烷中H原子数目分别为8、10,不符合题意,故C错误;
D.乙烯和丁烯中H原子数目分别为4、8,符合题意,故D正确,
故选D.点评:
本题考点: 有关有机物分子式确定的计算.
考点点评: 本题考查有机物燃烧规律的知识,注意利用平均分子式,结合燃烧通式进行解答,难度不大.1年前查看全部
- 某烃A和B混合气体对H2相对密度为11.8取标况下该混合烃5.6L,通入足量溴水,溴水增重2.7g,问A、B可能的结
 tanyanan1年前1
tanyanan1年前1 -
 bird44005 共回答了12个问题
bird44005 共回答了12个问题 |采纳率66.7%某烃A和B混合气体对H2相对密度为11.8
则平均式量=2*11.8=23.6
取标况下该混合烃5.6L(物质的量=5.6L / 22.74L/mol = 0.25mol)
0.25mol混合烃质量=0.25mol * 23.6g/mol = 5.9g
溴水增重2.7g,增重质量为烯烃或者炔烃质量,说明混合烃中有烯烃或炔烃.
则烷烃的质量=5.9g - 2.7g = 3.2g
式量小于23.6的只有烷烃中的甲烷(CH4)是16,所以可以肯定含有甲烷
3.2g 甲烷物质的量=3.2g / 16g/mol = 0.2mol
则剩余不饱和烃物质的量=0.25mol - 0.2mol = 0.05mol
式量大于23.6的气态烯烃和炔烃有:
乙烯C2H4,式量28
乙炔C2H2,式量26
丙烯C3H6,式量42
丙炔C3H4,式量40
丁烯C4H8,式量56
丁炔C4H6,式量54
假设该不饱和烃为乙烯,则2.7g乙烯物质的量=2.7g / 28g/mol = 0.096 mol
不合题意,舍去
经过计算,只有丁炔符合
假设该不饱和烃为丁炔,则2.7g丁炔物质的量=2.7g / 54g/mol = 0.05 mol
符合题意
所以混合烃为甲烷0.2mol,丁炔0.05mol
甲烷CH4(无同分异构体)
丁炔C4H6(有同分异构体)
CH≡C-CH2-CH3(1-丁炔)
CH3-C≡C-CH3(2-丁炔)
CH2=CH-CH=CH2(1,3-丁二烯)1年前查看全部
- 两种气态烃组成的混合气体,完全燃烧后得到CO2和H2O的物质的量随着混合烃物质的量的变化,如图所示,则下列对混合烃的判断
两种气态烃组成的混合气体,完全燃烧后得到CO2和H2O的物质的量随着混合烃物质的量的变化,如图所示,则下列对混合烃的判断正确的是①一定有C2H4 ②一定有CH4③一定有C3H8 ④一定没有C2H6 ⑤可能有C2H2 ⑥可能有C2H4
A ②⑤⑥ B ②④ C ②④⑥ D ②③
答案为C
为什么?要有过程图
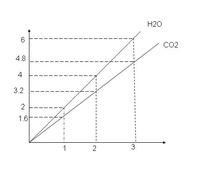
 谁说的非爱不可1年前2
谁说的非爱不可1年前2 -
 圣皇临飞轩 共回答了20个问题
圣皇临飞轩 共回答了20个问题 |采纳率80%观察法的话,就是由图得,混合气体的平均分子式为C1.6H4
所以,混合的两种气体应该为CH4和C2H4,混合比为2:3.或者CH4和C3H4,混合比为7:3.等等……
原理的话,最简单的思路就是由数论的方法列如下方程组并讨论.
假设两种烃分别为CaHb和CcHd,摩尔百分比分别为x和1-x.(01等式可以成立.如果c>1,则a=1即可保证等式可以成立.
当d=6时,可知b-d6时,(b-d)x=4-d,由于4-d1年前查看全部
- 化28.在120℃时,某混合烃和过量O2在一密闭容器中完全反应,测知反应前后的压强没有变化,则该混合烃可
 songren1年前3
songren1年前3 -
 xzrain 共回答了21个问题
xzrain 共回答了21个问题 |采纳率90.5%设该烃为CxHy
CxHy+(x+y/4)O2=xCO2+y/2H2O
因为前後压强不变说明分子数不变,有
1+x+y/4=x+y/2
解得y=4
因此只要满足通式CxH4的都可以
所以A正确
B中由於C2H6+C2H2可以看成2C2H4,因此也符合题意,B也正确.
CD都错误.1年前查看全部
- 两种气态烃以任意比例混合,在105℃时,1L该混合烃与9L氧气混合,充分燃烧后恢复到原来状态,所得气体体积仍是10L.下
两种气态烃以任意比例混合,在105℃时,1L该混合烃与9L氧气混合,充分燃烧后恢复到原来状态,所得气体体积仍是10L.下面各组混合烃中不符合此条件的是( )
①CH4 C2H4 ②CH4 C3H6 ③C2H4 C3H4 ④C2H2 C3H6.
A.①③
B.②
C.②④
D.①④ 网络hh11年前1
网络hh11年前1 -
 如梦_似幻 共回答了12个问题
如梦_似幻 共回答了12个问题 |采纳率83.3%解题思路:令两种气态烃的平均分子组成为CxHy,烃燃烧前后体积不变,所以反应前后气体的化学计量数和相等,据此判断.注意105℃时水是气体.设有机物的平均式为CxHy,则有:CxHy+(x+[y/4])O2→xCO2+[y/2]H2O(g),燃烧前后体积不变,则
1+(x+[y/4])=x+[y/2],解得y=4.
即混合气中平均含有H原子数为4,
①CH4、C2H4中H原子数都为4,以任意比混合,H原子数平均值为4,符合题意,故①不选;
②CH4、C3H6中H原子数分别为4、6,H原子数平均值为介于4~6之间,故②选;
③C2H4、C3H4中H原子数都为4,以任意比混合,H原子数平均值为4,符合题意,故③不选;
④C2H2、C3H6H原子数分别为2、6,只有1:1混合才能使平均值为4,不符合以任意比例混合的要求,故④选.
故②④不符合题意.
故选C.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查烃混合物分子式确定,难度较大,注意利用平均分子组成判断烃的组成,常用方法有1、平均碳法 2、平均氢法 3、平均碳氢分子式法 4、平均式量法.1年前查看全部
- 混合烃中的n,平均分子式,相对分子质量,体积与原来相比有什么关系.怎么求
 c0080061年前1
c0080061年前1 -
 2musou2 共回答了28个问题
2musou2 共回答了28个问题 |采纳率82.1%烷烃的为CnH2n+2
烯烃得为CnH2n
炔烃得为CnH2n-2
根据题目可知其是什么烃类的有机化合物,然后根据原子质量联立方程,就可以求出n1年前查看全部
- 等物质的量的下列烃中的3种烃的混合物在室温和常压下的体积为2L,完全燃烧该混合烃需相同条件下的氧气11L,则该混合烃中不
等物质的量的下列烃中的3种烃的混合物在室温和常压下的体积为2L,完全燃烧该混合烃需相同条件下的氧气11L,则该混合烃中不可能含有( )
A、CH3CH3
B、CH3CH2CH3
C、CH3CH2CH2CH3
D、CH3CH(CH3)2 新韵清听1年前3
新韵清听1年前3 -
 最爱烟雨楼 共回答了11个问题
最爱烟雨楼 共回答了11个问题 |采纳率100%有机物中每molH完全然烧消耗氧气0.25mol,每molC完全然烧消耗氧气1mol
1molCH3CH3完全燃烧消耗氧气3.5mol
1molCH3CH2CH3完全燃烧消耗氧气5mol
1molCH3CH2CH2CH3完全燃烧消耗氧气6.5mol
1molCH3CH(CH3)2完全燃烧消耗氧气6.5mol
完全燃烧2L混合烃需相同条件下的氧气11L
即混合烃与氧气11L的比例是1:5.5
CH3CH2CH3与其他任意两种烃等物质的量混合,均无法达到1:5.5的比例
故选B1年前查看全部
- 两种气态烃以任意比例混合,在105℃时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得到气体体积是11L.下列各
两种气态烃以任意比例混合,在105℃时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得到气体体积是11L.下列各组混合烃符合此条件的是( )
A.C4H10、C3H6
B.C4H8、C3H8
C.C4H10、C2H4
D.CH4、C3H8 dajiahao021年前1
dajiahao021年前1 -
 livesconten 共回答了19个问题
livesconten 共回答了19个问题 |采纳率100%解题思路:设平均分子组成为CxHy,则CxHy+(x+[y/4])O2→xCO2+[y/2]H2O,因为105℃时,生成的H2O是气体,因反应后气体的体积增大了1L,利用差量法计算出混合气态烃中氢原子数目,然后根据“两种气态烃以任意比例混合”及计算结果进行判断即可.设混合烃的平均分子式为CxHy,混合烃燃烧后气体体积增大了:11L-1L-9L=1L,
烃燃烧的方程式为:CxHy+(x+[y/4])O2→xCO2+[y/2]H2O△V
1 x+[y/4]x[y/2][y/4]-1
1L1L,
即:[y/4]-1=1,y=8,
由于两种气态烃以任意比例混合,氢原子数都是8,
则两种烃分子中H原子数只能都是8,
故选B.点评:
本题考点: 有关有机物分子式确定的计算.
考点点评: 本题考查了有机物分子式的确定,题目难度中等,注意掌握有机物燃烧的方程式,明确差量法在确定有机物分子组成中的应用方法,注意题干中信息“两种气态烃以任意比例混合”的含义.1年前查看全部
- 25℃和101kPa时,乙烷、乙炔和丙烯组成的混合烃4L与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气
25℃和101kPa时,乙烷、乙炔和丙烯组成的混合烃4L与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了9L,原混合烃中乙烷、乙炔和丙烯的体积比不可能为( )
A.1:1:1
B.2:1:1
C.3:2:3
D.5:3:4 eks5wt1年前1
eks5wt1年前1 -
 还是喜欢阳光点 共回答了15个问题
还是喜欢阳光点 共回答了15个问题 |采纳率80%解题思路:发生反应分别为:C2H6+[7/2]O2=2CO2+3H2O,C2H2+[5/2]O2=2CO2+H2O,C3H6+[9/2]O2=3CO2+3H2O,除去水蒸气,恢复到原来的温度和压强,根据反应方程式可知,相同体积的C2H6和C3H6反应后体积减小的量是相同的,故可将两者看成是一种物质,设C2H6和C3H6一共为xmL,则C2H2为(4-x)mL,利用气体体积缩小了9mL列等式计算,进而计算C2H6和C3H6总体积与C2H2体积比例关系,而C2H6、C3H6二者为任意比.除去水蒸气,恢复到原来的温度和压强,则:
C2H6+[7/2]O2=2CO2+3H2O△V
1 3.5 22.5
C2H2+[5/2]O2=2CO2+H2O△V
1 2.5 2 1.5
C3H6+[9/2]O2=3CO2+3H2O△V
1 4.5 32.5
相同体积的C2H6和C3H6反应后体积减小的量是相同的,故可将两者看成是一种物质,设C2H6和C3H6一共为xmL,则C2H2为(4-x)mL,则:2.5x+1.5(4-x)=9,解得x=3,
故V(C2H6和C3H6):V(C2H2)=3mL:(4-3)mL=3:1,而C2H6、C3H6二者为任意比,
故选A.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查混合物计算、化学方程式有关计算,关键是根据方程式判断体积变化,把C2H6和C3H6看作一个组分,从而转化为两组分混合,注意差量法的应用,难度中等.1年前查看全部
- 两种气态烃以一定比例混合,在105℃是1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积是11L.下列各组
两种气态烃以一定比例混合,在105℃是1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积是11L.下列各组混合烃中不可能符合此条件的是( )
A.C4H10 C3H6 B.C4H8 C3H8 C.C4H10 C2H4 D.CH4 C3H8
我是先给混合烃设了个平均分子式CxHy 然后求出了y=8,x≤7 在然后就卡住了,通过y=8,x≤7怎么判断哪一组符合条件阿?还有个问题,题目中说燃烧后恢复到原状态是想说明什么? 一级用户321年前6
一级用户321年前6 -
 天天不做梦 共回答了22个问题
天天不做梦 共回答了22个问题 |采纳率90.9%原状态 为 105 度时,是指 水是气态,占有体积很多时.
你已经 算出 Y =8 对吧 ,也就是混合烃的 平均分子式 里面含有 8 个氢原子,这是肯定的 .看选项,D CH4 C3H8 很明显,真两种物质混合 的平均分子式 中 ,H 原子 个数 可定 大于四 小于 8 不能等于八.相当于 C3H8 里面 有 甲烷杂质
故 D 可定不对 .
如果 要 计算 X 等于几 ,貌似的 分 氧气完全燃烧 和 混合气体 完全燃烧.没往下做,这句说的不一定对 .
不明白 HI我 一直在1年前查看全部
- 120℃时,某混合烃和过量O2在一密闭容器中完全反应,测知反应前后的压强没有变化,则该混合烃可能是( )
120℃时,某混合烃和过量O2在一密闭容器中完全反应,测知反应前后的压强没有变化,则该混合烃可能是( )
A.CH4和CH2=CH2
B.CH≡CH和CH2=CH2
C.CH2=CH2和C2H6
D.CH≡CCH3和CH2=CHCH3 winny_lee1年前1
winny_lee1年前1 -
 冷血判oo-狂风 共回答了20个问题
冷血判oo-狂风 共回答了20个问题 |采纳率100%解题思路:设该烃的化学式为CxHy,反应前后的压强不变,则气体的物质的量不变,结合反应的化学方程式判断.设烃的分子式为CxHy,120℃条件下水为气体,该烃燃烧的通式为:CxHy+[4x+y/4]O2
点燃
xCO2+[y/2]H2O(g),
由于反应前后压强不变,可得:1+[4x+y/4]=x+[y/2],
解得y=4,从而推知,只要两种烃中满足CxH4,即氢原子平均能够等于4,
A、甲烷与乙烯分子中氢原子都是4,满足CxH4,故A正确;
B、乙炔含有2个氢原子,乙烯含有4个氢原子,不能够满足氢原子平均为4,故B错误;
C、乙烯含有4个氢原子,乙烷含有6个氢原子,不能够满足氢原子平均是4,故C错误;
D、丙炔含有4个氢原子,丙烯含有6个氢原子,氢原子平均一定大于4,故D错误;
故选A.点评:
本题考点: 有关有机物分子式确定的计算.
考点点评: 本题考查有机物分子式的确定,题目难度不大,注意从有机物燃烧的方程式结合体积的变化进行解答.1年前查看全部
- 两种气态烃以一定比例混合,在105度时,1L该混合烃与9L氧气混合,充分燃烧后恢复到原来的状态,所得气体的体积为11L,
两种气态烃以一定比例混合,在105度时,1L该混合烃与9L氧气混合,充分燃烧后恢复到原来的状态,所得气体的体积为11L,下列各组混合烃中不符合此条件的是( )A.C3H6.C4H10 B.C3H8.C4H8 C.C2H4.C4H10 D.CH4.C3H8 答案是说求混合烃的平均氢原子数为8--这我也不会,
 shanehua1年前1
shanehua1年前1 -
 清风舞烟柳 共回答了19个问题
清风舞烟柳 共回答了19个问题 |采纳率89.5%设该烃的分子式为CxHy,那么燃烧的化学式为CxHy + (2x+y/2)/2 O2=x CO2 + y/2 H2O ,因为是充分燃烧所以得烃氧比为1:(2x+y/2)/2=1:9 ;温度为105度那么燃烧后的水为气态,则,1:(x+y/2)=1 :11 (其中的1为烃的量,x+y为后面生成的CO2和H2O的量),两式合二为一,解得x=7,y=8.也就是两个气态烃的平均氢原子数为8 .1年前查看全部
- 为什么:两混合气态烃,充分燃烧后,生成CO2气体的体积小于2倍原混合烃的体积,则原混合烃中必含CH4.若生成水的物质的量
为什么:两混合气态烃,充分燃烧后,生成CO2气体的体积小于2倍原混合烃的体积,则原混合烃中必含CH4.若生成水的物质的量小于2倍原混合烃的物质的量,则必含C2H2.
 lovecc19839221年前3
lovecc19839221年前3 -
 ahsdzl 共回答了19个问题
ahsdzl 共回答了19个问题 |采纳率84.2%因为所有气态烃中只有甲烷与氧气反应生成的二氧化碳的体积小于2倍原烃的体积,其他的或等于或大于, 同理所有气态烃中只有C2H2与氧气反应生成的水的物质的量小于2倍原烃的物质的量.1年前查看全部
- 高中化学某混合烃和过量O2在120度时,某混合烃和过量O2在一密闭容器中完全反应,测知反应前后的压强没有变化,则混合烃可
高中化学某混合烃和过量O2
在120度时,某混合烃和过量O2在一密闭容器中完全反应,
测知反应前后的压强没有变化,则混合烃可能()
A,CH4和C2H4
B,C2H2和C2H6
C,C2H4和C2H6
D,C3H4和C3H6
最好解析 jia3251年前1
jia3251年前1 -
 坏坏惹人嗳 共回答了16个问题
坏坏惹人嗳 共回答了16个问题 |采纳率87.5%CxHy + (x+y/4)O2 == xCO2 + (y/2)H2O
因为是在120℃,所以生成的水是气态.由题意反应前后的压强没有变化,即反应前后气体体积相等.所以1+x+y/4=x+y/2,解得4.所以混合烃的平均含氢数是4.选A1年前查看全部
- 150℃时,将1L两种气态烃的混合物与8LO2混合后,点燃充分反应,恢复至150℃,密闭容器中压强增大了8%,则原混合烃
150℃时,将1L两种气态烃的混合物与8LO2混合后,点燃充分反应,恢复至150℃,密闭容器中压强增大了8%,则原混合烃可能是( )
A.甲烷、丙烯 B.乙烷、丙烯 C.乙炔、丙炔 D.乙烯、丁烯 心涌动1年前1
心涌动1年前1 -
 迷糊喵咪 共回答了20个问题
迷糊喵咪 共回答了20个问题 |采纳率80%像这类题,设混合烃的组成是CXHY.压强增大8%,说明物质的量增大8%,因为原物质的量是9,说明增大了0.72
CXHY+(X+0.25Y)O2-------XCO2+0.5YH2O 增大
1 X+0.25Y X 0.5Y 0.25Y-1
固有0.25Y-1=0.72
Y =3.28,说明混合烃的含H是3.28.故一个中含H>3.28 一个H1年前查看全部
- 两种气态烃的混合气1L,完全燃烧后,生成2LCO2和2L水蒸气(相同状况),则该混合烃的组合及其体积比是( )
两种气态烃的混合气1L,完全燃烧后,生成2LCO2和2L水蒸气(相同状况),则该混合烃的组合及其体积比是( )
A.CH4和C3H6,体积比2:1
B.C3H8和C2H4,体积比2:1
C.C2H6和C2H2,体积比1:1
D.C2H6和C2H2,体积比2:1 hanfengyun1231年前1
hanfengyun1231年前1 -
 ilxx10000 共回答了22个问题
ilxx10000 共回答了22个问题 |采纳率95.5%解题思路:两种气态烃的混合气1L,完全燃烧后,生成2LCO2和2L水蒸气(相同状况),则平均分子式为C2H4,据此判断各选项组成情况,根据组成中C原子或H原子数目计算体积之比,据此解答.两种气态烃的混合气1L,完全燃烧后,生成2LCO2和2L水蒸气(相同状况),则平均分子式为C2H4,
A.若为CH4和C3H6混合,令CH4和C3H6的物质的量分别为x mol、ymol,由C原子平均可知:[x+3y/x+y]=2,解得x:y=1:1,即二者体积之比为1:1,二者1:1混合,平均H原子数目=[4×6/2]=5,平均H原子数目不是4,不符合,故A错误;
B.C3H8和C2H4混合,平均C原子数目介于2~3之间,平均H原子数目介于4~8之间,不符合,故B错误;
C.C2H6和C2H2混合,由平均C原子数目,二者为任意比,令C2H6和C2H2的物质的量分别为x mol、ymol,由H原子平均可知:[6x+2y/x+y]=4,解得x:y=1:1,即二者体积之比为1:1,符合题意,故C正确;
D.由C中分析可知,C2H6和C2H2混合,体积之比为1:1,故D错误,
故选C.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查混合物的计算,题目难度中等,注意利用平均分子式进行解答,常用方法有:1、平均碳法 2、平均氢法 3、平均碳氢分子式法 4、平均式量法.1年前查看全部
- 25℃和101kPa时,乙烷,乙炔和丙烯组成的混合烃8mL与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,
25℃和101kPa时,乙烷,乙炔和丙烯组成的混合烃8mL与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了18mL,原混合烃中乙炔的体积分数为( )
A.12.5%
B.25%
C.50%
D.75% hanxinhan5551年前1
hanxinhan5551年前1 -
 jy_sky 共回答了18个问题
jy_sky 共回答了18个问题 |采纳率94.4%解题思路:发生反应分别为:C2H6+[7/2]O2=2CO2+3H2O、C2H2+[5/2]O2=2CO2+H2O、C3H6+[9/2]O2=3CO2+3H2O,除去水蒸气,恢复到原来的温度和压强,根据反应方程式可知,相同体积的C2H6和C3H6反应后体积缩小的量是相同的,故可将两者看成是一种物质,设C2H6和C3H6一共为xmL,C2H2为ymL,列方程计算,进而计算乙炔的体积分数.除去水蒸气,恢复到原来的温度和压强,水为液态,则:
C2H6+[7/2]O2=2CO2+3H2O△V
1 3.52 2.5
C2H2+[5/2]O2=2CO2+H2O△V
1 2.5 2 1.5
C3H6+[9/2]O2=3CO2+3H2O△V
14.5 32.5
相同体积的C2H6和C3H6反应后体积缩小的量是相同的,故可将两者看成是一种物质,设C2H6和C3H6一共为xmL,C2H2为ymL,则有:
x+y=8
2.5x+1.5y=18
解得x=6 y=2,
混合烃中乙炔的体积分数为[2mL/8mL]×100%=25%,
故选B.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查混合物计算,关键是根据方程式判断体积变化,把C2H6和C3H6看作一个组分,从而转化为两组分混合,注意差量法的应用,难度中等.1年前查看全部
- 为什么:两种混合烃,若其平均相对分子质量小于26,则该烃中必含甲烷
 wodiMJ1年前5
wodiMJ1年前5 -
 QINSHOP 共回答了16个问题
QINSHOP 共回答了16个问题 |采纳率93.8%因为除了甲烷外,质量最小的烃就是乙炔(分子量是26),若小于26,当然有甲烷(分子量16)啦1年前查看全部
- 标准状态下,乙烷,乙炔和丙烯组成的混合烃32ml,原混合烃中乙炔的体积分数
标准状态下,乙烷,乙炔和丙烯组成的混合烃32ml,原混合烃中乙炔的体积分数
0.125
0.25
0.5
0.75
 37305001年前1
37305001年前1 -
 xiaxue8 共回答了16个问题
xiaxue8 共回答了16个问题 |采纳率100%你的题目肯定是缺少条件了.(比如混合物的质量是多少,n总是多少)
若就这题,那当然是任何的体积比都可以.1年前查看全部
- 一道化学烃的燃烧规律题3mol两种气态混合烃完全燃烧得到4.8molCO2和6molH2O.2mol这种混合烃燃烧生成3
一道化学烃的燃烧规律题
3mol两种气态混合烃完全燃烧得到4.8molCO2和6molH2O.2mol这种混合烃燃烧生成3.2molCO2.下列正确的是1一定有乙烯2一定有甲烷3一定有丙烷4一定无乙烷6可能有丙炔
A235B56C246D12 firstxia1年前2
firstxia1年前2 -
 nm28339 共回答了20个问题
nm28339 共回答了20个问题 |采纳率80%C
2mol烃燃烧生成3.2Mol二氧化碳,
CxHy====XCO2+[1/2*Y]H2O
3 4.8 6
得到C【1.6】H[4]
所以,一定是有一个碳的甲烷存在,又由于甲烷是CH4
所以另一种必定也是CxH4
C2H4(乙烯) C3H4(丙炔)中的一种{还有C4H4环丁二烯,但是不考虑了}
所以,2、4、6符合提议,答案为C1年前查看全部
- 常温常压下,乙烷、乙炔和丙烯组成的混合烃64mL,与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体
常温常压下,乙烷、乙炔和丙烯组成的混合烃64mL,与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了112 mL,原混合烃中乙炔的体积分数为( )
A.12.5% B.25% C.50% D.75。  显龙在天1年前1
显龙在天1年前1 -
 魚魚翅膀 共回答了21个问题
魚魚翅膀 共回答了21个问题 |采纳率85.7%B
1年前查看全部
- 25℃和101kPa时,甲烷、丙炔(C3H4)和丙烯组成的混合烃10mL与50mL氧气混合,完全燃烧后,除去水蒸气,恢复
25℃和101kPa时,甲烷、丙炔(C3H4)和丙烯组成的混合烃10mL与50mL氧气混合,完全燃烧后,除去水蒸气,恢复到原来的温度和压强,气体总体积为37.5mL,原混合烃中丙烯的体积分数为( )
A.50%
B.25%
C.75%
D.12.5% 黑金战甲1年前1
黑金战甲1年前1 -
 raining1981123 共回答了13个问题
raining1981123 共回答了13个问题 |采纳率84.6%解题思路:发生反应有:CH4+2O2=CO2+2H2O,C3H4+4O2=3CO2+2H2O,C3H6+[9/2]O2=3CO2+3H2O,除去水蒸气,恢复到原来的温度和压强,根据反应方程式可知,CH4和丙炔(C3H4)反应后体积缩小的量是相同的,故可将两者看成是一种物质,设丙炔(C3H4)一共为xmL,C3H6为ymL,利用气体体积缩小了(10+50-37.5)mL=22.5mL及混合气体的体积来列等式计算出丙烯的体积,进而计算丙烯的体积分数.除去水蒸气,恢复到原来的温度和压强,则:
CH4+2O2=CO2+2H2O△V
121 2
C3H4+4O2=3CO2+2H2O△V
1432
C3H6+[9/2]O2=3CO2+3H2O△V
14.53 2.5
CH4和C3H4反应后体积缩小的量是相同的,故可将两者看成是一种物质,
设CH4和C3H4一共为xmL,C3H6为ymL,
则:总体积为:①x+y=10,气体体积减小为:②2x+2.5y=(10+50-37.5)mL=22.5mL
根据①②解得:x=5,y=5,
则原混合烃中丙烯的体积分数为:[5mL/10mL]×100%=50%,
故选A.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查混合物计算、化学方程式有关计算,题目难度中等,解答关键是根据方程式判断体积变化,把甲烷与丙炔看作一个组分,从而转化为两组分混合,注意差量法的应用.1年前查看全部
- 两种气态烃混合,在105℃时1L该混合烃与9LO2混合,充分燃烧后恢复到原状态,所得气体体积仍是10L(补充问
两种气态烃混合,在105℃时1L该混合烃与9LO2混合,充分燃烧后恢复到原状态,所得气体体积仍是10L(补充问
下列各组混合烃中不符合此条件的是
A、CH4 C2H4 B、CH4 C3H6 C、C2H4 C3H4 D、C2H2 C3H6 vampirewang1年前1
vampirewang1年前1 -
 jiangji68590333 共回答了19个问题
jiangji68590333 共回答了19个问题 |采纳率94.7%根据烃的燃烧通式:再考虑气体的体积比等于分子数之比,前后体积不变,则化学反应方程式中反应前后的分子数相等.
CxHy+(x+y/4)O2----xCO2 + y/2 H2O
1-----x+y/4=====x+y/2
y=4
氢原子数为4符合题意.
B,CH4,C3H6无论按什么比例混合,均不能使氢原子为4的1年前查看全部
- 25℃和101 kPa时,乙烷、乙炔和丙烯组成的混合烃32 mL与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和
25℃和101 kPa时,乙烷、乙炔和丙烯组成的混合烃32 mL与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了72 mL,原混合烃中乙炔的体积分数为
A.12.5% B.25% C.50% D.75% yuki86081年前1
yuki86081年前1 -
 oldcat0843 共回答了24个问题
oldcat0843 共回答了24个问题 |采纳率91.7%设乙烷、乙炔和丙烯分别为x、y、z ml,则有x+y+z=32 (ml)
C2H6 + 7/2 O2 = 2CO2 + 3H2O △V=5/2
C2H2 + 5/2 O2 = 2CO2 + H2O △V=3/2
C3H6 + 9/2 O2 = 3CO2 + 3H2O △V=5/2
由于减少了72ml,所以有:
5/2 x + 3/2 y + 5/2 z = 72 ①
x+y+z=32 ②
解① ② ,得到y=8 (ml)
即 乙炔 8ml,体积分数 25%1年前查看全部
- 怎么算出混合烃的平均分子式?
 wxqf1111年前1
wxqf1111年前1 -
 laoji0007 共回答了17个问题
laoji0007 共回答了17个问题 |采纳率94.1%以两种烃混合为例.
一种的分子式是 C x1 H y1 ,含量是w1(指的是物质的量分数,下同)
一种的分子式是 C x2 H y2 ,含量是w2
则混合烃的分子式是 C m H n
m=(x1)(w1)+(x2)(w2)
n=(y1)(w1)+(y2)(w2)
多种烷烃的混合也是类似的.1年前查看全部
- 在25摄氏度、101kPa时,甲烷、乙炔和乙烯组成的混合烃32mL,与过量氧气混合并完全燃
在25摄氏度、101kPa时,甲烷、乙炔和乙烯组成的混合烃32mL,与过量氧气混合并完全燃
与过量氧气混合并完全燃烧,恢复到原来的温度和压强,气体总体积缩小56ml,原混合烃中乙炔的体积分数为
速求 秋之梦_zy1年前1
秋之梦_zy1年前1 -
 zooneer 共回答了24个问题
zooneer 共回答了24个问题 |采纳率95.8%列出燃烧反应方程式就一目了然,50%1年前查看全部
- 混合烃能算不饱和度吗
 齐舟舟1年前2
齐舟舟1年前2 -
 might2008 共回答了22个问题
might2008 共回答了22个问题 |采纳率90.9%不可以.
不饱和度是针对单个有机分子下定义的,对单个有机分子讲不饱和度有意义.
混合烃中,可以对成其成分求不饱和度.但不饱和度本身不能加和.如果是继续算需要加氢到全部饱和,那么需要的氢的物质的量倒是可以加和.1年前查看全部
- 两种气态烃一任意比例混合,在150度是1L该混合烃与9L氧气混合,充分燃烧后回复到原状态,所得气体体积任是10L,下列各
两种气态烃一任意比例混合,在150度是1L该混合烃与9L氧气混合,充分燃烧后回复到原状态,所得气体体积任是10L,下列各组混合烃中不符合次条件的是( )
A.CH4 C2H4 B.CH4 C3H6
C.C2H4 C3H4 D.CH4 C3H4
为什么啊 lxj1101年前1
lxj1101年前1 -
 superdragonzzf 共回答了19个问题
superdragonzzf 共回答了19个问题 |采纳率78.9%设混合烃平均化学式CxHy.
那么根据反应方程式,由于体积差量为0,那么y=4.
如此,不符的只有B1年前查看全部
- 两种烃的混合物完全燃烧后生成的二氧化碳的物质的量比水的物质的量多,该混合烃的组成不可能是
两种烃的混合物完全燃烧后生成的二氧化碳的物质的量比水的物质的量多,该混合烃的组成不可能是
A.两种烯烃 B.一烷烃一烯烃 C.一烯烃一炔烃 D.一烷烃一炔烃 漂浮人海1年前2
漂浮人海1年前2 -
 zhiwei236 共回答了19个问题
zhiwei236 共回答了19个问题 |采纳率100%这题关键看C、H的摩尔数之比.
烷烃:CnH2n+2,燃烧后 n mol的二氧化碳,n+1 mol的水
烯烃:CnH2n,燃烧后 n mol的二氧化碳,n mol的水
炔烃:CnH2n-2,燃烧后 n mol的二氧化碳,n-1 mol的水
综上,A两种烯烃那二氧化碳和水的物质的量肯定是相同的;B一烷烃一烯烃,则不管烷烃多还是烯烃多,水的物质的量肯定比二氧化碳多;C一烯烃一炔烃,则二氧化碳比水多;较难判断的是D,因为这要看烷烃和炔烃的相对含量,烷烃多则水多,炔烃多则二氧化碳多
所以这题应该选A,B.1年前查看全部
- 关于混合烃的计算题两种气态烃以任意比例混合,在105摄氏度是1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体
关于混合烃的计算题
两种气态烃以任意比例混合,在105摄氏度是1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍为10L,则符合此条件的烃要满足什么条件啊
只要满足氢的原子数为4即可, zhou4u1年前2
zhou4u1年前2 -
 lee0108 共回答了17个问题
lee0108 共回答了17个问题 |采纳率100%在105摄氏度燃烧,生成水蒸气和二氧化碳,应该是选择题吧?没选项我也不知道怎么说1年前查看全部
- 气态烃的碳原子数小于等于4,若混合烃的平均相对分子质量小于等于26,则其中必有甲烷,为什么?
气态烃的碳原子数小于等于4,若混合烃的平均相对分子质量小于等于26,则其中必有甲烷,为什么?
气态烃的碳原子数小于等于4,若混合烃的平均相对分子质量小于等于26,则可判定其中必有甲烷,为什么? 影连1年前2
影连1年前2 -
 雨雨想 共回答了22个问题
雨雨想 共回答了22个问题 |采纳率86.4%一楼还说漏了一个,乙炔,正好是26,但题目说是混合烃,所以另一种分比乙炔还小,只能是甲烷了.1年前查看全部
- 两种气态烃以一定比例混合,在105℃时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10L.下列各
两种气态烃以一定比例混合,在105℃时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10L.下列各组混合烃中不符合此条件的是( )
A. CH4C2H4
B. CH4C3H6
C. C2H4C3H4
D. C2H2C3H6 其名是鱼1年前1
其名是鱼1年前1 -
 ivanyu_1980 共回答了17个问题
ivanyu_1980 共回答了17个问题 |采纳率82.4%解题思路:在105℃时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10L,说明反应前后,该温度下,气体的计量数之和不变,据此分析解答.设烃的化学式为CxHy,设有机物的平均式为CxHy,则有:CxHy+(x+[y/4])O2→xCO2+[y/2]H2O,有机物燃烧前后体积不变,则
1+x+[y/4]=x+[y/2],y=4,
A.CH4、C2H4中H原子数都为4,平均值为4,符合题意,故A不选;
B.CH4、C3H6中H原子数分别为4、6.平均值不可能为4,故B选;
C.C2H4、C3H4中H原子数都为4,平均值为4,符合题意,故C不选;
D.C2H2、C3H6H原子数分别为2、6,只有1:1混合才能使平均值为4,不符合以任意比例混合的要求,故D选.
故选:BD.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查了根据化学方程式进行计算,利用平均原子个数来分析解答,注意该温度下水是气体,为易错点.1年前查看全部
- 甲烷乙烷和乙烯组成的混合烃80ml,与过量氧气混合并充分燃烧,恢复到原来压强,气体总体积增加了30ml,则原气体中甲烷乙
甲烷乙烷和乙烯组成的混合烃80ml,与过量氧气混合并充分燃烧,恢复到原来压强,气体总体积增加了30ml,则原气体中甲烷乙烷乙烯的体积比不可能是3比2比3.为什么?
 yuanlixiang11年前3
yuanlixiang11年前3 -
 俄从草原来 共回答了15个问题
俄从草原来 共回答了15个问题 |采纳率93.3%可以倒推
根据甲烷乙烷乙烯的体积比若是3比2比3,甲烷30ml 乙烷20ml 乙烯30ml
且不管其他的物质就对比生成的CO2
CH4~CO2 C2H6~2CO2 C2H4~2CO2
30ml 30ml 20ml 40ml 30ml 60ml
就CO2生成的总体积就是130ml,就不符合题中“气体总体积增加了30ml”的条件1年前查看全部
- 两种气态烃以一定比例混合,在105℃时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10L.下列各
两种气态烃以一定比例混合,在105℃时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10L.下列各组混合烃中不符合此条件的是( )
A. CH4C2H4
B. CH4C3H6
C. C2H4C3H4
D. C2H2C3H6 fweferffd1年前3
fweferffd1年前3 -
 小小一条鱼 共回答了22个问题
小小一条鱼 共回答了22个问题 |采纳率90.9%解题思路:在105℃时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10L,说明反应前后,该温度下,气体的计量数之和不变,据此分析解答.设烃的化学式为CxHy,设有机物的平均式为CxHy,则有:CxHy+(x+[y/4])O2→xCO2+[y/2]H2O,有机物燃烧前后体积不变,则
1+x+[y/4]=x+[y/2],y=4,
A.CH4、C2H4中H原子数都为4,平均值为4,符合题意,故A不选;
B.CH4、C3H6中H原子数分别为4、6.平均值不可能为4,故B选;
C.C2H4、C3H4中H原子数都为4,平均值为4,符合题意,故C不选;
D.C2H2、C3H6H原子数分别为2、6,只有1:1混合才能使平均值为4,不符合以任意比例混合的要求,故D选.
故选:BD.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查了根据化学方程式进行计算,利用平均原子个数来分析解答,注意该温度下水是气体,为易错点.1年前查看全部
- 两种气态烃以任意比例混合,在105℃时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得到气体体积是11L.下列各
两种气态烃以任意比例混合,在105℃时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得到气体体积是11L.下列各组混合烃符合此条件的是( )
A. C4H10、C3H6
B. C4H8、C3H8
C. C4H10、C2H4
D. CH4、C3H8 cranesay1年前2
cranesay1年前2 -
 爱过念过痛苦过 共回答了20个问题
爱过念过痛苦过 共回答了20个问题 |采纳率90%解题思路:设平均分子组成为CxHy,则CxHy+(x+[y/4])O2→xCO2+[y/2]H2O,因为105℃时,生成的H2O是气体,因反应后气体的体积增大了1L,利用差量法计算出混合气态烃中氢原子数目,然后根据“两种气态烃以任意比例混合”及计算结果进行判断即可.设混合烃的平均分子式为CxHy,混合烃燃烧后气体体积增大了:11L-1L-9L=1L,
烃燃烧的方程式为:CxHy+(x+[y/4])O2→xCO2+[y/2]H2O△V
1 x+[y/4]x[y/2][y/4]-1
1L 1L,
即:[y/4]-1=1,y=8,
由于两种气态烃以任意比例混合,氢原子数都是8,
则两种烃分子中H原子数只能都是8,
故选B.点评:
本题考点: 有关有机物分子式确定的计算.
考点点评: 本题考查了有机物分子式的确定,题目难度中等,注意掌握有机物燃烧的方程式,明确差量法在确定有机物分子组成中的应用方法,注意题干中信息“两种气态烃以任意比例混合”的含义.1年前查看全部
- 两种气态烃以一定比例 比例混合 在105 2l该混合烃26l氧气混合 充分燃烧后恢复到原状态
两种气态烃以一定比例 比例混合 在105 2l该混合烃26l氧气混合 充分燃烧后恢复到原状态
所的气体体积为30l 下列各族混合听众不符合此条件的是
c4h10 c3h4 c4h8 c3h8 c4h10 c2h4 c4h6 c3h8 graceyy_80cn1年前2
graceyy_80cn1年前2 -
 yfpp88 共回答了16个问题
yfpp88 共回答了16个问题 |采纳率100%选D
CxHy+(x+y/4)O2-->xCO2+y/2H2O △v
1 y/4 - 1
2L (30-26-2)L
解得y=8 即平均氢原子数为8,D不符合
2L此题选项中各烃最多消耗氧气体积达不到26L,所以氧气一定过量.1年前查看全部
- 两种气态烃以任意比例混合,在120摄氏度时,将1升该混合烃跟9升氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10升
两种气态烃以任意比例混合,在120摄氏度时,将1升该混合烃跟9升氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10升.则下列符合此情况的是:CH4 和 C2H4
 ymxkesinia1年前1
ymxkesinia1年前1 -
 luohuichao 共回答了19个问题
luohuichao 共回答了19个问题 |采纳率78.9%本题目主要强调的是反应前后在120摄氏度时气体体积不变,(注意任意比例混合,说明两种烃都满足这个条件),现在我们来看你给出的这两个答案,甲烷和两摩尔氧气发生反应生成三摩尔气体(水为蒸汽)同理乙烯也是.1年前查看全部
- (双选)两种气态烃以认真比例混合,在105℃时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态(就是不明白这个恢复到原
(双选)两种气态烃以认真比例混合,在105℃时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态(就是不明白这个恢复到原状态什么意思),所得气体体积仍为10L.下列各组混合烃中不符合此条件的是A,CH4,C2H4 B,CH4,C3H6 C,C2H4,C3H4 D,C2H2,C3H6
 tiangang4221年前1
tiangang4221年前1 -
 wangbiqi 共回答了14个问题
wangbiqi 共回答了14个问题 |采纳率100%恢复到原状态是指原温度105摄氏度,即水为气态.应该是BD两个不符合.1年前查看全部
- 平均分子式解题两种气态烃以一定比例混合,在105°C时,1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积
平均分子式解题
两种气态烃以一定比例混合,在105°C时,1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积是10L 下列各组混合烃中一定不符合此条件的是
A.CH4 C2H4 B.CH4 C3H6 C C2H4 C3H4 D C2H2 C3H6
请问这个题的解法
CxHy + (x+y/4) O2 → xCO2 + y/2 H2O
1 9 x y/2
列出方程
x+y/4 = 9
x+ y/2 = 10
这样对吗
为什么接出来是C8H4 ..
请问下此类题的解法
我估计是我的方程列错了, 我是来自南方的狼1年前1
我是来自南方的狼1年前1 -
 smilecalla 共回答了24个问题
smilecalla 共回答了24个问题 |采纳率83.3%一定注意审题:1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,充分燃烧,可不是恰好完全反应,所以氧气可能过量,所以x+y/4 = 9这个式子不对,
这道题应从反应前后气体体积不变(100以上),所以烃平均分子式中氢原子数为4,所以
B.CH4 C3H6 不可能
能看出你的化学基础还可以,在学习中注意方法,另外一定注意审题,细心点1年前查看全部
- 两种气态烃以一定比例混合,在105℃时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10L.下列各
两种气态烃以一定比例混合,在105℃时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10L.下列各组混合烃中不符合此条件的是( )
A. CH4C2H4
B. CH4C3H6
C. C2H4C3H4
D. C2H2C3H6 ITCZ1年前2
ITCZ1年前2 -
 apollo845 共回答了15个问题
apollo845 共回答了15个问题 |采纳率93.3%解题思路:在105℃时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10L,说明反应前后,该温度下,气体的计量数之和不变,据此分析解答.设烃的化学式为CxHy,设有机物的平均式为CxHy,则有:CxHy+(x+[y/4])O2→xCO2+[y/2]H2O,有机物燃烧前后体积不变,则
1+x+[y/4]=x+[y/2],y=4,
A.CH4、C2H4中H原子数都为4,平均值为4,符合题意,故A不选;
B.CH4、C3H6中H原子数分别为4、6.平均值不可能为4,故B选;
C.C2H4、C3H4中H原子数都为4,平均值为4,符合题意,故C不选;
D.C2H2、C3H6H原子数分别为2、6,只有1:1混合才能使平均值为4,不符合以任意比例混合的要求,故D选.
故选:BD.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查了根据化学方程式进行计算,利用平均原子个数来分析解答,注意该温度下水是气体,为易错点.1年前查看全部
- 混合烃的燃烧计算其解题方法及思路是什么?快期末考试了、这个一直我都不会、、
 天赐我馨1年前1
天赐我馨1年前1 -
 qq佳人谁来邀 共回答了12个问题
qq佳人谁来邀 共回答了12个问题 |采纳率100%楼上的思路基本正确,我补充整理一下:
某烃,既然是烃类,就不含氧.就是CxHy类,完全燃烧就是CO2,H2O,你可以通过计算二氧化碳和水的含C含H量的值(单位为mol)计算出C H 的比值.看题意,如果不能完全燃烧,H全部变成H20,C就可能部分CO+CO2或全部是CO,如果提到黑色固体,就是C变成单质碳(一般不涉及),参考耗O2量,也你能算出C:H 的比值.根据题意如某烃的质量或体积或相对分子量得出某烃的分子量.最终就能确定x、y的值,从而求的某烃的分子式.
如果题目说的是某有机物,产物中只有CO2,H2O,就是CxHyOz这样的,根据题意,看燃烧的耗氧量,以及二氧化碳和水中的含O量,你能算出C: H: O 的比值.根据题意如某有机物的质量或体积或相对分子量得出某烃的分子量.最终就能确定x、y、z的值,从而求的某烃的分子式.
如果题目说的是混合烃,产物有CO2,H2O.既然是烃类,就不含氧,就是CxHy类.一般是2种烃(CxHy+CmHn)的混合物,同上C:H的比值的方程式1,耗氧量得方程式2,平均分子量得方程式3,再依题意建一个方程式就可直接算出,或者根据xymn均为大于0的整数就可推断出来了.1年前查看全部
- 气体混合烃与足量的氧气充分燃烧后,若总体积保持不变,则原混合烃中的氢原子平均数为4;若体积扩大,氢原子平均数大于4;若体
气体混合烃与足量的氧气充分燃烧后,若总体积保持不变,则原混合烃中的氢原子平均数为4;若体积扩大,氢原子平均数大于4;若体积缩小,氢原子平均数小于4,即必含C2H2(温度在100℃以上).
 南方推介1年前3
南方推介1年前3 -
 n2at9j 共回答了19个问题
n2at9j 共回答了19个问题 |采纳率94.7%设混合烃平均分子式是CxHy,
CxHy+(x+y/4)O2=xCO2+y/2H2O
体积不变则1+x+y/4=x+y/2,y=4.
体积扩大则y>4,缩小则y1年前查看全部
- 完全燃烧2mol两种气态烃组成的混合气体后所得到3.2molCO2和4molH2O混合烃中乙烯__甲烷__丙烷__乙烷_
完全燃烧2mol两种气态烃组成的混合气体后所得到3.2molCO2和4molH2O混合烃中乙烯__甲烷__丙烷__乙烷__乙炔__(填“一定有”“一定无”“可能有”)
 刺_儿1年前1
刺_儿1年前1 -
 我不是新来的啊 共回答了18个问题
我不是新来的啊 共回答了18个问题 |采纳率94.4%设平均分子式为CxHy,则由燃烧方程式
CxHy+(x+y/4)O2→点燃→xCO2+y/2H2O
1 x y/2
2mol 3.2mol 4mol
X=1.6mol
y=4mol
因为混合气体是由两种气态烃组成,根据计算可知:碳原子的平均物质的量为1.6mol,所以含碳原子的物质的量一定有小于1.6、一定有大于1.6,而小于1.6的只有甲烷中碳原子数小于1.6,所以一定含有甲烷;
而甲烷分子中氢原子数是4,与平均相同,所以另一气态烃的氢原子数也应为4,因此另一气态烃为乙烯.
乙烯 一定有_甲烷_一定有_丙烷_一定无_乙烷_一定无_乙炔_一定无_1年前查看全部
- 25℃和101kpa时,乙烷、乙炔和丙烯组成的混合烃32mL与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强
25℃和101kpa时,乙烷、乙炔和丙烯组成的混合烃32mL与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体的总体积缩小了72mL,原混合烃中乙炔的体积分数为( )
A.12.5%
B.25%
C.50%
D.75% 585947231年前1
585947231年前1 -
 wzl1978 共回答了23个问题
wzl1978 共回答了23个问题 |采纳率87%解题思路:根据有机物燃烧的化学反应方程式,分析反应前后气体体积的变化,利用气体体积缩小了72mL及混合气体的体积来列等式计算出乙炔的体积,最后计算乙炔的体积分数.由乙烷、乙炔和丙烯燃烧的方程式可知,除去水蒸气,恢复到原来的温度和压强,
C2H6+[7/2]O2=2CO2+3H2O△V
1[7/2]2 2.5
C2H2+[5/2]O2=2CO2+H2O△V
1[5/2]2 1.5
C3H6+[9/2]O2=3CO2+3H2O△V
1[9/2] 32.5
则C2H6和C3H6反应后体积缩小的量是相同的,故可将两者看成是一种物质即可,
设C2H6和C3H6一共为xmL,C2H2为ymL,
则有
x+y=32
2.5x+1.5y=72,解得y=8mL,
混合烃中乙炔的体积分数为
8
32×100%=25%,
故选B.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查学生利用有机物燃烧的化学反应方程式进行体积分数的计算,明确气体体积缩小的量及将乙烷和丙烯看成一种物质是解答的关键.1年前查看全部
大家在问
- 1矩形ABCD的周长为56,对角线AC,BD交于点O,△ABO与△BCO的周长差为4,则AB的长是 [
- 2五年级语文人教版下册第二单园的日积月累
- 3在中国文学宝库中,有 在中国文学宝库中,有着丰富的名言格言名句成语典故谚语,如“刻舟求剑、画饼充饥、审时度势、日有所思,
- 4cos15°sin9°+sin6°/sin15°sin9°—cos6°=
- 5冰壶做曲线运动的原理从物理学分析,冰壶会曲线运动的原因,这个曲线运动跟投球时的旋转有关吗,还是跟擦冰有关?
- 6关于硫酸的制法的一些问题..1黄铁矿焙烧前要粉碎,解释是黄铁矿不能燃烧..为什么错?2沸腾炉出来的炉气必须净化,因为杂质
- 7北极星几点出现?一天24小时都能看见?
- 8甲、乙、丙三个工程队合修一条公口路,甲队单独修30天完成,乙队单独修15天完成.现在由甲,乙,丙三队合修4天,完成全部的
- 9I am in Suzhou now.if you want to learn English,you need to
- 10你爸爸是什么职业的?英文翻译
- 11Tea means two things.
- 12some go letus and get drinks连词成句
- 13“现代社会人们越来越重视健康复和体育锻炼”英文怎么翻译
- 14英语翻译我喜欢魔戒这部电影,因为这部电影里的各种效果做的很逼真,而且故事情节也很吸引人,并且演员的演技也很到位.(呵呵自
- 15概率题目某市有30%住户订日报,有50%住户订晚报,有65%的住户至少订这两种报纸的一种,则同时订这两种报纸的住户的百分
