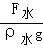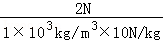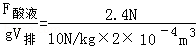酸液加水,pH怎样变化?
 yonggandexin2022-10-04 11:39:543条回答
yonggandexin2022-10-04 11:39:543条回答
已提交,审核后显示!提交回复
共3条回复
 fengxingtao 共回答了17个问题
fengxingtao 共回答了17个问题 |采纳率82.4%- 酸液加水,ph值会升高
随着水的增多,ph值会无限接近7 - 1年前
 时势变化 共回答了1个问题
时势变化 共回答了1个问题 |采纳率- 水就等于是在溶液中增加溶剂而溶质不变,那么溶液浓度降低。
加了水相对来说氢离子浓度下降,所以酸性下降,pH数值变大 - 1年前
 lipice 共回答了84个问题
lipice 共回答了84个问题 |采纳率- 比如浓硫酸,加了水浓度降低就成了稀硫酸。
加水就等于是在溶液中增加溶剂而溶质不变,那么溶液浓度降低。
对于酸,加了水相对来说氢离子浓度下降,所以酸性下降,pH数值变大。 - 1年前
相关推荐
- 溶液颜色较浅时滴入酸液过快,停止滴定后反加一滴NAOH溶液无变化,那会差成什么误差啊,详细说明一上啊.
 看一看顶一顶1年前3
看一看顶一顶1年前3 -
 lwr_16898 共回答了15个问题
lwr_16898 共回答了15个问题 |采纳率80%溶液化学反应不完全.
因为溶液颜色较浅说明溶质少,又滴入酸液过快,这样根本不会有什么反应在进行.所以没有生成的物质很少,所以加一滴NAOH溶液会无变化1年前查看全部
- 配置油田用酸化压裂用酸液40方,其中20%为盐酸,盐酸的浓度为31%,求所需盐酸的质量和体积,
 水本无尘1年前1
水本无尘1年前1 -
 雨霏云灿-- 共回答了15个问题
雨霏云灿-- 共回答了15个问题 |采纳率86.7%(1).原料盐酸浓度是31.0%,密度相当与1.154克/毫升=1.154吨/立方米(20摄氏 度) (2).需要原料盐酸的体积是:40方*20%=8方(立方米),折合质量数是:(1.154吨/立方米)*8立方米=9.232吨1年前查看全部
- 在进行中和滴定时,为甚麼要用标准酸液润洗酸滴定管2-3次 用酸溶液润洗後的滴定管,如果再用蒸馏水润洗,
在进行中和滴定时,为甚麼要用标准酸液润洗酸滴定管2-3次 用酸溶液润洗後的滴定管,如果再用蒸馏水润洗,
是否正确 为甚麼?
请详细回答... tsddd1年前2
tsddd1年前2 -
 EmilyLei 共回答了18个问题
EmilyLei 共回答了18个问题 |采纳率94.4%酸碱滴定的一般计算方法是:C标准·V标准=C待测·V待测,当然如果计量系数不同还要对应成比例的.所以C待测=C标准·V标准÷V待测,在这个表达式中,C标准 一定是有具体数据,V待测一定是提前取好放入锥形瓶中的,也有具体数据,只有 V标准 是根据滴定过程而定的,有偶然性,也会受到诸多因素的影响,因此分析 C待测 的误差,一般紧扣 V标准 来分析,特别要注意的是——两者变化趋势相同.
如果标准酸液不去润洗滴定管2-3次,那么滴定管内壁上会挂有蒸馏水,直接加入标准液,相当于将标准液冲稀,在滴定过程中就会导致标准液多加,引起滴定结果误差偏大.
如果酸溶液润洗过后的滴定管,再用蒸馏水润洗,当然就跟蒸馏水洗滴定管一样,会有水滞留挂壁,导致加入的标准液浓度变小.虽然标准液浓度变小了,可是你代入计算的时候用的还是原数据,因为根本无法确定变小了多少,但是标准液的体积一定多加,即 V标准 变大,待测液浓度偏大.1年前查看全部
- 如图所示的装置打开分液漏斗的活塞,让水滴入锥形瓶中,可以观察到锥形瓶中出现溶液沸腾,酸液四溅的现象.且U形管左低右高,为
如图所示的装置打开分液漏斗的活塞,让水滴入锥形瓶中,可以观察到锥形瓶中出现溶液沸腾,酸液四溅的现象.且U形管左低右高,为什么会左低右高?
我描述一下装置:分液漏斗中装有水,锥形瓶中装有98%的硫酸,水慢慢滴到硫酸上去. welyuner1年前1
welyuner1年前1 -
 a121538 共回答了18个问题
a121538 共回答了18个问题 |采纳率100%在有限的空间内,水沸腾,产生大量的蒸汽,压力增大,u形管液面出现高低差1年前查看全部
- (2010•自贡)用如图装置制取氢气,在多孔塑料板上放锌粒,稀H2SO4由漏斗中加入.若打开弹簧夹,酸液由漏斗
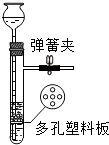 (2010•自贡)用如图装置制取氢气,在多孔塑料板上放锌粒,稀H2SO4由漏斗中加入.若打开弹簧夹,酸液由漏斗
(2010•自贡)用如图装置制取氢气,在多孔塑料板上放锌粒,稀H2SO4由漏斗中加入.若打开弹簧夹,酸液由漏斗
中流下与锌粒接触即发生反应,产生的氢气由支管导出,请回答下列问题:
(1)发生反应的化学方程式为______.
(2)检查此装置的气密性时,关闭弹簧夹,从漏斗注入适量的水形成液封后,若看到漏斗内______,则表明装置气密性良好.
(3)反应过程中关闭弹簧夹,容器内继续反应产生的氢气会使容器内______,将酸液压回漏斗中,使酸液与锌粒______,反应即自行停止.
(4)若在塑料隔板上放小块大理石,漏斗中加入稀HCl,______(填能活否)用弹簧夹控制CO2的发生和停止. 紫姜狗肉少爷1年前1
紫姜狗肉少爷1年前1 -
 zhli_1428 共回答了23个问题
zhli_1428 共回答了23个问题 |采纳率87%解题思路:根据气体的制取进行分析,锌能与稀硫酸反应生成硫酸锌和氢气;
装置的气密性良好则在长颈漏斗中形成的液面不下降;
关闭弹簧夹则产生的气体排不出去,会使装置内的压强增大,从而压着液体回流,达到液固分离的目的;
大理石与盐酸的反应可以使用此装置.(1)锌能与稀硫酸反应生成硫酸锌和氢气,故填:Zn+H2SO4═ZnSO4+H2↑;
(2)检查此装置的气密性时,关闭弹簧夹,从漏斗注入适量的水形成液封后,若看到漏斗内液面不下降,则表明装置气密性良好,故填:液面不下降;
(3)反应过程中关闭弹簧夹,容器内继续反应产生的氢气会使容器内压强增大,将酸液压回漏斗中,使酸液与锌粒分离,反应即自行停止,故填:压强增大,分离;
(4)若在塑料隔板上放小块大理石,漏斗中加入稀HCl,盐酸与碳酸钙反应生成二氧化碳,能用弹簧夹控制CO2的发生和停止,故填:能.点评:
本题考点: 氢气的制取和检验;检查装置的气密性;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查了氢气的制取,完成此题,可以依据已有的知识进行.1年前查看全部
- 某市发生了一起盐酸泄漏事故,盐酸泄漏的瞬间,酸雾弥漫,空气中散发着淡淡的酸味,泄漏的酸液顺势
某市发生了一起盐酸泄漏事故,盐酸泄漏的瞬间,酸雾弥漫,空气中散发着淡淡的酸味,泄漏的酸液顺势
流入低洼的村庄,酸雾导致十余人住院观察.某校化学兴趣小组应邀参与这一事故的处理,同学们展开了激烈的讨论1)小明提出用可溶性碱来处理,例如---------(填写一种具体物质)2)小丽提出不同意见,她认为在污染面积较大且不能使用酸碱指示剂的情况下,无法确定酸碱是否完全反应,因为--------------
3)通过以上讨论,大家决定用盐类物质处理酸液,例如-------(填一种具体物质 shumating1年前1
shumating1年前1 -
 4732232 共回答了20个问题
4732232 共回答了20个问题 |采纳率70%例如-NaOH--------(填写一种具体物质)2)小丽提出不同意见,她认为在污染面积较大且不能使用酸碱指示剂的情况下,无法确定酸碱是否完全反应,因为-盐酸和氢氧化钠都是无色的-------------1年前查看全部
- 吸收酸性气体用碱液、吸收碱性气体用酸液 干燥酸性气体用酸液、干燥碱性气体用碱液 那干燥和吸收有什么区
吸收酸性气体用碱液、吸收碱性气体用酸液 干燥酸性气体用酸液、干燥碱性气体用碱液 那干燥和吸收有什么区
吸收酸性气体用碱液、吸收碱性气体用酸液。
干燥酸性气体用酸液、干燥碱性气体用碱液。
那干燥和吸收有什么区别。
顺便把在高中里一些常见的强酸强碱在有关试验里的应用说下。
以及一些常见强酸强碱的酸碱性强弱、并说下是怎么判定的。 yelong41年前3
yelong41年前3 -
 蓝色月光_168 共回答了18个问题
蓝色月光_168 共回答了18个问题 |采纳率94.4%干燥气体时干燥剂不能与待干燥气体反应,不然,你辛辛苦苦做出来的产品就这样飞了,懂不?另外纠正下,干燥酸性气体用非氧化性酸液、干燥碱性气体用碱液 .
吸收气体时多数要发生化学反应(也有仅发生物理反应的,比如用水吸收NH3),使杂质气体或废气脱离体系,使产品净化.有时也被吸收的气体正是所要的产品,所以,吸收的目的要看具体而定1年前查看全部
- 实验室制取CO2一般有几个步骤:①检查装置的气密性,按要求装配好仪器;②向长颈漏斗中注入酸液;③向锥形瓶放人几小块的大理
实验室制取CO2一般有几个步骤:①检查装置的气密性,按要求装配好仪器;②向长颈漏斗中注入酸液;③向锥形瓶放人几小块的大理石;④收集气体.下列操作顺序正确的是( )
A.②①④③
B.①③②④
C.①④②③
D.②③④① 我恨燃烧1年前1
我恨燃烧1年前1 -
 丫丫在上海 共回答了19个问题
丫丫在上海 共回答了19个问题 |采纳率94.7%解题思路:根据制取二氧化碳的步骤(连→查→加→倒→定→收)进行分析解答即可.制取二氧化碳的操作步骤是:连(连接仪器、组装实验装置)→查(检查装置的气密性)→加(加入固体药品)→倒(倒入液体药品)→定(用铁架台固定仪器装置)→收集(用向上排空气法收集).
故①③②④.
故选:B.点评:
本题考点: 制取二氧化碳的操作步骤和注意点.
考点点评: 本题难度不大,掌握制取二氧化碳的操作步骤和注意事项是正确解答本题的关键.1年前查看全部
- 稀硫酸为什么会变红?在无磁无镍的不锈钢表面滴上一滴稀硫酸,用电池的正极接钢,负极接触稀硫酸,导电后酸液就会变红.这是为什
稀硫酸为什么会变红?
在无磁无镍的不锈钢表面滴上一滴稀硫酸,用电池的正极接钢,负极接触稀硫酸,导电后酸液就会变红.这是为什么啊?怎样不变红?
怎样阻止酸液变红?我愿出钱收购答案.13693348625 巴牙儿91年前3
巴牙儿91年前3 -
 康凯 共回答了15个问题
康凯 共回答了15个问题 |采纳率73.3%不锈钢主要成分是铁,用正极接钢发生正极反应Fe - 2e → Fe2+,Fe2+易被氧气氧化成Fe3+,负极反应2H+ + 2e → H2↑,因为是稀硫酸估计酸不够,马上负极反应就变成中性溶液中的反应O2 + 2H2O + 4e → 4OH-,Fe3+ + 3OH- → Fe(OH)3红褐色,少量不是沉淀是胶体,所以看到溶液变红.
顺便说一句,电解反应一般都用惰性材料作电极,版主怎么会想到用不锈钢作正极?作负极问题倒不大.如果是想电解稀硫酸(不就是电解水嘛?……)的话,就用石墨棒作电极.1年前查看全部
- 把百分之99的纯硫酸一千克稀释成百分之4的酸液,需要加多少蒸馏水?
 雾聆1年前1
雾聆1年前1 -
 DAINNNA 共回答了18个问题
DAINNNA 共回答了18个问题 |采纳率94.4%1000*99%=x*4%
0.04x=990
x=24750
24750-1000=23750
加23750克的水.1年前查看全部
- 下列实验操作中正确的是( )A.测定未知NaOH溶液浓度时,酸式滴定管需用标准酸液润洗2-3次B.用托盘天平称取3.2
下列实验操作中正确的是( )
A.测定未知NaOH溶液浓度时,酸式滴定管需用标准酸液润洗2-3次
B.用托盘天平称取3.25gNaCl
C.用碱式滴定管量取12.20mL高锰酸钾溶液
D.先将pH试纸用蒸馏水润湿后,再测定溶液的pH 66kl1年前1
66kl1年前1 -
 我是旅行社的 共回答了21个问题
我是旅行社的 共回答了21个问题 |采纳率81%解题思路:A.滴定管需用标准酸液润洗2-3次;
B.托盘天平精确值为0.1,故用托盘天平不能称取3.25gNaCl;
C.酸性高锰酸钾溶液有强氧化性;
D.用pH试纸测定未知溶液的pH时,正确的操作方法为用玻璃棒蘸取少量溶液置于干燥的pH试纸上,通过与标准比色卡对比来确定pH.A.酸碱中和滴定要求精确度较高,滴定管用标准酸液润洗2-3次可保证酸液浓度,故A正确;
B.用托盘天平称取3.25gNaCl,实验记录不合理,天平不能精确的0.01,故B错误;
C.酸性高锰酸钾溶液有强氧化性能将碱式滴定管的橡胶管氧化,故C错误;
D.此题中pH试纸已经用蒸馏水湿润,稀释了待测溶液,则测定的pH可能不变、可能变大、可能变小,故D错误.
故选A.点评:
本题考点: 计量仪器及使用方法;试纸的使用.
考点点评: 本题考查托盘天平、pH试纸、滴定管的使用,难度不大,注意高锰酸钾溶液应用酸式滴定管.1年前查看全部
- 将浓硫酸浓盐酸分别暴露在空气中 酸液的质量会都减小么
 chen05771年前3
chen05771年前3 -
 意大利vsvvl2比0 共回答了26个问题
意大利vsvvl2比0 共回答了26个问题 |采纳率92.3%浓硫酸具有吸水性,吸收空气中水蒸气,所以酸液的质量会增加
而浓盐酸具有挥发性,挥发出HCl气体,酸液的质量会减小1年前查看全部
- 实验室制取二氧化碳一般有如下步骤:①检查装置气密性;②按要求组装实验装置;③通过长颈漏斗加入酸液;④向锥形瓶中加入适量的
实验室制取二氧化碳一般有如下步骤:①检查装置气密性;②按要求组装实验装置;③通过长颈漏斗加入酸液;④向锥形瓶中加入适量的石灰石;⑤收集气体.正确的操作顺序是( )
A.①②③④⑤
B.②①④③⑤
C.②③④①⑤
D.①④②③⑤ ly8612201年前1
ly8612201年前1 -
 deng2002an 共回答了18个问题
deng2002an 共回答了18个问题 |采纳率77.8%解题思路:根据制取二氧化碳的步骤(连→查→加→倒→收→验满)进行分析解答即可.制取二氧化碳的操作步骤是:连(连接仪器、组装实验装置)→查(检查装置的气密性)→加(向广口瓶中装入石灰石)→倒(向漏斗中注入稀盐酸)→收集(用向上排空气法收集).则正确的操作顺序为:②①④③⑤.
故选:B.点评:
本题考点: 制取二氧化碳的操作步骤和注意点.
考点点评: 本题难度不大,掌握制取二氧化碳的操作步骤和注意事项是正确解答本题的关键.1年前查看全部
- 2007年4月,陕西汉中市区,一辆运输浓盐酸的车辆发生事故,导致酸液泄漏闹市,经喷水和撒石灰处理后,排除了险情,对喷水和
2007年4月,陕西汉中市区,一辆运输浓盐酸的车辆发生事故,导致酸液泄漏闹市,经喷水和撒石灰处理后,排除了险情,对喷水和撒石灰做法的叙述错误的是()。
A.喷水可以减少浓盐酸挥发 B.喷水可以降低盐酸酸性 C.撒石灰为了消除盐酸污染 D.喷水是为了尽快把盐酸冲进下水道  ypm20081年前1
ypm20081年前1 -
 padog 共回答了19个问题
padog 共回答了19个问题 |采纳率100%D
A、用水把浓盐酸稀释,挥发性会降低,故解释正确;
B、加水可以降低盐酸的酸性,降低破坏性,故解释正确;
C、石灰是碱性物质可以中和酸,降低破坏性,故解释正确;
D、如果用水把酸冲进下水道,酸会腐蚀管道,故解释不正确.
故选D1年前查看全部
- 请问用标准酸液滴定未知碱液的时候,如果锥形瓶内有标准液未冲洗下去,结果会怎样变?
 sindy16521年前2
sindy16521年前2 -
 ww说早点回家 共回答了25个问题
ww说早点回家 共回答了25个问题 |采纳率92%未知碱液浓度会比实际值偏高.1年前查看全部
- 技术人员为了测量某种酸液的密度,如图所示:先取一装有铁砂的密闭玻璃瓶,用细线悬挂在校零后的弹簧测力计下方,测得其重量G;
技术人员为了测量某种酸液的密度,如图所示:先取一装有铁砂的密闭玻璃瓶,用细线悬挂在校零后的弹簧测力计下方,测得其重量G;然后将玻璃瓶完全浸没于水中,测得拉力大小F 1 ;最后再将玻璃瓶完全浸没于酸液中,测得拉力大小F 2 .求:( g取10N/kg)
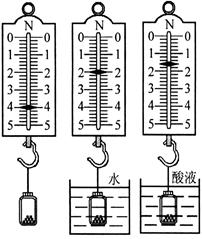
(1)玻璃瓶的体积;
(2)酸液的密度。 股海岸边1年前1
股海岸边1年前1 -
 chenlin1029 共回答了19个问题
chenlin1029 共回答了19个问题 |采纳率89.5%1年前查看全部
- 电动车中一般都要用到铅酸蓄电池,某铅酸蓄电池所用的酸液是溶质质量分数为35%的硫酸.用98%的浓硫酸(密度为1.84G/
电动车中一般都要用到铅酸蓄电池,某铅酸蓄电池所用的酸液是溶质质量分数为35%的硫酸.用98%的浓硫酸(密度为1.84G/ML3)可配制溶质质量分数为28%的稀硫酸多少克?
 liang78021年前1
liang78021年前1 -
 jajabinsun 共回答了23个问题
jajabinsun 共回答了23个问题 |采纳率91.3%若浓硫酸为mg,则可配28%稀硫酸质量=m*98%/28%=3.5mg,所以可配3.5mg1年前查看全部
- 化学与生活、生产密切相关,下列叙述正确的是( ) A.稀释浓硫酸时,把水沿烧杯壁缓慢注入浓硫酸中,防止酸液飞溅 B.往
化学与生活、生产密切相关,下列叙述正确的是( ) A.稀释浓硫酸时,把水沿烧杯壁缓慢注入浓硫酸中,防止酸液飞溅 B.往积雪的道路上撒盐,使其凝固点升高 C.往硬水中加入肥皂水并搅拌,产生垢状物较少,泡沫较多 D.硝酸铵化肥不能与熟石灰混合施用,以免降低肥效  jiexiuliu1年前1
jiexiuliu1年前1 -
 雪域深寒 共回答了19个问题
雪域深寒 共回答了19个问题 |采纳率89.5%A、稀释浓硫酸时,把水沿烧杯壁缓慢注入浓硫酸中,防止酸液飞溅.这种说法是错误的,这样做会放出大量热,使水和酸液飞溅的;
B、往积雪的道路上撒盐,使其凝固点升高.这种说法是错误的,它是降低了其熔点;
C、往硬水中加入肥皂水并搅拌,产生垢状物较少,泡沫较多.这种说法是错误的,硬水与肥皂水会产生浮渣,泡沫较少.
D、硝酸铵化肥不能与熟石灰混合施用,以免降低肥效,这种说法是正确的.
故选:D1年前查看全部
- 实验室制取CO2时加入酸液大理石表面瞬间产生气泡后反应几乎停止
 草人心情1年前2
草人心情1年前2 -
 范帝周 共回答了18个问题
范帝周 共回答了18个问题 |采纳率83.3%有两种可能:一,加的酸是盐酸,但可能是氯化氢的浓度不大,以至于氯化氢被消耗完,使反应终止!二,加的酸是硫酸,硫酸和碳酸钙反应生成硫酸钙,水和二氧化碳.其中硫酸钙是一种微溶物,会覆盖在大理石表面,阻止了碳酸钙和硫酸的接触,从而阻碍了硫酸和碳酸钙的反应!使得反应终止!对于考题来说最大可能是第二种(考点是硫酸钙是微溶物),但在实际做实验时要全面考虑!1年前查看全部
- 电动车中一般都要用到铅酸蓄电池,某铅酸蓄电池所用的酸液是溶质质量分数为28%的稀硫酸.用一升溶质质量分数为98%的浓硫酸
电动车中一般都要用到铅酸蓄电池,某铅酸蓄电池所用的酸液是溶质质量分数为28%的稀硫酸.用一升溶质质量分数为98%的浓硫酸(密度为1.84G/ML3)需要蒸馏水多少升,配得稀硫酸质量为多少去千克
 ilyshiming1年前1
ilyshiming1年前1 -
 35421 共回答了17个问题
35421 共回答了17个问题 |采纳率94.1%(这里用P代表密度)
m=PV=1.84g/cm^3*1*10^3cm^3=1.84*10^3g=1.84kg
设需要蒸馏水的质量为a g
(1.84*10^3*98%)/(1.84*10^3+a)=28%
得a=4600g
v(水)=m/P=4600g/1.0g/cm^3=4600ml=4.6L
m(稀硫酸)=1.84kg+4.6kg=6.44kg
你给再加点分呗~~1年前查看全部
- (2006•徐州)据新闻报道,今年4月,一辆运输浓盐酸的车辆发生事故,导致酸液泄漏闹市,经喷水和撒石灰处理后,排除了险情
(2006•徐州)据新闻报道,今年4月,一辆运输浓盐酸的车辆发生事故,导致酸液泄漏闹市,经喷水和撒石灰处理后,排除了险情.对喷水和撒石灰的做法解释错误的是( )
A.喷水可以减少浓盐酸挥发
B.喷水可以降低盐酸酸性
C.撒石灰为了消除盐酸污染
D.喷水是尽快把盐酸冲进下水道 映霜寒1年前1
映霜寒1年前1 -
 jackiechan 共回答了21个问题
jackiechan 共回答了21个问题 |采纳率90.5%解题思路:A、把浓的稀释了,挥发性降低一点;
B、水可以降低盐酸酸性;
C、碱能中和酸;
D、盐酸进入下水道会腐蚀管道.A、用水把浓盐酸稀释,挥发性会降低,故解释正确;
B、加水可以降低盐酸的酸性,降低破坏性,故解释正确;
C、石灰是碱性物质可以中和酸,降低破坏性,故解释正确;
D、如果用水把酸冲进下水道,酸会腐蚀管道,故解释不正确.
故选D点评:
本题考点: 常见的意外事故的处理方法;酸碱溶液的稀释;酸、碱性废水的处理.
考点点评: 化学来源于生产、生活,同时又服务于生产、生活,化学与生活联系的考题也成为中考的考点之一.1年前查看全部
- 甲基橙的滴定终点,溶液呈什么颜色?主要是我不太明白,假如滴定的是酸液,那么终点颜色和滴定碱液一样吗
 绝对风光1年前4
绝对风光1年前4 -
 carrotred 共回答了13个问题
carrotred 共回答了13个问题 |采纳率84.6%ph3.1以下,红色.3.1到4.4橙色.4.4以上,黄色.
滴定酸液,由公红变到黄色的时候停止.滴定碱液,由黄变橙的时候停止.
明白了吗?1年前查看全部
- 金属与酸反应速率与酸液的浓度有关,在一定量的硫酸溶液加入一定质量的金属铝,反应速率较快,为了使反应速率减慢,又不影响产生
金属与酸反应速率与酸液的浓度有关,在一定量的硫酸溶液加入一定质量的金属铝,反应速率较快,为了使反应速率减慢,又不影响产生氢气的质量,下列措施不可行的是( )
A.加入适量的氯化钡溶液
B.加入适量的硫酸铜溶液
C.加入适量的硫酸钠溶液
D.加入适量的蒸馏水 尘埃上的花1年前1
尘埃上的花1年前1 -
 X_qian 共回答了18个问题
X_qian 共回答了18个问题 |采纳率83.3%解题思路:酸液的浓度越小,反应速度越快.为使一定质量的金属铝与一定量的硫酸溶液的反应速率减慢,可减小酸液的浓度,当加入ABCD四选项中的物质时,均能减小酸液的浓度,起到减缓反应速率的作用,但是当加入硫酸铜溶液时,由于金属铝比铜活泼,金属铝先与硫酸铜溶液发生如下反应:Fe+CuSO4═Cu+FeSO4,这样减少了与酸反应的金属铝的质量,从而影响到产生氢气的质量,与题目要求又不影响产生氢气的质量不符.故答案B不可行.A、加入适量的氯化钡溶液,尽管发生如下反应:BaCl2+H2SO4═BaSO4↓+2HCl 只是H+的浓度减小但质量不变,故反应速率减慢,又不影响氢气的质量,该措施可行.
B、加入适量的硫酸铜溶液,金属铝先与硫酸铜溶液发生如下反应:Fe+CuSO4═Cu+FeSO4,这样减少了与酸反应的金属铝的质量,从而影响到产生氢气的质量,故该措施不可行.
C、硫酸钠与硫酸和金属铝都不反应,加入适量的硫酸钠溶液后,只是增加了溶液的质量,降低了酸液的浓度,故能使反应速率减慢,又不影响氢气的质量,该措施可行.
D、加入适量的蒸馏水,稀释了酸液,故能使反应速率减慢,又不影响氢气的质量,该措施可行.
故选:B点评:
本题考点: 影响化学反应速率的因素探究;金属活动性顺序及其应用;酸碱溶液的稀释.
考点点评: 该题难度不大,但综合性较强,以影响反应速率的因素探究为情境,重点考查金属活动顺序的应用和对溶质质量分数的理解.1年前查看全部
- 据《扬子晚报》报道,今年4月,陕西汉中市区,一辆运输浓盐酸的车辆发生事故,导致酸液泄漏闹市,经喷水和撒石灰处理后,排除了
据《扬子晚报》报道,今年4月,陕西汉中市区,一辆运输浓盐酸的车辆发生事故,导致酸液泄漏闹市,经喷水和撒石灰处理后,排除了险情。对喷水和撒石灰做法的叙述错误的是 [ ]A.喷水可以减少浓盐酸挥发
B.喷水可以降低盐酸酸性
C.撒石灰为了消除盐酸污染
D.喷水是尽快把盐酸冲进下水道 lfbs4561年前1
lfbs4561年前1 -
 枫叶简 共回答了20个问题
枫叶简 共回答了20个问题 |采纳率80%D1年前查看全部
- 一辆运输浓盐酸的车发生事故,导致酸液泄漏.经喷水和撒石灰处理后排除了险情.那喷水和撒石灰有哪些作用
 autochthon1年前3
autochthon1年前3 -
 ywyxy432 共回答了17个问题
ywyxy432 共回答了17个问题 |采纳率88.2%浓盐酸具有强烈的挥发性
泄露以后大量HCl气体进入空气,HCl强酸,对人体有害,极易溶于水
所以喷水吸收空气中大量到HCl
再流到地面上的溶液强酸啊,当然用石灰中和1年前查看全部
- 实验室制取CO2一般有六个步骤:①检查装置的气密性;②按要求装配好仪器;③向漏斗中注入酸液;④向广口瓶放人小块的大理石;
实验室制取CO2一般有六个步骤:①检查装置的气密性;②按要求装配好仪器;③向漏斗中注入酸液;④向广口瓶放人小块的大理石;⑤收集气体;⑥验满.下列操作顺序中,正确的是( )
A.①②③④⑤⑥
B.②①④③⑤⑥
C.①④②③⑤⑥
D.②③④①⑤⑥ biyele3211年前1
biyele3211年前1 -
 兰色贝儿 共回答了20个问题
兰色贝儿 共回答了20个问题 |采纳率95%解题思路:根据制取二氧化碳的步骤(连→查→加→倒→定→收→验满)进行分析解答即可.制取二氧化碳的操作步骤是:连(连接仪器、组装实验装置)→查(检查装置的气密性)→加(加入固体药品)→倒(倒入液体药品)→定(用铁架台固定仪器装置)→收集(用向上排空气法收集)→验满.则正确的操作顺序为:②①④③⑤⑥.
故选B.点评:
本题考点: 制取二氧化碳的操作步骤和注意点.
考点点评: 本题难度不大,掌握制取二氧化碳的操作步骤和注意事项是正确解答本题的关键.1年前查看全部
- 酸液中,酸中H+和水电离的OH-反应,那为什么由水电离出的H+和OH-还会相同?
 ocdtt1年前1
ocdtt1年前1 -
 shaya0707 共回答了15个问题
shaya0707 共回答了15个问题 |采纳率100%这是因为,酸中的氢离子抑制了水中氢离子的的电离,其实这是很好理解的, 根据化学平衡就可以解决,而水的电离是微乎其微的,它电离的氢离子永远都等于氢氧根离子,1年前查看全部
- 强碱滴定弱酸 使其成中性时 碱液中碱的物质的量与酸液中酸的物质的量的关系
 fannywzx1年前2
fannywzx1年前2 -
 陈东邪 共回答了11个问题
陈东邪 共回答了11个问题 |采纳率100%n(碱)<n(酸)
假设n(碱)=n(酸),此时中和得到的是强碱弱酸盐,水解呈碱性
因此若溶液呈中性,应减少碱的用量
因此n(碱)<n(酸)1年前查看全部
- 做化学实验时必须遵守实验规则,注意安全.实验时如果眼睛里不慎溅入酸液或碱液,应怎么办?
 bhpdj0011年前5
bhpdj0011年前5 -
 leafnie 共回答了23个问题
leafnie 共回答了23个问题 |采纳率78.3%解题思路:根据酸碱具有腐蚀性以及处理措施进行解答.酸碱具有腐蚀性,若酸、碱的溶液溅入眼睛内,立即用大量清水清洗;如果溅进了浓酸或浓碱,应立即医院诊治.
点评:
本题考点: 常见的意外事故的处理方法.
考点点评: 本题考查化学实验安全及事故处理,题目难度不大,注意相关基础知识的积累.1年前查看全部
- 酸液碱液留到桌子上用中和吗?用什么中和?那如果溅到皮肤上手上和眼睛上呢?
 湖口佳佳1年前2
湖口佳佳1年前2 -
 恨水东流 共回答了17个问题
恨水东流 共回答了17个问题 |采纳率82.4%桌上,用布擦掉就好了.手上,先用布擦拭,然后自来水冲.眼睛的话,马上就医,不能拖延1年前查看全部
- 酸液不慎洒在桌上或皮肤上应用什么溶液冲洗?碱溶液不慎洒在皮肤上应用什么溶液冲洗?
 855029921年前1
855029921年前1 -
 jseraph100 共回答了23个问题
jseraph100 共回答了23个问题 |采纳率82.6%酸性的应该用碱性溶液清洗 苏打水最平常了
碱性就用酸性溶液喽 家里的醋就是酸性的1年前查看全部
- 用如下图所示的装置制取氢气,在多孔塑料板上放锌粒,稀H 2 SO 4 由A 中加入,若打开弹簧夹,酸液由A 中流下与锌粒
用如下图所示的装置制取氢气,在多孔塑料板上放锌粒,稀H 2 SO 4 由A 中加入,若打开弹簧夹,酸液由A 中流下与锌粒接触即发生反应,产生的氢气由支管导出,试完成下列问题: 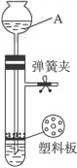
(1) 仪器A 的名称是_________ 。
(2) 检查此装置的气密性时,关闭弹簧夹,从仪器A 处注入适量的___________ 形成液封后,若看到仪器A 内___________ ,则表明装置气密性良好。
(3) 若关闭弹簧夹,容器内继续反应产生的氢气会使容器内___________ ,将酸液压回仪器A 中,使酸液与锌粒___________ ,反应即自行停止。
(4) 若氢气发生装置气密性良好,该同学用排水法收集一试管氢气,经检验不纯,你认为可能的原因是__________________________________________________________ 。
(5) 若在塑料隔板上放小块大理石,A 中放稀HCl ,__________( 填“能”或“否”) 用弹簧夹控制CO 2 的发生和停止。 爱糊基地1年前1
爱糊基地1年前1 -
 爱蓝小麦猪 共回答了24个问题
爱蓝小麦猪 共回答了24个问题 |采纳率83.3%(1)长颈漏斗
(2)水;液面不变
(3)压强增大;脱离接触
(4)开始冒气泡就收集,氢气中混有了原试管中的空气
(5)能1年前查看全部
- 溶液颜色较浅时滴入酸液过快,停止滴定后反加一滴NAOH溶液无变化,那会差成什么误差啊,详细说明一上啊.
溶液颜色较浅时滴入酸液过快,停止滴定后反加一滴NAOH溶液无变化,那会差成什么误差啊,详细说明一上啊.
有关酸碱中和滴定的问题.用酸滴定碱. lili4631年前2
lili4631年前2 -
 霜解tt 共回答了21个问题
霜解tt 共回答了21个问题 |采纳率71.4%用酸滴定碱的时候,要在PH=8.2的时候变色,此时是从浅红色变为无色.当酸液滴加过快,溶液已经无色的时候,你已经不能确定是否酸液过量.如果酸液过量,那么会使消耗酸的体积变大,而酸的体积和被滴定的碱的体积都已经确定,所以导致计算出来的碱的浓度变大.1年前查看全部
- 实验室制CO2有以下操作步骤:①向试管中装入大理石;②检验装置气密性;③收集CO2气体;④向长颈漏斗中注入酸液.按正确操
实验室制CO2有以下操作步骤:①向试管中装入大理石;②检验装置气密性;③收集CO2气体;④向长颈漏斗中注入酸液.按正确操作顺序排列是( )
A. ①②③④
B. ②①④③
C. ②④①③
D. ①④②③ zx865101年前1
zx865101年前1 -
 wzddewc1 共回答了25个问题
wzddewc1 共回答了25个问题 |采纳率96%解题思路:检验气密性是制气体装置的第一步,接下来是发生装置,净化装置,收集装置,尾气处理装置.检验气密性是制气体装置的第一步,接下来是发生装置,净化装置,收集装置,尾气处理装置.就实验室制二氧化碳而言,第一步:检验检验气密性,第二步:装石灰石然后盖上塞子,第三步、向长颈漏斗中注入酸液,开始生成气体,第四步、收集气体.
故选B.点评:
本题考点: 二氧化碳的实验室制法;实验步骤的探究.
考点点评: 学会组装一套完整的气体制取装置,一定记住检验气密性是制气体装置的第一步.1年前查看全部
- 如何计算该硫酸浓度比重为1.84的浓硫酸1000毫升、逐渐加入570毫升水,待酸液冷却到20度时比重为1.657求其浓度
如何计算该硫酸浓度
比重为1.84的浓硫酸1000毫升、逐渐加入570毫升水,待酸液冷却到20度时比重为1.657求其浓度
写明计算过程 hmily1215791年前1
hmily1215791年前1 -
 半文钱 共回答了22个问题
半文钱 共回答了22个问题 |采纳率86.4%原浓硫酸质量m=1.84*1000=1840g
稀释后硫酸质量m'=1840+570*1=2410g
根据浓硫酸比重为1.84可得原浓硫酸的质量分数为98%
所以稀释后硫酸质量分数ω=1840*98%÷2410=74.82%
所以稀释后浓度为74.82%1年前查看全部
- 用标准酸液滴定待测碱液时,若未润洗酸式滴定管就直接注入标准酸液所测碱液的物质的量浓度会( )
用标准酸液滴定待测碱液时,若未润洗酸式滴定管就直接注入标准酸液所测碱液的物质的量浓度会( )
填偏高偏低或无影响(2)若锥形瓶未润洗且瓶中有少量蒸馏水所测碱溶液的物质的量浓度会( ) (3)NAHCO3溶液呈碱性的原因______(写出有关的离子方程式,下同)AL2(SO4)3溶液呈酸性的原因是( ) 混迹尘中1年前1
混迹尘中1年前1 -
 刺猬蜗牛乌龟 共回答了23个问题
刺猬蜗牛乌龟 共回答了23个问题 |采纳率100%不润洗酸管,待测浓度偏高
不干燥锥形瓶:无影响(锥形瓶是不能润洗的)
HCO3- + H2O = H2CO3 + OH-
Al3+ + 3H2O = Al(OH)3 + 3H+1年前查看全部
- ...水倒进浓硫酸时,会放热使____的酸液沸腾而溅出...
 啊ho241年前2
啊ho241年前2 -
 绝地苍狼 共回答了17个问题
绝地苍狼 共回答了17个问题 |采纳率82.4%水倒进浓硫酸时,会放热使表面的酸液沸腾而溅出1年前查看全部
- 如何将粗硝基苯中混有少量酸液及其他有机物出去
 风起衣袂飘1年前2
风起衣袂飘1年前2 -
 shu10 共回答了22个问题
shu10 共回答了22个问题 |采纳率90.9%2、最后倒入水中一般两个原因,一方面是稀释硫酸和硝酸,使反应终止,更重要的第二个原因是洗去残留的未反应的酸,有机物中会多少溶解少量硫酸和硝酸,但1年前查看全部
- 先制混合酸,冷却后,再加入苯,那么不怕酸液飞溅吗?
先制混合酸,冷却后,再加入苯,那么不怕酸液飞溅吗?
对比稀释浓硫酸的时候要现加水,后加浓硫酸 遗弃的躯壳1年前1
遗弃的躯壳1年前1 -
 hhhxxxjjj123 共回答了15个问题
hhhxxxjjj123 共回答了15个问题 |采纳率93.3%浓硫酸加水会放出大量热是因为浓硫酸能与水反应生成水合硫酸..苯是不会发生这种反应的,所以加入苯不会发生飞溅的情况...1年前查看全部
- 某酸溶液和某碱溶液恰好完全中和时,酸液和碱液中一定相等的是:A c(H+)和c(OH-) B 溶液的物质的量浓度
某酸溶液和某碱溶液恰好完全中和时,酸液和碱液中一定相等的是:A c(H+)和c(OH-) B 溶液的物质的量浓度
某酸溶液和某碱溶液恰好完全中和时,酸液和碱液中一定相等的是:
A c(H+)和c(OH-)
B 溶液的物质的量浓度
C 溶质的物质的量
D 所提供的H+和OH-的物质的量
为什么 (我选D的) 开心熊11年前4
开心熊11年前4 -
 心莲 共回答了15个问题
心莲 共回答了15个问题 |采纳率93.3%A D中加个字“能”应该更好理解 所能提供的H+和OH-的物质的量1年前查看全部
- 为什么先倒入水,后倒入浓硫酸不会是酸液飞溅,就算浓硫酸密度大,能迅速穿过水层,但是穿过之后还不是要进行溶解,水还是在浓硫
为什么先倒入水,后倒入浓硫酸不会是酸液飞溅,就算浓硫酸密度大,能迅速穿过水层,但是穿过之后还不是要进行溶解,水还是在浓硫酸上面,这时再用什么玻璃棒搅拌还有什么用啊,到底怎么,求救
还有就是在穿过水层的过程中是否与水进行溶解呢,求答 linglongtou1年前3
linglongtou1年前3 -
 freudz 共回答了20个问题
freudz 共回答了20个问题 |采纳率90%稀释浓硫酸的时候要酸入水而不是水入酸,是因为混合时会放出大量的热,酸入水时,这些热量就能及时被容器中大量的水吸收,如果水入酸,热量就会使硫酸沸腾,引起酸液飞溅,密度什么的倒还没什么关系吧,关键是水的热容比浓硫酸大的多1年前查看全部
- 请问一下,PH值为4的酸性相当于PH值为6的酸液的多少倍
 0突然的自我01年前1
0突然的自我01年前1 -
 FB-111 共回答了17个问题
FB-111 共回答了17个问题 |采纳率94.1%PH值为4的酸性相当于PH值为6的酸液的 100倍
PH是氢离子浓度的负对数,对数相差2,浓度相差 10^2=1001年前查看全部
- 有一个原电池由两个氢电极组成,其中有一个是标准氢电极,为了得到最大的电动势,另一个电极浸入的酸液为?
有一个原电池由两个氢电极组成,其中有一个是标准氢电极,为了得到最大的电动势,另一个电极浸入的酸液为?
A.盐酸 B.磷酸 C.醋酸 D.醋酸+醋酸钠 以上各物质的浓度均为0.1mol/L
麻烦给解析下 遗梦34年1年前2
遗梦34年1年前2 -
 tbs1209 共回答了18个问题
tbs1209 共回答了18个问题 |采纳率88.9%D
H+离子浓度最小1年前查看全部
- 求问清洗玻璃仪器的酸液能重复使用吗?1%的盐酸!
求问清洗玻璃仪器的酸液能重复使用吗?1%的盐酸!
如题
 灭风1年前1
灭风1年前1 -
 雨蛙男 共回答了15个问题
雨蛙男 共回答了15个问题 |采纳率73.3%可以的,洗之后要用蒸馏水冲洗干净,不过当酸液中的酸消耗完后就得换了1年前查看全部
大家在问
- 1酸与碱反应后PH值如何变化
- 2中性高锰酸钾与亚硫酸钠反映的现象及解释
- 3硫酸与硝酸混合先加哪个?
- 4在粗盐提纯中,每步都需要用到的仪器是什么
- 5能解释一下匀速圆周运动的外力做功问题吗 麻烦 拜托 谢谢
- 6外力使物体发生圆周运动算是做功吗?
- 71.856这个小数的小数点后面第20位上的数字是多少?小数部分前30位上的数字之和是多少?
- 81、2、3、4 .、1998,1999,2000这些自然数的所有数字之和例如:1996=1+9+9+6
- 9在粗盐提纯实验中,每步都要用到的的是 ------
- 10在粗盐提纯实验中每步实验都用到的是
- 11物体所受合力不为0,动能一定改变.这句话对吗
- 12特别是第三问,星光中学课外活动小组准备围建一个长方形生物苗圃园,其中一边靠墙,另外三边用长30米的篱笆围成,已知墙长为1
- 13绿化队在一块长50米,宽30米的苗圃里种树苗,如果每3平方米种2棵,可以种多少棵树苗
- 14"百以千计的" 用英文怎么拼写英文单词怎么拼写
- 15七分之四化成小数后,小数点后面第20位上的数字是?