(2014•汇川区模拟)将117.0g氯化钠溶液与140.0g的硝酸银溶液混合,恰好完全反应,过滤后所得溶液的质量为22
 ellie07242022-10-04 11:39:541条回答
ellie07242022-10-04 11:39:541条回答(反应的化学方程式为NaCl+AgNO3═AgCl↓+NaNO3)

已提交,审核后显示!提交回复
共1条回复
 h-h-h 共回答了14个问题
h-h-h 共回答了14个问题 |采纳率92.9%- 解题思路:根据过滤后所得溶液的质量可以计算沉淀氯化银的质量,根据氯化银的质量可以计算氯化钠的质量,进一步可以计算该氯化钠溶液的溶质质量分数.
设氯化钠的质量为x,根据质量守恒定律,生成AgCl的质量为:117.0g+140.0g-228.3g=28.7g,NaCl+AgNO3=AgCl↓+NaNO3,58.5 143.5 x&nb...
点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性. - 1年前
相关推荐
- (2014•汇川区模拟)下列生活中常见物质,pH小于7的是( )
(2014•汇川区模拟)下列生活中常见物质,pH小于7的是( )
A.食醋
B.食盐水
C.糖水
D.肥皂水 tt就是我1年前1
tt就是我1年前1 -
 lanjiaohai 共回答了16个问题
lanjiaohai 共回答了16个问题 |采纳率87.5%解题思路:当溶液的pH等于7时,呈中性;当溶液的pH小于7时,呈酸性;当溶液的pH大于7时,呈碱性;据此结合常见溶液的酸碱性进行分析判断.A、食醋中含有醋酸,显酸性,pH小于7.
B、食盐水显中性,pH等于7.
C、糖水显中性,pH等于7.
D、肥皂水显碱性,pH大于7.
故选:A.点评:
本题考点: 溶液的酸碱性与pH值的关系.
考点点评: 本题难度不大,掌握常见溶液的酸碱性、溶液的酸碱性和溶液pH大小之间的关系是正确解题的关键.1年前查看全部
- (2013•汇川区质检)二氧化碳在化学家的眼里是可以利用的重要资源,只要有合适的条件,可以像发生光合作用那样将二氧化碳转
(2013•汇川区质检)二氧化碳在化学家的眼里是可以利用的重要资源,只要有合适的条件,可以像发生光合作用那样将二氧化碳转变为所需要的产物.二氧化碳可以为化工合成提供足够的碳元素,既可以减少化工产业对煤和石油的消耗,又可以缓解大气中二氧化碳含量的增加.
(1)二氧化碳和水通过光合作用转变为葡萄糖和氧气的化学方程式为:6CO2+6H2O
C6H12O6+6O2光 .叶绿素 6CO2+6H2O.
C6H12O6+6O2光 .叶绿素
(2)化肥厂用二氧化碳与氨气在一定条件下反应生成尿素[CO(NH2)2]和水的化学方程式为:CO2+2NH3
CO(NH2)2+H2O一定条件 .CO2+2NH3.
CO(NH2)2+H2O一定条件 .
(3)超氧化钾(用X表示)能与二氧化碳反应生成氧气,在载人航天飞机和潜水艇中可用它作制氧剂,供呼吸之用.超氧化钾(X)与二氧化碳反应的化学方程式为:4X+2CO2═2K2CO3+3O2则X的化学式为______. 送265个拥抱1年前1
送265个拥抱1年前1 -
 蓝青书简 共回答了27个问题
蓝青书简 共回答了27个问题 |采纳率81.5%解题思路:(1)①正确书写葡萄糖的化学式C6H12O6,确定反应物为二氧化碳和水,反应条件为在叶绿体中、光照,生成物为葡萄糖和氧气;
②配平的方法:可以把化学式最复杂的计量数定为“1”,再按“C→H→O”的顺序配平;
(2)由题意知,反应物为二氧化碳与氨气,生成物为尿素[CO(NH2)2]和水,根据质量守恒定律,可以书写化学方程式;
(3)根据质量守恒定律:反应前后元素种类不变,原子个数相等,由4X+2CO2═2K2CO3+3O2,可以推测X的化学式.(1)二氧化碳和水通过光合作用转变为葡萄糖和氧气:确定反应物、生成物、反应条件;选择合适的配平方法,故化学方程式为6CO2+6H2O
光
.
叶绿素 C6H12O6+6O2.
故答案为:6CO2+6H2O
光
.
叶绿素 C6H12O6+6O2.
(2)由题意知,反应物,反应条件,生成物,根据质量守恒定律,故CO2+2NH3
一定条件
.
CO(NH2)2+H2O;
故答案为:CO2+2NH3
一定条件
.
CO(NH2)2+H2O;
(3)根据质量守恒定律:反应前后元素种类不变,原子个数相等,由4X+2CO2=2K2CO3+3O2,可以推测X的化学式为KO2.
故答案为:
(1)6CO2+6H2O
光
.
叶绿素 C6H12O6+6O2.
(2)CO2+2NH3
一定条件
.
CO(NH2)2+H2O.
(3)KO2.点评:
本题考点: 二氧化碳对环境的影响;质量守恒定律及其应用;书写化学方程式、文字表达式、电离方程式.
考点点评: 根据题目信息,找出反应物和生成物,再利用书写化学方程式的方法及步骤,根据质量守恒定律,正确书写化学方程式.1年前查看全部
- (2014•汇川区模拟)碘元素是人体必需的微量元素之一.
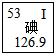 (2014•汇川区模拟)碘元素是人体必需的微量元素之一.
(2014•汇川区模拟)碘元素是人体必需的微量元素之一.
(1)如图是元素周期表中碘元素的部分信息.碘原子的核电荷数是______,碘元素属于______(填“金属”或“非金属”)元素;
(2)已知某碘盐的主要成分为氯化钠和碘酸钾(KIO3).
①氯化钠中含有的阴离子是______(用符号表示),KIO3中I的化合价为______价;
②用试剂X测定该碘盐中碘元素的含量,发生如下反应:
KIO3+5X+3H2SO4═3K2SO4+3I2+3H2O,推算X的化学式为______. 冰河Tony1年前1
冰河Tony1年前1 -
 banxialu 共回答了16个问题
banxialu 共回答了16个问题 |采纳率87.5%解题思路:(1)根据元素周期表中的一个小格所提供的信息,其中原子序数=核外电子数=质子数=核电荷数,进行解答;
(2)①氯化钠是由钠元素和氯元素组成的化合物,化学式为NaCl;氯化钠含有的阴离子是Cl-;根据“在化合物中,正负化合价的代数和为零”的原则,解答KIO3中I的化合价;
②根据质量守恒定律反应中前后原子个数不变解答.(1)根据元素周期表中的一个小格所提供的信息,可知碘原子的核电荷数是 53,
(2)①氯化钠是由钠元素和氯元素组成的化合物,化学式为NaCl;氯化钠含有的阴离子是氯离子;表示为:Cl-;
根据“在化合物中,正负化合价的代数和为零”的原则,可得KIO3中I的化合价为:(+1)+x+(-2)×3=0;x=+5;
②根据反应的化学方程式KIO3+5X+3H2SO4=3K2SO4+3I2+3H2O,反应后K、S、O、I、H元素的原子个数分别为6、3、15、6、6,而反应前除5个X分子外K、S、O、I、H元素的原子个数分别为1、3、15、1、6;根据反应前后原子个数不变,可判断5个X分子中应含有5个钾原子和5个碘原子,则每个X分子由1个钾原子、1个碘原子所构成,所以,物质X的化学式为KI
答案:(1)53非金属
(2)①Cl-+5
②KI点评:
本题考点: 元素周期表的特点及其应用;元素的简单分类;有关元素化合价的计算;化学符号及其周围数字的意义;质量守恒定律及其应用.
考点点评: 本题考查学生对化合价计算能力;考查学生运用质量守恒定律推断化学式的能力.此类问题是有关质量守恒定律的常见题,根据化学方程式,得出未知的化学式中所含元素的原子个数,即可推断出化学式.1年前查看全部
- (2013•汇川区质检)有甲、乙、丙、丁四种金属,仅甲在自然界中主要以单质形式存在.丙的化合物的水溶液不能用丁制的容器盛
(2013•汇川区质检)有甲、乙、丙、丁四种金属,仅甲在自然界中主要以单质形式存在.丙的化合物的水溶液不能用丁制的容器盛放,丁与乙的化合物的水溶液不反应.这四种金属的活动性由强到弱的顺序是( )
A.甲乙丙丁
B.丁乙甲丙
C.丙乙丁甲
D.乙丁丙甲 skdkjh2k3jhfaksj1年前1
skdkjh2k3jhfaksj1年前1 -
 唐章勇 共回答了26个问题
唐章勇 共回答了26个问题 |采纳率96.2%解题思路:在金属活动性顺序中,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来.甲在自然界中主要以单质形式存在,说明甲是最稳定的金属,丙的化合物的水溶液不能用丁制的容器盛放,说明丁>丙,丁与乙的化合物的水溶液不反应说明乙>丁,从而说明乙>丁>丙>甲,观察选项,故选D.
点评:
本题考点: 金属活动性顺序及其应用;金属活动性的探究.
考点点评: 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行.1年前查看全部
- (2013•汇川区质检)因为它含有丰富的( )
 (2013•汇川区质检)因为它含有丰富的( )
(2013•汇川区质检)因为它含有丰富的( )
A.糖类
B.维生素
C.油脂
D.蛋白质 飞龙上天1年前1
飞龙上天1年前1 -
 yinjie1112 共回答了22个问题
yinjie1112 共回答了22个问题 |采纳率86.4%解题思路:根据人体所需六大营养素的种类、食物来源,结合题中所给的食物判断所含的营养素,进行分析判断.蛋白质是人体需要的六大类营养物质之一,瘦肉、鱼、奶、蛋和豆类等食物中含有较多的蛋白质,则鱼肉中含有丰富的蛋白质.
故选D.点评:
本题考点: 食品、药品与健康食品中的有机营养素.
考点点评: 本题难度不大,掌握各种营养素的生理功能、食物来源等是正确解题的关键.1年前查看全部
- (2014•汇川区模拟)我们呼吸的空气中,体积分数占78%的气体是( )
(2014•汇川区模拟)我们呼吸的空气中,体积分数占78%的气体是( )
A.氧气
B.氮气
C.稀有气体
D.二氧化碳 吹吹风其貌不扬1年前1
吹吹风其貌不扬1年前1 -
 安妮宝石 共回答了11个问题
安妮宝石 共回答了11个问题 |采纳率81.8%解题思路:根据空气中各成分及体积分数来回答本题.要注意是体积分数不是质量分数.空气中各成分及体积分数为:氮气:78%、氧气:21%、稀有气体:0.94%、二氧化碳0.03%、水蒸气和杂质:0.03%.
故选B.点评:
本题考点: 空气的成分及各成分的体积分数.
考点点评: 熟记空气中各成分及体积分数,知道空气中的主要气体,哪种气体最多,哪种气体最少.1年前查看全部
- (2014•汇川区模拟)请根据要求填空:
(2014•汇川区模拟)请根据要求填空:
(1)汽车尾气装置发生的反应是:2NO+2CO→N2+2CO2,该反应的基本类型是______;
A.化合反应B.分解反应C.置换反应D.复分解反应E.不属于上述中的一种
(2)DNA水解产物中的胸腺嘧啶(C3H6N2O2),该物质中氮元素与氧元素的质量比为______;
(3)可燃冰的主要成分是甲烷(CH4),写出其燃烧的化学反应方程式CH4+2O2
CO2+2H2O点燃 .CH4+2O2.
CO2+2H2O点燃 . wangdian521年前1
wangdian521年前1 -
 娃哈哈ehe 共回答了20个问题
娃哈哈ehe 共回答了20个问题 |采纳率85%解题思路:(1)化合反应指的是由两种或两种以上的物质生成一种物质的反应;分解反应,是指一种物质生成两种或两种以上其他物质的反应;由两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应;置换反应是单质与化合物反应生成另外的单质和化合物的化学反应,进行判断.
(2)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.
(3)首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤进行书写即可.(1)由四大基本反应类型的判定方法可知,该反应不属于四大基本反应类型,故选E;
(2)胞嘧啶中氮与氧元素的质量比为(14×2):(16×2)=28:32.
(3)甲烷(CH4)在空气中燃烧生成二氧化碳和水,反应的化学方程式为:CH4+2O
点燃
.
CO2+2H2O.
故答案为:
(1)E
(2)28:32(或14:16或7:8)
(3)CH4+2O2
点燃
.
CO2+2H2O点评:
本题考点: 反应类型的判定;元素质量比的计算;书写化学方程式、文字表达式、电离方程式.
考点点评: 此题考查学生对反应类型的判定的方法、物质中各元素的质量比和化学方程式的书写、理解与掌握,并能在解题中灵活应用的能力.1年前查看全部
- (2014•汇川区模拟)金属材料在工业上有广泛的用途.
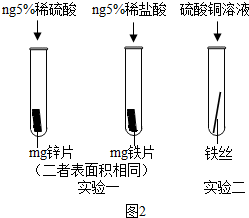 (2014•汇川区模拟)金属材料在工业上有广泛的用途.
(2014•汇川区模拟)金属材料在工业上有广泛的用途.
(1)铝合金材质与纯铝比较,主要优点是______;
(2)钢铁的锈蚀主要是铁与空气中的______共同作用的结果,工业生产中常用稀盐酸除去铁制品表面的铁锈,该反应的化学方程式为______;
(3)为了避免钢铁腐蚀,通常在钢铁外壳上镶嵌比铁活动性强的金属.小明为探究锌、铁、铜三种金属的活动性顺序,设计了如图的两个实验:
①实验一,小明以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱,有同学认为不够合理,理由是______;
②实验二,若出现______现象,可证明铁的活动性强于铜,该反应的化学方程式为______. 指点kk江山1年前1
指点kk江山1年前1 -
 安家蟹 共回答了25个问题
安家蟹 共回答了25个问题 |采纳率92%解题思路:(1)根据铝合金的性质分析;
(2)根据铁生锈的条件解答;铁锈的主要成分是氧化铁,它能与稀盐酸反应生成氯化铁和水;
(3)①从控制变量的角度进行分析;
②若铁的活动性强于铜,则铁可置换出硫酸铜中的铜.(1)铝合金材质与纯铝比较,强度大、质量轻;
(2)钢铁的锈蚀,实际上是铁跟水和氧气共同作用的结果;
铁锈的主要成分是氧化铁,它能与稀盐酸反应生成氯化铁和水,反应方程式为:Fe2O3+6HCl=2FeCl3+3H2O;
(3)①从图可以看出选取的酸的种类不同,因此以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱不够合理;
②实验二中,若铁丝表面出现红色物质,溶液由蓝色变成浅绿色,可证明铁的活动性强于铜,该反应的化学方程式为:Fe+CuSO4═FeSO4+Cu
故答案为:(1)强度大、质量轻;
(2)氧气和水;Fe2O3+6HCl═2FeCl3+3H2O;
(3)①酸的种类不同;
②铁丝表面出现红色物质;Fe+CuSO4=FeSO4+Cu点评:
本题考点: 合金与合金的性质;金属活动性顺序及其应用;金属锈蚀的条件及其防护;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度较大,掌握常见合金的优点、钢铁锈蚀的原理和除锈原理以及根据实验分析、解决问题方法是解决本题的关键.1年前查看全部
- (2013•汇川区质检)向含有CuCl2和HCl的混合溶液100g中,逐滴加入质量分数为10%的NaOH溶液,参加反应的
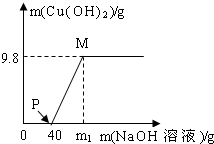 (2013•汇川区质检)向含有CuCl2和HCl的混合溶液100g中,逐滴加入质量分数为10%的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图,仅考虑沉淀为Cu(OH)2.则下列说法正确的是( )
(2013•汇川区质检)向含有CuCl2和HCl的混合溶液100g中,逐滴加入质量分数为10%的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图,仅考虑沉淀为Cu(OH)2.则下列说法正确的是( )
A.P点溶液中的溶质只有一种
B.M点溶液比P点溶液中氯化钠的质量分数小
C.整个反应过程中,氯离子个数不变
D.沉淀完全时,m1的数值为80 月遜1年前1
月遜1年前1 -
 xwc66 共回答了24个问题
xwc66 共回答了24个问题 |采纳率91.7%解题思路:A、根据复分解反应的实质来考虑;
B、P点表示氢氧化钠与盐酸恰好反应完,再去考虑溶质是谁;
C、根据溶质质量和溶液质量的变化来考虑;
D、根据沉淀质量算出与氯化铜反应的氢氧化钠的质量,再除以10%算出氢氧化钠溶液质量.A、P点表示氢氧化钠与盐酸恰好反应完,但氯化铜还没有反应,此时溶质是氯化铜、氯化钠,故A错误;
B、M点溶液比P点溶液中氯化钠的质量多了因为氢氧化钠与氯化铜反应生成了氯化钠,溶液质量少了,因为生成了沉淀,所以质量分数变大了,故B错误;
C、复分解反应的实质是能生成气体、水、沉淀的离子参加了反应,即氢离子、氢氧根离子、铜离子、而氯离子实际并没有参加反应,所以整个反应过程中,氯离子个数不变,故C正确;
D、根据沉淀质量算出氢氧化钠质量为8g,所以需氢氧化钠溶液质量为80g,但这是与氯化铜反应需要的氢氧化钠,再加上与盐酸反应的氢氧化钠应该是120g,故D错误.
故选C.点评:
本题考点: 碱的化学性质.
考点点评: 通过回答本题知道了复分解反应的实质,掌握了有关质量分数的计算方法.1年前查看全部
- (2014•汇川区模拟)某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究.
(2014•汇川区模拟)某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究.
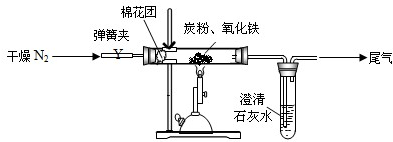
(查阅资料:①氮气不与碳、氧化铁发生反应;②氢氧化钡易溶于水,氢氧化钙微溶于水.)
(1)【提出假设】
①该反应的气体产物是CO2
②该反应的气体产物是CO
③该反应的气体产物是______;
(2)【设计方案】如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应.
(3)【实验步骤】
①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁、2.00g碳粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气,目的是______;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间氮气目的是______,冷却至室温,称得硬质玻璃管和固体总质量为52.4g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g.
(4)【数据处理】根据实验数据分析,写出该实验中氧化铁与碳发生反应的化学方程式:Fe2O3+2C
2Fe+CO2↑+CO↑高温 .Fe2O3+2C;
2Fe+CO2↑+CO↑高温 .
(5)【实验优化】A.甲同学认为:应将澄清石灰水换成Ba(OH)2溶液,其理由是:
①______;
②钡的相对原子质量较大,生成的沉淀质量较大,称量时误差较小;
B.乙同学从环境保护的角度,提出一个优化方案是:______. xbxadi1年前1
xbxadi1年前1 -
 xmzxr 共回答了24个问题
xmzxr 共回答了24个问题 |采纳率91.7%解题思路:(1)反应产物可能是二氧化碳或一氧化碳,或二氧化碳和一氧化碳;
(3)步骤②、④中都分别通入N2,其作用分别为:排尽装置中的空气;使生成的二氧化碳全部被石灰水吸收.
(4)根据实验数据分析可知,该实验中氧化铁与碳发生反应生成了铁、一氧化碳和二氧化碳;根据反应物、生成物及其质量守恒定律可以书写化学方程式;
(5)氢氧化钡比氢氧化钙更易溶于水,吸收二氧化碳的能力更强;尾气扩散到空气中会污染环境,应把它处理掉.(1)①该反应的气体产物是CO2.②该反应的气体产物是CO.③该反应的气体产物是二氧化碳和一氧化碳.
故填:CO2和CO.
(3)步骤②、④中都分别通入N2,其作用分别为:排尽装置中的空气;使生成的二氧化碳全部被石灰水吸收.
故填:排尽装置中的空气;使生成的二氧化碳全部被石灰水吸收.
(4)根据实验数据分析可知,该实验中氧化铁与碳发生反应生成了铁、一氧化碳和二氧化碳;化学方程式是:Fe2O3+2C
高温
.
2Fe+CO2↑+CO↑.
(5)①甲同学认为:应将澄清石灰水换成Ba(OH)2溶液,其理由是氢氧化钡易溶于水,可以吸收更多的二氧化碳.B.尾气扩散到空气中会污染环境,可点燃或收集起来.
故填:氢氧化钡易溶于水,可以吸收更多的二氧化碳.B.点燃或收集尾气.点评:
本题考点: 碳的化学性质;常见气体的检验与除杂方法;书写化学方程式、文字表达式、电离方程式.
考点点评: 化学实验现象是化学实验最突出、最鲜明的部分,也是进行分析推理得出结论的依据,掌握物质的性质和相互之间的反应关系,并有助于提高观察、实验能力.1年前查看全部
- (2013•汇川区质检)结合图示实验装置,回答下列问题.
(2013•汇川区质检)结合图示实验装置,回答下列问题.
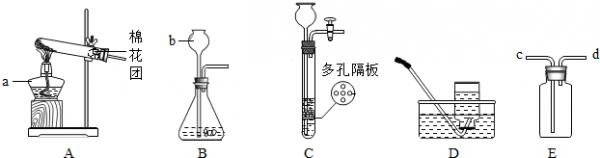
(1)图中b仪器的名称:______.
(2)用高锰酸钾固体制氧气,选用的发生装置是______(填“A”“B”或“C”),该反应的化学方程式为2KMnO4
K2MnO4+MnO2+O2↑△ .2KMnO4;如用D装置收集O2,则气体收集完毕时,应先______.
K2MnO4+MnO2+O2↑△ .
(3)实验室制取二氧化碳时,如用E装置收集CO2,则气体应从端通入______(填“c”或“d”).
(4)用块状固体和液体不加热制取气体时,改用C装置(多孔隔板用来放块状固体)代替B装置的优点是______. didih1年前1
didih1年前1 -
 跳跃的晶粒 共回答了18个问题
跳跃的晶粒 共回答了18个问题 |采纳率100%解题思路:(1)据常用仪器回答;
(2)据反应物的状态和反应条件选择发生装置,并据高锰酸钾制取氧气的反应原理书写方程式;收集完毕,应先移导管后熄灯,防止水倒吸引起试管炸裂;
(3)二氧化碳的密度比空气大,据此分析解答;
(4)C装置可通过弹簧夹的开闭控制反应的发生和停止.(1)b仪器是长颈漏斗,是用来加入液体药品;
(2)加热高锰酸钾属于固体型,故选发生装置A,加热高锰酸钾生成锰酸钾、二氧化锰和氧气,方程式是:2KMnO4
△
.
K2MnO4+MnO2+O2↑;收集完毕,应先移导管后熄灯,防止水倒吸引起试管炸裂;
(3)二氧化碳的密度比空气大,故应从长导管进入,将空气挤压到集气瓶上部排出;
(4)用块状固体和液体不加热制取气体时,改用C装置(多孔隔板用来放块状固体)代替B装置的优点是:打开弹簧夹固体和液体接触生成气体,关闭弹簧夹,试管内气压变大,将液体挤压到长颈漏斗中,固体和液体分离,反应终止,从而节约了药品;
故答案为:(1)长颈漏斗;
(2)A;2KMnO4
△
.
K2MnO4+MnO2+O2↑;将导管从水槽中取出;
(3)c;
(4)可以控制反应的发生和停止(或节约药品).点评:
本题考点: 常用气体的发生装置和收集装置与选取方法.
考点点评: 了解装置特点、发生和收集装置的选取方法、反应原理等,并能结合题意灵活分析解答,难度不大.1年前查看全部
- (2013•汇川区质检)微型化录音录像的高性能磁带中的磁粉主要材料之一是化学组成相当于CoFe2O4的化合物,又知钴(C
(2013•汇川区质检)微型化录音录像的高性能磁带中的磁粉主要材料之一是化学组成相当于CoFe2O4的化合物,又知钴(Co)和铁都可能有+2、+3价,且上述化合物中每种元素只具有一种化合价,则铁和钴的化合价分别为( )
A.+3、+2
B.+2、+3
C.+2、+2
D.+3、+3 mond1年前1
mond1年前1 -
 放开nagenvhai 共回答了15个问题
放开nagenvhai 共回答了15个问题 |采纳率93.3%解题思路:根据在化合物中正负化合价代数和为零,结合CoFe2O4的化学式进行解答本题.若钴和铁元素的化合价相同时,即都为+2价时,则CoFe2O4中化合价的代数和为:(+2)+(+2)×2+(-2)×4≠0;都为+3价时,CoFe2O4中化合价的代数和为:(+3)+(+3)×2+(-2)×4≠0,则都不符合要求,故化合物中Co和Fe的化合价不同;
因此Co、Fe的化合价可能为+2、+3价或+3、+2价;
若Co的化合价为+3,Fe的化合价为+2时,CoFe2O4中化合价的代数和为:(+3)+(+2)×2+(-2)×4≠0,不符合要求;
若Co的化合价为+2,Fe的化合价为+3,CoFe2O4中化合价的代数和为:(+2)+(+3)×2+(-2)×4=0,符合要求.
故选A.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题难度较大,掌握利用化合价的原则计算指定元素的化合价的方法是正确解答的关键.1年前查看全部
- (2014•汇川区模拟)在厨房中进行的下列操作中发生化学变化的是( )
(2014•汇川区模拟)在厨房中进行的下列操作中发生化学变化的是( )
A.酿米酒
B.榨果汁
C.磨豆浆
D.冻冰块 lanyu51551年前1
lanyu51551年前1 -
 三斑倒 共回答了7个问题
三斑倒 共回答了7个问题 |采纳率71.4%解题思路:本题考查学生对物理变化和化学变化的确定.判断一个变化是物理变化还是化学变化,要依据在变化过程中有没有生成其他物质,生成其他物质的是化学变化,没有生成其他物质的是物理变化.A、酿米酒有新物质乙醇生成,属于化学变化,故A正确;
B、榨果汁只是将水果中的汁液提取出来,没有新物质生成,属于物理变化,故B错;
C、磨豆浆只是将豆子磨碎,没有新物质生成,属于物理变化,故C错;
D、冻冰块是由液态变为固态,只是状态发生了变化,没有新物质生成,属于物理变化,故D错.
故选A.点评:
本题考点: 化学变化和物理变化的判别.
考点点评: 搞清楚物理变化和化学变化的本质区别是解答本类习题的关键.判断的标准是看在变化中有没有生成其他物质.一般地,物理变化有物质的固、液、气三态变化和物质形状的变化.1年前查看全部
- (2013•汇川区质检)通过学习化学知识,我们可以解释一些生活中的问题:
(2013•汇川区质检)通过学习化学知识,我们可以解释一些生活中的问题:
(1)电解水时加入少量稀硫酸或氢氧化钠,其目的是______:
(2)切过咸菜的菜刀(未清洗擦干)更易生锈,原因是______;
(3)家用煤炉中的蜂窝煤有12孔、14孔,甚至16孔等多个品种,你认为孔道越多燃烧越充分,理由是______. 知足者不乐乐乐1年前1
知足者不乐乐乐1年前1 -
 senwe 共回答了12个问题
senwe 共回答了12个问题 |采纳率83.3%解题思路:(1)根据稀硫酸或氢氧化钠在水中能解离出自由移动的离子分析回答;
(2)铁与氧气和水充分接触时容易生锈,盐溶液能够促进菜刀生锈;
(3)根据燃料充分燃烧的条件分析.(1)由于稀硫酸或氢氧化钠在水中能解离出自由移动的离子.所以,电解水时加入少量稀硫酸或氢氧化钠,其目的是为了增强水的导电性;
(2)铁与氧气和水充分接触时容易生锈,盐溶液能够促进菜刀生锈.所以,切过咸菜的菜刀更易生锈;
(3)由燃料充分燃烧的条件可知,家用煤炉中的蜂窝煤孔越多,煤与氧气接触的面积越大,燃烧越充分.
故答为:(1)为了增强水的导电性;(2)铁与氧气和水充分接触时容易生锈,盐溶液能够促进菜刀生锈;(3)增大煤与空气的接触面积,使煤充分燃烧.点评:
本题考点: 电解水实验;金属锈蚀的条件及其防护;完全燃烧与不完全燃烧.
考点点评: 此题较为综合地考查了物质的性质、铁生锈的条件、物质的燃烧等知识.所以,应注意应用化学知识来解决、解释身边的一些现象.1年前查看全部
- (2013•汇川区质检)材料与人类生活密切相关.下列日常生活物品属于合成材料制成的是( )
(2013•汇川区质检)材料与人类生活密切相关.下列日常生活物品属于合成材料制成的是( )
A.铁锅
B.瓷器
C.保鲜膜
D.玻璃钢餐桌 neo_suyunpeng1年前1
neo_suyunpeng1年前1 -
 深圳十三少 共回答了19个问题
深圳十三少 共回答了19个问题 |采纳率94.7%解题思路:有机合成材料简称合成材料,要判断是否属于合成材料,可抓住三个特征:有机物、合成、高分子化合物,据此常见材料的分类进行分析判断.有机合成材料必须具备三个特征:人工合成、有机物、高分子.
A、铁锅是用铁合金制成的,属于金属材料,故选项错误.
B、瓷器是土烧制而成的,属于无机非金属材料,故选项错误.
C、保鲜膜是用塑料制成的,塑料属于三大合成材料之一,故选项正确.
D、玻璃钢是玻璃纤维与合成材料复合而成的一种特殊材料,属于复合材料,故选项错误.
故选C.点评:
本题考点: 合成材料的使用及其对人和环境的影响.
考点点评: 本题难度不大,掌握合成材料的三大特征(有机物、合成、高分子化合物)、分类是正确解答此类题的关键所在.1年前查看全部
大家在问
- 1英语翻译十二月一日 晴今天我过的很愉快因为今天对我来说是重要的一天,我们上了一街体育课,老师没来 我在操场上打了一节篮球
- 2一阶偏导数存在是不是表明曲面没有棱角,那二阶偏导数存在代表什么
- 3有很多人都说十倍的望远镜就象一千米的物体拉近十倍相当于一百米的肉眼看到的物体 可是我怎么没有这样的感
- 4英文改错啊 一行一错,最多有一行是正确的
- 5小明和小军进行投篮,小明投了十五次,投中了九个,小军投了二十次,投中了十四个.(1)小明投中的次数与所投总数的最简比是多
- 6谁家有现代汉语词典第五版?谁能帮我翻译下 前面是页数,后面是第几个字 709(7)504(14)1651(11)1234
- 7they,a,new,hospital,my,in,built,hometown,last,year(连词成句)
- 8因式分解,(x²-5)²+8(x²-5)+16=
- 9生成HCl,写成离子方程式要不要写成H离子和氯离子?HCl易挥发?
- 10用英文写一篇读后感 字数不限
- 11x^5+x^4-8/x^3-x求不定积分,
- 12The boy is a good swimmer.He can swim_____(cross)the wide ri
- 1312V14ah的蓄电池用30W的节能灯最多可以亮多长时间,怎么计算的.
- 14我国国旗经历的变化有哪些变化?各个时期的名称是什么?
- 15五分之四用英语怎么说
